基于Gβγ互作蛋白监测G蛋白激活的生物传感器的制作方法
相关申请的交叉引用
本申请要求于2014年10月14日提交的美国临时申请号62/063,622的权益,其通过引用全文并入本文。
本发明涉及对g蛋白激活的监测,更特别地涉及用于检测g蛋白激活的信号传导生物传感器。
背景技术:
异源三聚体g蛋白由三个亚基组成:α、β和γ,该异源三聚体g蛋白向各种胞内效应物传递由g蛋白偶联受体(gpcr)提供的信息。在缺乏刺激的情况下,g蛋白的α-亚基与gdp(鸟苷二磷酸)分子形成复合体。配体激活受体后的构象变化促进了gdp分子磷酸化为gtp(鸟苷三磷酸)。结合gtp的gα亚基与gβγ亚基解离,然后两者能够与下游效应物相互作用和调节下游效应物的活性。因此,使用gβγ互作蛋白,通过下游效应物与gβγ的相互作用分析下游效应物来评估g蛋白的激活。在gα亚基将gtp水解为gdp后,gα对gβγ的亲和力恢复,并且三个亚基重结合,形成无活性的异源三聚体g蛋白,结束效应物的参与,从而发生信号转导(gilman1987)。
除了gpcr对g蛋白的经典激活以外,其他蛋白质也可以调节这些异源三聚体g蛋白的活性,如g蛋白信号传导调节因子(rgs)、g蛋白信号传导激活因子(ags)和抗胆碱酯酶8蛋白抑制因子(resistancetoinhibitorsofcholinesterase8proteins,ric-8)。在这些非典型信号转导通路中的某些中,另一种蛋白(例如ric-8)替代了由gpcr经典地发挥的鸟嘌呤交换因子(gef)活性(boularan和kehrl,2014)。
g蛋白偶联受体激酶(grks)2和g蛋白偶联受体激酶3首先以其在受体脱敏中的作用为特征,其也是通过与gβγ亚基的相互作用参与的效应物。grk2和grk3含有普列克底物蛋白同源(ph)域,所述普列克底物蛋白同源(ph)域在g蛋白的gβγ亚基与激活的结合gtp的gα亚基解离时,与g蛋白的gβγ亚基相互作用(pitcher,inglese等人.1992)(touhara,inglese等人.1994)。因此,gβγ互作蛋白(βγip)(如grk2和grk3)可以用于直接研究gpcr或其他g蛋白激活因子对g蛋白的激活。
当前,药物开发工业中使用几种方法评估gpcr的激活和由此评估受体连接g蛋白,如钙动员测定或基于通过g蛋白结合的gtpγs的放射性测定。钙动员测定测量发生在gq激活下游的信号传导事件,并且仅当与使用修饰的gα亚基偶联时可以应用于gi偶联受体或gs偶联受体。在gtpγs结合测定的情况下,使用放射性gtpγ35s在细胞膜上直接测量各种异源三聚体g蛋白的激活,该异源三聚体g蛋白的激活不能在活细胞中进行。
由此,到目前为止尚未探索在不修饰g蛋白的激活因子或gα亚基的情况下在活细胞中激活g蛋白。此外,已知的方法不适合于使用相同的检测配偶体研究所有不同的g蛋白。这样的测定在药物开发过程的不同阶段中是尤其有用的,例如,通过使g蛋白偶联谱能够表征和促进对具有限定的信号传导特性的新化合物的鉴定以用于筛选测定和结构-活性关系研究。这是尤其真实的,因为g蛋白激活因子作为药物靶标的重要性,其占所有通过gpcr起作用的处方药中的26%(garland2013)。尽管有几种方法可以用于支持开发新的靶向g蛋白激活因子的治疗活性分子,但那些化合物的精确作用机制的可用信息的缺乏常常限制新型药物的发现。
因此,存在新的评估g蛋白激活的工具和测定的需求。
本说明书参考许多文献,所述文献的内容通过引用全文并入本文。
技术实现要素:
本发明提供了以下的1至68个项目:
1.用于检测g蛋白活性的生物传感器系统,所述生物传感器系统包括(a)或(b)中定义的元件:
(a)
(i)第一生物传感器,其包括:
第一组件,其包括融合于(a)共振能量转移(ret)供体;(b)ret受体或(c)报告蛋白的第一片段的gβγ互作蛋白(βγip);和
第二组件,其包括融合的gβ蛋白或融合的gγ蛋白,其中所述gβ蛋白或所述gγ蛋白融合于(a)ret供体;(b)ret受体或(c)所述报告蛋白的第二片段;
(ii)第二生物传感器,其包括:
(i)中定义的第一组件和第二组件;和
包括重组gα蛋白的第三组件;
其中,(a)如果所述βγip融合于所述ret供体,则所述gβ或gγ蛋白融合于所述ret受体;(b)如果所述βγip融合于所述ret受体,则所述gβ或gγ蛋白融合于所述ret供体;(c)如果所述βγip融合于所述报告蛋白的第一片段,则所述gβ或gγ蛋白融合于所述报告蛋白的第二片段;或
(b)
(i)生物传感器,其包括
第一组件,其包括融合于(a)ret供体;(b)ret受体或(c)报告蛋白的第一片段的gβγ互作蛋白(βγip);
第二组件,其包括融合的g蛋白偶联受体(gpcr),其中所述gpcr在其c端融合于(a)ret供体;(b)ret受体或(c)所述报告蛋白的第二片段;
第三组件,其包括重组gα蛋白;
其中,(a)如果所述βγip融合于所述ret供体,则所述gpcr融合于所述ret受体;(b)如果所述βγip融合于所述ret受体,则所述gpcr融合于所述ret供体;(c)如果所述βγip融合于所述报告蛋白的第一片段,则所述gpcr融合于所述报告蛋白的所述第二片段。
2.项目1所述的生物传感器系统,其中所述gγ蛋白融合于所述ret供体、ret受体或第二片段。
3.项目1或2所述的生物传感器系统,其中所述ret供体、ret受体或第二片段融合于所述gβ或gγ蛋白的n端。
4.项目1至3中任一项所述的生物传感器系统,其中所述ret供体、ret受体或第一片段融合于所述βγip的c端。
5.项目1至4中任一项所述的生物传感器系统,其中所述βγip融合于所述ret受体,并且所述gβ蛋白、gγ蛋白或gpcr融合于所述ret供体。
6.项目1至5中任一项所述的生物传感器系统,其中所述ret供体是生物发光蛋白。
7.项目6所述的生物传感器系统,其中所述生物发光蛋白是荧光素酶。
8.项目7所述的生物传感器系统,其中所述荧光素酶是海肾(renilla)荧光素酶。
9.项目1至8中任一项所述的生物传感器系统,其中所述ret受体是荧光蛋白。
10.项目9所述的生物传感器系统,其中所述荧光蛋白是gfp。
11.项目1至4中任一项所述的生物传感器系统,其中所述βγip融合于所述第一片段,所述gβ蛋白、gγ蛋白或gpcr融合于所述第二片段。
12.项目11所述的生物传感器系统,其中所述报告蛋白是生物发光蛋白。
13.项目12所述的生物传感器系统,其中所述生物发光蛋白是荧光素酶。
14.项目13所述的生物传感器系统,其中所述荧光素酶是海肾荧光素酶。
15.项目14所述的生物传感器系统,其中所述第一片段包括海肾荧光素酶的大约第1至110位残基,所述第二片段包括海肾荧光素酶的大约第111至311位残基。
16.项目1至15中任一项所述的生物传感器系统,其中,第一组件进一步包括融合于所述βγip或所述ret供体、ret受体或第一片段的质膜(pm)靶向部分。
17.项目16所述的生物传感器系统,其中所述pm靶向部分融合于所述ret供体、ret受体或第一片段的c端。
18.项目16或17所述的生物传感器系统,其中所述pm靶向部分包括异戊二烯化基序。
19.项目16所述的生物传感器系统,其中所述异戊二烯化基序是人kras剪接变体b的异戊二烯化基序。
20.项目19所述的生物传感器系统,其中所述pm靶向部分包括氨基酸序列kkkkkksktkcvim(seqidno:37)。
21.项目16至20中任一项所述的生物传感器系统,进一步包括(i)所述ret供体、ret受体或第一片段与(ii)所述pm靶向部分之间的柔性接头。
22.项目21所述的生物传感器系统,其中所述柔性接头具有相当于约50至约500个氨基酸的长度。
23.项目22所述的生物传感器系统,其中所述柔性接头具有相当于约200个氨基酸的长度。
24.项目1至23中任一项所述的生物传感器系统,其中所述重组gα蛋白是人gαq、gαs、gαi1、gαi2、gαi3、gαt-锥(gαt-cone)、gαt-棒(gαt-rod)、gαt-味(gαt-gust)、gαz、gαoa、gαob、gαolf、gα11、gα12、gα13、gα14和gα15/gα16蛋白,或其混杂的或非选择性的gα变体,例如突变的gα多肽包括在对应于本文描述的人gαq蛋白的第66、67和/或75位残基位置处的突变。
25.项目1至24中任一项所述的生物传感器系统,其中所述βγip是grk2或grk3。
26.项目1至25中任一项所述的生物传感器系统,其中,(i)如果所述第二组件包括融合的gβ蛋白,则所述第一生物传感器和第二生物传感器进一步包括重组gγ蛋白,或(ii)如果所述第二组件包括融合的gγ蛋白,则所述第一生物传感器和第二生物传感器进一步包括重组gβ蛋白。
27.项目1至25中任一项所述的生物传感器系统,其中,(a)中定义的生物传感器系统进一步包括g蛋白偶联受体(gpcr)。
28.项目1至27中任一项所述的生物传感器系统,其中,(b)中定义的生物传感器系统进一步包括重组gβ蛋白和/或重组gγ蛋白。
29.项目1至28中任一项所述的生物传感器系统,其中所述第一生物传感器存在于第一细胞中,所述第二生物传感器存在于第二细胞中。
30.项目1至28中任一项所述的生物传感器系统,其中,在(a)中定义的生物传感器系统中,所述第一生物传感器存在于第一膜制备物中,所述第二生物传感器存在于第二膜制备物中。
31.项目1至30中任一项所述的生物传感器系统,其中,(a)中定义的生物传感器系统包括多个第二生物传感器,其中所述第二生物传感器中的每一个包括不同的重组gα蛋白。
32.项目31所述的生物传感器系统,其中所述不同的重组gα蛋白是以下gα蛋白中的至少两种:gαq、gαs、gαi1、gαi2、gαi3、gαt-锥、gαt-棒、gαt-味、gαz、gαoa、gαob、gαolf、gα11、gα12、gα13、gα14和gα15/gα16。
33.包括编码项目1至26中任一项定义的第一组件、第二组件和第三组件的序列的核酸。
34.项目33所述的核酸,进一步包括编码gγ蛋白或gβ的序列。
35.项目33或34所述的核酸,进一步包括一个或多个翻译调节序列。
36.项目35所述的核酸,其中所述一个或多个翻译调节序列是内部核糖体进入位点(ires)。
37.用于检测g蛋白活性的生物传感器,其包括:
(i)第一组件,其包括融合于(a)ret供体;(b)ret受体或(c)报告蛋白的第一片段的gβγ互作蛋白(βγip);和
(ii)第二组件,其包括融合的质膜(pm)靶向部分,其中所述pm靶向部分融合于(a)ret供体;(b)ret受体或(c)所述报告蛋白的第二片段;
其中,(a)如果所述βγip融合于所述ret供体,则所述pm靶向部分融合于所述ret受体;(b)如果所述βγip融合于所述ret受体,则所述pm靶向部分融合于所述ret供体;和(c)如果所述βγip融合于所述报告蛋白的第一片段,则所述pm靶向部分融合于所述报告蛋白的第二片段。
38.项目37所述的生物传感器,其中所述pm靶向部分是pm蛋白或其定位于pm的片段。
39.项目38所述的生物传感器,其中所述pm蛋白或其片段包括(a)棕榈酰化、豆蔻酰化和/或异戊烯化信号序列和/或(b)多碱序列。
40.项目39所述的生物传感器,其中所述多碱序列和异戊烯化信号序列来自人kras剪接变体b。
41.项目40所述的生物传感器,其中所述pm靶向部分包括氨基酸序列kkkkkksktkcvim(seqidno:37)。
42.项目37至41中任一项所述的生物传感器,其中所述生物传感器进一步包括第三组件,所述第三组件包括重组gα蛋白。
43.项目42所述的生物传感器,其中所述重组gα蛋白属于gq家族。
44.项目43所述的生物传感器,其中所述重组gα蛋白是gαq或gα11。
45.用于确定测试试剂是否调节gpcr的活性的方法,所述方法包括:
(1)提供包括(a)、(b)或(c)中定义的元件的生物传感器:
(a)
(i)第一组件,其包括融合于(a)ret供体;(b)ret受体或(c)报告蛋白的第一片段的gβγ互作蛋白(βγip);
(ii)第二组件,其包括融合的gβ蛋白或融合的gγ蛋白,其中所述gβ蛋白或所述gγ蛋白融合于(a)ret供体;(b)ret受体或(c)所述报告蛋白的第二片段,
其中,(a)如果所述βγip融合于所述ret供体,则所述gβ或gγ蛋白融合于所述ret受体;(b)如果所述βγip融合于所述ret受体,则所述gβ或gγ蛋白融合于所述ret供体;(c)如果所述βγip融合于所述报告蛋白的第一片段,则所述gβ或gγ融合于所述报告蛋白的第二片段;
(iii)第三组件,其包括重组gα蛋白;和
(iv)第四组件,其包括所述gpcr;
(b)
(i)第一组件,其包括融合于(a)ret供体;(b)ret受体或(c)报告蛋白的第一片段的gβγ互作蛋白(βγip);
(ii)第二组件,其包括在其c端融合于(a)ret供体;(b)ret受体或(c)所述报告蛋白的第二片段的gpcr;
(iii)第三组件,其包括重组gα蛋白;
其中,(a)如果所述βγip融合于所述ret供体,则所述gpcr融合于所述ret受体;(b)如果所述βγip融合于所述ret受体,则所述gpcr融合于所述ret供体;(c)如果所述βγip融合于所述报告蛋白的第一片段,则所述gpcr融合于所述报告蛋白的第二片段;或
(c)
(i)第一组件,其包括融合于(a)ret供体;(b)ret受体或(c)报告蛋白的第一片段的gβγ互作蛋白(βγip);
(ii)第二组件,其包括融合的质膜(pm)靶向部分,其中所述pm靶向部分融合于(a)ret供体;(b)ret受体或(c)所述报告蛋白的第二片段;
其中,(a)如果所述βγip融合于所述ret供体,则所述pm靶向部分融合于所述ret受体;(b)如果所述βγip融合于所述ret受体,则所述pm靶向部分融合于所述ret供体;(c)如果所述βγip融合于所述报告蛋白的第一片段,则所述pm靶向部分融合于所述报告蛋白的第二片段;
(iii)第三组件,其包括重组gα蛋白;和
(iv)第四组件,其包括所述gpcr;以及
(2)在存在和不存在所述测试试剂的情况下,测量由所述ret受体或报告蛋白发射的信号;
其中在试剂存在的情况下测量到的较高信号表示所述测试试剂提高所述gpcr的活性,而在试剂存在的情况下测量到的较低信号表示所述试剂抑制所述gpcr的活性。
46.项目44所述的方法,其中所述生物传感器包括项目2至32和38至44中定义的特征中的一个或多个。
47.用于确定gα蛋白是否由gpcr激动剂激活的方法,所述方法包括:
(a)在项目1至32中任一项所述的生物传感器系统的第一生物传感器和第二生物传感器中,在存在和不存在所述gpcr激动剂的情况下,测量由ret受体或报告蛋白发射的信号,和
(b)基于由所述ret受体或报告蛋白发射的信号,鉴别gα蛋白是否由所述gpcr激动剂激活;
其中,在gpcr激动剂存在的情况下,在所述第二生物传感器中测量到的与所述第一生物传感器相比更高的信号增加,说明gα蛋白是由所述gpcr激动剂激活的,而其中在gpcr激动剂存在的情况下,在所述第二生物传感器中测量到的与所述第一生物传感器相似或与所述第一生物传感器相比更低的信号增加或信号减少,说明所述gα蛋白不是由所述gpcr激动剂激活的。
48.用于确定gα蛋白是否由gpcr激动剂激活的方法,所述方法包括:
(a)在第一生物传感器中,在存在和不存在所述gpcr激动剂的情况下,测量由ret受体或报告蛋白发射的信号,所述第一生物传感器包括:
(i)第一组件,其包括融合于(a)ret供体;(b)ret受体或(c)报告蛋白的第一片段的gβγ互作蛋白(βγip);和
(ii)第二组件,其包括融合的g蛋白偶联受体(gpcr),其中所述gpcr在其c端融合于(a)ret供体;(b)ret受体或(c)所述报告蛋白的第二片段;
(b)在第二生物传感器中,在存在和不存在所述gpcr激动剂的情况下,测量由ret受体或报告蛋白发射的信号,所述第二生物传感器包括:
(i)(a)中定义的第一组件和第二组件;和
(ii)第三组件,其包括重组形式的所述gα蛋白;
其中,(a)如果所述βγip融合于所述ret供体,则所述gpcr融合于所述ret受体;(b)如果所述βγip融合于所述ret受体,则所述gpcr融合于所述ret供体;(c)如果所述βγip融合于所述报告蛋白的第一片段,则所述gpcr融合于所述报告蛋白的第二片段;
其中,在gpcr激动剂存在的情况下,在所述第二生物传感器中测量到的与所述第一生物传感器相比更高的信号增加,说明gα蛋白是由所述gpcr激动剂激活的,而其中在gpcr激动剂存在的情况下,在所述第二生物传感器中测量到的与所述第一生物传感器相似或与所述第一生物传感器相比更低的信号增加或信号减少,说明所述gα蛋白不是由所述gpcr激动剂激活的。
49.项目47所述的方法,其中所述生物传感器包括项目38至44中定义的特征中的一个或多个。
50.项目45所述的方法,进一步包括:
(3)在存在和不存在所述测试试剂和gpcr激动剂存在的情况下,在以下生物传感器中测量由ret受体或报告蛋白发射的信号:
(a)项目1至31中任一项的元件(a)中定义的第二生物传感器,
(b)项目1至31中任一项的元件(b)中定义的生物传感器,或
(c)项目42至44中任一项所述的生物传感器,
其中所述重组gα蛋白偶联于所述gpcr;以及
(4)确定所述测试试剂是否是所述gα蛋白的抑制剂;
其中,在测试试剂存在的情况下测量到的较低信号表示所述测试试剂是所述gα蛋白的抑制剂,而在测试试剂存在的情况下测量到的相似或较高信号表示所述测试试剂不是所述gα蛋白的抑制剂。
51.用于确定测试试剂是否是感兴趣的gα蛋白的抑制剂的方法,所述方法包括:
(1)使以下生物传感器与gpcr激动剂接触:
(a)项目1至32中任一项的元件(a)中定义的第二生物传感器,
(b)项目1至32中任一项的元件(b)中定义的生物传感器,或
(c)项目42至44中任一项所述的生物传感器;
其中所述重组gα蛋白对应于所述感兴趣的gα蛋白;
(2)在存在和不存在所述测试试剂的情况下,测量由所述ret受体或报告蛋白发射的信号;以及
(3)确定所述测试试剂是否是所述gα蛋白的抑制剂,
其中在测试试剂存在的情况下测量到的较低信号表示所述测试试剂是所述感兴趣的gα蛋白的抑制剂,而在测试试剂存在的情况下测量到的相似或较高信号表示所述测试试剂不是所述感兴趣的gα蛋白的抑制剂。
52.用于确定测试试剂是否是感兴趣的gα蛋白的激活剂的方法,所述方法包括:
(1)使以下生物传感器与gpcr激动剂接触:
(a)项目1至32中任一项的元件(a)中定义的第二生物传感器,
(b)项目1至32中任一项的元件(b)中定义的生物传感器,或
(c)项目42至44中任一项所述的生物传感器;
其中所述重组gα蛋白对应于所述感兴趣的gα蛋白;
(2)在存在和不存在所述测试试剂的情况下,测量由所述ret受体或报告蛋白发射的信号;以及
(3)确定所述测试试剂是否是所述gα蛋白的激活剂,
其中,在测试试剂存在的情况下测量到的较高信号表示所述测试试剂是所述感兴趣的gα蛋白的激活剂,而在测试试剂存在的情况下测量到的相似或较低信号表示所述测试试剂不是所述感兴趣的gα蛋白的激活剂。
53.项目45至52中任一项所述的方法,其中所述ret供体是生物发光蛋白,其中所述方法进一步包括使生物传感器与所述供体生物发光蛋白的底物接触。
54.项目53所述的方法,其中所述底物是荧光素。
55.项目54所述的方法,其中所述荧光素是腔肠素。
56.项目55所述的方法,其中所述腔肠素是腔肠素400a。
57.项目45至56中任一项所述的方法,其中所述生物传感器包括ret供体和ret受体,其中所述方法进一步包括:(i)测量由所述ret供体发射的信号,和(ii)确定[ret受体信号/ret供体信号]的比。
58.突变的gα多肽,其包括在对应于人gαq蛋白的第67位残基和/或第75位残基的位置的突变。
59.项目58所述的突变的gα多肽,其中所述突变是置换。
60.项目58或59所述的突变的gα多肽,其中所述突变在对应于人gαq蛋白的第67位残基的位置。
61.项目60所述的突变的gα多肽,其中所述突变是对非芳香残基的置换。
62.项目61所述的突变的gα多肽,其中所述非芳香残基是半胱氨酸。
63.项目58或59所述的突变的gα多肽,其中所述突变在对应于人gαq蛋白的第75位残基的位置。
64.项目63所述的突变的gα多肽,其中所述突变是对非芳香残基的置换。
65.项目64所述的突变的gα多肽,其中所述非芳香残基是甘氨酸。
66.包括编码项目58至65中任一项所述的突变的gα多肽的序列的核酸。
67.包括项目66所述的核酸的质粒或载体。
68.包括项目65所述的核酸或项目67所述的质粒的细胞。
在阅读仅参照附图通过举例的方式提供的以下具体实施方式的非限制性描述时,本发明的其他目的、优势和特征会变得更明显。
附图说明
在附图中:
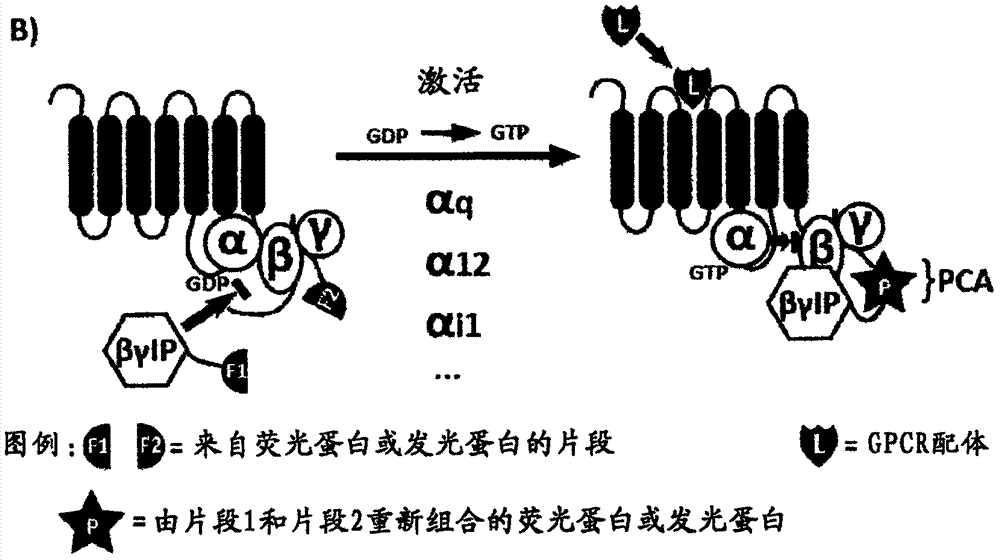
图1a至图1c显示了,图示以gpcr作为g蛋白激活剂的例子,作为使用g蛋白激活的基于βγip的生物传感器的基本原理的示意图。该测定基于gα亚基和βγip之间竞争结合于gβγ二聚体。当异源三聚体g蛋白的gα亚基处于非激活形式时,其紧密结合于gβγ二聚体。当配体结合于受体上时,gα亚基从gdp结合形式转变为gtp结合形式,导致所述gα亚基与gβγ亚基解离,使βγip被募集至游离gβγ亚基。因此,当受体受刺激时,βγip和gβγ之间的相互作用会反映特定的g蛋白的激活。可以用不同的检测方法来评估βγip和gβγ之间的相互作用,如共振能量转移(ret)方法(图1a)或蛋白质互补(pc)测定(图1b)。在共振能量转移方法中,用能量供体和受体标记了βγip和gβγ,当g蛋白激活时,观察到ret信号的增加。在蛋白质互补测定的情况下,βγip和gβγ融合于荧光蛋白或发光酶的片段,在g蛋白激活后,两个片段的互补作用将导致荧光信号或酶活性的增强。图1c显示了g蛋白激活的基于βγip的生物传感器的结果的理论方案(scenarios)和相应解释。使用bret作为测定方法的例子,图1c中描绘了三种不同的方案。在方案1(左)中,用除了异源三聚体g蛋白的gα亚基外的生物传感器的所有组件转染细胞。缺少α亚基导致过量gβγ亚基与基态βγip相互作用。方案2(中)中,转染生物传感器的所有组件,但是过表达的gα亚基(gα1)不与感兴趣的受体在功能上偶联。方案3(右)显示了当伴随对感兴趣的受体适当的gα亚基(gα2)而表达生物传感器的所有组件时,该生物传感器的典型应答。在该情况下,受体激活导致bret信号的增强,所述bret信号通过将标记gfp的βγip募集至之前与特定gα亚基偶联的标记rluc的gβγ亚基产生。
图2显示测试对基于βγip的g蛋白激活生物传感器的优化的某些不同构建体。在图2a中,呈现了grk2/3的结构。grk2/3包括(arbour)不同功能域:钙调蛋白结合域(cam);rgs(g蛋白信号传导调节剂)域,其可以通过本文描述的d110a置换失活;催化域,其用于grk2/3激酶活性,以及可以通过本文描述的k220r置换失活;以及普列克底物蛋白同源域(ph域),其与pip2和异源三聚体g蛋白的gβ亚基结合。这些相互作用促进grk转移至质膜及其激活。已经报道了grk的c端部分(第670位和第685位丝氨酸)的磷酸化作用调控其活性。测试了grk2和grk3的四种不同的gfp标记的构建体,两种基于完整的grk编码序列,两种基于c端ph域/gβ结合域,其中gfp位于grk的n端部分或c端部分。以与bret标记的融合物来测试gβ和gγ亚基两者,并且它们均可以用于监测grk/gβγ相互作用。
图2b和图2c显示了四种不同grk构建体(图2a)的不同比例的测试(滴定)和获得的对gα15的β1ar激活(图2b)以及gα11的血栓素a2受体(tpαr)介导的激活的响应(图2c)。基于转染了编码受体的构建体以及gα(图2b中的β1ar/gα15和图2c中的tpαr/gα11)、gβ1、rluch-gγ5(96孔板中0.5ng/孔)和变化量的标记gfp10的grk2构建体(高达75ng/孔)的hek293细胞,进行bret供体向受体的滴定。用载体或激动剂处理细胞15分钟(1μm异丙肾上腺素和100nmu-46619分别处理表达β1ar和tpαr的细胞)。报告了bret比在gfp构建体表达(对荧光的评价)的功能上优于rlucii构建体表达(对生物发光的评价)的功能。这些结果表明,根据bret信号的幅度和对宽范围的供体与受体比响应的稳定性,c端标记了bret供体(gfp)的全长grk提供了最佳的动态窗口。
图3a至图3c显示了使用基于βγip的生物传感器的tpαr的g蛋白激活谱。图3a:在bret测量之前,瞬时表达tpαr以及grk2-gfp、rluc-gγ5、gβ1和指定的gα的hek293细胞暴露于100nmu-46619或载体中15分钟。模拟条件没有任何gα亚基过表达。图3b:图3a中激动剂处理的细胞获得的bret值表示为用载体处理的相应细胞获得的bret值的百分比。模拟条件用来确定阳性响应的阈值。图3c:使用grk2-gfp/rluc-gγ5/gβ1生物传感器,并使用tpαr的gαq、gα13、gα14、gα15、gαqg66k和gαqy67c激活的激动剂u-46619的剂量响应曲线。
图4a至图4j显示了使用基于βγip的生物传感器的多巴胺d2受体(d2r)、α1b-肾上腺素能受体(α1bar)和α2c-肾上腺素能受体(α2car)的g蛋白激活谱。在bret测量之前,用以下激动剂:罗替戈汀(图4a和图4b)、苯基肾上腺素(图4c、图4d、图4e)或肾上腺素(图4e)刺激瞬时表达d2r(图4a和图4b)、α1bar(图4c和图4d)或α2car(图4e和图4f),以及grk2-gfp、rluc-gγ5、gβ1和指定的gα的hek293细胞15min。图4a、图4c和图4e:数据表示为载体处理的细胞中获得的bret信号的百分比。没有任何gα亚基过表达的模拟条件用于测定阳性响应的阈值。如图4a、图4c和图4e所呈现的,具有混杂激活(promiscuousactivation)特性的g蛋白(如gαqy67c)可以用于监测受体激活(参见图14中的位置和周围序列)。gα的这些混杂突变体可以用作受体激活的阳性对照,所述受体激活的阳性对照可以用于表征拮抗剂或筛选孤儿受体(orphanreceptor)激动剂。图4b是使用grk2-gfp/rluc-gγ5/gβ1生物传感器,选择的gα蛋白(gαi1和四种混杂gαq突变体:g66k、g66d、y67c和f75g)与罗替戈汀(一种d2r激动剂)的剂量响应曲线。在图4d中,显示了使用grk2-gfp/rluc-gγ5/gβ1生物传感器,α1bar和选择的gα蛋白质(gα11和gαq)与苯基肾上腺素(一种α-肾上腺素激动剂)的剂量响应曲线。在图4e中,由表达α2car、gαz、grk2-gfp、rluc-gγ5以及gβ1的hek293细胞,获得了gαz激活与不同的肾上腺素能激动剂(肾上腺素、去甲肾上腺素、苯基肾上腺素和异丙肾上腺素)的剂量响应曲线。图4f显示使用两种不同的α2car激动剂:肾上腺素和苯基肾上腺素的α2car的g蛋白激活谱。这些结果显示,基于βγip的生物传感器可以用于建立g蛋白激活和不同的受体和配体的药理学谱。在图4g至图4j中,用gβγ亚基的不同组合获得肾上腺素/α2car促进gαz激活的剂量响应曲线。用编码α2car、gαz、grk2-gfp、不同的标记rluc的gγ(图4g和图4h)以及gβ(图4g中的gβ1,图4h中的gβ3短变体(gβ3sh))的构建体转染hek293细胞。在图4i和图4j中,用编码α2car、gαz、grk2-gfp、标记rluc的gγ(图4i中的gγ1和图4j中的gγ5)以及不同的gβ的构建体转染细胞。这些结果显示,gβ和gγ两种亚基的组合可以导致不同的g蛋白激活的药理学谱。这些差异可以部分地与使用不同细胞和组织观察到的不同药理学谱相关,所述不同细胞和组织不仅表达特定的gα亚基集合,还表达gβ亚基和gγ亚基的不同的组合和水平。这些结果显示,基于βγip的生物传感器可以用来研究和更好地理解这些差异。
图5a至图5d显示了基于βγip的生物传感器可以用于表征和验证g蛋白调节剂的选择性和作用方式。图5a和图5b显示了ptx(一种gαi/gαo阻断剂)对gαi1的选择性抑制和ubo-qic(一种gαq抑制剂类似物:ym-254890)对gαq的选择性抑制。在记录bret信号之前,用ptx、ubo-qic或载体(对照)预处理表达tpαr和gαq(图5a)或d2r和gαi1(图5b)以及gβ1、rluc-gγ5和grk2-gfp的hek293细胞,然后将所述hek293细胞暴露于增加浓度的u-46619(图5a)或罗替戈汀中(图5b)15分钟。在图5c中,tpαr介导的g蛋白激活用于验证ubo-qic抑制剂的选择性。用ubo-qic预处理共表达tpαr和生物传感器grk2-gfp/rluc-gγ5/gβ1+指定的gα亚基的细胞,然后将所述细胞暴露于载体或激动剂u-46619(100nm)中。这些结果显示,gαq家族(gαq、gα11、gα14和gα15)中,仅gα15对ubo-qic不敏感。gα12蛋白和gα13蛋白也对ubo-qic不敏感。图5d,基于βγip的生物传感器用来揭示突变的gαq激活的ubo-qic敏感性。在第67位引入了gαq置换(见图14)。抗ubo-qic抑制的仅该酪氨酸残基的置换(y67c、y67g、y67s和y67l)还显示混杂特性,这说明该残基对控制g蛋白激活也是重要的。phe75残基置换为甘氨酸导致仅部分的ubo-qic介导的激活抑制(图5d)和还导致了混杂表型(见图4a)。
图6a和图6b显示了受体激活时基于βγip的g蛋白激活生物传感器响应的动力学。图6a:使瞬时表达d2r,以及gαi1、gβ1、rluc-gγ5和grk2-gfp的hek293细胞暴露于1μm罗替戈汀或载体中,同时每隔一定时间测量bret。图6b:使瞬时表达tpαr,以及gα11、gβ1、rluc-gγ5和grk2-gfp的hek293细胞暴露于100nmu-46619或载体中,同时每隔一定时间测量bret。在两种情况下,测量30秒后,将激动剂和载体添加至细胞。
图7a和图7b显示了基于βγip的g蛋白激活生物传感器的z’因子评价。使瞬时表达d2r和gαi1(图7a)或tpαr和gα11(图7b),以及gβ1、rluc-gγ5和grk2-gfp的hek293细胞暴露于1μm的罗替戈汀(图7a)、100nm的u-46619(图7b)或载体(图7a、图7b)中15分钟。以96孔板的每个单独的孔表示bret比。对于这些代表性实验,d2r(图7a)和tpαr(图7b)的z’因子分别评价为0.79和0.89。
图8a至图8c显示了基于βγip的g蛋白激活生物传感器的配体分布图。图8a:瞬时表达血管紧张素ii1型受体(at1r),以及gβ1、rluc-gγ5、grk2-gfp和指定的gα的hek293细胞的g蛋白激活分布图,在bret测量之前用1μm血管紧张素ii刺激所述hek293细胞15分钟。图8b:饱和浓度的血管紧张素ii类似物(1μm)对gαq、gα11和gα12的g蛋白激活分布图。图8a和图8b中的结果表示为在载体处理的细胞中获得的bret信号的百分比,没有任何gα亚基过表达的模拟条件下用于测定阳性响应阈值。图8c:使用grk2-gfp/rluc-gγ5/gβ1生物传感器,并用angii和dvg配体获得的剂量响应曲线,所述angii和dvg配体用于at1r的gαq和gα12激活。数据表示为对每个g蛋白获得的angii响应的百分比。
图9a和图9b显示了使用基于βγip的生物传感器,用基于蛋白互补的检测方法评估g蛋白激活;rluc蛋白互补测定(rluc-pca)。图9a:对用tpαr、grk2-rlucf1、rlucf2-gγ5、gβ1和gα11亚基转染,并且用100nm的u-46619或载体刺激10分钟的hek293细胞获得的z’因子。以96孔板的每个单独的孔表示发光值。对于该代表性实验,z’因子评估为0.53。图9b:使用grk2-rlucf1/rlucf2-gγ5/gβ1生物传感器并使用激动剂u-46619的剂量响应曲线,所述激动剂u-46619用于tpαr的gα11激活。
图10a至图10c显示了使用grk3作为βγip评估g蛋白激活。图10a:获得自hek293细胞的剂量响应曲线,所述hek293细胞瞬时表达d2r,以及gαi1、gβ1、rluc-gγ5和grk2-gfp(黑色圆圈)或grk3-gfp(白色三角形),并且在bret测量之前,暴露于增加浓度的激动剂罗替戈汀中15分钟。图10b:基于grk3的生物传感器响应于hek293细胞的动力学,所述hek293细胞用d2r、gαi1、gβ1、rluc-gγ5和grk3-gfp转染,并且暴露于1μm的罗替戈汀或载体中,同时每隔一定时间测量bret。在测量30秒后,将激动剂和载体注射至细胞。图10c:对于hek293细胞的基于grk3的生物传感器的z’因子评价,所述hek293细胞用d2r、gαi1、gβ1、rluc-gγ5和grk3-gfp转染,暴露于1μm的罗替戈汀或载体中15分钟。以96孔板的每个单独的孔表示bret比,对于该代表性实验,z’因子评价为0.71。
图11a至图11d显示了用编码基于βγip的g蛋白激活生物传感器的多顺反子载体进行的实验结果。图11a:图示了编码以下蛋白的多顺反子构建体的示意图:grk2-gfp、rluc-gγ5和gβ1。图11b中呈现了hek293细胞的g蛋白激活谱,所述hek293细胞用编码tpαr、gα(gαq、gα11、gα12、gα13、gα14或gα15/16;模拟条件没有gα)的构建体和编码标记gfp的wtgrk2或grk2的rgs-死亡(dead)突变体(d110a)的多顺反子构建体(图11a中所描述的)共转染。tpαr通过其激动剂(100nmu46619)激活导致与多顺反子构建体相似的结果和分布图,说明功能性rgs域不是grk2募集的必要条件。图11c:使用图11a中描述的多顺反子构建体(具有wtgrk2),使用激动剂u-46619的剂量响应曲线,所述激动剂u-46619用于tpαr的gα11激活。图11d中,获得hek293细胞的z’因子,所述hek293细胞如图11c中转染,以及用100nm的u-46619或载体刺激15分钟。以96孔板的每个单独的孔表示bret比。对于该代表性实验,z’因子评价为0.80。
图12a和图12b显示了膜锚定的基于βγip的g蛋白激活生物传感器。图12a:图示了作为使用基于膜锚定的grk2(grk2-mem)的生物传感器的基本原理和相关的编码grk2-gfp-mem的dna构建体的示意图。图12b:从hek293细胞中获得膜制备物,所述hek293细胞用tpαr、gβ1、rlucii-gγ5、grk2-gfp或grk2-gfp-mem,在缺少或存在gα11的情况下转染,以及用100nm的u-46619或载体刺激15分钟。然后基于所述膜制备物进行bret实验。数据表示为在载体处理的细胞中获得的bret信号的百分比。
图13a至图13c显示了报道的影响grk2功能(rgs和催化)或其通过磷酸化的调控的置换不阻止也不显著促进grk2募集至激活的g蛋白。在图13a中,用提高剂量的u46619刺激共表达tpαr、gαq、gβ1、rlucii-gγ5和grk2-gfp(wt=实心正方形,rgs-死亡d110a突变体=空心圆圈,和催化-死亡k220r突变体=空心三角形)变体的hek293细胞。如图11b和图13a所显示,功能性rgs域不是用生物传感器检测到的gαq响应所需要的(其也不促进用生物传感器检测到的gαq响应)。也可以以以下两种配置与该生物传感器(图13a和图13c)使用催化-死亡grk2的突变体:测量为由grk2-gfp与游离的gβ1/rlucii-gγ5(图13a)相互作用所致的bret增加,和由rlucii-grk2与游离的gβ1/gfp10-gγ5(图13c)相互作用所致的bret增加的g蛋白激活。使用这些突变体可以使过表达功能性激酶的副作用最小化,已知所述副作用通过激酶的rgs域抑制gαq-介导的plc激活。使用这样的突变体对需要通过传感器的多路复用(multiplexing)或不同测定的多路复用对多个信号传导通路进行监测的应用是有利的。在图13b中,如图13a转染hek293细胞,但用wtgrk2(实心正方形)或会阻止(s670a=空心三角形,s676a=空心菱形和s685a=空心圆圈)或模拟(s670d=实心三角形,s676d=实心菱形和s685d=实心圆圈)其c端结合域的磷酸化的突变体转染hek293细胞。已知grk2通过erk、pka和cdk2-细胞周期蛋白a对这些丝氨酸残基磷酸化来调节其活性(cong等人,生物化学期刊(thejournalofbiologicalchemistry),276,15192-15199;pitcher等人,生物化学期刊(thejournalofbiologicalchemistry),274,34531-34534;penela等人,pnas,107(3):1118-1123;choudhary等人,molcell.200936(2):326-39)。然而,图13b中呈现的结果提供了以下证据:grk2募集至gβγ对不同信号传导事件的调控可以是不敏感的。图13c中,用增加剂量的u46619刺激共表达tpαr、gαq、gβ1、gfp-gγ5和rlucii-grk2变体(wt=实心正方形,和催化-死亡k220r突变体=空心三角形)的hek293细胞。bret供体和受体在grk2的n端(图13c)或c端(图13a)具有标记的两种配置导致相似的结果,这为生物传感器的配置是柔性的提供了证据。
图14显示了人g蛋白α亚基(seqidnos:1-17)的序列比对和导致混杂的偶联特性的置换。人异源三聚体g蛋白的gα亚基使用dialign工具(http://bibiserv.techfak.uni-bielefeld.de/dialign/submission.html)比对,用boxshade工具(http://www.ch.embnet.org/software/box_form.html)格式化,以及呈现了以接头1为中心的区域。贯穿gα亚基显示高保守性的残基用黑色和灰色背景标识。还标识了接头1和由第二结构预测的α螺旋。
图15a显示了图示包括ret受体(a)标记的βγip(grk)和在c端用ret供体(d)标记的gpcr的生物传感器的示意图。测定也基于gα亚基和βγip之间竞争结合于gβγ二聚体,所述gβγ二聚体结合于gpcr的c端部分。当处于无活性形式时,异源三聚体g蛋白的gα亚基紧密地结合于gβγ二聚体。当配体结合于gpcr时,gα与gβγ亚基解离,允许βγip被募集至游离的gβγ亚基,以及使ret受体紧密接近于连接于gpcr的ret供体,由此诱导/提高bret信号。图15b和15c显示了用图15a中描述的生物传感器获得的g蛋白激活的剂量响应曲线。用增加剂量的u46619刺激共表达tpαr-rlucii、不同的gα(gαq=实心正方形,gα11=实心三角形,gα14=实心菱形和gα12=空心圆圈)、gβ1、gγ5和wtgrk2-gfp(图15b)或突变的d110agrk2-gfp(图15c)的hek293细胞。剂量响应曲线在图15b和图15c中显示相似的分布图,这说明如图11b和图13a中的一样,但采用不同的生物传感器配制,对于将βγip募集至激活的g蛋白,不需要功能性rgs。
图16a显示了图示生物传感器的示意图,所述生物传感器包括用ret供体(d)标记的βγip(grk)和质膜标记物:用质膜靶向和锚定序列(例如caax域)标记的ret受体(a)。该测定也基于gα亚基和βγip之间竞争结合于位于质膜的gβγ二聚体。当处于非激活的形式时,异源三聚体g蛋白的gα亚基紧密地结合于gβγ二聚体。当配体结合于gpcr时,gα与gβγ亚基解离,允许βγip被募集至位于质膜的gβγ亚基,这导致ret供体(βγip-d)和受体(质膜标记物,a-caax)的密度增加,从而诱导/提高bret信号。图16b显示由图16a中描述的生物传感器获得的g蛋白激活的剂量响应曲线。用增加剂量的u46619刺激共表达tpαr、不同的gα(gαq=实心正方形,gα11=实心三角形,模拟条件(无gα)=空心圆圈)、gβ1、gγ5、rlucii-grk2和rgfp-caax的hek293细胞。图16b中的剂量响应曲线与在图3c、图9b和图11c中用不同配置的生物传感器获得的剂量响应曲线相似。在图16c中,获得了hek293细胞的z’因子,所述hek293细胞如图16b中转染,以及用100nm的u-46619或载体刺激15分钟。96孔板的每个单独的孔表示bret比率。对于该代表性实验,z’因子评价为0.89。
图17a显示了人grk2(seqidno:18)的氨基酸序列,其中黑体部分为d110位、k220r位、s670位、s676位和s685位(在本文描述的某些构建体中发生突变),下划线部分为推定的ph域,以及斜体部分为用于本文描述的某些构建体中的grk2的c端部分(grk2c端,seqidno:50)。
图17b显示了人grk3(seqidno:19)的氨基酸序列,其中下划线部分为推定的ph域,以及斜体部分为用于本文描述的某些构建体中的grk3的c端部分(grk3c端,seqidno:51)。
图17c显示了plekhg2(seqidno:20)的氨基酸序列,其中下划线部分为推定的ph域。
图17d显示用于本文描述的试验的gfp10的氨基酸序列(seqidno:38)。
图17e显示了用于本文描述的试验的海肾(renillareniformis)gfp的氨基酸序列(rgfp,seqidno:46)。
图17f显示了用于本文描述的试验的rlucii的氨基酸序列(seqidno:39)。
具体实施方式
本文使用的遗传学、分子生物学、生物化学和核酸的术语和符号遵循本领域中的标准论著和课本中的术语和符号,例如kornberg和baker,dna复制,第二版(w.h.freeman,newyork,1992);lehninger,生物化学,第二版(worthpublishers,newyork,1975);strachan和read,人类分子遗传学(humanmoleculargenetics),第二版(wiley-liss,newyork,1999);eckstein,编,寡核苷酸和类似物:实用方法(oligonucleotidesandanalogs:apracticalapproach)牛津大学出版社(oxforduniversitypress,newyork,1991);和gait,编,寡核苷酸合成:实用方法(oligonucleotidesynthesis:apracticalapproach)(irlpress,oxford,1984)等。所有术语应该以本领域中建立的典型意义理解。
本文使用的冠词“a”和“an”是指一个或多于一个(例如至少一个)的冠词的语法对象。例如,“一个元件(anelement)”意为一个元件或多于一个元件。贯穿本说明书,除非上下文另有需要,单词“包含(comprise)”、“包含(comprises)”和“包含(comprising)”会被理解为暗示包含陈述的步骤或元件或步骤或元件的组,而不排除任何其他步骤或元件或步骤或元件的组。
本文描述的研究中,本发明已经显示基于βγip竞争的生物传感器可以用于监测g蛋白激活,不需要修饰受体和/或gα亚基。由于它基于竞争,因此需要单个生物传感器来研究所有不同的g蛋白,以及建立基于共转染的gα亚基的g蛋白激活/偶联谱。g蛋白激活谱不仅对表征受体和药物靶点很重要,而且也可以用于药物发现方法,所述药物发现方法用于鉴别、表征和优化具有与治疗效果和减少副作用相关的偏置信号传导特性的gpcrs配体。
本公开涉及用于监测g蛋白激活,而无需修饰gα蛋白质亚基或g蛋白激活因子(例如g蛋白偶联受体(gpcr)、g蛋白信号传导激活因子(ags)、g蛋白信号传导调节因子或其他化学和生物实体)的通用生物传感器。更具体地说,本发明涉及使用gβγ互作蛋白(βγip)监测各种异源三聚体g蛋白的激活。有利地,本文公开的信号传导生物传感器允许敏感和定量的测定,所述测定可以用于大规模筛选测定和用于鉴定靶向g蛋白活性的配体(激动剂、拮抗剂、反向激动剂、变构调节剂等)结构-活性关系研究。另外,本文公开的生物传感器表示用于评估g蛋白激活谱的工具,以及通过刺激时定位哪一种特定g蛋白被激活来对化合物进行分析。
如图1显示的,根据本公开的实施方式的系统基于gα亚基和βγip之间竞争结合于gβγ二聚体。当处于非激活形式时,异源三聚体g蛋白的gα亚基紧密地结合于gβγ二聚体。当配体与受体结合时,gα亚基从gdp结合形式转换为gtp结合形式,导致gα亚基与gβγ亚基解离,使βγip被募集至游离的gβγ亚基。因此,当受体受刺激时,βγip和gβγ之间的相互作用会反映特定g蛋白的激活。
本发明人还展示了,使用生物传感器监测g蛋白激活是可能的,标记所述生物传感器使用互补bret受体(例如rgfp)标记的质膜靶向部分,在质膜处(在此βγip与结合于gpcr的gβγ复合体相互作用)测量bret供体(例如rluc)标记的βγip(例如grk)的募集/定位。通过bret信号的增强检测βγip在质膜处的浓度/密度的提高(对βγip募集至gβγ复合体的间接测量)。
本发明人进一步展示了,使用测量bret供体(例如rluc)标记的βγip(例如grk)向互补bret受体(例如rgfp)标记gpcr募集的生物传感器监测g蛋白激活是可能的(图15)。
在该背景下,本发明涉及基于βγip的g蛋白激活生物传感器和使用这样的生物传感器评估通过特定g蛋白的激活因子促进的特定g蛋白激活的系统。该系统包括g蛋白激活因子;gα蛋白;和本文描述的生物传感器。本发明进一步涉及使用本公开的系统检测g蛋白激活的方法。
由此,本发明涉及用于检测g蛋白活性的生物传感器系统,所述生物传感器系统包括(a)或(b)中定义的元件:
(a)(i)第一生物传感器,其包括:第一组件,其包括融合于(a)ret供体;(b)ret受体或(c)报告蛋白的第一片段的gβγ互作蛋白(βγip);和第二组件,其包括融合的gβ蛋白或融合的gγ蛋白,其中所述gβ蛋白或所述gγ蛋白融合于(a)ret供体;(b)ret受体或(c)所述报告蛋白的第二片段;(ii)第二生物传感器,其包括:(i)中定义的第一组件和第二组件;以及包括重组gα蛋白的第三组件;其中(a)如果所述βγip融合于所述ret供体,则所述gβ或gγ蛋白融合于所述ret受体;(b)如果所述βγip融合于所述ret受体,则所述gβ或gγ蛋白融合于所述ret供体;(c)如果所述βγip融合于所述报告蛋白的第一片段,则所述gβ或gγ蛋白融合于所述报告蛋白的第二片段;或
(b)(i)生物传感器,其包括:第一组件,其包括融合于(a)ret供体;(b)ret受体或(c)报告蛋白的第一片段的gβγ互作蛋白(βγip);第二组件,其包括融合的g蛋白偶联受体(gpcr),其中所述gpcr在其c端融合于(a)ret供体;(b)ret受体或(c)所述报告蛋白的第二片段;第三组件,其包括重组gα蛋白;其中(a)如果所述βγip融合于所述ret供体,则所述gpcr融合于所述ret受体;(b)如果所述βγip融合于所述ret受体,则所述gpcr融合于所述ret供体;(c)如果所述βγip融合于所述报告蛋白的第一片段,则所述gpcr融合于所述报告蛋白的第二片段。
由此,本发明涉及生物传感器,其包括:(1)第一组件,其包括融合于(a)ret供体;(b)ret受体或(c)报告蛋白的第一片段的gβγ-互作蛋白(βγip);(2)第二组件,其包括融合的gβ蛋白或融合的gγ蛋白,其中所述gβ蛋白或所述gγ蛋白融合于(a)ret供体;(b)ret受体或(c)所述报告蛋白的第二片段;(3)第三组件,其包括重组gα蛋白,其中所述重组gα蛋白是混杂的或非选择性的gα蛋白,例如包括在对应于如本文描述的人gαq的第66、67和/或75位残基的位置处的突变的gα蛋白。在一种实施方式中,生物传感器进一步包括gpcr(天然的或重组的),优选包括孤儿gpcr。
在一种实施方式中,上文定义的生物传感器进一步包括重组gβ蛋白和/或重组gγ蛋白。在进一步的实施方式中,上文定义的生物传感器进一步包括重组gβ蛋白和重组gγ蛋白。在一种实施方式中,上文定义的生物传感器进一步包括gpcr,在进一步的实施方式中,包括重组gpcr。
在另一个方面,本公开由此进一步涉及生物传感器,其包括:(i)第一组件,其包括融合于(a)ret供体;(b)ret受体或(c)报告蛋白的第一片段的gβγ互作蛋白(βγip);和(ii)第二组件,其包括融合的质膜(pm)靶向部分,其中所述pm靶向部分融合于(a)ret供体;b)ret受体或(c)所述报告蛋白的第二片段;其中(a)如果所述βγip融合于所述ret供体,则所述pm靶向部分融合于所述ret受体;(b)如果所述βγip融合于所述ret受体,则所述pm靶向部分融合于所述ret供体;和(c)如果所述βγip融合于所述报告蛋白的第一片段,则所述pm靶向部分融合于所述报告蛋白的第二片段。
在一种非限制性实施方式中,本文描述的生物传感器的活性可基于选自以下的技术检测:共振能量转移(ret),例如生物发光共振能量转移(bret)或荧光共振能量转移(fret);蛋白质互补测定或蛋白质片段补充测定(pca),例如酶片段互补(efc)或双分子荧光互补(bifc)等(见图1)。这样的技术是本领域中已知的,采用可以融合于生物传感器的c端、n端或蛋白元件内的标记/部分。
在共振能量转移方法中,用能量供体和受体标记βγip和gβγ,以及在g蛋白激活时,观察到ret信号的增强。在蛋白质互补测定的情况下,用报告蛋白(如荧光蛋白或发光酶)的片段标记βγip和gβγ,在g蛋白激活后,两个片段的互补会导致报告蛋白信号(例如荧光信号或酶活性)的增强。
共振能量转移(缩写为ret)是描述具有重叠发射/吸收谱的两个发色团之间的能量转移的机制。当两个发色团(“供体”和“受体”)彼此处于短距离(例如10-100埃)并且它们的跃迁偶极子适当地取向时,供体发色团能通过非辐射性的偶极子-偶极子偶联将供体发色团的激发态能量转移至受体发色团。ret的一种类型是生物发光共振能量转移(bret),其基于供体生物发光团(生物发光酶例如荧光素酶)和受体发光团(例如gfp或yfp)之间能量的非辐射性转移。ret的另一种类型是荧光共振能量转移(fret),其涉及能量从激发的供体荧光团向邻近的受体荧光团的转移。例如,gfp的两种颜色变体cfp和yfp分别可以用作供体和受体。
如本文使用的,术语“荧光蛋白”是指当在适当的波长下激发时发荧光的任何蛋白。已经开发了广泛的荧光蛋白,其以几乎跨越整个可见光谱的荧光发射光谱分布为特征。绿色荧光蛋白的非限制性例子包括egfp、gfp10、祖母绿蛋白(emerald)、superfoldergfp、azamigreen、mwasabi,、taggfp、turbogfp、acgfp、zsgreen和t宝石蓝(t-sapphire)。蓝色荧光蛋白的非限制性的例子包括ebfp、ebfp2、石青蛋白(azurite)和mtagbfp。蓝绿色荧光蛋白的非限制性例子包括ecfp、mecfp、蔚蓝色蛋白(cerulean)、mturquoise、cypet、amcyan1、midori-ishicyan、tagcfp、mtfp1(teal)。黄色荧光蛋白的非限制性的例子包括eyfp、topaz、venus、mvenus、mcitrine、mametrine、ypet、tagyfp、phiyfp、zsyellow1和mbanana。橙色荧光蛋白的非限制性的例子包括kusabiraorange、kusabiraorange2、morange、morange2、dtomato、dtomato-tandem、tagrfp、dsred、dsred2、dsred-express(t1)、dsred-monomer和mtangerine。红色荧光蛋白的非限制性的例子包括mruby、mapple、mstrawberry、asred2、mrfp1、jred、mcherry、hcred1、mraspberry、dkeima-tandem、hcred-tandem、mplum和aq143。
如本发明的上下文中使用的“重叠”是指来自供体荧光蛋白或发光酶(例如荧光素酶)的发射光具有能够激发非常接近(通常在约
如本文使用的,术语“荧光素酶”是指一类用于生物发光的氧化酶,其不同于光蛋白。一个例子是来自萤火虫(photinuspyralis)的萤火虫荧光素酶(ec1.13.12.7)(萤火虫(p.pyralis)荧光素酶)。来自几个其他物种的几种重组荧光素酶也是商购可获得的,包括来自海肾(genbank:aaa29804)的荧光素酶及其变体(例如,海肾荧光素酶的稳定变体,例如rlucii(genbank:aav52877.1))、rluc8(genbank:ef446136.1)、高斯荧光素酶(gaussialuciferase)(gluc,genbank:aag54095.1)、
在一种实施方式中,以下bret配置中的一种用于本文描述的生物传感器和方法:bret1,其包括腔肠素-h(coel-h)和yfp(yfp)或来自海肾的gfp(rgfp);bret2,其包括腔肠素-400a(coel-400a)和uv--激发的gfp(uvgfp)或来自海肾的gfp(rgfp);或bret3,其包括coel-h或v-腔肠素(来自nanolight
在pca中,每种蛋白质(例如βγip和gβ/gγ,或gpcr)共价连接于报告蛋白的不完整片段,并且βγip和gβ/gγ的相互作用使报告蛋白片段足够接近,以使它们形成活性可以被测定的功能性报告蛋白。可以被分裂为两部分并且非共价重组的任何蛋白可以用于基于pca的生物传感器。术语“报告蛋白”是指可以容易地检测到(例如通过荧光、光谱学、发光法等),并且在使用的系统中通常地(内源性地)不存在的蛋白。pca中使用的典型的报告蛋白包括酶(其活性可以用合适的底物测定)(例如二氢叶酸还原酶(dhfr)、β-内酰胺酶、β-半乳糖苷酶),或提供色度信号或荧光信号的蛋白(如荧光素酶(例如海肾荧光素酶)、gfp及其变体)。
在另一种非限制性实施方式中,ret或pca标记位于:(i)βγip和gβ蛋白上,或(ii)βγip和gγ蛋白上。在进一步的非限制性实施方式中,在βγip和gβ或gγ亚基的n端、c端或蛋白质内的任何内部区域标记βγip和gβ或gγ亚基。在一种实施方式中,在βγip和gβ或gγ亚基的n端或c端标记βγip和gβ或gγ亚基。在一种非限制性实施方式中,添加至βγip和gβ或gγ亚基的本文描述的pca标记可以是但不限于:荧光团、荧光素酶或包括荧光蛋白或荧光酶的一部分的其片段。
“gpcr”是指全长天然gpcr分子以及突变体/变体gpcr分子。foord等人(2005)pharmacolrev.57,279-288(其通过引用并入本文)中给出了gpcr的清单,更新的gpcr的清单可从iuphar-db数据库中获得(harmaraj,等人.(2009)iuphar-db:g蛋白质偶联受体和离子通道的iuphar数据库(theiuphardatabaseofgprotein-coupledreceptorsandionchannels).nucl.acidsres.37(数据库期):d680-d685;sharmanjl,等人,(2013)iuphar-db:更新的数据库内容和新特性(iuphar-db:updateddatabasecontentandnewfeatures).nucl.acidsres.41(数据库期):d1083-8;alexandersph,bensonhe,faccendae,pawsonaj,sharmanjl,speddingm,petersja和harmaraj,cgtpcollaborators.(2013)药理学简明指南2013/14:g蛋白偶联受体(theconciseguidetopharmacology2013/14:gprotein-coupledreceptors).brjpharmacol.170:1459-1581)。在一种实施方式中,gpcr是孤儿gpcr。如本文使用的术语“孤儿gpcr”是指与其他已鉴别的gpcr具有相似的结构,但是其内源性配体尚未被鉴别的表观受体(apparentreceptor)。通常将gpcr孤儿受体命名为“gpr”后接数字,例如gpr1。孤儿gpcr更新的清单可从上述的iuphar-db数据库中获得。
在一种实施方式中,gpcr在其c端与ret供体或ret受体融合,在进一步的实施方式中,gpcr在其c端与ret供体(例如荧光素酶(rluc))融合。
如本文使用的术语“重组”是指由重组核酸分子(即通过分子生物学/基因工程技术手段制备的核酸)表达的蛋白质分子,例如用编码蛋白的核酸(例如存在于载体中的)转染/转导细胞(或其后代)后表达的蛋白(与细胞天然表达的蛋白相对)。
如本文使用的术语变体(或突变体)是指在结构(氨基酸序列)和生物活性上与对应的天然蛋白基本上相似的蛋白。它包括含有天然蛋白的一个或多个域的片段,以及含有天然蛋白或其片段的融合蛋白。为了产生具有某些希望的特征(例如能组成性激活、失活、与一种或多种配体的结合改变等)的蛋白,变体可以包括相对于天然蛋白的一个或多个突变(置换、缺失、插入)。在序列中改变、插入或缺失单个氨基酸或核苷酸或小百分比的氨基酸或核苷酸的单独置换、缺失或插入产生了“保守修饰的变体”,其中改变导致氨基酸置换为化学相似的氨基酸。提供功能相似的氨基酸的保守置换表是本领域熟知的。除了这样的保守修饰的变体以外,也不排除本发明的多态性变体和等位基因。
“同源性”或“一致性”和“同源的”或“一致的”是指两个多肽之间或两个核酸分子之间的序列和/或结构的相似性。可以通过比较比对的序列中的每个位置来确定同源性/同一性。核酸之间的或氨基酸序列之间的同源性/同一性的程度是在序列共有的位置处相同或匹配的核苷酸或氨基酸的数目的函数。如果两个序列基本上一致并且序列的功能活性是保守的,则如本文使用的术语,核酸序列与另一个序列是同源的(本文使用的术语‘同源的’不能推断出进化亲缘性)。当最佳地比对(允许具有间隙(gap))时,如果两个核酸序列共有至少约50%的序列相似性或一致性,或如果序列共有定义的功能性基序,则两个核酸序列被认为是基本上一致的。在供选择的实施方式中,在最佳比对的基本一致序列中,序列相似性可以是至少60%、65%、70%、75%、80%、85%、90%、95%、96%、97%、98%或99%。如本文使用的,给定的序列之间的同源性/一致性的百分比表示在最佳比对的序列中序列一致性的程度。“不相关的”或“非同源的”序列与本文描述的任何序列共有小于40%的一致性,尽管小于约25%的一致性是优选的。
在一种非限制性实施方式中,系统包括活细胞、膜制备物或两者。本文定义的系统是但不限于膜制备物,所述βγip通过膜靶向接头(例如包括质膜(pm)靶向域(例如质膜-锚定信号肽)的蛋白质/肽接头)粘连于连接到(tetheredto)膜上。该质膜靶向域可以是但不限于共价结合于肽链的脂质群组(例如棕榈酰化、豆蔻酰化或异戊烯化修饰物(作为来自kras的膜锚定信号例如(hancock2003)))、跨膜域或多碱区(作为例如grk5中存在的)。
在一种实施方式中,pm靶向部分包括caax基序(c是半胱氨酸残基,aa是两个脂族残基,x代表任何氨基酸)。在“caax蛋白”中发现了caax基序,所述caax蛋白定义为在c端具有指导其翻译后修饰的特定氨基酸序列的一组蛋白质。caax蛋白涵盖很多种分子,所述分子包括核纤层蛋白(中间丝)(如前核纤层蛋白a、核纤层蛋白b1和核纤层蛋白b2)、ras和多种gtp-结合蛋白(g蛋白)(如ras、rho、rac和cdc42)、几种蛋白激酶和磷酸酶等。(见例如gao等人,amjtranslres.2009;1(3):312-325)。在c端末端具有caax基序或盒的蛋白质在蛋白质迁移到质膜或核膜和发挥不同的功能之前,典型地需要异戊烯化过程。在一种实施方式中,caax盒来源于人ras家族蛋白,例如hras、nras、ral-a、kras4a或kras4b。如下描述了ras、nras、kras4a或kras4b的最后的c端残基(被称为作为高度可变区或hvr),其中以斜体字表示推定的最小质膜靶向区,以下划线表示caax盒(见例如ahearn等人,自然综述分子细胞生物学(naturereviewsmolecularcellbiology)13:39-51,2012年1月):hras:klnppdesgpgcmsckcvls;(seqidno:40);nras:klnssddgtqgcmglpcvvm;(seqidno:41);kras4a:kiskeektpgcvkikkciim;(seqidno:42);kras4b:kmskdgkkkkkksktkcvim:(seqidno:43);ral-a/ral1:kngkkkrkslakrirerccil(seqidno:44)。在一种实施方式中,膜靶向部分包括上述序列的最后4个残基。在进一步的实施方式中,膜靶向部分包括上述序列的最后10个残基。在一种实施方式中,膜靶向部分包括caax蛋白(例如人ras家族蛋白)的c端部分(例如约最后10-30个或15-25个氨基酸),例如人ras家族蛋白的约最后10-30个、15-25个或20个氨基酸。
在一种实施方式中,pm靶向部分包括来自kras4b的序列kkkkkksktkcvim(seqidno:37)。在另一种实施方式中,pm靶向部分包括来自hras的质膜靶向棕榈酰化序列和来自ral-a/ral1的异戊烯化信号序列(序列:cmsckccil,seqidno:45)。
几种蛋白还含有靶向pm的非脂质多碱域(polybasicdomain),所述蛋白如ras小gtp酶、磷酸酶pten、非受体酪氨酸激酶src、肌动蛋白调节因子wasp和marcks、和g蛋白质-偶联受体激酶(grk)(如grk5)。在一种实施方式中,多碱域来自grk5,并且包括序列spkkgllqrlfkrqhqnnsks(seqidno:46)。在一种实施方式中,pm靶向部分在ret供体或受体的c末端融合,在进一步的实施方式中,pm靶向部分在ret受体(如gfp(例如rgfp))的c末端融合。在另一种实施方式中,pm靶向部分在ret供体或受体的c末端融合,在进一步的实施方式中,pm靶向部分在ret受体(如gfp(例如rgfp))的c末端融合,并且ret供体或受体在其n端融合于βγip,例如grk蛋白或其gβγ互作片段/变体。
根据本公开,g蛋白激活因子包括但不限于gpcr进行的g蛋白的经典激活,以及也可以调节这些异源三聚体g蛋白活性的其他蛋白,如g蛋白信号传导调节因子(rgs)、g蛋白信号传导激活因子(ags)和抗胆碱酯酶8蛋白抑制因子(ric-8)。在这些非经典信号传导通路中的一些中,gpcr经典产生的鸟嘌呤交换因子(gef)活性被另一种蛋白质(例如ric-8)替代,例如(boularan和kehrl,2014)。
在一种实施方式中,g蛋白激活因子是gpcr家族的成员。
如本文定义的gα蛋白亚基包括但不限于17种不同的已知同种型、它们的剪接变体和任何突变的gα蛋白,例如导致非选择性/混杂gα的那些gα蛋白。在一种非限制性实施方式中,本文描述的gα蛋白选自任何天然哺乳动物gα蛋白,所述天然哺乳动物gα蛋白包括gαq、gαs、gαi1、gαi2、gαi3、gαt-锥、gαt-棒、gαt-味、gαz、gαoa、gαob、gαolf、gα11、gα12、gα13、gα14,和gα15/16(目前认定的gna15),这些同种型的剪接变体,以及它们的功能性变体。在一种实施方式中,gα蛋白亚基属于gi家族。在一种实施方式中,gα蛋白亚基属于gs家族。在一种实施方式中,gα蛋白亚基属于gq家族。在一种实施方式中,gα蛋白亚基属于g12/13家族。在一种实施方式中,gα蛋白是混杂的或非选择性gα蛋白。在进一步的实施方式中,gα蛋白是在g66、y67、f75及其组合的任意位置处具有置换或在其他gα亚型中具有等价保守置换的突变gα蛋白(例如gαq蛋白),所述等价保守置换导致产生由任意gpcr(包括孤儿受体)激活的非选择性gα蛋白(即能够独立于这些受体与特定的gα蛋白(通常被称为“混杂的”gα蛋白)优先天然偶联,而与gpcr相互作用的gα蛋白),本公开中也包括所述非选择性gα蛋白。在一种实施方式中,用于本文描述的生物传感器/方法的重组gα蛋白是混杂的gα蛋白,gpcr是孤儿gpcr。
在另一个方面,本发明涉及突变gα多肽,其包括位于对应于人gαq蛋白的第67位残基和/或第75位残基位置的突变。所述突变可以是插入、缺失、或置换(例如非保守置换)。图14公开了根据本发明可以发生突变的代表性hgα蛋白的序列的比对,其中用箭头指示对应的gαq的第67位和/或第75位的位置。技术人员会理解,根据对应的gαq(特别是gα1)的第67位和第75位的位置的n端残基数,残基的编号会变化。例如,在hgα14中,对应于gαq的第67位的残基是残基63(y)。相似地,在hgα12中,对应于gαq的第67位的残基是残基85(f)。因此,本发明涵盖了,例如包括第63位突变(例如置换非芳香族残基)的突变gα14多肽和包括第85位突变(例如置换非芳香族残基)的突变gα12多肽,它们对应于在gαq的第67位的突变。本公开涵盖了包括在对应于人gαq蛋白的第67位残基和/或第75位残基的一个或多个位置处的突变的任意突变gα多肽。
在一种实施方式中,本发明涉及包括seqidno:1-17中所述序列的任一个的突变gα多肽,其中对应于人gαq蛋白的第67位残基和/或第75位残基的残基是突变的。在一种实施方式中,突变在对应于人gαq蛋白的第67位残基的位置。在一种实施方式中,突变在对应于第67位残基的位置,并且是对非芳香族残基的置换,在进一步的实施方式中,是对半胱氨酸的置换。在另一种实施方式中,突变在对应于人gαq蛋白的第75位残基的位置,并且是对非芳香族残基的置换,在进一步的实施方式中,所述非芳香族残基是甘氨酸。这样的突变gα多肽可以用于本文描述的任意生物传感器和/或方法。在一种非限制性实施方式中,突变的gαq蛋白包括以下置换中的一个:gαqg66k、gαqy67c和gαqf75g,它们导致产生非选择性gα蛋白。
在另一个方面,本发明涉及包括编码以上定义的突变gα多肽的序列的核酸。在另一个方面,本发明涉及包括以上定义的核酸的质粒或载体。在另一个方面,本发明涉及包括以上定义的核酸或载体的细胞(宿主细胞)。在另一个方面,本发明提供了包括编码本文定义的突变gα多肽的核酸的试剂盒。在一种实施方式中,已经用编码本文定义的突变gα多肽的核酸转染或转化细胞。本发明进一步提供了使用例如本领域熟知的培养基和试剂,表达本文定义的突变gα多肽的重组表达系统、载体和细胞,如上文所述的那些。细胞可以是能表达上文定义的突变gα多肽的任何细胞。用于蛋白表达的适当的宿主细胞和方法是本领域熟知的。可以使用能表达上文定义的突变gα多肽的任何细胞。例如,可以使用真核宿主细胞如哺乳动物细胞(例如啮齿动物细胞如小鼠、大鼠和仓鼠细胞系,人细胞/细胞系)。在另一种实施方式中,上文提及的细胞是人细胞系,例如胚肾细胞系(例如hek293或hek293t细胞)。
在多种实施方式中,本文描述的gβ蛋白选自任意的已知的gβ蛋白,所述gβ蛋白包括gβ1、gβ2、gβ3(例如gβ3的短变体gβ3sh)、gβ4和gβ5(gβ5-s或gβ5-l),这些同种型的剪接变体,以及它们的功能性变体。在进一步的实施方式中,gβ蛋白是gβ1。在另一种实施方式中,gβ蛋白是gβ3。在进一步的实施方式中,gβ蛋白(例如gβ1)在n端标记了bret受体,例如gfp。
在多种实施方式中,本文描述的gγ蛋白选自任意的已知的人gγ蛋白,所述gγ蛋白包括gγ1、gγ2、gγ3、gγ4、gγ5、gγ7、gγ8、gγ9、gγ10、gγ11、gγ12和gγ13,以及它们的功能性变体。在进一步的实施方式中,gγ蛋白是gγ5。在进一步的实施方式中,gγ蛋白(例如gγ5)在n端标记bret供体,例如荧光素酶。在另一种实施方式中,gγ蛋白(例如gγ5)在n端标记bret受体,例如gfp。在另一种实施方式中,gγ蛋白(例如gγ5)在n端标记pca相容性报告蛋白的第一域,例如荧光素酶(例如海肾荧光素酶)。
在一种实施方式中,本文描述的βγip是在gαβγ异三聚体解离时与gβγ二聚体相互作用,并且包括普列克底物蛋白同源(ph)域的蛋白质,如g蛋白偶联受体激酶(grk)蛋白(grk2或grk3)或其功能性片段,所述功能性片段包括grk蛋白的c端普列克底物蛋白同源(ph)域(即保持与gβγ二聚体相互作用的能力),一种含有g家族(具有rhogef域)成员2(plekhg2)的普列克底物蛋白同源域。图17a-c中描绘了grk2、grk3和plekhg2的氨基酸序列,其中用下划线表示ph域。在一种非限制性实施方式中,本文描述的grk蛋白质(grk2或grk3)或保持了与gβγ二聚体相互作用的能力的其片段(例如,所述片段包括grk的c端普列克底物蛋白同源(ph)域,如包括seqidno:50或51中所记载的序列的c端片段)在c端用bret受体(如荧光团)标记。在一种实施方式中,βγip是grk2或grk3或其变体/片段,并且其在c端与bret受体(例如gfp)融合。在另一种实施方式中,βγip是包括使g蛋白信号传导(rgs)域的调节因子失活的突变的grk蛋白变体(“rgs-死亡”变体)。在进一步的实施方式中,grk蛋白的“rgs-死亡”变体包括在对应于grk2的d110残基位置处的突变,例如d置换为a。天然人grk2(uniprotkb登录号p25098)和grk3(uniprotkb登录号p35626)的rgs域跨越约第54位至第175位残基。在另一种实施方式中,βγip是包括使其激酶域失活的突变的grk蛋白变体(“激酶-死亡”变体)。在进一步的实施方式中,grk蛋白的“激酶-死亡”变体包括在对应于grk2的k220残基位置处的突变(例如非保守性置换),例如k置换为d。grk2(uniprotkb登录号p25098)和grk3(uniprotkb登录号p35626)的激酶域跨越约第191位至第453位残基。在另一种实施方式中,βγip是包括在其c端域中的突变(例如在最后30个c端残基内)的grk蛋白变体。在进一步的实施方式中,突变是位于c端域内的丝氨酸残基,更特别地是在天然蛋白质中可以被磷酸化的丝氨酸。在进一步的实施方式中,突变(例如非保守性置换)在对应于grk2的s670残基、s676残基和/或s685残基的位置,例如s置换为a和/或s置换为d。
在多种实施方式中,本文描述的融合分子的域可以直接地(例如通过肽键)或通过适当的接头部分“间接地”共价连接,所述接头部分例如一个或多个氨基酸的接头或另一种类型的化学接头(例如糖类接头、脂质接头、脂肪酸接头、聚醚接头、peg等)。在一种实施方式中,在上文定义的域之前(n端)、之间或之后(c端)可以插入一个或多个额外的域。在一种实施方式中,融合分子的域通过肽键共价连接。在另一种实施方式中,融合分子的一个或多个组件通过肽接头连接。可以采用接头提供标记的化合物内的bret/fret标记发色团的期望构象,例如包括使bret/fret对的发色团之间分离。接头可以被连接于c端、n端或在中间位置。在一种实施方式中,接头是肽接头,典型长度为2至30个氨基酸,例如约5至约20~25个氨基酸。根据所希望的多种特性如柔性和水溶性,可以选择每个接头的组成和长度。例如,肽接头可以包括相对小的氨基酸残基(包括但不限于甘氨酸);小的氨基酸残基可以降低立体位阻和提高肽接头的柔性。肽接头还可以包括极性氨基酸(包括但不限于丝氨酸)。极性氨基酸残基可以提高肽接头的水溶性。此外,例如globplot2.3(linding等人,globplot:探索蛋白质序列的球状性和杂乱性(globplot:exploringproteinsequencesforglobularityanddisorder),nucleicacidres2003-vol.31,no.13,3701-8)的程序可以用于帮助确定杂乱(disorder)和球状(globularity)的程度,因此也能确定它们的柔性程度。在一种实施方式中,肽接头包括以下实施例中公开的一个或多个氨基酸序列。
在一种非限制性实施方式中,如图12a所图示的,本文描述的重组的基于βγip的构建体包括:用荧光团、荧光素酶或包括荧光蛋白或发光酶的一部分的其片段标记的βγip;接头,优选柔性多肽接头;和质膜(pm)锚定/靶向域或将βγip粘连于膜的信号。在一种实施方式中,柔性接头具有与以下随机氨基酸序列的长度对应的长度,约50至1000、900、800、700、600或500个氨基酸,例如约100至约500、400或300个氨基酸,优选为约200至400个、200至300个或约200个氨基酸的长度。在进一步的实施方式中,柔性接头包括约50个至约1000、900、800、700、600或500个氨基酸的随机氨基酸序列,例如约100至约500、400或300个氨基酸的长度,优选约200至400个、200至300个或约200个氨基酸的长度。用于设计柔性氨基酸接头,更特别地具有最小球状和最大杂乱的接头的方法是本领域已知的。这可以通过例如使用上文描述的globplot程序实现。可以进一步优化序列以消除推定的聚集热点(aggregationhotspots)、定位域(localizationdomains)和/或互作基序和磷酸化基序。在一种实施方式中,柔性接头位于bret供体或受体(例如rluc或gfp)与质膜靶向域之间。在进一步的实施方式中,构建体具有以下配置:βγip(例如grk2)-bret受体(例如gfp)-柔性接头-pm靶向域(例如caax域)。
在一种实施方式中,本公开涉及包括以下的系统:gpcr;选自以下的gα蛋白:gαq、gαs、gαi1、gαi2、gαi3、gαt-锥、gαt-棒、gαt-味、gαz、gαoa、gαob、gαolf、gα11、gα12、gα13、gα14和gα15/16,以及如本文描述的突变的非选择性gα蛋白;信号传导生物传感器,其包括:用荧光团、荧光素酶或包括荧光蛋白或发光酶的一部分的其片段标记的grk蛋白(grk2或grk3)或包括grk的c端普列克底物蛋白同源(ph)域的其片段,gβ蛋白和gγ蛋白,其中gβ蛋白或gγ蛋白用荧光团、荧光素酶或包括荧光蛋白或发光酶的一部分的其片段标记。
在一种实施方式中,本公开涉及包括以下的系统:gpcr;选自以下的gα蛋白:gαq、gαs、gαi1、gαi2、gαi3、gαt-锥、gαt-棒、gαt-味、gαz、gαoa、gαob、gαolf、gα11、gα12、gα13、gα14和gα15/16,以及突变的gα蛋白,所述突变的gα蛋白在对应于以下任意gαq的位置的位置具有突变:g66、y67和/或f75;信号传导生物传感器,其包括grk蛋白(grk2或grk3)或其片段,所述片段包括grk的c端普列克底物蛋白同源(ph)域,所述信号传导生物传感器用荧光团、荧光素酶或包括荧光蛋白或发光酶的一部分的其片段标记;gβ1蛋白和gγ5蛋白,其中gβ蛋白或gγ蛋白用荧光团、荧光素酶或包括荧光蛋白或发光酶的一部分的其片段标记。
根据另一个广泛的非限制性方面,本公开涉及用于表征配体的信号传导特征的系统,所述系统包括:g蛋白活性激活因子;gα蛋白;和本文描述的生物传感器或系统。
本公开还涉及包括编码如本公开定义的蛋白的核酸序列的系统,所述核酸序列可以是但不限于:dna分子、rna分子、病毒或质粒。在一种实施方式中,本公开还涉及包括编码一种或多种本文描述的生物传感器的蛋白组件(例如融合蛋白)的序列的核酸。在一种实施方式中,核酸包括编码以下的序列:(i)βγip,(ii)第一荧光团、生物发光蛋白或包括荧光蛋白或生物发光蛋白的一部分的其片段;(iii)gγ蛋白;(iv)第二荧光团、生物发光蛋白或包括荧光蛋白或生物发光蛋白的一部分的其片段;和(v)gβ蛋白。在进一步的实施方式中,核酸进一步包括编码位于生物传感器的组件之间的一个或多个接头的一个或多个序列。在进一步的实施方式中,核酸进一步包括一个或多个转录调节序列(例如启动子、增强子和/或其他调节序列)和/或一个或多个涉及翻译调节的序列(例如内部核糖体进入位点(ires)序列)。
在一种实施方式中,核酸存在于载体/质粒中,在进一步的实施方式中,核酸存在于表达载体/质粒中。这样的载体包括能编码本文描述的生物传感器的上文定义的组件(例如融合蛋白)的核酸序列,所述核酸序列可操作地连接于一个或多个转录调节序列。
术语“载体”是指能够运输已经与其连接的另一种核酸的核酸分子。一种优选的载体是游离体,即能在染色体外复制的核酸。优选的载体是能够自主复制和/或表达连接于其的核酸的载体。能够指导可操作地连接于其的基因表达的载体在本文中被称为“表达载体”。本发明的重组表达载体可以通过标准技术构建,所述标准技术是本领域技术人员已知的并且可以在例如sambrook等人.(1989)分子克隆:实验指南(molecularcloning:alaboratorymanual)中找到。各种策略对于dna片段的连接是可用的,对所述策略的选择取决于dna片段末端的特性并且可以被本领域技术人员容易地确定。本发明的载体也可以包括促进载体在细菌和宿主细胞中增殖和筛选的其他序列元件。此外,本发明的载体包括一个或多个限制性核酸内切酶位点的核苷酸序列。如用于选择性标记物和报告基因的编码序列是本领域技术人员熟知的。
可以将包括本发明的核酸序列的重组表达载体导入细胞(宿主细胞),所述细胞可以包括能够从定义的重组表达载体表达蛋白质编码区的活细胞。活细胞可以包括培养的细胞和活生物体内的细胞。因此,本发明也提供了包含本发明的重组表达载体的宿主细胞。术语“细胞”、“宿主细胞”和“重组宿主细胞”在本文中可交换地使用。这样的术语不仅是指特定的受试细胞(subjectcell),而且是指这样的细胞的后代或潜在后代。因为某些修饰可以由于突变或环境影响而在随后的各代中发生,所以这样的后代事实上可能与亲本细胞不一致,但是其仍然被包括在如本文使用的术语的范围内。
可以通过常规的转化或转染技术将载体dna导入细胞。术语“转化”和“转染”是指将外来核酸导入宿主细胞的技术,包括磷酸钙或氯化钙共沉淀、deae-葡聚糖介导的转染、脂质转染、电穿孔、显微注射和病毒介导的转染。在例如sambrook等人(分子克隆:实验指南(molecularcloning:alaboratorymanua)l,第二版,冷泉港实验室出版社(1989))和其他实验指南中可以找到用于转化或转染宿主细胞的适当的方法。“转录调节序列/元件”是指诱导或控制与其可操作地连接的蛋白编码序列转录的dna序列的通用术语,所述dna序列如起始信号和终止信号、增强子和启动子、剪接信号、多聚腺苷酸化信号。当第一核酸序列与第二核酸序列具有功能性关系设置时,第一核酸序列“可操作地连接于”第二核酸序列。例如,如果启动子影响编码序列的转录或表达,则启动子可操作地连接于编码序列。通常,可操作地连接的dna序列是连续的,并且在阅读框内在必要时连接两个蛋白编码区。然而,由于例如当增强子与启动子被几千个碱基和具有可变长度的内含子序列分隔时,增强子一般也是起作用的,所以某些多核苷酸元件可操作地连接但是不连续。
在一种实施方式中,如图11a所描绘的,核酸或载体编码本文描述的生物传感器的多于一个组件(融合蛋白)(例如多顺反子构建体)。在一种实施方式中,多顺反子构建体(例如dna、载体)包括,除了gβ蛋白以外还编码各自标记了适合的荧光团、荧光素酶或包括荧光蛋白或发光酶的一部分的其片段的βγip和gγ蛋白的核酸序列。通过共转染该多顺反子构建体与包括编码gα蛋白亚基和感兴趣的g蛋白激活因子的核酸序列的dna分子,可以再生本发明的系统。
在另一个方面,本发明提供了包括本文定义的核酸和/或载体的试剂盒。
在另一个方面,本公开还提供了包括或表达本文描述的任意生物传感器的任意蛋白质组件(例如融合蛋白、重组蛋白)的细胞(例如宿主细胞)。在一种实施方式中,已经用编码本文定义的突变gα多肽的核酸转染或转化细胞。本发明进一步提供了使用例如本领域熟知的培养基和试剂,表达本文定义的突变gα多肽的重组表达系统、载体和细胞,如上文所述的那些。细胞可以是能表达上文定义的突变gα多肽的任何细胞。用于蛋白表达的适当的宿主细胞和方法是本领域熟知的。可以使用能表达上文定义的突变gα多肽的任何细胞。例如,可以使用真核宿主细胞如哺乳动物细胞(例如啮齿动物细胞如小鼠、大鼠和仓鼠细胞系,人细胞/细胞系)。在另一种实施方式中,上文提及的细胞是人细胞系,例如胚肾细胞系(例如hek293或hek293t细胞)。在另一个方面,本公开还提供了包括或表达本文描述的任意生物传感器的任意蛋白质组件(例如融合蛋白、重组蛋白)的膜制备物,在进一步的实施方式中,本公开还提供了包括或表达膜锚定的融合蛋白的膜制备物。
本公开进一步涉及用于在第一条件和第二条件之间评估对gβγ互作蛋白(βγip)向gβγ亚基募集的调节的方法,所述方法包括:提供一种本文定义的生物传感器;在所述第一条件和第二条件下测量bret受体信号;其中所述第一条件和第二条件之间bret信号的差异表示在第一条件和第二条件之间gβγ互作蛋白(βγip)向gβγ亚基募集的调节。在一种实施方式中,第一条件是存在测试试剂,第二条件是缺少测试试剂,其中bret信号的差异表示测试试剂调节(增高或降低)gβγ互作蛋白(βγip)向gβγ亚基的募集。gβγ互作蛋白(βγip)向gβγ亚基的募集可以用做对gpcr和/或g蛋白激活的读数。
本公开进一步涉及用于检测包括本文描述的系统的g蛋白激活的方法,所述方法包括:1)使所述系统与激活g蛋白的化合物接触,以及2)通过测量生物传感器的信号来检测g蛋白的激活。该方法可以进一步包括以下步骤:3)从信号传导生物传感器的信号获得g蛋白功能性偶联信息,以及4)处理所述信息以确定g蛋白激活因子的g蛋白激活谱和化合物的信号传导特征(signature)。使用包括多种生物传感器的生物传感器系统(其中每种生物传感器包括不同的重组gα蛋白)确定任意gpcr和/或gpcr配体的g蛋白偶联谱是可能的,如图3a和3b中例示的。
术语“化合物”、“试剂”、“测定化合物”或“测试试剂”是指可以通过本发明的方法/生物传感器筛选的任何分子(例如候选药物),其可以从任意数目的来源中获得,所述来源包括合成化合物或天然化合物的库。例如,很多手段对于随机和定向合成多种有机化合物和生物分子是可用的,包括随机化寡核苷酸的表达。供选择地,细菌、真菌、植物和动物提取物形式的天然化合物的库是可用的或容易生产的。此外,通过常规的化学、物理和生物手段,容易修改天然或合成生产的库和化合物。
本公开进一步涉及用于确定测试试剂是否调节gpcr活性的方法,所述方法包括,在本文描述的生物传感器中的一种中,在存在和不存在所述测试试剂的情况下,测量由ret受体或报告蛋白发射的信号;其中在试剂存在的情况下测量到的较高信号表示所述测试试剂提高所述gpcr的活性,而在试剂存在的情况下测量到的较低信号表示所述试剂抑制所述gpcr的活性。在一种实施方式中,方法包括:
(1)提供包括(a)、(b)或(c)中定义的元件的生物传感器:
(a)(i)第一组件,其包括融合于(a)ret供体;(b)ret受体或(c)报告蛋白的第一片段的gβγ互作蛋白(βγip);(ii)第二组件,其包括融合的gβ蛋白或融合的gγ蛋白,其中所述gβ蛋白或所述gγ蛋白融合于(a)ret供体;(b)ret受体或(c)所述报告蛋白的第二片段;其中(a)如果所述βγip融合于所述ret供体,则所述gβ或gγ蛋白融合于所述ret受体;(b)如果所述βγip融合于所述ret受体,则所述gβ或gγ蛋白融合于所述ret供体;(c)如果所述βγip融合于所述报告蛋白的第一片段,则所述gβ或gγ融合于所述报告蛋白的第二片段;(iii)第三组件,其包括重组gα蛋白;和(iv)第四组件,其包括所述gpcr;
(b)(i)第一组件,其包括融合于(a)ret供体;(b)ret受体或(c)报告蛋白的第一片段的gβγ互作蛋白(βγip);(ii)第二组件,其包括在其c末端融合于(a)ret供体;(b)ret受体或(c)所述报告蛋白的第二片段的所述gpcr;(iii)第三组件,其包括重组gα蛋白;其中(a)如果所述βγip融合于所述ret供体,则所述gpcr融合于所述ret受体;(b)如果所述βγip融合于所述ret受体,则所述gpcr融合于所述ret供体;(c)如果所述βγip融合于所述报告蛋白的第一片段,则所述gpcr融合于所述报告蛋白的第二片段;或
(c)(i)第一组件,其包括融合于(a)ret供体;(b)ret受体或(c)报告蛋白的第一片段的gβγ互作蛋白(βγip);
(ii)第二组件,其包括融合的质膜(pm)靶向部分,其中所述pm靶向部分融合于(a)ret供体;(b)ret受体或(c)所述报告蛋白的第二片段;其中(a)如果所述βγip融合于所述ret供体,则所述pm靶向部分融合于所述ret受体;(b)如果所述βγip融合于所述ret受体,则所述pm靶向部分融合于所述ret供体;(c)如果所述βγip融合于所述报告蛋白的第一片段,则所述pm靶向部分融合于所述报告蛋白的第二片段;
(iii)第三组件,其包括重组gα蛋白;和
(iv)第四组件,其包括所述gpcr;以及
(2)在存在和不存在所述测试试剂的情况下,测量由所述ret受体或报告蛋白发射的信号;其中在试剂存在的情况下测量到的较高信号表示所述测试试剂提高所述gpcr的活性,而在试剂存在的情况下测量到的较低信号表示所述试剂抑制所述gpcr的活性。
在一种实施方式中,上文提及的方法进一步包括:
(3)在本文定义的生物传感器中,在存在和不存在测试试剂,以及存在gpcr激动剂的情况下,测量由ret受体或报告蛋白发射的信号,其中重组gα蛋白偶联于gpcr(即已知通过gpcr偶联或激活);以及
(4)确定所述测试试剂是否是所述gα蛋白的抑制剂;其中在测试试剂存在的情况下测量到的较低信号表示测试试剂是gα蛋白的抑制剂,在测试试剂存在的情况下测量到的相似或较高信号表示测试试剂不是gα蛋白的抑制剂。
在一种实施方式中,本文使用的术语“较高信号”或“较低信号”是指比在缺少测试试剂的情况下测量到的参比信号高(或低)至少10%、20%、30%、40%、45%或50%的信号。在另一种实施方式中,通过显示在存在测试试剂相对于不存在测试试剂的情况下测量到的信号的统计学上的显著性差异(使用适当的统计学分析确定),例如通过合并多个样本中获得的结果,确定“较高信号”或“较低的号”。确定不同组的数据之间的显著性差异的统计学分析(anova、学生t-检验、卡方检验等)是本领域已知的,这样的分析可以使用适当的计算机程序进行。
本公开进一步涉及鉴别由gpcr激动剂(激动剂的g蛋白分布/特征)激活的gα蛋白的方法,所述方法包括(i)在多个本文定义的生物传感器中,在存在和不存在所述gpcr激动剂的情况下,测量由ret受体或报告蛋白发射的信号,其中每个生物传感器包括不同的重组gα蛋白;(ii)鉴别由gpcr激动剂激活的gα蛋白;其中在gpcr激动剂存在的情况下,在包括重组gα蛋白的生物传感器中测量到的相对于不表达重组gα蛋白的对应生物传感器更高的信号增加,说明gα蛋白是由所述gpcr激动剂激活的,而其中在gpcr激动剂存在的情况下,在包括重组gα蛋白的生物传感器中测量到的与不表达重组gα蛋白的对应生物传感器相似或相对于不表达重组gα蛋白的对应生物传感器更低的信号增加或信号减少,说明gα蛋白不是由所述gpcr激动剂激活的。在一种实施方式中,该方法包括:(a)在本文定义的生物传感器系统的第一生物传感器和多个第二生物传感器中,在存在和不存在所述gpcr激动剂的情况下,测量由ret受体或报告蛋白发射的信号,和(b)鉴别由gpcr激动剂激活的gα蛋白;其中在gpcr激动剂存在的情况下,在所述第二生物传感器中测量到的相对于所述第一生物传感器更高的信号增加,说明gα蛋白是由所述gpcr激动剂激活的,而其中在gpcr激动剂存在的情况下,在所述第二生物传感器中测量到的与所述第一生物传感器相似或相对于所述第一生物传感器更低的信号增加或信号减少,说明gα蛋白不是由所述gpcr激动剂激活的。
阳性对照和阴性对照可以用于本文描述的方法/测定。对照和测试样本可以进行多次以获得统计学上显著的结果。
在一种实施方式中,上文提及的方法是高通量方法(高通量筛选,hts)。本文使用的术语“高通量筛选”(hts)是指允许快速地和在平行地筛选对靶分子具有结合活性或生物活性的大量化合物(数百、数千)的方法。这样的hts方法典型地在具有数个孔,例如384、1536、或3456个孔的微量滴定板上进行。对于hts重要的是以高敏感性、精确性和重现性检测读出信号。
测量bret信号的方法和设备是本领域熟知的。例如通过确定bret受体信号的强度(光强度),和/或通过计算bret供体发射的信号或光强度与bret受体发射的信号或光强度的比(bret比),可以测量bret信号。为了检测bret供体和/或bret受体光发射,可以使用酶标仪或装有适当的滤光套件的显微镜测量bret信号。
应该理解的是,本文描述的特征或实施方式的组合/子组合可以存在或用于本文描述的生物传感器、系统和/或方法中。
在一种实施方式中,本文描述的生物传感器、系统和/或方法包括以下实施例和所附的附图中描述的构建体/融合蛋白和/或重组蛋白中的一个或多个,例如rluc-gγ1至rluc-gγ13、grk-gfp、grk-rlucf1、rlucf2-gγ5、grk2-gfp-mem、rluc-grk2、gfp-gγ5、gfp-caax或gpcr-rluc。
实施本发明的方式
通过以下非限制性实施例更详细地说明本发明
实施例1:材料与方法
试剂:血管紧张素ii(angii;[asp-arg-val-tyr-ile-his-pro-phe],seqidno:49)、聚鸟氨酸、聚d-赖氨酸、异丙肾上腺素、罗替戈汀、肾上腺素、去甲肾上腺素、苯基肾上腺素和百日咳毒素来自
表达载体:受体和g蛋白。编码at1r的质粒由stéphanelaporte(麦吉尔大学,蒙特利尔,加拿大)馈赠。gαq、gα11、gα12、gα13、gα14、gα15/16、gαoa、gαob、gαz、gαs、gαi1、gαi2、gαi3、gβ1、tpαr、d2r和α1bar获得自cdna资源中心(cdna.org)。通过使用表i中描述的引物使gαq野生型蛋白质编码序列发生定点诱变(pcr重叠),获得编码包括gαqg66k、gαqy67c和gαqf75g的突变gα蛋白的质粒。用acc65i+xhoi限制酶消化pcr片段,以及将所述pcr片段克隆至acc65i+xhoi消化的pcdna3.1zeo(+)(来自
表i:用于本文描述的实验中的引物序列
表达载体:生物传感器构建体。rluc-gγ5和gfp-gγ:编码融合蛋白rluc-gγ1至rluc-gγ13和gfp10-gγ5的质粒通过pcr扩增gγ编码序列获得,然后所述gγ编码序列在其n端框内融合于pcdna3.1载体中(接头序列:gsagt,seqidno:33)的人源化海肾荧光素酶ii(hrlucii)序列(之前报道的hrluc的变体(leduc,breton等人2009),seqidno:39),或在其n端框内融合于gfp10(之前报道的绿色荧光蛋白(gfp)的变体形式(mercier,salahpour等人2002,seqidno:38)。grk2-gfp和grk3-gfp:通过pcr扩增grk2和grk3,然后所述grk2和grk3在其c端融合于gfp10,进入pcdna3.1zeo(+)载体,在grk和gfp10蛋白之间产生11个氨基酸残基的接头(接头序列:gsagtgklpat,seqidno:34),来产生grk2-gfp、grk3-gfp、grk2c端(seqidno:50)-gfp、grk3c端(seqidno:51)-gfp。gfp-grk2和gfp-grk3:通过pcr扩增grk2和grk3,然后grk2和grk3在其n端融合于pcdna3.1zeo(+)载体中的gfp10(seqidno:38),在grk和gfp10蛋白之间产生7个氨基酸残基的接头(接头序列:gsagtgg,seqidno:52),来产生grk2-gfp、gfp-grk2c端(seqidno:50)、gfp-grk3c端(seqidno:51)。使用相似的步骤,通过pcr定向的诱变产生gfp-和rlucii-标记的grk2突变体。grk2-rlucf1和rlucf2-gγ5:通过pcr扩增seqidno:39(rlucf1)中记载的人源化海肾荧光素酶ii序列的第1-110位残基的编码序列,随后该编码序列融合于pcdna3.1zeo(+)载体中的grk2蛋白的c端,在rluc片段和grk2之间产生18个氨基酸的接头(接头序列:gsagwgklgsagsgsags,seqidno:35),来获得grk2-rlucf1。通过pcr扩增seqidno:39(rlucf2)中记载的人源化海肾荧光素酶序列的第111-311位残基的编码序列,随后所述编码序列框内融合于pcdna3.1zeo(+)载体中的gγ5蛋白的n端,在rluc片段和gγ5之间产生11个氨基酸的接头(接头序列:gsagtgsagtt,seqidno:36),来获得rlucf2-gγ5。grk2-gfp-mem:编码grk2-gfp与后接人kras蛋白的膜锚定信号(异戊烯化基序:caxx)(hancock2003)的200个氨基酸残基的柔性接头之间的融合序列的grk2-gfp-mem构建体如下产生:首先,由2000个残基的随机序列产生具有预测的杂乱结构的接头。在消除聚集热点、推定的定位、互作和磷酸化基序之后,从该序列中选择具有最小球状和最大杂乱指数的200个残基的片段。直接合成该200个氨基酸的柔性接头(seqidno:53),然后使用pcr扩增将该200个氨基酸的柔性接头框内融合于人kras蛋白剪接变体b的膜锚定信号(氨基酸序列:kkkkkksktkcvim,seqidno:37)的n端。然后将后接kras异戊烯化信号的柔性接头在grk2-gfp蛋白的c端亚克隆至grk2-gfppcdna3.1zeo(+)载体。多顺反子生物传感器载体:首先通过将wt和d110a突变的grk2-gfp10融合蛋白亚克隆至plvx载体,产生编码grk2-gfp、rluc-gγ5和gβ1的多顺反子载体。然后将ires-gβ1亚克隆至pcdna3.1rluc-gγ5,获得pcdna3.1rluc-gγ5-ires-gβ1。最后组装两种构建体,产生含有grk2-gfp-ires-rluc-gγ5-ires-gβ1的plvx载体。rgfp-caax:通过用编码接头的反向引物(序列:gsagtmasnntasg,seqidno:47)pcr扩增rgfp编码序列(seqidno:46),以及通过pcr扩增来自kras剪接变体b(-gkkkkkksktkcvim,命名:caax,seqidno:37)的质膜靶向多碱序列和异戊烯化信号序列获得编码融合蛋白rgfp-caax的质粒。caax质膜靶向序列框内融合于rgfp编码序列的c端。将pcr片段亚克隆至pcdna3.1(+)载体。rlucii-grk2:pcr扩增grk2cdna,并且用接头ggsgsgsgs(seqidno:48)与rlucii亚克隆至pireshyg3表达载体(来自
细胞培养和转染:在37℃下,在具有5%co2的加湿气氛中将人胚肾293(hek293)细胞保持在补充了10%胎牛血清、100个单位/ml青霉素/链霉素的杜氏改良伊戈尔培养基(dmem)中。实验前的两天,使用聚乙烯亚胺25-kda线性型(pei)作为转染剂(以pei/dna为3比1的比例)用指定的质粒转染hek293细胞(hamdan,rochdi等人.2007),然后将所述细胞以每孔35,000个细胞的密度直接接种于用聚-l-鸟氨酸氢溴酸盐或聚-d-赖氨酸预处理的96孔板中(用于对活细胞的bret和pca测定),或以每孔1,000,000个细胞的密度接种于6孔板中(用于在膜制备物上的bret测定)。
对活细胞的bret测定:用磷酸缓冲盐水(pbs)洗涤接种于96孔板中的细胞两次,然后添加台氏缓冲液(tyrodebuffer)(组成:137mmnacl、0.9mmkcl、1mmmgcl2、11.9mmnahco3、3.6mmnah2po4、25mmhepes、5.5mm葡萄糖和1mmcacl2,ph7.4)。然后用不同配体或载体处理细胞指定的次数。以2.5μm的终浓度添加rluc底物、腔肠素400a,进一步温育细胞另外的5分钟。然后使用mithrastmlb940多模式酶标仪或
对grk2-gfp向rlucii标记的受体转移的bret测定(图15b和图15c):将pei∶dna的比为3∶1的100ngha-tpαr-rlucii、750nggrk2-gfp10(图15b中的wt或图15c中的d110a突变体)、100ng指定的gα、100ngwtgβ1和100ngwtgγ5与pei添加至hek293sl悬液(350,000个细胞/ml)中。将细胞接种于聚-d-赖氨酸预处理的板上(96孔板的每个孔100μl细胞/pei/dna悬液)。转染后48小时,用台氏液+1mmcacl2洗涤细胞和在37℃下预温育细胞60分钟。在37℃下使细胞暴露于在图15b和图15c中的不同剂量的u-46619中总计15分钟。然后在刺激的最后5分钟内以2.5μm的终浓度添加腔肠素400a。在37℃下使用
对rlucii-grk2向rgfp-caax(kras)标记的质膜转移的bret测定(图16b和图16c):将pei∶dna的比为3∶1的100ngha-tpαr、20ngrlucii-grk2、100ng指定的gα、100ngwtgβ1、100ngwtgγ5、400ngrgfp-caax(kras)、180ngssdna与pei添加至hek293sl悬液(350,000个细胞/ml)。将细胞接种于聚-d-赖氨酸预处理的板上(96孔板的每个孔100μl细胞/pei/dna悬液)。转染后48小时,用台氏液+1mmcacl2洗涤细胞和在37℃下预温育细胞60分钟。在37℃下使细胞暴露于图16b中的不同剂量的u-46619中总计15分钟,或在37℃下将载体或100nmu46619添加至一半的96孔板的孔中用于z’因子测定(图16c)。然后在刺激的最后5分钟内以2.5μm的终浓度添加腔肠素400a。在37℃下使用
g蛋白抑制剂:如之前描述的进行bret测定,除了细胞在37℃下用100ng/ml百日咳毒素预处理过夜,或在37℃下用100nmubo-qic预处理20分钟。
动力学实验:如之前描述的进行bret测定,除了在添加腔肠素后5分钟,每隔一定时间收集bret读数,同时在测量bret的30秒后将配体和载体注射至细胞。
z’因子测定:用指定的构建体如描述地转染hek293细胞(见图7a、图7b、图9a、图10c、图11d和图16c的说明)。用指定的激动剂处理的一半的96孔板和相应载体处理的另一半的板,如之前描述地进行bret测定。如zhang等人.(zhang,chung等人.1999)所描述计算z’因子。0.4至1的z’因子被认为是稳健的测定。
使用rlucii片段的蛋白互补测定:用pbs洗涤细胞两次,然后添加台氏缓冲液。然后在37℃下用终浓度为2.5μm的rluc底物、腔肠素400a预处理细胞30分钟。添加不同配体或载体进行另外的10分钟。然后使用没有任何滤光器的mithrastmlb940多模式酶标仪收集发光值。
对膜制备物进行bret测定:收集接种于6孔板中的细胞,并且在裂解缓冲液(组成:25mmtris-hclph7.4、2mmedta、5mmmgcl2、27%蔗糖、15μmgdp、2μmgtp、10μg/ml苯甲脒、5μg/ml大豆胰蛋白酶抑制剂和5μg/ml亮抑酶肽)中重悬,使其经历宝创(polytron)均化处理。离心步骤后,将膜沉淀物重悬于补充了5mmmgcl2、15μmgdp和15μmgtp的台氏缓冲液中。使用每孔400μg的膜,如之前描述进行bret实验。
bret滴定(图2b和图2c):使用等于1μg∶3μl的μgdna与μlpei1mg/ml比的pei瞬时转染hek293细胞。dna转染的96孔板中的每个孔如下:图2a和图2b中:40ng的编码ha-tpαr或ha-β1ar的构建体、0.5ng的编码rlucii-gγ5的构建体、10ng的编码gα11或gα15的构建体、10ng的编码gβ1的构建体和增加量的高达75ng的用gfp10标记的grk2构建体。转染后2天进行bret测定;用pbs洗涤细胞一次,并且将细胞置于台氏缓冲液中。在室温下用载体或激动剂药物100nmu-46619(图2b)或1μm异丙肾上腺素(图2a)处理细胞总计15分钟。然后以2.5μm的终浓度在刺激的最后5分钟内添加rluc底物coel-400a。然后使用
实施例2:结果
为了研究gpcr对特定的g蛋白的激活,基于gα和βγip之间竞争结合gβγ亚基发展了一种测定。如图1a和图1b中描绘的,在受体激活不存在的情况下,gα亚基紧密结合于gβγ二聚体,阻止gβγ二聚体与βγip结合。在受体刺激后,结合gtp的gα与gβγ复合体解离,然后所述gβγ复合体游离以与βγip相互作用。因此,βγip和gβγ之间的相互作用反映了g蛋白的激活。通过共表达各自用检测系统的两个组件之一标记的βγip和gβγ与不同亚型未标记的gα,在给定受体激活后,确定该给定受体的偶联谱是可能的。如以下所示,可以用不同的检测方法来评估βγip和gβγ之间的相互作用,如共振能量转移(ret)方法(图1a:生物发光共振能量转移(bret)或荧光共振能量转移(fret));或图1b:蛋白质互补(pc)测定。
以ret作为检测方法的例子,图1c中显示了基于βγip的g蛋白激活生物传感器的可能的方案和对应的结果分析。在缺少与两个ret配偶体βγip-a和gβγ-d共转染的任意gα亚基的情况下,基础ret信号是相当高的,这是由于βγip和gβγ之间的组成型相互作用。在这种情况下,在受体刺激后测量到的ret信号的调节会反映内源gα亚基的激活(模拟或-gα条件)。gα亚基的共表达阻止了βγip-a和gβγ-d之间的基础相互作用,导致记录的基础ret响应值降低(+gα1和+gα2条件下的白色柱)。当刺激受体时(例如用适当的gpcr配体),只有受体结合(例如偶联于)与其他生物传感器组件共表达的特定gα亚基,才能观察到与模拟条件相比ret信号调节的显著提高(黑色柱,+gα2条件)。然而,如果过表达的gα亚基不在功能上偶联于受体,则受体受刺激时不能检测到bret信号的显著改变(黑色柱,+gα1条件)。
图2a至图2c呈现了测试对基于βγip的g蛋白激活生物传感器的优化的某些不同构建体。测试了grk2和grk3的四种不同的标记gfp的构建体,两种基于完整的grk编码系列,两种基于c端ph域/gβ结合域,其中gfp位于grk的n端部分或c端部分(图2a)。呈现于图2b和图2c中的结果表明,所有grk2配置/构建体给出了可检测的bret响应(因此可以用于生物传感器),根据bret信号的幅度和在宽范围的供体与受体的比中的稳定性,在c端标记了bret受体(例如gfp)的全长grk2提供了最佳的动态窗口。使用gfp标记的grk3构建体获得了相似的结果。
为了评估使用βγip监测g蛋白激活的可行性,选择与游离gβγ二聚体特异地相互作用的grk2蛋白作为代表性的βγip,以及在所述grk2蛋白的c端标记能量受体gfp10(gfp),由此允许使用bret作为其与gβγ的相互作用的读数。grk2-gfp融合蛋白与在n端标记了能量受体海肾荧光素酶(rluc)的gγ5亚基以及与未标记的gβ1和gα亚基共表达。除了生物传感器组件(grk2-gfp和rluc-gγ5)、gβ1和各种gα之外,还用选择为原型gpcr的例子的血栓素a2受体(tpαr)共转染细胞。在图3a中描述的实验中,通过刺激共表达不同gα蛋白(gαq、gα11、gα12、gα13、gα14、gα15、gαoa、gαob、gαz、gαs、gαi1、gαi2和gαi3)与tpαr激动剂u-46619(一种稳定的合成的内过氧化物前列腺素pgh2类似物)的细胞,确定tpαr的g蛋白偶联谱,以及与gα过表达不存在的情况下获得的结果(模拟条件,左柱)比较。在不存在gα共转染时,记录的bret信号相对较高,并且在用u-46619刺激时仅被稍微地调节,这反映了内源gα蛋白的激活。在共表达特定的gα蛋白时,过表达gαq、gα11、gα12、gα13、gα14和gα15/16的细胞的bret信号的激动剂诱导的调节显著高于模拟条件或过表达gαi家族的gα亚基的细胞,这表明tpαr偶联于gαq和gα12家族的g蛋白激活,而不偶联于gαi家族的g蛋白激活(图3b)。
除了野生型(天然)gα蛋白之外,三种gαq突变体(gαqg66k、gαqy67c和gαqf75g)也用于用tpαr测试的g蛋白组。之前已经描述了用带电残基(例如gqg66k)置换gαq蛋白的第66位的甘氨酸残基,导致了gαq蛋白突变体具有混杂偶联特性,这是由于它们也能被非gαq偶联的受体激活(heydorn,ward等人,2004)。正如图3a和图3b中可见的,tpαr激活了之前描述的gαqg66k突变体以及本文描述的新的gαqy67c和gαqf75g。这些混杂gα蛋白(或具有在这些位置上的等价突变的任意gα蛋白,见图14)可以用作基于βγ的生物传感器测定中gpcr激活的阳性对照,以及对在偶联偏好性上仅有限信息可用的受体(如孤儿受体)是尤其有用的。然后选择gαq、gα13、gα14、gα15/16、gαqg66k和gαqy67c,用于u-46619的剂量响应曲线(图3c)。有趣地,测量到g13的0.5nm至gα15/16的6.6nm的效能范围,验证了基于βγip的生物传感器测定可以检测激活的特定效能,所述激活与给定的受体配体对所结合的每种g蛋白相关联。
为了进一步说明基于βγip的g蛋白激活生物传感器可以用于揭示g蛋白激活对不同gpcr的特异性,多巴胺d2受体(d2r)和α1b-肾上腺素能受体(α1bar)各自与grk2-gfp、rluc-gγ5、gβ1和各种gα共表达,并且被它们的原型激动剂刺激(d2r的原型激动剂为罗替戈汀,α1bar的的原型激动剂为苯基肾上腺素)。如图4a和图4c中所示,每个受体显示特异的g蛋白激活谱,其与用tpαr(图3a和图3b)所观察到的不同;d2r单独地偶联于gαi家族成员(gαoa、gαob、gαz、gαi1、gαi2和gαi3),同时α1bar排他地偶联于gαq家族成员(gαq、gα11和gα15/16)。混杂的gαq突变体gαqy67c由两种受体激活(图4a和图4c)。用d2r激活的某些g蛋白(gαi1和gαqy67c)和α1bar激活的某些g蛋白(gαq和gα11)获得剂量响应曲线。在图4e中,由表达α2car、gαz、grk2-gfp、rluc-gγ5以及gβ1的hek293细胞,获得了对于不同的肾上腺素能激动剂(肾上腺素、去甲肾上腺素、苯基肾上腺素和异丙肾上腺素)gαz激活的剂量响应曲线。这些结果证明了,基于βγip的g蛋白激活生物传感器可以用于建立g蛋白偏好和gpcr的激活/药理学谱,以及解决给定的配体的效能和功效的药理学工具,所述配体用于通过它们的同源受体激活各种g蛋白。如图4f至图4j所示,用不同的gβ和gγ亚基的组合获得了不同的g蛋白激活谱。结果显示,gβ和gγ两种亚基的组合可以导致不同的g蛋白激活的药理学谱。这些差异可以,至少部分地与使用不同的细胞和组织观察到的不同的药理学谱相关,所述不同的细胞和组织不仅表达特定的gα亚基集合,还表达gβ亚基和gγ亚基的不同的组合和水平。
g蛋白活性的抑制剂,如分别选择性阻断gαi和gαq激活的百日咳毒素(ptx)和ubo-qic(结构上与环酯肽ym-254890香港)已经广泛地用于gpcr领域中,用于表征受体的偶联特性(takasaki,saito等人.2004)。使用基于βγip的g蛋白激活生物传感器,用那些选择性g蛋白抑制剂进行实验,以说明获得的bret信号的特异性。对于偶联于gαq激活的tpαr,在激动剂刺激后使用基于βγip的bret生物传感器测量到的bret响应在ubo-qic预处理时被完全去除,而ptx预处理对该响应没有作用(图5a)。相反地,对于gαi偶联受体d2r,ptx预处理显著减少了激动剂温育后检测的生物传感器bret响应,而gq抑制剂ubo-qic的预处理对记录的bret信号不具有可检测到的作用。tpαr介导的g蛋白激活也用于验证ubo-qic抑制剂的选择性。图5c中呈现的结果显示,gαq家族(gαq、gα11、gα14和gα15/16)中,仅gα15/16对ubo-qic不敏感。gα12和gα13蛋白对ubo-qic也不敏感。最后,基于βγip的生物传感器用于揭示突变的gαq(在第67或75位-见图14)的激活的ubo-qic敏感性。在第67位上酪氨酸残基的置换(y67c、y67g、y67s和y67l)导致对ubo-qic的抗性和混杂特性,这说明该残基对控制g蛋白激活是重要的,phe75残基置换为甘氨酸(与混杂表型相关-见图4a)导致了部分的ubo-qic介导的激活抑制(图5d)。因此,除了验证了记录的bret信号对各种g蛋白的特异性,这些结果支持使用本文描述的基于βγip的g蛋白激活生物传感器作为鉴别/开发新的g蛋白选择性抑制剂的工具。
为了进一步表征基于βγip的g蛋白激活生物传感器,分别在d2r和tpαr激动剂处理后,确定了gαi1(图6a)和gα11(图6b)激活的动力学。如图6a和图6b中所示,对两种不同的受体和g蛋白获得相似的激活动力学,其中,添加配体后约30秒达到最大响应,在初始刺激后的平稳期持续至少30分钟。该持续的响应尤其适合于高通量筛选(hts)的测定适应性。
为了评价测定的稳健性,通过典型的gαi偶联受体(d2r,图7a)和gαq偶联受体(tpαr,图7b)确定g蛋白激活的z’因子。d2r/gαi1和tpαr/gα11的z’因子分别为0.79和0.89,测定是尤其稳健的。该测定的稳健性与筛选应用,尤其是hts应用的要求向匹配。
除了之前描述的基于βγ的生物传感器在受体的g蛋白质分析和hts中的潜在应用,配体表征呈现了g蛋白激活生物传感器的另一应用。当gpcr被不同配体激活时,其可以优先参与不同的g蛋白和信号传导通路,该现象被称为gpcr的配体偏好的信号传导(galandrin,oligny-longpre等人,2007)((kenakin和christopoulos2013)。本文描述的生物传感器尤其适合于进行配体分析实验,这是由于使用相同的ret配偶体评价所有g蛋白亚型的活性是可能的。作为代表性的例子,使用基于βγip的g蛋白激活生物传感器对血管紧张素ii1型受体(at1r)进行分析(图8a至图8c)。使用其天然配体血管紧张素ii进行第一组实验以确定受体的偶联特性。如图8a所示,at1r偶联于蛋白的gαq、gα11和gαi家族的几个成员。在用不同的血管紧张素ii类似物激活at1r后,选择gαq、gα11和gα12用于进一步的表征。如图8b和图8c中所示,那些血管紧张素ii衍生的肽在不同程度上刺激了不同的g蛋白,这揭示了某些配体对特定的g蛋白的潜在偏好。例如,相对于血管紧张素ii响应,dvg肽显示了对gα12的激活比gαq更好的效果(图8c)。
接下来评估的是取代基于ret的测定的蛋白互补测定(pca)是否可以用于评估βγip和gβγ亚基之间的相互作用(图1b)。pca,如生物分子荧光互补(bifc)或酶片段互补(efc)允许检测两个蛋白配偶体之间的相互作用,使pca与基于βγip的g蛋白激活生物传感器相容。为了确定是否可能在基于βγip的g蛋白激活生物传感器中使用基于efc的测定,更特别地使用基于rluc的efc测定,产生了两种融合蛋白:在c端用rluc的n端部分标记的grk2(grk2-rlucf1),以及在gγ5的n端用rluc的互补c端部分标记的grk2(rlucf2-gγ5)。如果grk2和游离gβγ亚基之间的相互作用发生(g蛋白激活之后),两个互补rluc片段会重结合,在rluc底物腔肠素的存在下可以测量发光。使用共表达tpαr与grk2-r1ucf1、rlucf2-gγ5、gβ1和gα11的细胞完成对构思的证明。在用u-46619刺激后,测量稳健的发光信号,这揭示了g11蛋白的激活,其中z’因子为0.53(图9a),ec50为8.4nm(图9b),验证了pca可以用于本文描述的基于βγip的g蛋白激活生物传感器。
接下来评价的是除了grk2以外的βγip(如grk3)是否可以用于在基于βγip的g蛋白激活生物传感器中监测g蛋白激活。在grk3和能量受体gfp之间产生融合蛋白,共表达所产生的grk3-gfp与rluc-gγ5、gβ1、gαi1和d2r,以获得对多巴胺的剂量响应曲线。如图10a中所示,使用基于grk2或grk3的生物传感器,观察到相似的效能(grk2为96pm,grk3为56pm)。基于grk3的生物传感器的激活的动力学也与使用基于grk2的生物传感器所获得的相似(图6a和图6b),其中在大约30秒时达到最大响应,稳定期为至少几分钟(图10b)。最后,还用基于grk3的生物传感器产生了z’因子。使用d2r和gαi1,用grk3生物传感器获得的z’因子为0.71,这证实了测定的稳健性(图10c)。总结起来,这些数据证明了不同的βγip可以用于基于βγip的g蛋白激活生物传感器以评价g蛋白激活。
为了简化基于βγip的g蛋白激活生物传感器的使用,发展了编码grk2-gfp、rluc-gγ5和gβ1的多顺反子载体(图11a)。这确保了生物传感器的组件由一个构建体并且以固定的比表达,这可以使实验内变化性最小化。如图11d中所示,使用与编码tpαr和gα11的质粒共转染的多顺反子构建体获得的z’因子为0.8。该结果与用编码单独的生物传感器组件的质粒转染的细胞获得的z’因子相当(图7b,z’=0.89)。还使用该多顺反子载体进行了剂量响应曲线实验,对于用u-46619刺激的tpαr,获得的ec50值为4.3nm,相似于与基于rluc-pca的grk2生物传感器使用的相同受体/配体对测量到的8.4nm的ec50(图9b)。这些结果证实了在多顺反子载体中表达生物传感器的不同组件的有效性,这可以有利地用于建立仅具有一个选择标记的稳定细胞系,由此简化了实验步骤和潜在地改善了再现性(例如使实验内变化性最小化)。
发展了基于βγip的g蛋白激活生物传感器的另一种变体,其中grk2蛋白粘连于质膜(pm)(图12a)。该构建体可以用于某些特定的应用,其中在膜制备物上进行体外实验对于整个细胞实验是优选的,如用于筛选应用。为了验证该方法,bret实验在膜制备物上进行,所述膜制备物表达tpαr、gα11gβ1、rluc-gγ5,以及之前使用的胞浆形式的grk2-gfp(图12b中的grk2wt)或质膜锚定的grk2-gfp(grk2-mem)。相对于wtgrk2(图12b)在配体刺激时仅检测到低的bret增长,用粘连于膜的grk2观察到bret信号的优选调节。这些结果验证了在膜制备物上使用pm锚定的βγip测量g蛋白激活。
图13a至图13c中描绘的结果显示了报道的影响grk2功能的突变(如rgs域中的d110a置换(rgs-死亡突变体)和催化域中的k220r置换(催化-死亡突变体)),或其通过磷酸化的调节(如s670a、s676a和s685a置换或s670d、s676d和s685d置换),所述突变分别阻止和模拟由erk、pka和cdk2-细胞周期素a对grk2的c端结合域的磷酸化,不阻止也不显著促进其募集至激活的蛋白,如使用基于βγip的g蛋白激活生物传感器所评估的。包括上文提及的突变的grk2变体以与天然grk相似的程度被募集(图13a至图13c),由此提供了以下证据:grk向gβγ的募集可以是对不同信号传导事件的调节不敏感的。用血管紧张素ii激活at1r后,用grk2d110a变体获得了相似的结果。
开发了测量gα亚基和βγip之间竞争结合于gβγ亚基的另一种生物传感器;图15a显示了这样的生物传感器的配置和原理。生物传感器包括标记了ret供体或受体(图示了ret受体(a))的βγip(grk)和在c端标记了ret供体或受体(图示了ret供体(d))的gpcr。当处于无活性形式时,异源三聚体g蛋白的gα亚基紧密地结合于gβγ二聚体。当配体(l)结合于gpcr时,gα与gβγ亚基解离,允许βγip被募集至游离的gβγ亚基,以及使ret受体紧密接近于连接于gpcr的ret供体,由此诱导/提高bret信号。图15b和图15c显示了用根据图15a的生物传感器获得的g蛋白激活的剂量响应曲线,所述生物传感器包括野生型grk2(图15a)或rgs-死亡grk2突变体(d110a)(图15b)。剂量响应曲线显示了图15b和图15c中相似的谱,表明对于将βγip募集至激活的g蛋白,不需要功能性rgs,证实了使用不同的生物传感器配置的图11b和图13a中呈现的结果。
开发了测量gα亚基和βγip之间竞争结合于gβγ亚基的生物传感器;图16a显示了这样的生物传感器的配置和原理。生物传感器包括标记了ret供体或受体(图示了ret供体(d))的βγip(例如grk)和标记了ret供体或受体(图示了ret受体(a))的质膜(pm)靶向域。当处于无活性形式时,异源三聚体g蛋白的gα亚基紧密地结合于gβγ二聚体。当配体(l)结合于gpcr时,gα与gβγ亚基解离,允许βγip被募集至位于pm的游离gβγ亚基,以及使ret供体d紧密接近于锚定在pm上的ret受体a,由此诱导/提高bret信号。图16b显示了用增加剂量的u46619刺激的共表达tpαr、不同的gα(gαq=实心正方形,gα11=实心三角形,模拟条件(无gα)=空心圆圈)、gβ1、gγ5、rlucii-grk2和rgfp-caax的hek293细胞,并使用根据图16a中的生物传感器获得的g蛋白激活的剂量响应曲线。图16b中的剂量响应曲线与采用具有不同配置的生物传感器(图3c、图9b和图11c)获得的剂量响应曲线相似,提供了以下证据:在pm上测量βγip募集的生物传感器适合于“间接”评估βγip向锚定于pm上的游离gβγ亚基的募集。
虽然在上文中已经通过具体实施方式描述了本发明,但是可以在不背离所附的权利要求中限定的本发明的精神和性质的情况下修改本发明。在权利要求中,词语“包括(comprising)”用作开放性术语,基本上等价于短语“包括但不限于”。除非上下文另有明确规定,单数形式“一个/一种(a)”、“一个/一种(an)”和“所述/该(the)”包括相应的复数引用。
参考文献
1.boularan,c.和j.h.kehrl(2014).″免疫系统的非经典g蛋白信号传导的启示(implicationsofnon-canonicalg-proteinsignalingfortheimmunesystem).″细胞信号(cellsignal)26(6):1269-1282.
2.galandrin,s.,g.oligny-longpre和m.bouvier(2007).″药效的逃避性质:药物发现的启示(theevasivenatureofdrugefficacy:implicationsfordrugdiscovery.)″药理学趋势(trendsinpharmacologicalsciences)28(8):423-430.
3.garland,s.l.(2013).″gpcr仍是新靶点的来源吗?(aregpcrsstillasourceofnewtargets?)″jbiomolscreen18(9):947-966.
4.gilman,a.g.(1987).″g蛋白:受体产生的信号的转导器(g-proteins:transducersofreceptor-generatedsignals).″annurevbiochem56:615-649.
5.hamdan,f.f.,m.d.rochdi,b.breton,d.fessart,d.e.michaud,p.g.charest,s.a.laporte和m.bouvier(2007).″使用实时监测激动剂促进的β抑制蛋白和ap-2之间的相互作用阐明g蛋白偶联受体内吞途径(unravelinggprotein-coupledreceptorendocytosispathwaysusingreal-timemonitoringofagonist-promotedinteractionbetweenbeta-arrestinsandap-2.)″jbiolchem282(40):29089-29100.
6.hancock,j.f.(2003).″ras蛋白:来自不同位置的不同信号(rasproteins:differentsignalsfromdifferentlocations.)″natrevmolcellbiol4(5):373-384.
7.heydorn,a.,r.j.ward,r.jorgensen,m.m.rosenkilde,t.m.frimurer,g.milligan和e.kostenis(2004).″对受体-g蛋白相互作用特异性重要的g蛋白α亚基内的新位点的鉴定(identificationofanovelsitewithingproteinalphasubunitsimportantforspecificityofreceptor-gproteininteraction.)″molpharmacol66(2):250-259.
8.kenakin,t.和a.christopoulos(2013).″新药发现中的信号传导偏好:检测、定量和治疗影响(signallingbiasinnewdrugdiscovery:detection,quantificationandtherapeuticimpact.)″natrevdrugdiscov12(3):205-216.
9.leduc,m.,b.breton,c.gales,c.legouill,m.bouvier,s.chemtob和n.heveker(2009).″天然和合成前列腺素ep4受体配体的功能选择性(functionalselectivityofnaturalandsyntheticprostaglandinep4receptorligands.)″jpharmacolexpther331(1):297-307.
10.mercier,j.f.,a.salahpour,s.angers,a.breit和m.bouvier(2002).″通过生物发光能量共振转移定量评价β1和β2肾上腺素能受体同二聚化和异二聚化(quantitativeassessmentofthebeta1andbeta2-adrenergicreceptorhomoandhetero-dimerizationbybioluminescenceresonanceenergytransfer.)″jbiolchem277:44925-44931.
11.pitcher,j.a.,j.inglese,j.b.higgins,j.l.arriza,p.j.casey,c.kim,j.l.benovic,m.m.kwatra,m.g.caron和r.j.lefkowitz(1992).″g蛋白βγ亚基在使β肾上腺素能受体激酶靶向于膜结合受体中的作用(roleofbetagammasubunitsofgproteinsintargetingthebeta-adrenergicreceptorkinasetomembrane-boundreceptors.)″科学(science)257(5074):1264-1267.
12.stefan,e.,s.aquin,n.berger,c.r.landry,b.nyfeler,m.bouvierands.w.michnick(2007).″使用海肾荧光素酶片段互补定量动态蛋白复合体应用于体内蛋白激酶a活性(quantificationofdynamicproteincomplexesusingrenillaluciferasefragmentcomplementationappliedtoproteinkinaseaactivitiesinvivo.)″procnatlacadsciusa104(43):16916-16921.
13.takasaki,j.,t.saito,m.taniguchi,t.kawasaki,y.moritani,k.hayashi和m.kobori(2004).″新型gαq/11选择性抑制剂(anovelgalphaq/11-selectiveinhibitor.)″jbiolchem279(46):47438-47445.
14.touhara,k.,j.inglese,j.a.pitcher,g.shaw和r.j.lefkowitz(1994).″g蛋白βγ亚基与普列克底物蛋白同源域结合(bindingofgproteinbetagamma-subunitstopleckstrinhomologydomains.)″jbiolchem269(14):10217-10220.
15.zhang,j.h.,t.d.chung和k.r.oldenburg(1999).″用于高通量筛选测定的评价和检测的简单统计学参数(asimplestatisticalparameterforuseinevaluationandvalidationofhighthroughputscreeningassays.)″jbiomolscreen4(2):67-73.
16.cong等人,生物化学期刊(thejournalofbiologicalchemistry),276,15192-15199.
17.pitcher等人,生物化学期刊(thejournalofbiologicalchemistry),274,34531-34534.
18.penela等人,pnas,107(3):1118-1123.
19.choudhary等人,molcell.200936(2):326-39.
20.linding等人,globplot:探索蛋白质序列的球状性和杂乱性(globplot:exploringproteinsequencesforglobularityanddisorder),nucleicacidres2003-vol.31,no.13,3701-8.
- 还没有人留言评论。精彩留言会获得点赞!