一株庆大霉素降解菌株及其应用的制作方法
本发明涉及生物
技术领域:
,尤其涉及一株用于降解庆大霉素的菌株及其应用。
背景技术:
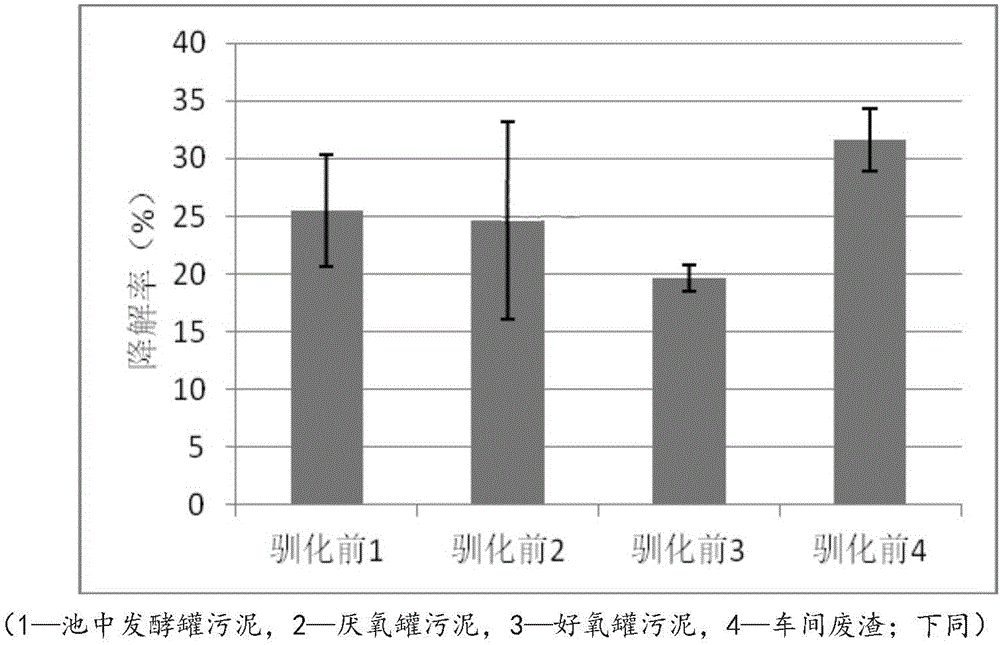
:抗生素(antibiotics)是由微生物(包括细菌、真菌、放线菌属)产生的具有抗病原体或其它活性的一类次级代谢产物,能干扰其他活细胞的发育功能。抗生素作为抑菌或杀菌类药物已被广泛应用于人类疾病治疗、畜禽及水产养殖等多个领域,主要包括四环素类,磺胺类,β-内酰胺类、氟喹诺酮类、氨基糖苷类和大环内酯类等。我国是抗生素生产和使用大国,每年抗生素生产量达21万吨,使用量达18.9万吨,其中兽用抗生素占到使用量的一半以上。研究发现,生物体摄入大量抗生素类药物后除部分被机体代谢外,约有40-90%以原药或初级代谢产物的形式随粪便和尿液排出体外,最终又通过施肥等方式进入土壤环境或者通过渗漏和污水排放进入水体环境。近年来,关于抗生素类污染物在水体、沉积物和土壤中被检出的国内外相关报道层出不穷,甚至在蔬菜、奶类和肉类等产品中也发现了抗生素残留。研究发现,长期暴露在抗生素环境下,不仅人和动物的患病和发病率会升高,而且对植物的叶绿素合成、酶分泌和根系生长都有影响。此外微生物也会逐渐适应抗生素环境,并产生抗生素耐药性和抗性基因(antibioticresistancegenes,ARGs)。同时,低浓度抗生素对生态环境中微生物种群也能够起到筛选作用,使具有抗生素耐药性的微生物种群得以保留并逐渐壮大,而对其敏感的种群不断死亡消失,直接后果就是使微生物种群结构失衡,对生态环境及人类健康造成极大的危害。据报道,2014年全球有70万人因抗生素耐药性的产生而死亡,因此解决抗生素问题迫在眉睫。为了解决抗生素污染问题,除了减少抗生素的滥用,如何去除环境体系中残留的抗生素已经成了近年来研究的热点。目前,对含有抗生素残留污水的理化处理方法进行了大量的研究和实践,包括高级氧化法、活性炭吸附法、低温等离子体技术和膜处理法等。但是这些理化法处理所需成本高,管理复杂,除了高级氧化法对抗生素的去除率可达95%外,其他方法的去除效率都较低,并且都对固态介质中抗生素残留处理存在局限性。因此有关抗生素的微生物降解研究逐渐成为热点并不断报道。但是经文献和专利检索,目前多是对四环素类、磺胺类、β-内酰胺类、氟喹诺酮类和大环内酯等抗生素降解菌的研究,尚未发现对氨基糖苷类抗生素降解菌的筛选。因此,有必要获得一种可有效降解氨基糖苷类抗生素的微生物菌株。技术实现要素:本发明的目的是弥补现有技术的不足,提供一种好氧液体发酵条件下降解庆大霉素等氨基糖苷类抗生素的高效菌株。本发明的另一个目的是提供一种可有效降解庆大霉素菌株的筛选方法。本发明的再一个目的是提供该菌株在好氧降解庆大霉素中的应用,以及运用该菌株降解庆大霉素的方法。本发明的技术方案包括:一株缺陷短波单胞菌(Brevendimonasdiminuta)BZC-3,其保藏号为CGMCCNo.12070,已于2016年1月15日保藏于中国微生物菌种保藏管理委员会普通微生物中心,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所。上述缺陷短波单胞菌(Brevendimonasdiminuta)BZC-3可在如下1)-2)中任一方式中应用:1)在降解氨基糖苷类抗生素中的应用;2)在提高降解氨基糖苷类抗生素去除率中的应用。其中,所述氨基糖苷类抗生素是指庆大霉素。运用上述缺陷短波单胞菌BZC-3(Brevendimonasdiminuta)在处理含庆大霉素废水或废渣中的应用,其可有效降解庆大霉素。一种降解环境中、药厂残渣、废弃物等中残留的庆大霉素的方法,是将上述的缺陷短波单胞菌BZC-3接种到含有庆大霉素的体系中培养,实现对庆大霉素的降解。其中,在接种到含庆大霉素的体系中之前,还包括对该菌株的预培养,将该菌株接种到BPM培养基中培养30h-40h。本发明还包括一种筛选所述缺陷短波单胞菌BZC-3的方法,该方法包括:步骤一、从不同来源的药厂废渣中分别获得菌群,使用的一定的驯化压力驯化培养所述菌群;步骤二、测定这些不同来源的菌群,在驯化前和驯化后对庆大霉素的降解率;步骤三、挑选其中在驯化前及驯化后,都对庆大霉素具有较强降解能力的某一来源的菌群;步骤四、稀释所选定菌群的菌液,涂平板培养,对生长出来的不同菌分别进行划线分离得到纯化菌株;步骤五、培养分离的纯化菌株,测定单一菌株对庆大霉素的降解率,挑选出其中降解能力最强的纯化菌株,鉴定该菌株。所述的筛选方法,还包括一个测定该菌株生长特性的步骤。本发明所筛选得到的缺陷短波单胞菌BZC-3对庆大霉素去除率可达50%以上;可对其进行专门培养,并将该菌株BZC-3接种到含有庆大霉素的体系中,以有效、快速、高效地降解其中的庆大霉素。因而,可将其应用到制药废弃物,包括药厂药渣或废水等的排放前处理程序中,以防止大量的抗生素流入到自然环境,减轻抗生素对自然环境、动植物及人类健康造成的严重危害。此外,按照本发明的方法筛选用于降解庆大霉素的菌株,经过驯化前及驯化后两次降解能力的筛选和比较,所筛选出庆大霉素降解菌株可抗一定环境压力,即使在一定的胁迫压力下依然能保持较强的庆大霉素降解能力,具有良好的适应性。附图说明为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1是驯化前4个不同来源的菌群在含庆大霉素液体的1/5BPM中培养7d对庆大霉素的降解率;其中:池中发酵罐污泥来源的菌群标记为1,厌氧罐污泥来源的菌群标记为2,好氧罐污泥来源的菌群标记为3,车间废渣来源的菌群标记为4。图2是驯化后4个不同来源的菌群在含庆大霉素液体的1/5BPM中培养7d对庆大霉素的降解率。图3是驯化前4个不同来源的菌群在含庆大霉素液体的MSM中培养7d对庆大霉素的降解率。图4是车间废渣的菌群中分离出的单一菌株在液体1/5BPM培养48h后,在在含庆大霉素液体的MSM中培养7d对庆大霉素的降解率。图5是车间废渣的菌群中分离出的单一菌株BZC-3在液体1/5BPM培养基中生长曲线图。图6A是筛选出的单一菌株BZC-3的形态镜检照片;图6B是筛选出的单一菌株BZC-3的平板培养形态照片。图7是单一菌株BZC3的16SrRNA基因序列与已知相近模式菌株构建的系统发育进化树。图8是以气相色谱法分析所述单一菌株BZC3的脂肪酸组成的色谱图。具体实施方式下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例用的试剂和材料:菌株的筛选材料:从山东省只楚药业(生产庆大霉素的药厂)获得的池中发酵罐污泥、厌氧罐污泥、好氧罐污泥和车间废渣。生化试剂:庆大霉素标准品,1mol/LNaOH,牛肉膏,蛋白胨,NaCl,琼脂粉,甲醇(色谱纯),三氟乙酸(色谱纯),哇哈哈纯净水,蒸馏水。培养基配方:液体牛肉膏蛋白胨培养基(BPM)配方:成分用量牛肉膏3gNaCl5g蛋白胨5g蒸馏水1LpH值7.0左右其中,按照表格配置得到的液体BPM培养基是培养基原液,记为1/1BPM培养基,1/2、1/5、1/10BPM是在原液的基础上被蒸馏水呈2倍、5倍、10倍地稀释,分别对应简写为1/2BPM培养基、1/5BPM培养基、1/10BPM培养基。固体BPM培养基:1L液体1/1BPM培养基中加入18g琼脂配而成。无机盐培养基(MSM)的配方:成分用量NH4Cl1gNaCl1gK2HPO41.5gMgSO40.2g蒸馏水1LpH值7.0所有的培养基在用配好后都要经过121℃高温灭菌30min。实验例一、菌群的驯化及降解率测定(1)、菌群来源:分别取4个不同来源的药渣(4个来源:池中发酵罐污泥、厌氧罐污泥、好氧罐污泥和车间废渣)10g溶解于含有90g无菌水的250ml三角瓶中,再加入适量的玻璃珠,在恒温振荡培养箱中震荡5-10分钟,使样品充分打散,然后取出药渣浸出液备用。(2)、菌群驯化培养:取上述药渣浸出液5mL加入到95mL含有一定量庆大霉素(使用庆大霉素标准品)的液体BPM中,置于30℃、150r/min的恒温振荡摇床中培养驯化。驯化分为四个周期,驯化压力是经过逐次投加庆大霉素并减少营养物质含量的方式,使庆大霉素的浓度从50mg/L依次增加到200mg/L,以筛选出具有良好降解庆大霉素能力的复合菌群。在此过程中,每一组以不接入菌样(不加药渣浸出液的含等量庆大霉素的液体BPM)为空白对照,每个实验组设置3个平行。驯化培养条件如下表:(3)、分别测定以上4个不同来源的菌群在驯化前和驯化后,在不同培养基中对庆大霉素的降解率,其测定方法如下:将驯化前和驯化后的菌群分别以1%的接种量接入到庆大霉素含量为100mg/L的1/5BPM培养基中,同时还将驯化后的菌群以1%的接种量接入到庆大霉素含量为100mg/L的MSM中,再均于30℃、150r/min恒温振荡培养箱中培养一定天数(在本发明的实施例中,以培养7天来考察),检测庆大霉素的浓度变化。通过计算“复合菌群”对抗生素的降解率,来考察“驯化前、后”菌群对庆大霉素的降解效果、以及两种不同培养基下菌群对庆大霉素降解效果。期间,每一实验组又以不接入菌液(不加药渣浸出液的含等量庆大霉素的液体BPM和MSM)为空白对照,每一实验组设置3个平行。降解率按照以下公式计算:降解率(%)=((Ct2-Ct1)-(Ck2-Ck1))×100/(Ct1-(Ck2-Ck1))其中:Ct1:实验组庆大霉素初始浓度;Ct2:一定天数后处理庆大霉素浓度;Ck1:空白对照的庆大霉素初始浓度;Ck2:一定天数后空白对照的庆大霉素浓度。在公式中:(Ct2-Ct1)=实验组的庆大霉素经过一定天数后的庆大霉素浓度变化(包含自然因素造成的浓度变化和菌株降解浓度变化);(Ck2-Ck1)=自然因素造成的庆大霉素浓度变化;((Ct2-Ct1)-(Ck2-Ck1))=由“复合菌降解掉”的庆大霉素的浓度;(Ct1-(Ck2-Ck1))=实验组放置一定天数后庆大霉素的浓度。去除率=由复合菌降解的浓度/实验组放置一段后庆大霉素的浓度*100%。上述“一定天数”在本发明的具体实施例中是7d。按照上述计算公式,计算所述4个不同来源菌群驯化前和驯化后在液体BPM中对庆大霉素的降解率,结果参见图1-2所示:由图1、图2中可以看到,在液体BPM中,驯化前来自“车间废渣”的菌群(即驯化前4)对庆大霉素具有较高的降解率,达到30%以上;而在驯化后来自“厌氧罐污泥”和“车间废渣”的菌群(驯化后2和驯化后4)对庆大霉素具有相当的较高降解率,均可达到30%以上;其中来自“车间废渣”的菌群“4”,无论是驯化前还是驯化后,在BPM培养液中对庆大霉素具有显著的降解能力。可见,来自菌群“4”的某些菌株在庆大霉素的降解能力方面具有较强的环境适应能力。按照上述降解率的计算公式,计算所述4个不同来源的菌群驯化后在MSM培养基中对庆大霉素的降解率,结果参见图3所示。由图3显示的实验结果表明,驯化后的菌群(驯化后1、驯化后2、驯化后3、驯化后4)在MSM培养对庆大霉素降解率均较低,最高降解率不超过4%;低于菌群在BPM培养基中对庆大霉素的降解率。可见,菌群对庆大霉素的降解能力与其所在培养基有一定关联。二、单菌落的筛选纯化及降解率测定(1)、分离纯化菌株:取“一、(3)”降解能力较高的来自“车间废渣”的菌群“4”1ml共7次,分别稀释得到菌群梯度浓度10-1、10-2…10-7的菌液,然后将菌群浓度为10-5、10-6、10-7的菌液涂布于含庆大霉素50mg/L的固体BPM平板上,在30℃的恒温培养箱中培养48h,对生长出来的不同菌分别进行划线分离得到纯化菌株,并在4℃冰箱保存。(2)、单一菌株降解率测定:用无菌接种环分别挑取“二、(1)”中分离的单一菌落1环于液体BPM培养基中进行培养,48h后分别取1mL的菌液于1mL的离心管内以10000rpm/min的转速离心10min,然后在无菌环境下倒掉上清液,将沉淀接入到100mL含庆大霉素初始浓度50m/L的1/5BPM培养液中。将离心的沉淀转入到“100mL含庆大霉素初始浓度50m/L的1/5BPM培养液”中的具体操作方法是:每次用滴管吸取少量的1/5BPM培养液使细菌沉淀悬浮,然后用滴管吸取悬浮液,并转移到培养液中。细菌接种好后,将培养液置于30℃、150r/min恒温培养箱中培养7d,取样并测定培养液中残留的庆大霉素的浓度,考察和计算不同单一菌株对庆大霉素的降解率。同时每一组以不接入菌液的培养基为空白对照,每个实验组设置3个平行。通过降解效果的对比,筛选出降解能力较强的优势菌株。计算方式,参照前述“一、(3)”所记载的计算公式。经过7d培养,实验组和空白对照组中残留的庆大霉素的浓度可采用以下方法测定:用1mL的注射器吸取1mL的培养液并过0.22μm的有机滤器,保存于1mL的棕色进样品,然后利用高效液相色谱一蒸发光检测器(HPLC-ELSD)法测定样品中庆大霉素浓度。其中检测条件为:色谱柱:C18,250mm×4.6mm(内径),5μm粒径,流速:0.6ml/min;流动相∶0.2M的三氟乙酸∶甲醇=92∶8,蒸发光散射检测器载气流量:2.8L/min。有关庆大霉素在培养基中残留量的测定为本领域的常规技术手段,且亦不属于本发明要点所在,在此不再赘述。可以理解的是,本领域技术人员可采用已知的任何手段,测定培养一定天数后庆大霉素的最终浓度。最后,从车间废渣的混合菌群“4”中分离出的7个纯化菌株具有较强的庆大霉素降解能力。这7株菌的降解率如图4所示。可以看出,单一菌株BZC-3对庆大霉素的降解率最高,在含庆大霉素的培养基中培养7d后,降解率超过50%,而其他菌株对庆大霉素的降解率低或者重复性差。通过单一菌株的降解率测定,筛选出菌株BZC-3作为目标菌株。而若将该菌株规模化培养和应用于含庆大霉素废渣、废水的处理,具有较强的繁殖能力和生长速度是必要的,以下是对其生长特性的考察。(3)菌株BZC-3的生长曲线的测定用无菌接种环挑取“二、(2)”中具有较高庆大霉素降级能力的菌株BZC-3,在固体BPM培养基中划线,至于30℃的培养箱中培养24h;挑取单菌落接种于100mL的液体BPM中,并在振荡培养箱中培养(30℃,150rpm);每隔两个小时利用分光光度计测定细菌的OD600。测定结果参见图5所示。图5显示的结果表明,菌株BZC-3在培养超过10h后,OD600呈线性增长,而培养40h后,该细菌的OD600趋于稳定,不再随着培养时间增长而变化。因此,单株菌株BZC-3的培养时间介于30h-40h较佳。在对残留有庆大霉素的药厂废渣、废水处理之前,可先将菌株BZC-3接种到培养基中预培养一段时间,待其增殖到一定浓度后加入到含庆大霉素的体系中,可高效去除庆大霉素。三、菌株BZC-3的鉴定挑选具有较高庆大霉素降解能力的菌株BZC-3进行鉴定,主要包括形态学鉴定、分子生物学鉴定;而分子生物学鉴定包括细菌遗传物质的鉴定和微生物脂肪酸组成的验证。1、菌株BZC-3的形态鉴定用无菌的竹签蘸取少量菌体BZC-3,先在平板BPM培养基的一边作平行线3~4次,然后换根无菌竹签,穿过第一次划线部分进行第二次划线,再用同样的方法穿过第二次划线部分进行第三次划线,划线完毕后,盖上培养皿盖,用记号笔标明样品编号、日期,将培养皿倒置于培养箱培养,等到平板上形成单个菌落,拍照、保存;照片为图6B。(1)菌株BZC-3的形态观察,操作方法按照①-⑨进行:①载玻片的处理,将载玻片在火焰上烤一下,冷却待用;②涂片,在载玻片上滴一小滴无菌水,用无菌的竹签从平板上的单个菌落挑取少许菌苔,在载玻片上混合无菌水涂抹均匀,形成均匀的薄膜;③干燥,涂布后待其自然干燥;④固定,将易干燥的涂片样本朝上,在酒精灯火焰上通过3次左右;⑤初染,滴加结晶紫染色液,染色1min,水洗;⑥媒染,再滴加革兰氏碘液覆盖涂片上,作用1min,水洗;⑦脱色,用纸吸去载玻片上的残留水,滴加95%的乙醇脱色,约30s,水洗;⑧复染,滴加沙黄复染色液,复染1min,水洗,用纸吸干载玻片背面及样品周围的水渍,待干;⑨镜检,用油镜观察样品。在显微镜下观察,BZC-3菌体呈革兰氏染色阴性,杆状,无芽孢(图6A)。直接观察的形态照片,如图6B,其菌落乳白色,边缘整齐。因此可初步确定该菌株BZC-3是一种细菌。2、遗传物质鉴定(1)16SrRNA基因序列分析:①、DNA的提取:用无菌牙签挑取少量已纯化的菌体重悬于100uL无菌双蒸水H2O中,然后在沸水浴中煮沸10min,立即置于-20℃冰箱30min,12000rpm离心1min,使用时取上清液作为模板。②、反应引物:细菌通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’)用于16SrDNA部分片段的扩增,将引物稀释成10μM的工作液。③、扩增体系:通用引物27F(10μM)和1492R(10μM)分别1μL,2×PCR缓冲液(MM)12.5uL,模板(步骤①得到的菌体粗裂解液)3uL,双蒸水ddH2O12.5uL组成30uL体系。④、扩增条件:94℃预变性5min;之后94℃变性1min、55℃复性1min、72℃延伸1min,共经30个循环;72℃延伸10min。(2)rpoB保守基因序列分析:①、DNA的提取:采用细菌基因组DNA提取试剂盒提取基因组DNA作为PCR反应的模板。②、反应引物:引物VIC4(5’-GGCGAAATGGCDGARAACCA-3’)和VIC6(5’-GARTCYTCGAAGTGGTAACC-3’)用于rpoB片段的扩增,将引物稀释成10uM的工作液。③、扩增体系:通用引物27F(10μM)和1492R(10μM)分别1μL,2×PCR缓冲液(MM)12.5uL,模板0.5uL,加入双蒸水ddH2O至体系体积27.5uL。④、扩增条件:94℃预变性4min;之后94℃变性1min、49℃复性1min、72℃延伸1min,共经30个循环;72℃延伸7min。菌株BZC-3的16SrRNA基因测定获得序列长度为1370bp(见如SEQIDNo:1所示),经http://www.ezbiocloud.net/eztaxon比对结果见图7,通过Mega6.0软件,邻接法构建系统发育树(图7)。根据序列对比结果和系统发育树理论,可以初步确定该菌株BZC-3与缺陷短波单胞菌(Brevundimonasdiminuta)16SrRNA基因同源性最高,达到99.9%以上,并稳定的聚在同一分支。3、以脂肪酸组成进一步确定菌株BZC-3实验方法主要参照微生物脂肪酸快速鉴定系统MIDI(美国MIDI公司生产)操作手册,即在培养基上28℃恒温培养细菌24h后取菌,通过提取和分离细菌细胞膜中的磷脂脂肪酸(PLFA),甲基化后进行气相色谱鉴定分析。具体操作方法如下:①、细菌的培养,在含TSA培养基的培养皿上按照四区划线法分别接种菌株BZC-3,28℃恒温培养箱中培养24h。②、菌株BZC-3的获取:按照MIDI系统推荐的方法,三区取样获取的菌株脂肪酸最具代表性。因此用普通接种环获取已培养好的三区菌株至少40mg到10ml带聚四氟乙烯塞的玻璃瓶中。③、皂化,在取好菌株样的玻璃瓶中加入1.0ml的溶液I(皂化试剂),盖好盖子,旋涡振荡5~10s,于100℃的沸水浴中加热5min,稍冷却后振荡5~10s,再将玻璃瓶放入水浴中继续加热25min,然后冷却至室温。④、甲基化,每个玻璃瓶中加入溶液II(甲基化试剂)2.0ml,盖紧盖子旋涡振荡后,放入80℃水浴加热10min,再将玻璃瓶冷却至室温。⑤、萃取,往玻璃瓶中加入1.25ml溶液III(萃取试剂),玻璃瓶盖紧盖子在旋转式)昆合振荡仪上温和振荡10min后,打开盖子,取出每个样品的下层相并丢弃,保留上层有机相。⑥、基本洗涤,每个玻璃瓶中加入3.0溶液IV(碱洗液),盖紧盖子后在旋转式混合振荡仪上温和旋转振荡5min。静置几分钟,若两相界面不清楚,加数滴溶液V(饱和NaCl溶液)使两层液面的接口更清楚。⑦、分析,吸取上层有机相于气相色谱样品瓶中,在安捷伦6890气相色谱仪,配备分流/不分流进样口,氢火焰离子化检测器(FID)及HP气相色谱化学工作站(HPCHEMSTATIONverA5.01)。菌株(Brevendimonasdiminuta)BZC-3的具体脂肪酸的GC图谱参见图8。而MIDI系统的分析结果参见下表:其中RT-保留时间;面积峰高比(Ar/Ht)、等链长(ECL)、脂肪酸命名(Peakname)、百分含量(Percent)。图8中除第一个是溶剂波峰外,其余每一个波峰代表一种脂肪酸。通过微生物脂肪酸快速鉴定系统(MIDI)检测菌株的脂肪酸组成,可知待测菌株BZC-3的主要脂肪酸为SumInFeature8(18:1w7c或18:1w6c(63.61%),C16:0(23.74%)和SumInFeature3(16:1w7c或/和16:1w6c(2.94%)(表中底色加重),为缺陷短波单胞菌及其相关属的典型脂肪酸组成。最后,通过MIDI系统,确定菌株BZC3为一种缺陷短波单胞菌(Brevundimonasdiminuta)。MIDI微生物鉴定系统主机软件是一个全自动GC(气相色谱)分析系统,其原理是通过细菌独特的脂肪酸来对细菌进行鉴定分型。MIDI系统的主机软件能由GC检测器得到的电讯号传输到电脑,由软件对峰制进行积分计算,数据储存并与MIDI的菌株数据库进行分析比对。菌株数据库容量共2200余种,包括嗜氧菌库,厌氧菌库,酵母库,放射菌库等。以上所述的具体实施方式,对本发明的目的、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施方式而已,并不用于限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1