获得病毒的方法与流程
本发明涉及生物医药领域,具体地,本发明涉及获得病毒的方法。
背景技术:
基因治疗是将人正常基因或者有治疗功能的基因导入人体靶细胞发挥治疗作用,曾在2009年被评为十大成功之一,直至今天,世界各国已批准数千个基因治疗临床试验的项目。腺病毒载体是基因治疗的关键载体之一,表现出高效、靶向、不整合到细胞基因组、安全系数高、可长期表达目的基因片段、可制备高效价的病毒颗粒等优点。故大批量生产腺病毒载体成为基因治疗深入研究和市场推广关键位点之一。
技术实现要素:
专利cn200480038524.4公开“生产在无血清的培养基悬浮培养中稳定的a549细胞系的方法”,该专利中公开采用无血清驯化培养的a549进行生产腺病毒的方法。发明人经过实验研究发现,采用无血清驯化培养的hek293细胞生产病毒,如腺病毒,且生产过程中不添加氯化钙,批量产出的腺病毒的滴度可达3×1012pfu/batch,腺病毒的比活大于1.5%,不仅腺病毒的产量更大、比活更高,而且工艺简单无需灌注,培养过程中无需补加氯化钙,减少工艺程序,降低污染风险,工艺简单容易操作,可以实现工业化生产,生产成本大幅降低。
在本发明的第一方面,本发明提出一种获得病毒的方法。根据本发明的实施例,所述方法包括:利用病毒种子感染宿主细胞,所述宿主细胞为hek293细胞,且所述宿主细胞为悬浮培养在无血清培养基中的宿主细胞;以及将感染后的宿主细胞继续进行悬浮培养,以便获得病毒,其中,在进行所述感染时,所述病毒种子的病毒感染复数为10~50,所述宿主细胞在所述无血清培养基中的浓度为1.0~3.0×106cells/ml。根据本发明的实施例,该方法中所用宿主细胞hek293是经过无血清培养驯化过的hek293细胞,该细胞相比于a549细胞,生存能力更强、产毒效率更高。利用根据本发明实施例的获得病毒的方法,所得病毒滴度高、比活大,符合临床药用要求。且根据发明的实施例,本发明的获得病毒的方法,工艺简单无需灌注,培养过程中无需补加氯化钙,减少工艺程序,降低污染风险,工艺简单容易操作,可以实现工业化生产,生产成本大幅降低。
根据本发明的实施例,上述获得病毒的方法还可以进一步包括如下附加技术特征至少之一:
根据本发明的实施例,所述宿主细胞在所述无血清培养基中的接种密度为3.0~5.0×105cells/ml。发明人经过实验发现,宿主细胞以3.0~5.0×105cells/ml的接种密度进行接种,可以保证接种后,宿主细胞在无血清培养基中健康的生长状态。发明人发现,接种密度低于3.0×105cells/ml,细胞密度过低,细胞生长缓慢,接种密度高于5.0×105cells/ml,细胞密度过高,细胞生长受到抑制,细胞状态受到显著影响。
根据本发明的实施例,将感染后的宿主细胞继续进行悬浮培养24~48h,以便获得病毒。发明人经过实验发现,感染后的宿主细胞悬浮培养24~48h,此时收集病毒,可最大可能地保证病毒的活力和数量的最大化。
根据本发明的实施例,将感染后的宿主细胞继续进行悬浮培养24~48h的过程中,葡萄糖在所述无血清培养基中的浓度为2~5g/l。发明人发现,病毒在感染、包装和扩增过程中不断地消耗葡萄糖,控制培养基中葡萄糖在2~5g/l,可有效保证病毒感染、包装和扩增的高效和稳定。
根据本发明的实施例,所述病毒为腺病毒、慢病毒或逆转录病毒。利用本发明实施例所提出的获得病毒的方法,可批量获得腺病毒、慢病毒或逆转录病毒,病毒产率高、比活大。
根据本发明的实施例,所述无血清培养基为gibcocd293agttm/aem,hyclonecdm4/sfm4/pf-293*/sfmtransfx。发明人经过筛选实验发现,本发明的宿主细胞hek293细胞在gibcocd293agttm/aem,hyclonecdm4/sfm4/pf-293*/sfmtransfx培养基中的生长状态相比于在其它培养基中的生长状态,更加健康,病毒产率更高。
在本发明的第二方面,本发明提出一种获得病毒的方法。根据本发明的实施例,所述方法包括:1)hek293细胞种子接种到生物反应器的无血清培养基gibcocd293agttm/aem,hyclonecdm4/sfm4/pf-293*/sfmtransfx中,接种密度为3.0~5.0×105cells/ml,并继续在生物反应器中进行悬浮培养;2)当hek293密度达到1.0~3.0×106cells/ml时,用腺病毒种子以病毒感染复数为10~50直接感染细胞并继续进行悬浮培养,葡萄糖的浓度控制在2~5g/l;以及3)通过监测接毒后生物反应器内培养的细胞活率,当感染后24~48h,结束培养,分别收集细胞及培养上清,以便获得腺病毒。利用根据本发明实施例的获得病毒的方法,所得病毒滴度高、比活大,符合临床药用要求。
根据本发明的实施例,上述获得病毒的方法还可以进一步包括如下附加技术特征至少之一:
根据本发明的实施例,hek293细胞种子预先复苏并扩增培养在无血清培养基中,hek293细胞种子的复苏密度为3.0~5.0×105cells/ml,当生长到2.0~4.0×106cells/ml左右时,以细胞密度为3.0~5.0×105cells/ml进行扩增培养。发明人通过实验发现,hek293细胞种子在上述复苏密度(3.0~5.0×105cells/ml)、传代临界密度(2.0~4.0×106cells/ml)和扩增密度(3.0~5.0×105cells/ml)下,hek293细胞种子更加健康、生长状态更好,将此生长状态好且健康的细胞种子进行接种扩毒,细胞的产毒效率更高。
根据本发明的实施例,所述方法进一步包括对所获得的腺病毒进行纯化。纯化进一步提高病毒的滴度,所得病毒更加安全。
需要说明的是,本申请中所提到的“经过无血清培养驯化过的细胞”,是指细胞经过无血清培养基的适应培养,细胞已经能够完全适应无血清的生长环境,在无血清的培养基中具有持续生长的能力。
附图说明
图1显示了根据本发明实施例的hek293细胞不同初始密度的生长曲线;
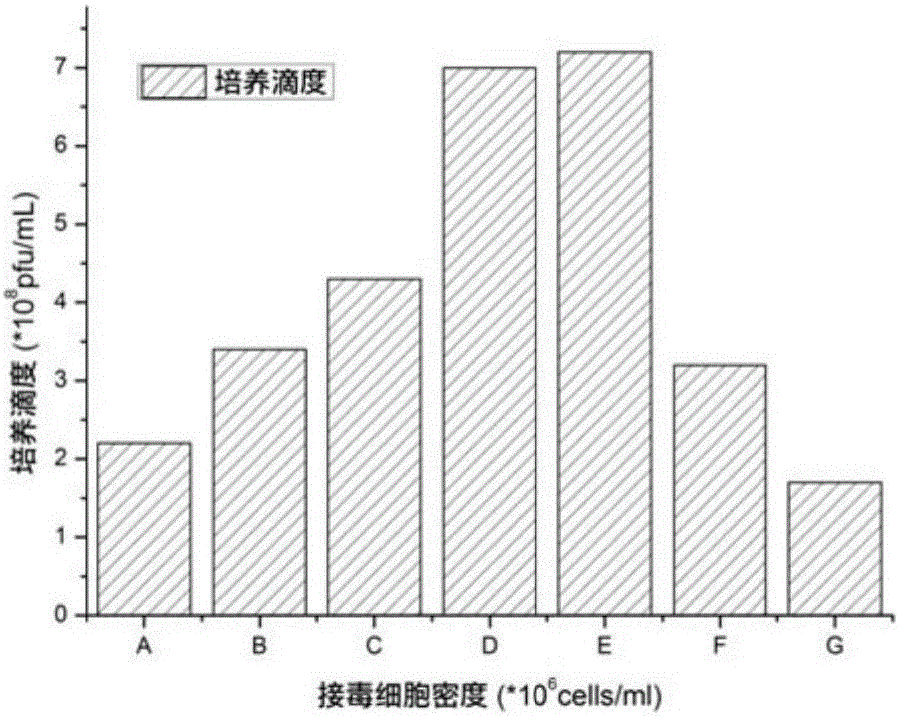
图2显示了根据本发明实施例的不同的接毒细胞密度对生产重组腺病毒ad-hgf的影响;
图3显示了根据本发明实施例的不同的moi对hek293细胞生产重组腺病毒ad-hgf的影响;以及
图4显示了根据本发明实施例的不同的收毒时间对hek293细胞生产重组腺病毒ad-hgf的影响。
具体实施方式
下面详细描述本发明的实施例。下面描述的实施例是示例性的,仅用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
实施例1
在本实施例中,发明人以在7.5l搅拌式生物反应器中生产ad-hgf为例,详细介绍获得腺病毒的方法。
1材料及仪器
细胞:hek293细胞(人胚肾细胞);
培养基:细胞培养基gibcocd293agttm/aem,hyclonecdm4/sfm4/pf-293*/sfmtransfx(简写为cd293/sfm4);
病毒:ad-hgf是经过基因工程改造过的,无复制能力的重组人5型腺病毒;
生物反应器:7.5l的生物反应器(美国nbs公司,310型号),工作体积为3l。
2hek293种子细胞的制备
2.1细胞种子复苏
取一支hek293细胞冻存管,用含4mm谷氨酰胺的cd293/sfm4培养基调整细胞浓度为3.0~5.0×105cells/ml,按30ml每瓶(125ml细胞培养瓶)的工作体积,于37℃,5%co2,105rpm的条件下培养细胞。
2.2细胞种子扩增
当细胞密度生长到2.0~4.0×106cells/ml左右时,用含4mm谷氨酰胺的cd293/sfm4培养基调整细胞浓度为3.0~5.0×105cells/ml,按100ml每瓶(250ml细胞培养瓶)的工作体积,于37℃,5%co2,105rpm的条件下培养细胞。
2.3在7.5l生物反应器中培养hek293细胞
当细胞种子密度生长到2.0×106cells/ml左右时,用含4mm谷氨酰胺的cd293/sfm4培养基调整细胞浓度为3.0~5.0×105cells/ml,将3l的工作体积接入生物反应器中,并于37℃,ph为7.15~7.20,溶氧为30~60%,转速为50~80rpm的条件下培养细胞。每天取样测细胞活率及密度,同时检查谷氨酰胺、乳酸和葡萄糖的浓度,控制葡萄糖浓度2~5g/l。
2.4接种腺病毒
当生物反应器内的细胞密度达到1.0~3.0×106cells/ml,活率>90%时,用腺病毒(moi=10~50)种子打入生物反应器内,继续培养,病毒在生物反应器内感染细胞,在胞内包装及释放到胞外培养液中。当接毒后,葡萄糖浓度控制在2~5g/l,直到培养结束。
2.5收集病毒
通过监测接毒后生物反应器培养的细胞活率,当接毒后24~48h,结束培养,分别收集细胞及培养上清。含有大量腺病毒的细胞经过三次-80℃~37℃冻融裂解,分别检测培养上清和细胞裂解液的滴度,计算培养液滴度和生产能力。
发明人将每批次实验涉及到的接毒时的细胞密度、moi、感染时间、培养滴度以及生产能力列于表1中。
表1:反应器中的hek293细胞生产重组腺病毒ad-hgf
实施例2
发明人在前期方法的开发过程中,对hek293细胞在不同初始密度下的生长情况、病毒接种(感染)时的细胞密度、moi、收毒时间进行严格的筛选,实验的操作过程同实施例1所述,筛选结果如图1~4、表2~4所示。
其中,图1显示hek293细胞不同初始密度的生长曲线,其中,a表示细胞初始密度为2.5×105cells/ml,b表示细胞初始密度为3.0×105cells/ml,c表示细胞初始密度为5.0×105cells/ml,d表示细胞初始密度7.5×105cells/ml,结果表明,细胞的初始密度在3.0×105cells/ml~5.0×105cells/ml时,细胞在生长过程中,存活率更高。进而发明人在对细胞进行复苏、扩增、接种时,采用3.0×105cells/ml~5.0×105cells/ml的细胞密度。表2和图2(其中a表示细胞密度为0.7×106cells/ml;b表示细胞密度为1.08×106cells/ml;c表示细胞密度为1.46×106cells/ml;d表示细胞密度为1.82×106cells/ml;e表示细胞密度为2.0×106cells/ml;f表示细胞密度为2.84×106cells/ml;g表示细胞密度为3.5×106cells/ml)表示不同的接毒细胞密度对生产重组腺病毒ad-hgf的影响。
表2:
表3和图3(其中,a:moi=1;b:moi=3;c:moi=5;d:moi=10;e:moi=20;f:moi=30;g:moi=50;h:moi=70)显示了不同的moi对hek293细胞生产重组腺病毒ad-hgf的影响。
表3:
表4和图4显示不同的收毒时间对hek293细胞生产重组腺病毒ad-hgf的影响。
表4:
综合表2~表4、图2~图4的结果可以看出,病毒接种(感染)时的细胞密度在1.0~3.0×106cells/ml、moi在10~50、接毒时间(感染后的培养时间)在24~48小时的条件下,产出病毒的滴度高,可达1.4×109pfu/ml生产能力高,当病毒接种(感染)时的细胞密度低于1.0×106cells/ml或高于3.0×106cells/ml、moi低于10或高于50、接毒时间低于24h或高于48小时的条件下,产出病毒的滴度低。
实施例3
发明人通过实验,具体比较专利cn200480038524.4公开的技术方案和本申请的技术方案。在两种技术方案下,生产腺病毒的工艺及病毒产量的对比结果如表5和表6所示。
表5生产腺病毒的结果对比
表6生产腺病毒的工艺对比
由实施例3的对比实验可以看出,在各自优选工艺条件下,生产重组腺病毒的量基本相同,然而,本申请的技术方案生产腺病毒工艺不需要灌注和额外补料cacl2溶液,减少工艺步骤,工艺简单方便工人操作,降低污染风险,更容易工艺放大投产;另外本申请的技术方案生产腺病毒工艺无需灌注,节约灌流培养基,同时减少灌流培养废液后处理工序,大幅度缩减生产成本。综上所述,本申请的技术方案生产腺病毒,有着较大的人力、物力及时间优势。
在本说明书的描述中,参考术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等的描述意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于多串联表位的重组腺病毒hiv疫苗及其制备方法
- 检测和治疗获得性免疫缺陷综合症的组合物和方法
- 用于治疗和预防获得性免疫缺陷综合症(aids)和其变体的含有胶苦瓜的水溶性抗病毒产品的制作方法
- 用于治疗和预防获得性免疫缺陷综合症(aids)和其变体的含有节莎草的水溶性抗病毒产品的制作方法
- 用于治疗和预防获得性免疫缺陷综合症(aids)的含有天堂椒的水溶性抗病毒产品的制作方法
- 用于治疗人类获得性免疫缺陷病毒和其它病毒感染的组合物的制作方法
- 用于治疗获得性免疫缺陷综合征(aids)的药物制剂及其制备方法
- 一种治疗艾滋病的药物及其制备方法
- 用于预防和治疗获得性免疫缺陷综合症的协同组合物的制作方法
- 用于预防和治疗获得性免疫缺陷综合症的协同组合物的制作方法