重组脱酰胺化麦醇溶蛋白抗原的制作方法
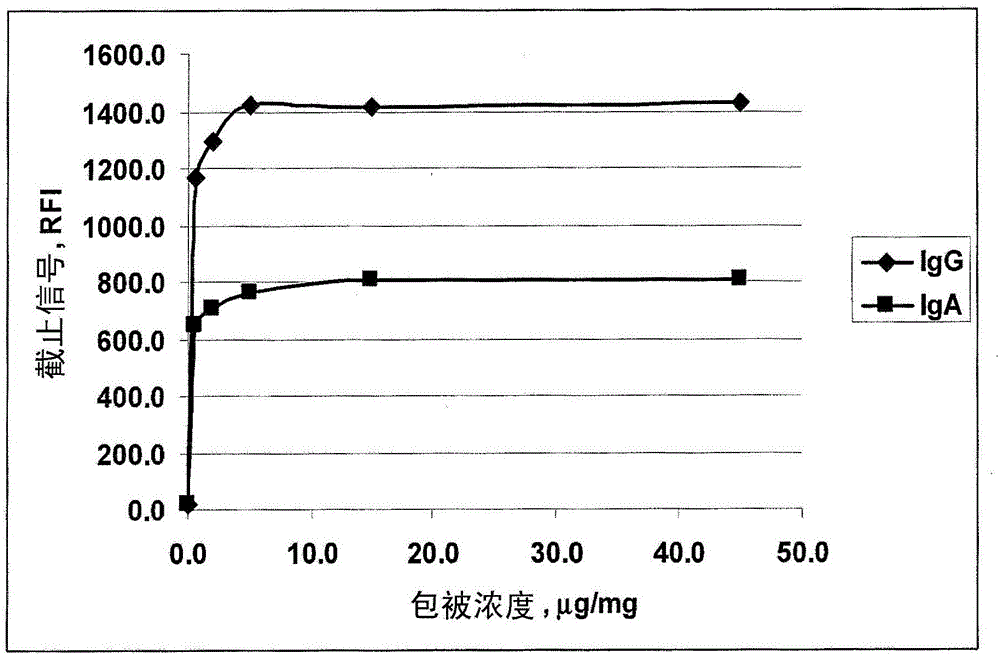
与相关申请的交叉参考本申请要求2011年12月5日提出的美国临时专利申请的优先权权益,为了所有目的其整体内容通过引用并入本文。对作为ASCII文本文件提交的”序列表,”表,或计算机程序表附录的引用2012年12月28日创建的,写于file-939-1PC.TXT中的序列表(12,288字节,机器格式IBM-PC,MS-Windows操作系统),为了所有目的,在此以其整体通过引用并入。发明背景乳糜泻(celiacdisease,CD)是严重的胃肠疾病,其具有强烈的遗传组分。CD表征为对来自小麦,大麦,黑麦,和燕麦的蛋白的永久性不耐受。尽管不完全了解CD的病理生理学,但明显患者的饮食中的毒性蛋白的存在引起肠粘膜的完全或部分损伤(Brandtzaeg,P.1997.Mechanismsofgastrointestinalreactionstofood.EnvironmentalToxicologyandPharmacology4;9-24)导致严重的吸收不良综合征(malabsorptionsyndromes)并且引起乳糜泻,呕吐,腹痛,厌食症,生长阻滞,营养不良和贫血。CD已与在未诊断和未治疗的患者中肠癌(intestinalcancer)的更高风险关联(HolmesGKT,1989.Malignancyincoeliacdisease-effectofagluten-freediet,Gut30;333-338)。CD主要影响三岁以下儿童,但其在成人中也常见,并且有时是临床非典型的或无临床症状的(FergusonA,等人1992.Definitionsanddiagnosticcriteriaoflatentandpotentialcoeliacdisease.由AurricchioS,VisakorpiJK,在EpidemiologyofCD中编辑.DynNutrRes,Basel,Karger2;119-127)。CD在具有其它遗传或自身免疫病(比如胰岛素依赖性糖尿病(insulindependentdiabetesmellitus),唐氏综合征(Downsyndrome),选择性IgA缺陷(selectiveIgAdeficiency),和疱疹样皮炎(dermatitisherpetiformis))的患者中更常见(SirgusN等人1993.PrevalenceofcoeliacdiseaseindiabeticchildrenandadolescentsinSweden.ActaPediatr66;491-494;ZubillagaP等人1993.Downsyndromeandcoeliacdisease.JPediatrGastroenterolNutr16:168-171;BoyceN1997)。CD的临床症状可能与由其它肠胃疾病产生的那些混淆。在这些情况中,CD被误诊并且患者未接受特异的治疗,即,在其饮食中完全排除谷蛋白。在另一方面,如果非乳糜泻患者被错误地诊断为乳糜泻,他将在其一生承受不必要的无谷蛋白饮食。因此,CD的精确诊断至关重要。当前CD诊断的标准为肠道活检,重复三次:在临床症状的开始,无谷蛋白饮食之后几个月,和用谷蛋白激发后。因为肠道活检是侵入性方法并且已经开发了精确的血清学测试,因此以上标准已经被修订(Walker-Smith等人1990.Revisedcriteriafordiagnosisofcoeliacdisease.ReportofWorkinggroupofEuropeanSocietyofPediatricGastroenterologyandNutrition.ArchDisChild65:909-911)。目前,可以在临床症状的开始进行血清学测试并且当它们是阳性时,将指示验证性肠道活检。对用无谷蛋白饮食治疗的反应也可以继之以血清学测试。如果在对治疗的临床反应和血清学测试的结果差异发生,将指示第二次肠道活检。对于乳糜泻诊断,已经开发一些血清学测试,比如检测针对对细胞抗原的抗体,或针对食物抗原(比如麦醇溶蛋白)的抗体。存在用于检测抗肌内膜抗体,抗网硬蛋白抗体,抗麦醇溶蛋白抗体,和抗组织转谷氨酰胺酶抗体的诊断试剂盒。抗麦醇溶蛋白抗体(AGA)已广泛被用于CD的血清学诊断(SternM等人1996.Validationandstandardizationofserologicalscreeningtestsforcoeliacdiseasein1996.第三次EMRC/ESPGAN研讨会,12月5日-8日,1996,Molsheim,France,pp:9-24;CatassiC等人1999.Quantitativeantigliadinantibodymeasurementinclinicalpractice:anItalianmulticenterstudy.ItalJGastroenterolHapatol31;366-370)。主要通过ELISA(酶联免疫吸附测定)(比IFA(间接免疫荧光抗体分析)更简单,更客观的方法)检测AGA,并且AGA可以用于分析大量的样品。尽管如此,对CD,AGA比肌内膜抗体(EMA)更不特异并且针对IgA或IgG同种型之一的抗体的检测需要两个独立的测定。近来,已经报道用于检测AGA的可见免疫测定,其解决这些问题中的一些(GarroteJA,SorellL,AlfonsoP等人1999.Asimplevisualimmunoassayforthescreeningofcoeliacdisease.Eur.JClinInvest29;697-699;西班牙专利和商标局No.9801067)。在1997年,Dietrich等人鉴别了组织转谷氨酰胺酶(tTG)(85kDa蛋白)为由抗肌内膜抗体检测的主要的自身抗原(DietrichW等人1997.Identificationoftissuetransglutaminzseastheautoantigenofceliadisease.NatMed.3:797-801)。近来已经报到以ELISA或放射配体(RLA)形式基于源自豚鼠肝提取物tTG或从不同组织克隆的重组人tTG检测抗tTG抗体(SulkanenS等人1998.Tissuetransglutaminzseautoantibodyenzyme-linkedimmunosorbentassayindetectingceliacdisease.Gastroenterology115:1322-1328;SiesslerJ等人1999.Antibodiestohumanrecombinanttissuetransglutaminzsemeasuredbyradioligandassay:Evidenceforhighdiagnosticsensitivityforceliacdisease.HormMetabRes31;375-379)。检测乳糜泻的现有技术方法在测定中使用特定的麦醇溶蛋白表位或所述麦醇溶蛋白的部分,其导致假阴性和假阳性。需要的是这样的测定法:提供包含一组更具包容性的,提供对于乳糜泻更精确测定的表位的新抗原。另人惊讶的是,本发明满足了这个和其它需求。发明概述在一个实施方案中,本发明提供用于检测乳糜泻的抗原。所述抗原包括含有肽六聚体的重组脱酰胺化麦醇溶蛋白,每个所述肽具有SEQIDNO:1,其中所述重组脱酰胺化麦醇溶蛋白共价连接于标签以形成麦醇溶蛋白融合蛋白,其中所述麦醇溶蛋白融合蛋白固定在固体支持物上,并且其中所述重组脱酰胺化麦醇溶蛋白能够结合抗脱酰胺化麦醇溶蛋白抗体。在其它实施方案中,本发明提供用于检测乳糜泻的抗原,所述抗原通过包括以下步骤的方法制备:将固体支持物与麦醇溶蛋白融合蛋白接触,其中所述麦醇溶蛋白融合蛋白包含肽六聚体的重组脱酰胺化麦醇溶蛋白,每个所述肽具有SEQIDNO:1并且其中所述重组脱酰胺化麦醇溶蛋白共价连接于标签,这样以致所述麦醇溶蛋白融合蛋白固定在固体支持物上。这样制备了用于检测乳糜泻的抗原。在一些其它实施方案中,本发明提供诊断受试者中乳糜泻的方法。所述方法包括将来自受试者的体液样品与本发明的抗原接触,所述抗原包括含有SEQIDNO:3的六聚体的重组脱酰胺化麦醇溶蛋白。所述方法还包括检测特异结合抗原的任何抗体,由此指示所述受试者中乳糜泻的存在。在另一个实施方案中,本发明提供试剂盒,所述试剂盒包括本发明的抗原,其中重组脱酰胺化麦醇溶蛋白包含SEQIDNO:3的六聚体,检测试剂,和任选地缓冲剂,盐,稳定剂和说明书中的至少一种。附图简述图1显示D2-六聚体的纯化。图2显示DGP六聚体的包被滴定:校正截止值信号相对荧光强度(RFI)。图3显示在位置14赖氨酸替代谷氨酸残基的DGP六聚体的包被滴定:校正截止值信号RFI。图4显示与rDGP三聚体相比,rDGP六聚体已改善灵敏度。发明详述I.定义如在本文使用的,术语“接触”指将至少两个不同的个体相接触的过程,这样以致它们可以反应。产生的反应产物直接从添加的试剂之间的反应产生或从可以在反应混和物中产生的来自一种或更多添加的试剂的中间产物产生。如在本文使用的,术语“体液”指哺乳动物的液体,包括,但不限于,水质的体液,胆汁,血液和血浆,母乳,间质液,淋巴液,粘液,胸膜液,脓液,唾液,血清,汗液,泪液,尿液,脑脊液,滑液或胞内液。本领域技术人员将理解其它体液用于本发明。如在本文使用的,术语“交联剂”指能够将两个分开的部分连接在一起的双功能或多功能化学或生物学部分。用于本发明的交联剂实例在下文描述。如在本文使用的,“抗体”包括涉及在免疫学上与特定抗原反应的免疫球蛋白分子,并且包括单克隆和多克隆抗体二者。如在本文使用的,术语“受试者”指动物(比如哺乳动物),包括,但不限于,灵长类(例如,人),牛,绵羊,山羊,马,狗,猫,兔,大鼠,小鼠等。如在本文使用的,术语“固定的”指所述tTG,所述麦醇溶蛋白融合蛋白或所述tTG-麦醇溶蛋白融合蛋白复合物与固体支持物物质通过共价键形成,离子键形成,氢键,偶极-偶极相互作用或通过范德华相互作用关联。所述固定可以是暂时的或永久的。如在本文使用的,术语“抗原”指能够比如通过抗体的产生刺激免疫应答的分子。本发明的抗原包括固定于固体支持物的麦醇溶蛋白融合蛋白和固定于固体支持物的tTG-麦醇溶蛋白融合蛋白复合物。本发明的麦醇溶蛋白融合蛋白可以包括重组脱酰胺化麦醇溶蛋白和标签(比如谷胱甘肽S-转移酶(GST)蛋白)二者。如在本文使用的,术语“缓冲剂”指抵抗pH的改变和维持pH在所需的点左右的任何无机或有机酸或碱。用于本发明的缓冲剂包括,但不限于,氢氧化钠,无水磷酸氢二钠,和其混和物。本领域技术人员将理解其它缓冲剂用于本发明。如在本文使用的,术语“组织转谷氨酰胺酶(tTG)”指在赖氨酸残基的氨基基团和谷氨酰胺残基的甲酰胺基团之间交联蛋白的转谷氨酰胺酶家族的酶。这产生分子间或分子内键。tTG可以用于检测乳糜泻。如在本文使用的,术语“麦醇溶蛋白融合蛋白”指连接于标签,比如谷胱甘肽S-转移酶(GST)或His标签的麦醇溶蛋白。所述麦醇溶蛋白包括重组麦醇溶蛋白或合成的麦醇溶蛋白,等等。在一些实施方案中,所述麦醇溶蛋白是脱酰胺的。标签典型地是其它可以用作用于纯化,用于增溶,层析的亲和标签,用作表位标签,荧光标签等蛋白或化合物。用于本发明的标签包括,但不限于,BCCP,c-myc-标签,钙调蛋白-标签,FLAG-标签,HA-标签,His-标签,麦芽糖结合蛋白-标签,Nus-标签,谷胱甘肽-S-转移酶(GST)标签,绿色荧光蛋白-标签,硫氧还蛋白-标签,S-标签,StreptagII,Softag1,Softag3,T7-标签,类弹性蛋白肽,壳多糖-结合结构域,和木聚糖酶10A。本领域技术人员将理解其它蛋白用于本发明的融合蛋白。如在本文使用的,术语“tTG-麦醇溶蛋白融合蛋白复合物”指当所述tTG和所述麦醇溶蛋白融合蛋白连接在一起时形成的复合物。所述tTG和所述麦醇溶蛋白融合蛋白可以在多种反应下以多种方式连接。所述tTG可以连接于所述标签和所述麦醇溶蛋白融合蛋白的重组脱酰胺化麦醇溶蛋白之一或二者。如在本文使用的,术语“重组脱酰胺化麦醇溶蛋白”指通过遗传工程制备的脱酰胺化麦醇溶蛋白。脱酰胺化蛋白是使游离酰胺功能基团的一些或全部水解为羧酸,比如转变谷氨酰胺为谷氨酸。在一些实施方案中,用于本发明的重组脱酰胺化麦醇溶蛋白包括含有与SEQIDNO:1至少75%序列同一性的肽或包括含有与SEQIDNO:3至少75%序列同一性的六聚体。如在本文使用的,术语“交联的”指两个不同的化学部分之间形成多于一个键。在本发明中,所述化学部分可以是生物学种类,比如蛋白,酶,抗体,等,或固体支持物物质。连接交联的个体化学部分的化学功能性被称为“交联剂”。交联剂典型地是双功能化合物,所述双功能化合物与一个化学部分上的一个反应性功能基团和另一个化学部分上的一个反应性功能基团反应,从而将两个化学部分彼此连接的。所述交联剂可以是同型双功能交联剂或异型双功能交联剂。同型双功能交联剂是其中同型双功能交联剂的与各个化学部分反应的功能基团相同的那些。异型双功能交联剂是其中异型双功能交联剂的与各个化学部分反应的功能基团不同的那些。本发明的优选的同型双功能和异型双功能交联剂在下文更详细地描述。如在本文使用的,在两条或更多条核酸或多肽序列的情况下的术语“同一的”或“同一性”百分数,指,当比较和比对比较窗口或如使用以下序列比较算法或通过手动比对和肉眼检查测量的指定区域的最大对应时,相同或具有相同的指定的氨基酸残基或核苷酸百分数的两条或更多条序列或子序列(即,对指定区域有60%同一性,优选65%,70%,75%,80%,85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%或99%同一性)。该定义还指测试序列的互补序列。在两条核酸或多肽的情况下,措辞“基本上同一的”,指与参考序列具有至少40%序列同一性的序列或子序列。备选地,同一性百分数可以是从40%至100%的任何整数。更优选的实施方案包括使用本文描述的程序与参考序列相比至少:40%,45%,50%,55%,60%,65%,70%,75%,80%,85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%或99%;优选如下文描述的使用标准参数的BLAST。为了序列比较,典型地一条序列用作参考序列,测试序列与其比较。当使用序列比较算法时,将测试和参考序列输入计算机,如果需要,指定子序列坐标,并指定序列算法程序参数。可以使用缺省程序参数,或可以指定备选的参数。序列比较算法随后基于程序参数计算测试序列相对于参考序列的序列同一性百分数。为了核酸和蛋白的序列比较,使用下文讨论的BLAST和BLAST2.0算法和缺省参数。适于确定序列同一性百分数和序列相似性的优选的算法实例是BLAST和BLAST2.0算法,其分别描述于Altschul等人,Nuc.AcidsRes.25:3389-3402(1977)和Altschul等人,J.Mol.Biol.215:403-410(1990)中。与本文描述的参数一起使用BLAST和BLAST2.0以确定本发明的核酸和蛋白的序列同一性百分数。通过NationalCenterforBiotechnologyInformation(http://www.ncbi.nlm.nih.gov/)公众可获得用于进行BLAST分析的软件。该算法包括首先通过在查询序列中鉴别长度W的短词鉴别高得分序列对(HSPs),当与数据库序列中相同长度的词比对时,其匹配或满足一些正值的阈值评分T。T被称为邻域词得分阈值(Altschul等人,同前)。这些起始邻域词的命中用作用于起始找到包含它们的更长的HSPs搜索的种子。词命中在延各个序列的两个方向延伸直到累积的比对得分可以增加。对于核苷酸序列,使用参数M(对一对匹配残基的奖励得分;始终>0)和N(对错配残基的罚分;始终<0)计算累积得分。对于氨基酸序列,使用得分矩阵以计算累积得分。当累积比对得分从最大获得值以量X减少;由于一个或更多个负得分残基比对,累积得分到0或更低;或到达两条序列中任一个的末端时,在各个方向上词命中的延伸终止。BLAST算法参数W,T,和X决定比对的灵敏度和速度。BLASTN程序(对于核苷酸序列)使用词长(W)为11,期望值(E)为10,M=5,N=-4和两条链的比较作为缺省值。对于氨基酸序列,BLASTP程序使用词长为3,和期望值(E)为10,和BLOSUM62得分矩阵(参见Henikoff&Henikoff,Proc.Natl.Acad.Sci.USA89:10915(1989))比对(B)为50,期望值(E)为10,M=5,N=-4,和两条链的比较作为缺省值。BLAST算法还对两条序列间的相似性进行统计分析(参见,例如,Karlin&Altschul,Proc.Nat’1.Acad.Sci.USA90:5873-5787(1993)).由BLAST算法提供的一种相似性测量是最小和概率(smallestsumprobability)(P(N)),其提供两条核苷酸或氨基酸序列碱的匹配将偶然发生的可能性的指示。例如,如果在测试核酸与参考核酸的比较中,最小和概率小于约0.2,更优选小于约0.01,和最优选小于约0.001,核酸被认为与参考序列相似。如在下文描述的,两条核酸序列或多肽基本上相同的指征是,由第一核酸编码的多肽与针对由第二核酸编码的多肽引起的抗体在免疫学上交叉反应。因此,多肽典型地与第二多肽相同基本上相同,例如,其中所述两个肽仅相差保守的置换。两条核酸序列基本上相同的另一个指征是两个分子或其互补序列在严格条件下彼此杂交。两条核酸序列基本上相同的又一个指征是同样的引物可以用于扩增所述序列。如在本文使用的,术语“核酸”和“多核苷酸”同义地使用并指从5’到3’末端读的脱氧核糖核苷酸或核糖核苷酸碱基的单链或双链聚合物。本发明的核酸将通常包含磷酸二酯键,尽管在一些情况下,可以使用核酸模拟物,所述核酸模拟物可以具有备选的主链,包括,例如,氨基磷酸酯,硫代磷酸酯,二硫代磷酸酯,或O-甲基磷酰胺连接(参见Eckstein,OligonucleotidesandAnalogues:APracticalApproach,OxfordUniversityPress);和肽核酸主链和连接。其它模拟物核酸包括具有正电主链,非离子主链和非核糖主链的那些。因此,核酸或多核苷酸还可以包括允许由聚合酶正确读通的修饰的核苷酸。“多核苷酸序列”或“核酸序列”包括核酸的作为个体单链或在双链体中的正义和反义链二者。如将被本领域技术人员理解的,单链的描述限定了互补链的序列;因此本文描述的序列也提供序列的互补序列。除非另有指示,特定核酸序列还隐含包括其变体(例如,简并密码子置换)和互补序列,以及明确指示的序列。所述核酸可以是DNA(基因组的和cDNA二者),RNA或杂合物,其中所述核酸可以包含脱氧核糖-和核糖-核苷酸的组合,和包括尿嘧啶,腺嘌呤,胸腺嘧啶,胞嘧啶,鸟嘌呤,肌苷,黄嘌呤次黄嘌呤,异胞嘧啶,异鸟嘌呤等的碱基的组合。如在本文使用的,措辞“编码…的核酸序列”指包含对于结构RNA(比如rRNA,tRNA),或特定蛋白或肽的主要氨基酸序列,或反式作用调控剂的结合位点的序列信息的核酸。该措辞具体包括天然序列或可以引入以与特定宿主细胞中的密码子偏爱一致的序列的简并密码子(即,编码单个氨基酸的不同密码子)。如在本文使用的,术语“特异结合”指通过指示乳糜泻存在的抗体捕获或诱捕本发明的抗原。因此,在指定的免疫测定条件下,抗体(例如,抗脱酰胺化麦醇溶蛋白抗体)以至少两倍于背景水平和更典型地已至少5,10,20,30,40,或50倍于背景水平结合本发明的抗原。可以使用多种免疫测定形式以确定抗体是否特异结合本发明的抗原。例如,固相ELISA免疫测定常规用于确定抗体是否与蛋白特异免疫反应(参见,例如,Harlow和Lane,UsingAntibodies,ALaboratoryManual(1998)foradescriptionofimmunoassayformatsandconditionsthatcanbeusedtodeterminespecificimmunoreactivity)。II.抗原本发明提供用于检测乳糜泻的抗原和方法。所述抗原包括固定在固体支持物物质上的麦醇溶蛋白融合蛋白。所述麦醇溶蛋白融合蛋白包括重组脱酰胺化麦醇溶蛋白和标签二者。所述抗原可以任选地包括组织转谷氨酰胺酶(tTG)。当存在时,在固定于固体支持物上之前,所述麦醇溶蛋白融合蛋白和tTG可以比如通过转酰胺基作用共价连接,以形成tTG-麦醇溶蛋白融合蛋白复合物。将tTG-麦醇溶蛋白融合蛋白复合物固定在固体支持物上之后,可用使用交联剂交联所述麦醇溶蛋白融合蛋白和所述tTG。在一些实施方案中,本发明提供用于检测乳糜泻的抗原。本发明的抗原包括下文描述的结合固体支持物的麦醇溶蛋白融合蛋白。在其它实施方案中,本发明提供用于检测乳糜泻的抗原。所述抗原包括具有肽六聚体的重组脱酰胺化麦醇溶蛋白,所述肽各自具有SEQIDNO:1的序列,其中所述重组脱酰胺化麦醇溶蛋白共价连接于标签以形成麦醇溶蛋白融合蛋白,其中所述麦醇溶蛋白融合蛋白固定在固体支持物上,并且其中所述重组脱酰胺化麦醇溶蛋白能够结合抗脱酰胺化麦醇溶蛋白抗体。A.麦醇溶蛋白融合蛋白用于本发明的麦醇溶蛋白融合蛋白包括表达为带标签的蛋白的重组脱酰胺化麦醇溶蛋白。本领域技术人员将认可很多重组麦醇溶蛋白用于本发明的方法。在一些实施方案中,所述重组麦醇溶蛋白可以包括D2(Aleanzi等人,ClinChem2001,47(11),2023),肽序列:QPEQPQQSFPEQERPF(SEQIDNO:1)。所述重组麦醇溶蛋白还可以包括由下式表示的D2变体:X1PX2X3PX4X5SFPX6X7X8RPF(SEQIDNO:12)其中每个X是谷氨酰胺(Q)或谷氨酸(E),这样以致至少一个X是谷氨酰胺并且至少一个X是谷氨酸。本发明的重组麦醇溶蛋白还可以是D2或其变体的六聚体。在一些实施方案中,所述重组麦醇溶蛋白是由任何合适的间隔区,比如GGGGS(SEQIDNO:2)分开的D2或其变体的六聚体。本领域技术人员将理解其它间隔区用于本发明。任何合适的间隔区用于本发明,并且与接头可互换。典型的肽间隔区序列包含Gly,Ser,Ala和Thr残基。有用的间隔区包括甘氨酸-丝氨酸聚合物,所述聚合物包括,例如,(GGGGS)n(SEQIDNO:13),(GS)n,(GSGGS)n(SEQIDNO:14),和(GGGS)n(SEQIDNO:15),其中n是至少为一的整数;甘氨酸-丙氨酸聚合物;丙氨酸-丝氨酸聚合物;和其它柔性接头。在一些实施方案中,所述六聚体包括将各个肽分开的间隔区,所述间隔区具有SEQIDNO:1的序列。在其它实施方案中,每个间隔区可以具有SEQIDNO:2的序列。在一些实施方案中,所述重组脱酰胺化麦醇溶蛋白是D2六聚体(SEQIDNO:3)。在一些其它的实施方案中,本发明提供编码SEQIDNO:1或SEQIDNO:3的序列中的多肽的任何核苷酸序列。本发明的重组脱酰胺化麦醇溶蛋白结合抗脱酰胺化麦醇溶蛋白抗体,并且因此能够诊断具有谷蛋白相关疾病(比如乳糜泻)的受试者。本领域技术人员将理解其它重组脱酰胺化麦醇溶蛋白用于本发明。所述麦醇溶蛋白融合蛋白还包括标签。任何本领域已知的标签用于本发明麦醇溶蛋白融合蛋白。本发明抗原中合适的标签包括,但不限于,谷胱甘肽S-转移酶(GST),His-标签,FLAG,StreptagII,HA-标签,Softag1,Softag3,c-myc,T7-标签,S-标签,类弹性蛋白肽,壳多糖-结合结构域,硫氧还蛋白,木聚糖酶10A,麦芽糖结合蛋白和NusA。在一些实施方案中,所述标签是谷胱甘肽S-转移酶(GST)或His-标签。本领域技术人员将理解其它标签用于本发明。所述标签典型地通过共价连接与重组麦醇溶蛋白连接。用于本发明的His-标签可以是任何合适的His-标签。适于本发明的His-标签包括,但不限于,SEQIDNO:4,SEQIDNO:5,或SEQIDNO:6的序列。在一些实施方案中,所述His-标签可以是SEQIDNO:5或SEQIDNO:6的序列。在其它实施方案中,所述重组脱酰胺化麦醇溶蛋白可以是SEQIDNO:7或SEQIDNO:8的序列。在另一个实施方案中,所述标签是谷胱甘肽S-转移酶(GST)蛋白。所述GST蛋白(SEQIDNO:10)行使很多功能,包括使重组麦醇溶蛋白的纯化和在重组麦醇溶蛋白中表示的表位的呈现可行。当包括GST和重组脱酰胺化麦醇溶蛋白的麦醇溶蛋白融合蛋白为D2六聚体时,麦醇溶蛋白融合蛋白由SEQIDNO:11的序列表示。在一些实施方案中,本发明提供编码SEQIDNO:11的序列中多肽的任何核苷酸序列。可以通过多种方法制备本发明的麦醇溶蛋白融合蛋白,包括通过重组方法(比如描述的那些)。麦醇溶蛋白融合蛋白在固体支持物上的固定可以通过本领域已知的任何方法获得。可以通过共价或离子键形成,氢键,范德华力,以及通过抗体-抗原相互作用将麦醇溶蛋白融合蛋白固定于固体支持物。本领域技术人员将理解其它固定方法用于本发明。在一些实施方案中,所述抗原还包括组织转谷氨酰胺酶(tTG)。当tTG存在时,所述tTG和麦醇溶蛋白融合蛋白形成tTG-麦醇溶蛋白融合蛋白复合物。所述tTG和所述麦醇溶蛋白融合蛋白可以以多种方式连接,比如通过共价键,离子键,氢键的形成,或通过范德华相互作用。当所述tTG和所述麦醇溶蛋白融合蛋白共价连接时,所述共价键可以通过多种反应,比如转酰胺基作用形成。所述转酰胺基作用可以在多种条件下,比如在Ca2+存在下发生。所述tTG可以连接于所述标签和麦醇溶蛋白融合蛋白的所述重组脱酰胺化麦醇溶蛋白之一或二者。所述tTG在如固定所述麦醇溶蛋白融合蛋白相同的条件下和相同的时间固定于固体支持物。组织转谷氨酰胺酶是本领域技术人员已知的并且在前已描述,参见NCBIRefSeqNP_004604和NP_945189(2008年4月13日)。在其它实施方案中,所述tTG和所述麦醇溶蛋白融合蛋白通过交联剂共价连接。本领域技术人员将理解比如通过离子键,氢键或通过范德华力的其它交联方法是可用的。本领域技术人员将认可在本发明中合适的任何交联剂。在一些实施方案中,所述交联剂是选自由异型双功能交联剂和同型双功能交联剂组成的组的成员。在进一步其它实施方案中,所述交联剂是同型双功能交联剂。在更进一步的其它实施方案中,所述交联剂是选自由以下各项组成的组的成员:二(磺基琥珀酰亚胺)辛二酸酯(BS3),乙二醇二[琥珀酰业胺琥珀酸酯](EGS),乙二醇二[磺基琥珀酰蛇胺琥珀酸酯](磺基-EGS),二[2-(琥珀酰亚氨基氧羰基氧)乙基]砜(BSOCOES),二硫二(琥珀酰亚胺)丙酸酯(DSP),3,3′-二硫二(磺基琥珀酰亚胺丙酸酯)(DTSSP),二琥珀酰亚胺辛二酸酯(DSS),二琥珀酰亚胺戊二酸酯(DSG),甲基N-琥珀酰亚胺己二酸酯(MSA),二琥珀酰亚胺酒石酸酯(DST),1,5-二氟-2,4-二硝基苯(DFDNB),1-乙基-3-[3-二甲基氨丙基]碳二亚胺盐酸盐(EDC或EDAC),磺基琥珀酰亚胺-4-(N-马来酰亚胺甲基)环己烷-1-羧酸酯(磺基-SMCC),N-羟基磺基琥珀酰亚胺(磺基-NHS),羟胺和磺基-LC-SPDP(N-琥珀酰亚胺3-(2-吡啶基二硫)-丙酸酯)和磺基琥珀酰亚胺6-(3′-[2-吡啶基二硫]-丙酰氨基)己酸酯(磺基-LC-SPDP)。在另一个实施方案中,所述交联剂是二(磺基琥珀酰亚胺)辛二酸酯(BS3)。在一个进一步的实施方案中,所述重组脱酰胺化麦醇溶蛋白具有与SEQIDNO:395%的同一性。本领域技术人员将理解,当比较和比对与表窗口或指定区域的最大的对应时,其它同一性百分数是可能的,比如60%同一性,优选相对指定区域65%,70%,75%,80%,85%,86%,87%,88%,89%,90%,91%,92%,93%,94%,95%,96%,97%,98%或99%同一性。此种序列随后被称为“基本上相同”。与SEQIDNO:3的序列具有一些同一性百分数的本发明的重组脱酰胺化麦醇溶蛋白可以结合样品中的抗麦醇溶蛋白抗体,以检测乳糜泻。在一些其它的实施方案中,所述重组脱酰胺化麦醇溶蛋白具有SEQIDNO:3的序列。B.固体支持物用于本发明的固体支持物物质通过以下性质表征:(1)不溶于用于筛选的液相;(2)能够不依赖于其它所有支持物在三个维度移动;(3)包含很多拷贝的麦醇溶蛋白融合蛋白或tTG-麦醇溶蛋白融合蛋白复合物;(4)与筛选测定条件的相容性;和(5)对测定条件是惰性的。优选的支持物还具有反应性功能基团,包括,但不限于,羟基,羧基,氨基,巯基,醛,卤素,硝基,氰基,酰胺基,脲,碳酸酯,氨基甲酸酯,异氰酸酯,砜,磺酸酯,磺胺,亚砜等,用于连接麦醇溶蛋白融合蛋白和tTG。如在本文使用的,固体支持物物质不限于支持物的特定类型。而是大量支持物是可用的并且是本领域普通技术人员已知的。固相支持物包括硅胶,树脂,衍生的塑料薄膜,珠(比如玻璃珠,塑料珠或磁珠),棉,氧化铝凝胶,多糖(比如琼脂糖等),等。其它固体支持物可以是ELISA微量滴定板。合适的固相支持物可以根据所需的最终用途和各种合成方案的适用性选择。例如,在聚酰胺合成中,有用的固相支持物可以是树脂比如聚苯乙烯(例如,获自BachemInc.,PeninsulaLaboratories的PAM-树脂,等),POLYHIPETM树脂(获自Aminotech,Canada),聚酰胺树脂(获自PeninsulaLaboratories),接枝有聚乙二醇的聚苯乙烯树脂(TentaGelTM,RappPolymere,Tubingen,Germany),聚二甲基-丙烯酰胺树脂(获自Milligen/Biosearch,California),或PEGA珠(获自PolymerLaboratories)。优选的用于特定合成的固相合成支持物在下文描述。在一些实施方案中,所述固体支持物是珠。本领域技术人员将认可很多类型的固体支持物用于本发明.C.制备重组脱酰胺化麦醇溶蛋白抗原的方法在一些实施方案中,本发明提供用于检测乳糜泻的通过以下方法制备的抗原,所述方法包括将固体支持物与麦醇溶蛋白融合蛋白接触,其中所述麦醇溶蛋白融合蛋白包括具有肽六聚体的重组脱酰胺化麦醇溶蛋白,所述肽各自具有SEQIDNO:1的序列并且其中所述重组脱酰胺化麦醇溶蛋白共价连接于标签,以致麦醇溶蛋白融合蛋白固定在固体支持物上。从而,制备用于检测乳糜泻的抗原。制备重组脱酰胺化麦醇溶蛋白抗原的方法可以制备上文描述的任何重组脱酰胺化麦醇溶蛋白抗原。所述标签在上文描述。在一些实施方案中,所述标签是GST或His-标签。在另一个实施方案中,所述标签是GST。在一些实施方案中,所述麦醇溶蛋白融合蛋白通过所述标签固定在固体支持物上。固体支持物为如以上描述的。在一些实施方案中,所述固体支持物是珠,比如磁珠。在一些实施方案中,所述固体支持物具有功能反应性基团。当tTG存在时,所述方法还可以包括在接触步骤之前,在麦醇溶蛋白融合蛋白和tTG之间形成共价键以形成tTG-麦醇溶蛋白融合蛋白复合物。在接触步骤过程中和/或接触步骤之后,在麦醇溶蛋白融合蛋白tTG间形成共价键的过程还可以发生。麦醇溶蛋白融合蛋白和tTG的复合可以通过本领域已知的任何方法发生。在一些实施方案中,所述复合通过转酰胺基作用发生以形成共价键。在其它实施方案中,所述方法进一步包含将固体支持物与交联剂接触以交联麦醇溶蛋白融合蛋白和tTG。在一些其它的实施方案中,所述交联剂将GST蛋白交联于tTG。本领域技术人员将理解任何交联剂在本发明的方法中是有用的,比如上文描述的那些。交联可以通过氢键,共价或离子键形成发生。1.一般重组方法本发明可以使用重组遗传学领域中的常规技术制备重组脱酰胺化麦醇溶蛋白多肽。公开在本发明中使用的一般方法的基础文字材料包括Sambrook&Russell,MolecularCloning,ALaboratoryManual(第三版,2001);Kriegler,GeneTransferandExpression:ALaboratoryManual(1990);和CurrentProtocolsinMolecularBiology(Ausubel等人,编辑,1994-1999).可以使用本领域公知的技术表达例如,包括重组脱酰胺化麦醇溶蛋白和标签(比如GST标签或His标签)的重组脱酰胺化麦醇溶蛋白,或融合蛋白。可以使用真核和原核宿主细胞,比如动物细胞,昆虫细胞,细菌,真菌和酵母。技术人员公知在表达分离的核酸中使用宿主细胞的方法,并可以例如,在同前的一般参考文献中找到该方法。因此,本发明还提供包括本文描述的核酸序列的宿主细胞和表达载体。可以使用标准重组或合成技术制备编码例如包括重组脱酰胺化麦醇溶蛋白和标签(比如GST标签或His标签)的重组脱酰胺化麦醇溶蛋白,或融合蛋白的核酸。核酸可以是RNA,DNA,或其杂合物。技术人员可以构建多种包含功能上相当的核酸(比如编码相同多肽的核酸)的克隆。完成这些目的的克隆方法,和验证核酸序列的测序方法是本领域公知的。在一些实施方案中,体外合成所述核酸。可以根据由Beaucage&Caruthers,TetrahedronLetts.22(20):1859-1862(1981)描述的固相亚磷酰胺三酯方法,使用,例如,如在Needham-VanDevanter,等人,NucleicAcidRes.12:6159-6168(1984)描述的自动合成仪化学合成脱氧核苷酸。在其它实施方案中,编码所需蛋白的核酸可以通过扩增反应,例如,PCR获得。技术人员将认可很多其它产生给定多肽序列的改变或变体的方式。最常见的,通过改变相应核酸序列和表达多肽改变多肽序列。技术人员可以基于本文涉及的序列和本领域容易获得的关于重组脱酰胺化麦醇溶蛋白结构和功能的知识,选择本发明所需的核酸或多肽。对于熟练的从业者,这些蛋白的物理特性和一般性质是已知的。为了获得包括重组脱酰胺化麦醇溶蛋白和标签(比如GST标签或His标签)的重组脱酰胺化麦醇溶蛋白,或融合蛋白的高水平表达,构建表达载体,所述表达载体包括元件如启动子以引导转录,转录/翻译终止子,用于翻译起始的核糖体结合位点等。合适的细菌启动子是本领域公知的并描述于,例如,上文引用的提供表达克隆方法和方案的参考文献中。用于表达核糖核酸酶的细菌表达系统在,例如,大肠杆菌(E.coli),芽胞杆菌(Bacillussp.),沙门氏菌(Salmonella)中可获得(还参见Palva,等人,Gene22:229-235(1983);Mosbach,等人,Nature302:543-545(1983)。用于此种表达系统的试剂盒是可市购的。用于哺乳动物细胞,酵母和昆虫的真核表达系统是本领域公知的并且也是可市购的。除了启动子之外,表达载体典型地包括含有对于核酸在宿主细胞中表达所需的所有其它元件的转录单元或表达盒。典型的表达盒因此包含可操作连接于编码重组脱酰胺化麦醇溶蛋白或融合蛋白(例如,重组脱酰胺化麦醇溶蛋白-GST融合蛋白)的核酸序列的启动子,和转录本的有效多腺苷酸化所需的信号,核糖体结合位点,和翻译终止。依赖于所述表达系统,编码重组脱酰胺化麦醇溶蛋白或融合蛋白(例如,重组脱酰胺化麦醇溶蛋白-GST融合蛋白)的核酸序列可以连接于可切割信号肽序列以促进由转化的细胞分泌编码的蛋白。如上文指出的,所述表达盒还应该在结构基因的下游包含转录终止区域以提供有效的终止。终止区域可以获自与启动子序列相同的基因或可以获自不同的基因。用于转运遗传信息到细胞中的特定表达载体不是特别至关重要的。可以使用用于在真核或原核细胞表达的任何常规载体。标准的细菌表达载体包含质粒,比如基于pBR322的质粒,pSKF,pET15b,pET23D,pET-22b(+),和融合表达系统,比如GST和LacZ。还可以向重组蛋白添加表位标签(例如,6-his)以提供分离的方便方法。除了包含编码序列,T7启动子,转录起始子和终止子的表达盒之外,这些载体还包含,pBR322复制起始位点,bla编码序列和lac1操纵子。可以在多种宿主细胞中表达包括编码RNase分子或融合蛋白的核酸序列的载体,所述宿主细胞包括大肠杆菌,其它细菌宿主,酵母,和各种高等真核细胞,比如COS,CHO和HeLa细胞系和骨髓瘤细胞系。除了细胞之外,可以通过转基因动物,优选绵羊,山羊和牛表达载体。典型地,在该表达系统中,在转基因动物的乳液中表达重组蛋白。通过公知的方法,比如对于大肠杆菌的氯化钙转化和对于哺乳动物细胞的磷酸钙处理,脂质体融合或电穿孔将本发明的表达载体或质粒转移至选择的宿主细胞中。可以通过由质粒上包含的基因(比如amp,gpt,neo和hyg基因)提供的对抗生素的抗性选择被质粒转化的细胞。一经表达,可以根据本领域的标准工序(包括硫酸铵沉淀,柱层析(包括亲和层析),凝胶电泳等)纯化表达的蛋白(通常参见,R.Scopes,ProteinPurification,Springer--Verlag,N.Y.(1982),Deutscher,MethodsinEnzymologyVol.182:GuidetoProteinPurification.,AcademicPress,Inc.N.Y.(1990);Sambrook和Ausubel,二者都同前。在一些实施方案中,本发明提供包括SEQIDNO:9的序列的分离的核酸,其编码重组麦醇溶蛋白蛋白D2六聚体序列。在其它实施方案中,所述分离的核酸在表达载体中。在一些其它的实施方案中,所述表达载体在宿主细胞中。2.在固体支持物上的固定本发明的麦醇溶蛋白融合蛋白可以通过本领域已知的有用的固定方法固定于任何有用的固体支持物物质。可以通过共价或离子键形成,氢键,范德华力,以及通过抗体-抗原相互作用将麦醇溶蛋白融合蛋白固定于固体支持物。本领域技术人员将理解其它固定方法用于本发明。已经开发了使能够以类似于抗体的方式固定的其它化合物。某些这些“抗体模拟物”使用非免疫球蛋白的蛋白骨架作为用于抗体可变区的备选蛋白框架区。例如,Ladner等人(美国专利5,260,203)描述了具有类似于聚集的,但分子状态上分离的,抗体轻和重链可变区的结合特异性的单多肽链结合分子。所述单链结合分子包含通过肽接头连接的抗体的重和轻链可变区二者的抗原结合位点并且将折叠为类似两个肽抗体结构的结构。所述单链结合分子相对常规抗体显示一些优势,包括,更小的尺寸,更好的稳定性并且更易于修饰。Ku等人(Proc.Natl.Acad.Sci.U.S.A.92(14):6552-6556(1995))公开了基于细胞色素b562的抗体的备选方案。Ku等人(1995)建立了细胞色素b562的两个环随机化的文库,并选择针对牛血清白蛋白的结合。发现个体突变体选择性结合BSA,类似于抗BSA抗体。Lipovsek等人(美国专利6,818,418和7,115,396)公开了抗体模拟物,其以纤连蛋白或类纤连蛋白的蛋白骨架和至少一个可变环为特征。被称为Adnectins,这些基于纤连蛋白的抗体模拟物展现很多与天然或工程抗体相同的特性,包括对任何靶配体的高亲和力和特异性。可以使用这些抗体模拟物用于进化新的或改善的结合蛋白的任何技术。这些基于纤连蛋白的抗体模拟物的结构类似于IgG重链可变区的结构。因此,这些模拟物显示在性质上类似的抗原结合性质和类似于天然抗体的亲和力。进一步地,这些基于纤连蛋白的抗体模拟物展现某些相对抗体和抗体片段的益处。例如,这些抗体模拟物对于天然折叠稳定性不依赖于二硫键,并且因此在通常破坏抗体的条件下稳定。此外,因为这些基于纤连蛋白的抗体模拟物的结构类似于IgG重链的结构,因此可以体外使用环的随机化和改组(shuffling)过程,其类似于抗体的体内亲和力成熟过程。Beste等人(Proc.Natl.Acad.Sci.U.S.A.96(5):1898-1903(1999))公开了基于脂钙蛋白骨架的抗体模拟物脂钙蛋白由具有在蛋白末端的四个高变环的β-桶构成。Beste(1999),将所述环随机突变并且选择与例如,荧光素的结合。三个变体展示与荧光素的特异结合,其中一个变体显示类似于抗荧光素抗体的结合。进一步分析揭示所有随机化的位置是可变的,表明将适于用作抗体的备选物。是小的,单链肽,典型地有介于160和180之间的残基,其提供一些相对抗体的优势,包括减少的生产成本,增加的储藏稳定性和减少的免疫反应。Hamilton等人(美国专利5,770,380)公开了使用刚性的环芳烃的非肽有机骨架的合成的抗体模拟物,所述骨架与多个用作结合位点的可变肽环连接。所述肽环全都几何学上从环芳烃的同侧伸出,彼此互不干扰。由于该几何学确认,所有环可用于结合,增加对于配体的结合亲和力。然而,在与其它抗体模拟物的比较中,所述基于环芳烃的抗体模拟物不仅由肽构成,并且因此其不易于被蛋白酶攻击。骨架不完全由肽,DNA或RNA构成,意味着该抗体模拟物在极端环境条件下相对稳定并且具有长的寿命。进一步地,因为基于环芳烃的抗体模拟物相对小,其不太可能产生免疫应答。Murali等人(CellMolBiol49(2):209-216(2003))讨论了将抗体简化为更小的模拟肽的方法,他们称其为“类抗体结合模拟肽”(ABiP),其也可以用作抗体的备选物。除了非免疫球蛋白的蛋白框架区之外,已经以包含RNA分子和非天然寡聚物的化合物(例如,蛋白酶抑制剂,苯二氮,嘌呤衍生物和β-转角模拟物)模拟抗体性质。备选地,已知的,例如,链霉亲和素和生物素之间的结合相互作用,可以用于将麦醇溶蛋白融合蛋白结合于固体支持物。用于将麦醇溶蛋白融合蛋白连接于固体支持物的其它方法包括使用同型双功能和异型双功能接头。零长度交联试剂诱导两个配体的直接缀合而不引入任何外来物质。催化二硫键形成的试剂属于该目录。另一个实例是诱导羧基和主要氨基基团缩合以形成酰胺键的试剂,比如碳二亚胺,氯甲酸乙酯,Woodward’s试剂K1,羰二咪唑,等。同型双功能试剂携带两个相同的功能基团,而异型双功能试剂包含两个不相似的功能基团。大多数异型双功能交联剂包含主要的酰胺反应基团和巯基反应基团。由Heindel,N.D.等人,BioconjugateChem.2,427-430(1991)公开了对于甲酰与巯基偶联的新颖的异型双功能接头。在一个优选的实施方案中,共价交联剂选自能够形成二硫桥(-S-S-),乙二醇桥(-CH(OH)-CH(OH)-),偶氮桥(-N=N-),砜桥(-S(=O2)-),或酯桥(-C(=O)-O-)的试剂。用Luminex染料内部染色的,存在于顺磁乳胶珠表面上的羧酸基团,可以通过N-环己基-N′-(2-吗啉乙基)碳二亚胺甲基-p-甲苯磺酸酯(CMC)和N-羟基琥珀酰亚胺(NHS)的作用转变为N-羟基琥珀酰亚胺酯。磁性分离和洗涤后,将麦醇溶蛋白融合蛋白和tTG的混合物加入去污剂和包含10mMCaCl2的pH7.4的缓冲盐水。悬液在室温震荡孵育1小时。洗涤后,封闭珠以减少非特异结合并随后储存于粒子稀释剂。III诊断具有乳糜泻的受试者的方法在一些实施方案中,本发明提供诊断具有乳糜泻的受试者的方法。所述方法包括将来自受试者的体液样品与本发明的抗原接触,所述抗原包括含有六聚体的重组脱酰胺化麦醇溶蛋白,所述六聚体具有SEQIDNO:3的序列。所述方法还包括检测任何特异结合抗原的抗体,从而表明受试者中乳糜泻的存在。本发明的样品可以是任何体液。在一些实施方案中,所述样品可以是水质的体液,胆汁,血液和血浆,母乳,间质液,淋巴液,粘液,胸膜液,脓液,唾液,血清,汗液,泪液,尿液,脑脊液,滑液或胞内液。在一些实施方案中,所述样品是血液样品。本发明的受试者可以是任何哺乳动物。在一些实施方案中,所述受试者可以是灵长类(例如,人),牛,绵羊,山羊,马,狗,猫,兔,大鼠,小鼠,等。在其它实施方案中,所述受试者是人。可以通过本领域已知的任何方法检测结合于固体支持物固定的麦醇溶蛋白融合蛋白或tTG-麦醇溶蛋白融合蛋白复合物的抗体的存在。在一些实施方案中,检测步骤可以使用测定(比如ELISA,RIA或免疫荧光测定)进行。在其它实施方案中,检测步骤可以使用酶促方法进行。可以在检测步骤使用的免疫测定包括,例如,竞争和非竞争测定系统,比如蛋白质印迹,放射免疫测定,ELISA(酶联免疫吸附测定),“夹心”免疫测定,免疫沉淀测定,沉淀素反应,凝胶扩散沉淀素反应,免疫扩散测定,凝集试验,补体结合试验,免疫放射测定试验,荧光免疫测定,蛋白A免疫测定,等。参见,例如,Harlow和Lane,UsingAntibodies,ALaboratoryManual,ColdSpringHarborLaboratory,NewYork(1999)。特异于抗原的抗体可以是任何合适的抗体。在一些实施方案中,所述抗体可以是IgA,IgD,IgE,IgG或IgM。在其它实施方案中,所述抗体可以是IgG或IgA。本领域技术人员将理解其它抗体用于本发明。IV试剂盒在一些实施方案中,本发明提供试剂盒,所述试剂盒包括如上文描述的抗原,其中所述重组脱酰胺化麦醇溶蛋白包括与SEQIDNO:3序列基本上相同的或具有SEQIDNO:3序列的六聚体,检测试剂,和任选地缓冲剂,盐,稳定剂和说明书中的至少一种。用于本发明的缓冲剂,盐和稳定剂包括技术人员已知的那些,并可以在Gennaro,编辑,Remington’sPharmaceuticalSciences,第18版,MackPublishingCo.(Easton,Pa.)1990中找到。V实施例实施例1.带有His标签的D2-六聚体的纯化可以使用天然或变性条件纯化带有His标签的D2-六聚体。在本实施例中,在用8M脲的变性条件纯化D2-六聚体。制备了“典型的”带有His标签的D2-六聚体,其中所述蛋白具有SEQIDNO:7的序列。此外,制备了“包含赖氨酸的”带有His标签的D2-六聚体,其中所述蛋白具有SEQIDNO:8的序列。典型的重组六聚体的纯化。将来自6升过表达六聚体的大肠杆菌培养物的溶解的细胞以约5ml/g湿重悬于平衡缓冲液(100mMNaH2PO4,8M脲,500mMNaCl,10mM咪唑,pH8.0)。室温搅拌30分钟之后,通过离心除去细胞碎片。将约200ml上清加入25ml用平衡缓冲液预洗涤的Ni-NTA树脂,并在室温混合60分钟。从未结合的细胞溶菌液分离结合于树脂的六聚体蛋白,然后用100ml洗涤缓冲液(100mMNaH2PO4,8M脲,500mMNaCl,20mM咪唑,0.5%TritonX100,pH8.0)洗涤四次。在从树脂移除洗涤缓冲液之后,用四体积的20ml洗脱缓冲液(100mMNaH2PO4,8M脲,200mMNaCl,250mM咪唑,pH7.5)洗脱结合的六聚体蛋白。汇集洗脱的蛋白级分,浓缩,并用10mMMOPS,150mMNaCl(pH7.4)透析。通过在15kxg离心移除观察到的任何沉淀。可以进一步用尺寸排阻柱,用10mMMOPS,150mMNaCl(pH7.4)纯化亲和纯化的蛋白,用UV在230nm监控。汇集并浓缩包含第一主峰的级分。包含赖氨酸的D2-六聚体重组蛋白的纯化方法与典型的重组六聚体的纯化方法相同。纯化的典型或包含赖氨酸的六聚体蛋白的表征。通过SDS-PAGE凝胶电泳分析亲和纯化的蛋白(图1)。通过SDS-PAGE分析在如上文描述的尺寸排阻柱上进一步纯化的D2-六聚体(图1)。出乎意料的,两种六聚体(典型的和包含赖氨酸的)显示大约45kd的主带,与六聚体蛋白的三聚体的大小相应。六聚体的该聚集这么强,以至于在用于SDS-PAGE的变性条件下不分离。此外,在尺寸排阻色谱中,两种六聚体蛋白在约45kd的位置的迁移。不限制于特定理论,六聚体的另人惊讶的聚集以形成六聚体的三聚体的倾向可以促进D2六聚体的改善的免疫反应性。实施例2.重组脱酰胺化麦醇溶蛋白抗原的制备本实施例提供用于制备“典型的”His-标签标记的重组脱酰胺化麦醇溶蛋白(SEQIDNO:7)的方案。重组脱酰胺化麦醇溶蛋白肽(DGP)抗原在磁珠上的固定将10mg羧基修饰的磁珠置于微量离心管中。向管中加入1000μL于70%乙醇(EtOH)中50mM2-(N-吗啉)乙磺酸(MES)pH6.1。涡旋管并且磁性分离珠。吸出上清并弃去。再重复一次该洗涤步骤。将500μL的溶于含有50mMMES,pH6.1的70%EtOH中的120mMN-羟基琥珀酰亚胺(NHS)加入含有珠的管并混合。将500μL溶于含有50mMMES,pH6.1的70%EtOH的N-环己基-N′-(2-吗啉乙基)碳二亚胺甲基-p-甲苯磺酸酯(CMC)加入具有珠的相同的管并混合。在室温孵育管30分钟,同时不断混合。将珠从上清中分离并且加入1000μL溶于10%EtOH的5mMMESpH6.1。混合珠,磁性分离并且吸出上清并弃去。再重复一次该洗涤步骤。通过加入250μL的5mMMESpH6.1重悬洗涤的珠并混合。将重组DGP抗原(如之前描述制备的)在珠偶联缓冲液(包含去污剂的缓冲盐水)中混合以获得加入珠的5μg/mg的包被浓度。将该混合物在室温孵育60分钟,伴之以连续混合。将1000μL的包被后洗涤缓冲液(包含去污剂,氯化钙和防腐剂的缓冲盐水)加入管并混合。磁性分离珠并吸出上清并弃去。再重复该过程3次。珠封闭将1000μL封闭缓冲液(包含去污剂,氯化钙,防腐剂和封闭剂的缓冲盐水)加入管。在2-8℃孵育管并混合。在孵育的最后磁性分离珠并且吸出上清并弃去。通过向管中加入1000μL粒子稀释剂用粒子稀释剂(包含去污剂,氯化钙,防腐剂和封闭剂的缓冲盐水)洗涤珠。混合珠并且磁性分离珠并且吸出上清并弃去。重复该过程3次以上。将1000μL粒子稀释剂(100μL/mg粒子)加入管并在该缓冲液中储藏于2-8℃。实施例3.使用重组DGP抗原检测乳糜泻本实施例提供用于使用典型His-标签标记的重组脱酰胺化麦醇溶蛋白(SEQIDNO:7)作为抗原检测乳糜泻的方法。乳糜泻病IgA和IgG免疫测定方案的概要:仪器,BioPlex2200(由Bio-RadLaboratories制造)从样品管中吸取5μL样品并分配入追加有45μL洗涤缓冲液(包含去污剂和防腐剂的磷酸缓冲盐水)反应容器(RV)。将100μL样品稀释液(包含去污剂,防腐剂和封闭剂的缓冲盐水)加入RV,随后加入150μL洗涤缓冲液。在37℃孵育RV130秒。将100μL粒子试剂(于粒子稀释液中的重组脱酰胺化麦醇溶蛋白包被的珠的溶液)加入RV。最终样品稀释度为1/80。将该混合物在37℃孵育1180秒,伴之以间断混合。用600μL,随后300μL,随后600μL的洗涤缓冲液洗涤珠三次,每次洗涤之后磁性分离。将50μL缀合试剂(于缀合稀释液(包含去污剂,防腐剂和封闭剂的缓冲盐水)中的抗人IgA/IgG-藻红蛋白混合物)加入RV。将混合物在37℃孵育600秒,同时间断混合。用600μL,随后300μL,随后600μL的洗涤缓冲液洗涤珠三次,每次洗涤之后磁性分离。将50μL洗涤缓冲液加入RV以重悬珠。将珠重悬液吸入LuminexDetectormodule(LDM)并且测量每个指定的珠区域的粒子的荧光中值。图2显示DGP典型六聚体的包被滴定。乳糜泻病测试中的灵敏度表1显示对于正常和乳糜泻阳性样品在不同DGP六聚体浓度下检测的信号量(相对荧光强度,RFI)。表1.对于“典型”DGP的RFI和DGP包被浓度乳糜泻样品的分析以下一致性研究由62个乳糜泻病样品组成。表2显示DGP六聚体和判定(Predicate)方法的比较结果。表2.使用“典型”DGP的62个乳糜泻病样品的一致性研究对正常和乳糜泻患者样品使用DGP六聚体测量相对荧光强度(RFI)(表3)。通过抗体指数(AI)评估患者免疫反应性,其中阳性反应性为>1.0。表3.对于正常和乳糜泻患者样品使用“典型”DGP的RFI和AI数据实施例4.使用具有额外赖氨酸的重组DGP抗原检测乳糜泻在本实施例中,测试“包含赖氨酸的”D2六聚体蛋白(具有在接近N端区域的位置14用赖氨酸置换谷氨酸残基的His-标签标记的重组脱酰胺化麦醇溶蛋白肽)(SEQIDNO:8)对于乳糜泻的灵敏度。以如在实施例2中描述的相同方式完成该抗原在磁珠上的固定。图3显示包含赖氨酸的DGP六聚体的包被滴定。使用该抗原通过免疫测定检测乳糜泻以如在实施例3中对于“典型”六聚体蛋白描述的相同的方式进行。乳糜泻病测试中的灵敏度表4显示在不同DGP六聚体浓度下对于正常和乳糜泻阳性样品的RFI。表4.对于“包含赖氨酸的”DGP的RFI和DGP包被浓度乳糜泻样品的分析表5显示对于正常和乳糜泻患者样品如由DGP六聚体测量的相对荧光强度(RFI)。通过抗体指数(AI)评估患者免疫反应性,其中阳性反应性为>1.0。表5.对于正常和乳糜泻患者样品使用“包含赖氨酸的”DGP的RFI和AI数据实施例5.DGP三聚体相对DGP六聚体的比较研究以下一致性研究由比较了DGP六聚体相对于之前描述的麦醇溶蛋白抗原(D2三聚体重组融合蛋白(之前在US2009/0311727中描述,本文通过引用并入))的预测值的62个乳糜泻病样品组成。DGP六聚体相对DGP三聚体显示改善的阳性一致和总一致(表6)。这些结果证明与DGP三聚体比较时,DGP六聚体改善的灵敏度。表6.比较一致性研究与DGP三聚体比较(其产生很多假阳性结果),DGP六聚体还另人惊讶地显示改善的特异性。通过使用DGP六聚体排除该问题。。表7显示来自407个正常样品的筛选的数据。DGP三聚体给出25%的假阳性,而DGP六聚体仅给出0.5%假阳性。对于假阳性检测的特异性≤1%。表7.正常样品的筛选DGP三聚体DGP六聚体总样品407407假阳性1022图4a和4b显示与DGP三聚体相比改善的DGP六聚体的性能。在这些研究中,DGP六聚体的珠包被浓度比DGP三倍体小5倍,而截止值RFI信号相同。与重组DGP三聚体相比,在IgA(图4a)和IgG(图4b)两种测定中,重组DGP六聚体都具有改善的灵敏度。尽管为了理解清楚的目的已通过说明和实施例比较详细得描述了在前的发明,本领域技术人员将理解可以在附加的权利要求的范围内实施某些改变和修饰。此外,本文提供的各个参考文献以如每个参考文献单独通过引用并入相同的程度以其整体通过引用并入本文。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1