一种恶性腹水来源的TIL细胞的分离培养方法与流程
本发明属于细胞培养技术领域,涉及恶性腹水来源的TIL细胞(肿瘤浸润淋巴细胞)的分离培养方法。
背景技术:
肿瘤浸润淋巴细胞(TIL)是存在于肿瘤组织、肿瘤引流淋巴结、癌性胸腹水中的淋巴细胞,相比于外周血淋巴细胞,TIL细胞中含有较高比例的活化的肿瘤特异性T淋巴细胞,这一类淋巴细胞经过体外分离、扩增、活化后,对肿瘤细胞的杀伤活性提高,可用于肿瘤的过继细胞免疫治疗。
使用这种技术已经取得了良好的临床效果。Rosenberg等采用全身放疗+化疗+TIL细胞治疗恶性黑色素瘤,总有效率达到了72%(Rosenberg SA1,Dudley ME.Adoptive Cell Therapy for the Treatment of Patients with Metastatic Melanoma.Curr Opin Immunol.2009Apr;21(2):233-240.);Li J等采用化放疗+TIL细胞治疗鼻咽癌,20人中有19人有客观的抗肿瘤反应(Li J1,Chen QY2,He J1,Li ZL1,Tang XF1,Chen SP1,Xie CM3,Li YQ1,Huang LX1,Ye SB1,Ke M1,Tang LQ2,Liu H2,Zhang L2,Guo SS2,Xia JC1,Zhang XS1,Zheng LM1,Guo X2,Qian CN2,Mai HQ2,Zeng YX4.Phase I trial of adoptively transferred tumor-infiltrating lymphocyte immunotherapy following concurrent chemoradiotherapy in patients with locoregionally advanced nasopharyngeal carcinoma.Oncoimmunology.2015Mar 6;4(2):e976507.eCollection 2015.);Khammari A等用TIL细胞结合瘤内注射表达IFN-r的腺病毒治疗恶心黑色素瘤,取得了46%的疾病控制率(Khammari A1,Nguyen JM,Saint-Jean M,Knol AC,Pandolfino MC,Quereux G,Brocard A,Peuvrel L,Saiagh S,Bataille V,Limacher JM,Dreno B.Adoptive T cell therapy combined with intralesional administrations of TG1042(adenovirus expressing interferon-γ)in metastatic melanoma patients.Cancer Immunol Immunother.2015Apr 7.)。
目前临床应用的TIL细胞的来源主要有两个方面:1.手术切除的肿瘤组织或淋巴结;2.癌性胸腹水。从手术样品中分离TIL细胞一般需要经过机械剪切,多种蛋白酶的酶解等多个步骤;癌性胸腹水来源的TIL细胞分离的方法相对简单,也容易在体外培养。
由于TIL细胞是一种异质性的细胞群,包含T细胞、B细胞、NK细胞等,其中发挥抗肿瘤作用的主要是活化的肿瘤特异性T淋巴细胞,因此TIL细胞治疗的关键技术是如何从TIL中筛选出活化的肿瘤特异性T淋巴细胞并进行扩增培养。
传统的TIL细胞分离和培养步骤复杂,整个操作时间将近2个月,其中分离和鉴定肿瘤特异性TIL细胞的过程最复杂、耗时最长。首先需要将肿瘤组织制作成小块组织或单细胞悬液,分成很多小份然后用大剂量IL-2培养,培养4-6个星期后,每份取少量细胞与肿瘤细胞进行共培养,通过测试共培养后的上清中IFN-r的含量确定哪一份里面有肿瘤特异性T淋巴细胞。然后取这些孔内的细胞进行快速扩增培养。这种操作方法步骤复杂,时间长,而且分离过程易受操作者主观因素的影响,不同的操作者操作的结果差别很大。长时间的操作过程容易导致污染,且细胞活力降低。因此很大程度地影响了TIL细胞临床应用的效果。
因此TIL治疗的两大关键的技术,一是要从恶性腹水中找到肿瘤抗原特异性的T淋巴细胞,并把它分离出来;二是要把这些珍贵的T淋巴细胞进行大量扩增。要把具有肿瘤特异性杀伤活性的肿瘤特异性T淋巴细胞从肿瘤组织中分离出来,需要用到一个可以区分肿瘤特异性T淋巴细胞的表面标记。肿瘤组织中的肿瘤抗原特异性T淋巴细胞是一种已经活化了的T淋巴细胞,PD-1、LAG-3和TIM-3都是T细胞活化后诱导表达的抑制性受体,与其配体结合后抑制T细胞的活化和功能。TIL细胞中具有肿瘤特异性杀伤活性的T淋巴细胞就存在于这一群已经活化了的T淋巴细胞中(Alena Gros etc.PD-1identifies the patient-specific CD8+tumor-reactive repertoire infiltrating human tumors.The Journal of Clinical Investigation.Volume 124Number 5May 2014)。因此PD-1、LAG-3和TIM-3都可以作为分离TIL细胞中肿瘤特异性T淋巴细胞的标记。
免疫磁珠(Immunomagnetic bead,IMB)技术是一种免疫学技术,IMB为包被有抗体的球型磁性微粒,可特异性地与靶物质结合使之具有磁响应性。IMB技术的优势在于可以保证被分离靶细胞的形态和功能完整,同时还具有灵敏度高、特异性高、检测速度快、重复性好、操作简单和不需要昂贵的仪器设备等优点。用IMB技术进行细胞分离由两种方式,一种是直接从细胞混合液中分离出靶细胞的方法称为阳性分离;用IMB去除无关细胞使靶细胞得以纯化的方法称为阴性分离。因此利用免疫磁珠将具有肿瘤特异性杀伤活性的肿瘤特异性T淋巴细胞从TIL细胞群中直接分离出来。
目前未有文献报道利用PD-1、LAG-3和TIM-3中的至少一种作为分离TIL细胞中肿瘤特异性T淋巴细胞的标记,并结合免疫磁珠技术将肿瘤特异性T淋巴细胞从TIL细胞群中分离出来,再经过体外高效扩增获得肿瘤特异性TIL细胞的方法。
技术实现要素:
本发明的目的在于针对现有技术分离培养TIL细胞操作复杂、耗时、长时间的操作过程容易导致污染、细胞活力降低的不足,提供了一种TIL细胞的分离培养方法,该方法将具有肿瘤特异性杀伤活性的肿瘤特异性T淋巴细胞从TIL细胞群中分离出来并进行大量扩增培养,操作流程更简单,花费时间明显缩短,便于推广使用,分离得到的肿瘤特异性TIL细胞杀伤活性更强。
本发明的技术方案是:步骤一,单细胞悬液的制备,即从恶性腹水中获取含有肿瘤特异性T淋巴细胞的单细胞悬液;步骤二:使用免疫磁珠技术将所述单细胞悬液进行分离,即将肿瘤特异性T淋巴细胞从肿瘤细胞、肿瘤非特异性T淋巴细胞、抑制性T淋巴细胞、成纤维细胞等混合体中分离出来,得到肿瘤特异性TIL细胞;步骤三:肿瘤特异性TIL细胞的快速扩增,即将所述肿瘤特异性TIL细胞在高效扩增培养体系中进行高效扩增培养,得到大量的具有特异性杀伤肿瘤细胞活性的肿瘤特异性TIL细胞。
优选的,步骤一中,所述单细胞悬液的制备,具体包括如下步骤:
恶性腹水用D-Hanks平衡盐溶液洗涤,用Ficoll密度梯度法分离单个核细胞,得到肿瘤组织单细胞悬液。
优选的,步骤二中,所述使用免疫磁珠技术将所述单细胞悬液进行分离,具体包括如下步骤:
2.1往步骤一所得肿瘤组织单细胞悬液中按每1×108个细胞加入0.4ml PBS缓冲溶液、10-500ul生物素标记或荧光染料标记(包括Cy5/Anti-Alexa Fluor 647、Cy7、FITC、PE、APC等标记)或未标记的PD-1、LAG-3、TIM-3的抗体溶液中的至少一种、10-500ul Fc受体阻断剂、与抗体标记相对应的20-1000ul抗生物素磁珠或抗荧光染料磁珠(包括Anti-Cy5/Anti-Alexa Fluor647MicroBeads、Anti-Cy7MicroBeads、Anti-FITC MicroBeads、Anti-PE MicroBeads、Anti-APC MicroBeads)或抗Ig磁珠,混匀,重悬得细胞悬液。
2.2将所述细胞悬液加入到细胞分选柱中,利用磁性分离器收集肿瘤特异性TIL细胞。
优选的,步骤三中,所述肿瘤特异性TIL细胞的快速扩增,具体包括如下步骤:
1.将步骤二得到的肿瘤特异性TIL细胞与下列试剂和因子混合培养:CM和AIM-V混合培养基,异体辐射致死(50Gy)的PBMC,OKT3抗体。
2.第2天加入IL-2 100-10000IU/ml。
3.根据细胞数进行扩瓶(袋)培养,培养基为含IL-2的CM和AIM-V混合培养基。
4.扩增培养到第7-30天,得到最终的大量的肿瘤特异性TIL细胞。
优选的,步骤三中,所述CM和AIM-V混合培养基为CM培养基、AIM-V培养基按照1:1的比例混合而成。
优选的,步骤三中,所述异体辐射致死(50Gy)的PBMC与所述肿瘤特异性TIL细胞的比值为10:1-1000:1。
优选的,步骤三中,所述OKT3抗体,按每1.0ml培养基加入0.01-0.1ug OKT3抗体的比例。
使用本发明涉及的分离培养方法分离培养的肿瘤特异性TIL细胞用于肿瘤的治疗或预防。
与现有技术相比,本发明具有如下的有益效果:
1.本发明TIL细胞的分离培养方法更简单,细胞培养周期明显缩短,大大降低培养成本;
2.本发明利用免疫磁珠技术分离肿瘤特异性T淋巴细胞,相比现有技术使分离时间由4-5个星期缩短到1天,而且操作流程更简单,便于推广使用。
3.本发明利用活化的T细胞表达的抑制性受体将肿瘤特异性T淋巴细胞从复杂的细胞群中分离出来,增加了分离的针对性,使最终培养得到的肿瘤特异性TIL细胞的肿瘤杀伤活性更强。
附图说明
图1为实施例1与对比例1得到的TIL细胞杀瘤实验的结果;
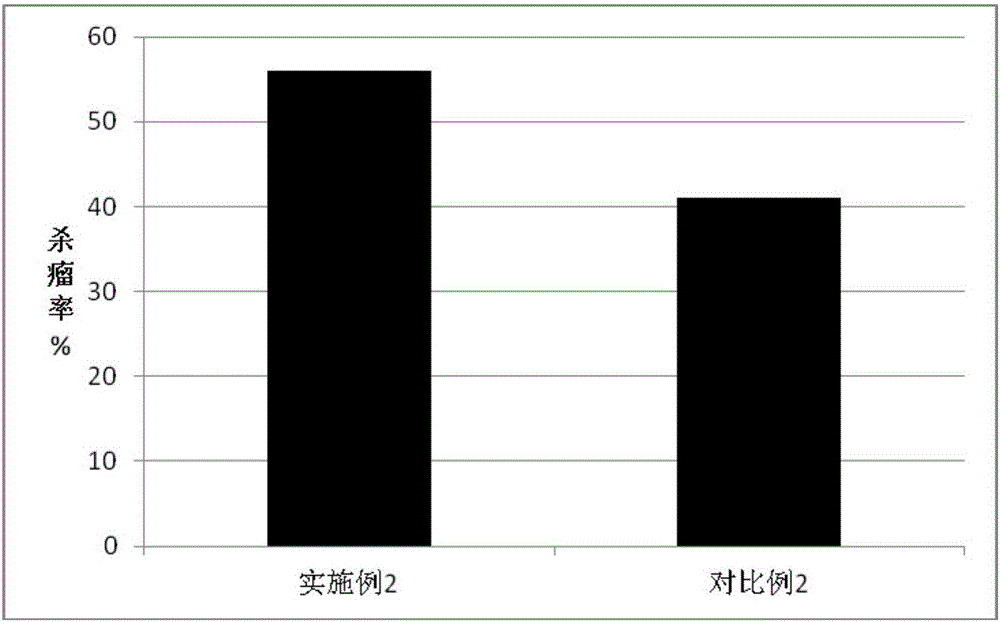
图2为实施例2与对比例2得到的TIL细胞杀瘤实验的结果;
图3为实施例3与对比例3得到的TIL细胞杀瘤实验的结果;
图4为实施例4与对比例4得到的TIL细胞杀瘤实验的结果;
图5为实施例5、6得到的TIL细胞杀瘤实验的结果;
具体实施方式
以下通过实施例对本发明作进一步的说明,但本发明并不限于这些具体实施方式。
实施例1
现取一肝癌患者(女,48岁)恶性腹水为制备肿瘤特异性TIL细胞的材料,肿瘤特异性TIL细胞分离培养过程如下:
步骤1:单细胞悬液的制备。
1.2腹水用D-Hanks溶液洗2次,沉淀细胞加入适量PBS缓冲溶液(含0.5%BSA,2mmol EDTA,PH 7.2)用Ficoll淋巴细胞分离液分离单个核细胞,计数后用PBS缓冲溶液重悬,得到最终的肿瘤组织单细胞悬液。
步骤2:用免疫磁珠技术分离得到肿瘤特异性TIL细胞。
2.1调整步骤1最终所得的细胞浓度为每1.0ml缓冲溶液2.5×108个细胞。
2.2加入100ul Fc受体阻断剂(Miltenyi Biotec,货号130-059-901),混匀,2-8摄氏度冰箱放置10分钟。
2.3加入10-20ml PBS缓冲溶液300xg离心10分钟,去除上清。
2.4加入0.4ml PBS缓冲溶液、100ul CD279(PD1)-Biotin溶液(Miltenyi Biotec,货号130-096-162),混匀,2-8摄氏度冰箱放置10分钟。
2.5加入10-20ml PBS缓冲溶液300xg离心10分钟,去除上清。
2.6加入0.8ml PBS缓冲溶液、200ul抗生物素磁珠(Miltenyi Biotec,货号130-090-485),混匀,2-8摄氏度冰箱放置15分钟。
2.7加入10-20ml PBS缓冲溶液300xg离心10分钟,去除上清,加入1ml缓冲溶液重悬得到细胞悬液。
2.8将LD柱放在MACS磁性分离器中,用2ml PBS缓冲溶液润洗一次。
2.9加入步骤2.5所得细胞悬液到LD柱中,收集通过LD柱未标记的细胞到A管中,再用PBS缓冲溶液洗2次(每次使用1ml PBS缓冲溶液),洗液也收集到A管中,得到未标记的细胞。
2.10将LD柱从磁性分离器中取出,加入2ml缓冲液用推杆将标记的细胞洗出来,用B管收集,得到肿瘤特异性TIL细胞。
步骤3:肿瘤特异性TIL细胞的快速扩增。
3.1将步骤2得到的肿瘤特异性TIL细胞按每1×106细胞与下列试剂和因子混合培养:CM培养基(在RPMI1640培养基中加入25mmol/L HEPES PH 7.2,100IU/mL盘尼西林(penicillin),100ug/mL链霉素(streptomycin),2mmol/L谷氨酰胺(L-glutamine),5.5×10-5mol/Lβ-巯基乙醇(β-mercaptoethanol),10%人AB血清)75ml,2×108个异体辐射致死(50Gy)的PBMC,4.5ug OKT3抗体,75ml AIM-V培养基。
3.2第2天加入IL-2至6000IU/ml。
3.3第5天,去除120ml上清,再加入120ml含6000IU/ml IL-2的50%CM和50%AIM-V的混合培养基。
3.4第6天根据细胞数进行扩瓶(袋)培养,细胞浓度调整为1×106/ml,培养基为6000IU/ml IL-2的50%CM和50%AIM-V的混合培养基。
3.5扩增培养到第14天,得到最终的大量的肿瘤特异性TIL细胞。
实施例2
现取一结直肠癌患者(男,53岁)恶性腹水为制备肿瘤特异性TIL细胞的材料,肿瘤特异性TIL细胞分离培养过程如下:
步骤1和步骤3同实施例1的;
步骤2的操作过程同实施例1的,步骤2.4中加入的抗体不一样,为Anti-TIM-3-APC(Miltenyi Biotec,货号130-098-936);步骤2.6中加入的磁珠不一样,为抗APC磁珠(Miltenyi Biotec,货号130-090-855)。
实施例3
取一结直肠癌患者(女,58岁)恶性腹水为制备肿瘤特异性TIL细胞的材料,肿瘤特异性TIL细胞分离培养过程如下:
步骤1和步骤3同实施例1的;
步骤2的操作过程同实施例1的,不同之处有:步骤2.4中加入的抗体不一样,为鼠抗人LAG-3抗体(R&D SYSTEMS,货号:MAB23193,IgG1);步骤2.6中加入的磁珠不一样,为抗鼠IgG1磁珠(Miltenyi Biotec,货号130-047-101)
实施例4
取一肝癌患者(男,58岁)的癌性腹水为制备肿瘤特异性TIL细胞的材料,肿瘤特异性TIL细胞分离培养过程如下:
步骤1:肿瘤组织单细胞悬液的制备
癌性胸水1000ml,1500转离心10分钟得到细胞沉淀,沉淀细胞加入适量PBS缓冲溶液(含0.5%BSA,2mmol EDTA,PH 7.2)用Ficoll分离单个核细胞,计数后用PBS缓冲溶液重悬,得到最终的肿瘤组织单细胞悬液。
步骤2和3同实施例1的。
实施例5、6
取一肝癌患者(女,68岁)恶性腹水为实施例5、6制备肿瘤特异性TIL细胞的材料,肿瘤特异性TIL细胞分离培养过程如下:
步骤1~3的操作过程同实施例1的,不同之处在于:
(1)步骤1.1中加入胶原酶、透明质酸酶、DNA酶的数量不同:
实施例5:0.2mg/ml胶原酶、0.01mg/ml透明质酸酶、0.01mg/ml DNA酶;
实施例6:20mg/ml胶原酶、10mg/ml透明质酸酶、10mg/ml DNA酶。
(2)步骤2中加入抗体溶液、Fc受体阻断剂、抗生物素磁珠的数量不同:
实施例5:10ul抗体溶液、10ul Fc受体阻断剂、20ul抗生物素磁珠;
实施例6:500ul抗体溶液、500ul Fc受体阻断剂、1000ul抗生物素磁珠。
(3)步骤3中加入IL-2、异体辐射致死(50Gy)的PBMC、OKT3抗体的数量不同:
实施例5:IL-2 100IU/ml、异体辐射致死(50Gy)的PBMC 1.0×107个、OKT3抗体1.5ug;
实施例6:IL-2 10000IU/ml、异体辐射致死(50Gy)的PBMC 1.0×109个、OKT3抗体15ug。
(4)步骤3中细胞培养的天数不同:
实施例5:扩增培养到第7天,得到最终的大量的肿瘤特异性TIL细胞;
实施例6:扩增培养到第30天,得到最终的大量的肿瘤特异性TIL细胞。
对比例1~4
对比例1取实施例1步骤1制备的肿瘤组织单细胞悬液为制备TIL细胞的初始材料;
对比例2取实施例2步骤1制备的肿瘤组织单细胞悬液为制备TIL细胞的初始材料;
对比例3取实施例3步骤1制备的肿瘤组织单细胞悬液为制备TIL细胞的初始材料;
对比例4取实施例4步骤1制备的肿瘤组织单细胞悬液为制备TIL细胞的初始材料。
对比例1~4的TIL细胞分离培养过程完全相同,如下:
步骤1:制备自体肿瘤细胞株
将细胞悬液用CM培养基重悬,加入到2级密度梯度分离液上(下层是100%Ficoll,中间层是75%Ficoll和25%CM培养液的混合液),2000转离心20分钟,收集上层和中间层之间的细胞得到富集了的肿瘤细胞。用含10%FBS的RPMI 1640培养基调整细胞浓度为2×105个/ml,接种到培养瓶中培养。
步骤2:TIL细胞的初始扩增
单细胞悬液用CM培养基调整细胞浓度为5×105个/ml,加入6000IU/ml IL-2,接种在24孔板中,每孔接种2ml,放入37℃、5%CO2培养箱中培养。
无论孔内淋巴细胞生长如何,不超过一周要进行一次半量换液。当任何一个孔内的淋巴细胞长满时,将所有孔内的细胞混匀,均分为2份,补加含6000IU/ml IL-2的CM培养基继续培养。此后,每周进行2次半量换液。或者将细胞浓度调整为0.8~1.6×106个/ml。此过程需要4-5个星期。
步骤3:IFN-r释放实验
3.1取步骤3得到的TIL细胞和步骤2得到的自体肿瘤细胞以1:1的比例一起加入到一个96孔板孔中,加入200ul含10%FBS RPMI 1640培养基,共培养12小时。
3.2每孔取上清100ul用于ELISA方法检测IFN-r浓度(BD,货号:550612),肿瘤杀伤性TIL细胞定义为上述IFN-r浓度>200pg/ml,从而筛选出肿瘤杀伤性TIL细胞。
步骤4:TIL细胞的扩增。
4.1将步骤4筛选出的肿瘤杀伤性TIL细胞按每1×106细胞与下列试剂和因子混合培养:CM培养基75ml,2×108异体辐射致死(50Gy)的PBMC,4.5ug OKT3抗体,75ml AIM-V培养基。
4.2第2天加入IL-2至6000IU/ml。
4.3第5天,去除120ml上清,再加入120ml含6000IU/ml IL-2的50%CM和50%AIM-V的混合培养基。
4.4第6天根据细胞数进行扩瓶(袋)培养,细胞浓度调整为1×106/ml,培养基为6000IU/ml IL-2的50%CM和50%AIM-V的混合培养基。
4.5扩增培养至第14天,得到最终的TIL细胞。
杀瘤实验
步骤一:制备自体肿瘤细胞株
将实施例5、6步骤一所得细胞悬液用CM培养基重悬,加入到2级密度梯度分离液上(下层是100%Ficoll,中间层是75%Ficoll和25%CM培养液的混合液),2000转离心20分钟,收集上层和中间层之间的细胞得到富集了的肿瘤细胞。用含10%FBS的RPMI 1640培养基调整细胞浓度为2×105个/ml,接种到培养瓶中培养。
步骤二:
分别将上述实施例1~6中最终得到的肿瘤特异性TIL细胞和对比例1~4中最终的到的TIL细胞作为效应细胞,分别以对比例1~4步骤2得到的自体肿瘤细胞和以上步骤一制备的自体肿瘤细胞株为靶细胞。
1.取效应细胞,用RPMI 1640培养基洗2次,用含10%FBS的RPMI1640培养基配成1×106/ml细胞悬液。
2.取靶细胞,用RPMI 1640培养基洗一次,配成1×105/ml细胞悬液。
3.按效靶比10:1接种到96孔板内,同时设置效应细胞孔和靶细胞孔,按每种培养基3个复孔,37度5%CO2培养4小时。
4.用MTT法测吸光度值,计算杀瘤率。
杀瘤率%=1-(试验孔-效应细胞孔)/靶细胞孔。
结果:
实施例1与对比例1得到的TIL细胞杀瘤实验的结果见图1;
实施例2与对比例2得到的TIL细胞杀瘤实验的结果见图2;
实施例3与对比例3得到的TIL细胞杀瘤实验的结果见图3;
实施例4与对比例4得到的TIL细胞杀瘤实验的结果见图4;
实施例5、6得到的TIL细胞杀瘤实验的结果见图5;
结论:
从实施例1~4和对比例1~4可以看出,相比于对比例1~4用到的方法,采用本发明的方法分离肿瘤特异性T淋巴细胞时间由4-5周缩短到1天,降低成本,而且操作流程更简单,便于推广使用。
从图1可以看出,实施例1得到的肿瘤特异性TIL细胞的肿瘤杀伤活性高于对比例1得到的TIL细胞;
从图2可以看出,实施例2得到的肿瘤特异性TIL细胞的肿瘤杀伤活性高于对比例2得到的TIL细胞;
从图3可以看出,实施例3得到的肿瘤特异性TIL细胞的肿瘤杀伤活性高于对比例3得到的TIL细胞;
从图4可以看出,实施例4得到的肿瘤特异性TIL细胞的肿瘤杀伤活性高于对比例4得到的TIL细胞;
因此,本发明利用活化的T细胞表达的抑制性受体将肿瘤特异性T淋巴细胞从复杂的细胞群中分离出来,增加了分离的针对性,使最终培养得到的肿瘤特异性TIL细胞的肿瘤杀伤活性更强。
应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施方式中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
上文所列出的一系列的详细说明仅仅是针对本发明的可行性实施方式的具体说明,它们并非用以限制本发明的保护范围,凡未脱离本发明技艺精神所作的等效实施方式或变更均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!