一种三维细胞划痕芯片及其制备方法与应用与流程
本发明涉及生物技术领域,进一步涉及一种三维细胞划痕芯片,以及该三维细胞划痕芯片的制备方法,使用该芯片进行细胞迁移的研究。
背景技术:
细胞迁移是很多重要生理活动的基础,受到细胞生理活动的高度控制。而细胞生理活动不仅与胚胎发育、组织修复、伤口愈合以及血管新生等正常生理过程相关,还是动脉粥样硬化、内膜增生、再狭窄以及恶性肿瘤转移等病理过程的关键环节。因此,研究细胞迁移对生理活动的理解以及疾病的治疗具有重要的理论意义和实用价值。
目前,划痕法是研究细胞迁移的重要方法之一,而传统划痕法是利用物理工具在融合的单层细胞中物理移除一部分细胞,形成一个无细胞区域,从而产生细胞生长和细胞迁移等多种细胞反应。虽然传统划痕法具有简单以及能够可视化细胞迁移过程等优点,但是这种方法本质上是一种二维方法,不能模仿体内细胞的三维微环境。
为了更好的模仿体内细胞的复杂微环境,近年来已有课题组建立了三维划痕模型,用于研究体内细胞的三维迁移。现有技术中一种方式是利用微加工技术在聚苯乙烯微孔中培养出三维细胞球,然后将细胞球植入胶原,实现了细胞的三维迁移。现有技术中另一种方式是利用数字微流控平台将三维细胞球封装于胶原内部,实现了自动化操作三维细胞迁移实验。与传统划痕法相比,三维划痕法可以有效的模仿体内细胞的三维微环境,从而说明了三维划痕法研究三维细胞迁移的可行性。但上述三维划痕法还不能够精确控制三维细胞团的空间位置和立体形态,从而使实验存在重复性差和通量低的问题。
在实现本发明的过程中,上述现有技术存在如下技术缺陷:
(1)现有的划痕法大多属于二维方法,不能模拟体内细胞的三维复杂微环境,导致实验模型与体内的实际情况存在巨大差异。
(2)现有的三维划痕法,不能准确的控制三维细胞团的空间位置和立体形态,而且普遍存在重复性差以及通量低的问题。
技术实现要素:
(一)要解决的技术问题
有鉴于此,本发明的目的在于提供一种三维细胞划痕芯片及其应用,以克服以上所述的现有技术的至少一项技术问题。
(二)技术方案
根据本发明的一方面,提供一种三维细胞划痕芯片,包括基底和上下两侧开口的小室阵列,所述小室阵列固定于所述基底上使基底封闭小室阵列的其中一侧开口,形成多个单侧开口的三维小室;每个所述小室在基底一侧的部分区域上形成有金属层,所述金属层上进一步形成有自组装硫醇分子层,所述自组装硫醇分子层中的硫醇分子其一端具有与所述金属反应吸附的第一官能团,另一端具有抑制细胞吸附的第二官能团。
优选的,所述第一官能团为氢硫键。
优选的,所述第二官能团为聚乙二醇长链(Polyethylene glycol,PEG)。
优选的,所述部分区域的内侧边界呈圆形、矩形、三角形或者树形。
优选的,所述部分区域的外侧边界为所述小室在基底上的边界,所述部分区域外侧边界呈圆形、矩形、椭圆形或者菱形。
优选的,所述小室阵列为N行M列的阵列,N为介于1-20之间的自然数,M为介于1-30之间的自然数。
根据本发明的另一方面,提供一种三维细胞划痕芯片的制备方法,包括步骤:
S1:制备上下两侧开口的小室阵列;
S2:在一基底上沉积金属层阵列;
S3:采用键合方式将所述基底和小室阵列固定,使所述基底封闭小室阵列的其中一侧开口,形成多个单侧开口的三维小室,并且所述金属层阵列一一对应的位于每个小室之内;
S4:在所述金属层上形成自组装硫醇分子层,所述自组装硫醇分子层中的硫醇分子其一端具有与所述金属反应吸附的第一官能团另一端具有抑制细胞吸附的第二官能团。
优选的,步骤S4包括子步骤:将基底进行表面清洗,以去除金属表面杂质;在每个小室内滴加稀释的硫醇溶液,密封浸泡后,在表面形成自组装硫醇分子层。
根据本发明的另一方面,还提供利用以上任一所述芯片进行细胞迁移实验,包括:
在小室的不含金属层区域的表面进行细胞外基质修饰,使细胞接种后容易在基底表面贴壁生长;
消化细胞至悬浮状态,并将细胞悬浮液接种于各个小室;
培养细胞,直至细胞在小室的不含金属层区域贴壁生长;
细胞贴壁生长以后,在自组装硫醇分子层的作用下,细胞被限制在非金属层区域,随着培养时间的增加,细胞增殖而形成三维立体结构;
形成三维立体结构后,将小室内的培养基吸出,并加入胶原溶液,将芯片放入细胞培养箱固化胶原;
胶原固化后,在每个小室内加入含不同种类或浓度趋化因子的细胞培养基,之后拍照记录三维细胞团中细胞向胶原内部进行三维迁移的情况。
(三)有益效果
通过上述技术方案可知本发明的三维细胞划痕芯片及其应用所体现的有益效果在于:
(1)本发明是一种三维划痕法,可以模拟体内细胞的三维微环境,为进一步理解细胞迁移机理以及疾病治疗提供更加可靠的手段和依据;
(2)本发明与现有的三维划痕法相比,用含第二官能团的自组装硫醇分子层修饰金表面的方式限制细胞的生长区域,不仅可以培养出不同形貌的三维细胞团,例如圆柱体和正方体三维细胞团,还能使三维细胞团具有清晰的划痕边界,从而可以提高三维划痕实验的一致性;
(3)本发明是一种大序列划痕芯片,可以同时进行至少96组实验,极大的提高了实验通量。
附图说明
图1是本发明实施例三维细胞划痕芯片的技术方法总流程图;
图2是本发明实施例三维细胞划痕芯片的结构图;
图3是本发明实施例芯片的制作流程图;
图4是本发明实施例的芯片制作过程示意图;
图5是本发明实施例的片上实验流程图;
图6是本发明实施例的片上实验示意图
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明作进一步的详细说明。
本发明将芯片技术与划痕实验相结合,设计了一种通量高、重复性好并可实现三维细胞迁移的划痕芯片。本芯片在结构上,与传统多孔板技术相兼容,可以完全应用于现有的多孔板平台。以下将以96孔板为例,介绍本发明的技术方法,当然本发明并不仅限于此,也可以是N行M列的任意阵列,其中N为介于1-20之间的自然数,M为介于1-30之间的自然数。
本技术方法具体实施情况如下:
本技术方法总流程包括芯片设计(即介绍三维细胞划痕芯片)、芯片制作(即芯片的制备方法)、片上实验以及数据处理(即芯片的应用)四个步骤,如图1所示:
图1为本发明实施例三维细胞划痕芯片的技术方法总流程图。
步骤1,芯片设计:
本实施例采用含第一官能团和第二官能团的硫醇分子(EG-terminated thiols,分子式可以为HS(CH2)11(OCH2CH2)4OH,简称EG4),其一端的氢硫键(-SH)可以与金(Au)或银(Ag)发生反应,使硫醇分子吸附于Au或Ag表面而形成自组装硫醇分子层,而硫醇分子的另一端为PEG,可以抑制细胞和蛋白的吸附,进而阻止细胞吸附于Au或Ag表面。而硫醇分子不会与玻璃表面发生反应,使得细胞可以在玻璃表面贴壁生长,从而达到限制细胞只在特定区域进行三维生长的目的。
本领域技术人员应当知晓,硫醇分子中抑制细胞和蛋白吸附的的聚乙二醇长链并不限于某一种化学分子式,还可以是[-CH2CH2O-]4OH、[-CH2CH2O-]4CH3以及其他化学式。硫醇分子不局限于某一种聚合物分子,只要是一端具有可以吸附于金表面的氢硫键,另一端具有可以阻止细胞粘附的聚乙二醇长链都可应用于此。
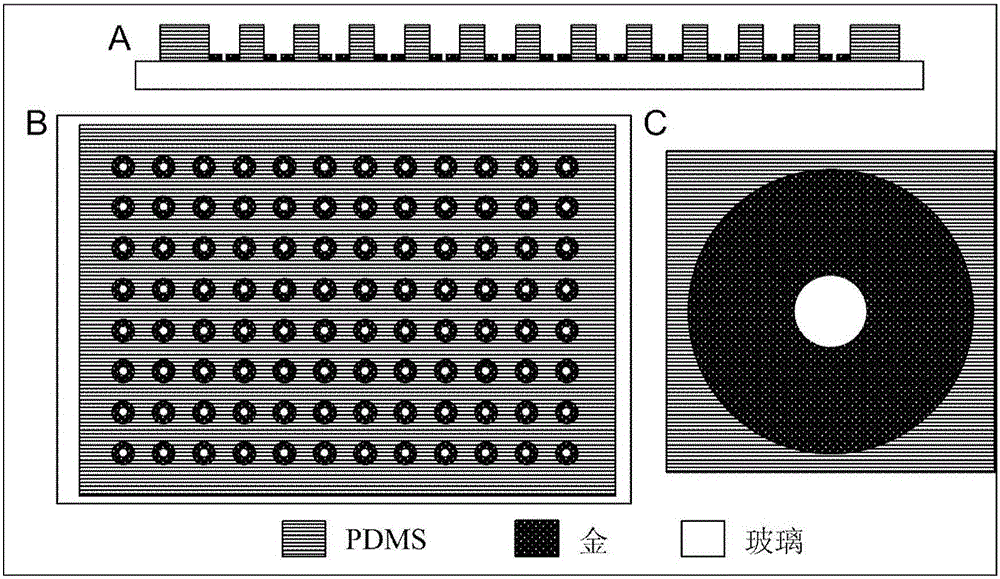
图2中子图A为本发明设计的三维细胞划痕芯片的侧视图,芯片分为三层,由上至下依次为聚二甲基硅氧烷(Polydimethylsiloxane,PDMS)划痕小室阵列层、金圆阵列层以及玻璃基底层。
本领域技术人员应当知晓,划痕小室的材料可以是具有生物兼容性的任意材料并不仅限于聚二甲基硅氧烷,金属阵列的金属也不仅限于金,以及基底材料并不仅限于玻璃,本实施列举上述材料仅为进行详细叙述而不是为了限制本发明。
图2中子图B为本发明设计的三维细胞划痕芯片的俯视图。PDMS厚度为8毫米,其内部共有96个(8行×12列)圆柱形划痕小室,其中圆柱形划痕小室直径为5毫米,中心间距为9毫米,与标准96孔板尺寸基本一致。玻璃基底上的Au层由96个Au圆组成,每一个Au圆与划痕小室的底面为中心对齐,使得Au圆就是划痕小室的圆底面,其中Au的直径为6毫米,厚度为200埃。最下层的玻璃基底厚度为1毫米。上述尺寸设置仅为例示性的,本领域技术人员可以设计任意能够实现细胞三维迁移的小室和Au圆尺寸。
图2中子图C给出了每个划痕小室的放大图,其中每一个划痕小室的底面都由Au和玻璃两部分组成。Au表面用于修饰硫醇形成PEG层,抑制细胞在Au表面生长,使细胞只在玻璃表面贴壁生长;玻璃表面用于细胞贴壁生长,并且玻璃表面可设计为任意不同尺寸的图案(例如:圆形、树形和矩形等),以便培养出不同形貌的三维细胞结构。
图2为本发明实施例的三维划痕芯片结构图。
步骤2,芯片制作:
芯片制作流程包括PDMS划痕小室阵列的制作和玻璃基底表面Au圆阵列的制作,将两者键合后再进行Au表面的硫醇修饰,使Au表面形成PEG层。PDMS划痕小室阵列的制作步骤包括:3D打印PDMS阳模、浇注PDMS以及翻模得到划痕小室阵列。玻璃基底表面Au圆阵列的制作步骤包括:光刻胶阳模制作、金的溅射以及剥离得到金圆阵列。而后,需要经过PDMS与玻璃基底键合、硫醇修饰金圆以及金表面形成PEG几个步骤,便完成了芯片的制作。三维细胞划痕芯片制作流程如图3所示,流程包含:
步骤S1:制备上下两侧开口的小室阵列,该步骤包含子步骤A2-C2:
子步骤A2,3D打印PDMS阳模:
用三维绘图软件画出阳模的三维图,输入3D打印机软件,打印机便利用打印材料自动打印出图4中子图A所示的PDMS阳模,其中打印材料一般为聚乳酸(Polylacticacid,PLA)。
子步骤B2,浇注PDMS:
PDMS预聚物与PDMS固化剂按一定质量比混合后,搅拌均匀,浇注在3D打印的阳模上,然后加热一段时间而使其固化,见图4中子图B。
子步骤C2,翻模得到划痕小室阵列层:
翻模固化后的PDMS,便可获得96孔PDMS划痕小室阵列层,见图4中子图C。
步骤S2:在一基底上沉积金属层阵列,该步骤包含子步骤D2-F2:
子步骤D2,光刻胶阳模制作:
玻璃片依次在丙酮、乙醇和去离子水中清洗,热板上烘干后,在玻璃片表面均匀旋涂一层具有一定厚度的光刻胶,放上掩模板曝光。将曝光后的玻璃片放入显影液中显影,最后在需要溅射金的位置暴露出玻璃表面,而不需要溅射金的位置留下光刻胶形成牺牲层,见图4中子图D。
子步骤E2,金的溅射:
先在带有牺牲层的玻璃片表面溅射打底层,其中打底层一般为铬或钛,增强Au的吸附性,然后溅射一层Au,见图4中子图E。
子步骤F2,剥离得到金圆阵列:
将溅射后的玻璃片置于丙酮中浸泡,然后低功率超声直至Au层完全剥离,完成Au圆阵列的制作,见图4中子图F。
子步骤G2,PDMS与玻璃基底键合(也即步骤S3):
将PDMS划痕小室阵列层和Au圆阵列覆盖的玻璃基底二者键合,得到完整芯片,见图4中子图G。
步骤S4:在所述金属层上形成自组装硫醇分子层,所述自组装硫醇分子层中的分子其一端具有与所述金属反应吸附的第一官能团,另一端具有抑制细胞吸附的第二官能团。
步骤S4包含子步骤H2-I2。子步骤H2,硫醇修饰金圆阵列:
修饰硫醇之前,先将芯片进行表面清洗,一般为等离子体清洗机(Plasma cleaner)清洗,以去除掉Au圆表面的杂质,增强硫醇修饰的效果。然后在每个划痕小室内滴加稀释后的硫醇溶液,密封浸泡一段时间,使Au圆与硫醇发生反应,见图4中子图H。
子步骤I2,金表面形成PEG:
见图4中子图I,Au圆在硫醇溶液中浸泡一段时间之后,在其表面形成一层PEG。至此,三维细胞划痕芯片的制作已全部完成。
步骤3,片上实验:
利用上述完成的三维细胞划痕芯片可以实现片上实验,因此,该步骤将详细介绍三维细胞划痕芯片的使用方法和操作步骤。片上实验的主要步骤分为细胞外基质修饰、细胞接种、细胞贴壁、细胞三维培养、胶原固化和细胞迁移,其流程图如图5所示:
图5是本发明实施例的片上实验流程图,包括:
子步骤A3,细胞外基质修饰:
细胞接种之前,需要在划痕小室的玻璃表面进行细胞外基质修饰,其中细胞外基质一般为纤连蛋白,增强细胞在玻璃表面的粘附性,使细胞接种后更加容易在玻璃表面贴壁生长,见图6中子图A。
子步骤B3,细胞接种:
消化细胞至悬浮状态,并用移液枪将细胞悬液接种与各个划痕小室,见图6中子图B。
子步骤C3,细胞贴壁:
培养细胞,直至细胞在划痕小室的玻璃表面贴壁生长,见图6中子图C。通常情况下,细胞贴壁后要更换一次培养基,以去掉划痕小室金表面上未贴壁的细胞。
子步骤D3,细胞三维培养:
细胞贴壁生长以后,在PEG层的作用下,细胞被限制在玻璃区域,随着培养时间的增加,细胞增殖而形成不同形貌的三维立体结构,见图6中子图D。细胞三维培养的周期视具体实验要求而定,但需要每隔一段时间更换一次新鲜培养液,以保证三维细胞团的正常生长。
子步骤E3,胶原固化:
细胞三维培养结束后,将划痕小室内的培养基吸出,并加入一定体积的胶原溶液,其中胶原溶液的浓度视具体实验情况而定,最后将芯片放入细胞培养箱固化胶原,见图6中子图E。
子步骤F3,细胞迁移:
胶原固化后,在每个划痕小室内加入含不同种类或浓度趋化因子的细胞培养基,一定时间后,拍照记录三维细胞团中细胞向胶原内部进行三维迁移的情况,见图6中子图F。
步骤4,数据处理:
共聚焦显微镜照片记录细胞向胶原内部进行三维迁移的情况,通过分析共聚焦显微镜照片,便可得到三维细胞迁移的具体参数。分析的方法可以使用图像识别软件,识别三维细胞团迁移后的体积,再通过对比不同时间点的三维迁移体积的大小差异,便可得到不同种类或浓度趋化因子作用下的迁移结果,进而获得有关的实验结论。
此外,上述对各元件和方法的定义并不仅限于实施例中提到的各种具体结构、形状或方式,本领域普通技术人员可对其进行简单地更改或替换,例如:
(1)划痕小室的形状不局限于圆形,也可以是矩形、三角形以及其他规则或不规则图形;
(2)划痕小室的数量也不局限于96,也可以是384、24、12和6等其他标准规格多孔板上孔的数量;
(3)在每个划痕小室内,底面中心的玻璃表面形成的图案不仅限于图2中子图C所示的圆形,还可以是矩形、三角形和树形等图案;
(4)在每个划痕小室内,Au阵列的外侧边界不一定是圆形,也可以是矩形、椭圆形和菱形等图形;
(5)溅射金层下面的打底层金属不局限于铬,还可以用钛和镍等金属作为打底层,以增强金层和基底之间的粘附性。
(6)用于修饰自组装硫醇分子层的金属不局限于Au,也可以是银等其他金属;
(7)修饰硫醇之前,芯片的表面清洗方法不局限于等离子机清洗,也可以用″食人鱼″洗液(Piranha solution)或反应离子刻蚀(Reactive ion etching)等清洗方法清洗;
(8)浇注PDMS用的阳模,不只有3D打印一种方法,所使用的材料也不局限于PLA,任何能形成柱状阵列的方法和材料都可以用来制作PDMS阳模;
(9)硫醇分子中抑制细胞和蛋白吸附的聚乙二醇长链并不局限于某一种化学分子式,包括[-CH2CH2O-]4OH、[-CH2CH2O-]6OH、[-CH2CH2O-]4CH3、[-CH2CH2O-]6CH3以及其他类似的化学式;
(10)用于增强细胞贴壁效果的细胞外基质不局限于纤连蛋白,也可以是多聚赖氨酸(Poly-L-Lysine)等其他细胞外基质;
(11)用于构建细胞三维迁移环境的试剂不局限于胶原,也可以是海藻酸钠和水凝胶等其他试剂;
(12)本发明中提到的方向用语,例如“上”、“下”、“前”、“后”、“左”和“右”等,仅仅表示参考方向,并非用于限制本发明。
至此,已经结合附图对本实施例进行了详细描述。依据以上描述,本领域技术人员应当对本发明一种三维细胞划痕芯片及其制备方法与应用有了清楚的认识。
以上所述的具体实施例,对本发明的目的、技术方案和有益效果进行了进一步详细说明,应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!