与大白菜紫色叶球基因BrPur连锁的分子标记的制作方法
本发明属于蔬菜育种及分子遗传学领域,具体涉及与大白菜紫色叶球基因BrPur连锁的分子标记,还涉及到扩增该分子标记的引物及在大白菜辅助育种中的应用。
背景技术:
白菜 (Brassica rapa L.) 属十字花科芸薹属芸薹种白菜亚种,是起源于我国的主要蔬菜作物之一,也是我国种植面积最大的蔬菜作物之一,同时还是世界三大油菜之一,与人们的日常生活密切相关。近年来,随着人们生活水平的提高,人们对大白菜品质的要求日益提高,而紫色大白菜花青素含量丰富,对于人类健康的营养价值极高,因此,紫色大白菜育种受到越来越多国内外学者和育种家的重视。
研究表明紫色大白菜类黄酮类次生代谢产物丰富,尤其是花青素含量较高,不仅有利于提高白菜类作物自身的抗逆能力,而且其具有抗癌、抗氧化及心血管疾病的功效,对于人类健康具有重要的营养价值,近年来受到国内外的广泛关注。但是,白菜叶球颜色需要在其结球期成熟后才能表现出,而且需要在田间切开叶球逐株观察,操作起来不仅对种质材料的破坏性极大,而且费时费力,极大的延缓了育种进程。因此为了加快紫色叶球大白菜的育种速度,利用现代的分子生物技术,进行分子标记辅助育种十分必要。
随着分子生物学技术的快速发展,多种基于DNA多态性的分子技术应运而生,并广泛应用于遗传育种研究的各个领域。简单序列重复(simple sequence repeats,SSR),又称为微卫星DNA(microsatellite,DNA),是一类由1 - 6个核苷酸串联重复组成的DNA序列如(CA)n,(ATG)n,(TAGG)n等重复,其长度一般较短,广泛分布于基因组的不同位置,由于重复次数的不同和重复程度的不完全造成了每个位点的多态性,包括SSR标记和EST-SSR标记两种类型。其中,SSR标记具有共显性、重复性好、多态性丰富、易于检测等优点,已广泛应用于植物遗传多样性分析、遗传图谱构建、基因定位和分子标记辅助育种等研究领域(Tautz and Schlötterer,1994;Powell et al.,1996)。
因此,基于以上SSR标记的优点,申请人利用大白菜的测序结果,开发并成功筛选出与大白菜叶球紫色基因BrPur紧密连锁的分子标记,并构建了BrPur基因的分子遗传图谱,为克隆该基因及利用该分子标记进行紫色叶球大白菜分子辅助育种,加快育种进程奠定了基础。
技术实现要素:
本发明的目的在于,提供与大白菜叶球颜色基因BrPur紧密连锁的SSR分子标记。
本发明的还一个目的在于,提供可用于PCR扩增与大白菜叶球颜色基因BrPur紧密连锁的SSR分子标记的引物对,以及应用该分子标记引物,通过PCR方法,获得分子标记。以此在苗期即可鉴定区分紫色叶球大白菜和非紫色叶球大白菜,从而淘汰非目标植株,大大提高选择的效率。
为了实现上述任务,本发明采用如下的技术解决方案:
本发明公开了与大白菜紫色叶球基因BrPur紧密连锁的SSR分子标记,所述分子标记Sep ID NO.1和Sep ID NO.3所示的序列。
本发明还公开了与大白菜紫色叶球基因BrPur连锁的SSR分子标记引物,已鉴定出的6对SSR引物,优选引物B-76(序列Sep ID NO.5、Sep ID NO.6)和引物SSR14-36(Sep ID NO.7、Sep ID NO.8)所示的序列,6对中的一对,即可将紫色叶球与非紫色叶球大白菜区分开,同时使用两个标记能提高选择的准确性。
[f1] 对SSR引物对的脱氧核糖核苷酸引物序列如下:
引物对B-31:
上游引物(F):5'-GGTCAAAACCTTTCAGAACTCCC-3';
下游引物(R):5'-AATCTTATCTTTTGGTTTGGTGCTG-3';
引物对B-51:
上游引物(F):5'-TGGATTTGGTTAGGTGGTCAGC-3'
下游引物(R):5'-CATGCACTTTGGGTGGAGATAC-3'
引物对B-76:
上游引物(F):5'-TGGAACGCAAATGAACCCTC-3'
下游引物(R):5'-GATGGCAAAATTCACATAAGTTCAG-3'
引物对SSR14-36:
上游引物(F):5'-TAAACCTAAAAATACATCTGCTTCC-3'
下游引物(R):5'-TTTAACGTGAGAGCTTGAATGC-3'
引物对SSR14:
上游引物(F):5'-CGAGTTGACCTGCGAACATTG-3'
下游引物(R):5'-CGATTCCTTCATATTTGGTTTCAC-3'
引物对SSR17:
上游引物(F):5'-CTCTCAATCCCTCAATCAAACC-3'
下游引物(R):5'-AGGAGGCGTGCGGTTATG-3'
本发明公开的分子标记,是由优选的引物对B-76(Sep ID NO.5、Sep ID NO.6)和引物对SSR14-36(Sep ID NO.7、Sep ID NO.8)经过PCR扩增获得的。
[A2]
采用上述与大白菜紫色叶球基因BrPur紧密连锁的SSR分子标记引物,通过DNA扩增在苗期即可鉴定区分紫色叶球和非紫色叶球大白菜,从而淘汰非目标植株,大大提高选择的效率。同时大白菜紫色叶球基因BrPur分子遗传图谱的构建可加快克隆该基因。
本发明首次获得了与大白菜紫色叶球基因BrPur最为紧密连锁的分子标记引物,具有检测方便,扩增稳定,重复性和准确率高等优点。其具体有益效果表现在:
(1)获得了在第7连锁群(A07)上大白菜紫色叶球基因BrPur的分子遗传图谱,且首次获得与BrPur基因紧密连锁的分子标记B-76和SSR14-36,可在紫色大白菜分子标记辅助育种及BrPur基因克隆中发挥重要的作用。
[A3] [A4]
(3)鉴定方便。这2个标记均为共显性标记,具有扩增稳定、检测方便、快速等优点。用这2个分子标记检测BrPur基因,可以确定BrPur的存在与否及存在的状态,进而快速筛选携有BrPur基因的植株,并用于紫色大白菜品种的选育。同时利用分子标记进行检测时还可以避免环境对品种的影响,提高选择的准确性。
(4)提高紫色大白菜的选择效率。在传统的紫色大白菜鉴定过程中,必须等到白菜结球期成熟后才能对叶球颜色性状进行观察统计,因此紫色大白菜的选育不仅费时费力,而且难度大,成本高,育种周期长。用本发明的分子标记引物,通过检查与大白菜紫色叶球基因BrPur紧密连锁的分子标记,可将表型鉴定的工作大大减少,在苗期即可区分紫色和非紫色叶球大白菜,从而淘汰非目标植株,因此,利用本发明的与BrPur基因紧密连锁的分子标记,不仅节约成本,而且大大的提高了育种效率,加快了育种进程。
(5)可用于克隆大白紫色叶球基因的研究。图位克隆大白菜紫色基因BrPur的前提在于获得与BrPur紧密连锁的分子标记。B-76和SSR14-36在所有已知的A07分子标记中是首次报道的位于BrPur两侧并且与之连锁最为紧密标记,这为克隆该基因提供了分子生物学基础和遗传学依据。
附图说明
图1是白菜紫色叶球基因BrPur的遗传连锁图,右侧为遗传连锁图的标记,左侧数据为标记间的遗传距离(cM)。
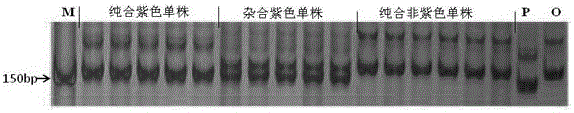
图2 是B-76在紫色和橙色亲本及F2代单株中的扩增结果;泳道信息:(从左到右)M,50 bp DNA ladder;5个纯合紫色单株;5个杂合紫色单株;6个纯合非紫色单株;P是紫色亲本;O是橙色亲本。
图3是SSR14-36在紫色和橙色亲本及F2代单株中的扩增结果;泳道信息:(从左到右)M,50 bp DNA ladder;P是紫色亲本;O是橙色亲本;5个纯合紫色单株;5个杂合紫色单株;5个纯合非紫色单株;。
图4是标记B-76的引物在亲本14S839和14S162间的扩增序列差异。B-76-14S839表示标记B-76的引物在亲本14S839中的扩增结果;B-76-14S162表示标记B-76的引物在亲本14S162中的扩增结果。
图5是标记SSR14-36的引物在亲本14S839和14S162间的扩增序列差异。SSR14-36-14S839表示标记SSR14-36的引物在亲本14S839中的扩增结果;SSR14-36-14S162表示标记SSR14-36的引物在亲本14S162中的扩增结果。
图6 P1、P2分别是紫色亲本材料14S839成熟期的叶球外观和紫色球叶性状;O1、O2分别是橙色亲本材料14S162成熟期的叶球外观和非紫色球叶性状。
以下结合附图和实施例对本发明作进一步的详细说明。
具体实施方式
以下实施例中的实验方法均为常规方法,所涉及的实验试剂均为常规生化试剂。
本发明的与白菜紫色叶球基因BrPur紧密连锁的SSR分子标记引物是通过以下步骤获得的:
(1)群体材料准备
以紫色大白菜“14S839” (西北农林科技大学学报(自然科学版)2011(3)11:146-151)为父本,橙色大白菜“14S162”(秦白6号大白菜的亲本之一,陕西农业科学,1999 (3),5-6)为母本杂交产生的F1群体,然后通过单株自交获得相应的F2群体。
(2)白菜单株基因组总DNA的提取
A、取0.2 g去掉主脉的新鲜嫩叶,塞入装有钢珠(钢珠需要由质量分数为75%的酒精清洗过)的2 mL的离心管中,放入液氮中速冻,利用组织研磨仪磨成粉末;
B、向离心管中加700 μL经65 ℃预热的CTAB提取液(CTAB:2%,Tris-HCl(pH 8.0):100 mmol/L,EDTA:20 mmol/L,NaCl:1.4 mol/L),再加入10 µL的β-巯基乙醇,迅速混匀;
C、随后将离心管放入65 ℃烘箱中,中间每间隔5-10 min分钟摇一次,温浴45 min;
D、取出离心管,加入等体积的酚:氯仿:异戊醇(25:24:1)的混合物,摇匀15 min后,常温下10000 r/min 离心10 min;
E、将上层液相(约700μL)转移到另一离心管中,加入等体积的氯仿和异戊醇混合溶液(氯仿:异戊醇=24:1),轻轻摇匀10 min,常温下10000 r/min离心10 min;
F、取上清(约500μL),加入2倍体积经预冷的无水乙醇,轻轻混匀使DNA抱团,-20℃条件下沉淀30 min,4℃条件下8000 r/min离心5 min;
G、弃上清,加入500 μL质量百分数为75%的乙醇洗涤沉淀2次后,沉淀物室温晾干;
H、加入500 μL的无菌蒸馏水溶解DNA,加入0.29 μL的RNase A(10 µg/µl),混匀后稍离心,37 ℃保温30 min;
I、加入3 mol/L的NaAc溶液50 µL和2倍体积经预冷的无水乙醇,轻轻混匀使DNA抱团,-20 ℃条件下沉淀30 min;
J、在4℃条件下,8000 r/min离心5 min,弃上清,加入质量百分数为75%的乙醇清洗沉淀1~2次后,沉淀物室温晾干,加入400~500 µL的灭菌ddH2O溶解使用,或加入质量百分数为75%的乙醇-20 ℃保存备用;
(3)SSR序列的获得
根据http://brassicadb.org/brad/index 中公布的已知引物,共选取大白菜10对染色体上已知的引物120对,利用亲本材料对120对引物进行筛选,共筛选出20对差异引物,然后选择紫色较深的F2单株和非紫色F2单株各10株,对这20对引物进行再次筛选,发现1对差异引物A710,随后继续选取A710引物两侧已知引物,发现了另一对差异引物A731。进一步沿A731到BrPur方向设计SSR引物。利用SSRHunter软件对该区间序列内的SSR位点进行检索,检索标准为:含二、三、四、五和六核苷酸类型的SSR基序(motif)的最小重复数分别为5,4,3,3和3次。将检索得到的含SSR位点的序列在芸薹属基因组网站(http://www.brassica.bbsrc.ac.uk/)进行同源性比对,SSR序列选取条件为比对相似性85%以上,同时有3条以上的同源序列与该序列存在SSR位点差异。
(4)SSR分子标记引物设计
根据SSR差异位点两端的序列,采用Primer 5.0 软件对符合条件的目标序列设计引物。设计引物参数原则:退火温度为50℃~70℃,最佳温度为57℃;引物长度18bp ~26bp;产物大小为100 bp ~300bp;引物(G+C)含量为40%~60%,引物不出现二级结构、发夹结构和二聚体。引物由生工生物工程(上海)股份有限公司合成,设计合成了SSR引物297对。
(5)多态性引物筛选和SSR分子标记分析
选用所设计的297对引物,将在紫色亲本和非紫色亲本间表现出相同多态性的引物重复分析3次,然后选择在F2群体中30株极端个体间进行多态性验证,如果扩增结果与在两亲本间扩增结果一致,则将确实存在多态性的引物用于F2代单株的SSR分析。最后根据连锁交换规律,结合单株基因型材料与田间对叶球颜色调查统计的结果,利用JoinMap4.0软件构建了大白菜紫色叶球基因BrPur的分子遗传连锁图1,获得了与BrPur紧密连锁的6个SSR标记,图1是白菜紫色叶球基因BrPur的遗传连锁图,右侧为遗传连锁图的标记,左侧数据为标记间的遗传距离(cM)。
6对SSR引物对的脱氧核糖核苷酸引物序列如下:
引物对B-31:
上游引物(F):5'-GGTCAAAACCTTTCAGAACTCCC-3';
下游引物(R):5'-AATCTTATCTTTTGGTTTGGTGCTG-3';
引物对B-51:
上游引物(F):5'-TGGATTTGGTTAGGTGGTCAGC-3'
下游引物(R):5'-CATGCACTTTGGGTGGAGATAC-3'
引物对B-76:
上游引物(F):5'-TGGAACGCAAATGAACCCTC-3'
下游引物(R):5'-GATGGCAAAATTCACATAAGTTCAG-3'
引物对SSR14-36:
上游引物(F):5'-TAAACCTAAAAATACATCTGCTTCC-3'
下游引物(R):5'-TTTAACGTGAGAGCTTGAATGC-3'
引物对SSR14:
上游引物(F):5'-CGAGTTGACCTGCGAACATTG-3'
下游引物(R):5'-CGATTCCTTCATATTTGGTTTCAC-3'
引物对SSR17:
上游引物(F):5'-CTCTCAATCCCTCAATCAAACC-3'
下游引物(R):5'-AGGAGGCGTGCGGTTATG-3'
所述的PCR扩增包括:20 μL PCR 反应体系为: 50ng/μL的模板 DNA 为2μL, 2×TaqMaster Mix 10μLM的上、下游引物各1μL,用无菌蒸馏水补充反应体系至20 μL;
PCR 反应程序为:
B-76引物:先94 ℃预变性5min;然后94 ℃变性30s,55℃退火30s,72℃延伸30s,共 30个循环;最后72℃再延伸10min,4℃保存。
SSR14-36引物:先94 ℃预变性5min;然后94 ℃变性30s,55℃退火30s,72℃延伸 30s,共 30个循环;最后72℃再延伸10min,4℃保存。
以下是发明人给出的具体实施例。
实施例:SSR14-36引物的应用
(一)采用CTAB法提取大白菜基因组DNA,提取步骤如下所示:
A. 取0.2 g去掉主脉的新鲜嫩叶片,塞入装有钢珠(钢珠需要由质量分数为75%的酒精清洗过)的2 mL的离心管中,放入液氮中速冻,利用组织研磨仪磨成粉末;
B. 向离心管中加700 μL经65 ℃预热的CTAB提取液(CTAB:2%,Tris-HCl(pH 8.0):100 mmol/L,EDTA:20 mmol/L,NaCl:1.4 mol/L),再加入8 µl的β-巯基乙醇,迅速混匀;
C. 随后将离心管放入65 ℃水浴中,中间每间隔5-10 min分钟摇一次,水浴45 min;
D. 取出离心管,加入等体积的酚、氯仿和异戊醇的混合物(酚:氯仿:异戊醇=25:24:1),摇匀15 min后,常温下10000 r/min离心10 min;
E. 将上层液相(约700 μL)转移到另一离心管中,加入等体积的氯仿和异戊醇的混合物(氯仿:异戊醇=24:1),轻轻摇匀10 min,常温下10000 r/min离心10 min;
F. 取上清(约500 μL),加入2倍体积预冷的无水乙醇,轻轻混匀使DNA抱团,-20℃条件下沉淀30 min,4 ℃条件下8000 r/min离心5 min;
G. 弃上清,加入500 μL质量分数为75%的乙醇洗涤沉淀2次后,沉淀物室温晾干;
H. 加入500 μL的无菌蒸馏水溶解DNA,加入0.29 μL的RNaseA(10 µg/µL),混匀后离心,37 ℃保温30 min;
I.加入3 mol/L NaAc溶液50 µL和2倍体积经预冷的无水乙醇,轻轻混匀使DNA抱团,-20 ℃条件下沉淀30 min;
J. 在4 ℃条件下,8000 r/min离心5 min,弃上清,加入质量分数为75%的乙醇清洗沉淀1~2次后,沉淀物室温晾干,加入400 -500 μL灭菌的ddH2O溶解使用,或加入质量百分数为75%乙醇-20℃保存备用;
(二)PCR扩增
用紫色亲本和非紫色亲本DNA作模板,按照下述PCR扩增条件和程序进行分析
PCR扩增条件:
20 μL PCR 反应体系为: 50ng/μL的模板 DNA 为2 μL,2×Taq Master Mix 10μL,10 μ M的上、下游引物各1 μL,用无菌蒸馏水补充反应体系至20 μL;
② PCR反应程序为:先94 ℃预变性5 min;然后94 ℃变性30 s,53 ℃退火 30 s,72 ℃延伸 30 s,共 30个循环;最后72 ℃再延伸10 min,4 ℃保存。PCR反应在Bio-Rad S1000 96型PCR仪中进行。
(三)9%非变性聚丙烯酰胺凝胶电泳
(1)9%非变性聚丙烯酰胺凝胶的制备方法如下:
①玻璃板的清洗:用清水将玻璃板冲洗干净,再用无水乙醇冲洗并空置晾干,洗板时应将带有磨砂条的玻璃板和光滑玻璃板分开。
②装板:将带有磨砂条的玻璃板和光滑玻璃板两侧对齐,光滑玻璃板下侧突出插入到带有凹槽的橡皮封条中,利用1%的琼脂糖凝胶将磨砂玻璃板与橡皮封条之间的间隙封住,琼脂糖凝胶凝固后待用。
③灌胶:封底之后,取25 mL,9%的非变性聚丙烯酰胺凝胶溶液,加250 μL浓度为10%的过硫酸氨(APS)和25 μL的TEMED,轻轻混匀,灌完后,将梳子插入适当位置,再将板调至水平,室温下胶板凝固30 min。
(2)电泳:
①点样:往胶槽内倒入适量1×TBE电泳缓冲液(中间槽的电泳液需要高于光滑玻璃板的高度,两侧液体高度10 cm以上),将梳子从胶板中轻轻地拔出,用移液器将梳孔中残余的凝胶和气泡清除干净,加入2 μL由SSR14-36引物扩增出的PCR扩增产物。
②电泳检测:接通电源,恒压180 V电泳检测,时间约为90 min,待二甲苯氰跑出胶底部,停止电泳。
③卸板:将电泳完毕的凝胶从玻璃板上剥离下来,该过程在水中进行,可以减少凝胶的损坏。
(3)银染步骤:
①冲洗:将电泳完毕的凝胶从玻璃板上剥离下来后,放入盛有蒸馏水的盘子里,轻晃5-6 s,倒掉,以洗去凝胶表面的残余电泳液;
②染色:将胶转入0.1 % 的硝酸银溶液中震荡染色8-10 min;
③水洗:将染完色的凝胶转入蒸馏水中漂洗2-3次,洗去凝胶表面的硝酸银残余;
④显色:将冲洗完毕的凝胶转入显色液(1.5% NaOH,0.4%甲醛)中显色至条带清楚显示;
⑤冲洗:将显色液倒掉,用自来水冲洗胶片2-3次;
⑥保存:将冲洗后的凝胶放在胶片观察灯上统计分析、照相,然后用保鲜膜封存,4 ℃可保存数月。
(四)结果判断
纯合紫色材料扩增出大约140bp的产物、纯合非紫色材料扩增出大约128bp的产物,杂合紫色材料扩增出共显性的产物见图3,图3是SSR14-36在紫色和橙色亲本及F2代单株中的扩增结果;泳道信息:(从左到右)M,50 bp DNA ladder;P是紫色亲本;O是橙色亲本;5个纯合紫色单株;5个杂合紫色单株;5个纯合非紫色单株。图5是标记SSR14-36的引物在亲本14S839和14S162间的扩增序列差异。SSR14-36-14S839表示标记SSR14-36的引物在亲本14S839中的扩增结果;SSR14-36-14S162表示标记SSR14-36的引物在亲本14S162中的扩增结果。
实施例:B-76引物的应用
(一)采用CTAB法提取大白菜基因组DNA,提取步骤如下所示:
A. 取0.2 g去掉主脉的新鲜嫩叶片,塞入装有钢珠(钢珠需要由质量分数为75%的酒精清洗过)的2 mL的离心管中,放入液氮中速冻,利用组织研磨仪磨成粉末;
B. 向离心管中加700 μL经65 ℃预热的CTAB提取液(CTAB:2%,Tris-HCl(pH 8.0):100 mmol/L,EDTA:20 mmol/L,NaCl:1.4 mol/L),再加入8 μL的β-巯基乙醇,迅速混匀;
C. 随后将离心管放入65 ℃水浴中,中间每间隔5-10 min分钟摇一次,水浴45 min;
D. 取出离心管,加入等体积的酚、氯仿和异戊醇的混合物(酚:氯仿:异戊醇=25:24:1),摇匀15 min后,常温下10000 r/min离心10 min;
E. 将上层液相(约700 μL)转移到另一离心管中,加入等体积的氯仿和异戊醇的混合物(氯仿:异戊醇=24:1),轻轻摇匀10 min,常温下10000 r/min离心10 min;
F. 取上清(约500 μL),加入2倍体积预冷的无水乙醇,轻轻混匀使DNA抱团,-20 ℃条件下沉淀30 min,4 ℃条件下8000 r/min离心5 min;
G. 弃上清,加入500 μL质量分数为75%的乙醇洗涤沉淀2次后,沉淀物室温晾干;
H. 加入500 μL的无菌蒸馏水溶解DNA,加入0.29 μL的RNaseA(10 µg/µL),混匀后离心,37 ℃保温30 min;
I.加入3 mol/L NaAc溶液50 µL和2倍体积经预冷的无水乙醇,轻轻混匀使DNA抱团,-20 ℃条件下沉淀30 min;
J. 在4 ℃条件下,8000 r/min离心5 min,弃上清,加入质量分数为75%的乙醇清洗沉淀1~2次后,沉淀物室温晾干,加入400-500 μL灭菌的ddH2O溶解使用,或加入质量百分数为75%乙醇﹣20 ℃保存备用;
(二)PCR扩增
用紫色亲本和非紫色亲本DNA作模板,按照下述PCR扩增条件和程序进行分析
PCR扩增条件:
20 μL PCR 反应体系为: 50 ng/μL的模板 DNA 为2 μL,2×Taq Master Mix 10 μL,10 μ M的上、下游引物各1 μL,用无菌蒸馏水补充反应体系至20 μL;
② PCR反应程序为:先94 ℃预变性5 min;然后94 ℃变性30 s,55 ℃退火 30 s,72℃延伸 30 s,共 30个循环;最后72 ℃再延伸10 min,4 ℃保存。PCR反应在Bio-Rad S1000 96型PCR仪中进行。
(三)9%非变性聚丙烯酰胺凝胶电泳
(1)9%非变性聚丙烯酰胺凝胶的制备方法如下:
①玻璃板的清洗:用清水将玻璃板冲洗干净,再用无水乙醇冲洗并空置晾干,洗板时应将带有磨砂条的玻璃板和光滑玻璃板分开。
②装板:将带有磨砂条的玻璃板和光滑玻璃板两侧对齐,光滑玻璃板下侧突出插入到带有凹槽的橡皮封条中,利用1%的琼脂糖凝胶将磨砂玻璃板与橡皮封条之间的间隙封住,琼脂糖凝胶凝固后待用。
③灌胶:封底之后,取25 mL,9%的非变性聚丙烯酰胺凝胶溶液,加250 μL浓度为10%的过硫酸氨(APS)和25 μL的TEMED,轻轻混匀,灌完后,将梳子插入适当位置,再将板调至水平,室温下胶板凝固30 min。
(2)电泳:
①点样:往胶槽内倒入适量1×TBE电泳缓冲液(中间槽的电泳液需要高于光滑玻璃板的高度,两侧液体高度10 cm以上),将梳子从胶板中轻轻地拔出,用移液器将梳孔中残余的凝胶和气泡清除干净,加入2 μL由B-76引物扩增出的PCR扩增产物。
②电泳检测:接通电源,恒压180 V电泳检测,时间约为90 min,待二甲苯氰跑出胶底部,停止电泳。
③卸板:将电泳完毕的凝胶从玻璃板上剥离下来,该过程在水中进行,可以减少凝胶的损坏。
(3)银染步骤:
①冲洗:将电泳完毕的凝胶从玻璃板上剥离下来后,放入盛有蒸馏水的盘子里,轻晃5-6 s,倒掉,以洗去凝胶表面的残余电泳液;
②染色:将胶转入0.1 % 的硝酸银溶液中震荡染色8-10 min;
③水洗:将染完色的凝胶转入蒸馏水中漂洗2-3次,洗去凝胶表面的硝酸银残余;
④显色:将冲洗完毕的凝胶转入显色液(1.5% NaOH,0.4%甲醛)中显色至条带清楚显示;
⑤冲洗:将显色液倒掉,用自来水冲洗胶片2-3次;
⑥保存:将冲洗后的凝胶放在胶片观察灯上统计分析、照相,然后用保鲜膜封存,4 ℃可保存数月。
(四)结果判断
纯合紫色材料扩增出大约152bp的产物、纯合非紫色材料扩增出大约160bp的产物,杂合紫色材, 料扩增出共显性的产物见图2,图2是B-76在紫色和橙色亲本及F2代单株中的扩增结果;泳道信息:(从左到右)M,50 bp DNA ladder;5个纯合紫色单株;5个杂合紫色单株;6个纯合非紫色单株;P是紫色亲本;O是橙色亲本。图4是标记B-76的引物在亲本14S839和14S162间的扩增序列差异。B-76-14S839表示标记B-76的引物在亲本14S839中的扩增结果;B-76-14S162表示标记B-76的引物在亲本14S162中的扩增结果。
图6中的 P1、P2分别是紫色亲本材料14S839成熟期的叶球外观和叶球剖面;O1、O2分别是橙色亲本材料14S162成熟期的叶球外观和叶球剖面。
<110> 西北农林科技大学
<120> 与大白菜紫色叶球基因BrPur连锁的SSR分子标记扩增产物序列
<160> 16
<210> 1
<211> 152bp
<212> DNA
<213> B-76-14S839.sep
<400> 1
TGGAACGCAA ATGAACCCTC ATAGAACACT TTCGTTTTGA TTTTAGTTGA TAAAT 55
TTTCTCTTAG GATTAAATTT TGATATATAT ATATATATAT ATA....... .ACTT 102
TAATTGATCT TCTGATACGC TAAAACTGAA CTTATGTGAA TTTTGCCATC 152
<210> 2
<211> 160bp
<212> DNA
<213> B-76-14S162.sep
<400> 2
TGGAACGCAA ATGAACCCTC ATAGAACACT TTCGTTTTGA TTTTAGTTGA TAAAT 55
TTTCTCTTAG GATTAAATTT TGATATATAT ATATATATAT ATATATATAT AACTT 110
TAATTGATCT TCTGATACGC TAAAACTGAA CTTATGTGAA TTTTGCCATC 160
<210> 3
<211> 140bp
<212> DNA
<213> SSR14-36-14S839.sep
<400> 3
TAAACCTAAA AATACATCTG CTTCCATATA TATATATATA TATATATATA ACAAT 55
GATATACTAC ATTTTATCAA AATAAATTAA TAATCTATAT TAGTATTTAA AAAGT 110
AATTTTTCGC ATTCAAGCTC TCACGTTAAA 140
<210> 4
<211> 128bp
<212> DNA
<213> SSR14-36-14S162.sep
<400> 4
TAAACCTAAA AATACATCTG CTTCCATATA TATATGTA.. .......... ACAAT 43
GATATACT ACATTTTA TCAAAATA AATTAATA ATCTATAT TAGTATTT AAAAAGT 98
AATTTTTC GCATTCAA GCTCTCAC GTTAAA 128
<210> 5
<211> 20bp
<212> DNA
<213> 引物对B-76上游人工序列
<400> 5
TGGAACGCAA ATGAACCCTC 20
<210> 6
<211> 25bp
<212> DNA
<213> 引物对B-76下游人工序列
<400> 6
GATGGCAAAA TTCACATAAG TTCAG 25
<210> 7
<211> 25bp
<212> DNA
<213> 引物对SSR14-36上游人工序列
<400> 7
TAAACCTAAA AATACATCTG CTTCC 25
<210> 8
<211> 22bp
<212> DNA
<213> 引物对SSR14-36上游人工序列
<400> 8
TTTAACGTGA GAGCTTGAAT GC 22
<210> 9
<211> 22bp
<212> DNA
<213> 引物对B-31上游人工序列
<400> 9
GGTCAAAACC TTTCAGAACT CCC 23
<210> 10
<211> 25p
<212> DNA
<213> 引物对B-31下游人工序列
<400> 10
AATCTTATCT TTTGGTTTGG TGCTG 25
<210> 11
<211> 22bp
<212> DNA
<213> 引物对B-51上游人工序列
<400> 11
TGGATTTGGT TAGGTGGTCA GC 22
<210> 12
<211> 22bp
<212> DNA
<213> 引物对B-51下游人工序列
<400> 12
CATGCACTTT GGGTGGAGAT AC 22
<210> 13
<211> 21bp
<212> DNA
<213> 引物对SSR14上游人工序列
<400> 13
CGAGTTGACC TGCGAACATT G 21
<210> 14
<211> 21bp
<212> DNA
<213> 引物对SSR14下游人工序列
<400> 14
CGATTCCTTC ATATTTGGTT TCAC 24
<210> 15
<211> 22bp
<212> DNA
<213> 引物对SSR17上游人工序列
<400> 15
CTCTCAATCC CTCAATCAAA CC 22
<210> 16
<211> 21bp
<212> DNA
<213> 引物对SSR17下游人工序列
<400> 16
AGGAGGCGTG CGGTTATG 18
- 还没有人留言评论。精彩留言会获得点赞!