利用非接触式与自动辨识的血液循环肿瘤细胞纯化分离的方法及装置与流程
本发明涉及血液循环肿瘤细胞纯化分离的方法及装置,尤指一种利用非接触式与自动辨识的血液循环肿瘤细胞纯化分离的方法及装置,透过现有试剂分离技术进行初步细胞分离,再结合微流体与光介电泳力技术,利用荧光抗体影像进行目标细胞专一性圈选分离,提供100%高纯度循环肿瘤细胞分离,供后端进行有效基因分析。
背景技术:
目前科学研究上分离血液中循环肿瘤细胞的方法种类繁多,不论是透过ficoll溶液去除红血球、磁珠免疫抗体套组捕捉白血球,或是微流体晶片利用化学或物理方法去除血球细胞…等等,其最终循环肿瘤细胞纯度无法有效达到100%,使得循环肿瘤细胞在非常稀少的情况下(数十颗到数百颗),进行高灵敏度次世代基因定序分析,将受到其他血球细胞的严重干扰,导致基因分析结果不精确或是误判的情况产生。
技术实现要素:
本发明的目的在于,提供一种利用非接触式与自动辨识的血液循环肿瘤细胞纯化分离的方法及装置,其所使用的光介电泳利用光来当作虚拟电极,也就是利用光照射到两平板电极中的光导材料上,于光图形周围产生不均匀的电场分布,并以该不均匀的电场来操控电极化的颗粒体。在实际操作上,使用者利用电脑介面来操作投影机的光投射,即可进行微小颗粒的操作。
藉由上述光介电泳力的原理,应用于本发明提供利用非接触式与自动辨识的血液循环肿瘤细胞纯化分离的方法,至少包括以下步骤:
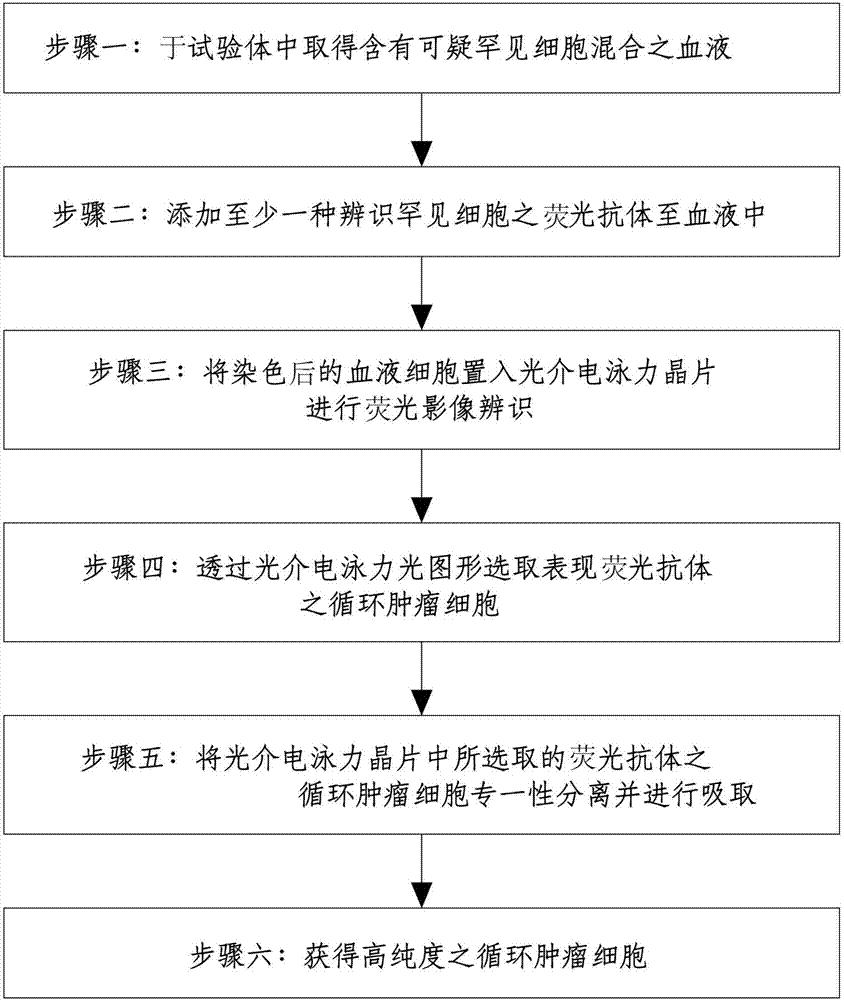
步骤一:于试验体中取得含有可疑罕见细胞混合的血液;
步骤二:添加至少一种辨识罕见细胞的荧光抗体至血液中;
步骤三:将染色后的血液细胞置入光介电泳力晶片进行荧光影像辨识;
步骤四:透过光介电泳力光图形选取表现荧光抗体的循环肿瘤细胞;
步骤五:将光介电泳力晶片中所选取的荧光抗体的循环肿瘤细胞专一性分离并进行吸取;
步骤六:获得高纯度的循环肿瘤细胞。
其中,步骤一和步骤二之间去除血液中的红血球及白血球。
其中,步骤五进行吸取前,将获得的高纯度的循环肿瘤细胞再次利用荧光影像辨识其分离纯度,判断是否有非目标细胞荧光表现;接着再利用荧光影像辨识其是否均是有核细胞,而非获取伪阳性目标,以达到更进一步检查及纯化循环肿瘤细胞的目的。
其中,步骤二所述的荧光抗体为荧光接合专一抗体,并将收集得到表现微弱或不表现cd45的疑似肿瘤细胞结合,上述荧光接合专一抗体为上皮细胞粘合蛋白、细胞角质蛋白、癌干细胞表面抗原、表皮生长因子受体、钙粘蛋白。
其中,高纯度的循环肿瘤细胞可用于癌症的侦测及术后愈合的治疗判断,更可延伸应用于基因分析、抗药性测试及药物测试。
本发明另外提供一种利用非接触式与自动辨识的血液循环肿瘤细胞纯化分离方法的装置,至少包括:
一晶片本体,包括一第一导电玻璃、一生物相容性胶膜及一第二导电玻璃;该生物相容性胶膜设置于该第一导电玻璃下层,该生物相容性胶膜横向设置一主要通道,垂直设置一侧边微通道,该主要通道与该侧边微通道交叠区域为一细胞分离区;
该第一导电玻璃上层相对应该主要通道两端分别设置一第一孔洞及一第二孔洞,及该侧边微通道的末端设置一第三孔洞,该第一孔洞上设置一样本置放槽,该第二孔洞上设置一废物排出槽,该第三孔洞设置一标的物收集槽;
该第二导电玻璃设置于该生物相容性胶膜底部;
一控制器,内部设置一光学投影装置及一影像撷取装置。
其中,该第一导电玻璃周缘与该主要通道相对应位置设置一第一电极通道,与该侧边微通道相对应位置设置一第二电极通道。
其中,该第二导电玻璃朝向该第一导电玻璃的反向板面涂布一导光层。
其中,该晶片本体外部系连接设置一液体驱动组件及一讯号产生装置,且该液体驱动组件与该讯号产生装置相互连结。
本发明还提供了一种利用非接触式与自动辨识的血液循环肿瘤细胞纯化分离方法的装置,至少包括:
一晶片本体,该晶片本体包括一第一导电玻璃及一第二导电玻璃;
该第一导电玻璃与该第二导电玻璃相向设置,且该第一导电玻璃下层或该第二导电玻璃上层横向设置一主要通道,垂直设置一侧边微通道,该主要通道与该侧边微通道交叠区域为一细胞分离区;
该第一导电玻璃上层相对应该主要通道两端分别设置一第一孔洞及一第二孔洞,及该侧边微通道的末端设置一第三孔洞,该第一孔洞上设置一样本置放槽,该第二孔洞上设置一废物排出槽,该第三孔洞设置一标的物收集槽;
一控制器,内部设置一光学投影装置及一影像撷取装置。
其中,该第一导电玻璃侧边与该主要通道相对应位置设置一第一电极通道,与该侧边微通道相对应位置设置一第二电极通道。
其中,该第二导电玻璃朝向该第一导电玻璃的反向板面涂布一导光层。
其中,该晶片本体外部连接设置一液体驱动组件及一讯号产生装置,且该液体驱动组件与该讯号产生装置相互连结。
本发明的优点在于:
首先,本发明能够提供100%高纯度循环肿瘤细胞样本;第二,透过本发明可任意标记研究需求所需的荧光抗体,只要影像系统可辨识荧光标记,皆可抓取目标细胞,无论是想研究癌症病患残余的白血球、混在循环肿瘤细胞中的癌干细胞,甚至是具有高度转移能力的循环肿瘤细胞会表现的细胞表面抗原,皆可藉由荧光抗体辨识标记,提供循环肿瘤细胞研究一个更弹性更精准的分离方法;第三,若能纯化分离出这些癌症病患血液中稀少的循环肿瘤细胞,未来将可取代高风险原位癌组织的手术取样,简易地抽取病患血液进行癌细胞基因分析,即可得知目前癌症病患的肿瘤情况;最后,本发明所获得的高纯度循环肿瘤细胞,后端将不再受到正常血球细胞的影响,可针对个别病人的循环肿瘤细胞进行高灵敏度次世代基因定序,看其对于抗癌药物的基因表现反应,或是供药厂作为开发药物的依据,此发明大大提升后端进行个人化循环肿瘤细胞基因分析的精确度及灵敏度。
附图说明
图1:为本发明的流程方块图。
图2:为本发明系统架构示意图。
图3:为本发明第一实施例的光介电泳力晶片立体示意图。
图4:为本发明第一实施例的光介电泳力晶片立体分解示意图。
图5:为本发明第二实施例的光介电泳力晶片立体分解示意图。
图6:为本发明第三实施例的光介电泳力晶片立体分解示意图。
图7:为本发明的方法及装置实际操作血液循环肿瘤细胞纯化分离的分解影像拍摄图。
具体实施方式
参阅图1,本发明提供一种利用非接触式与自动辨识的血液循环肿瘤细胞纯化分离的方法,至少包括以下步骤:步骤一:于试验体中取得含有可疑罕见细胞混合的血液;步骤二:添加至少一种辨识罕见细胞的荧光抗体至血液中;步骤三:将染色后的血液细胞置入光介电泳力晶片进行荧光影像辨识;步骤四:透过光介电泳力光图形选取表现荧光抗体的循环肿瘤细胞;步骤五:将光介电泳力晶片中所选取的荧光抗体的循环肿瘤细胞专一性分离并进行吸取;步骤六:获得高纯度的循环肿瘤细胞。
其中,步骤一和步骤二之间去除血液中的红血球及白血球,上述除去血球步骤能增加染色后可疑罕见细胞的收集速度;去除血液中的红血球的方法可为物理分离法或化学去除法,去除血液中的白血球的方法系使用cd45鸡尾酒磁性抗体套组辨识,并去除有核细胞中所有表现cd45的白血球细胞。
其中,步骤五进行吸取前,将获得的高纯度的循环肿瘤细胞再次利用荧光影像辨识其分离纯度,判断是否有非目标细胞荧光表现;接着再利用荧光影像辨识其是否均是有核细胞,而非获取伪阳性目标,以达到更进一步检查及纯化循环肿瘤细胞的目的。
上述中,去除血液中的红血球的物理分离法的步骤为:(a)取一可造成细胞密度差异分离的物质至新管子中后再缓慢加入血液,上述物质与血液的体积比为3:4,得到一混合液;(b)以转速400g离心30分钟;使该混合液产生分层现象,最上层为血清层,中层为透明溶液层,底层为红血球层;(c)取出血清层与透明溶液层之间乳白色交界的周围血液单核球细胞层至一新离心管;(d)利用生理食盐水冲洗数次;(e)获得不含红血球的血液。
其中,上述物质为蔗糖或其他多醣类。
上述中,去除血液中的红血球的化学去除法系利用渗透压原理,使血液中无细胞核的红血球胀破,有细胞核的白血球保留,方法为:(a)配置反应试剂1x红血球裂解缓冲液(rbclysisbuffer)1000ml,使用8.26g的氯化铵(nh4cl),1.19g的碳酸氢钠(nahco3),200μl0.5mph8的乙二胺四乙酸(edta)并添加1000ml无菌蒸馏水,待溶解后再调整最终ph值为7.3;(b)加入血液与反应试剂,其体积比依序为1:5,并静置反应10分钟;(c)接着以转速400g离心五分钟,去除上清液;(d)加入10ml磷酸盐缓冲盐液(pbs)冲洗细胞一次,并再次离心400g,5分钟;(e)最后除去上清液,剩余的即为白血球与其余罕见的有核细胞。
其中,步骤二所述的荧光抗体为荧光接合专一抗体,并将上述抗体收集得到表现微弱或不表现cd45的疑似肿瘤细胞结合,上述荧光接合专一抗体为上皮细胞粘合蛋白、细胞角质蛋白、癌干细胞表面抗原、表皮生长因子受体、钙粘蛋白。
上述中,高纯度的循环肿瘤细胞可用于癌症的侦测及术后愈合的治疗判断,更可延伸应用于基因分析、抗药性测试及药物测试。
参阅图2~图4,本发明另外提供一种利用非接触式与自动辨识的血液循环肿瘤细胞纯化分离的装置,至少包括:一晶片本体5,包括一第一导电玻璃10、一生物相容性胶膜12及一第二导电玻璃14;该生物相容性胶膜12设置于该第一导电玻璃10下层,该生物相容性胶膜12横向设置一主要通道18,垂直设置一侧边微通道20,该主要通道18与该侧边微通道20交叠区域为一细胞分离区22;该第一导电玻璃10上层相对应该主要通道18两端分别设置一第一孔洞24及一第二孔洞26,及该侧边微通道20的末端设置一第三孔洞28,该第一孔洞24上设置一样本置放槽30,该第二孔洞26上设置一废物排出槽32,该第三孔洞28设置一标的物收集槽34;该第二导电玻璃14设置于该生物相容性胶膜12底部;一控制器60,内部设置一光学投影装置62及一影像撷取装置64。
其中,该第一导电玻璃10周缘与该主要通道18相对应位置设置一第一电极通道161,与该侧边微通道20相对应位置设置一第二电极通道162。
其中,该第二导电玻璃14朝向该第一导电玻璃10的反向板面涂布具导光性的一导光层141,使该第二导电玻璃14具有导光特性。
其中,该晶片本体5外部连接设置一液体驱动组件52及一讯号产生装置54,且该液体驱动组件52与该讯号产生装置54相互连结。
参阅图2、图5、图6,本发明另一实施例为利用非接触式与自动辨识的血液循环肿瘤细胞纯化分离方法的装置,至少包括:一晶片本体5,该晶片本体5包括一第一导电玻璃10及一第二导电玻璃14;该第一导电玻璃10与该第二导电玻璃14相向设置,且该第一导电玻璃10下层或该第二导电玻璃14上层横向设置一主要通道18,垂直设置一侧边微通道20,该主要通道18与该侧边微通道20交叠区域为一细胞分离区22;该第一导电玻璃10上层相对应该主要通道18两端分别设置一第一孔洞24及一第二孔洞26,及该侧边微通道20的末端设置一第三孔洞28,该第一孔洞24上设置一样本置放槽30,该第二孔洞26上设置一废物排出槽32,该第三孔洞28设置一标的物收集槽34;一控制器60,内部设置一光学投影装置62及一影像撷取装置64。
其中,该第一导电玻璃10侧边与该主要通道18相对应位置设置一第一电极通道161,与该侧边微通道20相对应位置设置一第二电极通道162。
其中,该第二导电玻璃14朝向该第一导电玻璃10的反向板面涂布一导光层141。
其中,该晶片本体5外部系连接设置一液体驱动组件52及一讯号产生装置54,且该液体驱动组件52与该讯号产生装置54相互连结。
操作时,该第一导电玻璃10若为正极,则该第一电极通道161及该第二电极通道162同样为正极,该第二导电玻璃14则为负极;相反地,若该第一导电玻璃10为负极,该第二导电玻璃14则为正极。
详细实施流程参阅图7,首先从受试癌症病患中取得血液,透过目前现有的技术先将大部分的红血球及白血球去除,接着将剩余的血液细胞藉由市售免疫荧光抗体进行染色,将染色后的血液细胞添加至样本置放槽,接着(i)从流动的细胞悬浮液中,使用者藉由荧光影像辨识找寻荧光标记的目标循环肿瘤细胞;(ii)当具有荧光标记的目标循环肿瘤细胞于细胞隔离区出现时,会先使细胞悬浮液体暂停流动,待收集完成后再使细胞悬浮液体继续流动;(iii)辨识目标循环肿瘤细胞及非目标循环肿瘤细胞(白血球);(iv)确定标记的细胞有细胞核,而非伪阳性荧光标记或是杂质非专一性标记;(v)利用光介电泳力圈选固定目标细胞;(vi)利用光介电泳力扫除非目标细胞(白血球),使其存放至废物排出槽;(vii)利用光介电泳力将圈选固定的目标细胞移至标的物收集槽;(viii)目标循环肿瘤细胞在标的物收集槽中;(ix)利用光介电泳力将目标细胞往下收集至下端;最后,(x)利用荧光影像辨识其分离纯度,判断是否有非目标细胞荧光表现;(xi)再透过荧光影像辨识其是否均是有核细胞,而非获取伪阳性目标;(xii)等待将其抽取供后端分析。
上述中,总操作时间为20分钟,以2.5ul/min流速操作(10分钟流动,10分钟静止操作),操作细胞体积30ul,总细胞数约104。
- 还没有人留言评论。精彩留言会获得点赞!