一种鉴别地方猪品种的结构变异SV200分子标记的制作方法
本发明涉及家畜分子生物学检测领域,具体来说,涉及一种鉴别地方猪品种与大白猪的结构变异分子标记技术。
背景技术:
自野猪被驯化以来,生存环境和人工选择等因素造就了多种多样的家猪品种,特别是地方猪品种的体型外貌、行为特征、生长繁殖性能等方面存在很大的差异(王亚楠,2015)。贵州地方猪品种体质健壮、基因纯和、肉质香嫩、抗逆性强,耐粗饲(蒋会梅等,2012),具有丰富的遗传多样性,源自欧洲的、已实现全球商品化的大白猪,在瘦肉率、生长速度等方面有明显的优势。两大类猪品种所具有的优势在实践生产中将依据人类的需求进行选择性利用,是新品种选育的基础。如何区分地方猪品种和欧洲商品猪,特别是在地方猪群体中甄别有没有欧洲猪血统的掺入,当前缺乏准确的技术。
我们测定了香猪的全基因组序列,从中发现了一个结构变异SV200。结构变异(structural variations,SVs)包括基因组水平发生的片段的插入、缺失、倒位、重复、易位和拷贝数变异等(姜玥,2013)。研究表明,基因组结构变异与个体的表型变异和疾病的发生有关。1976年发现果蝇棒眼的形成是由于bar基因发生了复制所致(Muller,1936)。通过第二代测序技术,从中国恒河猴(Chinese rhesus macaque)基因组中检测出125150个结构变异;这些结构变异中有123610个缺失型变异,长度为25bp~10kb,其中63%的缺失位于基因的间隔区,35%位于基因中(Fang xiaodong,et al,2011)。从小鼠基因组鉴定出的711920个SVs中发现,98%的SV是缺失或插入类型,一半以上的SV是由逆转录转座子引起的(Binnaz Yalcinl,et al,2011)。人类发生A型血友病是由于F8基因发生倒位所致;SOX3基因缺失及340kb片段的插入,使病人出现X连锁的隐性甲状腺功能减退(何永蜀等,2009)。
本发明所述的结构变异SV200位于基质金属蛋白酶15(matrix metallopeptidase 15,MMP-15)基因的内含子5中。MMP-15属于基质金属蛋白酶家族(MMPs),是高度保守的、依赖于Zn2+等金属离子的蛋白水解酶。MMPs几乎能降解所有细胞外基质成分,通过降解细胞外基质来维持基因的平衡,影响细胞的正常分化、迁移,参与血管生成、伤口愈合、胚胎形成及组织重构等生理过程(丁巍等,2011)。从香猪基因组中发现的结构变异SV200的功能不明。
技术实现要素:
本发明要解决的技术问题是:提供一种鉴别地方猪品种的结构变异SV200分子标记。
本发明的技术方案是:一种在地方猪品种群体中以缺失(D)为主的结构变异SV200,缺失片段长度为155bp,序列是SEQ ID No.3,位于猪参考基因组Sscrofa 10.2的chr 6:17953135-17953289,MMP-15基因内含子5中,将结构变异SV200存在的两种等位基因命名为D或A,分别对应DD、AA和DA三种基因型。
本发明还提供用于检测结构变异SV200的一对引物,所述的引物分别为:上游引物F:5’-CCCTGTTCCTCCCATTGTCA-3’,下游引物R:5’-ATGGCCACCGTGTCAAAGTC-3’,目的序列分别为SEQ ID No.1和SEQ ID No.2。
本发明还提供所述结构变异SV200在不同猪品种群体中的检测方法。
该方法包括以下步骤:
(1)提取待测猪品种的基因组DNA;
(2)以待测样品基因组DNA为模板,利用引物F和R进行PCR扩增,用1.5%琼脂糖凝胶电泳检测PCR产物,以凝胶成像系统分析判断基因型,分析待测样品的猪品种。
步骤(2)中进行PCR扩增的体系为20μL:2×Taq PCR Master Mix10μL,10μmol/L上游引物F 0.4μL,10μmol/L下游引物F 0.4μL,ddH2O 8.2μL,10ng/μL基因组DNA 1μL;进行PCR反应采用的条件:1)预变性:94.0℃5min;2)扩增反应:变性:94.0℃30sec,退火:57℃30sec,延伸:72.0℃45sec,30个循环;72.0℃10min。
本发明进一步提供所述结构变异SV200鉴别地方猪品种群体的分子标记的应用技术。
前述的应用包括以下步骤:
(1)应用PCR技术检测结构变异SV200在不同猪品种群体中的基因型分布情况。
(2)采用SPSS v20.0进行基因频率的差异显著性检验,分析结构变异SV200在5个地方猪品种和大白猪之间的差异。
(3)根据结构变异SV200的基因型辅助鉴别猪品种。
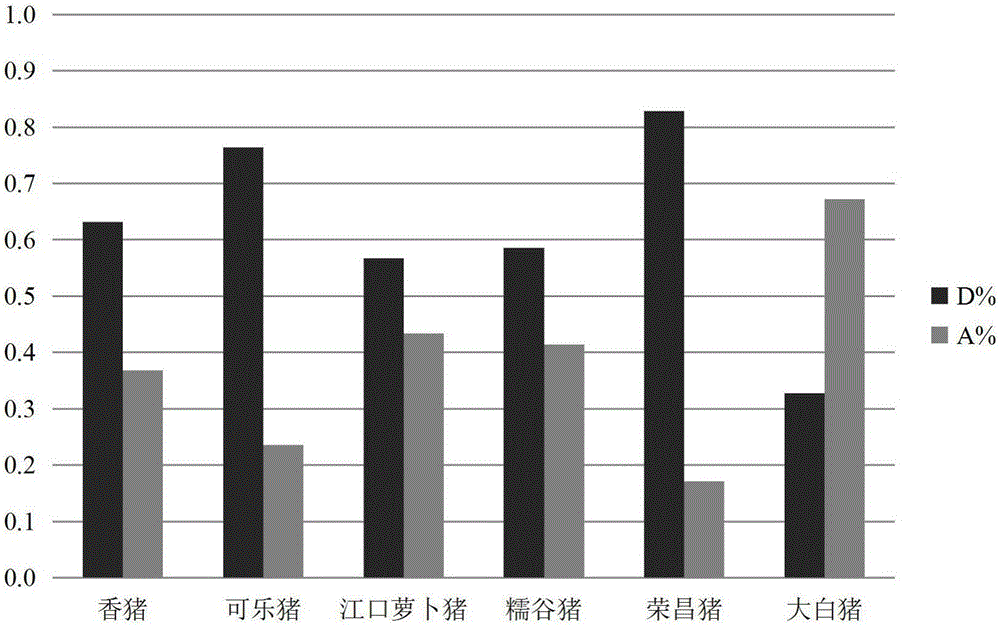
本发明对6个猪品种群体中的结构变异SV200进行了检测(表2),5个地方猪品种群体均以DD和DA基因型为主,大白猪群体主要以AA和DA基因型为主;大白猪群体的D基因频率明显低于5个地方猪品种,经SPSS v20.0软件的χ2检验分析,5个地方猪品种群体与大白猪的D基因频率间的差异极显著(P<0.01),5个地方猪品种群体之间,D基因频率的差异不大(P>0.05)。
将纯合的DD和AA基因型扩增条带回收,克隆测序,与猪参考基因组Sscrofa 10.2进行比对,确定结构变异SV200的缺失片段长度为155bp,位于MMP-15内含子5中。采用TRANSFAC等软件分析,未能从155bp的缺失区域中找到转录因子结合位点(TFBS)。
MMP-15基因编码基质金属蛋白酶,属于基质金属蛋白酶家族(MMPs)。MMP-15又称MT-MMP2,即膜型金属蛋白酶-2,主要降解层粘蛋白(游绍莉等,2001),在胚胎发育过程中MMPs广泛表达,MMP15a基因在斑马鱼胚胎受精后一个细胞时期就开始表达(李艳欢等,2009)。在卵巢癌中,HLA-G与MMP-15基因的表达有很强的相关性,HLA-G参与肿瘤侵袭或肿瘤转移,可能依赖于NK细胞毒性抑制和MMP-15基因表达的诱导(Wei huayan,2013)。MMP-15基因位于人类基因组16q13,从中发现多个SNP位点,rs12447804位点位于该基因的一个内含子上,其C/T多态性与广东潮汕人群阻塞性肺病的发病有关(邓燕,2014)。人的MMP-15基因有2个转录本(参照Ensembl)。
本发明检测了结构变异SV200在6个猪品种群体中的分布情况,并对该结构变异区域的进行了生物信息学分析,统计学分析显示,5个地方猪品种群体的SV200发生缺失(D基因)的频率明显高于大白猪的相应值(P<0.01),结构变异SV200可作为鉴别地方猪品种的分子标记,为地方猪品种的鉴别和辅助选育提供技术支持。
本发明的有益效果:(1)本发明提供的地方猪品种结构变异SV200不受地方猪品种的年龄、性别、饲养条件等因素的限制。
(2)本发明建立的检测地方猪品种结构变异SV200的方法准确可靠,操作简便。
(3)地方猪品种结构变异SV200分子标记,可为地方猪品种的分子标记辅助选育技术奠定技术基础。
附图说明
图1为本发明实施例1中结构变异SV200的基因分型结果;
图2为本发明实施例2中地方猪品种结构变异SV200基因频率与大白猪的比较。
具体实施方式
以下实例对本发明做进一步的解释,但不限定本发明的范围,若无特别指明,实施例中所用的技术方法和条件均为本领域技术人员所熟知的技术方法和常规实验条件,或按照相关试剂厂商说明书建议的方法和条件。
实施例1猪结构变异SV200的检测技术,步骤如下:
1、提取基因组DNA
本发明采用天根生化科技(北京)有限公司生产的血液/细胞/组织基因组DNA提取试剂盒(离心柱型)提取基因组DNA,具体方法如下:
1)处理材料
a、如果材料是血液,直接取200μL新鲜、冷冻或加入各种抗凝剂的血液,不足200μL可加缓冲液GA补足。
b、如果材料是组织,取50mg组织样品剪碎,加入200μL缓冲液GA,震荡至彻底悬浮。
2)加入20μLProteinase K溶液,混匀。
a、提取血液基因组时,只需加入Proteinase K溶液混匀,即可进行下一步;
b、提取组织基因组时,加入Proteinase K溶液混匀后,56℃水浴直至组织颗粒全部溶解,瞬时离心去除管盖内壁的水珠,再进行下一步。
3)加入200μL缓冲液GB,充分颠倒混匀,70℃放置10min,溶液应变清亮,瞬时离心去除内壁水珠;
4)加入200μL无水乙醇,充分震荡混匀15sec,此时可能会出现絮状沉淀,瞬时离心以去除管盖内壁水珠;
5)将上步所得溶液和絮状沉淀都加入吸附柱CB3中(吸附柱放入收集管中),12000rmp离心30sec,倒掉废液;
6)向吸附柱CB3中加入500μL缓冲液GD(使用前需加入无水乙醇),12000rmp离心30sec,倒掉;
7)向吸附柱CB3中加入600μL漂洗液PW(使用前需加入无水乙醇),12000rmp离心30sec,倒掉废液;
8)重复操作步骤(7)一次;
9)将吸附柱CB3放回收集管中,12000rmp离心2min,倒掉废液。将吸附柱CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
10)将吸附柱CB3转入一个干净的离心管中,向吸附膜中间部位悬空滴加50-200μL洗脱缓冲液TE,室温放置2-5min,12000rmp离心2min,将DNA溶液收集到离心管中;
11)为增加基因组DNA的得率,将离心得到的溶液再重复加入吸附柱CB3中,室温放置2min,12000rpm离心2min,收集DNA溶液,进行下一步实验或-20℃保存。
2、目标序列的扩增
本发明所述的结构变异SV200位于chr 6:17953135-17953289,参考NCBI Genbank收录的相应序列,使用PrimerPremier 5.0软件设计两条引物,上游引物F:5’-CCCTGTTCCTCCCATTGTCA-3’,下游引物R:5’-ATGGCCACCGTGTCAAAGTC-3’,目的片段分别为960bp和805bp,测序后得出目的序列分别为SEQ ID No.1和SEQ ID No.2。
PCR扩增体系为20μL:2×Taq PCR Master Mix 10μL,10μmol/L上游引物F 0.4μL,10μmol/L下游引物F 0.4μL,ddH2O 8.2μL,10ng/μL基因组DNA 1μL;进行AS-PCR采用的反应条件:1)预变性:94.0℃5min;2)扩增反应:变性:94.0℃30sec,退火:57℃30sec,延伸:72.0℃45sec,30个循环;72.0℃10min。
3、PCR产物琼脂糖凝胶电泳检测及基因型判断
PCR扩增结束后,取5μLPCR产物经1.5%的琼脂糖电泳检测,0.5μg/mL溴乙锭染色,凝胶成像系统记录条带。
每个样品,若只扩增出805bp的单条带,将基因型定义为DD型;若扩增出805bp和960bp的双条带,将基因型定义为DA型;若只扩增出960bp的单条带,将基因型定义为AA型(图1)。
实施例2结构变异SV200基因型在各猪品种中的分布及检测应用
按照实施例1的方法,试验材料如表1所示,以chr 6:17953135-17953289为候选结构变异,命名为SV200,利用PCR技术检测6个猪品种中结构变异SV200的基因型(表2和图2),应用SPSS v20.0软件中的χ2检验,分析结构变异SV200的基因频率。结果显示,地方猪品种的结构变异SV200以“缺失”基因(D)为主,大白猪以“正常”的A基因为主,地方猪品种与大白猪群体间的基因频率差异极显著(P<0.01)。
表1试验材料及来源统计表
表2结构变异SV200的基因型和基因频率
(备注:同列数据肩标字母不同表示差异显著(P<0.05);相同字母表示差异不显著(P>0.05)
- 还没有人留言评论。精彩留言会获得点赞!