一种妊娠期酒精暴露对胎儿脑损伤的体外模型建立方法与流程
本发明微流控芯片技术,具体涉及一种妊娠期酒精暴露对胎儿脑损伤的体外模型建立方法。
背景技术:
研究病理条件的分子学和细胞学机制研究为我们更好地了解、控制和治疗疾病提供了基础。传统的生物方法主要包括2d的细胞培养方式和动物模型。2d的细胞培养无法模拟生理条件下细胞的微环境,包括三维细胞外基质、间隙流、细胞间相互作用等,因此与生理条件下相比细胞的形态功能有很大不足,不能完全反映病理条件下分子层面和细胞层面的异常变化。而动物实验目前主要是使用鼠、兔、果蝇、线虫等模式生物,虽然模式生物来源方便、培养条件简单,但是基于人与动物的极大不同,因此很难完全反映各种条件下人体的生理变化。而对于人体的研究在保证最低损伤和方便观察的前提下,较为常用的有核磁共振、ct等,但是这些方法不具实时监测特点,并且很多都无法应用于胎儿发育、
近几年来各种干细胞来源的类器官发育得到了有效发展,包括神经干细胞、肠干细胞、胚胎干细胞以及ipscs。类器官的特征是干细胞或原代细胞自发形成的3d细胞团结构,其含有相应组织器官的多种功能细胞,这些细胞自组装成具有一定结构功能特异性的组织,一定程度上模拟了相应组织器官的发育过程。其中体外hipscs来源的3d脑基本复制了胎儿早期脑发育的过程。
但是目前来看类器官技术也有许多不足和需要改进的地方。由于其3d细胞团的结构特点,使得内部细胞由于缺少氧气和营养,出现大规模死亡,极大限制了体外类器官发育的程度,包括体积大小、功能成熟度等,而在生理情况下组织和器官中分散着血管组织来提供所需的氧气和营养。因此结合其他技术有望弥补这种不足。此外,现有的传统细胞培养技术培养类器官操作复杂、耗费时间长、可控性差。因此与现有的生物工程类手段结合有望优化类器官技术。
丝状结构作为培养载体,有几大优势:首先,借助微流控芯片技术可根据实际应用灵活高效产生不同尺寸、厚度的海藻酸钠丝。其次,丝状结构具有较高的比表面积比,利于物质交换,对于细胞培养提供良好的生存环境。再次,丝状结构可导向细胞团的生长,产生结构类似的脑组织,并在发育过程中限制其生长,一定程度上模拟了生理情况下脑膜的作用。最后,海藻酸钠材料可在高盐或柠檬酸钠条件下溶解,释放细胞,满足不同的处理需求。
但是目前将生物工程与hipscs来源的类器官相结合,建立人属的疾病模型领域尚属空白。
技术实现要素:
本发明的目的是提供一种妊娠期酒精暴露对胎儿脑损伤的体外模型建立方法,该方法使用海藻酸钠中空丝作为细胞培养载体,不仅保证了发育过程中的物质运输,同时实现可控的发育结构,并具实时监测的特点。
本发明提供了一种妊娠期酒精暴露对胎儿脑损伤的体外模型建立方法,其步骤主要分为四部分:
(1)海藻酸钠中空丝的制备;
(2)3d脑前期诱导;
(3)3d脑包裹在海藻酸钠中空丝内;
(4)酒精处理3d脑。
步骤(1)海藻酸钠中空丝的制备,具体为:
所述海藻酸钠中空丝的制备是利用套管形式的微流控芯片,制备的中空丝内径为600-1000μm,管壁厚度为50-200μm,所用液体无菌处理。
所述海藻酸钠丝需浸泡在dmem/f12培养基中,使其完成在培养基中的溶胀过程,并在4℃低温保存,便于后续操作。
步骤(2)3d脑前期诱导,具体为:
(1)使用带有坑状结构的pdms芯片制备拟胚体:坑状结构的芯片置于24孔板内,小坑结构直径为600-800μm,深度为100-300μm,用于拟胚体的形成。
(2)第1天,制备拟胚体,将2×105-6×105个hipscs消化成单细胞,并转移至(1)所述的芯片中,离心500-2000rpm,3-5min,所用培养基为ksr培养基,并加入5μmy27632;
所述ksr培养基的基础成分为dmem/f12,另外需添加占总体积20%的knockoutreplacement(ksr),占总体积1%neaa(nonessentialaminoacid,100×),占总体积1%glutamax(100×),占总体积1%penicillin-streptomycin(100×),以及0.1mmbeta-mercaptoethanol,4ng/mlbfgf。
(3)第2天,将形成的拟胚体转移至低粘附的培养皿中,悬浮培养拟胚体,所用培养基为ksr培养基。
(4)第5天,诱导拟胚体向神经上皮方向分化,将ksr培养基替换为神经诱导培养基;细胞团仍保持悬浮培养,每3天更换培养基。
其中神经诱导培养基的基础成分为dmem/f12,另外需添加占总体积1%n2(100×),占总体积1%glutamax(100×),占总体积1%neaa(nonessentialaminoacid,100×),1μg/mlheparin,占总体积1%penicillin-streptomycin(100×)。
使用坑状结构的pdms芯片制备拟胚体,其大小可通过小坑体积的变化以及细胞悬液中细胞的数量来调节,细胞球的大小范围约为50-500μm。
hipscs使用accutase进行适度消化,消化时间约为2-5min,确保最后消化成较小的细胞块。若消化过度成为散在的单个细胞,会使拟胚体结构中含有较多死细胞,影响后来的分化和发育;若消化不足,影响拟胚体的成球效果,较难形成大小一致的细胞团。
hipscs使用accutase消化成比较小的细胞块后,进行后续离心操作,使细胞尽可能的聚集在一起,利于形成体积比较大的拟胚体,有效提高后续脑发育的成功率。
虽然拟胚体可在几个小时内形成,但是需要确保细胞24小时内在pdms芯片内静置培养,确保拟胚体结构的稳定。
步骤(3)3d脑包裹在海藻酸钠中空丝内,具体为:
第10天,使用matrigel重悬前期诱导的细胞团,并用注射器将细胞团注入海藻酸钠丝内,整个过程避免产生气泡,确保冰上操作维持低温,保证matrigel不凝固。
将含有细胞团的海藻酸钠丝置于37℃培养箱20-30min,使matrigel凝固。
将含有细胞团的海藻酸钠丝转移至6孔板中进行后续培养,所用培养基为神经分化培养基。
所述神经分化培养基,所用培养基为神经分化培养基,其基础成分为体积比为1:1的dmem/f12和neuralbasalmedium,另外需添加占总体积1%b27(50×),占总体积0.5%n2(100×),占总体积0.5%neaa(100×),占总体积1%glutamax(100×),占总体积1%penicillin-streptomycin(100×),0.05mmbeta-mercaptoethanol。
3d脑的发育过程需要使用matrigel,matrigel作为细胞外基质为3d脑发育提供三维介质,利于3d脑的快速发育。
步骤(4)酒精处理3d脑具体步骤为:
第11天,对照组使用神经分化培养基培养3d脑,样品组使用酒精浓度为20-200mm的神经分化培养基培养3d脑,所用的培养基需现用现配。此外样品组中6孔板间隙内需加入含同浓度酒精的pbs缓冲液,需使用封口膜密封,降低酒精挥发。由于酒精的挥发以及确保营养物质的供应,样品组和对照组都是每两天换一次培养基。
本发明一种妊娠期酒精暴露对胎儿脑损伤的体外模型,其后续检测方法如下:
(1)显微镜明场下实时监测酒精处理情况下3d脑的生长速度和发育状态;
(2)rt-pcr方法检测酒精处理组3d脑发育的异常。
(3)使用冷冻切片技术,将细胞团切成10-20μm厚度,进行免疫荧光染色,检测酒精处理组3d脑发育的异常;
(4)tunel方法检测酒精处理组3d脑发育过程中的细胞凋亡。
本发明中海藻酸钠中空丝可根据实验要求设计成不同的直径大小和管壁厚度。
本发明中空丝的材料不仅限于海藻酸钠,还包括其他生物相容性比较好的材料。
本发明中空丝的制备方法不仅限于套管形式,还包括微流控芯片方式。
本发明提供一种妊娠期酒精暴露对胎儿脑损伤的体外模型,也适用于研究酒精对其他不同干细胞(包括胚胎干细胞)来源的类器官的发育的影响,已发表的类器官组织包括肠、胃、视网膜、脑等。该模型作为创新的体外器官发育疾病模型,不仅利于直观观察酒精对脑发育的形态学影响,也可以借鉴各种检测方法,研究酒精对脑发育影响的分子学和细胞学机制,弥补了传统细胞实验和动物实验的不足,为研究妊娠期酒精对胎儿早期脑发育的影响提供了有力的工具。
附图说明
图1本发明明场条件下对照组和样品组3d脑发育情况跟踪;
图2免疫组化及冷冻切片方法检测对照组和样品组3d脑发育情况;
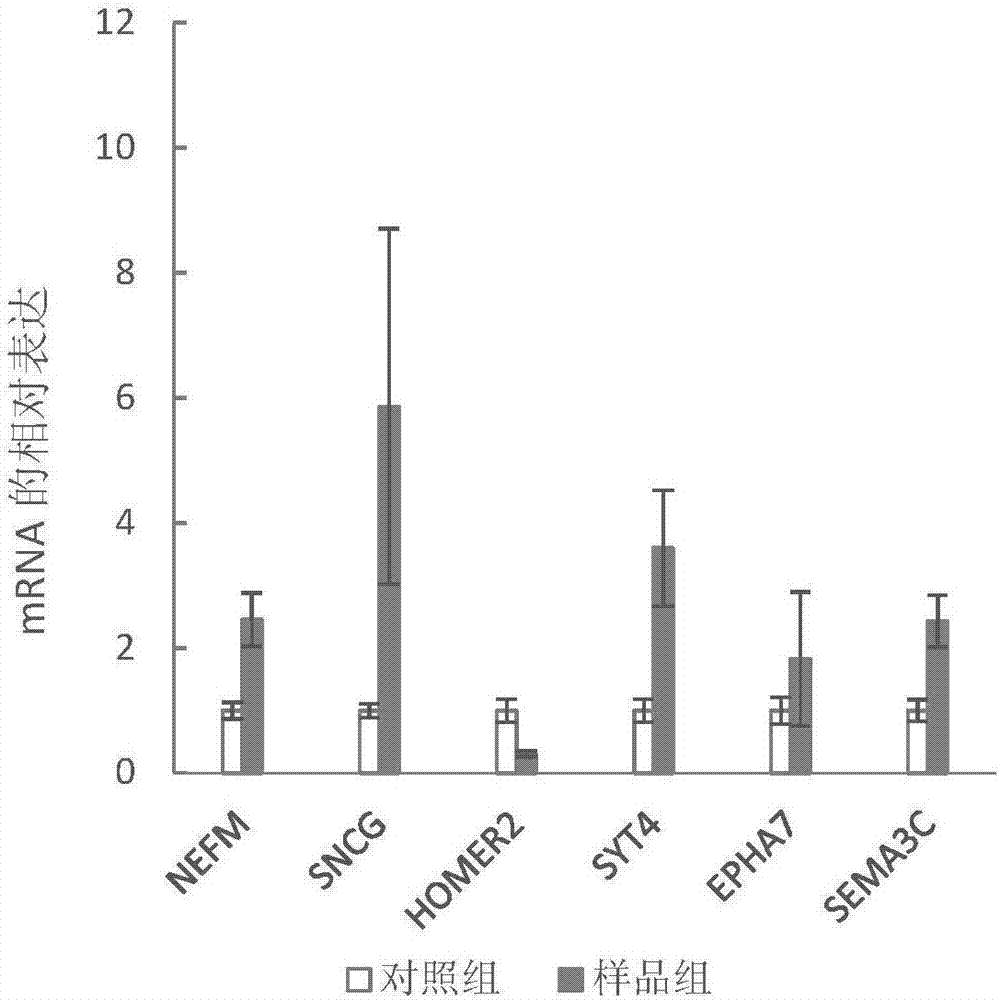
图3rt-pcr方法检测3d脑发育过程中神经及不同脑区基因表达情况。
具体实施方式
下面的实施例将对本发明予以进一步的说明,但并不因此而限制本发明。本发明所采用的所有试剂均为市购。
实施例1
妊娠期酒精暴露对胎儿脑损伤的体外模型建立
其步骤主要分为四部分:海藻酸钠中空丝的制备、3d脑前期诱导、3d脑包裹在海藻酸钠中空丝内和酒精处理3d脑。
步骤(1)海藻酸钠中空丝的制备,具体为:所述海藻酸钠中空丝的制备是利用套管形式的微流控芯片,制备的中空丝内径为600-1000μm,管壁厚度为50-200μm,所用液体无菌处理。所述海藻酸钠丝需浸泡在dmem/f12培养基中,使其完成在培养基中的溶胀过程,并在4℃低温保存,便于后续操作。
步骤(2)3d脑前期诱导,具体为:使用带有坑状结构的pdms芯片制备拟胚体:坑状结构的芯片置于24孔板内,小坑结构直径为800μm,深度为300μm,用于拟胚体的形成。第1天,制备拟胚体,将2×105-6×105个hipscs消化成单细胞,并转移至带有坑状结构的pdms芯片中,离心1000rpm,5min,所用培养基为ksr培养基,并加入5μmy27632;
ksr培养基的基础成分为dmem/f12,另外需添加占总体积20%的knockoutreplacement(ksr),占总体积1%neaa(nonessentialaminoacid,100×),占总体积1%glutamax(100×),占总体积1%penicillin-streptomycin(100×),以及0.1mmbeta-mercaptoethanol,4ng/mlbfgf。
第2天,将形成的拟胚体转移至低粘附的培养皿中,悬浮培养拟胚体,所用培养基为ksr培养基。第5天,诱导拟胚体向神经上皮方向分化,将ksr培养基替换为神经诱导培养基。细胞团仍保持悬浮培养。每3天更换培养基。
其中神经诱导培养基的基础成分为dmem/f12,另外需添加占总体积1%的n2(100×),占总体积1%的glutamax(100×),占总体积1%的neaa(nonessentialaminoacid,100×),1μg/mlheparin,占总体积1%的penicillin-streptomycin(100×)。
步骤(3)3d脑包裹在海藻酸钠中空丝内,具体为:第10天,使用matrigel重悬前期诱导的细胞团,并用注射器将细胞团注入海藻酸钠丝内,整个过程避免产生气泡,冰上操作维持低温,保证matrigel不凝固。将含有细胞团的海藻酸钠丝置于37℃培养箱30min,使matrigel凝固。将含有细胞团的海藻酸钠丝转移至6孔板中进行后续培养,所用培养基为神经分化培养起,其基础成分为体积比为1:1的dmem/f12和neuralbasalmedium,另外需添加占总体积体积1%的b27(50×),总体积0.5%的n2(100×),总体积的0.5%neaa(100×),总体积1%的glutamax(100×),总体积体积的1%penicillin-streptomycin(100×),0.05mmbeta-mercaptoethanol。
步骤(4)酒精处理3d脑具体步骤为:
第11天,对照组使用神经分化培养基培养3d脑,样品组使用酒精浓度为100mm的神经分化培养基培养3d脑,所用的培养基需现用现配。此外样品组中6孔板间隙内需加入含同浓度酒精的pbs缓冲液,需使用封口膜密封,降低酒精挥发。由于酒精的挥发以及确保营养物质的供应,样品组和对照组都是每两天换一次培养基。
明场跟踪样品组和对照组中3d脑发育状况,结果如图1所示。
实施例2
妊娠期酒精暴露对胎儿脑损伤的体外模型建立方法基本与实施例1相同,不同点在于:
步骤(2)3d脑前期诱导,具体为:使用带有坑状结构的pdms芯片制备拟胚体:坑状结构的芯片置于24孔板内,小坑结构直径为600μm,深度为200μm,用于拟胚体的形成。第1天,制备拟胚体,将2×105-6×105个hipscs消化成单细胞,并转移至带有坑状结构的pdms芯片中,离心2000rpm,3min,所用培养基为ksr培养基,并加入5μmy27632;
步骤(3)3d脑包裹在海藻酸钠中空丝内,具体为:第10天,使用matrigel重悬前期诱导的细胞团,并用注射器将细胞团注入海藻酸钠丝内,整个过程避免产生气泡,冰上操作维持低温,保证matrigel不凝固。将含有细胞团的海藻酸钠丝置于37℃培养箱25min,使matrigel凝固。将含有细胞团的海藻酸钠丝转移至6孔板中进行后续培养,
步骤(4)酒精处理3d脑具体步骤为:
第11天,对照组使用神经分化培养基培养3d脑,样品组使用酒精浓度为200mm的神经分化培养基培养3d脑,所用的培养基需现用现配。此外样品组中6孔板间隙内需加入含同浓度酒精的pbs缓冲液,需使用封口膜密封,降低酒精挥发。由于酒精的挥发以及确保营养物质的供应,样品组和对照组都是每两天换一次培养基。
实施例3
妊娠期酒精暴露对胎儿脑损伤的体外模型建立方法基本与实施例1相同,不同点在于:
步骤(2)3d脑前期诱导,具体为:使用带有坑状结构的pdms芯片制备拟胚体:坑状结构的芯片置于24孔板内,小坑结构直径为700μm,深度为200μm,用于拟胚体的形成。第1天,制备拟胚体,将2×105-6×105个hipscs消化成单细胞,并转移至带有坑状结构的pdms芯片中,离心500rpm,5min,所用培养基为ksr培养基,并加入5μmy27632;
步骤(3)3d脑包裹在海藻酸钠中空丝内,具体为:第10天,使用matrigel重悬前期诱导的细胞团,并用注射器将细胞团注入海藻酸钠丝内,整个过程避免产生气泡,冰上操作维持低温,保证matrigel不凝固。将含有细胞团的海藻酸钠丝置于37℃培养箱20min,使matrigel凝固。
步骤(4)酒精处理3d脑具体步骤为:
第11天,对照组使用神经分化培养基培养3d脑,样品组使用酒精浓度为20mm的神经分化培养基培养3d脑,所用的培养基需现用现配。此外样品组中6孔板间隙内需加入含同浓度酒精的pbs缓冲液,需使用封口膜密封,降低酒精挥发。由于酒精的挥发以及确保营养物质的供应,样品组和对照组都是每两天换一次培养基。
实施例4
rt-pcr方法检测对照组和样品组脑发育相关基因表达情况
收集实施例1中发育30天的3d脑,pbs缓冲液清洗1次,并离心。使用trizol法提取全rna,方法如下:1mltrizol重悬细胞,上下吹打直至无细胞块,整个溶液澄清;加入200μl氯仿,上下混匀5min,室温静置3min,15000rpm离心15min;溶液出现分层,取上层液体至新管中,整个过程小心操作尽量避免接触中间层白色沉淀;在吸取液中加入等量异丙醇,上下颠倒混匀,-20℃静置过夜,利于rna析出;15000rpm离心10min;保留管底部的白色rna沉淀,小心去上清;75%乙醇清洗白色沉淀,15000rpm离心5min;尽可能去除75%乙醇,室温让其挥发5min,以免乙醇污染样品,影响后续实验;depc水溶解rna沉淀;测rna浓度和纯度,并进行相应的稀释,终浓度为500ng/ml。
第二步,将mrna反转录为cdna,体系为50μl,具体配比如下:500ng/mlrna10μl,buffer10μl,oligodt2.5μl,random6mers2.5μl,enzyme2.5μl,depc水27.5μl,37℃20min,4℃保存。
第三步,real-timepcr,按照试剂盒要求配体溶液,终体系为5ul,退火温度tm统一为58℃。
最后统计对照组和样品组脑发育相关基因的表达,结果如图2所示。
实施例5
免疫组化方法检测对照组和样品组3d脑发育情况
收集实施例1第15和24天的3d脑进行冷冻切片,方法如下:4%多聚甲醛进行细胞固定20min,pbs缓冲液冲洗三次,每次10min;30%蔗糖4℃过夜脱水;oct包埋,室温存放30min,80℃凝固;冷冻切片,厚度为10-20μm,并将其贴附在静电吸附的载玻片上。然后进行免疫荧光染色,方法为:将带有切片的载玻片置于pbs缓冲液中浸泡5min;0.1%tritonx-100致孔剂作用10min,pbs缓冲液冲洗1次,5min;山羊封闭血清室温作用1h,一抗(tuj1,sox2)1:400稀释,4℃过夜孵育,pbs缓冲液冲洗1次,5min;二抗(fluorescence488/594标记的山羊抗兔或鼠igg)1:100稀释,常温孵育1h,pbs缓冲液冲洗1次,5min;冲洗完毕后加入1:2000稀释的dapi工作液,荧光显微镜下拍照,记录sox2和tuj1的表达情况,结果如图3所示。结果如图3所示。样品组中神经元(tuj1)的表达明显高于对照组,证明酒精处理促进3d脑的神经发育。
- 还没有人留言评论。精彩留言会获得点赞!