构建多西环素调控表达c‑met蛋白的大鼠骨髓间充质干细胞细胞株的方法与流程
本发明涉及细胞生物
技术领域:
,尤其涉及一种构建多西环素调控表达c-met蛋白的大鼠骨髓间充质干细胞细胞株的方法。
背景技术:
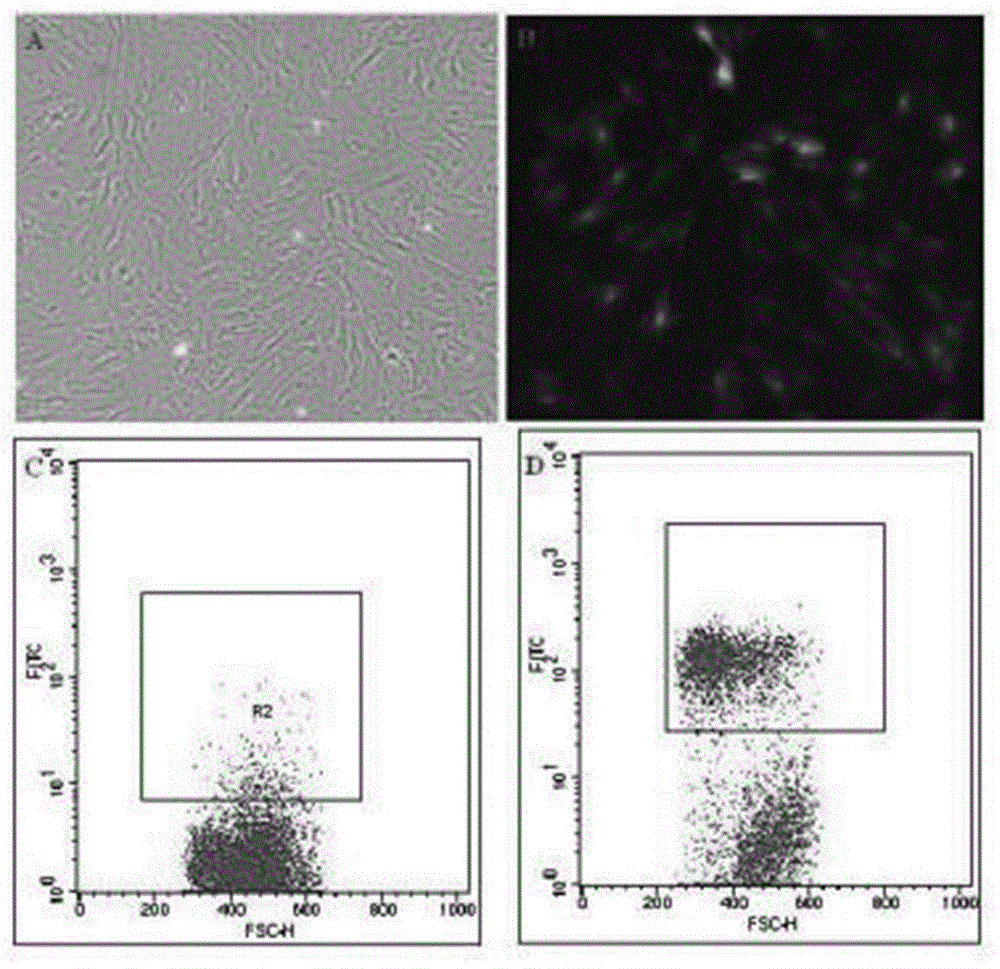
:基因治疗是将具有防治潜能的外源基因通过合适载体转移到患者的有关组织细胞内,并获得适当表达,以达到防治或减轻疾病的目的。有关基因治疗肝衰竭的研究我们已做了大量工作,并对其研究现状和前景进行了详细综述。目前基因治疗有两条主要途径,即invivo和exvivo。invivo途径是指将外源基因装配于特定的真核细胞表达载体(病毒型或非病毒型)上,直接导入人体内,因转染效率和安全性等问题而限制了其临床应用范围;exvivo途径是指将含外源基因的载体在体外导入人体自身或异体细胞,经体外细胞扩增后回输体内,该种方法与干细胞移植相结合即为基因修饰后干细胞移植。介导基因转移的载体一般分为病毒载体和非病毒载体,目前病毒载体具有较高的转染效率,在干细胞移植研究中应用最多。但由于普通病毒载体导入细胞后目的基因表达量和表达时间难以控制。Gossen等最早利用原核基因调控元件构建了真核细胞基因可控性表达系统,即Tet系统。该系统由两部分组成:1)Tet反应性元件(tetracyclineresponsiveelement,TRE),由7个拷贝的细菌四环素操纵子DNA序列(TetoperatorDNAsequence,TetO)和启动子组成;2)融合的转录活化因子,tTA(tet-controlledtranscriptionalactivator)或rtTA(reversetet-controlledtranscriptionalactivator)。tTA和rtTA中TetR成分与TetO序列结合,通过VP16发挥转录活性。tTA在其诱导因子不存在时与上述反应性元件结合,启动目的基因转录;加入诱导因子后,诱导因子与tTA结合使其从TRE上脱落,终止目的基因转录。而rtTA的作用方式与tTA的相反,当加入诱导因子时启动目的基因的转录,当诱导因子从系统中去除后,目的基因的转录关闭。这两种系统能在外源诱导因子的作用下可人为控制目的基因的表达或关闭,故被分别称为Tet-off/Tet-on系统。目前应用最多的Tet-on系统为Clontech公司提供的Tet-onadvanced多西环素调控系统,该系统和其它基因调控系统相比,其可控性和目的基因表达效率都有极大的提高。然而Tet-onadvanced系统的可控性主要体现在目的基因表达时间的控制,对于表达的部位或细胞种类缺少控制,因此在基因修饰干细胞治疗靶向控制研究领域还存在缺陷。目前尚未见到关于构建多西环素调控c-met蛋白表达、ALB启动子控制GFP表达的大鼠骨髓间充质干细胞株的研究和报道。技术实现要素:针对上述问题,本发明提供一种可以通过多西环素调控表达c-met蛋白的大鼠骨髓间充质干细胞细胞株的方法,用于研究该细胞株治疗肝衰竭时顺HGF浓度定向归巢和分化能力,以及该能力与HGF/c-met轴表达水平之间的量效关系的研究,本发明是这样获得的:一种构建多西环素调控表达c-met蛋白的大鼠骨髓间充质干细胞细胞株的方法,其特征在于,具体步骤如下:1、选取4周龄SPF级SD雄性大鼠,提取并培养BMSCs;2、建立Tet-OnAdvancedBMSCs细胞株:2.1分别以SEQIDNO.1和SEQIDNO.2为上下游引物,以pTet-OndvancedVector载体为模板,进行PCR扩增,获得目的基因CMV-rtTA;2.2以限制性内切酶BamHI、AgeI酶切慢病毒载体GV211,于37℃反应3h,酶切产物即为线性化载体DNA;酶切体系:10×CutSmartBuffer5μl,1μg/μL慢病毒载体GV2112μl,10U/μl的限制性内切酶BamHI、AgeI酶1μl,ddH2O补足至50μl;2.3配制线性化载体DNA和目的基因重组反应体系,于37℃反应30min,获得慢病毒表达载体GV211-CMV-rtTA;2.4向离心管中加入GV211-CMV-rtTA20μg、pHelper1.015μg、pHelper2.010μg,以InvitrogenLipofectamine2000转染试剂补足至1ml,室温下孵育15min;然后滴入细胞密度为70%~80%的293T细胞中,于37℃,5%CO2的细胞培养箱培养6h,弃去培养基,加入含10%血清低糖培养基,于37℃、含5%CO2的细胞培养箱继续培养48~72h;2.5收集步骤2.4培养后的293T细胞上清液,于4℃,4000g离心10min;取上清液以0.45μm滤器过滤,再收集滤液于4℃,25000rpm,离心2h;弃去上清,加入病毒保存液,即获得Len-CMV-rtTA慢病毒;2.6将对数生长期的BMSCs接种于96孔板中,每孔加入4~5×104个细胞及100μl含10%血清低糖培养基,当细胞融合度达到30%左右时,弃去培养基,向各孔中加入10μl步骤2.5获得的病毒滴度为2×108TU/ml的Len-CMV-rtTA慢病毒、10μl终浓度为5μg/ml的ploybrene增强液和80μl的含10%血清低糖培养基,于37℃、5%CO2的细胞培养箱培养;感染12h后,弃去培养基,每孔加入100μl含10%血清低糖培养基;感染72h后,再次以含10%血清低糖培养基换液,并向每孔加入终浓度为9μg/ml的嘌呤毒素进行药物筛选,成活细胞即为Tet-OnAdvancedBMSCs;3、建立GFP(+)Tet-on-c-metBMSCs细胞株:3.1合成基因序列TRE-minCMV启动子-c-met-ALB启动子-GFP;3.2配制线性化载体DNA和目的基因重组反应体系:5×CEIIBuffer2μl,步骤2.2获得的浓度为800ng/μL线性化载体DNA2.5μl,步骤3.1获得的浓度为800ng/μL的TRE-minCMV启动子-c-met-ALB启动子-GFP1μl,ExnaseII1μl,ddH2O补足至10μl;将反应体系置于于37℃反应30min,获得慢病毒表达载体GV211-TREminCMV-c-met/ALB-GFP;重组反应体系:3.3向离心管中加入GV211-TREminCMV-c-met/ALB-GFP20μg、pHelper1.015μg、pHelper2.010μg,以InvitrogenLipofectamine2000转染试剂补足至1ml,室温下孵育15min;然后滴入细胞密度为70%~80%的293T细胞中,于37℃,5%CO2培养箱中培养6h,弃去培养基,加入含10%血清低糖培养基,于37℃、含5%CO2培养箱中继续培养48-72h;3.4收集步骤3.3培养后的293T细胞上清液,于4℃,4000g离心10min;取上清液以0.45μm滤器过滤,再收集滤液于4℃,25000rpm,离心2h;弃去上清,加入病毒保存液,即获得慢病毒Len-TREminCMV-c-met/ALB-GFP,其病毒滴度为2×108TU/ml;3.5将对数生长期的Tet-OnAdvancedBMSCs接种于96孔板中,每孔加入4~5×104个细胞及100μl含10%血清低糖培养基,当细胞融合度达到30%左右时,弃去培养基,向各孔中加入10μlLen-TREminCMV-c-met/ALB-GFP慢病毒、10μl终浓度为5μg/ml的ploybrene增强液和80μl的含10%血清低糖培养基,于37℃、5%CO2的细胞培养箱培养;感染12h后,弃去培养基,每孔加入100μl含10%血清低糖培养基;感染72h后,再次以含10%血清低糖培养基换液,并向每孔加入终浓度为9μg/ml的嘌呤毒素;通过流式细胞仪筛选GFP阳性BMSCs细胞,即获得GFP(+)Tet-on-c-metBMSCs细胞株;其中,所述含10%血清低糖培养基配制方法为:以质量百分百计,将89%的DMEM/Low培养基、10%的胎牛血清和1%的青霉素-链霉素溶液混合后获得。进一步,如本发明所述构建多西环素调控表达c-met蛋白的大鼠骨髓间充质干细胞细胞株的方法中,所述细胞密度为70%~80%的293T细胞是这样获得的:转染前24h,用胰蛋白酶消化对数生长期的293T细胞,以含10%血清低糖培养基调整细胞密度为5x106细胞/15ml,接种于直径为10cm的细胞培养皿中,于37℃、含5%CO2的培养箱内培养,待细胞密度达70%~80%时即可用于转染;并于转染前2h更换培养基为无血清培养基。进一步,如本发明所述构建多西环素调控表达c-met蛋白的大鼠骨髓间充质干细胞细胞株的方法中,步骤2.1所述进行PCR扩增是指:PCR反应体系:5×PSBuffer10μl,2.5mMeach的dNTPMix4μl,10μM的上游引物1μl,10μM的下游引物1μl,10ng/μL的模板1μl,PrimeSTARHSDNApolymerase0.5μl,ddH2O补足至50μl;PCR反应条件:98℃预热5min;98℃10s,55℃10s,72℃90s,共30个循环;4℃延伸。进一步,如本发明所述构建多西环素调控表达c-met蛋白的大鼠骨髓间充质干细胞细胞株的方法中,步骤2.2所述配制线性化载体DNA和目的基因重组反应体系为:5×CEIIBuffer2μl,浓度为800ng/μL线性化载体DNA2.5μl,浓度为700ng/μL的目的基因CMV-rtTA1μl,ExnaseII1μl,以ddH2O补足至10μl。本发明在Clontech公司提供的Tet-on表达系统基础之上要进行改造,将TRE-minCMV调控的c-met和ALB启动子调控的GFP表达序列构建于同一质粒中(该质粒为Tet-on系统的反应质粒),并包装为慢病毒颗粒,以建立多西环素控制的c-met表达系统,所获得的合成基因序列TRE-minCMV启动子-c-met-ALB启动子-GFP,该序列含有两个启动子TRE-minCMV与ALB,分别调控c-met与GFP的表达;TRE-minCMV启动子在rtTA蛋白存在条件下接受多西环素的调控,即可用通过多西环素诱导c-met表达,而ALB启动子为肝细胞特异性启动子,通过该启动子调控GFP表达有利于筛选出能够分化为肝细胞的骨髓BMSCs,因此该系统具有通过ALB启动子调控GFP在具有类肝细胞分化潜力BMSCs靶向表达的功能。本发明中,两个启动子均发挥其相应作用,利用该系统筛选出GFP(+)BMSCs回输体内治疗肝衰竭模型,研究BMSCs顺HGF浓度定向归巢和分化能力,以及该能力与HGF/c-met轴表达水平之间的量效关系;对于研究该细胞株回输体内治疗肝衰竭,BMSCs顺HGF浓度定向归巢和分化能力,以及该能力与HGF/c-met轴表达水平之间的量效关系具有重要意义。附图说明图1为基因序列TRE-minCMV启动子-c-met-ALB启动子-GFP结构示意图。图2为通过流式细胞仪筛选具有肝细胞分化潜力的GFP(+)Tet-on-c-metBMSCs镜检图。图3为Real-timePCR法检测c-metmRNA的表达结果示意图。图4为Western-blot法检测c-met蛋白的电泳结果示意图。图5为Western-blot法检测c-met蛋白的表达结果示意图。具体实施方式下面结合附图,对本发明技术方案进行更进一步的描述。以下实施例涉及实验材料与仪器来源:4周龄SPF级SD雄性大鼠购于南京医科大学医药实验动物中心;293T细胞由南京医科大学第一附属医院感染病科李军教授赠送;胎牛血清购自Corning公司;LowDMEM购自Hyclone公司;pTet-OndvancedVector载体、In-FusionTMPCRCloningKit购自Clotech公司;慢病毒载体GV211(1μg/μL)、基因序列TRE-minCMV启动子-c-met-ALB启动子-GFP由上海吉凯基因化学技术有限公司合成;慢病毒载体GV211、病毒包装辅助质粒(Helper1.0、Helper2.0)购于购自上海吉凯基因化学技术有限公司;1kpDNAladderMarker购自Fermentas公司;250bpDNAladderMarker购自捷瑞公司;Taqpolymerase购自SinoBio公司;dNTP购自Takara;限制性内切酶购自NEB公司;Plasmid抽提Kit购自promega;嘌呤霉素购自amresco公司;琼脂糖凝胶DNA回收试剂盒购自天根生化公司;无血清培养基、PBS购于Hyclone公司;病毒保存液购自上海吉凯基因化学技术有限公司;胰蛋白酶购于Sigma公司;PCR仪购自AppliedBiosystems公司;positiveclone测序由美季生物技术完成;稳压DNA电泳仪购自BioRad公司;凝胶成像仪购自天能公司.实施例涉及的培养基来源/制备方法:含10%血清低糖培养基配方:以质量百分百计,将89%(质量百分数)的DMEM/Low培养基(购自Hyclone公司)、10%(质量百分数)的胎牛血清(购自Corning公司)和1%(质量百分数)的青霉素-链霉素溶液(购自碧云天公司,100×双抗)混合后获得;以下实施例涉及的DNA序列:SEQIDNO.1:5’-GGATCCCTTGACATGCTCCCCGGGTA-3’;SEQIDNO.2:5’-ACCGGTTTACCCGGGGAGCATGTCAA-3’;SEQIDNO.3(ALB启动序列,237bp):SEQIDNO.4(PminCMV序列,60bp):taggcgtgtacggtgggaggcctatataagcagagctcgtttagtgaaccgtcagatcgc60SEQIDNO.5(TRE序列,250bp):SEQIDNO.6(GFP序列,720bp):实施例1大鼠骨髓间充质干细胞(BMSCs)的提取与培养选取4周龄SPF级SD雄性大鼠,颈椎脱臼法处死,取出胫骨和股骨,去除两端干骺端,用5毫升注射器吸取生理盐水冲洗骨髓腔于50毫升离心管中,1000rpm离心冲洗液10min后,采用3ml含10%血清低糖培养基冲悬离心管底部沉淀,将液体加入到含3ml大鼠淋巴细胞分离液的15毫升离心管中,2000rpm离心20min后,吸取离心管中第三层白膜层,并加入到含有其4倍体积生理盐水的离心管中,1000rpm离心10min,含10%血清低糖培养基冲悬底部沉淀接种到培养皿中,并将细胞放入37℃、含5%CO2培养箱内培养。实施例2Tet-OnAdvancedBMSCs细胞株的建立1、构建慢病毒表达载体GV211-CMV-rtTA1.1分别以SEQIDNO.1和SEQIDNO.2为上下游引物,以pTet-OnadvancedVector载体为模板,进行PCR反应,反应体系如表1所示,反应条件如表2所示;将反应物混合后轻轻吹打混匀,置于PCR仪中扩增目的基因rtTA及上游CMV启动子,并以试剂盒回收,测序正确的扩增产物即为目的基因CMV-rtTA。表1PCR反应体系表2PCR反应条件表3慢病毒载体GV211酶切体系试剂体积(μl)ddH2O4210×CutSmartBuffer5慢病毒载体GV211(1μg/μL)2BamHI、AgeI酶(10U/μl)1Total501.2根据表3,配制50μl酶切体系,按表3顺序依次加入各种试剂,用移液器轻轻吹打混匀,置于37℃反应3h,以获得慢病毒载体GV211的酶切产物,以获得酶切后的线性化载体DNA;表4重组慢病毒表达载体GV211-CMV-rtTA体系试剂体积(μl)ddH2O3.55×CEIIBuffer2酶切后的线性化载体DNA2.5目的基因CMV-rtTA1ExnaseTMII1Total101.3以步骤1.2获得的酶切后的线性化载体DNA和步骤1.1获得的目的基因扩增产物于冰水浴中配制如表4所示的反应体系,用移液器轻轻吹打混匀,避克产生气泡,于37℃反应30min,获得由线性化载体和目的基因CMV-rtTA重组形成的慢病毒表达载体GV211-CMV-rtTA。2、rtTA基因重组慢病毒包装、浓缩与纯化2.1转染前24h,用胰蛋白酶(购于Gibco公司)消化对数生长期的293T细胞,以含10%血清低糖培养基调整细胞密度约5×106细胞/15ml,重新接种于直径为10cm细胞培养皿中,37℃、5%CO2细胞培养箱内培养;24h后待细胞密度达70%~80%时即可用于转染;并于转染前2h更换为无血清培养基;2.2向一灭菌离心管中加入步骤1获得的GV211-CMV-rtTA20μg、pHelper1.015μg、pHelper2.010μg,以InvitrogenLipofectamine2000转染试剂补足至1ml,室温孵育15min;然后滴入细胞密度为70%~80%的293T细胞中,于37℃,5%CO2的细胞培养箱培养6h,然后弃去培养基,加入含10%血清低糖培养基,于37℃、含5%CO2的细胞培养箱继续培养48-72h;2.3收集转染后48h(转染时即为0h计起)的293T细胞上清液;于4℃,4000g离心10min,除去细胞碎片;再以0.45μm滤器过滤上清液于40ml的超速离心管中;然后分别配平样品,将带有病毒上清液的超速离心管逐一放入至Beckman超速离心机内,设置离心参数为25000rpm,离心时间为2h,离心温度控制在4℃;离心结束后,弃去上清,尽量去除残留在管壁上的液体,加入病毒保存液,即获得rtTA基因慢病毒;2.4基因慢病毒滴度测定:采用荧光法测定病毒滴度,测定前一天,使用293T贴壁细胞铺板,96孔板,每孔4×104个细胞;准备7个无菌的EP管,分别编号1-7,每管中加入90μl无血清培养基,取待测定的rtTA基因慢病毒液原液10μl加入到1号管中,混匀后,取10μl加入到2号管中,继续相同的操作直到第7管;选取所需的细胞孔,弃去各孔90μl培养基,依次加入90μl稀释好的7个管中的病毒溶液,培养箱培养,4天后,观察荧光表达情况,荧光细胞数随稀释倍数的增加而减少,根据公式:病毒滴度=荧光细胞数/病毒原液量,即可算出该病毒滴度为2×108TU/ml。2.5确定嘌呤霉素筛选浓度:取对数生长期的大鼠骨髓间充质干细胞(BMSCs),用2mlPBS清洗两遍后,加入2ml胰蛋白酶消化2min,显微镜下观察BMSCs已全部消化下来后,加入2ml含10%血清低糖培养基终止消化,并将其加入到15ml无菌离心管中,1000rpm离心5min,弃去上清,加入6ml含10%血清低糖培养基冲悬底部沉淀,并将其接种于6孔板中。待各孔细胞长满后,弃去原培养基,梯度加入含嘌呤霉素的含10%血清低糖培养基2ml,各孔嘌呤霉素浓度分别为0、6、7、8、9、10μg/ml;然后于37℃、5%CO2细胞培养箱培养;细胞每两天更换一次含相应浓度嘌呤霉素的含10%血清低糖培养基,并每天对各孔细胞生长情况进行观察;4天可以杀死相应孔中全部细胞的嘌呤霉素最低浓度,本实施例中最终药物筛选浓度为9μg/ml。3、rtTA基因重组慢病毒载体转染大鼠BMSCs及转染后嘌呤霉素筛选3.1转染前一天,将处于对数生长期的BMSCs接种于96孔板中,每孔加入4~5×104个细胞(接种密度为细胞3~4天长满为宜)及100μl含10%血清低糖培养基,放入细胞培养箱中培养;当细胞融合度达到25%-35%时,弃去原培养基,以感染复数(MOI=100)进行转染,即向各孔中加入10μl步骤2.3获得的rtTA基因慢病毒(病毒滴度为2×108TU/ml)、10μl终浓度为5μg/ml的ploybrene增强液和80μl的含10%血清低糖培养基,于37℃、含5%CO2培养箱中培养;3.2感染12h后,弃去培养基,每孔加入100μl含10%血清低糖培养基;在转染48h后,即可用荧光显微镜观察转染情况;感染72h后,再次以含10%血清低糖培养基换液,并向每孔加入终浓度为9μg/ml的嘌呤毒素,药物筛选周期为一周,并在荧光显微镜下观察效果,待显微镜下观察细胞荧光阳性率达100%后,将药物筛选浓度维持在1.8μg/ml,即获得稳定高效表达rtTA蛋白的大鼠骨髓间充质干细胞细胞株(即Tet-OnAdvancedBMSCs)。实施例3GFP(+)Tet-on-c-metBMSCs细胞株的建立1、构建慢病毒Len-TREminCMV-c-met/ALB-GFP1.1交由上海吉凯基因化学技术有限公司合成基因序列TRE-minCMV启动子-c-met-ALB启动子-GFP,其结构如图1所示,ALB启动序列(237bp)如SEQIDNO.3所示,minCMV启动子序列(60bp)如SEQIDNO.4所示,TRE序列(250bp)如SEQIDNO.5所示,GFP序列(720bp)如SEQIDNO.6所示;1.2配制线性化载体DNA和目的基因重组反应体系:5×CEIIBuffer2μl,实施例2步骤1.2获得的酶切后的线性化载体DNA(浓度800ng/μL)2.5μl,TRE-minCMV启动子-c-met-ALB启动子-GFP(浓度800ng/μL)1μl,ExnaseII1μl,ddH2O补足至10μl;将上述体系至于37℃反应30min,即获得慢病毒表达载体GV211-TREminCMV-c-met/ALB-GFP;1.3向离心管中加入上述GV211-TREminCMV-c-met/ALB-GFP20μg、pHelper1.015μg、pHelper2.010μg,以InvitrogenLipofectamine2000转染试剂补足至1ml,室温下孵育15min;然后滴入细胞密度为70%~80%的293T细胞中,于37℃,5%CO2培养箱中培养6h,然后弃去原培养基,加入含10%血清低糖培养基,于37℃、含5%CO2培养箱中继续培养48-72h;1.4收集上述293T细胞上清液,于4℃,4000g离心10min;取上清液以0.45μm滤器过滤,收集滤液于4℃,25000rpm,离心2h;弃去上清,加入病毒保存液,即获得慢病毒Len-TREminCMV-c-met/ALB-GFP(病毒滴度为2×108TU/ml);2、慢病毒Len-TREminCMV-c-met/ALB-GFP转染Tet-OnAdvancedBMSCs细胞株2.1转染前一天,将处于对数生长期的Tet-OnAdvancedBMSCs接种于96孔板中,每孔加入4~5×104个细胞(接种密度为细胞3~4天长满为宜)及100μl含10%血清低糖培养基,放入细胞培养箱中培养;当细胞融合度达到25%-35%时,弃去原培养基,以感染复数(MOI=100)进行转染,即向各孔中加入10μl步骤1.4获得的慢病毒Len-TREminCMV-c-met/ALB-GFP、10μl终浓度为5μg/ml的ploybrene增强液和80μl的含10%血清低糖培养基,于37℃、含5%CO2培养箱中培养;2.2感染12h后,弃去培养基,每孔加入100μl含10%血清低糖培养基;在转染48h后,即可用荧光显微镜观察转染情况;感染72h后,再次以含10%血清低糖培养基换液,并向每孔加入终浓度为9μg/ml的嘌呤毒素,药物筛选周期为一周,并在荧光显微镜下观察效果,待显微镜下观察细胞荧光阳性率达100%后,将药物筛选浓度维持在1.8μg/ml,即获得西环素调控表达c-met蛋白的大鼠骨髓间充质干细胞细胞株(即GFP(+)Tet-on-c-metBMSCs细胞株)。实施例41、流式细胞仪筛选具有肝细胞分化潜力的GFP(+)Tet-on-c-metBMSCs实验组:实施例2获得的GFP(+)Tet-on-c-metBMSCs;对照组:无基因修饰的BMSCs;(实验方法参考文献:XiaoLK,etal.StemCellsInt.2016;2016:8906945)。实验结果如图2所示,其中,图2A为普通显微镜下观察GFP(+)Tet-on-c-metBMSCs形态示意图,可见该细胞生长良好;图2B为荧光显微镜下观察部分GFP(+)Tet-on-c-metBMSCs,可见其可表达GFP;图2C为对照组GFP阳性表达细胞数;图2D为实验组GFP阳性表达细胞。实验组获得GFP的阳性表达,利用流式细胞术分析结果示GFP(+)BMSCs占总细胞数约57%。说明获稳定转染pALB-GFP质粒的BMSCs中约57%细胞具备表达ALB的功能,即具有潜在分化为肝细胞的能力,另一方面也说明约43%细胞缺少ALB启动子发挥作用的细胞内环境,推测可能不具备分化类肝细胞的潜力。2、通过多西环素体外诱导GFP(+)Tet-on-c-metBMSCs细胞株表达c-metGFP(+)Tet-on-c-metBMSCs细胞株体外培养,在其含10%血清的低糖培养基中加不同浓度的多西环素(分别为0.01、0.1、1、10、100ng/ml),并将细胞放入37℃、含5%CO2培养箱内培养12h后收集细胞。通过Real-timePCR法检测c-metmRNA的表达情况(参考文献:ZhuX,etal.CellDeathDis.2016;7(6):e2239),结果如图3所示,可见,c-metmRNA表达水平与多西环素的浓度相关,即随着多西环素浓度的增加(0.1、1、10ng/ml),表达水平逐步升高,10ng/ml与100ng/ml的多西环素浓度诱导的c-met表达水平无明显差异,图3中P<0.01是指两组具有统计学差异。通过Western-blot法检测c-met蛋白的表达情况(检参考文献:ZhuX,etal.CellDeathDis.2016;7(6):e2239),结果如图4所示,随着多西环素浓度的增加,图4中,从左至右1-5分别为细胞依次加入0.01、0.1、1、10、100ng/ml多西环素后,Western-blot法检测的c-met蛋白表达量也逐步升高。图5为Western-blot法检测c-met蛋白的表达情况示意图,可见随着多西环素浓度的增加(0.1、1、10ng/ml),c-met蛋白表达量逐步升高,10ng/ml的多西环素诱导c-met表达量达到最高水平,结果说明c-met基因高表达的最佳多西环素诱导浓度为10ng/ml。本发明具体应用途径很多,以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以作出若干改进,这些改进也应视为本发明的保护范围。SEQUENCELISTING<110>江苏省人民医院<120>构建多西环素调控表达c-met蛋白的大鼠骨髓间充质干细胞细胞株的方法<130>6<160>6<170>PatentInversion3.3<210>1<211>26<212>DNA<213>人工合成<400>1ggatcccttgacatgctccccgggta26<210>2<211>26<212>DNA<213>人工合成<400>2accggtttacccggggagcatgtcaa26<210>3<211>237<212>DNA<213>人工合成<400>3caaagtcttgtgcatgggggtgggggtggggttagaggggaacagctccagatggcaaac60atacgcaagggatttagtcaaacaactttttggcaaagatggtatgattttgtaatgggg120taggaaccaattgaaatgcgaggtaagtatggttaatgatctacagttattggttaaaga180agtatattagagcgagtctttctgcacacacgatcacctttcctatcaaccccacta237<210>4<211>60<212>DNA<213>人工合成<400>4taggcgtgtacggtgggaggcctatataagcagagctcgtttagtgaaccgtcagatcgc60<210>5<211>250<212>DNA<213>人工合成<400>5cgagtttactccctatcagtgatagagaacgtatgtcgagtttactccctatcagtgata60gagaacgatgtcgagtttactccctatcagtgatagagaacgtatgtcgagtttactccc120tatcagtgatagagaacgtatgtcgagtttactccctatcagtgatagagaacgtatgtc180gagtttatccctatcagtgatagagaacgtatgtcgagtttactccctatcagtgataga240gaacgtatgt250<210>6<211>720<212>DNA<213>人工合成<400>6atggtgagcaagggcgaggagctgttcaccggggtggtgcccatcctggtcgagctggac60ggcgacgtaaacggccacaagttcagcgtgtccggcgagggcgagggcgatgccacctac120ggcaagctgaccctgaagttcatctgcaccaccggcaagctgcccgtgccctggcccacc180ctcgtgaccaccctgacctacggcgtgcagtgcttcagccgctaccccgaccacatgaag240cagcacgacttcttcaagtccgccatgcccgaaggctacgtccaggagcgcaccatcttc300ttcaaggacgacggcaactacaagacccgcgccgaggtgaagttcgagggcgacaccctg360gtgaaccgcatcgagctgaagggcatcgacttcaaggaggacggcaacatcctggggcac420aagctggagtacaactacaacagccacaacgtctatatcatggccgacaagcagaagaac480ggcatcaaggtgaacttcaagatccgccacaacatcgaggacggcagcgtgcagctcgcc540gaccactaccagcagaacacccccatcggcgacggccccgtgctgctgcccgacaaccac600tacctgagcacccagtccgccctgagcaaagaccccaacgagaagcgcgatcacatggtc660ctgctggagttcgtgaccgccgccgggatcactctcggcatggacgagctgtacaagtaa720当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1