一种基于标准土样的土壤中假单胞菌的定量检测方法与流程
本发明涉及生物
技术领域:
,特别是一种定量检测土壤中假单胞菌的方法。
背景技术:
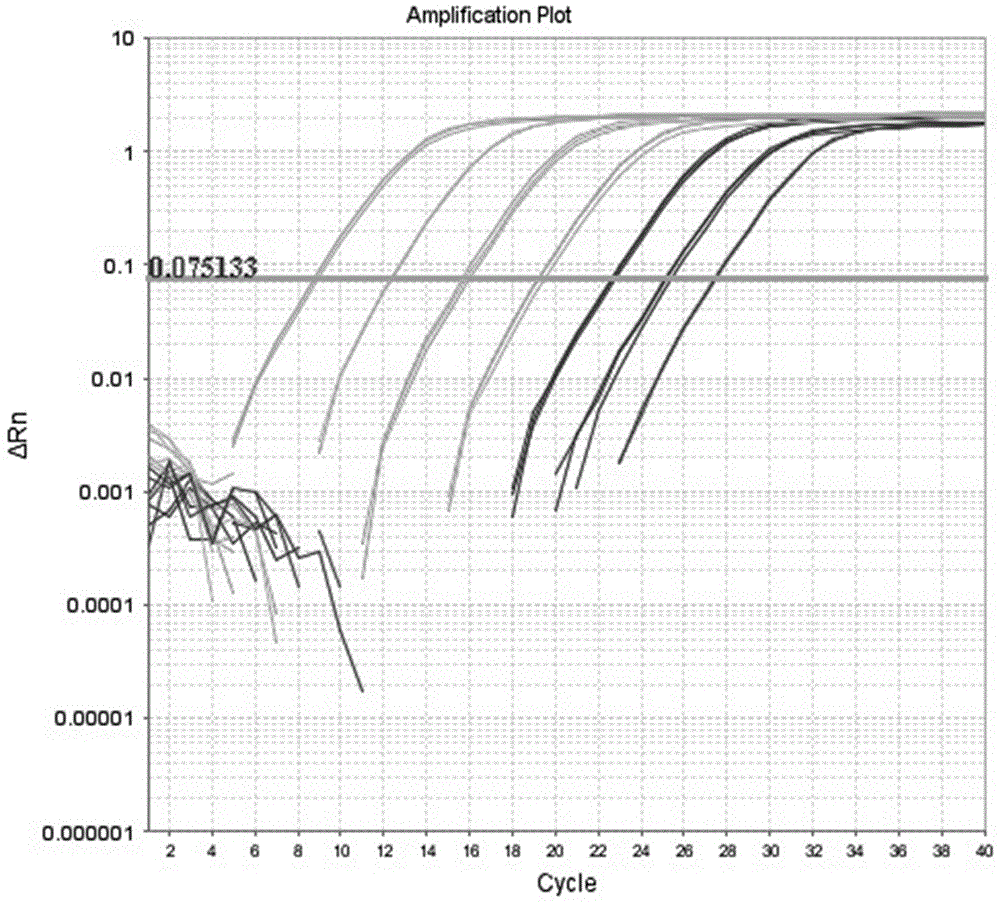
:假单胞菌(Pseudomonadaceae)在分类学上属于细菌域、变形菌门、γ-变形菌纲、假单胞菌目、假单胞菌科的假单胞菌属。假单胞菌广泛存在于土壤中,是研究最深入的土壤微生物种群之一。假单胞菌是土壤微生态系统和土壤碳氮循环的重要组成部分。很多假单胞菌能改善植物微环境,并且诱导植物系统抗性、抑制病原微生物侵染根系,有促进植物生长和防治植物病害的作用。一些假单胞菌还具有降解利用多种人工合成化合物的潜力。此外,假单胞菌的某些种对重金属和有机污染物具有抗性并可将其在体内富集。对土壤中假单胞菌的定量检测可以更好的分析土壤微生物生态功能、土壤抑病性能力和污染土壤的微生物修复能力等。目前对土壤中假单胞菌的定量检测方法主要是平板涂布计数法(Elad和Baker,1985;Garbeva等,2006)。平板涂布计数法为土壤浸提液经梯度稀释后涂布在选择性培养基上,再进行假单胞菌菌落计数,进而计算出土壤中假单胞菌浓度,这种方法存在较大的误差和困难,准确性低、费时,且易受杂菌影响,对试验人员假单胞菌识别能力要求高。随着分子生物学技术日益成熟,现在在DNA水平上采用定量PCR技术对土壤中假单胞菌进行定量检测(Kaare等,1999),但常规定量PCR以拷贝数或者基因组浓度量化待测样品,所得结果单位为拷贝数每克土或者ng基因组DNA每克土,而非菌数每克土,不能直观的了解土壤中假单胞菌的浓度。且不同批次检测结果系统误差较大,同一样品的不同批次定量结果可能存在千倍以上的差异。因此,常规定量PCR在检测土壤中假单胞菌浓度时也具有局限性。技术实现要素:针对上述问题,本发明提供一种采用定量PCR技术以假单胞菌浓度已知的标准土样绘制标曲从而定量检测待测土样中的假单胞菌,可用于假单胞菌的跟踪检测,为研究假单胞菌对土壤的生态适应性和假单胞菌相关土壤生态功能提供了一种简便、高效的方法,本发明是这样实现的:一种基于标准样品的土壤中假单胞菌的定量检测方法,其具体步骤如下:a)分别制备假单胞菌浓度依次为5×107、5×106、5×105、5×104、5×103、5×102和50CFU/mL(CFU/mL是指活菌数每毫升菌液,下同)的系列梯度标准土样;b)利用土壤微生物DNA提取试剂盒分别提取系列梯度标准土样DNA及待测土样DNA,提取步骤严格依照说明书进行;c)选定可扩增假单胞菌的特异性引物(Widmer发明,1998),合成特异性上下游引物SEQIDNO.1(Psf)和SEQIDNO.2(Psr);分别以步骤b)中获得系列梯度标准土样DNA及待测土样DNA为模板,SEQIDNO.1和SEQIDNO.2为上下游引物,进行荧光定量PCR反应;d)根据系列梯度标准土样假单胞菌浓度的对数值和相应的阈值循环数作图,并进行线性拟合得到标准曲线:y=40.765-4.755x,R2=0.991;将待测土样荧光定量PCR反应结果(阈值循环数和线性方程)代入标准曲线,即可获得待测土样中假单胞菌的浓度。进一步,本发明所述基于标准土样的土壤中假单胞菌的定量检测方法中,步骤c)所述荧光定量PCR反应体系为:2×SYBRPremixExTaq10μL,浓度均为10μmol/L上下游引物各0.4μL,ROXReferenceDyeII0.4μL,浓度为40-60ng/μLDNA模板2μL,灭菌超纯水补足至20μL;反应程序为:95℃预变性30s;95℃预变性5s,65℃退火34s,共40个循环。进一步,本发明所述基于标准土样的土壤中假单胞菌的定量检测方法中,所述系列梯度标准土样是这样获得的:a)取耕地土壤126℃灭菌120min,风干后即获得获得土样;b)将假单胞菌接种到牛肉膏蛋白胨液体培养基中活化,活化后的假单胞菌接种到装有100mL牛肉膏蛋白胨液体培养基的250mL三角瓶中,37℃、160r/min摇床培养2天后,平板计数后备用;用无菌水将菌液依次稀释为5×107、5×106、5×105、5×104、5×103、5×102和50CFU/mL;分别取20mL稀释后的菌液加入到100g步骤a)获得的土样中(即体积质量比1:5,mL/g)并快速风干(强通风阴暗条件下12h内风干土壤),即获得假单胞菌浓度依次为5×107、5×106、5×105、5×104、5×103、5×102和50CFU/mL的系列梯度标准土样。本发明中,Psf和Psr可对假单胞菌特异性扩增出990bp的产物。本发明所涉及的平板计数法是参照文献[沈萍,范秀荣,李广武。微生物学实验[M]。北京:高等教育出版社,1999,92-94]进行,其具体步骤为:用1mL无菌吸管,吸取1mL菌液移入装有9mL无菌水的试管中,吹吸3次混匀菌液,即成10-1稀释液;再换一支无菌吸管吸取1mL10-1稀释液移入装有9mL无菌水的试管中,吹吸3次混匀菌液,即成10-2稀释液;以此类推,连续稀释制成10-3、10-4、10-5、10-6、10-7、10-8等一系列稀释液。各稀释液均吸取0.1mL到牛肉膏蛋白胨琼脂培养基平板上,用无菌刮铲涂匀至干。37℃培养三天后计数,菌液浓度=同一稀释度几次重复的菌落平均数×10×稀释倍数。即知菌悬液中假单胞菌的浓度。本发明提供的用于定量检测土壤中假单胞菌浓度的方法,可对土壤中假单胞菌进行快速检测定量,与现有技术相比,本发明的有益效果是:(1)实用性强,反应土壤真实假单胞菌浓度。本发明方法,可以替代一直沿用的平板涂布计数和常规定量PCR技术,通过改进常规定量PCR技术,以假单胞菌浓度已知的标准土样DNA做为定量PCR标曲DNA,可计数出待测土样中的假单胞菌浓度,所得数据单位为菌数每克土,这样即可避免传统平板涂布计数法结果的不可靠性,又可避免常规定量PCR结果的不直观性。(2)重复性高。已知假单胞菌浓度的标准土样DNA与待测土样DNA同时进行定量PCR,利用每个样品在荧光闽值处所经历的循环数(Ct)和标准样品的假单胞菌浓度建立标准曲线,根据待测样品Ct值在标准曲线上计算对应的假单胞菌浓度。这样可有效消除同一土样进行不同批次检测的系统误差。即同一土样不同批次检测结果差异较小。(3)操作简便快捷,应用本发明方法,对标准土样和待测土样进行土壤微生物DNA提取,再进行定量PCR即可得出结果,操作简便,适于检测土壤中假单胞菌浓度及对其进行实时检测。附图说明图1为特异性检测引物对假单胞菌及其它常见土壤细菌的扩增结果;图中:泳道1-2位假单胞菌,3-4为芽孢杆菌,5-6为链霉菌,7-8为大肠杆菌,9-10为农杆菌,11-12为阴性对照。图2为本发明对土壤中假单胞菌的灵敏度检测试验扩增曲线,样品阈值循环数从高到底依次对107、106、105、104、103、102和10假单胞菌/g风干土。图3为标准样品和待测样品的假单胞菌荧光定量PCR溶解曲线图,溶解温度为88.5℃。图4为标准样品和待测样品的假单胞菌荧光定量PCR扩增曲线图,纵坐标为循环数,横坐标为土壤假单胞菌浓度。图5为标准样品和待测样品的假单胞菌荧光定量PCR标准曲线图,y=40.765-4.755x,R2=0.991。具体实施方式以下结合具体实施例对本发明涉及的检测方法做进一步说明。实施例涉及的菌种及培养基:本实施例中涉及的假单胞菌为铜绿假单胞菌P1(参见文献“铜绿假单胞菌结合生物熏蒸防控辣椒疫病的效果”,王秋君等,江苏农业学报,2015);芽孢杆菌为枯草芽孢杆菌BS211(参见文献“西瓜内生枯草芽孢杆菌BS211的拮抗活性及盆栽防效”,马艳等,江苏农业学报,2006);链霉菌为娄彻氏链霉菌(参见文献“麦秸不同部位生物降解速率差异”,王佳佳等,农业资源与环境学报,2015);农杆菌为根癌农杆菌SK1044(参见文献“农杆菌介导转化大丽轮枝菌的体系优化”,陈天子等,棉花学报,2011);大肠杆菌为DH5a,购至宝生物工程(大连)有限公司。牛肉膏蛋白胨琼脂培养基:牛肉膏5g,蛋白胨10g,NaCl5g,琼脂20g,水1L,pH7.2-7.4。牛肉膏蛋白胨液体培养基:牛肉膏5g,蛋白胨10g,NaCl5g,水1L,pH7.2-7.4。实施例涉及的引物序列:SEQIDNO.1(Psf):5‘-GGTCTGAGAGGATGATCAGT-3’;SEQIDNO.2(Psr):5‘-TTAGCTCCACCTCGCGGC-3’。实施例涉及的试剂及仪器:土壤微生物DNA提取试剂盒为MP土壤DNA提取试剂盒,货号116560200;SYBRpremixExTaq试剂盒(包含2×SYBRPremixExTaq和ROXReferenceDyeII)购自宝生物工程有限公司,货号为RR420A;2×TaqPCRMasterMix购自南京基天生物技术有限责任公司;Psf/Psr引物由金斯瑞生物科技有限公司合成;实施例中的PCR荧光定量仪为ABI7500荧光定量PCR仪,数据分析由ABI7500荧光定量PCR仪自带的分析软件完成,荧光定量PCR反应完成后,软件自动对每个反应收集到的荧光信号进行分析,选择合适的荧光闽值,然后利用每个样品在荧光闽值处所经历的循环数(Ct)和标准样品的假单胞菌浓度建立标准曲线,待测样品可以根据其Ct值在标准曲线上查到对应的假单胞菌浓度。实施例中对土样快速风干是指即强通风阴暗条件下12h内风干土壤。实施例1假单胞菌的特异引物检测(1)各菌株DNA制备用牛肉膏蛋白胨液体培养基培养所有菌株,再用OMEGA细菌DNA提取试剂盒提取各菌株DNA。(2)检测假单胞菌特异引物的合成Psf:5’-GGTCTGAGAGGATGATCAGT-3’Psr:5’-TTAGCTCCACCTCGCGGC-3’由金斯瑞生物科技有限公司合成。(3)用于检测假单胞菌的PCR反应体系分别以各菌株DNA为模板,Psf和Psr为上下游引物,进行PCR扩增:PCR反应体系:2×TaqPCRMasterMix12.5μL,10μmol/L的引物各0.5μL,1μL浓度为40-60ng/μL的DNA模板,灭菌超纯水补足至25μL。PCR反应程度:95℃预变性5min;92℃变性1min,64.1℃退火1min,72℃延伸1min,共30个循环;然后72℃延伸10min。(4)PCR产物鉴定取6μLPCR产物进行1%琼脂糖电泳检测,经SYBR-green染色紫外灯下观察,根据DNA条带的有无及大小对假单胞菌特异引物的特异性进行验证。(5)试验结果PCR扩增结果如图1所示,图1中,泳道1-2位假单胞菌,3-4为芽孢杆菌,5-6为链霉菌,7-8为大肠杆菌,9-10为农杆菌,11-12为阴性对照引物;由图1可见,Psf/Psr只能特异性从假单胞菌DNA(1-2)中扩增出990bp的条带,而芽孢杆菌(3-4)、链霉菌(5-6)、大肠杆菌(7-8)、农杆菌(9-10)及阴性对照(11-12)均无扩增条带(3-12)。因此该对引物具有很好的特异性,只对假单胞菌有990bp的扩增产物,对其它对照菌株均无扩增产物。实施例2制作假单胞菌浓度已知的标准土样(1)假单胞菌的培养将试管斜面保存的一株假单胞菌接种到牛肉膏蛋白胨琼脂培养基中活化,再将活化好的假单胞菌接种到装有100mL牛肉膏蛋白胨液体培养基的250mL三角瓶,置于摇床,摇床转速为160r/min,在37℃环境中培养2天后得假单胞菌液,对菌液进行平板菌落计数,冷藏备用。实施例中对菌液进行平板菌落计数方法参照文献[沈萍,范秀荣,李广武。微生物学实验[M]。北京:高等教育出版社,1999,92-94]进行,用1mL无菌吸管,吸取1mL菌液移入装有9mL无菌水的试管中,吹吸3次混匀菌液,即成10-1稀释液;再换一支无菌吸管吸取1mL10-1稀释液移入装有9mL无菌水的试管中,吹吸3次混匀菌液,即成10-2稀释液;以此类推,连续稀释制成10-3、10-4、10-5、10-6、10-7、10-8等一系列稀释液。各稀释液均吸取0.1mL到牛肉膏蛋白胨琼脂培养基平板上,用无菌刮铲涂匀至干。37℃培养2天后计数,即知菌悬液中假单胞菌的浓度。(2)标准土样的制备在江苏省农业科学院六合基地设施辣椒大棚取耕层土壤进行126℃灭菌120min,然后风干即获得土样;取7份100g土壤,将菌液稀释为5×107、5×106、5×105、5×104、5×103、5×102和50CFU/mL,分别取20mL加入到100g土壤中并快速风干,获得107、106、105、104、103、102和10CFU/g风干土的系列梯度标准土样。实施例3定量检测土壤中假单胞菌成套技术的灵敏度试验(1)标准土样DNA的制备采用MP土壤DNA提取试剂盒提取107、106、105、104、103、102和10CFU/g的系列梯度标准土样的DNA。(2)用于定量检测假单胞菌的PCR反应体系PCR反应体系包括2×SYBRPremixExTaq10μL,10μmol/L的Psf/Psr引物各0.4μL,ROXReferenceDyeII0.4μL,DNA模板2μL,灭菌超纯水补足至20μL。(3)用于定量检测假单胞菌的PCR反应程序95℃预变性30s,95℃预变性5s,65℃退火34s,40个循环。(4)定量PCR扩增将标准土样DNA在ABI7500仪上进行定量PCR扩增。(5)试验结果本发明对土壤中不同浓度假单胞菌的灵敏度检测试验扩增曲线如图2所示,图2中,样品阈值循环数从高到底依次对应107、106、105、104、103、102和10假单胞菌/g风干土;结果显示此方法下107、106、105、104、103、102和10CFU/g的梯度标样DNA可形成梯度扩增曲线,灵敏度可达10CFU/g土。因此利用该方法检测土壤中假单胞菌浓度可检测到10个假单胞菌每克土。实施例4待测土样中假单胞菌的定量检测(1)待测土样DNA的制备对照土壤:取自淮安市清浦区耕作地;生物炭土壤:向对照土壤中加入1.33wt%的生物炭(由20目麦秸经马弗炉500℃或600℃厌氧裂解1h所得);将辣椒疫霉游动孢子液均匀加入上述两组土壤中,使得辣椒疫霉数量为每克干土500个游动孢子,在上述两组土壤中分别按照常规方法栽种辣椒(苏椒5号),自然光照,温度25℃-35℃,栽种32天(参见文献“秸秆生物炭对辣椒疫病的防控效果及机理研究”,王光飞等,土壤,2015),然后分别取两组土壤按照实施例2步骤(2)标准土样的制备步骤制备待测土样,将待测土样快速风干后,采用土壤微生物DNA提取试剂盒提取DNA。(2)用于定量检测假单胞菌的PCR反应体系20μLPCR反应体系:2×SYBRPremixExTaq10μL,10μmol/L的Psf/Psr引物各0.4μL,ROXReferenceDyeII0.4μL,浓度为60ng/μLDNA模板2μL(在具体操作过程中,DNA模板的浓度可以在40-60ng/μL范围内选择),灭菌超纯水补足至20μL。(3)用于定量检测假单胞菌的PCR反应程序95℃预变性30s,95℃预变性5s,65℃退火34s,40个循环。(4)定量PCR扩增将107、106、105、104和103CFU/g标准土样和待测土样DNA进行同时定量PCR扩增,并以标准土样假单胞菌浓度的对数值和相应的阈值循环数作图,并进行线性拟合得到标准曲线。根据待测土样阈值循环数和线性方程,计算出待测土壤中的假单胞菌浓度。(5)试验结果应用上述方法测定添加生物炭土壤和对照土壤假单胞菌浓度。溶解曲线见图3,溶解温度为88.5℃,标准样品及待测样品溶解曲线单峰。扩增曲线见图4(纵坐标为循环数,横坐标为土壤假单胞菌浓度),扩增效率为102.1。标准曲线见图5,标准土样DNA的对数值和相应的阈值循环数作图,并进行线性拟合得到标准曲线,标曲为y=40.765-4.755x,相关系数R2=0.991。扩增曲线、溶解曲线和标准曲线均符合定量PCR要求,结果可靠。根据待测土样阈值循环数和线性方程,可计算出待测土壤中的假单胞菌浓度,试验重复操作两次,两次技术结果如表1所示:表1同一样品不同批次检测结果样品假单胞菌浓度对照土壤11.40×106CFU/g生物炭土壤11.63×106CFU/g对照土壤21.37×106CFU/g生物炭土壤21.54×106CFU/g由表1可知,添加生物炭土壤假单胞菌显著高于对照土壤,这与相关报道研究(参见文献“EffectofbiocharamendmentsonmycorrhizalassociationsandFusariumcrownandrootrotofasparagusinreplantsoils”,Elmer等,PlantDisease,2011;“Inductionofsystemicresistanceinplantsbybiochar,asoilappliedcarbonsequesteringagent”,Elad等,Phytopathology,2010)一致。实施例5待测样品的重复性检测试验利用实施例4所述方法对同一土样进行多次定量检测,以此样品的检测结果来判定该方法的重复性。待测土样:取自淮安市清浦区耕作地土壤,按照常规方法人工栽种辣椒(苏椒5号),自然光照,温度25℃-35℃,栽种32天(即文献“秸秆生物炭对辣椒疫病的防控效果及机理研究”,王光飞等,土壤,2015中1.2节,CK1空白对照),采用与实施例4相同的方法,对上述土样进行多次检测,检测结果如表2所示:表2同一样品不同批次检测结果样品假单胞菌浓度第一次检测结果1.32×106CFU/g第二次检测结果1.37×106CFU/g第三次检测结果1.26×106CFU/g第四次检测结果1.23×106CFU/g从表2中数据可以看出该样品的多次重复检测结果误差较小,因此利用此方法检测土壤中假单胞菌浓度时,其检测结果受系统误差影响较小,可精确的反应土壤中假单胞菌浓度。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1