一种用于细胞共培养的微流控芯片及其细胞培养方法与流程
本发明属于生物医学工程以及细胞生物学研究领域,具体涉及于细胞共培养的微流控芯片及其细胞培养方法。
背景技术:
细胞培养是生命科学中多种研究的基础实验手段,虽然这项技术近年来的发展变缓,但细胞培养仍长期为多个领域的生物学研究做出了巨大的贡献。然而随着研究的深入和拓展,许多研究对细胞的培养也有了越来越多新的要求,例如需要在微容量环境中较长时间的保持细胞活性,在微重力等特殊环境条件下有效的进行细胞培养等等。因此人们开始探究和发展新的细胞培养技术手段。
同时,由于单种细胞培养下细胞所处的环境与多细胞生物体内细胞所处环境依旧存在巨大差别,20世纪80年代后期,人们在单种细胞细胞培养技术的基础上发展出了细胞共培养技术。细胞共培养技术是将2种或2种以上的细胞共同培养于同一环境中的技术,由于体外细胞共培养技术能更好地模拟体内多种细胞之间产生的微环境,便于研究者研究细胞与细胞、细胞与培养环境之间的相互作用,填补了体外单种细胞培养和体内动物实验之间的空白,所以细胞共培养技术被广泛应用于现代细胞研究中,如研究细胞通讯与细胞相互作用、诱导细胞向另一种细胞分化、诱导细胞自身的分化、维持细胞的功能和活力、调控细胞增殖、促进早期胚胎的发育、提高代谢物产量等。
按照细胞共培养的方式,细胞共培养可分为两类,直接共培养和间接共培养。直接共培养是将需要共培养的多种细胞混合在同一个培养器皿中进行细胞培养的一种细胞共培养技术,在直接共培养技术中,多种不同细胞可以共用培养基,并且培养的不同种类的细胞胞体可以直接接触。间接共培养是将需要共培养多种细胞分隔于不同空间内,使不同细胞的培养基可以互相交换,而细胞胞体无直接接触的一种共培养技术。
然而,现有的细胞共培养技术多是基于传统细胞培养技术发展起来的,应用于生物学研究时仍存在一定缺陷。首先,现有的细胞共培养技术多是基于静态细胞培养建立的,故其培养的细胞是处于静态微环境之中的,而多细胞生物体内的细胞则处于由循环系统和多种细胞共同营造的动态微环境中,这种差别可能导致研究结果的不准确。其次,现有的细胞共培养技术难以实现高通量研究。最后,现有细胞共培养技术的试剂消耗量较大,尤其是对于某些珍贵样品的研究而言,研究者往往无法直接使用现有的细胞共培养技术进行研究。
微流控细胞培养芯片是一种新型细胞培养及分析的技术,相比于传统的细胞培养技术,微流控芯片细胞培养技术具有微量、高通量以及可模拟细胞在体内真实生理状态等优点。具体而言,微流控芯片具有如下特点:1.低试剂试样的消耗量能够帮助节省稀有资源;2.流体的可控性可以帮助细胞进行原位操作,这在传统实验方法中是无法实现的;3.结合压力气体控制,可以模拟身体内部的多种运行机制包括心脏搏动,肠蠕动等;4.其高通量的特性允许其在同一时间处理多组样品;5.多功能模块化增强了其集成的可能性。
技术实现要素:
为了克服现有技术上的问题,本发明结合微流控细胞培养技术与细胞共培养技术,提供一种可以用于细胞共培养的微流控芯片,既可以有效地降低了灌流培养过程中流体对细胞产生的剪切力,避免剪切力损伤生长中的细胞,又可以有效地截留悬浮细胞,从而实现悬浮细胞的微流控细胞共培养。
本发明提供以下技术方案:
一种用于细胞共培养的微流控芯片,所述微流控芯片由下至上依次包括基底层、细胞培养腔室层、上盖板层,所述细胞培养腔室层由若干细胞培养腔室在同一平面相互连通而成,用于细胞培养,
所述细胞培养腔室层中设有筛绢将每个所述细胞培养腔室分为上下两层,上层为培养基交换层、下层为细胞培养层,每个细胞培养腔室内的筛绢上均设有筛绢通孔;
在所述上盖板层对应每个细胞培养腔室位置至少设有一个上盖板通孔,至少一个所述上盖板通孔与所述筛绢通孔位置相互对应,在上盖板层上对应所述上盖板通孔位置设有接头,所述接头内设有管道,用于培养基交换、细胞接种或检测。
进一步地,在相邻的所述细胞培养腔室之间设有微孔滤膜,微孔滤膜贯穿细胞培养腔室层分别与上盖板层和基底层相连,用于分隔相邻的细胞培养腔室。进一步地,在上盖板层和细胞培养腔室层对应两个细胞培养腔室之间相邻位置设有观测区域,所述观测区域为硬质透明材料,用与观测相邻两个细胞培养腔室内的细胞。
进一步地,所述筛绢孔径为200目-700目;所述微孔滤膜的孔径为50nm-1600nm;所述细胞培养腔室深度为0.5mm-2mm。
进一步地,在所述上盖板层对应每个细胞培养腔室位置设有3个上盖板通孔,其中上盖板通孔一通过管道分别与外界培养基和所述培养基交换层相连,用于输入新鲜培养基;上盖板通孔二通过管道分别与所述培养基交换层和废液收集装置或检测装置相连,用于输出废液或细胞检测;上盖板通孔三通过管道穿过筛网通孔分别与外界和细胞培养层相连,用于细胞接种。
进一步地,所述基底层、细胞培养腔室层、上盖板层和接头为丙烯腈-丁二烯-苯乙烯塑料ABS、聚氯乙烯PVC或聚甲基丙烯酸甲酯PMMA材料,由环氧树脂灌封胶或聚甲基丙烯酸甲酯PMMA双面胶相互粘合。
进一步地,所述微孔滤膜材质为聚碳酸酯,分别与上盖板层和基底层黏接。
进一步地,所述用于细胞共培养的微流控芯片用于贴壁细胞、悬浮细胞或贴壁细胞和悬浮细胞的共同培养。
一种用细胞共培养的微流控芯片培养细胞的连续灌流培养方法,包括以下步骤:
步骤1将贴壁细胞用胰蛋白酶消化成细胞悬液后,1000rpm离心5min,并用培养基进行细胞重悬,并将细胞悬液稀释至5×104-5×105个/mL,作为种子液,通过上盖板通口穿过筛网通孔在细胞培养层进行细胞接种;
步骤2将悬浮细胞稀释至合适范围内,作为种子液,通过上盖板通口穿过筛网通孔在细胞培养层进行细胞接种;
步骤3将所述用于细胞共培养的微流控芯片置于37℃,浓度5%CO2的环境下,静置3小时后,观察细胞形态,若贴壁细胞已经形态正常,则以0.05~0.4mL/h的流速以培养基进行灌流培养;
若形态未正常,将细胞培养腔室层的培养基更换为新鲜培养基,继续静置培养,至细胞贴壁后开始灌流培养。
进一步地,包括以下步骤:
步骤1将贴壁细胞用胰蛋白酶消化成细胞悬液后,1000rpm离心5min,并用培养基进行细胞重悬,并将细胞悬液稀释至5×104-5×105个/mL,作为种子液,通过上盖板通口穿过筛网通孔在细胞培养层进行细胞接种;
步骤2将悬浮细胞稀释至合适范围内,作为种子液,通过上盖板通口穿过筛网通孔在细胞培养层进行细胞接种;
步骤3将所述用于细胞共培养的微流控芯片置于37℃,浓度5%CO2的环境下,静置3小时后,观察细胞形态,若贴壁细胞已经形态正常,则以如下灌流模式开始间歇培养:静置10~48h,以0.5-2mL/h流速灌流0.5~1h,再静置10~48h。
进一步地,在步骤1之前包括步骤0根据培养细胞的种类对基底层进行包被。
采用上述技术方案,本发明具有如下有益效果:
(1)本发明的细胞共培养微流控芯片加工简单,无需加工掩膜或模具;
(2)本发明的细胞共培养微流控芯片可根据实际细胞培养需要灵活地改变芯片结构;
(3)本发明的细胞共培养微流控芯片的细胞培养腔室由筛绢分隔成两部分,有效地降低了灌流培养过程中流体对细胞产生的剪切力,避免剪切力损伤生长中的细胞;
(4)本发明的细胞共培养微流控芯片可有效地截留悬浮细胞,从而实现悬浮细胞的微流控细胞共培养;
(5)由于两个细胞培养腔室间通过微孔滤膜分隔,本发明的细胞共培养微流控芯片可以实现对两个腔室内细胞的有效截留,同时不阻碍两个细胞培养腔室的培养基交换,可实现多种细胞的间接共培养,同时可以连续观察不同时间下两个细胞培养腔室内细胞的动态变化情况,使研究实现实时高通量,从而简化相关的实验流程;
(6)本发明的细胞共培养微流控芯片的试剂用量和细胞用量均少于传统细胞共培养技术,可用于某些珍贵细胞和珍贵样品的实验。
附图说明
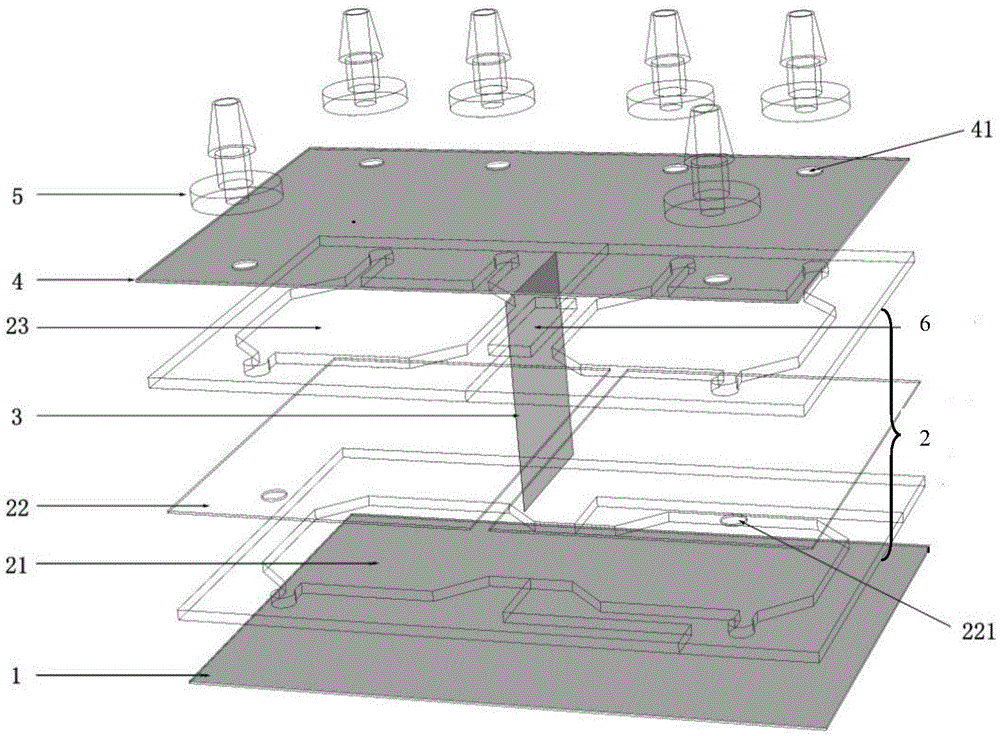
图1是本发明实施例中用于细胞共培养的微流控芯片的结构示意图;
图2是本发明实施例中共培养人神经母细胞瘤SH-SY5Y与人星形胶质瘤U87MG细胞的细胞形态图;
图3是本发明实施例4中共培养体系中人神经母细胞瘤SH-SY5Y与人星形胶质瘤U87MG细胞的细胞形态图;
图4是本发明实施例4中共培养体系中THP-1细胞的细胞形态图。
其中:1、基底层,2、细胞培养腔室层,21细胞培养层,22筛绢,221筛绢通孔,23培养基交换层,3、微孔滤膜,4、上盖板层,41上盖板通孔,5、接头,6、观测区域。
具体实施方式
为了使本发明的目的、技术方案及优点更加清楚明白,下面结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的结构图及具体实施例仅用以解释本发明,并不用于限定本发明。
实施例1
本发明提供一种用于细胞共培养的微流控芯片,如图1所示,微流控芯片由下至上依次包括基底层1、细胞培养腔室层,2、上盖板层4,细胞培养腔室层由若干细胞培养腔室在同一平面相互连通而成,用于细胞培养,实施例1为两个细胞培养腔室的举例说明,本发明细胞培养腔室的个数不限于2个,可以由多个细胞培养腔室相互连通而成。
基底层根据培养细胞类型的需要,可以为经过组织培养处理的透明材料;或者为通过包被达到细胞培养要求的透明材料:如聚对苯二甲酸乙二醇酯PET、玻璃或聚苯乙烯PS等。
细胞培养腔室层中设有筛绢22将每个所述细胞培养腔室分为上下两层,上层为培养基交换层23、下层为细胞培养层21,每个细胞培养腔室内的筛绢上均设有筛绢通孔221;筛绢孔径为200目-700目,细胞不能通过筛绢到达培养基交换层。
优选地,根据共培养细胞的需要在相邻的细胞培养腔室之间设有微孔滤膜3贯穿细胞培养腔室层分别与上盖板层和基地层相连,用于分隔相邻的细胞培养腔室;微孔滤膜的孔径为50nm-1600nm;细胞培养腔室深度为0.5mm-2mm,通过微孔滤膜可以防止细胞培养腔室之间的细胞相互接触。微孔滤膜材质为聚碳酸酯,可以分别与上盖板层和基底层黏接。
在上盖板层对应每个细胞培养腔室位置至少设有一个上盖板通孔41,至少一个上盖板通孔与筛绢通孔221位置相互对应,在上盖板层上对应上盖板通孔位置设有接头5,接头内设有管道,用于培养基交换、细胞接种或检测。在本发明中上盖板通孔的数量不做限定,本实施例中以3个上盖板通孔为例,其中上盖板通孔一通过管道分别与外界培养基和所述培养基交换层相连,用于输入新鲜培养基;上盖板通孔二通过管道分别与所述培养基交换层和废液收集装置或检测装置相连,用于输出废液或细胞检测;上盖板通孔三通过管道穿过筛网通孔分别与外界和细胞培养层相连,用于细胞接种。
在本发明中基底层、细胞培养腔室层、上盖板层和接头为丙烯腈-丁二烯-苯乙烯塑料ABS、聚氯乙烯PVC或聚甲基丙烯酸甲酯PMMA材料中的一种或几种,并且各个部件由环氧树脂灌封胶或聚甲基丙烯酸甲酯PMMA双面胶相互粘合。
本发明的细胞共培养的微流控芯片用于贴壁细胞、悬浮细胞或贴壁细胞和悬浮细胞的共同培养。
实施例2
优选地,在上盖板层和细胞培养腔室层对应两个细胞培养腔室相邻位置设有观测区域,如图1所示,在本发明中不限定观测区域的位置,一切能够实现相邻两个细胞培养腔室中细胞观察的区域都作为观测区域。观测区域可以使用任何透光的无生物毒性材料作为上盖板,用对相邻两个细胞培养腔室内的细胞的观察和检测。
实施例3
一种细胞共培养人神经母细胞瘤SH-SY5Y、人神经胶质瘤U87MG的微流控芯片培养细胞的间歇式培养方法,在本实施例中,微流控芯片的结构可以不设有滤网和筛绢,使显微成像清晰。
方法包括以下步骤:
人神经母细胞瘤SH-SY5Y、人神经胶质瘤U87MG冻存于-150℃中,实验前,复苏细胞,置于37℃,5%CO2培养箱中,培养于DMEM培养基,培养基中添加10%胎牛血清,100U/mL青霉素G和100μg/mL链霉素和2%MEM NEAA(100X)。待常规细胞培养的细胞长至对数期即可接种至微流控芯片内。
取胰蛋白酶消化细胞,消化结束后用胎牛血清终止消化。消化后的细胞经1000rpm离心5min,用培养基重悬沉淀后,使用手持式自动细胞计数仪对细胞进行计数,所使用的计数芯片的尺寸为60μm,然后将SH-SY5Y与U87MG细胞按照1﹕1.65配制成1×105细胞悬液,最后接种至微流控芯片腔室中,置于37℃,5%CO2条件下,静置3h,观察细胞形态,若贴壁细胞已经形态正常,则以如下灌流模式开始间歇培养:静置10~48h,以0.5mL/h灌流2h,再静置10~48h。
使用相差显微镜观察贴壁细胞形态,细胞形态结果如图2所示。
实施例4
一种利用细胞共培养人神经母细胞瘤细胞SH-SY5Y、人星形胶质瘤细胞U87MG和人单核细胞白血病细胞THP-1的微流控芯片培养细胞的连续灌流培养方法。
人神经母细胞瘤SH-SY5Y、人神经胶质瘤U87MG冻存于-150℃中,实验前,复苏细胞,置于37℃,5%CO2培养箱中,培养于DMEM培养基,培养基中添加10%胎牛血清,100U/mL青霉素G和100μg/mL链霉素和2%MEM NEAA 100X。待常规细胞培养的细胞长至对数期即可接种至微流控芯片内。
基底层需要使用0.4mg/mL人血浆来源的纤连蛋白包被,包被温度为37℃,包被时间为1h。
THP-1细胞接种:
THP-1细胞经1000rpm离心5min,弃上清,使用培养基重悬沉淀后,使用手持式自动细胞计数仪对细胞进行计数,所使用的计数芯片的尺寸为60μm,并将THP-1细胞配制成5×105细胞悬液,最后接种至微流控芯片腔室中,置于37℃,5%CO2条件下,静置3h后,以0.3mL/h开始灌流培养。
SH-SY5Y与U87MG细胞接种:
取胰蛋白酶消化细胞,消化结束后用胎牛血清终止消化。经过消化的细胞经1000rpm离心5min,弃上清,用培养基重悬沉淀后,使用手持式自动细胞计数仪对细胞进行计数,所使用的计数芯片的尺寸为60μm,并将SH-SY5Y与U87MG细胞按照1﹕1.65配制成1×105细胞悬液,最后接种至微流控芯片腔室中,置于37℃,5%CO2条件下,静置3h。
观察细胞形态,若贴壁细胞已经形态正常,则以0.3mL/h开始灌流培养。
使用相差显微镜观察贴壁细胞形态,细胞形态结果如图3和图4所示。
以上所述实施例仅表达了本发明的实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!