结合CD3和PSMA的异二聚抗体的制作方法
本申请要求2015年12月7日提交的美国临时申请号62/264,261和2016年4月19日提交的美国临时申请号62/324,823的优先权,所述临时申请以全文引用的方式明确并入。
技术领域
本公开涉及用于治疗癌症(例如,前列腺癌)的方法和组合物。
背景技术:
基于抗体的治疗剂已经成功地用于治疗多种疾病,包括癌症和自体免疫/发炎病症。然而,仍然需要对这一类药物的改善,特别是关于增强其临床功效。正在探索的一种途径是将额外和新颖的抗原结合位点工程改造至基于抗体的药物中以使得单一免疫球蛋白分子共啮合两种不同抗原。啮合两种不同抗原的这类非原生或替代的抗体格局常常被称作双特异体。因为抗体可变区(Fv)的相当大的多样性使得有可能产生识别几乎任何分子的Fv,所以双特异体产生的典型方法是将新的可变区引入抗体中。
已经探索了许多替代的抗体格局用于双特异性靶向(Chames和Baty,2009,《单克隆抗体(mAbs)》1[6]:1-9;Holliger和Hudson,2005,《自然生物技术(Nature Biotechnology)》23[9]:1126-1136;Kontermann,《单克隆抗体(mAbs)》4(2):182(2012),其全部以引用的方式明确并入本文中)。最初,通过融合各自产生单一单克隆抗体的两种细胞系来制造双特异性抗体(Milstein等,1983,《自然(Nature)》305:537-540)。尽管所得杂交杂交瘤或四源杂交瘤确实产生双特异性抗体,但这些抗体仅仅是微小的群体,并且需要大量的纯化来分离所需抗体。针对此的工程改造解决方案是使用抗体片段以制造双特异体。因为这类片段缺乏全长抗体的复杂四级结构,所以可变轻和重链可以在单一基因构建体中连接。已经产生了许多不同形式的抗体片段,包括双体抗体、单链双体抗体、串联scFv以及Fab2双特异体(Chames和Baty,2009,《单克隆抗体(mAbs)》1[6]:1-9;Holliger和Hudson,2005,《自然生物技术(Nature Biotechnology)》23[9]:1126-1136;以引用的方式明确并入本文中)。虽然这些格局可以在细菌中以高水平表达并且归因于其小尺寸可以具有有利的穿透效益,但其在体内快速清除并且可以呈现与其生产和稳定性有关的制造障碍。这些缺点的主要原因在于抗体片段通常缺乏具有其相关功能特性的抗体的恒定区,所述特性包括更大尺寸、高稳定性以及结合至各种Fc受体和配体,这些受体和配体在血清中维持长半衰期(即,新生儿Fc受体FcRn)或充当用于纯化(即,蛋白A和蛋白G)的结合位点。
最近的工作已经尝试通过将双重结合工程改造至全长抗体样格局中来解决基于片段的双特异体的不足(Wu等,2007,《自然生物技术(Nature Biotechnology)》25[11]:1290-1297;USSN12/477,711;Michaelson等,2009,《单克隆抗体(mAbs)》1[2]:128-141;PCT/US2008/074693;Zuo等,2000,《蛋白质工程(Protein Engineering)》13[5]:361-367;USSN09/865,198;Shen等,2006,《生物化学杂志(J Biol Chem)》281[16]:10706-10714;Lu等,2005,《生物化学杂志(J Biol Chem)》280[20]:19665-19672;PCT/US2005/025472;以引用的方式明确并入本文中)。这些格局克服了抗体片段双特异体的一些障碍,主要原因在于其含有Fc区。这些格局的一个显著缺点在于因为其在同二聚恒定链的顶部建立新的抗原结合位点,所以结合至新的抗原始终是二价的。
对于作为治疗性双特异体格局中的共靶(co-target)有吸引力的许多抗原,所需结合是单价的而不是二价的。对于许多免疫受体,通过单价结合相互作用的交联来实现细胞活化。交联的机制通常由抗体/抗原免疫复合物介导,或经由效应细胞与靶细胞的啮合。举例来说,低亲和力Fcγ受体(FcγR),诸如FcγRIIa、FcγRIIb以及FcγRIIIa,单价结合至抗体Fc区。单价结合并不活化表达这些FcγR的细胞;然而,在免疫复合或细胞间接触后,受体交联并且在细胞表面上簇集,从而引起活化。对于负责介导细胞杀伤的受体,例如天然杀伤(NK)细胞上的FcγRIIIa,当在高度亲合格局中效应细胞啮合靶细胞时发生受体交联和细胞活化(Bowles和Weiner,2005,《免疫学方法杂志(J Immunol Methods)》304:88-99,以引用的方式明确并入)。类似地,在B细胞上抑制性受体FcγRIIb仅当其啮合至具有细胞表面B细胞受体(BCR)的免疫复合物中时才下调B细胞活化,这一机制由可溶性IgG与由BCR识别的相同抗原的免疫复合介导(Heyman 2003,《免疫学快报(Immunol Lett)》88[2]:157-161;Smith和Clatworthy,2010,《自然综述免疫学(Nature Reviews Immunology)》10:328-343;以引用的方式明确并入)。作为另一个实例,仅当在高度亲合细胞间突触中T细胞相关的T细胞受体(TCR)啮合抗原呈递细胞上抗原负载的MHC时才发生T细胞的CD3活化(Kuhns等,2006,《免疫(Immunity)》24:133-139)。的确,使用抗CD3抗体的CD3的非特异性二价交联引出细胞因子风暴和毒性(Perruche等,2009,《免疫学杂志(J Immunol)》183[2]:953-61;Chatenoud和Bluestone,2007,《自然综述免疫学(Nature Reviews Immunology)》7:622-632;以引用的方式明确并入)。因此,对于实际的临床使用,用于靶细胞的重导向杀伤的CD3共啮合的优选模式是单价结合,这仅在与共啮合标靶啮合后才引起活化。
因此,虽然从抗体片段产生的双特异体遭受生物物理学和药物代谢动力学障碍,但用全长抗体样格局建立的那些的缺点在于其在不存在初级靶抗原的情况下多价啮合共靶抗原,导致非特异性活化和潜在毒性。本发明通过介绍针对CD3和前列腺特异性膜抗原(PSMA)的新颖双特异性抗体来解决这个问题。
技术实现要素:
本文提供了结合至CD3和前列腺特异性膜抗原(PSMA)的异二聚抗体,PSMA是在大多数前列腺癌细胞上显著过度表达的跨膜蛋白。这类抗体适用于治疗癌症(例如,前列腺癌),例如,通过促进靶向CD3+ T细胞至表达PSMA的肿瘤细胞。
在一个方面,本文提供了一种异二聚抗体,其包括:a)包括SEQ ID NO:64的第一单体;b)包括SEQ ID NO:65的第二单体;以及c)包含SEQ ID NO:66的轻链。在又一个方面,本文提供了一种核酸组合物,其包括:a)编码包括SEQ ID NO:64的第一单体的第一核酸;b)编码包括SEQ ID NO:65的第二单体的第二核酸;以及c)编码包括SEQ ID NO:66的轻链的第三核酸。在另一个方面,本文提供了一种表达载体组合物,其包括:a)包括编码包括SEQ ID NO:64的第一单体的第一核酸的第一表达载体;b)包括编码包括SEQ ID NO:65的第二单体的第二核酸的第二表达载体;以及c)包括编码包括SEQ ID NO:66的轻链的第三核酸的第三表达载体。
在另一个方面,本文提供了一种异二聚抗体,其包括:a)包括SEQ ID NO:118的第一单体;b)包括SEQ ID NO:119的第二单体;以及c)包括SEQ ID NO:120的轻链。在又一个方面,本文提供了一种核酸组合物,其包括:a)编码包括SEQ ID NO:118的第一单体的第一核酸;b)编码包括SEQ ID NO:119的第二单体的第二核酸;以及c)编码包括SEQ ID NO:120的轻链的第三核酸。在另一个方面,本文提供了一种表达载体组合物,其包括:a)包括编码包括SEQ ID NO:118的第一单体的第一核酸的第一表达载体;b)包括编码包括SEQ ID NO:119的第二单体的第二核酸的第二表达载体;以及c)包含包括第三核酸的核酸的第三表达载体,所述第三核酸编码包括SEQ ID NO:120的轻链。
在一个方面,本文提供了一种异二聚抗体,其包括:a)包括SEQ ID NO:121的第一单体;b)包括SEQ ID NO:122的第二单体;以及c)包括SEQ ID NO:123的轻链。在另一个方面,本文提供了一种核酸组合物,其包括:a)编码包括SEQ ID NO:121的第一单体的第一核酸;b)编码包括SEQ ID NO:122的第二单体的第二核酸;以及c)编码包括SEQ ID NO:123的轻链的第三核酸。在又一个方面,本文提供了一种表达载体组合物,其包括:a)包括编码包括SEQ ID NO:121的第一单体的第一核酸的第一表达载体;b)包括编码包括SEQ ID NO:122的第二单体的第二核酸的第二表达载体;以及c)包括编码第三核酸的核酸的第三表达载体,所述第三核酸编码包括SEQ ID NO:123的轻链。
在一个方面,本文提供了一种异二聚抗体,其包括:a)包括SEQ ID NO:124的第一单体;b)包括SEQ ID NO:125的第二单体;以及c)包括SEQ ID NO:126的轻链。在另一个方面,本文提供了一种核酸组合物,其包括:a)编码包括SEQ ID NO:124的第一单体的第一核酸;b)编码包括SEQ ID NO:125的第二单体的第二核酸;以及c)编码包括SEQ ID NO:126的轻链的第三核酸。在又另一个方面,本文提供了一种表达载体组合物,其包括:a)包括编码包括SEQ ID NO:124的第一单体的第一核酸的第一表达载体;b)包括编码包括SEQ ID NO:125的第二单体的第二核酸的第二表达载体;以及c)包括编码第三核酸的核酸的第三表达载体,所述第三核酸编码包括SEQ ID NO:126的轻链。
在一个方面,本文提供了一种包括第一单体、第二单体以及轻链的异二聚抗体。第一单体包括:i)第一Fc域;ii)包括scFv可变轻域和scFv连接子以及scFv可变重域的抗CD3 scFv;其中scFv使用域连接子共价附接至Fc域的N端。第二单体包括重链,所述重链包括:i)重可变域;以及ii)包括第二Fc域的重恒定域。轻链包括可变轻域和恒定轻域。重可变域和可变轻域结合PSMA。
在另一个方面,本文提供了一种包括第一单体、第二单体以及轻链的异二聚抗体。第一单体包括:i)第一Fc域;以及ii)包括scFv可变轻域、scFv连接子以及scFv可变重域的抗CD3 scFv;其中scFv使用域连接子共价附接至Fc域的N端。第二单体包括重链,所述重链包括i)重可变域;以及ii)包括第二Fc域的重恒定域。轻链包括可变轻域和恒定轻域。scFv可变轻域包括:CD3 L1.47的vlCDR(具有SEQ ID NO:6的vlCDR1、具有SEQ ID NO:7的vlCDR2以及具有SEQ ID NO:8的vlCDR3),scFv可变重域包括CD3 H1.30的vhCDR(具有SEQ ID NO:2的vhCDR1、具有SEQ ID NO:3的vhCDR2以及具有SEQ ID NO:4的vhCDR3),并且重可变域和可变轻域结合PSMA。
在另一个方面,本文提供了一种包括第一单体、第二单体以及轻链的异二聚抗体。第一单体包括:i)第一Fc域;以及ii)包括scFv可变轻域、scFv连接子以及scFv可变重域的抗CD3 scFv;其中scFv使用域连接子共价附接至Fc域的N端。第二单体包括重链,所述重链包括:i)重可变域;以及ii)包括第二Fc域的重恒定域。轻链包括可变轻域和恒定轻域。scFv可变轻域包括:CD3 L1.47的vlCDR(具有SEQ ID NO:15的vlCDR1、具有SEQ ID NO:16的vlCDR2以及具有SEQ ID NO:17的vlCDR3),scFv可变重域包括CD3 H1.32的vhCDR(具有SEQ ID NO:11的vhCDR1、具有SEQ ID NO:12的vhCDR2以及具有SEQ ID NO:13的vhCDR3),并且重可变域和可变轻域结合PSMA。
在一个方面,本文提供了一种包括第一单体、第二单体以及轻链的异二聚抗体。第一单体包括:i)第一Fc域;以及ii)包括scFv可变轻域、scFv连接子以及scFv可变重域的抗CD3 scFv;其中scFv使用域连接子共价附接至Fc域的N端。第二单体包括重链,所述重链包括:i)重可变域;以及ii)包括第二Fc域的重恒定域。轻链包括可变轻域和恒定轻域。scFv可变轻域包括CD3 L1.47的vlCDR(具有SEQ ID NO:24的vlCDR1、具有SEQ ID NO:25的vlCDR2以及具有SEQ ID NO:26的vlCDR3),scFv可变重域包括CD3 H1.89的vhCDR(具有SEQ ID NO:20的vhCDR1、具有SEQ ID NO:21的vhCDR2以及具有SEQ ID NO:22的vhCDR3),并且重可变域和可变轻域结合PSMA。
在一个方面,本文提供了一种包括第一单体、第二单体以及轻链的异二聚抗体。第一单体包括:i)第一Fc域;以及ii)包括scFv可变轻域、scFv连接子以及scFv可变重域的抗CD3 scFv;其中scFv使用域连接子共价附接至Fc域的N端。第二单体包括重链,所述重链包括:i)重可变域;以及ii)包括第二Fc域的重恒定域。轻链包括可变轻域和恒定轻域。scFv可变轻域包括:CD3 L1.47的vlCDR(具有SEQ ID NO:33的vlCDR1、具有SEQ ID NO:34的vlCDR2以及具有SEQ ID NO:35的vlCDR3),scFv可变重域包括CD3 H1.90的vhCDR(具有SEQ ID NO:29的vhCDR1、具有SEQ ID NO:30的vhCDR2以及具有SEQ ID NO:31的vhCDR3),并且重可变域和可变轻域结合PSMA。
在另一个方面,本文提供了一种包括第一单体、第二单体以及轻链的异二聚抗体。第一单体包括:i)第一Fc域;以及ii)包括scFv可变轻域、scFv连接子以及scFv可变重域的抗CD3 scFv;其中scFv使用域连接子共价附接至Fc域的N端。第二单体包括重链,所述重链包括:i)重可变域;以及ii)包括第二Fc域的重恒定域。轻链包括可变轻域和恒定轻域。scFv可变轻域包括:CD3 L1.47的vlCDR(具有SEQ ID NO:42的vlCDR1、具有SEQ ID NO:43的vlCDR2以及具有SEQ ID NO:44的vlCDR3),scFv可变重域包括CD3 H1.33的vhCDR(具有SEQ ID NO:38的vhCDR1、具有SEQ ID NO:39的vhCDR2以及具有SEQ ID NO:40的vhCDR3),并且重可变域和可变轻域结合PSMA。
在另一个方面,本文提供了一种包括第一单体、第二单体以及轻链的异二聚抗体。第一单体包括:i)第一Fc域;以及ii)包括scFv可变轻域、scFv连接子以及scFv可变重域的抗CD3 scFv;其中scFv使用域连接子共价附接至Fc域的N端。第二单体包括重链,所述重链包括:i)重可变域;以及ii)包括第二Fc域的重恒定域。轻链包括可变轻域和恒定轻域。scFv可变轻域包括:CD3 L1.47的vlCDR(具有SEQ ID NO:51的vlCDR1、具有SEQ ID NO:52的vlCDR2以及具有SEQ ID NO:53的vlCDR3),scFv可变重域包括CD3 H1.31的vhCDR(具有SEQ ID NO:47的vhCDR1、具有SEQ ID NO:48的vhCDR2以及具有SEQ ID NO:49的vhCDR3),并且重可变域和可变轻域结合PSMA。
在上文所描述的抗体的一个实施方案中,重可变域包括抗PSMA J591 H1_L1的vhCDR(具有SEQ ID NO:111的vhCDR1、具有SEQ ID NO:112的vhCDR2以及具有SEQ ID NO:113的vhCDR3)并且可变轻域包括抗PSMA J591 H1_L1的vlCDR(具有SEQ ID NO:107的vlCDR1、具有SEQ ID NO:108的vlCDR2以及具有SEQ ID NO:109的vlCDR3)。在一个例示性实施方案中,重可变域包括抗PSMA J591 H1_L1的可变重域(SEQ ID NO:110)并且可变轻域包括抗PSMA J591 H1_L1的可变轻域(SEQ ID NO:106)。
在一个方面,本文提供了一种包括第一单体、第二单体以及轻链的异二聚抗体。第一单体包括:i)第一Fc域;以及ii)包括scFv可变轻域、scFv连接子以及scFv可变重域的抗CD3 scFv;其中scFv使用域连接子共价附接至Fc域的N端。第二单体包括重链,所述重链包括:i)重可变域;以及ii)包括第二Fc域的重恒定域。轻链包括可变轻域和恒定轻域。重可变域包括抗PSMA J591 H1_L1的vhCDR(具有SEQ ID NO:111的vhCDR1、具有SEQ ID NO:112的vhCDR2以及具有SEQ ID NO:113的vhCDR3)并且可变轻域包括抗PSMA J591 H1_L1的vlCDR(具有SEQ ID NO:107的vlCDR1、具有SEQ ID NO:108的vlCDR2以及具有SEQ ID NO:109的vlCDR3)。重可变域和可变轻域结合PSMA。在一些实施方案中,重可变域包括抗PSMA J591 H1_L1的可变重域(SEQ ID NO:110)并且可变轻域包括抗PSMA J591 H1_L1的可变轻域(SEQ ID NO:106)。
在上文所描述的抗体的一些实施方案中,第一Fc域和第二Fc域包含选自由以下组成的群组的一组变体:S364K/E357Q:L368D/K370S;L368D/K370S:S364K;L368E/K370S:S364K;T411T/E360E/Q362E:D401K;L368D/K370S:S364K/E357L;以及K370S:S364K/E357Q。
在上文所描述的抗体的一些实施方案中,scFv连接子是带电荷连接子。
在上文所描述的抗体的一些实施方案中,重链恒定域包括氨基酸取代N208D/Q295E/N384D/Q418E/N421D。
在上文所描述的抗体的一些实施方案中,第一和第二Fc域包括氨基酸取代E233P/L234V/L235A/G236del/S267K。
在另一个方面,本文提供了一种包括第一单体、第二单体以及共同轻链的异二聚抗体。第一单体包括:i)第一重链,所述第一重链包括:1)第一可变重域;2)包括第一Fc域的第一恒定重链;以及3)包括scFv可变轻域、scFv连接子以及scFv可变重域的scFv;其中scFv使用域连接子共价附接至Fc域的C端。第二单体包括第二重链,所述第二重链包括第二可变重域和包括第二Fc域的第二恒定重链。共同轻链包括可变轻域和恒定轻域。第一和第二Fc域具有选自由以下组成的群组的一组氨基酸取代:S364K/E357Q:L368D/K370S;L368D/K370S:S364K;L368E/K370S:S364K;T411T/E360E/Q362E:D401K;L368D/K370S:S364K/E357L;以及K370S:S364K/E357Q。第一可变重域和可变轻域结合人类PSMA (SEQ ID NO:131),第二可变重域和可变轻域结合人类PSMA,并且scFv结合人类CD3。
在一个方面,本文提供了一种包括第一单体、第二单体以及共同轻链的异二聚抗体。第一单体包括i)第一重链,所述第一重链包括:1)第一可变重域;2)包括第一Fc域的第一恒定重域;以及3)第一可变轻域,其中第一可变轻域使用域连接子共价附接至第一Fc域的C端。第二单体包括:i)第二可变重域;ii)包括第二Fc域的第二恒定重域;以及iii)第三可变重域,其中第三可变重域使用域连接子共价附接至第二Fc域的C端。共同轻链包括第二可变轻域和恒定轻域。第一和第二Fc域具有选自由以下组成的群组的一组氨基酸取代:S364K/E357Q:L368D/K370S;L368D/K370S:S364K;L368E/K370S:S364K;T411T/E360E/Q362E:D401K;L368D/K370S:S364K/E357L;以及K370S:S364K/E357Q。第一可变重域和第二可变轻域结合PSMA,第二可变重域和第二可变轻域结合PSMA,并且第一可变轻域和第三可变重域结合CD3。
在一个方面,本文提供了一种包括第一单体、第二单体以及共同轻链的异二聚抗体。第一单体包括i)第一重链,其包括i)第一重链,所述第一重链包括:1)第一可变重域;2)包括第一CH1域和第一Fc域的第一恒定重链;以及3)包括scFv可变轻域、scFv连接子以及scFv可变重域的scFv;其中scFv使用域连接子共价附接于CH1域的C端与第一Fc域的N端之间。第二单体包括第二重链,所述第二重链包括第二可变重域和包括第二Fc域的第二恒定重链。共同轻链包括可变轻域和恒定轻域。第一和第二Fc域具有选自由以下组成的群组的一组氨基酸取代:S364K/E357Q:L368D/K370S;L368D/K370S:S364K;L368E/K370S:S364K;T411T/E360E/Q362E:D401K;L368D/K370S:S364K/E357L;以及K370S:S364K/E357Q。第一可变重域和可变轻域结合PSMA,第二可变重域和可变轻域结合PSMA,并且scFv结合CD3。
在一个方面,本文提供了一种包括第一单体、第二单体以及共同轻链的异二聚抗体。第一单体包括i)第一重链,所述第一重链包括i)第一可变重域;ii)包括第一Fc域的第一恒定重域;以及iii)第一可变轻域,其中第一可变轻域使用域连接子共价附接于第一恒定重域的CH1域的C端与第一Fc域的N端之间。第二单体包括:i)第二可变重域;ii)包括第二Fc域的第二恒定重域;以及iii)第三可变重域,其中第三可变重域使用域连接子共价附接于第二恒定重域的CH1域的C端与第二Fc域的N端之间。共同轻链包括第二可变轻域和恒定轻域。第一和第二Fc域具有选自由以下组成的群组的一组氨基酸取代:S364K/E357Q:L368D/K370S;L368D/K370S:S364K;L368E/K370S:S364K;T411T/E360E/Q362E:D401K;L368D/K370S:S364K/E357L;以及K370S:S364K/E357Q。第一可变重域和第二可变轻域结合PSMA,第二可变重域和第二可变轻域结合PSMA,并且第一可变轻域和第三可变重域结合CD3。
在一个方面,本文提供了一种包括第一单体、第二单体以及轻链的异二聚抗体。第一单体包括i)第一重链,其包括i)第一重链,所述第一重链包括:1)第一可变重域;2)包括第一CH1域和第一Fc域的第一恒定重链;以及3)包括scFv可变轻域、scFv连接子以及scFv可变重域的scFv;其中scFv使用域连接子共价附接于CH1域的C端与第一Fc域的N端之间。第二单体包括第二Fc域。轻链包括可变轻域和恒定轻域。第一和第二Fc域具有选自由以下组成的群组的一组氨基酸取代:S364K/E357Q:L368D/K370S;L368D/K370S:S364K;L368E/K370S:S364K;T411T/E360E/Q362E:D401K;L368D/K370S:S364K/E357L;以及K370S:S364K/E357Q。第一可变重域和可变轻域结合第一抗原,scFv结合第二抗原,并且第一和第二抗原中的一者是PSMA并且另一者是CD3。
在另一个方面,本文提供了一种核酸组合物,其编码本文所描述的主题异二聚抗体中的任一者。在一些实施方案中,核酸组合物包括a)编码第一单体的第一核酸;b)编码第二单体的第二核酸;以及c)编码轻链的第三核酸。
在另一个方面,本文提供了一种异二聚抗体,其选自由以下组成的群组:XENP14484、XENP16873、XENP16874以及XENP19722。
在另一个方面,本文提供了一种表达载体组合物,其包括本文所描述的核酸组合物中的任一者。在另一个方面,本文提供了一种宿主细胞,其包括本文所描述的核酸组合物或表达载体组合物中的任一者。在又另一个方面,本文提供了一种制造本文所描述的主题异二聚抗体的方法,其包括在表达抗体的条件下培养本文所描述的宿主细胞,以及回收抗体。
附图说明
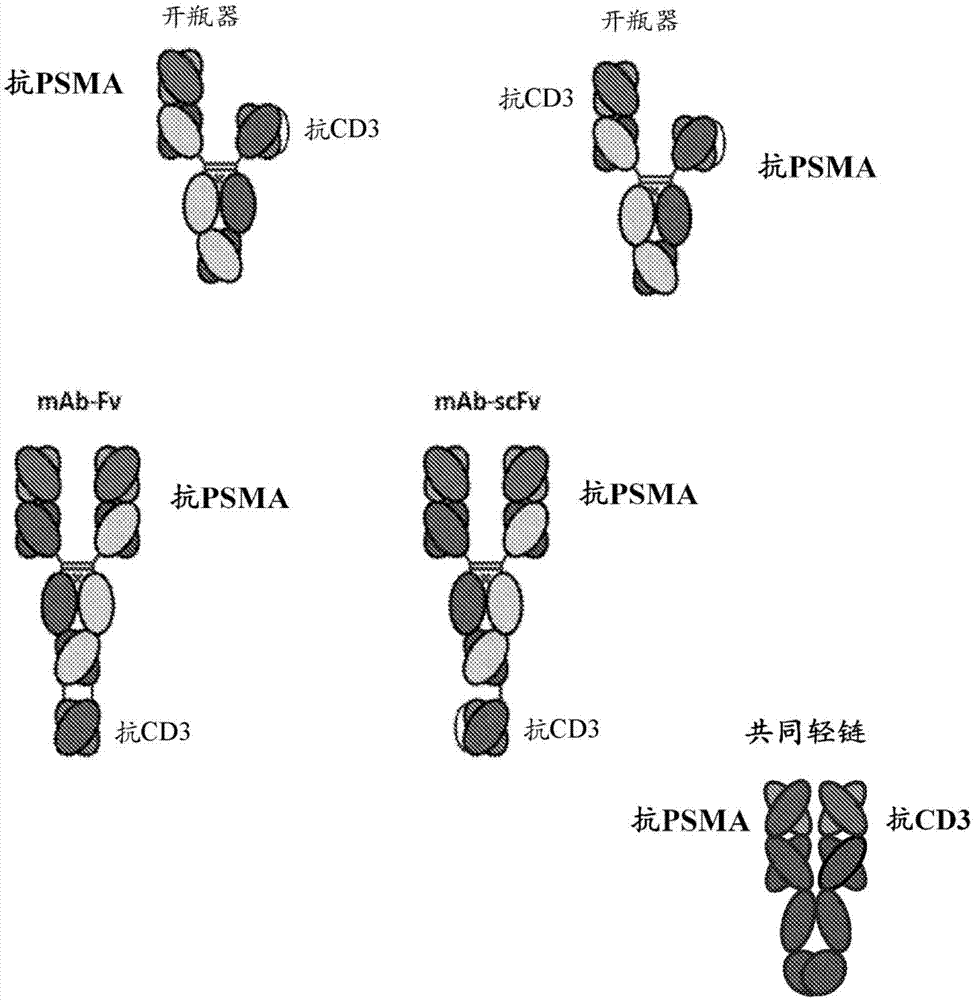
图1A和1B描绘了本发明的若干格局。描绘了“开瓶器”格局的两种形式,一种具有包含scFv的抗CD3抗原结合域和包含Fab的抗PSMA抗原结合域,并且一种具有颠倒的这些。mAb-Fv、mAb-scFv、中心scFv和中心Fv、共同轻链以及双特异性IgG格局全部示出。虽然这些图中的结构中的每一者将抗PSMA和抗CD3域描绘成scFv或Fv,但这些结构中的每一者的抗PSMA和抗CD3域也可以“颠倒”。举例来说,还预期图1A中描绘的mAb-scFv可以具有抗PSMA scFv和抗CD3Fv。另外,示出了一个单体只包含Fc域的“单臂”格局,包括单臂中心scFv和单臂中心Fv。还示出了双scFv格局。
图2描绘了“高CD3”抗CD3_H1.30_L1.47构建体的序列,包括可变重和轻域(CDR加下划线),以及个别的vl和vhCDR,以及具有带电荷连接子(加双下划线)的scFv构建体。正如图中描绘的所有序列的真实情况一样,需要时,这个带电荷连接子可以由不带电荷连接子或不同带电荷连接子置换。
图3描绘了“高Int#l”抗CD3_H1.32_L1.47构建体的序列,包括可变重和轻域(CDR加下划线),以及个别的vl和vhCDR,以及具有带电荷连接子(加双下划线)的scFv构建体。正如图中描绘的所有序列的真实情况一样,需要时,这个带电荷连接子可以由不带电荷连接子或不同带电荷连接子置换。
图4描绘了“高Int#2”抗CD3_H1.89_L1.47构建体的序列,包括可变重和轻域(CDR加下划线),以及个别的vl和vhCDR,以及具有带电荷连接子(加双下划线)的scFv构建体。正如图中描绘的所有序列的真实情况一样,需要时,这个带电荷连接子可以由不带电荷连接子或不同带电荷连接子置换。
图5描绘了“高Int#3”抗CD3_H1.90_L1.47构建体的序列,包括可变重和轻域(CDR加下划线),以及个别的vl和vhCDR,以及具有带电荷连接子(加双下划线)的scFv构建体。正如图中描绘的所有序列的真实情况一样,需要时,这个带电荷连接子可以由不带电荷连接子或不同带电荷连接子置换。
图6描绘了“Int”抗CD3_H1.33_L1.47构建体的序列,包括可变重和轻域(CDR加下划线),以及个别的vl和vhCDR,以及具有带电荷连接子(加双下划线)的scFv构建体。正如图中描绘的所有序列的真实情况一样,需要时,这个带电荷连接子可以由不带电荷连接子或不同带电荷连接子(例如,图14中的任何带电荷连接子)置换。
图7描绘了“低”抗CD3_H1.31_L1.47构建体的序列,包括可变重和轻域(CDR加下划线),以及个别的vl和vhCDR,以及具有带电荷连接子(加双下划线)的scFv构建体。正如图中描绘的所有序列的真实情况一样,需要时,这个带电荷连接子可以由不带电荷连接子或不同带电荷连接子(例如,图14中的任何带电荷连接子)置换。
图8描绘了XENP14484的可变重和可变轻域的序列,包括可变重和轻域(CDR加下划线),以及个别的vl和vhCDR,以及具有带电荷连接子(加双下划线)的scFv构建体。然而,如本领域的技术人员将了解,在PSMA实施方案的情况下的带电荷连接子,即带正电荷连接子也可以由如图14中所示的带负电荷连接子、或不带电荷的传统GS连接子置换。
图9描绘了XENP14484的序列。
图10A-10E描绘了异二聚变体组的有用对(包括偏移和pI变体)。在图10E上,存在没有对应的“单体2”变体的变体;这些是可以在任一单体上单独使用或包括于例如开瓶器的Fab侧上的pI变体,并且适当的带电荷scFv连接子可以在利用scFv作为第二抗原结合域的第二单体上使用。适合的带电荷连接子示于图14中。
图11描绘了等排变体抗体恒定区的清单和其相应的取代。pI_(-)指示更低pI变体,而pI_(+)指示更高pI变体。这些可以任选地并且独立地与本发明的其它异二聚变体(同样和其它变体类型,如本文所概述)组合。
图12描绘了消融FcγR结合的有用消融变体(有时称作“敲除”或“KO”变体)。
图13示出了本发明的两个特别有用的实施方案。
图14A-14B描绘了应用于增大或减小利用一个或多个scFv作为补体的异二聚抗体的pI的许多带电荷scFv连接子。(+H)正性连接子特别应用于本文中,特别地具有本文所示的抗CD3vl和vh序列。具有单电荷的单一现有技术scFv连接子以“Whitlow”提及,来自Whitlow等,《蛋白质工程(Protein Engineering)》6(8):989-995(1993)。应注意,这个连接子用于在scFv中减少聚集并且增强蛋白水解稳定性。
图15描绘了具有异二聚体产量(通过HPLC-CIEX确定)和热稳定性(通过DSC确定)的工程改造的异二聚体偏移Fc变体的清单。未确定的热稳定性由“n.d.”表示。
图16.测试物品是抗PSMA或抗RSV x抗CD3双特异体。上图:与100k LNCaP细胞的细胞表面结合。由FITC标记的抗人IgG Fc二级抗体进行检测。下图:重导向T细胞细胞毒性试验、24小时孵育、10k LNCaP细胞、400k纯化T细胞。由LDH进行检测。
图17A和17B包括了示出T细胞反应和细胞因子释放综合症(CRS)取决于猴中靶细胞的啮合的图解。向食蟹猴(n=3)给与单次剂量的XENP14484(抗PSMA x抗CD3,30μg/kg)或XENP13245(抗RSV x CD3,3mg/kg)。图17A通过流式细胞术检查CD4+ T细胞着边(上图)和由CD69MFI的活化(中图)。通过ELISA检查IL-6血清水平(下图)。图17B通过流式细胞术检查CD8+ T细胞着边(上图)和由CD69MFI的活化(中图)。通过ELISA检查TNF血清水平(下图)。
图18示出了本发明的实施方案的可能组合的矩阵。“A”意味着所提及的抗CD3序列的CDR可以与左手边的抗PSMA构建体的CDR组合。也就是说,例如对于左上角细胞,来自可变重链抗CD3 H1.30序列的vhCDR和来自抗CD3 L1.47序列的可变轻链的vlCDR可以与来自抗PSMA J591 H1_L1序列的vhCDR和来自J591 H1_L1序列的vlCDR组合(见图20)。“B”意味着来自抗CD3构建体的CDR可以与来自抗PSMA构建体的可变重和轻域组合。也就是说,例如对于左上角细胞,来自可变重链抗CD3 H1.30序列的vhCDR和来自抗CD3 L1.47序列的可变轻链的vlCDR可以与可变重域J591 H1_L1序列和J591 H1_L1序列组合。“C”是颠倒的,以使得来自CD3序列的可变重域和可变轻域与PSMA序列的CDR一起使用。“D”是来自各自的可变重链与可变轻链组合的情况。“E”是抗CD3的scFv与PSMA抗原结合域构建体的CDR一起使用的情况。“F”是CD3的scFv与PSMA抗原结合域的可变重和可变轻域一起使用的情况。“G”是抗CD3构建体的CDR与PSMA构建体的scFv一起使用的情况。“H”是抗CD3的可变重域和可变轻域与抗PSMA的scFv一起使用的情况。
图19描绘了各种前列腺特异性膜抗原(PSMA)的氨基酸序列,包括完全人类PSMA、人类PSMA胞外域、完全食蟹猴(Macaca fascicularis)PSMA以及食蟹猴PSMA胞外域。
图20描绘了未人类化抗PSMA抗体J591和人类化抗PSMA抗体J591 H1_L1的可变重(VH)和可变轻(VL)域的氨基酸序列。还描绘了包括于这些可变重和可变轻域中的可变重(vhCDR1-3)和可变轻(vlCDR1-3)域的互补决定区。在一些实施方案中,抗PSMA CDR以及VH和VL可以用于本文所描述的单特异性和异二聚体抗体(例如,抗PSMA x抗CD3)抗体中。在异二聚抗体进一步包括抗CD3结合域的一些实施方案中,抗CD3结合域可以包括图5-7中描绘的VH、VL或CDR中的任一者。
图21A-21E描绘了本文所描述的例示性抗PSMA x抗CD3抗体的氨基酸序列,包括XENP14484(图21A)、XENP16873(图21B)、XENP16874(图21C)以及XENP19722(图21D)。图22E描绘了例示性开瓶器支架的氨基酸序列。这样的支架可以与本文所描述的各种可变重域、可变轻域以及scFv组合。
图22描绘了示出抗PSMA x抗CD3抗体XENP14484和XENP19722的PSMA亲和力(Kd)确定的图解。
图23是示出例示性抗PSMA x抗CD3抗体XENP14484和XENP 19722与LNCaP前列腺癌细胞(LNCaP)的结合(上)以及这类例示性抗体介导LNCaP前列腺癌细胞系的重导向T细胞细胞毒性(RTCC)的能力(下)的图解。上图:与100k LNCaP细胞的细胞表面结合。由FITC标记的抗人IgG Fc二级抗体进行检测。下图:重导向T细胞细胞毒性试验、过夜孵育、10k LNCaP细胞、来自人类PBMC的100k纯化T细胞。由LDH进行检测。
图24是示出具有降低的CD3亲和力的抗PSMA x抗CD3双特异性抗体(XENP19722)与具有高CD3亲和力的抗PSMA x抗CD3双特异性抗体(XENP14484)(下)相比在猴中展现类似的T细胞活化(上、中)但更低的CRS的图解。
图25A-25D示出了若干有用的开瓶器格局骨架的序列,而没有Fv序列(例如,对于Fab侧的scFv以及vh和vl)。如本领域的技术人员将了解和下文所概述,这些序列可以与本文所概述的任何vh和vl对一起使用,其中一个单体包括scFv(任选地包括带电荷scFv连接子)并且另一个单体包括Fab序列(例如,vh附接至“Fab侧重链”并且vl附接至“恒定轻链”)。scFv可以是抗CD3或抗TTA,其中Fab是另一者。也就是说,本文所概述的任何抗CD3和抗PSMA Fv序列,包括这类序列的CDR,以任何组合可以合并至这些图25骨架中。
应注意,这些开瓶器骨架应用于图1B的中心scFv格局中,其中具有与第一Fab相同的抗原结合的额外的第二Fab(vh-CH1和vl-恒定轻)添加至“开瓶器侧”上的scFv的N端。
具体实施方式
I.定义
为了可以更全面地了解本申请,下文陈述了若干定义。这类定义有意包涵语法等效物。
“消融”在本文中意味着活性的降低或去除。因此,举例来说,“消融FcγR结合”意味着Fc区氨基酸变体与不含特定变体的Fc区相比具有小于50%的起始结合,其中小于70-80-90-95-98%的活性损失是优选的,并且一般来说,活性低于Biacore试验中的可检测结合的水平。FcγR结合的消融的特别用途是图12中所示的那些。
如本文所用的“ADCC”或“抗体依赖性细胞介导的细胞毒性”意味着细胞介导的反应,其中表达FcγR的非特异性细胞毒性细胞识别靶细胞上结合的抗体并且随后引起靶细胞的裂解。ADCC与结合至FcγRIIIa相关联;增加结合至FcγRIIIa使得ADCC活性增加。
如本文所用的“ADCP”或抗体依赖性细胞介导的吞噬意味着细胞介导的反应,其中表达FcγR的非特异性细胞毒性细胞识别靶细胞上结合的抗体并且随后引起靶细胞的吞噬。
“修饰”在本文中意味着多肽序列中的氨基酸取代、插入和/或缺失或对化学连接至蛋白质的部分的改变。举例来说,修饰可以是附接至蛋白质的碳水化合物或PEG结构改变。“氨基酸修饰”在本文中意味着多肽序列中的氨基酸取代、插入和/或缺失。为清楚起见,除非另有注释,否则氨基酸修饰始终是针对由DNA编码的氨基酸,例如,在DNA和RNA中具有密码子的20种氨基酸。
“氨基酸取代”或“取代”在本文中意味着亲本多肽序列中的特定位置处的氨基酸被不同氨基酸置换。特别地,在一些实施方案中,取代是针对不天然存在于特定位置处,不天然存在于生物体内或任何生物体中的氨基酸。举例来说,取代E272Y指的是变体多肽,在这种情况下是Fc变体,其中在位置272处的谷氨酸被酪氨酸置换。为清楚起见,已经工程改造以改变核酸编码序列但不改变起始氨基酸(例如,将CGG(编码精氨酸)交换成CGA(仍然编码精氨酸)以增加宿主生物体表达水平)的蛋白质不是“氨基酸取代”;也就是说,尽管创造编码相同蛋白质的新基因,但如果蛋白质在其所起始的特定位置处具有相同氨基酸,那么就不是氨基酸取代。
如本文所用的“氨基酸插入”或“插入”意味着在亲本多肽序列中的特定位置处添加氨基酸序列。举例来说,-233E或233E指明在位置233之后和在位置234之前插入谷氨酸。另外,-233ADE或A233ADE指明在位置233之后和在位置234之前插入AlaAspGlu。
如本文所用的“氨基酸缺失”或“缺失”意味着在亲本多肽序列中的特定位置处去除氨基酸序列。举例来说,E233-或E233#或E233()指明在位置233处谷氨酸缺失。另外,EDA233-或EDA233#指明在位置233处开始的序列GluAspAla缺失。
如本文所用的“变体蛋白”或“蛋白变体”或“变体”意味着由于至少一个氨基酸修饰而不同于亲本蛋白的蛋白质。蛋白变体可以指蛋白质本身、包含蛋白质的组合物或编码蛋白质的氨基序列。优选地,蛋白变体与亲本蛋白相比具有至少一个氨基酸修饰,例如,与亲本相比约一个至约七十个氨基酸修饰并且优选地约一个至约五个氨基酸修饰。如下文所描述,在一些实施方案中,亲本多肽,例如Fc亲本多肽是人类野生型序列,诸如来自IgG1、IgG2、IgG3或IgG4的Fc区,不过具有变体的人类序列也可以充当“亲本多肽”,例如,如先前所公开的IgG1/2杂交体。蛋白变体序列在本文中将优选地与亲本蛋白序列具有至少约80%一致性,并且最优选地至少约90%一致性,更优选地至少约95-98-99%一致性。变体蛋白可以指变体蛋白本身、包含蛋白变体的组合物或编码变体蛋白的DNA序列。因此,如本文所用的“抗体变体”或“变体抗体”意味着由于至少一个氨基酸修饰而不同于亲本抗体的抗体,如本文所用的“IgG变体”或“变体IgG”意味着由于至少一个氨基酸修饰而不同于亲本IgG(再次,在许多情况下来自人类IgG序列)的抗体,并且如本文所用的“免疫球蛋白变体”或“变体免疫球蛋白”意味着由于至少一个氨基酸修饰而不同于亲本免疫球蛋白序列的免疫球蛋白序列。如本文所用的“Fc变体”或“变体Fc”意味着在Fc域中包含氨基酸修饰的蛋白质。本发明的Fc变体根据构成其的氨基酸修饰来定义。因此,举例来说,N434S或434S是相对于亲本Fc多肽在位置434处具有丝氨酸取代的Fc变体,其中编号是根据EU索引。同样地,M428L/N434S定义相对于亲本Fc多肽具有取代M428L和N434S的Fc变体。WT氨基酸的身份可能未指定,在这种情况下前述变体称作428L/434S。注意,提供取代的顺序是任意的,这就是说,例如,428L/434S是与M428L/N434S相同的Fc变体,等等。对于本发明中涉及抗体所论述的所有位置,除非另有注释,否则氨基酸位置编号是根据EU索引。EU索引或如Kabat或EU编号方案中的EU索引指的是EU抗体的编号(Edelman等,1969,《美国国家科学院院刊(Proc Natl Acad Sci USA)》63:78-85,借此以引用的方式全文并入)。修饰可以是添加、缺失或取代。取代可以包括天然存在的氨基酸并且在一些情况下是合成氨基酸。实例包括美国专利号6,586,207;WO 98/48032;WO 03/073238;US2004-0214988A1;WO 05/35727A2;WO 05/74524A2;J.W.Chin等,(2002),《美国化学会志(Journal of the American Chemical Society)》124:9026-9027;J.W.Chin和P.G.Schultz,(2002),《化学生物化学(ChemBioChem)》11:1135-1137;J.W.Chin等,(2002),《美国经皮冠状动脉内支架植入术(PICAS United States of America)》99:11020-11024;以及L.Wang和P.G.Schultz,(2002),《化学(Chem.)》1-10,全部以引用的方式全文并入。
如本文所用,“蛋白质”在本文中意味着至少两个共价附接的氨基酸,其包括蛋白质、多肽、寡肽以及肽。肽基可以包含天然存在的氨基酸和肽键,或合成拟肽结构,即“类似物”,诸如类肽(参看Simon等,《美国国家科学院院刊(PNAS USA)》89(20):9367(1992),以引用的方式全文并入)。如本领域的技术人员将了解,氨基酸可以是天然存在的或合成的(例如,不是由DNA编码的氨基酸)。举例来说,高苯丙氨酸、瓜氨酸、鸟氨酸以及正亮氨酸出于本发明的目的被视为合成氨基酸,并且可以利用D构型与L(R或S)构型的氨基酸。本发明的变体可以包含包括使用合成氨基酸的修饰,所述合成氨基酸是使用例如由Schultz和同事开发的技术而合并,这些技术包括(但不限于)由以下描述的方法:Cropp和Shultz,2004,《遗传学趋势(Trends Genet.)》20(12):625-30;Anderson等,2004,《美国国家科学院院刊(Proc Natl Acad Sci USA)》101(2):7566-71;Zhang等,2003,303(5656):371-3;以及Chin等,2003,《科学(Science)》301(5635):964-7,全部以引用的方式全文并入。另外,多肽可以包括一个或多个侧链或末端的合成衍生、糖基化、聚乙二醇化、循环排列、环化、与其它分子的连接子、与蛋白或蛋白域的融合,以及肽标签或标记的添加。
如本文所用的“残基”意味着蛋白质中的位置和其相关的氨基酸身份。举例来说,天冬酰胺297(也称作Asn297或N297)是在人类抗体IgG1中的位置297处的残基。
如本文所用的“Fab”或“Fab区”意味着包含VH、CH1、VL以及CL免疫球蛋白域的多肽。Fab可以指孤立的这个区,或在全长抗体、抗体片段或Fab融合蛋白的情形中的这个区。如本文所用的“Fv”或“Fv片段”或“Fv区”意味着包含单一抗体的VL和VH域的多肽。如本领域的技术人员将了解,这些一般由两个链组成。
如本文所用的“IgG子类修饰”或“同型修饰”意味着将一种IgG同型的一个氨基酸转化成不同的经过比对的IgG同型中的对应氨基酸的氨基酸修饰。举例来说,因为在EU位置296处IgG1包含酪氨酸并且IgG2包含苯丙氨酸,所以IgG2中的F296Y取代被视为IgG子类修饰。
如本文所用的“非天然存在的修饰”意味着不是同型的氨基酸修饰。举例来说,因为IgG中无一者在位置434处包含丝氨酸,所以IgG1、IgG2、IgG3或IgG4(或其杂交体)中的取代434S被视为非天然存在的修饰。
如本文所用的“氨基酸”和“氨基酸身份”意味着由DNA和RNA编码的20种天然存在的氨基酸之一。
如本文所用的“效应功能”意味着由抗体Fc区与Fc受体或配体的相互作用引起的生物化学事件。效应功能包括(但不限于)ADCC、ADCP以及CDC。
如本文所用的“IgG Fc配体”意味着来自任何生物体的结合至IgG抗体的Fc区以形成Fc/Fc配体复合物的分子,优选的是多肽。Fc配体包括(但不限于)FcγRI、FcγRII、FcγRIII、FcRn、C1q、C3、甘露聚糖结合凝集素、甘露糖受体、葡萄球菌蛋白A、链球菌蛋白G以及病毒FcγR。Fc配体还包括Fc受体同源物(FcRH),其为与FcγR同源的Fc受体的家族(Davis等,2002,《免疫学评论(Immunological Reviews)》190:123-136,以引用的方式全文并入)。Fc配体可以包括结合Fc的未发现的分子。特定的IgG Fc配体是FcRn和Fcγ受体。如本文所用的“Fc配体”意味着来自任何生物体的结合至抗体的Fc区以形成Fc/Fc配体复合物的分子,优选的是多肽。
如本文所用的“Fcγ受体”、“FcγR”或“FcgammaR”意味着结合IgG抗体Fc区并且由FcγR基因编码的蛋白质的家族的任何成员。在人类中,这个家族包括(但不限于)FcγRI(CD64),包括同种型FcγRIa、FcγRIb以及FcγRIc;FcγRII(CD32),包括同种型FcγRIIa(包括同种异型H131和R131)、FcγRIIb(包括FcγRIIb-1和FcγRIIb-2)以及FcγRIIc;以及FcγRIII(CD16),包括同种型FcγRIIIa(包括同种异型V158和F158)和FcγRIIIb(包括同种异型FcγRIIb-NA1和FcγRIIb-NA2)(Jefferis等,2002,《免疫学快报(Immunol Lett)》82:57-65,以引用的方式全文并入),以及任何未发现的人类FcγR或FcγR同种型或同种异型。FcγR可以来自任何生物体,包括(但不限于)人类、小鼠、大鼠、兔以及猴。小鼠FcγR包括(但不限于)FcγRI(CD64)、FcγRII(CD32)、FcγRIII(CD16)和FcγRIII-2(CD16-2),以及任何未发现的小鼠FcγR或FcγR同种型或同种异型。
如本文所用的“FcRn”或“新生儿Fc受体”意味着结合IgG抗体Fc区并且至少部分由FcRn基因编码的蛋白质。FcRn可以来自任何生物体,包括(但不限于)人类、小鼠、大鼠、兔以及猴。如本领域中已知,功能性FcRn蛋白质包含两个多肽,常称作重链和轻链。轻链是β-2-微球蛋白并且重链由FcRn基因编码。除非本文另有注释,否则FcRn或FcRn蛋白质指的是FcRn重链与β-2-微球蛋白的复合物。多种FcRn变体用于增加结合至FcRn受体,并且在一些情况下用于增加如本文所概述的血清半衰期,诸如428L/434S。
如本文所用的“亲本多肽”意味着随后经过修饰以产生变体的起始多肽。亲本多肽可以是天然存在的多肽,或天然存在的多肽的变体或工程改造的型式。亲本多肽可以指多肽本身、包含亲本多肽的组合物或编码亲本多肽的氨基酸序列。因此,如本文所用的“亲本免疫球蛋白”意味着经过修饰以产生变体的未修饰的免疫球蛋白多肽,并且如本文所用的“亲本抗体”意味着经过修饰以产生变体抗体的未修饰的抗体。应注意,“亲本抗体”包括如下文所概述的已知的商业上重组产生的抗体。
如本文所用的“Fc”或“Fc区”或“Fc域”意味着包含排除第一恒定区免疫球蛋白域的抗体的恒定区并且在一些情况下包含铰链的一部分的多肽。因此,Fc指的是IgA、IgD和IgG的最后两个恒定区免疫球蛋白域,IgE和IgM的最后三个恒定区免疫球蛋白域,以及在这些域的N端的柔性铰链。对于IgA和IgM,Fc可以包括J链。对于IgG,Fc域包含免疫球蛋白域Cγ2和Cγ3(Cγ2和Cγ3)以及在Cγ1(Cγ1)与Cγ2(Cγ2)之间的更低铰链区。尽管Fc区的边界可以变化,但人类IgG重链Fc区通常定义为包括在其羧基端的残基C226或P230,其中编号是根据如Kabat中的EU索引。在一些实施方案中,如下文更全面描述,对Fc区进行氨基酸修饰,例如,以改变与一个或多个FcγR受体或与FcRn受体的结合。
“重恒定区”在本文中意味着抗体的CH1-铰链-CH2-CH3部分。
“Fc融合蛋白”或“免疫粘附素”在本文中意味着包含Fc区的蛋白质,所述Fc区一般(任选地经由连接子部分,如本文所描述)连接至不同蛋白质,诸如与靶蛋白的结合部分,如本文所描述。在一些情况下,异二聚抗体的一个单体包含抗体重链(包括scFv或进一步包括轻链)并且另一个单体是包含变体Fc域和配体的Fc融合。在一些实施方案中,这些“半抗体-半融合蛋白”称作“融合体”。
如本文所用的“位置”意味着在蛋白质的序列中的定位。位置可以依序编号,或根据确立的格局,例如用于抗体编号的EU索引来编号。
如本文所用的“靶抗原”意味着由给定的抗体的可变区特异性地结合的分子。靶抗原可以是蛋白质、碳水化合物、脂质或其它化学化合物。下文描述了许多适合的靶抗原。
在本发明的异二聚抗体的单体的情形中的“成股性”在本文中意味着类似于“匹配”的两股DNA,异二聚变体合并至每个单体中以保留“匹配”形成异二聚体的能力。举例来说,如果一些pI变体工程改造成单体A(例如,使得pI更高),那么作为同样可以利用的“电荷对”的空间变体并不干扰pI变体,例如,使得pI更高的电荷变体置于同一“股”或“单体”上以保留两种功能性。类似地,对于进入如下文更全面概述的组对中的“偏移”变体,技术人员在决定一组对将合并至哪一股或单体中将考虑pI,以使得同样使用偏移的pI使pI间隔最大化。
如本文所用的“靶细胞”意味着表达靶抗原的细胞。
如本文所用的“可变区”意味着包含实质上由分别构成κ、λ以及重链免疫球蛋白遗传基因座的V.κ.、V.λ.和/或VH基因中的任一者编码的一个或多个Ig域的免疫球蛋白区。
“野生型或WT”在本文中意味着在自然界中发现的氨基酸序列或核苷酸序列,包括等位基因变异。WT蛋白质具有尚未有目的地修饰的氨基酸序列或核苷酸序列。
本发明的抗体一般是分离的或重组的。“分离”当用于描述本文所公开的各种多肽时,意味着已经从表达其的细胞或细胞培养物鉴别和分离和/或回收的多肽。通常,分离的多肽将通过至少一个纯化步骤制备。“分离的抗体”指的是实质上不含具有不同抗原特异性的其它抗体的抗体。“重组”意味着抗体在外源宿主细胞中使用重组核酸技术产生。
“特异性结合”或“特异性地结合至”或“特异性针对”特定抗原或表位意味着在可测量的程度上不同于非特异性相互作用的结合。特异性结合可以例如通过与对照分子的结合相比确定分子的结合来测量,所述对照分子一般是不具有结合活性的类似结构的分子。举例来说,特异性结合可以通过与类似于标靶的对照分子竞争来确定。
对特定抗原或表位的特异性结合可以例如由对抗原或表位的KD为至少约10-4M、至少约10-5M、至少约10-6M、至少约10-7M、至少约10-8M、至少约10-9M、或者至少约10-10M、至少约10-11M、至少约10-12M或更大的抗体展现,其中KD指的是特定抗体-抗原相互作用的离解速率。通常,特异性地结合抗原的抗体将具有对于对照分子相对于抗原或表位大20、50、100、500、1000、5,000、10,000倍或更多倍的KD。
又,对特定抗原或表位的特异性结合可以例如由对于抗原或表位的KA或Ka对于表位相对于对照大至少20、50、100、500、1000、5,000、10,000倍或更多倍的抗体展现,其中KA或Ka指的是特定抗体-抗原相互作用的缔合速率。
II.综述
已经设计了共啮合CD3和肿瘤抗原标靶的双特异性抗体并且用于重导向T细胞以攻击并裂解靶向的肿瘤细胞。实例包括BiTE和DART格局,其单价啮合CD3和肿瘤抗原。虽然CD3靶向方法已经显示出相当大的前景,但这类疗法的常见副作用是细胞因子的相关产生,常常导致毒性细胞因子释放综合症。因为双特异性抗体的抗CD3结合域啮合所有T细胞,所以产生高细胞因子的CD4T细胞子组被募集。此外,CD4T细胞子组包括调控性T细胞,其募集和扩充可以潜在地导致免疫抑制并且对长期肿瘤抑制具有负面影响。另外,这些格局不含有Fc域并且在患者中显示出极短的血清半衰期。
虽然CD3靶向方法已经显示出相当大的前景,但这类疗法的常见副作用是细胞因子的相关产生,常常导致毒性细胞因子释放综合症。因为双特异性抗体的抗CD3结合域啮合所有T细胞,所以产生高细胞因子的CD4T细胞子组被募集。此外,CD4T细胞子组包括调控性T细胞,其募集和扩充可以潜在地导致免疫抑制并且对长期肿瘤抑制具有负面影响。减少细胞因子产生并且可能减少CD4T细胞的活化的一种这样的可能方式是通过降低抗CD3域对CD3的亲和力。
因此,在一些实施方案中,本发明提供了抗体构建体,其包含抗CD3抗原结合域与结合前列腺特异性膜抗原(PSMA)的抗原结合域的组合。
此外,在一些实施方案中,抗CD3抗原结合域是对CD3的“强”或“高亲和力”结合子(例如,一个实例是以H1.30_L1.47(任选地在适当时包括带电荷连接子)描绘的重和轻可变域)并且还结合至PSMA。在其它实施方案中,本发明提供了包含抗CD3抗原结合域的抗体构建体,所述抗CD3抗原结合域是对CD3的“弱”或“更低亲和力”结合子。额外的实施方案提供了包含抗CD3抗原结合域的抗体构建体,所述抗CD3抗原结合域对CD3具有中度或“中等”亲和力并且还结合至PSMA。亲和力一般使用Biacore试验测量。
应了解,本发明的“高、中、低”抗CD3序列可以用于多种异二聚格局中。虽然本文中的大部分公开内容使用异二聚体的“开瓶器”格局,但这些可变重和轻序列以及scFv序列(和包含这些可变重和轻序列的Fab序列)可以用于其它格局中,诸如WO公布号2014/145806的图2中所描绘的那些,这个公布的图式、格局以及图例以引用的方式明确并入本文中。
因此,本发明提供了结合至两种不同抗原的异二聚抗体,例如,抗体是“双特异性的”,这是在于其结合两种不同的靶抗原,例如,本发明中的CD3和PSMA。这些异二聚抗体可以单价(例如,存在单一抗原结合域,诸如可变重和可变轻域对)或二价(存在各自独立地结合抗原的两个抗原结合域)结合这些靶抗原。本发明的异二聚抗体是基于使用含有超越同二聚体向异二聚体的形成“偏移”的氨基酸取代的不同单体,如下文更全面概述,这与“pI变体”相结合,允许远离同二聚体简单纯化异二聚体,如下文类似地概述。对于本发明的异二聚双特异性抗体,本发明一般依赖于使用可以在生产细胞中自组装以产生异二聚蛋白的工程改造的或变体Fc域,以及产生和纯化这类异二聚蛋白的方法。
III.抗体
本发明涉及结合CD3和PSMA的双特异性抗体,一般是治疗性抗体的产生。如下文所论述,一般使用术语“抗体”。应用于本发明中的抗体可以呈现如本文所描述的许多格局,包括本文所描述的传统抗体以及抗体衍生物、片段和模拟物。
传统抗体结构单元通常包含四聚体。每个四聚体通常由多肽链的两个相同对组成,每对具有一个“轻”链(通常具有约25kDa的分子量)和一个“重”链(通常具有约50-70kDa的分子量)。人类轻链归类为κ和λ轻链。本发明是针对IgG种类,其具有若干子类,包括(但不限于)IgG1、IgG2、IgG3以及IgG4。应注意,IgG1具有不同的同种异型,其在356(D或E)和358(L或M)处具有多态性。本文所描绘的序列使用356D/358M同种异型,然而,本文中包括其它同种异型。也就是说,将本文所包括的IgG1Fc域包括在内的任何序列可以具有置换356D/358M同种异型的356E/358L。
另外,本文中的许多序列具有在位置220处由丝氨酸置换的至少一个半胱氨酸;一般来说,这对于本文所描绘的大多数序列在“scFv单体”侧上,不过其也可以在“Fab单体”侧上,或两者上,以减少二硫键形成。在本文中的序列内特定地包括这些置换的半胱氨酸(C220S)中的一者或两者。
因此,如本文所用的“同型”意味着由免疫球蛋白的恒定区的化学和抗原特征定义的免疫球蛋白的子类中的任一者。应了解,治疗性抗体还可以包含同型和/或子类的杂交体。举例来说,如以引用的方式并入的美国公布2009/0163699中所示,本发明涵盖IgG1/G2杂交体的pI工程改造。
每个链的氨基端部分包括约100至110个或更多个主要负责抗原识别的氨基酸的可变区,在本领域中和本文中一般称作“Fv域”或“Fv区”。在可变区中,对于重链和轻链的V域中的每一者集合成三个环以形成抗原结合位点。环中的每一者称作互补决定区(下文称作“CDR”),其中氨基酸序列中的变异是最显著的。“可变”指的是可变区的某些区段在抗体之间在序列中广泛不同的事实。可变区内的可变性并不均匀分布。替代地,V区由15-30个氨基酸的相对不变的伸长段,称为构架区(FR)组成,所述构架区由各9-15个氨基酸长或更长的极端可变性的更短区,称为“高变区”隔开。
每个VH和VL由三个高变区(“互补决定区”、“CDR”)和四个FR组成,从氨基端至羧基端按以下顺序排列:FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4。
高变区一般包涵来自以下的氨基酸残基:轻链可变区中的氨基酸残基约24-34(LCDR1;“L”表示轻链)、50-56(LCDR2)和89-97(LCDR3)以及重链可变区中的约31-35B(HCDR1;“H”表示重链)、50-65(HCDR2)和95-102(HCDR3);Kabat等,《免疫学关注的蛋白质序列(SEQUENCES OF PROTEINS OF IMMUNOLOGICAL INTEREST)》,第5版,Public Health Service,National Institutes of Health,Bethesda,Md.(1991);和/或形成高变环的那些残基(例如,轻链可变区中的残基26-32(LCDR1)、50-52(LCDR2)和91-96(LCDR3)以及重链可变区中的26-32(HCDR1)、53-55(HCDR2)和96-101(HCDR3));Chothia和Lesk(1987)《分子生物学杂志(J.Mol.Biol.)》196:901-917。下文描述了本发明的特定CDR。
如本领域的技术人员将了解,CDR的准确编号和安置在不同编号系统之间可以是不同的。然而,应了解,可变重和/或可变轻序列的公开内容包括相关CDR的公开内容。因此,每个可变重区的公开内容是vhCDR(例如,vhCDR1、vhCDR2以及vhCDR3)的公开内容并且每个可变轻区的公开内容是vlCDR(例如,vlCDR1、vlCDR2以及vlCDR3)的公开内容。
在本说明书通篇,当涉及可变域中的残基(大约是轻链可变区的残基1-107和重链可变区的残基1-113)时一般使用Kabat编号系统并且EU编号系统用于Fc区(例如,Kabat等,同上(1991))。
本发明提供了许多不同的CDR组。在这种情况下,“全CDR组”包含三个可变轻和三个可变重CDR,例如,vlCDR1、vlCDR2、vlCDR3、vhCDR1、vhCDR2以及vhCDR3。这些可以分别是更大的可变轻或可变重域的一部分。另外,如本文更全面概述,当使用重和轻链时(例如,当使用Fab时)可变重和可变轻域可以在独立的多肽链上,或在scFv序列的情况下在单一多肽链上。
CDR有助于抗体的抗原结合或更具体地表位结合位点的形成。“表位”指的是与抗体分子的可变区中的特异性抗原结合位点,称为互补位相互作用的决定子。表位是诸如氨基酸或糖侧链的分子的群组并且通常具有特定结构特征,以及特定电荷特征。单一抗原可以具有多于一个表位。
表位可以包含结合中直接涉及的氨基酸残基(也称为表位的免疫显性组分)和结合中不直接涉及的其它氨基酸残基,诸如由特异性抗原结合肽有效阻断的氨基酸残基;换句话说,氨基酸残基在特异性抗原结合肽的足迹内。
表位可以是构象的或线性的。构象表位由来自线性多肽链的不同区段的立体并置的氨基酸产生。线性表位是由多肽链中的相邻氨基酸残基产生的表位。构象和非构象表位的区别之处可以在于在变性溶剂存在下与前者而非后者的结合损失。
表位通常包括呈独特立体构象的至少3个并且更通常至少5个或8-10个氨基酸。识别相同表位的抗体可以在简单的免疫试验中验证,这个免疫试验显示了一种抗体阻断另一种抗体与靶抗原的结合的能力,例如“框并(binning)”。
每个链的羧基端部分界定主要负责效应功能的恒定区。Kabat等收集重链和轻链的可变区的众多一级序列。基于序列的保守程度,Kabat等将个别的一级序列归类为CDR和构架并且制作其清单(参看《免疫学关注的序列(SEQUENCES OF IMMUNOLOGICAL INTEREST)》,第5版,NIH出版,编号91-3242,E.A.Kabat等,以引用的方式全文并入)。
在免疫球蛋白的IgG子类中,重链中存在若干免疫球蛋白域。“免疫球蛋白(Ig)域”在本文中意味着具有截然不同的三级结构的免疫球蛋白区。本发明中关注的是重链域,包括恒定重(CH)域和铰链域。在IgG抗体的情形中,IgG同型各自具有三个CH区。因此,在IgG的情形中“CH”域如下:“CH1”指的是根据如Kabat中的EU索引的位置118-220。“CH2”指的是根据如Kabat中的EU索引的位置237-340,并且“CH3”指的是根据如Kabat中的EU索引的位置341-447。如本文所示和下文所描述,pI变体可以在CH区中的一者或多者以及下文所论述的铰链区中。
应注意,本文所描绘的序列在CH1区的位置118处开始;除非有注释,否则不包括可变区。举例来说,SEQ ID NO:2的第一氨基酸当在序列清单中指定为位置“1”时,对应于根据EU编号的CH1区的位置118。
重链的Ig域的另一种类型是铰链区。“铰链”或“铰链区”或“抗体铰链区”或“免疫球蛋白铰链区”在本文中意味着包含在抗体的第一与第二恒定域之间的氨基酸的柔性多肽。结构上,IgG CH1域在EU位置220处结束,并且IgG CH2域在残基EU位置237处开始。因此,对于IgG,抗体铰链在本文中定义为包括位置221(IgG1中的D221)至236(IgG1中的G236),其中编号是根据如Kabat中的EU索引。在一些实施方案中,例如在Fc区的情形中,包括更低铰链,其中“更低铰链”一般指的是位置226或230。如本文所注释,pI变体同样可以在铰链区中制造。
轻链一般包含两个域,可变轻域(含有轻链CDR并且连同形成Fv区的可变重域一起)和恒定轻链区(常称作CL或Cκ)。
下文所概述的对于额外取代所关注的另一个区是Fc区。
因此,本发明提供了不同抗体域。如本文所描述和本领域中已知,本发明的异二聚抗体包含在重和轻链内的不同域,其同样可以重叠。这些域包括(但不限于)Fc域、CH1域、CH2域、CH3域、铰链域、重恒定域(CH1-铰链-Fc域或CH1-铰链-CH2-CH3)、可变重域、可变轻域、轻恒定域、FAb域以及scFv域。
因此,“Fc域”包括-CH2-CH3域,和任选地铰链域。在本文的实施方案中,当scFv附接至Fc域时,scFv构建体的C端附接至Fc域的铰链;例如,其一般附接至作为铰链的起点的序列EPKS。重链包含可变重域和恒定域,其包括CH1-任选的铰链-包含CH2-CH3的Fc域。轻链包含可变轻链和轻恒定域。scFv包含可变重链、scFv连接子以及可变轻域。在本文所概述的大多数构建体和序列中,可变轻链的C端附接至scFv连接子的N端,其C端附接至可变重链的N端(N-vh-连接子-vl-C),不过这可以转换(N-vl-连接子-vh-C)。
本发明的一些实施方案包含至少一个scFv域,其虽然不是天然存在的,但一般包括由scFv连接子连接在一起的可变重域和可变轻域。如本文所示,存在通过重组技术产生的可以使用的许多适合的scFv连接子,包括传统的肽键。
连接子肽可以主要包括以下氨基酸残基:Gly、Ser、Ala或Thr。连接子肽应具有足以按如下方式连接两个分子的长度:这两个分子相对于彼此呈现正确构象以使得其保持所需活性。在一个实施方案中,连接子为约1至50个氨基酸长度,优选地约1至30个氨基酸长度。在一个实施方案中,可以使用1至20个氨基酸长度的连接子,其中约5至约10个氨基酸应用于一些实施方案中。适用的连接子包括甘氨酸-丝氨酸聚合物,包括例如(GS)n、(GSGGS)n、(GGGGS)n以及(GGGS)n,其中n是至少1的整数(并且一般是3至4);甘氨酸-丙氨酸聚合物;丙氨酸-丝氨酸聚合物;以及其它柔性连接子。或者,多种非蛋白质聚合物,包括(但不限于)聚乙二醇(PEG)、聚丙二醇、聚氧化烯、或聚乙二醇和聚丙二醇的共聚物可以用作连接子,这可以用作连接子。
其它连接子序列可以包括任何长度的CL/CH1域的任何序列但并非CL/CH1域的所有残基;例如,CL/CH1域的开头5-12个氨基酸残基。连接子可以来源于免疫球蛋白轻链,例如,Cκ或Cλ。连接子可以来源于任何同型的免疫球蛋白重链,包括例如Cγ1、Cγ2、Cγ3、Cγ4、Cα1、Cα2、Cδ、Cε以及Cμ。连接子序列也可以来源于其它蛋白质,诸如Ig样蛋白质(例如,TCR、FcR、KIR),源自铰链区的序列,以及来自其它蛋白质的其它天然序列。
在一些实施方案中,连接子是用于将如本文所概述的任何两个域连接在一起的“域连接子”。虽然可以使用任何适合的连接子,但许多实施方案利用甘氨酸-丝氨酸聚合物,包括例如(GS)n、(GSGGS)n、(GGGGS)n以及(GGGS)n,其中n是至少1的整数(并且一般是3至4至5),以及允许具有足够长度和柔性的两个域重组附接以允许每个域保持其生物功能的任何肽序列。在一些情况下并且注意到“成股性”,如下文所概述,可以使用如scFv连接子的一些实施方案中所用的带电荷域连接子。
在一些实施方案中,scFv连接子是带电荷scFv连接子,其中一些示于图14中。因此,本发明进一步提供了带电荷scFv连接子,以有助于第一与第二单体之间pI的分离。也就是说,通过合并正性或负性(或两者,在不同单体上使用scFv的支架的情况下)的带电荷scFv连接子,这允许包含带电荷连接子的单体改变pI而不会在Fc域中作出进一步的变化。这些带电荷连接子可以取代至含有标准连接子的任何scFv中。再次,如本领域的技术人员将了解,根据pI的所需变化,带电荷scFv连接子在正确的“股”或单体上使用。举例来说,如本文所论述,为了制造三重F格局异二聚抗体,计算所需抗原结合域中的每一者的Fv区的原始pI,并且选择一者以制造scFv,并且取决于pI,选择正性或负性连接子。
带电荷域连接子同样也可以用于增加本发明的单体的pI间隔,并且因此图14中所包括的那些可以用于本文中利用连接子的任何实施方案中。
在一些实施方案中,抗体是全长的。“全长抗体”在本文中意味着构成天然生物形式的抗体的结构,包括可变和恒定区,其包括如本文所概述的一个或多个修饰,特别是在Fc域中以允许异二聚形成或异二聚体远离同二聚体的纯化。全长抗体一般包括Fab和Fc域,并且另外可以含有外加抗原结合域,诸如scFv,如图1中一般描绘。
在一个实施方案中,抗体是抗体片段,只要其含有可以经过工程改造,诸如pI工程改造以产生异二聚体的至少一个恒定域即可。可以使用的其它抗体片段包括含有已经pI工程改造的本发明的CH1、CH2、CH3、铰链以及CL域中的一者或多者的片段。举例来说,Fc融合是Fc区(CH2和CH3,任选地具有铰链区)融合至另一种蛋白质的融合。许多Fc融合在本领域中是已知的并且可以通过添加本发明的异二聚变体而改善。在本发明的情况下,利用本文所描述的异二聚变体的任何组合,可以制造包含以下的抗体融合:CH1;CH1、CH2和CH3;CH2;CH3;CH2和CH3;CH1和CH3,可以制造任选地具有铰链区的其中任一者或所有。
特别地,图1中所描绘的格局是抗体,通常称作“异二聚抗体”,意味着蛋白质具有自组装成异二聚Fc域的至少两个相关Fc序列。
嵌合和人类化抗体
在一些实施方案中,抗体可以是来自不同物种的混合物,例如,嵌合抗体和/或人类化抗体。一般来说,“嵌合抗体”与“人类化抗体”指的是组合来自多于一个物种的区的抗体。举例来说,“嵌合抗体”传统上包含来自小鼠(或大鼠,在一些情况下)的可变区和来自人类的恒定区。“人类化抗体”一般指的是已经具有交换在人类抗体中发现的序列的可变域构架区的非人类抗体。一般来说,在人类化抗体中,除CDR以外的整个抗体由人类来源的多核苷酸编码或除在其CDR内以外与这样的抗体相同。一些或全部由来源于非人类生物体的核酸编码的CDR移植至人类抗体可变区的β-片构架中以创造抗体,其特异性由植入的CDR决定。这类抗体的创造描述于例如WO 92/11018;Jones,1986,《自然(Nature)》321:522-525;Verhoeyen等,1988,《科学(Science)》239:1534-1536中,全部以引用的方式全文并入。常常需要所选的接受体构架残基至对应的供体残基的“回复突变”以重获在初始移植的构建体中损失的亲和力(US 5530101;US 5585089;US 5693761;US 5693762;US 6180370;US 5859205;US 5821337;US 6054297;US 6407213,全部以引用的方式全文并入)。人类化抗体最佳还将包含免疫球蛋白恒定区(通常是人类免疫球蛋白)的至少一部分,并且因此通常将包含人类Fc区。人类化抗体还可以使用具有遗传工程改造的免疫系统的小鼠产生。Roque等,2004,《生物技术进展(Biotechnol.Prog.)》20:639-654,以引用的方式全文并入。用于人类化和重塑非人类抗体的多种技术和方法在本领域中是众所周知的(参看Tsurushita和Vasquez,2004,单克隆抗体的人类化(Humanization of Monoclonal Antibodies),《B细胞分子生物学(Molecular Biology of B Cells)》,533-545,Elsevier Science(USA)和其中所引用的参考文献,全部以引用的方式全文并入)。人类化方法包括(但不限于)以下所描述的方法:Jones等,1986,《自然(Nature)》321:522-525;Riechmann等,1988;《自然(Nature)》332:323-329;Verhoeyen等,1988,《科学(Science)》,239:1534-1536;Queen等,1989,《美国国家科学院院刊(Proc Natl Acad Sci,USA)》86:10029-33;He等,1998,《免疫学杂志(J.Immunol.)》160:1029-1035;Carter等,1992,《美国国家科学院院刊(Proc Natl Acad Sci USA)》89:4285-9;Presta等,1997,《癌症研究(Cancer Res.)》57(20):4593-9;Gorman等,1991,《美国国家科学院院刊(Proc.Natl.Acad.Sci.USA)》88:4181-4185;O'Connor等,1998,《蛋白质工程(Protein Eng)》11:321-8,全部以引用的方式全文并入。降低非人类抗体可变区的免疫原性的人类化或其它方法可以包括表面重整方法,如例如Roguska等,1994,《美国国家科学院院刊(Proc.Natl.Acad.Sci.USA)》91:969-973中所描述,以引用的方式全文并入。
在某些实施方案中,本发明的抗体包含来自特定种系重链免疫球蛋白基因的重链可变区和/或来自特定种系轻链免疫球蛋白基因的轻链可变区。举例来说,这类抗体可以包含包含以下或由以下组成:包含作为特定种系序列的“产物”或“来源于”特定种系序列的重或轻链可变区的人类抗体。作为人类种系免疫球蛋白序列的“产物”或“来源于”人类种系免疫球蛋白序列的人类抗体可以通过比较人类抗体的氨基酸序列与人类种系免疫球蛋白的氨基酸序列并且选择序列中与人类抗体的序列最接近(即,最大%一致性)的人类种系免疫球蛋白序列来如此鉴别。作为特定人类种系免疫球蛋白序列的“产物”或“来源于”特定人类种系免疫球蛋白序列的人类抗体与种系序列相比可以含有氨基酸差异,这归因于例如天然存在的体细胞突变或有目的地引入定点突变。然而,人类化抗体通常在氨基酸序列方面与由人类种系免疫球蛋白基因编码的氨基酸序列至少90%一致并且含有当与其它物种的种系免疫球蛋白氨基酸序列(例如,鼠类种系序列)相比时将抗体鉴别为来源于人类序列的氨基酸残基。在某些情况下,人类化抗体可以在氨基酸序列方面与由种系免疫球蛋白基因编码的氨基酸序列至少95%、96%、97%、98%或99%或甚至至少96%、97%、98%或99%一致。通常,来源于特定人类种系序列的人类化抗体将与由人类种系免疫球蛋白基因编码的氨基酸序列展现不多于10-20个氨基酸差异(在引入本文中的任何偏移、pI以及消融变体之前;也就是说,在引入本发明的变体之前变体的数目一般很低)。在某些情况下,人类化抗体可以与由种系免疫球蛋白基因编码的氨基酸序列展现不多于5个或甚至不多于4个、3个、2个或1个氨基酸差异(再次,在引入本文中的任何偏移、pI以及消融变体之前;也就是说,在引入本发明的变体之前变体的数目一般很低)。
在一个实施方案中,如本领域中已知,亲本抗体已经亲和力成熟。可以采用基于结构的方法用于人类化和亲和力成熟,例如,如USSN 11/004,590中所描述。可以采用基于选择的方法以使抗体可变区人类化和/或亲和力成熟,包括(但不限于)Wu等,1999,《分子生物学杂志(J.Mol.Biol.)》294:151-162;Baca等,1997,《生物化学杂志(J.Biol.Chem.)》272(16):10678-10684;Rosok等,1996,《生物化学杂志(J.Biol.Chem.)》271(37):22611-22618;Rader等,1998,《美国国家科学院院刊(Proc.Natl.Acad.Sci.USA)》95:8910-8915;Krauss等,2003,《蛋白质工程(Protein Engineering)》16(10):753-759中所描述的方法,全部以引用的方式全文并入。其它人类化方法可以涉及仅部分CDR的移植,包括(但不限于)USSN 09/810,510;Tan等,2002,《免疫学杂志(J.Immunol.)》169:1119-1125;De Pascalis等,2002,《免疫学杂志(J.Immunol.)》169:3076-3084中所描述的方法,全部以引用的方式全文并入。
IV.异二聚抗体
因此,在一些实施方案中,本发明提供了依赖于使用将自组装形成异二聚抗体的两个不同的重链变体Fc域的异二聚抗体。
本发明是针对新颖的构建体以提供允许结合至多于一种抗原或配体,例如以允许双特异性结合的异二聚抗体。异二聚抗体构建体是基于抗体的重链的两个Fc域的自组装性质,例如,组装成“二聚体”的两个“单体”。如下文更全面论述,异二聚抗体通过改变每个单体的氨基酸序列而制成。因此,本发明一般针对创造可以按若干方式共啮合抗原的异二聚抗体,这依赖于在每个链上不同的恒定区中的氨基酸变体以促进异二聚体形成和/或允许超越同二聚体易于纯化异二聚体。
因此,本发明提供了双特异性抗体。抗体技术中持续存在的问题是需要同时结合至两种不同抗原的“双特异性”抗体,一般来说由此允许接近不同抗原并且得到新的功能性和新的疗法。一般来说,这些抗体通过将每个重和轻链的基因包括于宿主细胞中而制成。这一般使得所需异二聚体(A-B)以及两种同二聚体(A-A和B-B(不包括轻链异二聚问题))形成。然而,双特异性抗体形成中的主要障碍是远离同二聚抗体纯化异二聚抗体和/或超越同二聚体的形成偏向异二聚体的形成中的困难。
存在许多可以用于产生本发明的异二聚体的机制。另外,如本领域的技术人员将了解,可以组合这些机制以确保高度异二聚。因此,使得异二聚体产生的氨基酸变体称作“异二聚变体”。如下文所论述,异二聚变体可以包括空间变体(例如,下文所描述的“杵臼”或“偏移”变体和下文所描述的“电荷对”变体)以及“pI变体”,这允许远离异二聚体纯化同二聚体。如借此以全文引用的方式并入的WO2014/145806中一般描述并且具体地如下文关于“异二聚变体”的论述,异二聚的适用机制包括“杵臼”(“KIH”;本文中有时称为“偏移”变体(参看WO2014/145806中的论述)、如WO2014/145806中所描述的“静电转向”或“电荷对”、如WO2014/145806中所描述的pI变体,以及如WO2014/145806中和下文所概述的一般的额外Fc变体。
在本发明中,存在可以使得易于纯化异二聚抗体的若干基本机制;一种机制依赖于使用pI变体,以使得每个单体具有不同pI,由此允许等电纯化A-A、A-B以及B-B二聚蛋白。或者,一些支架格局,诸如“三重F”格局也允许在尺寸的基础上分离。如下文进一步概述,还可能超越同二聚体向异二聚体的形成“偏移”。因此,空间异二聚变体和pI或电荷对变体的组合特别应用于本发明中。
一般来说,在本发明中特别使用的实施方案依赖于包括偏移变体的变体组,其促进异二聚形成超越同二聚形成,这与pI变体相结合,增加两个单体之间的pI差异。
另外,如下文更全面概述,取决于异二聚体抗体的格局,pI变体可以含于单体的恒定和/或Fc域内,或可以使用带电荷连接子、域连接子或scFv连接子。也就是说,利用scFv,诸如三重F格局的支架可以包括带电荷scFv连接子(正性或负性),这使得pI进一步提高用于纯化的目的。如本领域的技术人员将了解,一些三重F格局只适用于带电荷scFv连接子并且没有额外的pI调整,不过本发明同样提供在一个或两个单体上的pI变体,和/或带电荷域连接子。另外,用于替代的功能性的额外氨基酸工程改造也可以赋予pI变化,诸如Fc、FcRn以及KO变体。
在利用pI作为分离机制以允许纯化异二聚蛋白的本发明中,可以将氨基酸变体引入单体多肽中的一者或两者中;也就是说,单体中的一者(在本文中简称作“单体A”)的pI可以经过工程改造以远离单体B,或可以改变单体A与B,其中单体A的pI增大并且单体B的pI减小。如下文更全面概述,任一个或两个单体的pI变化可以通过以下实现:去除或添加带电荷残基(例如,中性氨基酸由带正电荷或带负电荷氨基酸残基置换,例如甘氨酸置换成谷氨酸),将带电荷残基从正性或负性变成相反电荷(天冬氨酸变成赖氨酸)或将带电荷残基变成中性残基(例如,电荷损失;赖氨酸变成丝氨酸)。许多这些变体示于图中。
因此,本发明的这个实施方案提供了在单体中的至少一者中创造足够大的pI变化以使得异二聚体可以与同二聚体分离。如本领域的技术人员将了解并且如下文进一步论述,这可以通过使用“野生型”重链恒定区和已经工程改造以增大或减小其pI的变体区(wt A-+B或wt A--B),或通过增大一个区并且减小另一个区(A+-B-或A-B+)来完成。
因此,一般来说,本发明的一些实施方案的组分是抗体的恒定区中的氨基酸变体,这是针对通过将氨基酸取代(“pI变体”或“pI取代”)合并至单体中的一者或两者中来改变二聚蛋白的单体中的至少一者(若非两者)的等电点(pI)以形成“pI抗体”。如本文所示,如果两个单体的pI差异小至0.1pH单位,那么可以实现异二聚体与两种同二聚体的分离,其中0.2、0.3、0.4以及0.5或更大全部应用于本发明中。
如本领域的技术人员将了解,将包括于每个或两个单体上以获得良好分离的pI变体的数目将部分取决于组分的起始pI,例如在三重F格局中,所关注的scFv和Fab的起始pI。也就是说,为了确定哪个单体进行工程改造或在哪个“方向”上(例如,更具正性或更具负性),计算两个靶抗原的Fv序列并且由其作出决定。如本领域中已知,不同Fv将具有在本发明中利用的不同起始pI。一般来说,如本文所概述,pI经过工程改造以得到至少约0.1log的每个单体的总pI差异,其中0.2至0.5如本文所概述是优选的。
此外,如本领域的技术人员将了解和本文所概述,在一些实施方案中,异二聚体可以在尺寸的基础上与同二聚体分离。如图1中所示,例如,若干格局允许在尺寸的基础上分离异二聚体和同二聚体。
在pI变体用于达成异二聚的情况下,通过使用重链的恒定区,提供了用以设计和纯化双特异性蛋白(包括抗体)的更模块化方法。因此,在一些实施方案中,异二聚变体(包括偏移和纯化异二聚变体)不包括于可变区中,以使得每个个别的抗体必须经过工程改造。另外,在一些实施方案中,通过输入来自不同IgG同型的pI变体以使得在不引入显著免疫原性的情况下改变pI来显著降低由pI变体产生的免疫原性的可能性。因此,有待解决的额外问题是阐明具有高人类序列含量的低pI恒定域,例如,最小化或避免在任何特定位置处的非人类残基。
可以与这种pI工程改造一起出现的附带效益还是血清半衰期的延长和增加的FcRn结合。也就是说,如USSN 13/194,904(以全文引用的方式并入)中所描述,降低抗体恒定域(包括抗体和Fc融合中发现的那些)的pI可以引起体内更长的血清保留。对于增加的血清半衰期的这些pI变体也促进pI变化用于纯化。
另外,应注意,异二聚变体的pI变体得到用于双特异性抗体的分析和质量控制过程的额外效益,这是因为当同二聚体存在时用以消除、最小化和区分的能力是显著的。类似地,用以可靠地测试异二聚抗体产生的再现性的能力是重要的。
异二聚变体
本发明提供了异二聚蛋白,包括呈多种格局的异二聚抗体,其利用异二聚变体以允许异二聚形成和/或纯化远离同二聚体。
存在异二聚偏移变体的许多适合的组对。这些变体进入“组”的“对”中。也就是说,一个组对合并至第一单体中并且另一个组对合并至第二单体中。应注意,这些组不一定表现为“杵臼”变体,其中在一个单体上的残基与另一者上的残基之间一对一对应;也就是说,这些组对在两个单体之间形成促进异二聚体形成和阻止同二聚体形成的界面,允许在生物条件下自发形成的异二聚体的百分比超过90%,胜过预期的50%(25%同二聚体A/A:50%异二聚体A/B:25%同二聚体B/B)。
空间变体
在一些实施方案中,可以通过添加空间变体来促进异二聚体的形成。也就是说,通过改变每个重链中的氨基酸,不同重链比形成具有相同Fc氨基酸序列的同二聚体更有可能缔合形成异二聚结构。适合的空间变体包括于图10中。
也可以任选地使用一种机制在本领域中一般称作“杵臼”,其涉及造成空间影响以利于异二聚形成并且不利于同二聚形成的氨基酸工程改造;这有时称作“杵臼”,如USSN 61/596,846;Ridgway等,《蛋白质工程(Protein Engineering)》9(7):617(1996);Atwell等,《分子生物学杂志(J.Mol.Biol.)》1997 270:26;美国专利号8,216,805中所描述,全部借此以全文引用的方式并入。图式鉴别了依赖于“杵臼”的许多“单体A-单体B”对。另外,如Merchant等,《自然生物技术(Nature Biotech.)》16:677(1998)中所描述,这些“杵臼”突变可以与二硫键组成以向形成异二聚偏移。
应用于产生异二聚体的额外机制有时称作“静电转向”,如Gunasekaran等,《生物化学杂志(J.Biol.Chem.)》285(25):19637(2010)中所描述,借此以全文引用的方式并入。这在本文中有时称作“电荷对”。在这个实施方案中,静电用于使形成向异二聚偏移。如本领域的技术人员将了解,这些也可以对pI并且由此对纯化有影响,并且因此在一些情况下也可以视为pI变体。然而,因为产生这些以推动异二聚并且不用作纯化工具,所以将其归类为“空间变体”。这些包括(但不限于)与D221R/P228R/K409R配对的D221E/P228E/L368E(例如,这些是“单体对应组”)和与C220R/E224R/P228R/K409R配对的C220E/P228E/368E。
额外的单体A和单体B变体可以任选地和独立地以任何量与其它变体组合,诸如本文所概述的pI变体或US 2012/0149876的图37中所示的其它空间变体,其图式和图例以及SEQ ID NO以引用的方式明确并入本文中。
在一些实施方案中,本文所概述的空间变体可以任选地和独立地与任何pI变体(或其它变体,诸如Fc变体、FcRn变体等等)一起合并至一个或两个单体中,并且可以独立地和任选地包括于本发明的蛋白质中或从本发明的蛋白质中排除。
适合的偏移变体的清单在图10中找到,并且图15示出了在许多实施方案中特别利用的一些对。特别用于许多实施方案中的有以下组对,包括(但不限于)特别优选的空间变体对,包括(但不限于)L368D/K370S:S364K、L368E/K370S:S364K、T411E/K360E/Q362E:D401K、L368D/K370S:S364K/E357L、K370S:S364K/E357Q以及S364K/E357Q:L368D/K370S。在命名方面,对“S364K/E357Q:L368D/K370S”意味着单体中的一者具有双变体组S364K/E357Q并且另一者具有双变体组L368D/K370S。
异二聚体的pI(等电点)变体
一般来说,如本领域的技术人员将了解,存在两种一般类别的pI变体:增大蛋白质的pI的那些(碱性变化)和减小蛋白质的pI的那些(酸性变化)。如本文所描述,可以实施这些变体的所有组合:一个单体可以是野生型或不展现与野生型显著不同的pI的变体,并且另一者可以更具碱性或更具酸性。或者,改变每个单体,一者变成更具碱性并且另一者变成更具酸性。
pI变体的优选组合示于图11中。如本文所概述和图中所示,这些变化相对于IgG1示出,但所有同型以及同型杂交体可以按这种方式改变。在重链恒定域来自IgG2-4的情况下,也可以使用R133E和R133Q。
在一个实施方案中,例如在开瓶器格局中,pI变体的优选组合具有包含208D/295E/384D/418E/421D变体(当相对于人类IgG1时N208D/Q295E/N384D/Q418E/N421D)的一个单体(负性Fab侧)和包含带正电荷scFv连接子的第二单体(正性scFv侧),包括(GKPGS)4。然而,如本领域的技术人员将了解,第一单体包括CH1域,包括位置208。因此,在不包括CH1域的构建体中(例如,对于在一个域上不利用CH1域的异二聚Fc融合蛋白,例如在双scFv格局中),优选的负性pI变体Fc组包括295E/384D/418E/421D变体(当相对于人类IgG1时Q295E/N384D/Q418E/N421D)。
抗体异二聚体轻链变体
在基于抗体的异二聚体的情况下,例如,在单体中的至少一者除重链域以外包含轻链的情况下,pI变体也可以在轻链中制造。用于降低轻链的pI的氨基酸取代包括(但不限于)K126E、K126Q、K145E、K145Q、N152D、S156E、K169E、S202E、K207E以及在轻链的c端添加肽DEDE。在这种类别中基于恒定λ轻链的变化包括在R108Q、Q124E、K126Q、N138D、K145T以及Q199E处的一个或多个取代。另外,也可以实施增大轻链的pI。
同型变体
另外,本发明的许多实施方案依赖于在特定位置处的pI氨基酸从一个IgG同型至另一个同型的“输入”,由此降低或消除不当的免疫原性引入变体中的可能性。许多这些示于美国公布2014/0370013的图21中,借此以引用的方式并入。也就是说,IgG1出于包括高效应功能的多种原因是治疗性抗体的常见同型。然而,IgG1的重恒定区具有比IgG2更高的pI(8.10对比7.31)。通过将IgG2残基在特定位置处引入IgG1骨架中,所得单体的pI降低(或增大)并且另外展现更长的血清半衰期。举例来说,IgG1在位置137处具有甘氨酸(pI 5.97),并且IgG2具有谷氨酸(pI 3.22);输入谷氨酸将影响所得蛋白质的pI。如下文所描述,一般需要许多氨基酸取代以显著影响变体抗体的pI。然而,如下文所论述应注意,甚至IgG2分子中的变化也允许增加血清半衰期。
在其它实施方案中,如下文更进一步描述,制造非同型氨基酸变化,以降低所得蛋白质的总体电荷态(例如,通过使更高pI氨基酸变成更低pI氨基酸),或允许结构上适应以达成稳定性,等等。
另外,通过对重和轻恒定域两者进行pI工程改造,可以观察到异二聚体的每个单体的显著变化。如本文所论述,两个单体的pI相差至少0.5可以允许通过离子交换色谱或等电聚焦,或对等电点敏感的其它方法分离。
计算pI
每个单体的pI可以取决于变体重链恒定域的pI和包括变体重链恒定域和融合伴侣的总单体的pI。因此,在一些实施方案中,使用美国公布2014/0370013的图19中的图表,在变体重链恒定域的基础上计算pI的变化。如本文所论述,哪个单体进行工程改造一般由Fv和支架区的固有pI决定。或者,可以比较每个单体的pI。
还赋予更好的FcRn体内结合的pI变体
在pI变体减小单体的pI的情况下,其可以具有改善体内血清保留的附加效益。
尽管仍然在检查中,但据信Fc区具有更长的体内半衰期,这是因为在pH 6下在核内体中结合至FcRn使Fc隔绝(Ghetie和Ward,1997《今日免疫学(Immunol Today.)》18(12):592-598,以引用的方式全文并入)。核内体区室然后使Fc再循环至细胞表面。一旦区室对细胞外间隙开放,那么约7.4的更高pH诱导Fc释放回血液中。在小鼠中,Dall'Acqua等显示,在pH 6和pH 7.4下具有增加的FcRn结合的Fc突变体具有降低的血清浓度和与野生型Fc相同的半衰期(Dall'Acqua等2002,《免疫学杂志(J.Immunol.)》169:5171-5180,以引用的方式全文并入)。据认为在pH 7.4下Fc对FcRn增加的亲和力阻止Fc释放回血液中。因此,将增加Fc的体内半衰期的Fc突变将理想地在更低pH下增加FcRn结合同时仍然允许在更高pH下释放Fc。氨基酸组氨酸在6.0至7.4的pH范围内改变其电荷态。因此,在Fc/FcRn复合物中的重要位置处发现His残基并不令人惊讶。
最近已经提出,带有具更低等电点的可变区的抗体也可以具有更长的血清半衰期(Igawa等,2010《蛋白质工程、设计和选择(PEDS.)》23(5):385-392,以引用的方式全文并入)。然而,这种机制仍然了解甚少。此外,可变区在抗体之间有差异。如本文所描述,具有降低的pI和延长的半衰期的恒定区变体将提供用以改善抗体的药物代谢动力学特性的更模块化方法。
用于额外功能性的额外Fc变体
除pI氨基酸变体以外,存在许多有用的Fc氨基酸修饰,其可以出于多种原因而制造,包括(但不限于)改变与一个或多个FcγR受体的结合、改变与FcRn受体的结合,等等。
因此,本发明的蛋白质可以包括氨基酸修饰,包括本文所概述的异二聚变体,其包括pI变体和空间变体。每组变体可以独立地和任选地包括于任何特定异二聚蛋白中或从任何特定异二聚蛋白中排除。
FcγR变体
因此,存在许多有用的Fc取代,可以制造这些取代以改变与FcγR受体中的一者或多者的结合。得到增加的结合以及减少的结合的取代可以是有用的。举例来说,据知与FcγRIIIa的结合增加一般导致增加的ADCC(抗体依赖性细胞介导的细胞毒性;细胞介导的反应,其中表达FcγR的非特异性细胞毒性细胞识别靶细胞上结合的抗体并且随后引起靶细胞的裂解)。类似地,与FcγRIIb(抑制性受体)的结合减少同样在一些情况下可以是有益的。应用于本发明中的氨基酸取代包括USSN 11/124,620(特别是图41)、11/174,287、11/396,495、11/538,406中所列的那些,其全部以全文引用的方式明确并入本文中并且特别是关于其中所公开的变体。可应用的特定变体包括(但不限于)236A、239D、239E、332E、332D、239D/332E、267D、267E、328F、267E/328F、236A/332E、239D/332E/330Y、239D、332E/330L、243A、243L、264A、264V以及299T。
另外,存在应用于增加与FcRn受体的结合和增加血清半衰期的额外Fc取代,如USSN 12/341,769中特别公开,借此以全文引用的方式并入,包括(但不限于)434S、434A、428L、308F、259I、428L/434S、259I/308F、436I/428L、436I或V/434S、436V/428L以及259I/308F/428L。
消融变体
类似地,另一种类别的功能变体是“FcγR消融变体”或“Fc敲除(FcKO或KO)”变体。在这些实施方案中,对于一些治疗应用,需要减少或去除Fc域与Fcγ受体(例如,FcγR1、FcγRIIa、FcγRIIb、FcγRIIIa等等)中的一者或多者或所有的正常结合以避免额外的作用机制。也就是说,例如在许多实施方案中,特别是在使用单价结合CD3的双特异性抗体中,一般需要消融FcγRIIIa结合以消除或显著降低ADCC活性,其中Fc域中的一者包含一个或多个Fcγ受体消融变体。这些消融变体描绘于图12中,并且各自可以独立地和任选地包括或排除,其中优选的方面利用选自由以下组成的群组的消融变体:G236R/L328R、E233P/L234V/L235A/G236del/S239K、E233P/L234V/L235A/G236del/S267K、E233P/L234V/L235A/G236del/S239K/A327G、E233P/L234V/L235A/G236del/S267K/A327G以及E233P/L234V/L235A/G236del。应注意,本文所提及的消融变体消融FcγR结合但一般不消融FcRn结合。
异二聚和Fc变体的组合
如本领域的技术人员将了解,所有所叙述的异二聚变体(包括偏移和/或pI变体)可以任选地和独立地以任何方式组合,只要其保持其“成股性”或“单体分配”即可。另外,所有这些变体可以组合成异二聚格局中的任一者。
在pI变体的情况下,虽然特别应用的实施方案示于图中,但遵循改变两个单体之间的pI差异以有助于纯化的基本规则可以产生其它组合。
另外,如本文一般概述,异二聚变体偏移和pI也独立地和任选地与Fc消融变体、Fc变体、FcRn变体组合。
本发明的有用格局
如本领域的技术人员将了解和下文更全面论述,本发明的异二聚融合蛋白可以呈现如图1中一般描绘的多种构型。一些图描绘了“单端”构型,其中在分子的一个“臂”上存在一种类型的特异性并且在另一个“臂”上存在不同特异性。其它图描绘了“双端”构型,其中在分子的“顶部”存在至少一种类型的特异性并且在分子的“底部”存在一种或多种不同特异性。因此,本发明是针对共啮合不同的第一和第二抗原的新颖的免疫球蛋白组合物。
如本领域的技术人员将了解,本发明的异二聚格局可以具有不同价以及是双特异性的。也就是说,本发明的异二聚抗体可以是二价和双特异性的,其中CD3由一个结合域结合并且PSMA由第二结合域结合。异二聚抗体也可以是三价和双特异性的,其中PSMA由两个结合域结合并且CD3由第二结合域结合。如本文所概述,优选的是CD3仅单价结合,以减少潜在的副作用。
本发明利用抗CD3抗原结合域和抗PSMA抗原结合域。如本领域的技术人员将了解,可以使用如任何图(特别参看图2至7和21)中所描绘的抗CD3CDR、抗CD3可变轻和可变重域、Fab和scFv的任何集合。
在一些实施方案中,主题抗体包括抗CD3抗原结合域,其包括抗CD3 H1.30_L1.47的可变轻和可变重域(图2)。在一些实施方案中,主题抗体包括抗CD3抗原结合域,其包括抗CD3 H1.30_L1.47的vhCDR1-3和vlCDR1-3(图2)。在一些实施方案中,主题抗体包括抗CD3_H1.30_L1.47 scFv(图2)。
在一些实施方案中,主题抗体包括抗CD3抗原结合域,其包括抗CD3 H1.32_L1.47的可变轻和可变重域(图3)。在一些实施方案中,主题抗体包括抗CD3抗原结合域,其包括抗CD3 H1.32_L1.47的vhCDR1-3和vlCDR1-3(图3)。在一些实施方案中,主题抗体包括抗CD3 H1.32_L1.47 scFv(图3)。
在一些实施方案中,主题抗体包括抗CD3抗原结合域,其包括抗CD3 H1.89_L1.47的可变轻和可变重域(图4)。在一些实施方案中,主题抗体包括抗CD3抗原结合域,其包括抗CD3 H1.89_L1.47的vhCDR1-3和vlCDR1-3(图4)。在一些实施方案中,主题抗体包括抗CD3 H1.89_L1.47scFv(图4)。
在一些实施方案中,主题抗体包括抗CD3抗原结合域,其包括抗CD3 H1.90_L1.47的可变轻和可变重域(图5)。在一些实施方案中,主题抗体包括抗CD3抗原结合域,其包括抗CD3 H1.90_L1.47的vhCDR1-3和vlCDR1-3(图5)。在一些实施方案中,主题抗体包括抗CD3 H1.90_L1.47 scFv(图5)。
在一些实施方案中,主题抗体包括抗CD3抗原结合域,其包括抗CD3 H1.33_L1.47的可变轻和可变重域(图6)。在一些实施方案中,主题抗体包括抗CD3抗原结合域,其包括抗CD3 H1.33_L1.47的vhCDR1-3和vlCDR1-3(图6)。在一些实施方案中,主题抗体包括抗CD3 H1.33_L1.47 scFv(图6)。
在一些实施方案中,主题抗体包括抗CD3抗原结合域,其包括抗CD3 H1.31_L1.47的可变轻和可变重域(图7)。在一些实施方案中,主题抗体包括抗CD3抗原结合域,其包括抗CD3 H1.31_L1.47的vhCDR1-3和vlCDR1-3(图7)。在一些实施方案中,主题抗体包括抗CD3 H1.31_L1.47 scFv(图7)。
类似地,可以使用抗PSMA抗原结合域中的任一者,无论是如图8和20中所描绘的抗PSMA CDR、抗PSMA可变轻和可变重域、Fab和scFv,任选地和独立地以任何组合形式组合。在一些实施方案中,主题抗体包括抗PSMA抗原结合域,其包括抗PSMA J591 H1_L1的可变轻和可变重域(图20)。在一些实施方案中,主题抗体包括抗PSMA抗原结合域,其包括抗PSMA J591 H1_L1的vhCDR1-3和vlCDR1-3(图20)。在一些实施方案中,主题抗体包括具有抗PSMA J591 H1_L1的可变轻和可变重域或vhCDR1-3和vlCDR1-3的抗PSMA J591 H1_L1scFv(图20)。
开瓶器格局
特别应用于本发明中的一个异二聚支架是如图1A中所示的“三重F”或“开瓶器”支架格局。在这个实施方案中,抗体的一个重链含有单链Fv(“scFv”,如下文所定义)并且另一个重链是包含可变重链和轻链的“常规”FAb格局。这个结构在本文中有时称作“三重F”格局(scFv-FAb-Fc)或“开瓶器”格局,这归因于与开瓶器大致的视觉相似性(见图1)。通过使用促进如下文更全面描述的异二聚抗体形成的恒定区(例如,Fc域、CH1域和/或铰链区)中的氨基酸变体使两个链合在一起。
对于本发明的“三重F”格局存在若干截然不同的优点。如本领域中已知,依赖于两个scFv构建体的抗体类似物常常具有稳定性和聚集问题,这些问题可以在本发明中通过添加“常规”重和轻链配对而减轻。另外,与依赖于两个重链和两个轻链的格局相反,不存在重和轻链的错误配对的问题(例如,重1与轻2配对等等)。
本文所概述的许多实施方案一般依赖于包含有包含scFv的第一单体的开瓶器格局,所述scFv包含使用scFv连接子(在许多情况下带电荷)共价附接的可变重和可变轻域,其中scFv通常经由域连接子(如本文所概述可以不带电荷或带电荷)共价附接至第一Fc域的N端。开瓶器格局的第二单体是重链,并且组合物进一步包含轻链。
一般来说,在许多优选的实施方案中,scFv是结合至CD3的域,并且重和轻链的Fab结合至PSMA。另外,本发明的Fc域一般包含偏移变体(例如,如图10和15中所示的一组氨基酸取代,其中特别有用的偏移变体选自由以下组成的群组:S364K/E357Q:L368D/K370S;L368D/K370S:S364K;L368E/K370S:S364K;T411T/E360E/Q362E:D401K;L368D/K370S:S364K/E357L;以及K370S:S364K/E357Q),任选地包含消融变体,并且重链包含pI变体。
在一些实施方案中,本文所描绘的vh和vl序列中的任一者(包括图中描绘的所有抗PSMA和抗CD3vh和vl序列以及相关的sCDR序列)可以作为“Fab侧”添加至图25的开瓶器骨架格局中,使用图中所示的抗CD3 scFv序列中的任一者。特别应用于这些实施方案中的抗CD3序列是抗CD3 H1.30_L1.47、抗CD3 H1.32_L1.47、抗CD3 H1.89_L1.47、抗CD3 H1.90_L1.47、抗CD3 H1.33_L1.47以及抗CD3 H1.31_L1.47(分别在图2-7中描绘的vh、vl以及CDR序列),作为图25中所示的骨架的scFv侧附接。
本发明提供了开瓶器格局,其中抗CD3 scFv序列如图2至7和21中所示,包括与图25的骨架格局的任何组合。另外,如图2至7和21中所示的抗CD3vh、vl以及CDR序列中的任一者可以用作Fab侧。
本发明提供了开瓶器格局,其中抗PSMA序列如图8和20中所示。类似于上文,每个抗PSMA vh、vl以及相关的CDR序列可以是Fab侧或scFv侧,并且可以作为开瓶器格局的抗原结合域中的一者连接,包括图25的那些。当抗PSMA序列是Fab侧时,可以使用图中陈述的任何抗CD3 scFv序列和相关的vh、vl以及CDR序列,特别包括抗CD3 H1.30_L1.47、抗CD3 H1.32_L1.47、抗CD3 H1.89_L1.47、抗CD3 H1.90_L1.47、抗CD3 H1.33_L1.47以及抗CD3 H1.31_L1.47,作为图25中所示的骨架的scFv侧附接。
在一些实施方案中,主题抗体是具有如图21E中所示的Fab-Fc重链支架、scFv-Fc重链支架以及轻链支架的开瓶器格局抗体。任何可变重域,包括(但不限于)本文所描述的可变重域中的任一者,可以可操作地连接至图21E中所描述的Fab-Fc重链支架。任何可变轻域,包括(但不限于)本文所描述的可变轻域中的任一者,可以可操作地连接至图21E中所描述的轻链支架。
在一些实施方案中,分别可操作地连接至Fab-Fc重链支架和轻链支架(图21E)的可变重域和可变轻域是抗PSMA结合域的可变重和轻域。在一些实施方案中,可变重域和可变轻域包括抗PSMA J591 H1_L1的可变轻和可变重域(图20)。在一些实施方案中,可变重域包括J591 H1_L1的vhCDR1-3(图20)并且可变轻域包括J591 H1_L1的vlCDR1-3(图20)。
在一些实施方案中,分别可操作地连接至Fab-Fc重链支架和轻链支架(图21E)的可变重域和可变轻域是抗CD3结合域的可变重和轻域。在一些实施方案中,可变重域和可变轻域包括抗CD3 H1.30_L1.47(图2)、抗CD3 H1.32_L1.47(图3)、抗CD3 H1.89_L1.47(图4)、H1.90_L1.47(图5)、H1.33_L1.47(图6)或H1.31_L1.47(图7)的可变轻和可变重域。在一些实施方案中,分别地,可变重域包括抗CD3 H1.30_L1.47(图2)、抗CD3 H1.32_L1.47(图3)、抗CD3 H1.89_L1.47(图4)、H1.90_L1.47(图5)、H1.33_L1.47(图6)或H1.31_L1.47(图7)的vhCDR1-3并且可变轻域包括抗CD3 H1.30_L1.47(图2)、抗CD3 H1.32_L1.47(图3)、抗CD3 H1.89_L1.47(图4)、H1.90_L1.47(图5)、H1.33_L1.47(图6)或H1.31_L1.47(图7)的vlCDR1-3(例如,可变重域包括抗CD3 H1.30_L1.47的vhCDR1-3并且可变轻域包括抗CD3 H1.30_L1.47的vlCDR1-3)。
在一些实施方案中,scFv-Fc重链支架(图21E)可操作地连接至抗CD3 scFv。在一些实施方案中,抗CD3 scFv包括H1.30_L1.47(图2)、H1.32_L1.47(图3)、H1.89_L1.47(图4)、H1.90_L1.47(图5)、H1.33_L1.47(图6)或H1.31_L1.47(图7)的可变重和可变轻域。在一些实施方案中,抗CD3 scFv包括H1.30_L1.47(图2)、H1.32_L1.47(图3)、H1.89_L1.47(图4)、H1.90_L1.47(图5)、H1.33_L1.47(图6)或H1.31_L1.47(图7)的vhCDR1-3和vlCDR1-3。在一些实施方案中,抗CD3 scFv是H1.30_L1.47scFv(图2)、H1.32_L1.47scFv(图3)、H1.89_L1.47scFv(图4)、H1.90_L1.47scFv(图5)、H1.33_L1.47scFv(图6)或H1.31_L1.47scFv(图7)。
在一些实施方案中,scFv-Fc重链支架(图21E)可操作地连接至抗PSMA scFv。在一些实施方案中,抗PSMA scFv包括抗PSMA J591 H1_L1的可变重域和可变轻域(图20)。在一些实施方案中,scFv包括J591 H1_L1的vhCDR1-3(图20)和J591 H1_L1的vlCDR1-3(图20)。在一些实施方案中,抗PSMA scFv是J591 H1_L1scFv(图20)。
在某些实施方案中,主题抗PSMA x抗x CD3抗体具有图9、21A-D以及25中所描绘的开瓶器格局中的任一者的序列。
mAb-Fv格局
特别应用于本发明中的一个异二聚支架是图1中所示的mAb-Fv格局。在这个实施方案中,格局依赖于使用“外加”可变重域至一个单体的C端附接和“外加”可变轻域至另一个单体的C端附接,由此形成第三抗原结合域,其中两个单体的Fab部分结合PSMA并且“外加”Fv域结合CD3。
在这个实施方案中,第一单体包含第一重链,所述第一重链包含第一可变重域和包含第一Fc域的第一恒定重域,其中第一可变轻域使用域连接子共价附接至第一Fc域的C端。第二单体包含第二可变重域、包含第二Fc域的第二恒定重域以及使用域连接子共价附接至第二Fc域的C端的第三可变重域。在一些实施方案中,两个C端附接的可变域构成结合CD3的Fv(因为具有二价CD3结合是不太优选的)。这个实施方案进一步利用包含可变轻域和恒定轻域的共同轻链,其与重链缔合形成结合PSMA的两个相同Fab。
在一些实施方案中,第一重链包括vh1-CH1-铰链-CH2-CH3-[任选的连接子]-vl2并且第二单体包括vh1-CH1-铰链-CH2-CH3-[任选的连接子]-vh2并且共同轻链包括vl1。在这个实施方案中,vh1和vl1形成PSMA结合域并且vh2和vl2形成CD3结合域。
关于本文中的许多实施方案,如有需要并且如本文所描述,这些构建体包括偏移变体、pI变体、消融变体、额外的Fc变体等等。
本发明提供了mAb-Fv格局,其中抗CD3 scFv序列示于图2至图7中。
本发明提供了开瓶器格局,其中抗PSMA序列如图8和图20中所示。
本发明提供了包含如图12中所示的消融变体的mAb-Fv格局。
本发明提供了包含如图10和图15中所示的偏移变体的mAb-Fv格局。
mAb-scFv
特别应用于本发明中的一个异二聚支架是图1中所示的mAb-scFv格局。在这个实施方案中,格局依赖于使用scFv至一个单体的C端附接,由此形成第三抗原结合域,其中两个单体的Fab部分结合PSMA并且“外加”scFv域结合CD3。因此,第一单体包含第一重链(包含可变重域和恒定域),其中C端共价附接的scFv包含在任一种定向上的scFv可变轻域、scFv连接子以及scFv可变重域(vh1-CH1-铰链-CH2-CH3-[任选的连接子]-vh2-scFv连接子-vl2或vh1-CH1-铰链-CH2-CH3-[任选的连接子]-vl2-scFv连接子-vh2)。这个实施方案进一步利用包含可变轻域和恒定轻域的共同轻链,其与重链缔合形成结合PSMA的两个相同Fab。关于本文中的许多实施方案,如有需要并且如本文所描述,这些构建体包括偏移变体、pI变体、消融变体、额外的Fc变体等等。
本发明提供了mAb-scFv格局,其中抗CD3 scFv序列如图2至图7中所示。
本发明提供了mAb-scFv格局,其中抗PSMA序列如图8和图20中所示。
本发明提供了包含如图12中所示的消融变体的mAb-scFv格局。
本发明提供了包含如图10和图15中所示的偏移变体的mAb-scFv格局。
中心scFv格局
特别应用于本发明中的一个异二聚支架是图1中所示的中心scFv格局。在这个实施方案中,格局依赖于使用插入的scFv域,由此形成第三抗原结合域,其中两个单体的Fab部分结合PSMA并且“外加”scFv域结合CD3。scFv域插入一个单体的Fc域与CH1-Fv区之间,由此提供第三抗原结合域。
在这个实施方案中,一个单体包含第一重链,所述第一重链包含第一可变重域、CH1域以及Fc域(和任选的铰链),其中scFv包含scFv可变轻域、scFv连接子以及scFv可变重域。scFv使用可选的域连接子共价附接于重恒定域的CH1域的C端与第一Fc域的N端之间(例如,vh1-CH1-[任选的连接子]-vh2-scFv连接子-vl2-[任选的连接子,包括铰链]-CH2-CH3或vh1-CH1-[任选的连接子]-vl2-scFv连接子-vh2-[任选的连接子,包括铰链]-CH2-CH3。第二单体是标准Fab侧(例如,vh1-CH1-[任选的连接子,包括铰链]-CH2-CH3)。这个实施方案进一步利用包含可变轻域(例如,vl1)和恒定轻域的共同轻链,其与重链缔合形成结合PSMA的两个相同Fab。关于本文中的许多实施方案,如有需要并且如本文所描述,这些构建体包括偏移变体、pI变体、消融变体、额外的Fc变体等等。
本发明提供了中心scFv格局,其中抗CD3 scFv序列如图2至7中所示。
本发明提供了中心scFv格局,其中抗PSMA序列如图8和图20中所示。
本发明提供了包含如图12中所示的消融变体的中心scFv格局。
本发明提供了包含如图10和图15中所示的偏移变体的中心scFv格局。
中心Fv格局
特别应用于本发明中的一个异二聚支架是图1中所示的中心Fv格局。在这个实施方案中,格局依赖于使用插入的scFv域,由此形成第三抗原结合域,其中两个单体的Fab部分结合PSMA并且“外加”Fv域结合CD3。scFv域插入单体的Fc域与CH1-Fv区之间,由此提供第三抗原结合域,其中每个单体含有Fv的组分(例如,一个单体包含可变重域并且另一个包含可变轻域)。
在这个实施方案中,一个单体包含第一重链,所述第一重链包含第一可变重域、CH1域和Fc域以及额外的可变轻域。额外的可变轻域使用域连接子共价附接于重恒定域的CH1域的C端与第一Fc域的N端之间(例如,vh1-CH1-[任选的连接子]-vl2-铰链-CH2-CH3)。另一个单体包含第一重链,所述第一重链包含第一可变重域、CH1域和Fc域以及额外的可变重域(例如,vh1-CH1-[任选的连接子]-vh2-铰链-CH2-CH3)。额外的可变重域使用域连接子共价附接于重恒定域的CH1域的C端与第一Fc域的N端之间。
这个实施方案进一步利用包含可变轻域和恒定轻域的共同轻链,其与重链缔合形成结合PSMA的两个相同Fab。关于本文中的许多实施方案,如有需要并且如本文所描述,这些构建体包括偏移变体、pI变体、消融变体、额外的Fc变体等等。
本发明提供了中心scFv格局,其中抗CD3 scFv序列如图2至7中所示。
本发明提供了中心scFv格局,其中抗PSMA序列如图8和图20中所示。
本发明提供了包含如图12中所示的消融变体的中心scFv格局。
本发明提供了包含如图10和图15中所示的偏移变体的中心scFv格局。
单臂中心scFv
特别应用于本发明中的一个异二聚支架是图1中所示的单臂中心scFv格局。在这个实施方案中,一个单体只包含Fc域,而另一个单体使用插入的scFv域,由此形成第二抗原结合域。在这个格局中,Fab部分结合PSMA并且scFv结合CD3,或者反之亦然。scFv域插入单体的Fc域与CH1-Fv区之间。
在这个实施方案中,一个单体包含第一重链,所述第一重链包含第一可变重域、CH1域以及Fc域,其中scFv包含scFv可变轻域、scFv连接子以及scFv可变重域。scFv使用域连接子共价附接于重恒定域的CH1域的C端与第一Fc域的N端之间(例如,vh1-CH1-[任选的连接子]-vh2-scFv连接子-vl2-[任选的连接子,包括铰链]-CH2-CH3或vh1-CH1-[任选的连接子]-vl2-scFv连接子-vh2-[任选的连接子,包括铰链]-CH2-CH3)。第二单体包含Fc域(CH2-CH3)。这个实施方案进一步利用包含可变轻域和恒定轻域的轻链,其与重链缔合形成Fab。关于本文中的许多实施方案,如有需要并且如本文所描述,这些构建体包括偏移变体、pI变体、消融变体、额外的Fc变体等等。
本发明提供了单臂中心scFv格局,其中抗CD3 scFv序列如图2至图7中所示。
本发明提供了单臂中心scFv格局,其中抗PSMA序列如图8和图20中所示。
本发明提供了包含如图12中所示的消融变体的单臂中心scFv格局。
本发明提供了包含如图10和图15中所示的偏移变体的单臂中心scFv格局。
双scFv格局
本发明还提供了如本领域中已知和图1中所示的双scFv格局。特别地,本发明提供了双scFv格局,其中抗CD3 scFv序列如图2至图7中所示。
本发明提供了双scFv格局,其中抗PSMA序列如图8中所示。在一些实施方案中,抗PSMA和抗CD3 scFv包括scFv连接子。在某些实施方案中,scFv连接子是图14中所示的scFv连接子。
本发明提供了包含如图12中所示的消融变体的双scFv格局。
本发明提供了包含如图10和图15中所示的偏移变体的双scFv格局。
共同轻链格局
特别应用于本发明中的一个异二聚支架是图1中所示的共同轻链格局。在这个实施方案中,第一单体包含第一重链,所述第一重链包含第一可变重域和包含第一Fc域的第一恒定重域。第二单体包含第二可变重域和包含第二Fc域的第二恒定重域。第一和第二单体中的每一者与包含可变轻域和恒定轻域的共同轻链缔合。关于本文中的许多实施方案,如有需要并且如本文所描述,这些构建体包括偏移变体、pI变体、消融变体、额外的Fc变体等等。
本发明提供了共同轻链格局,其中抗CD3序列如图2至图7中所示。
本发明提供了共同轻链格局,其中抗PSMA序列如图8和图20中所示。
本发明提供了包含如图12中所示的消融变体的共同轻链格局。
本发明提供了包含如图10和图15中所示的偏移变体的共同轻链格局。
双特异性IgG
特别应用于本发明中的一个异二聚支架是图1中所示的双特异性格局。在这个实施方案中,第一单体包含第一重链,所述第一重链包含第一可变重域和包含第一Fc域的第一恒定重域。第二单体包含第二可变重域和包含第二Fc域的第二恒定重域。第一和第二单体中的每一者与包含可变轻域和恒定轻域的轻链(即,分别是第一轻链和第二轻链)缔合。关于本文中的许多实施方案,如有需要并且如本文所描述,这些构建体包括空间变体(例如,杵臼变体)、偏移变体、pI变体、消融变体、额外的Fc变体等等。
本发明提供了双特异性IgG格局,其中抗CD3序列如图2至图7中所示。
本发明提供了双特异性IgG格局,其中抗PSMA序列如图8和图20中所示。
本发明提供了包含如图12中所示的消融变体的双特异性IgG格局。
本发明提供了包含如图10和图15中所示的偏移变体的双特异性IgG格局。
本发明的核酸
本发明进一步提供了编码本发明的双特异性抗体的核酸组合物。如本领域的技术人员将了解,核酸组合物将取决于异二聚蛋白的格局和支架。因此,举例来说,当格局需要三个氨基酸序列时,诸如对于三重F格局(例如,包含Fc域和scFv的第一氨基酸单体、包含重链和轻链的第二氨基酸单体),三个核酸序列可以合并至一个或多个表达载体中用于表达。类似地,一些格局(例如,双scFv格局,诸如图1中所公开)仅需要两个核酸;再次,可以将其置于一个或两个表达载体中。
如本领域中已知,编码本发明的组分的核酸可以合并至如本领域中已知的表达载体中,并且取决于用于产生本发明的异二聚抗体的宿主细胞。一般来说,核酸可操作地连接至许多调控元件(启动子、复制起点、可选择标志、核糖体结合位点、诱导子等等)。表达载体可以是染色体外或整合载体。
本发明的核酸和/或表达载体然后转化至如本领域中熟知的许多不同类型的宿主细胞中,包括哺乳动物、细菌、酵母、昆虫和/或真菌细胞,其中哺乳动物细胞(例如,CHO细胞)应用于许多实施方案中。
在一些实施方案中,如取决于格局可应用的编码每个单体的核酸和任选的编码轻链的核酸各自含于单一表达载体内,一般在不同或相同的启动子控制下。在特别用于本发明中的实施方案中,这两个或三个核酸中的每一者含于不同表达载体上。如本文和借此以引用的方式并入的62/025,931中所示,不同载体比率可以用于驱动异二聚体形成。也就是说,令人惊讶地,虽然蛋白质包含1:1:2比率的第一单体:第二单体:轻链(在具有包含异二聚抗体的三个多肽的本文中的许多实施方案的情况下),但这些不是得出最佳结果的比率。
本发明的异二聚抗体通过培养如本领域中熟知的包含表达载体的宿主细胞而制成。一旦产生,即完成传统抗体纯化步骤,包括离子交换色谱步骤。如本文所论述,两个单体的pI相差至少0.5可以允许通过离子交换色谱或等电聚焦,或对等电点敏感的其它方法分离。也就是说,包括pI取代,其改变每个单体的等电点(pI)以使得每个单体具有不同的pI并且异二聚体也具有截然不同的pI,由此有助于“三重F”异二聚体的等电纯化(例如,阴离子交换柱、阳离子交换柱)。这些取代也帮助确定和监测纯化后任何污染的双scFv-Fc和mAb同二聚体(例如,IEF凝胶、cIEF以及分析型IEX柱)。
治疗
一旦制成,本发明的组合物即应用于许多应用中,包括治疗表达或过度表达PSMA的癌症,包括(但不限于)前列腺癌。
因此,本发明的异二聚组合物应用于这些癌症的治疗中。
用于体内施用的抗体组合物
根据本发明使用的抗体的配方通过混合具有所需纯度的抗体与任选的医药学上可接受的载剂、赋形剂或稳定剂来制备以供储存(《雷明顿氏医药科学(Remington's Pharmaceutical Sciences)》第16版,Osol,A.编[1980]),呈冻干配方或水溶液的形式。可接受的载剂、赋形剂或稳定剂在所采用的剂量和浓度下对接受者无毒,并且包括缓冲剂,诸如磷酸盐、柠檬酸盐以及其它有机酸;抗氧化剂,包括抗坏血酸和甲硫氨酸;防腐剂(诸如十八烷基二甲基苄基氯化铵;氯化六烃季铵(hexamethonium chloride);苯扎氯铵(benzalkonium chloride)、苄索氯铵(benzethonium chloride);苯酚、丁醇或苄醇;对羟基苯甲酸烷酯,诸如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;邻苯二酚;间苯二酚;环己醇;3-戊醇;以及间甲酚);低分子量(小于约10个残基)多肽;蛋白质,诸如血清白蛋白、明胶或免疫球蛋白;亲水聚合物,诸如聚乙烯吡咯烷酮;氨基酸,诸如甘氨酸、谷氨酰胺、天冬酰胺、组氨酸、精氨酸或赖氨酸;单糖、二糖以及其它碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,诸如EDTA;糖,诸如蔗糖、甘露糖醇、海藻糖或山梨糖醇;成盐平衡离子,诸如钠;金属复合物(例如,Zn-蛋白质复合物);和/或非离子表面活性剂,诸如TWEENTM、PLURONICSTM或聚乙二醇(PEG)。
本文中的配方必要时还可以含有多于一种活性化合物用于所治疗的特定适应症,优选的是具有彼此并无不利影响的互补活性的那些。举例来说,可能需要提供具有其它特异性的抗体。或者或另外,组合物可以包含细胞毒性剂、细胞因子、生长抑制剂和/或小分子拮抗剂。这类分子适合以有效用于预期目的的量组合存在。
活性成分还可以圈闭于例如通过凝聚技术或通过界面聚合制备的微胶囊中,例如,分别是羟甲基纤维素或明胶微胶囊和聚(甲基丙烯酸甲酯)微胶囊;胶态药物递送系统(例如,脂质体、白蛋白微球、微乳液、纳米粒子以及纳米胶囊)中;或巨乳液中。这类技术在《雷明顿氏医药科学(Remington's Pharmaceutical Sciences)》第16版,Osol,A.编(1980)中公开。
有待用于体内施用的配方应是无菌的,或接近无菌。这通过经无菌过滤膜过滤来容易地实现。
可以制备持续释放制剂。持续释放制剂的适合实例包括含有抗体的固体疏水聚合物的半渗透基质,所述基质呈成形物品的形式,例如膜或微胶囊。持续释放基质的实例包括聚酯;水凝胶(例如,聚(甲基丙烯酸2-羟乙酯)或聚(乙烯醇));聚交酯(美国专利号3,773,919);L-谷氨酸和L-谷氨酸γ-乙酯的共聚物;不可降解的乙烯-乙酸乙烯酯;可降解的乳酸-乙醇酸共聚物,诸如LUPRON DEPOTTM(由乳酸-乙醇酸共聚物和醋酸亮丙瑞林(leuprolide acetate)组成的可注射微球);以及聚-D-(-)-3-羟基丁酸。虽然诸如乙烯-乙酸乙烯酯和乳酸-乙醇酸的聚合物能够释放分子持续超过100天,但某些水凝胶释放蛋白质持续更短的时间段。
当囊封的抗体在体内长时间保留时,其由于在37℃下暴露于水分而可能变性或聚集,使得生物活性损失和免疫原性可能发生变化。取决于所涉及的机制可以设计合理的策略用于稳定。举例来说,如果发现聚集机制是经由硫-二硫化物互换的分子间S--S键形成,那么可以通过修饰巯基残基,从酸性溶液冻干,控制水分含量,使用适当添加剂以及开发特定聚合物基质组成来达成稳定。
施用模态
本发明的抗体和化学治疗剂根据已知的方法施用于受试者,诸如作为大丸剂或通过经一段时间连续输注而静脉内施用、通过肌肉内、腹膜内、脑脊髓内、皮下、关节内、滑膜内、鞘内、经口、局部或吸入途径。抗体的静脉内或皮下施用是优选的。
治疗模态
在本发明的方法中,疗法用于提供关于疾病或病状的阳性治疗反应。“阳性治疗反应”预期是疾病或病状的改善,和/或与疾病或病状相关的症状的改善。举例来说,阳性治疗反应将涉及以下疾病改善中的一者或多者:(1)赘生性细胞的数目减少;(2)赘生性细胞的死亡增加;(3)赘生性细胞的存活受抑制;(5)肿瘤生长受抑制(即,一定程度上减缓,优选地停止);(6)患者存活率增加;以及(7)与疾病或病状相关的一种或多种症状的一些缓解。
在任何给定的疾病或病状中的阳性治疗反应可以通过特定针对那种疾病或病状的标准化反应准则来确定。可以使用筛选技术针对肿瘤形态(即,总体肿瘤负荷、肿瘤尺寸等等)的变化来评估肿瘤反应,诸如磁共振成像(MRI)扫描、x放射摄影成像、计算机断层摄影(CT)扫描、骨扫描成像、内窥镜检查,以及肿瘤活检取样,包括骨髓抽吸(BMA)和循环中的肿瘤细胞计数。
除了这些阳性治疗反应以外,经受疗法的受试者可以经历与疾病相关的症状改善的有益作用。
疾病的改善可以表征为完全反应。“完全反应”预期是通过任何先前异常的放射摄影研究、骨髓以及脑脊髓液(CSF)或在骨髓瘤的情况下异常的单克隆蛋白的正常化而不存在临床上可检测的疾病。
在根据本发明的方法治疗之后,这样的反应可以持续至少4至8周,或有时6至8周。或者,疾病的改善可以归类为部分反应。“部分反应”预期是在不存在新病灶的情况下所有可测量的肿瘤负荷(即,存在于受试者中的恶性细胞的数目,或肿瘤块的测量体积或异常单克隆蛋白的量)减少至少约50%,这可以持续4至8周或6至8周。
根据本发明的治疗包括“治疗有效量”的所用药剂。“治疗有效量”指的是在必需的剂量和时间段下有效达成所需治疗结果的量。
治疗有效量可以根据以下因素而变化,诸如疾病病况,个体的年龄、性别和体重,以及药剂在个体中引出所需反应的能力。治疗有效量也是抗体或抗体部分的任何毒性或有害作用被治疗有益作用超过的量。
肿瘤疗法的“治疗有效量”也可以由其稳定疾病进展的能力来度量。化合物抑制癌症的能力可以在预期人类肿瘤中的功效的动物模型系统中评价。
或者,组合物的这种特性可以通过用技术从业者所知的体外试验检查化合物抑制细胞生长或诱导凋亡的能力来评价。治疗性化合物的治疗有效量可以减小肿瘤尺寸,或以其它方式改善受试者的症状。本领域的一般技术人员将能够基于以下因素确定这类量,诸如受试者的体型、受试者症状的严重性以及所选择的特定组合物或施用途径。
调整给药方案以提供最佳的所需反应(例如,治疗反应)。举例来说,可以施用单一大丸剂,可以经过一段时间施用若干分次剂量,或如治疗情形的紧迫性所指示可以按比例地减少或增加剂量。出于施用简易性和剂量均匀性,肠道外组合物可以配制成剂量单位形式。如本文所用的剂量单位形式指的是适合作为单位剂量用于有待治疗的受试者的物理离散单位;每个单位含有预定量的活性化合物,所述量经过计算以与所需医药载剂相结合产生所需治疗作用。
本发明的剂量单位形式的规格由以下决定并且直接取决于以下:(a)活性化合物的独特特征和有待达成的特定治疗作用,以及(b)在混配这样的活性化合物用于个体的敏感性治疗的领域中固有的限制。
本发明中所用的双特异性抗体的有效剂量和给药方案取决于有待治疗的疾病或病状并且可以由本领域的技术人员确定。
本发明中所用的双特异性抗体的治疗有效量的例示性的非限制性范围为约0.1-100mg/kg,诸如约0.1-50mg/kg,例如约0.1-20mg/kg,诸如约0.1-10mg/kg,例如约0.5,诸如约0.3、约1或约3mg/kg。在另一个实施方案中,抗体以1mg/kg或更大的剂量,诸如1至20mg/kg的剂量,例如5至20mg/kg的剂量,例如8mg/kg的剂量施用。
具有本领域的一般技术的医学专业人员可以容易地确定和建议所需要的医药组合物的有效量。举例来说,医师或兽医可以在低于达成所需治疗作用所需要的水平下起始医药组合物中采用的药剂的剂量并且逐步增加剂量直至达成所需作用为止。
在一个实施方案中,以10至500mg/kg,诸如200至400mg/kg的周剂量通过输注施用双特异性抗体。可以重复这样的施用,例如1至8次,诸如3至5次。可以经过2至24小时,诸如2至12小时的时段通过连续输注进行施用。
在一个实施方案中,如有需要,经过长的时段,诸如超过24小时通过缓慢连续输注施用双特异性抗体,以减少包括毒性的副作用。
在一个实施方案中,以250mg至2000mg,诸如300mg、500mg、700mg、1000mg、1500mg或2000mg的周剂量施用双特异性抗体,至多8次,诸如4至6次。可以经过2至24小时,诸如2至12小时的时段通过连续输注进行施用。必要时,例如在6个月或12个月后,这样的方案可以重复一次或多次。可以通过例如取出生物样品并且使用靶向双特异性抗体的抗原结合区的抗独特型抗体测量施用后血液中本发明的化合物的量来确定或调整剂量。
在又一个实施方案中,每周一次施用双特异性抗体,持续2至12周,诸如3至10周,诸如4至8周。
在一个实施方案中,通过维持疗法施用双特异性抗体,诸如每周一次持续6个月或更长的时段。
在一个实施方案中,通过包括双特异性抗体的一次输注继之以偶联至放射性同位素的双特异性抗体的输注的方案来施用双特异性抗体。方案可以重复,例如,在7至9天后。
作为非限制性实例,根据本发明的治疗可以作为每天约0.1-100mg/kg,诸如0.5、0.9、1.0、1.1、1.5、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、40、45、50、60、70、80、90或100mg/kg的量的抗体日剂量提供,在治疗开始之后第1天、第2天、第3天、第4天、第5天、第6天、第7天、第8天、第9天、第10天、第11天、第12天、第13天、第14天、第15天、第16天、第17天、第18天、第19天、第20天、第21天、第22天、第23天、第24天、第25天、第26天、第27天、第28天、第29天、第30天、第31天、第32天、第33天、第34天、第35天、第36天、第37天、第38天、第39天或第40天中的至少一天,或者第1周、第2周、第3周、第4周、第5周、第6周、第7周、第8周、第9周、第10周、第11周、第12周、第13周、第14周、第15周、第16周、第17周、第18周、第19周或第20周中的至少一周或其任何组合,使用每24、12、8、6、4或2小时的单次或分次剂量或其任何组合。
在一些实施方案中,其双特异性抗体分子与一种或多种额外治疗剂,例如化学治疗剂组合使用。DNA损伤化学治疗剂的非限制性实例包括拓扑异构酶I抑制剂(例如,伊立替康(irinotecan)、拓扑替康(topotecan)、喜树碱(camptothecin)和其类似物或代谢物,以及阿霉素(doxorubicin));拓扑异构酶II抑制剂(例如,依托泊苷(etoposide)、替尼泊苷(teniposide)以及柔红霉素(daunorubicin));烷化剂(例如,美法仑(melphalan)、苯丁酸氮芥(chlorambucil)、白消安(busulfan)、噻替哌(thiotepa)、异环磷酰胺(ifosfamide)、卡莫司汀(carmustine)、洛莫司汀(lomustine)、司莫司汀(semustine)、链脲菌素(streptozocin)、达卡巴嗪(decarbazine)、甲氨蝶呤(methotrexate)、丝裂霉素C(mitomycin C)以及环磷酰胺(cyclophosphamide));DNA嵌入剂(例如,顺铂(cisplatin)、奥沙利铂(oxaliplatin)以及卡铂(carboplatin));DNA嵌入剂和自由基生成剂,诸如博莱霉素(bleomycin);以及核苷模拟物(例如,5-氟尿嘧啶、卡培他滨(capecitibine)、吉西他滨(gemcitabine)、氟达拉滨(fludarabine)、阿糖胞苷(cytarabine)、巯基嘌呤、硫鸟嘌呤、喷司他丁(pentostatin)以及羟基脲)。
破坏细胞复制的化学治疗剂包括:太平洋紫杉醇(paclitaxel)、多烯紫杉醇(docetaxel)以及相关类似物;长春新碱(vincristine)、长春碱(vinblastin)以及相关类似物;沙利度胺(thalidomide)、来那度胺(lenalidomide)以及相关类似物(例如,CC-5013和CC-4047);蛋白酪氨酸激酶抑制剂(例如,甲磺酸伊马替尼(imatinib mesylate)和吉非替尼(gefitinib));蛋白酶体抑制剂(例如,硼替佐米(bortezomib));NF-κB抑制剂,包括ΙκΒ激酶抑制剂;结合至在癌症中过度表达的蛋白质并且从而下调细胞复制的抗体(例如,曲妥珠单抗(trastuzumab)、利妥昔单抗(rituximab)、西妥昔单抗(cetuximab)以及贝伐单抗(bevacizumab));以及已知在癌症中上调、过度表达或活化的蛋白质或酶的其它抑制剂,所述蛋白质或酶的抑制下调细胞复制。
在一些实施方案中,可以在(硼替佐米)治疗之前、同时或之后使用本发明的抗体。
所有引用的参考文献以全文引用的方式明确并入本文中。
尽管上文出于说明的目的已经描述了本发明的特定实施方案,但本领域的技术人员将了解,在不背离如随附权利要求书中所描述的本发明的情况下可以作出细节的众多变更。
实施例
下文提供实施例以说明本发明。这些实施例并不有意将本发明限于任何特定的应用或操作理论。对于本发明中论述的所有恒定区位置,编号是根据如Kabat中的EU索引(Kabat等,1991,《免疫学关注的蛋白质序列(Sequences of Proteins of Immunological Interest)》,第5版,United States Public Health Service,National Institutes of Health,Bethesda,以引用的方式全文并入)。抗体领域的技术人员将了解,这个惯例由免疫球蛋白序列的特定区中的非依序编号组成,从而能够正规化提及免疫球蛋白家族中的保守位置。因此,如由EU索引定义的任何给定的免疫球蛋白的位置将不一定对应于其依序的序列。
一般和特定的科学技术在美国公布2015/0307629、2014/0288275以及WO2014/145806中概述,其全部以全文引用的方式明确并入并且特别是关于其中所概述的技术。
实施例1:双特异体产生
抗PSMA x抗CD3双特异体的氨基酸序列在图9和21A-D中列出。通过基因合成(Blue Heron Biotechnology,Bothell,Wash.)产生编码双特异性表达所需的三个链的DNA并且使用标准分子生物学技术亚克隆至表达载体pTT5中。使用定点诱变(QuikChange,Stratagene,Cedar Creek,Tex.)或额外的基因合成和亚克隆来引入取代。将DNA转染至HEK293E细胞中用于表达并且使用蛋白A亲和色谱(GE Healthcare)和阳离子交换色谱从上清液纯化所得蛋白质。使用具有50mM MES(pH 6.0)的洗涤/平衡缓冲液和50mM MES(pH 6.0)+1M NaCl线性梯度的洗脱缓冲液的HiTrap SP HP柱(GE Healthcare)进行阳离子交换色谱纯化。
通过生物膜层干涉法(BLI)在Octet Red仪器(ForteBio)上测量例示性抗体XENP14484和XENP19722的PSMA亲和力(KD)(图22)。将双特异体(XENP14484、XENP19722)捕捉至AHC传感器上,继而捕捉50至0.78125nM(两倍稀释)的浓度的人类或食蟹猴PSMA。
实施例2:重导向T细胞细胞毒性
针对PSMA+LNCaP前列腺癌细胞系的细胞表面结合和重导向T细胞细胞毒性(RTCC)体外表征抗PSMA x抗CD3双特异体(图16和23)。试验的细节在图例中指示。如这些图中所示,主题抗PSMA x抗CD3抗体XENP14484和XENP19722能够体外结合至LNCaP前列腺癌细胞并且介导RTCC杀伤,而抗RSV对照XENP13245并不展现PSMA或RTCC。
实施例3:食蟹猴药理学
向食蟹猴(n=3)给与单次剂量的XENP14484(抗PSMA x抗CD3,30μg/kg)或XENP13245(抗RSV x CD3,3mg/kg)。通过流式细胞术检查CD4+ T细胞着边和由CD69MFI的活化。通过ELISA检查IL-6血清水平(图17A)。另外,通过流式细胞术检查CD8+ T细胞着边和由CD69 MFI的活化并且通过ELISA检查TNFα血清水平(图17B)。如这些图中所示,T细胞反应和细胞因子释放综合症(CRS)取决于猴中靶细胞由抗PSMA x抗CD3抗体的啮合。
实施例4:CD3亲和力和细胞因子释放综合症
向食蟹猴(n=3)施用单次静脉内(i.v.)剂量的0.06mg/kg XENP14484(高CD3亲和力)或1mg/kg XENP19722(低CD3亲和力)。如图24中所示,XENP14484和XENP19722抗体尽管具有不同的CD3亲和力仍展现类似的T细胞着边和活化(CD4+(上图)和CD8+(中图))。尽管有T细胞活化的类似性,然而,对CD3具有低亲和力的XENP19722与对CD3具有高亲和力的XENP14484相比诱导更少的细胞因子减少综合症(CRS)(图24,下图)。这种更低的CD3亲和力甚至在更高的剂量水平下也与减少的细胞因子释放相关联。这样的话,抗PSMA双特异体的效力可以通过调整其募集T细胞的能力来调节。
- 还没有人留言评论。精彩留言会获得点赞!