恶性病变的组合治疗的制作方法
本发明是关于用于治疗恶性病变的新方法。
背景技术:
细胞毒T淋巴细胞相关抗原-4(CTLA-4)在1987年被发现是免疫球蛋白超家族的新成员,其特征在于与可变(V)或恒定(C)免疫球蛋白域共享关键结构特征的域(Brunet等人,Nature 328,267-270)。据说明,CTLA-4在免疫系统的调节中扮演关键的角色(Keilholz,U.,J Immunother 31,431-439)。据报告CTLA-4通过与CD28竞争CD80/CD86的结合位点来降低T细胞活化(Rudd等人,Immunol Rev 229,12-26)。虽然CTLA-4保护个体免受自身免疫疾病,但CTLA-4也会抑制抗癌免疫力。为了避免CTLA-4在癌症治疗中引起不期望的免疫反应,正在探索操作T细胞共刺激途径的几种方法,以增强抗癌免疫反应。靶向CTLA-4的治疗是最先进的策略之一,并且已在晚期临床试验中显示出有希望的结果(Hodi等人,N Engl J Med 363,711-723;Hodi,F.S.,Asia Pac J Clin Oncol 6Suppl 1,S16-23;Weber,J.,Oncologist 13Suppl 4,16-25;及Ribas,A.,Oncologist 13Suppl 4,10-15)。对抗CTLA-4的单株抗体之一ipilimumab已在2011年3月由FDA同意核准用于治疗转移性黑色素瘤。除了转移性黑色素瘤之外,CTLA-4抗体目前正进行用于治疗恶性肿瘤的许多临床试验,该恶性肿瘤包括胰腺癌、结肠直肠癌、肝细胞癌、淋巴瘤、激素难治的前列腺癌、卵巢癌及急性骨髓性白血病。
细胞程式死亡-1(PD-1)是CD28超家族的成员,其在结合其配体程序性死亡配体1和2(PD-L1和PD-L2)时触发阴性信号传递途径(Riley,J.L.,Immunol Rev 229,114-125)。PD-1与其配体之间的相互作用导致增殖、细胞因子产生、及T细胞的溶细胞功能的抑制,从而耗尽T细胞并抑制其免疫反应。PD-1/PD-L途径在耐受力和免疫力中起重要的作用。PD-1/PD-L途径保护组织和器官免受免疫介导的损伤。然而,已证明此途径被慢性感染和肿瘤的病原体用来抑制抗微生物和抗癌免疫力。已知PD-1/PD-L轴的免疫调节活性,已经开发出针对此途径的治疗剂用于治疗范围从感染、自身免疫到癌症的病变(Weber,J.,Semin Oncol 37,430-439)。
仍然需要增强免疫力同时避免抑制免疫反应的抗癌治疗的新方法。
技术实现要素:
因此,本发明提供一种将传统抗癌治疗与DNA或蛋白疫苗组合用于恶性病变的组合治疗,该组合治疗在肿瘤生长的抑制中表现出意想不到的改善功效。
在一个实施方案中,本发明提供用于治疗个体的恶性病变,包含对该个体施用疫苗与抗癌治疗的组合,其中该疫苗为医药组合物,该医药组合物包含DNA构筑体或融合蛋白,该DNA构筑体或融合蛋白包含细胞毒T淋巴细胞相关抗原-4(CTLA-4)、及细胞程式死亡-1(PD-1)或细胞程式死亡-配体1(PD-L1)、或上述的组合。
在另一个实施方案中,本发明提供一种用于在接受恶性病变治疗的个体体内增强免疫反应的医药组合物,该医药组合物包含含有CTLA-4和PD-1的DNA疫苗或含有CTLA-4和PD-L1的DNA疫苗。
在本发明的一个具体实施例中,该DNA疫苗为CTLA-4的DNA疫苗与PD-L1的疫苗或CTLA-4-PD-L1的疫苗的组合。
在本发明的另一个具体实施例中,该DNA疫苗为CTLA-4的DNA疫苗与PD-1的疫苗或CTLA-4-PD-1的疫苗的组合。
在本发明的进一步具体实施例中,该疫苗为针对PD-1片段(PD1Frag)、CTLA-4-PD-L1(CTLA4-PDL1Elec)、或CTLA-4-PD-L1融合蛋白的疫苗。
在进一步的实施方案中,本发明提供一种用于治疗个体的恶性病变的方法,包含对该个体施用抗癌治疗与DNA疫苗的组合,其中该DNA疫苗为医药组合物,该医药组合物包含含有编码细胞毒T淋巴细胞相关抗原-4(CTLA-4)的多核苷酸序列的DNA构筑体、及含有细胞程式死亡-1(PD-1)或细胞程式死亡-配体1(PD-L1)、或上述的组合的DNA构筑体,或其蛋白。
在本发明的一个或更多个实例中,该抗癌治疗为放射或抗癌抗体治疗。
附图说明
为了说明本发明的目的,在图式中图示出具体实施例。然而,应当理解的是,本发明并不限于图示的优选具体实施例。
在图式中:
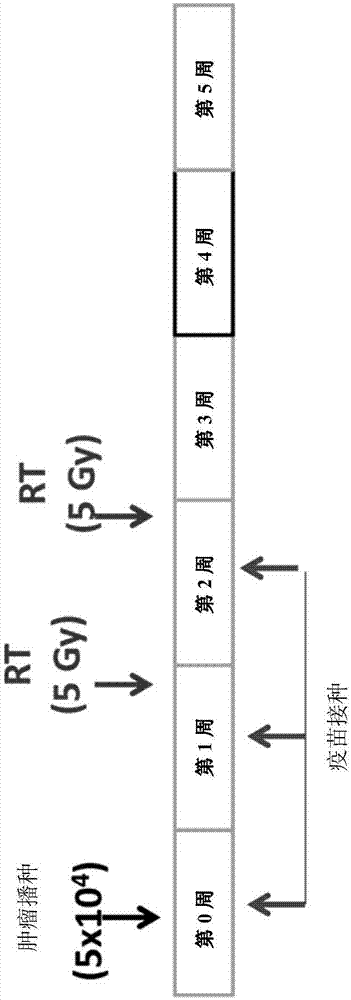
图1A提供实施例1和2中使用的实验和治疗时间表的简图。
图1B图示实施例1中用放射治疗处理的荷B16肿瘤小鼠的体重变化。
图1C图示实施例1中荷B16肿瘤小鼠的体重变化。
图2A提供实施例2的实验和治疗时间表的简图。
图2B图示实施例2的荷CT26肿瘤小鼠的体重变化。
图2C图示实施例2中通过各种治疗策略的CT26肿瘤抑制。
图3A图示实施例3中对CT26肿瘤抑制的实验和治疗时间表的简图。
图3B图示实施例3中通过各种治疗策略的CT26肿瘤抑制,其中就肿瘤抑制效果而言,与用放射治疗联合pVAC1的疫苗治疗的小鼠相比,用放射治疗联合CTLA4(pVAC1-mCTLA4)的DNA疫苗与PDL1(pVac1-mPDL1)的DNA疫苗的组合治疗的小鼠达到统计显著性+RT。
图4A图示实施例4中对CT26肿瘤抑制的实验和治疗时间表的简图。
图4B图示实施例4中通过各种治疗策略的CT26肿瘤抑制,其中就肿瘤抑制效果而言,与仅用RT治疗的对照组相比,用CTLA4-PLL1(pVAC1-mCTLA4-mPDL1)疫苗与放射治疗(在第16天和第22天10Gy x2)的组合治疗的小鼠达到统计显著性。
图5A图示实施例5中对CT26肿瘤抑制的实验和治疗时间表的简图。
图5B图示就肿瘤抑制效果而言,与pVAC1+RT和其他的疫苗相比,通过与各种疫苗(包括通过电穿孔递送的CTLA4-PDL1(pVAC1-mCTLA4-PDL1)的DNA疫苗)组合的放射与放射治疗的组合的CT26肿瘤抑制达到统计显著性。
图5C图示在实施例5中使用放射与各种疫苗的组合治疗的小鼠的Kapln-Meier存活曲线。
图6A图示实施例6中对B16肿瘤抑制的实验和治疗时间表的简图。
图6B图示CTLA-4-PD-L1的DNA疫苗的效果,在右侧肿瘤接受照射之后,CTLA-4-PD-L1的DNA疫苗能够诱导远位效应,如未经照射的左侧肿瘤的抑制生长所证(右图)。
图7A图示实施例7中对CT26肿瘤抑制的实验和治疗时间表的简图。
图7B图示用DNA疫苗治疗的组中的体重变化,其中在注射指定的抗CTLA-4(mCTLA)及/或抗PD-1(mPD1)DNA疫苗后,在Balb/c小鼠的两条腿上接种CT26结肠肿瘤,并照射右腿的肿瘤。
图7C图示实施例7中在小鼠的经照射肿瘤上的远位效应。
图7D图示实施例7中在小鼠的未经照射肿瘤上的远位效应。
图8A图示实施例8中使用DNA或蛋白疫苗与抗PD1抗体J43的组合治疗B16肿瘤的实验和治疗时间表的简图。
图8B图示实施例8中J43与CTLA-4-PD-L1DNA疫苗的组合的抗癌效果。
图9A图示在实施例9中用与抗PD1抗体(J43)组合的DNA疫苗治疗鼠Lewis肺癌(LLC)的实验和治疗时间表的简图。
图9B图示通过单独、或与J43或PD-1DNA片段疫苗组合的CTLA-4-PD-L1DNA疫苗、或单独J43的LLC生长抑制的效果。
图10A图示在实施例10中用mCTLA4-mPDL1DNA疫苗治疗鼠肝细胞癌(BNL)的实验和治疗时间表的简图。
图10B图示实施例10中mCTLA4-PDL1DNA疫苗对BNL肝癌细胞生长的效果。
具体实施方式
除非另有定义,否则本文中使用的所有技术和科学用语都具有本领域技术人员一般理解的含义。如本文所用,以下用语具有归属于它们的含义,除非另有说明。
本文中使用的冠词「一(a)」和「一(an)」是指冠词的一个或超过一个(即至少一个)语法上的受词。举例来说,「一组件」意指一个组件或超过一个组件。
「编码」是指多核苷酸中核苷酸的特定序列(例如基因、cDNA或mRNA)的固有性质,以作为在具有限定的核苷酸序列(即rRNA、tRNA及mRNA)或限定的氨基酸序列和从而产生的生物学性质的生物过程中用于合成其它聚合物和大分子的模板。因此,假使基因产生的mRNA的转录和转译在细胞或其他生物系统中产生蛋白质,则基因编码蛋白质。本领域技术人员应当理解的是,由于遗传密码的简并性,许多不同的多核苷酸和核酸可以编码相同的多肽。还应当理解的是,本领域技术人员可以使用例行技术来进行不影响由所述多核苷酸编码的多肽序列的核苷酸取代,以反映其中将表现多肽的任何特定宿主生物体的密码子使用。因此,除非另有说明,否则「编码氨基酸序列的多核苷酸」包括是彼此的简并形式并且编码相同氨基酸序列的所有多核苷酸。编码蛋白质和RNA的多核苷酸可以包括内含子。
「疫苗」是指含有活性成分的试剂或组合物,该活性成分在个体中针对某种病原体或疾病有效诱导治疗程度的免疫力。传统上,疫苗的活性成分是衍生自病原体的多肽,病原体是疫苗的攻击目标。「DNA疫苗」是指其中活性成分为DNA的疫苗。「蛋白质疫苗」是指其中活性成分为多肽的疫苗。
「医药组合物」是指适用于个体体内的医药用途的组合物。医药组合物包含有效量的活性剂和医药上可接受载体。「有效量」是指有效产生预期结果(例如本发明中的免疫反应)的试剂量。「医药上可接受载体」是指任何的标准医药载体、缓冲液、及赋形剂,例如磷酸盐缓冲盐溶液、5%葡萄糖水溶液、及乳液(例如油/水或水/油乳液)、以及各种类型的润湿剂及/或佐剂。优选的医药载体取决于活性剂的预期施用模式。典型的施用模式包括肠内(例如口服)或胃肠外(例如皮下、肌肉内、静脉内或腹膜内注射;或局部、经皮、或经黏膜施用)。「佐剂」是指改变其它药剂(例如药物、疫苗)的效果同时当自身被单独施用时几乎没有直接作用的医药或免疫药剂。佐剂时常被包括在疫苗中以增强受体对供应的抗原的免疫反应,同时将注射的外来物质保持在最少。
「个体」是人或非人哺乳动物。非人哺乳动物包括、但不限于灵长类动物、有蹄类哺乳动物、犬科动物及猫科动物。
「裸露DNA」是指不与脂质体偶联的DNA构筑体(用于对个体施用)。
本发明的医药组合物可以通过公知的方法以一种或更多种医药上可接受载体制造。本文所用的「医药上可接受载体」涵盖任何的标准医药载体。此类载体可以包括、但不限于:盐水、缓冲盐水、葡萄糖、水、甘油、乙醇及上述的组合。
本发明提供一种用于治疗个体的恶性病变的方法,包含对该个体施用DNA疫苗与抗癌治疗的组合,其中该DNA疫苗为医药组合物,该医药组合物包含含有编码细胞毒T淋巴细胞相关抗原-4(CTLA-4)的多核苷酸序列的DNA构筑体、及含有细胞程式死亡-1(PD-1)或细胞程式死亡-配体1(PD-L1)、或上述的组合的DNA构筑体。
在本发明的一个具体实施例中,该抗癌治疗可以是放射治疗或抗体治疗。
本发明还提供一种用于在接受恶性病变治疗的个体体内增强免疫反应的医药组合,该医药组合包含含有编码CTLA-4的多核苷酸序列的DNA构筑体与含有PD-1或PD-L1或上述的组合的DNA构筑体的组合。
此外,本发明提供一种用于治疗个体的恶性病变的方法,包含对该个体施用放射治疗或抗体治疗与含有编码CTLA-4的多核苷酸序列的DNA构筑体及含有PD-1或PD-L1或上述的蛋白的DNA构筑体的组合。
依据本发明,该疫苗可以是CTLA-4的DNA疫苗与PD-L1的疫苗或CTLA-4-PD-L1的疫苗的组合。或者,该DNA疫苗可以是CTLA-4的DNA疫苗与PD-1的疫苗或CTLA-4-PD-1的疫苗的组合。此外,该疫苗可以是针对PD-1片段(PD1Frag)、CTLA-4-PD-L1(CTLA4-PDL1Elec)、或CTLA-4-PD-L1融合蛋白的疫苗。
在以下实例中证实了针对免疫检查点蛋白的DNA基疫苗可以增强对肿瘤的免疫反应。与一些传统化学疗法类似的电离放射具有免疫调节性能。在本发明中,与可使肿瘤相关抗原暴露于T细胞的放射组合,这些免疫调节DNA疫苗可以逆转肿瘤诱导的免疫逃避并进一步产生可持续的抗肿瘤免疫力。
在本发明的具体实施例中,用抗癌药物治疗个体,例如抗体治疗,从而在个体体内引起免疫反应的刺激。
依据本发明,恶性病变可以选自转移性黑色素瘤、胰腺癌、结肠直肠癌、肝细胞癌、淋巴瘤、激素难治的前列腺癌、卵巢癌、急性骨髓性白血病、及肺癌。
通过以下实施例进一步说明本发明,提供这些实例是为了说明的目的而不是限制的目的。
材料
使用分别从小鼠和人的白血球获得的cDNA库作为模板将编码鼠CTLA-4、PD1、或PD-L1的DNA序列PCR扩增。将生成的PCR产物与胎盘碱性磷酸酶(PLAP)的跨膜域序列融合到哺乳动物表现质体pVAC-1中,从而形成CTLA-4和PD1或PD-L1以获得DNA疫苗。
使用4个具有黑色素瘤B16F10、鼠结肠直肠癌CT26、肺癌LLC、及肝癌BNL细胞的动物模型进行体内研究。
实施例1:放射加针对CTLA-4和PD-1的DNA疫苗用于黑色素瘤的组合治疗
如图1A所示,在电穿孔辅助下每周对c58B9BL/6小鼠(5只小鼠/组)肌内注射DNA疫苗或对照质体1次,共3次。在最后一次疫苗接种后一周,对来自免疫小鼠的血清进行ELISA测定,以检测针对各免疫检查点蛋白的抗体滴定量。在c58B9BL/6小鼠上建立B16F10鼠黑色素瘤肿瘤。在建立肿瘤之后,使用的放射方案(当适用时)为2周次的5Gy。将小鼠分组,每组用放射、放射加CTLA-4疫苗、放射加PD-1疫苗、放射加CTLA-4和PD-1疫苗、或无治疗(对照组)治疗。
发现与对照组相比,用CTLA-4或PD-1DNA疫苗接种的小鼠表现出增加的、针对各蛋白的抗体滴定量(p<0.005)。如图1B所示,对荷瘤小鼠的治疗没有导致实验小鼠之间体重有明显差异,表示缺乏可辨别的毒性。与单独放射相比,放射治疗组合CTLA-4疫苗的治疗导致在放射开始后1个月有更多的肿瘤消退(肿瘤体积减少53.2%;p=0.125)。然而,用PD-1疫苗的免疫法并未明显增强放射的肿瘤抑制(肿瘤体积减少14.7%;p=0.55)。还观察到在实验结束时,与其它组相比,在用放射加CTLA-4和PD-1疫苗治疗的荷瘤小鼠中肿瘤被明显抑制。如图1C所示,在用放射加上CTLA-4和PD-1疫苗治疗的小鼠中观察到B16F10肿瘤接近完全消退,相对于单独放射组肿瘤体积减少了92.4%(p=0.037)。
实施例2:放射加针对CTLA-4和PD-1的DNA疫苗用于结肠直肠癌的组合治疗
使用Balb/c小鼠(每组5只小鼠)来接种1×106个结肠直肠CT26癌细胞。疫苗接种和放射治疗的治疗时间表类似于荷B16小鼠的第一个实验的治疗方案,不同之处仅在于每次用8Gy照射小鼠(参见图2A)。
如图2B所示,在用各种方案治疗的实验小鼠之间体重没有明显差异。不同治疗策略的抗癌作用结果也与实施例1的结果相似,显示在治疗组之间最明显的肿瘤抑制效果是通过放射治疗组合CTLA-4和PD-1DNA疫苗的治疗(p<0.01)。具体而言,用放射组合CTLA-4和PD-1疫苗治疗的小鼠表现出比用放疗治疗与CTLA-4疫苗(p=0.003)或PD1DNA疫苗(p=0.001)治疗的组更好的肿瘤抑制效果。还观察到,在实验结束时,与其它组相比,用放射加CTLA-4和PD-1疫苗治疗的荷瘤小鼠中肿瘤被明显抑制了。
实施例3:放射加针对CTLA-4和PD-L1的DNA疫苗用于结肠直肠癌的组合治疗
我们检视CTLA-4和PD-L1DNA疫苗与放射治疗组合在体内对CT26肿瘤生长的作用。此实验的进行类似于实施例2,不同之处仅在于将PD-1DNA疫苗替换为PD-L1DNA疫苗,并且只用12Gy的放射治疗治疗小鼠一次,如图3A所示。
不同治疗策略的抗癌效果也与实施例2的抗癌效果相似,显示最明显的肿瘤抑制效果是在用放射治疗组合CTLA-4和PD-L1DNA疫苗治疗的小鼠中。如图3B所示,与仅用放射治疗的组相比,在仅用单一DNA疫苗(CTLA-4或PD-L1)组合放射治疗治疗的组中没有观察到明显的抗癌作用;然而,与单独用放射治疗的组相比,在用放射组合CTLA-4和PD-L1DNA疫苗治疗的组和用放射加CTLA-4-PD-L1融合基因疫苗的组中肿瘤被明显抑制了(p<0.05)。
实施例4:放射加针对CTLA-4和PD-L1的DNA疫苗用于结肠直肠癌的组合治疗
分别制备偶联脂质体的CTLA-4+PD-1DNA疫苗和CTLA-4-PD-L1融合DAN疫苗。将小鼠接种1×105个细胞,并用两次10Gy的放射治疗治疗,各如图4A所示,并用脂质体治疗。
如图4B所示,与单独用放射治疗的组相比,通过偶联脂质体的CTLA-4-PD-L1DNA疫苗与放射治疗组合实现了最明显的抗肿瘤效果(p<0.05)。
实施例5:放射加针对PD-1片段(PD1Frag)、CTLA-4-PD-L1(CTLA4-PDL1Elec)、或CTLA-4-PD-L1融合蛋白疫苗的DNA疫苗用于结肠直肠癌的组合治疗
研究了PD-1片段DNA疫苗(PD1Frag)、CTLA-4-PD-L1DNA疫苗(CTLA4-PDL1Elec)及CTLA-4-PD-L1蛋白疫苗(CTLA-4-PDL1Prot)与放射治疗(RT)组合在体内对CT26肿瘤生长的抗癌效果。此实验设计和治疗时间表类似于实施例4,不同之处仅在于使用5x104而不是1×105个CT26细胞来接种每只小鼠。
就皮下接种的CT26的大小变化而言,与放射治疗相比,仅CTLA-4-PD-L1DNA疫苗显示统计显著性(图5B)。如图5B所示,CTLA-4-PD-L1Prot疫苗和PD1Frag疫苗两者与放射(RT)组合在抑制肿瘤生长上提供更好的效果,但与单独RT相比则没有统计显著性。然而,如图5C所示,当与RT组合时,CTLA4-PDL1Prot疫苗和PD1Frag疫苗均显示统计显著性。
实施例6:CTLA-4-PD-L1疫苗对结肠直肠癌的远位效应(Abscopal effect)
放射对未经照射肿瘤的抗癌作用是所谓的「远位效应」。在本施实例中测试CTLA-4-PD-L1DNA疫苗或蛋白疫苗的肿瘤抑制。不仅在实验小鼠的右侧腹部的经照射肿瘤,而且还在左侧腹部的未经照射肿瘤。免疫检查点疫苗可产生这种罕见但非常有益的放射「远位效应」。实验设计如图6A所示。
如图6B所示,与放射治疗组合的疫苗没有表现出进一步增强的放射抗癌作用,但CTLA-4-PD-L1DNA疫苗抑制了接种在小鼠左侧腹部的未经照射肿瘤的生长,表示CTLA-4-PD-L1DNA疫苗能够诱导放射的远位效应。
实施例7:放射治疗组合针对CTLA-4和PD-1的疫苗在结肠直肠癌的远位效应
在用各种DNA疫苗与放射组合处理的CT26肿瘤模型中证明远位效应。实验设计如图7A所示。将Balb/c小鼠在两条腿上接种CT26结肠肿瘤,然后注射指定的抗CTLA-4(mCTLA)及/或抗PD-1(mPD1)DNA疫苗。RT:当指示时照射右腿上的肿瘤。
如图7B所示,发现在治疗组之间平均体重没有明显的差异。将每组经照射(指针)肿瘤的平均肿瘤生长图标于图7C,并将未经照射肿瘤的平均肿瘤生长图标于图7D。类似于在实施例6观察到的结果,与单独用放射治疗的组相比,接受放射和两种免疫检查点DNA疫苗组合治疗的Balb/c小鼠的经照射(指标)CT26肿瘤表现出改善的肿瘤消退。如在用放射加疫苗治疗的组中观察到的,肿瘤有明显消退,表示远位效应增强。
实施例8:抗-PD-1抗体加CTLA-4-PD-L1DNA或蛋白疫苗对抑制的效果
为了测试CTLA-4-PD-L1DNA或蛋白疫苗与抗PD-1抗体J43组合的协同作用,如图8A所示设计治疗时间表。
如图8B所示,与对照组相比,J43和CTLA-4-PD-L1DNA疫苗的组合显示优异的抗癌效果(p<0.01),而抗PD-1抗体J43未能在体内抑制B16肿瘤生长上显示统计显著性。
实施例9:抗PD-1抗体加CTLA-4-PD-L1DNA或蛋白疫苗对肺癌抑制的效果
在Lewis肺癌(LLC)细胞中检测两种不同的DNA疫苗CTLA-4-PD-L1和PD-1片段及其组合在抗PD-1抗体J43存在或不存在的情况下的抗癌作用。实验设计和治疗时间表如图9A所示。
类似于实施例8中使用B16黑色素瘤模型的结果,抗PD-1抗体J43无法表现出统计学上显著的Lewis肺癌(LLC)生长抑制。另一方面,与单独的对照DNA或抗-PD1抗体J43相比,CTLA-4-PD-L1DNA疫苗无论单独或与J43或PD-1DNA片段疫苗组合都表现出明显的LLC生长抑制(图9B)。此外,PD-1片段DNA疫苗还显示出比J43优异的LLC生长抗癌作用,表示免疫检查点DNA疫苗可以如同那些核准的抗体在人类临床环境中起作用。将统计结果列于表1。
表1统计结果
实施例10:抗PD-1抗体加CTLA-4-PD-L1DNA或蛋白疫苗对肝癌抑制的效果
为了测试CTLA-4-PD-L1DNA疫苗在体内对肝细胞癌细胞(BNL)生长的影响,如图10A所示对免疫的BALB/c小鼠皮下接种肝细胞株BNL/Luc(2×105个细胞/小鼠)。对小鼠进行荧光素酶活性成像,荧光素酶活性成像表示肿瘤生长的程度。
在疫苗接种之后第10天,用BNL/Luc肝癌细胞(2*105)刺激BALB/c小鼠。观察接受pVAC-1(对照)和pVAC-1-mCTLA4-PDL1的小鼠的肝细胞癌。如图10B所示,在治疗组与对照组之间平均肿瘤生长没有差异;然而,与对照组相比,在pVAC-1-mCTLA4-PDL1免疫小鼠中表现出抑制的肿瘤生长(p<0.005)。
基于以下在上述实施例中的发现得出的结论是,针对CTLA-4、PD-1或PD-L1的DNA疫苗的组合对于增强放射或抗PD-1抗体的组合在体内抑制肿瘤生长是有效的:
(1)CTLA-4或CTLA-4加PD-1DNA疫苗可以增强放射在B16(图1B)和CT26模型(图2B)的抗癌效果;
(2)CTLA-4-PD-L1融合基因DNA和CTLA-4加PD-L1DNA疫苗在CT26模型中与放射治疗组合使用时也都表现出优异的抗癌效果(图3B);
(3)当使用脂质体递送CTLA-4-PD-L1DNA疫苗并与放射组合时,也观察到正面的抗CT26效果(图4B);
(4)荷CT26肿瘤小鼠的放射增强存活不仅可通过CTLA-4-PD-1DNA疫苗实现,而且也可通过其蛋白疫苗实现(图5B);
(5)CTLA-4-PD-L1DNA疫苗可在小鼠体内对未经照射的B16肿瘤产生远位效应(图6B);类似地,与放射治疗组合,CTLA-4加PD-1DNA疫苗在未经照射的CT26上实现最明显的远位效应(图7D);
(6)此外,与单独J43相比,CTLA-4-PD-L1DNA疫苗与抗PD1抗体J43组合表现出更好的抗B16效果(图8B);
(7)与单独J43相比,CTLA-4-PD-L1或PD-1片段DNA疫苗都显示更好的抗LLC效果(图9B);以及
(8)CTLA-4-PD-L1DNA疫苗也对小鼠体内的肝癌细胞BNL的生长表现出抑制效果(图10B)。
本领域技术人员将理解的是,在不偏离广义的发明概念下,可以对上述具体实施例进行改变。因此,应当理解的是,本发明不限于公开的特定具体实施例,而是意图涵盖在权利要求书中界定的、本发明的精神和范围内的修改。
- 还没有人留言评论。精彩留言会获得点赞!