示出加水分解活性的新肽及其用途的制作方法
本发明涉及示出加水分解活性的新肽及其用途。
背景技术:
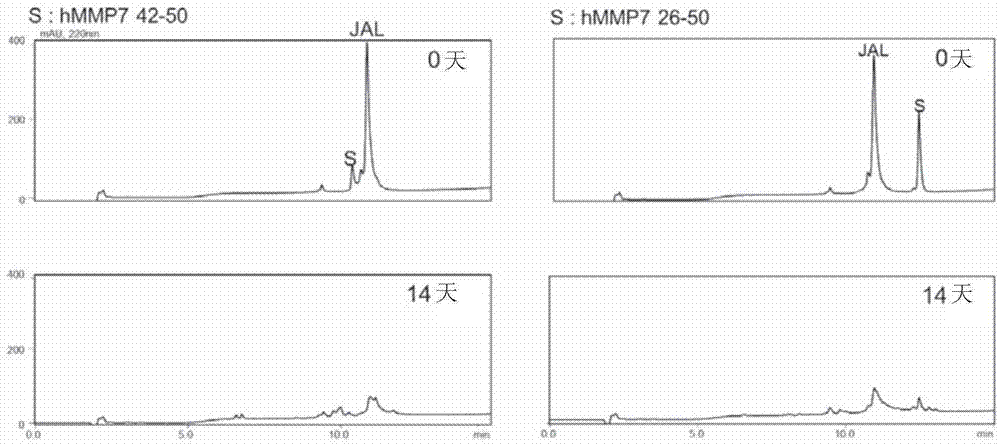
:在使用生物化学方法的蛋白质分解中,一般使用催化加水分解反应的酶蛋白。但众所周知,就酶蛋白而言,因例如水、温度、酸性等条件而在稳定性上容易受影响、容易变性。因此需要提供如酶蛋白般催化反应的新分子。技术实现要素:发明要解决的课题因此本发明以提供催化加水分解反应的、与酶蛋白不同的新分子为目的。解决课题的方法本发明的催化性肽为催化加水分解反应的肽,其特征在于由选自下述(A1)~(C4)的至少一种肽构成。(A1)由Tob/BTG蛋白质的BoxA与其上游区域及下游区域的至少一个区域构成的肽(A2)由所述(A1)的部分区域构成的肽(A3)在所述(A1)或所述(A2)的氨基酸序列中,由1个或数个氨基酸被缺失、置换、增加及/或插入而成的氨基酸序列构成的、具有加水分解活性的肽(A4)由相对于所述(A1)或所述(A2)的氨基酸序列具有85%以上一致性的氨基酸序列构成的、具有加水分解活性的肽(B1)由Tob/BTG蛋白质的BoxB构成的肽(B2)由所述(B1)的部分区域构成的肽(B3)在所述(B1)或所述(B2)的氨基酸序列中,由1个或数个氨基酸被缺失、置换、增加及/或插入而成的氨基酸序列构成的、具有加水分解活性的肽(B4)由相对于所述(B1)或所述(B2)的氨基酸序列具有85%以上一致性的氨基酸序列构成的、具有加水分解活性的肽(C1)由Tob/BTG蛋白质的C末端区域或中间区域构成的肽(C2)由所述(C1)的部分区域构成的肽(C3)在所述(C1)或所述(C2)的氨基酸序列中,由1个或数个氨基酸被缺失、置换、增加及/或插入而成的氨基酸序列构成的、具有加水分解活性的肽(C4)由相对于所述(C1)或所述(C2)的氨基酸序列具有85%以上一致性的氨基酸序列构成的、具有加水分解活性的肽本发明的催化性肽试剂包含催化性分子,所述催化性分子以是所述本发明的催化性肽为特征。本发明的分解方法为蛋白质或肽的分解方法,其特征在于,包括以所述本发明的催化性肽处理底物的工序,所述底物为蛋白质或肽。发明的效果通过本发明的催化性肽可催化加水分解反应。由于本发明的催化性肽与酶蛋白不同,为分子量小的肽,因而能够作为与所述蛋白质不同的新的催化剂分子适用于加水分解反应。附图说明图1为示出催化性肽的加水分解活性的色谱图。图2为示出催化性肽的加水分解活性的色谱图和分解而得的片段序列。图3为示出pH对催化性肽的加水分解活性影响的色谱图。图4为示出催化性肽对SOD1的加水分解活性的色谱图。图5示出由催化性肽引发的分解而得到的片段序列。图6为示出缓冲液对催化性肽的加水分解活性影响的色谱图。图7为示出缓冲液浓度对催化性肽的加水分解活性影响的色谱图。图8为示出催化性肽的最适宜pH的色谱图。图9为确认了金属对催化性肽的加水分解活性影响的色谱图。图10为示出催化性肽的加水分解活性的色谱图。图11为示出催化性肽的加水分解活性的色谱图和分解而得的片段序列。图12为确认了缓冲液对催化性肽的加水分解活性影响的色谱图。图13为示出由催化性肽引发的分解而得到的片段。图14为示出由催化性肽引发的分解而得到的片段。图15为示出各种催化性肽的加水分解活性的有无的表。图16为示出蛋白酶抑制剂造成的、对催化性肽的自我分解的抑制的色谱图。图17为确认了有机溶剂对催化性肽的加水分解活性影响的色谱图。图18为确认了白蛋白对催化性肽的加水分解活性影响的色谱图。图19为示出蛋白酶抑制剂造成的、对催化性肽的自我分解的抑制的色谱图。图20为示出催化性肽的最佳浓度的图表。图21为示出催化性肽的加水分解活性的色谱图和分解而得的片段的氨基酸序列。图22为示出各种蛋白酶抑制剂造成的、对催化性肽的自我分解的抑制的色谱图。图23为示出催化性肽的加水分解活性的图表。图24为示出催化性肽对固体Aβ1-42的加水分解活性的色谱图和分解而得的片段。图25为示出催化性肽对可溶性Aβ1-42的加水分解活性的色谱图和切断部位。图26为示出催化性肽自我分解的色谱图和分解而得的片段的氨基酸序列。图27为示出催化性肽的自我分解的色谱图和分解而得的片段的氨基酸序列。图28为示出催化性肽对Aβ11-29的加水分解活性的色谱图。图29为示出催化性肽对Aβ的加水分解活性的色谱图。图30为示出催化性肽对Aβ的加水分解活性的色谱图。图31为示出底物浓度和反应速度关系的图表。图32为示出催化性肽对Aβ的加水分解活性的色谱图。图33为示出催化性肽对Aβ的加水分解活性的色谱图。图34为示出催化性肽对Aβ的加水分解活性的色谱图。图35为示出催化性肽对Aβ的加水分解活性的色谱图。图36为示出催化性肽对Aβ的加水分解活性的色谱图。图37为示出催化性肽自我分解的色谱图。图38为示出蛋白酶抑制剂造成的、对催化性肽的自我分解的抑制的色谱图。图39为示出催化性肽造成的Aβ的切断点的图。图40为示出催化性肽对Aβ的分子间相互作用的图表。图41为催化性肽的NMR结果。图42为示出催化性肽的推测结构的概略图。图43为示出催化性肽对Tau的加水分解活性的色谱图。图44为示出催化性肽对Tau的加水分解活性的色谱图。图45为示出催化性肽对Tau的加水分解活性的色谱图。图46为示出催化性肽造成的Tau的切断点的图。图47为示出催化性肽对Aβ的加水分解活性的色谱图。图48为示出催化性肽对Aβ的加水分解活性的色谱图。图49为示出催化性肽对Aβ的加水分解活性的色谱图。图50为示出催化性肽对Aβ的加水分解活性的色谱图。图51为示出催化性肽对Aβ的加水分解活性的色谱图。图52示出了反应液组成。图53为示出催化性肽自我分解的色谱图。图54为示出催化性肽对Aβ的加水分解活性的色谱图。图55为示出催化性肽对Aβ的加水分解活性的色谱图。图56为示出催化性肽对Aβ的加水分解活性的色谱图。图57为示出蛋白酶抑制剂造成的、对催化性肽的自我分解的抑制的色谱图。图58为示出催化性肽对Aβ的加水分解活性的色谱图。图59为示出催化性肽对Aβ的加水分解活性的色谱图。图60为示出催化性肽对Aβ的加水分解活性的色谱图。图61为示出催化性肽对Aβ的加水分解活性的色谱图。图62为示出催化性肽对Aβ的加水分解活性的色谱图。图63为示出催化性肽对Aβ的加水分解活性的色谱图。图64为示出催化性肽对Aβ的加水分解活性的色谱图。图65为示出催化性肽对晶体蛋白的加水分解活性的色谱图。图66为示出催化性肽对晶体蛋白的加水分解活性的色谱图。图67为示出催化性肽对Aβ的加水分解活性的色谱图。图68为示出催化性肽对Aβ的加水分解活性的色谱图。图69为示出催化性肽对Aβ的加水分解活性的色谱图。图70为示出催化性肽对Aβ的加水分解活性的色谱图。图71为示出催化性肽的自我分解的色谱图。图72为示出催化性肽对Aβ的加水分解活性的色谱图。具体实施方式<催化性肽>如前所述,本发明的催化性肽为以由选自所述(A1)~(C4)的至少一种肽构成为特征的、催化加水分解反应的肽。本发明人员潜心研究发现Tob/BTG蛋白质中功能不明确的区域的肽具有催化加水分解反应的加水分解活性。本发明的催化性肽为短链小分子,例如比酶蛋白对水、温度、酸等的稳定性高而难以产生变性。因此,本发明的催化性肽例如比酶蛋白更容易处理,而能够替代酶蛋白应用于各种用途。就本发明催化性肽的长度而言,氨基酸残基数的下限例如为5、7、9,其上限例如为22、18、17,其范围例如为5~22、5~18、5~17。作为本发明的催化性肽,首先就所述(A1)~(A4)的肽进行说明。所述(A1)的肽为由Tob/BTG蛋白质的BoxA与其上游区域及下游区域的至少一个区域构成的肽。所述(A1)肽例如可为BoxA与其上游区域构成的肽,也可为由BoxA与其下游区域构成的肽,也可以为所述上游区域与BoxA与所述下游区域构成的肽。在所述(A1)肽中,对BoxA的氨基酸序列没有特别限定,例如可列举序列号1的氨基酸序列。在序列号1中,例如Xaa1为Y、F或H,Xaa2为P或S,Xaa3为E或D,Xaa4为K或C,Xaa5为Y、L、C或S,Xaa6为S或Q,Xaa7为G或A,Xaa8为F或Y,Xaa9为V或I,Xaa10为H或R,Xaa11为I或V。BoxA:序列号1HW[Xaa1][Xaa2][Xaa3][Xaa4]P[Xaa5]KG[Xaa6][Xaa7][Xaa8]RC[Xaa9][Xaa10][Xaa11]作为所述序列号1的BoxA,可列举以下序列作为具体例子。[表1]BoxA序列序列号TOB1HWYPEKPYKGSGFRCIHI3TOB2HWYPEKPLKGSGFRCVHI44BTG1HWFPEKPCKGSGYRCIRI45BTG2HWFPEKPSKGSGYRCIRI46BTG3HWYPEKPSKGQAYRCIRV47BTG4HWHSDCPSKGQAFRCIRI48在所述(A1)肽中,就所述上游区域的长度而言,氨基酸残基数的下限例如为1、2,其上限例如为10、8、6、4,其范围例如为1~10、1~8、1~6、1~4。另外,在所述(A1)肽中,就所述下游区域的长度而言,氨基酸残基数的下限例如为1、2,其上限例如为10、8、6、4,其范围例如为1~10、1~8、1~6、1~4。就所述(A1)肽的长度而言,氨基酸残基数的下限例如为18、20,其上限例如为30、26、22,其范围例如为18~30、18~26、18~22。作为所述(A1)肽的具体例子,例如可列举由序列号2的氨基酸序列构成的肽JAL。在所述JAL的序列中,下划线部分相当于序列号3的BoxA。另外,在序列号2中,下划线部分的序列例如可置换为序列号44~48的任一序列。JAL(Tob1):序列号2KYEGHWYPEKPYKGSGFRCIHI所述(A2)的肽为由所述(A1)的部分区域构成的肽。就所述(A2)肽的长度而言,氨基酸残基数的下限例如为5、7、9,其上限例如为18、17、16,其范围例如为5~18、5~17、5~16。作为所述(A2)肽的具体例子,例如可列举由序列号1的肽构成的BoxA。另外,作为所述(A2)肽的具体例子,例如可列举由选自序列号3~14的至少一种氨基酸序列构成的肽。序列号3为BoxA,序列号4及10~14分别为由作为所述(A1)肽的序列号2的JAL(Tob1)的部分区域构成的肽,其中,序列号4及11~14为由序列号3的BoxA(TOB1)的部分区域构成的肽。另外,序列号5~9分别为由序列号1及3的BoxA的部分区域构成的肽。[表2]所述(A3)的肽为在所述(A1)或所述(A2)的氨基酸序列中,由1个或数个氨基酸被缺失、置换、增加及/或插入而成的氨基酸序列构成的、具有加水分解活性的肽。在所述(A3)中,对被缺失、置换、增加及/或插入的氨基酸残基的个数没有特别限定,例如为1~5个、1~3个、1个或者2个。就所述(A3)的肽而言,作为具体例子,可列举例如由序列号15~26和序列号50及53的氨基酸序列构成的肽。[表3]所述(A3)的肽作为具体例子可列举例如由序列号27~31的氨基酸序列构成的肽。在序列号27中,Xaa为W、L、V、N或D,在序列号28中,Xaa为K、V、T、Y或M,在序列号29中,Xaa为T、E、P、W或K,在序列号30中,Xaa为H、V、W、Y、R、L、P、M、E、A、D、Q、N、K或G,在序列号31中,Xaa为T、Q、V、K或E。[表4]所述(A4)的肽为由相对于所述(A1)或所述(A2)的氨基酸序列具有85%以上一致性的氨基酸序列构成的、具有加水分解活性的肽。所述一致性例如为90%以上、95%以上、96%以上、97%以上、98%以上、99%以上。一致性为对要比较的序列之间进行适当比对时的一致性程度,意为所述序列之间氨基酸的准确地一致的出现率(%)。就一致性而言,例如需要考虑序列中间隔的存在及氨基酸的性质。所述比对例如可通过利用任意算法进行,具体而言,可使用BLAST(Basiclocalalign-mentsearchtool)、BLAST-2、FASTA、Smith-Waterman、ALIGN、Megasalin等同源性检索软件。计算一致性例如可使用所述公知的同源性检索程序进行计算,就具体例子而言,例如在美国国立生物技术信息中心(NCBI)的同源性算法BLAST(http://www.ncbi.nlm.nih.gov/BLAST/)中,可以通过预设参数算出。关于一致性以下是同样的。作为本发明的催化性肽,接下来就所述(B1)~(B4)的肽进行说明。所述(B1)的肽为由Tob/BTG蛋白质的BoxB构成的肽。在所述(B1)肽中,对BoxB的氨基酸序列没有特别限定,例如可列举序列号32的氨基酸序列。在序列号32中,例如、Xaa1为V或L、Xaa2为Q、E、S或K、Xaa3为D或E、Xaa4为L或M、Xaa5为S或T、Xaa6为V、L或I、Xaa7为V或I、Xaa8为F、Y或C、Xaa9为E或R、Xaa10为S或C、Xaa11为Y或C、Xaa12为Q或R、Xaa13为I或Y。BoxB:序列号32[Xaa1]P[Xaa2][Xaa3][Xaa4][Xaa5][Xaa6]W[Xaa7]DP[Xaa8][Xaa9]V[Xaa10][Xaa11][Xaa12][Xaa13]GE就所述(B1)的序列号32的BoxB而言,作为具体例子例如可列举由序列号33~35的氨基酸序列构成的肽。[表5]BoxB序列序列号BTG1LPSELTLWVDPYEVSYRIGE33TOB1LPQDLSVWIDPFEVSYQIGE34BTG3LPKELTLWVDPCRVCCRYGE35所述(B2)的肽为由所述(B1)的部分区域构成的肽。就所述(B2)肽的长度而言,氨基酸残基数的下限例如为5、7、9,其上限例如为19、18、17,其范围例如为5~19、5~18、5~17。就所述(B2)的肽而言,作为具体例子例如可列举由序列号36~38的氨基酸序列构成的肽。[表6]所述(B3)的肽为在所述(B1)或(B2)的氨基酸序列中,由1个或者数个氨基酸被缺失、置换、增加及/或插入而成的氨基酸序列构成的、具有加水分解活性的肽。在所述(B3)中,对被缺失、置换、增加及/或插入的氨基酸残基数的个数没有特别限定,例如为1~5个、1~3个、1个或2个。所述(B4)的肽为由相对于所述(B1)或所述(B2)的氨基酸序列具有85%以上一致性的氨基酸序列构成的、具有加水分解活性的肽。所述一致性例如为90%以上、95%以上、96%以上、97%以上、98%以上、99%以上。作为本发明的催化性肽,接下来就所述(C1)~(C4)的肽进行说明。所述(C1)的肽为由Tob/BTG蛋白质中的C末端区域或者中间区域构成的肽。就所述(C1)肽而言,作为具体例子,例如可列举由序列号39~41的任一氨基酸序列构成的肽。[表7]所述(C2)的肽为由所述(C1)的部分区域构成的肽。就所述(C2)肽的长度而言,氨基酸残基数的下限例如为5、7、9,其上限例如为23、15、13,其范围例如为5~23、5~15、5~13。所述(C3)的肽为在所述(C1)或者所述(C2)的氨基酸序列中,由1个或数个氨基酸被缺失、置换、增加及/或插入而成的氨基酸序列构成的、具有加水分解活性的肽。在所述(C3)中,对被缺失、置换、增加及/或插入的氨基酸的残基的个数没有特别限定,例如为1~5个、1~3个、1个或者2个。就所述(C3)的肽而言,作为具体例子例如可列举由序列号42或43的氨基酸序列构成的肽。[表8]BTG3239-252P246A:DRNHWINAHMLAPH序列号42BTG3239-252P246AP251A:DRNHWINAHMLAAH序列号43所述(C4)的肽为由相对于所述(C1)或所述(C2)的氨基酸序列具有85%以上一致性的氨基酸序列构成的、具有加水分解活性的肽。所述一致性例如为90%以上、95%以上、96%以上、97%以上、98%以上、99%以上。通过本发明的催化性肽,例如可将作为底物的蛋白质或肽加水分解。对所述底物没有特别限定,例如可列举β淀粉样蛋白(Aβ)蛋白质或其片段肽、朊蛋白或其片段肽、hMMP7(人基质金属蛋白酶7)或其片段肽、SOD1(超氧化物歧化酶1)或其片段肽、TauMBD等Tau蛋白质或其片段肽、αA-晶体蛋白等晶体蛋白或其片段肽等。本发明的催化性肽也可用于例如凝集性蛋白质或其片段肽的加水分解。据报告β淀粉样蛋白、朊蛋白和SOD1会因凝集而分别成为阿尔茨海默症、克罗伊茨费尔特-雅各布病(CJD)或肌萎缩性脊髓侧索硬化症(ALS)的原因。但是尚未报告过能够分解这些凝集蛋白质的蛋白质酶。一方面,通过本发明的催化性肽能够分解例如凝集的β淀粉样蛋白和朊蛋白甚至SOD1等。因此,可以说本发明的催化性肽作为例如起因于凝集性蛋白质的阿尔茨海默症和克罗伊茨费尔特-雅各布病(CJD)甚至肌萎缩性脊髓侧索硬化症(ALS)等神经疾病的治疗药也是有用的。本发明的催化性肽可进一步具有例如自我分解的特性。在此情况下,作为上述治疗药物(医药)对生物体投药时,例如由于可边发挥催化功能边逐渐分解而安全性优异。<催化性肽试剂>如前所述,本发明的催化性肽试剂包含催化性分子并以所述催化性分子为所述本发明的催化性肽为特征。就本发明而言,作为催化性分子以包含所述本发明的催化性肽为特征,其他结构不受任何限制。本发明的催化性肽试剂例如进一步包含与所述催化性肽不同的分子,所述分子可连接于所述催化性肽。所述分子例如为对于分解目标的靶而言的结合分子。所述结合物质例如为蛋白质或肽,作为具体例子可列举配体等。在本发明的催化型肽试剂中,优选例如将与所述靶结合的结合分子连接于所述催化性肽上备用。通过该种形式,例如本发明的催化性肽试剂能够通过所述结合分子与所述靶结合,并通过所述催化性肽试剂的所述催化性肽分解所述靶。<分解方法>如上所述,本发明的分解方法为蛋白质或肽的分解方法,其特征在于,包括以所述本发明的催化性肽处理底物的工序,所述底物为蛋白质或肽。本发明以使用所述催化性肽为特征,其他工序及条件等不受任何限制。作为所述底物,可列举例如所述靶。对所述处理工序的条件没有特别限定,反应温度例如为室温~37℃、反应pH例如为6.5~8。另外,在所述处理工序中,例如可并存白蛋白(albumen)。对所述底物没有特别限定,可沿用上述记载。实施例[实施例1](1)加水分解活性的确认已经确认了合成肽JAL对来自hMMP7(人基质金属蛋白酶7)的前结构域的合成肽具有加水分解活性。使用下述JAL作为加水分解肽,使用hMMP742-50或者hMMP726-50作为底物。JAL9(Tob1):KYEGHWYPEKPYKGSGFRCIHIhMMP742-50:FYLYDSETKhMMP726-50:GMSELQWEQAQDYLKRFYLYDSETK首先,在缓冲液(Tris-HCl、pH6.5、最终浓度100mmol/L)中加入JAL(最终浓度0.2mmol/L)及hMMP7的片段肽(最终浓度0.05mmol/L),将该反应液在37℃下培养14天或16天。之后对所述反应液通过HPLC确认了JAL及hMMP7的片段肽的峰。HPLC通过以下条件进行。柱:SHISEIDOCAPCELLPAKC18MGII(4.6mmID.×150mm)温度:40℃波长:220nm浓度梯度:0.1%含有TFA0-70%CH3CN、15分钟检测器:Photodiode-array然后,在HPLC中,每20μL分离峰,并使用质谱法(ABIQSTARElitesystem公司)(以下称MS)进行片段的鉴定。MS使用流动注射分析法并通过以下条件进行。MS:正离子模式离子喷雾电压:3500-5500V离子源温度:140-400℃溶剂:0.1%含有HCOOH70%CH3CN另外,在以下试验中,如无特别说明,则按照同样的条件进行加水分解活性的测定。将该结果示于图1及图2中。图1为反应开始后0天及14天后的HPLC结果。如图1所示,从hMMP742-50及hMMP726-50的峰减少的情况来看,很明显JAL对hMMP742-50及hMMP726-50具有活性。另外,从JAL本身的峰变低的情况来看,可认为出现了自我分解。图2为根据从反应开始16天后的MS鉴定片段的结果,示出了分解而得的片段序列。如图2所示,所述底物在多个位点被切断。(2)最佳pH的研究使用JAL作为加水分解肽、使用hMMP71-42作为底物来研究活性的最适宜pH。除了将反应液的pH在pH3.5-8.0的范围内以0.5刻度调整pH并将反应液培养5天之外,与所述(1)同样地进行测定。就pH的调整而言,在pH3.5-6.0范围内使用醋酸缓冲液,在pH6.5-8.0的范围内使用Tris-HCL缓冲液,使最终浓度都为150mmol/L。其结果为在pH3.5-6.0间具有活性(图3)。另外,在pH6.5-8.0中,和反应开始后第0天的结果之间未观察到差异。hMMP71-42:MRLTVLCAVCLLPGSLALPLPQEAGGMSELQWEQAQDYLKRF(序列号49)[实施例2](1)加水分解活性的确认已经确认了JAL对来自SOD1(超氧化物歧化酶1)的片段肽具有加水分解活性。除了使用所述JAL作为加水分解肽、使用下述SOD12-38、SOD112-38、SOD153-70、SOD1115-154或SOD12-12作为底物且反应液的pH为6.5或7.5、反应的培养时间为0天、3天、4天之外,与所述实施例1(1)同样地进行加水分解活性的测定。SOD12-38:ATKAVCVLKGDGPVQGIINFEQKESNGPVKVWGSIKGSOD112-38:DGPVQGIINFEQKESNGPVKVWGSIKGSOD153-70:DNTAGCTSAGPHFNPLSRSOD1115-154:GRTLVVHEKADDLGKGGNEESTKTGNAGSRLACGVIGIAQSOD12-12:ATKAVCVLKGD将该结果示于图4及图5中。图4为反应开始后0天及3天后或4天后的HPLC结果。如图4所示,能够确认JAL对SOD12-38、SOD112-38、SOD153-70、SOD12-12的活性。特别是对SOD153-70、SOD12-38的活性较强。一方面,对SOD1115-154未观察到活性。图5为根据MS的片段鉴定结果。如图5所示,通过JAL,在SOD12-38及SOD12-12中,箭头所示的多个位点被切断。另外,在来自SOD12-38的片段肽断片中,能够观察到Cys残基之间的S-S结合。(2)缓冲液(反应液)的研究使用JAL作为加水分解肽、使用SOD12-38作为底物来研究反应液中使用的缓冲液。除了使用Tris缓冲液(Tris-HCl、pH6.5、最终浓度100mmol/L)、试验缓冲液(50mmol/LTris-HCl、pH7.5、150mmol/LNaCl、10mmol/LCa2+、5μmol/LZn2+、0.06%Briji35及0.02%NaN3)作为缓冲液,培养时间为0天、1天、3天之外,和所述(1)同样地进行测定。另外,作为对照组,替代所述缓冲液而使用了生理盐水(0.9w/v%)。该结果为,与Tris缓冲液相比,试验缓冲液能更早观察到由于JAL产生的切断(图6)。另外,在生理盐水中未观察到活性。因此,可认为使用缓冲液对JAL的加水分解活性是必要的。另外,可认为生理盐水例如适合保存使用时之前的JAL。(3)浓度的研究接下来,除了改变Tris缓冲液的浓度,培养时间为0天、1天、4天之外,与所述(2)同样地进行测定。该结果为可观察到仅在MilliQ水(0mmol/L)中没有活性,而在Tris缓冲液中不依赖浓度可观察到活性(图7)。(4)最适宜pH的研究接下来,使用JAL作为加水分解肽、使用SOD12-38作为底物来研究活性的最适宜pH。除了将反应液的pH在pH6.5-8.0的范围内以0.5刻度调整pH且培养时间为0天、1天之外,与上述(1)同样地进行测定。结果为在任一pH下都可观察到活性,未观察到各pH间的差异(图8)。因此,可认为在体内使用之际,不受局部pH变动的影响。(5)金属需求性的研究进一步地,使用JAL作为加水分解肽、使用SOD12-38作为底物研究活性的金属需求性。在反应液中添加的金属离子为Zn2+、Ca2+、Co2+、其组合。在各反应液中,就金属离子的浓度而言,Ca2+为10mmol/L、其他金属离子为5μmol/L。然后除了在反应液中添加/不添加金属离子且培养时间为0天、1天之外,和上述(1)同样地对各反应液进行测定。其结果为与金属的有无无关,具有活性,且未观察到金属离子(Zn2+、Co2+、Ca2+)的有无造成的差异(图9)。[实施例3]确认了JAL的变体具有加水分解活性。(1)对SOD12-38及SOD12-12的活性除了使用作为JAL变体的下述JAL7-22、JAL14-22、JAL1-22C19M或JAL7-22C19M作为加水分解肽,使用所述SOD12-38及SOD12-12作为底物之外,与所述实施例1(1)同样地进行加水分解活性的测定。由于包含于JAL中的Cys残基在反应中形成S-S结合而导致片段解析困难,JAL1-22C19M及JAL7-22C19M为将JAL1-22及JAL7-22的Cys残基置换为Met而得的。其结果为可在JAL7-22、JAL1-22C19M及JAL7-22C19M中观察到活性(图10)。JAL7-22:YPEKPYKGSGFRCIHIJAL14-22:GSGFRCIHIJAL1-22C19M:KYEGHWYPEKPYKGSGFRMIHIJAL7-22C19M:YPEKPYKGSGFRMIHI(2)对Aβ1-20的活性除了使用JAL作为加水分解肽,使用下述Aβ1-20作为底物之外,与所述(1)同样地进行活性的测定。其结果为JAL对Aβ1-20具有活性(图11)。Aβ1-20:序列DAEFRHDSGYEVHHQKLVFF(3)缓冲液(反应液)的研究使用JAL作为加水分解肽、使用Aβ1-20作为底物来进行缓冲液的研究。除了使用PBS、Tris缓冲液、磷酸缓冲液作为缓冲液且培养时间为0天、3天、5天之外,与所述(2)同样地进行测定。其结果为在PBS(pH7.4)及Tris缓冲液(50mmol/L、pH7.5)中可观察到活性(图12)。一方面,在磷酸缓冲液中未观察到活性。该情况显示出通过使用PBS及Tris缓冲液作为缓冲液能够充分得到JAL的活性。在以下的试验中,从适合体内投药的角度出发,使用PBS进行测定。(4)Tob/BTG的活性研究除了使用JAL(Tob1)7-22CM、JAL(Tob1)7-22、Tob27-22、BTG17-22、BTG27-22、BTG37-22或BTG47-22作为加水分解肽,使用Aβ1-20或Aβ11-29作为底物之外,与所述(1)同样地进行活性的测定。另外,添加人血清白蛋白(HSA、和光纯药公司制造、最终浓度0.025%)并测定活性的变化。JAL(Tob1)7-22CM:YPEKPYKGSGFRMIHITob27-22:YPEKPLKGSGFRCVHIBTG17-22:FPEKPCKGSGYRCIRIBTG27-22:FPEKPSKGSGYRCIRIBTG37-22:YPEKPSKGQAYRCIRVBTG47-22:HSDCPSKGQAFRCIRI将该结果示于图13中。在图13中,1-19、1-18等示出分解而得的片段区域。在各变体中,可观察到对Aβ1-20及Aβ11-29的活性。另外,色谱的比较结果是通过添加HSA而活性增强。(5)对来自PrP(人朊蛋白)的片段肽的活性接下来,使用下述PrP175-189作为底物进行各种肽的活性的测定。另外,在使用Tob27-22或BTG37-22作为加水分解肽的测定中,测定因HSA中进一步加入Cu2+而造成的活性变化。加水分解活性的测定与所述(1)同样地进行。其结果为可观察到Tob2、BTG1、BTG3、BTG4对PrP175-189的活性。另外,Tob27-22及BTG37-22即便加入Cu2+,也具有活性(图14)。在加入Cu2+的反应体系中,可观察到来自PrP175-189的片段断片的肽导致的S-S结合。PrP175-189:FVHDCVNITIKQHTV(6)对Aβ肽的活性接下来,除了使用各种JAL的变体作为加水分解反应肽,使用Aβ1-20或下述Aβ11-29作为底物之外,与所述(1)同样地进行活性的测定(图15)。其结果是JAL(Tob1)7-22C19M、JAL(Tob1)12-18、JAL(Tob1)12-18S15A、JAL(Tob1)14-18对Aβ1-20具有活性。另外,JAL(Tob1)7-22Y7AC19MI22A、JAL(Tob1)9-20C19M、JAL(Tob1)12-22C19MI22A、JAL(Tob1)12-20C19M、JAL(Tob1)12-20Y12AC19M对Aβ11-29具有活性。Aβ11-29:EVHHQKLVFFAEDVGSNKG(7)由抑制剂造成的对自我分解的影响接下来,使用各种JAL变体作为加水分解肽来研究自我分解的机理。在各种JAL变体的反应液中加入蛋白酶抑制剂(商品名RochecOmplete、Roche公司制造)进行反应。将1片所述蛋白酶抑制剂溶解于1mLMilliQ水中后,添加50μL。加水分解活性的测定与所述(1)同样地进行。其结果是在所测定的所有肽中,对自我分解均有阻碍(图16)。[实施例4]针对JAL的加水分解活性,研究反应条件。(1)有机溶剂的影响使用JAL1-22C19M作为加水分解肽,使用Aβ1-19作为底物来研究有机溶剂的影响。除了在反应液中分别加入DMSO、CH3OH或CH3CN使其各自的最终浓度为10%且培养时间为0天、3天、5天之外,和所述实施例1(1)同样地进行活性测定。其结果为,即便在反应液中加入DMSO,也能观察到JAL1-22C19M的活性(图17)。另一方面,加入CH3OH及CH3CN时未能观察到活性。这种情况显示出了通过将难溶性的肽在DMSO中溶解并使用,能够不影响JAL的分解活性而使用。在以下试验中,将难溶性的肽在DMSO中溶解并使用。(2)白蛋白的影响除了使用JAL7-22C19M作为加水分解肽,使用牛血清白蛋白(BSA、和光纯药社制造、最终浓度0.025%)或HSA(和光纯药、最终浓度0.025%)作为底物之外,与所述(1)同样地进行活性测定。其结果为HSA、BSA均未观察到由JAL导致的切断(图18)。一方面,通过将HSA、BSA加入反应液中,JAL7-22C19M的自我分解均增加了。从这种情况来看,可认为通过加入HSA及BSA,JAL7-22C19M的活性增强了。另外,从体内存在血清白蛋白的情况来看,可认为也适合体内使用。在以后的试验中,将HSA加入反应液中来测定JAL的加水分解活性。(3)由抑制剂造成的对自我分解的影响使用JAL7-22C19M作为加水分解肽来研究自我分解的机理。除了在JAL7-22C19M的反应液中加入HSA并进一步加入蛋白酶抑制剂(商品名RochecOmplete)、E64、抑肽酶、AEBSF、EDTA(0.4mmol/L)或胃蛋白酶抑制剂A之外,与所述(1)同样地进行活性测定。其结果为在加入了RochecOmplete及AEBSF的样本中,自我分解的片段消失了(图19)。(4)最佳浓度的研究使用JAL7-22C19M作为加水分解肽、使用Aβ1-19作为底物研究了加水分解肽的底物的最佳浓度。除了培养时间为0天、3天、5天之外,与所述(1)同样地进行活性测定。该结果示于图20中。在图20中,各天数的各个条从左开始示出加水分解肽的浓度0、0.05、0.1、0.2、0.4、0.8mmol/L(mM)的结果。如图20所示,在底物(Aβ1-19)和肽的比例为1:1(肽最终浓度:0.05mmol/L)的条件下和为1:4(肽最终浓度0.2mmol/L)的条件下,底物减少(上图)、分解物(Aβ1-18)(下图)增加。从该情况来看,可知在这些浓度比中,JAL7-22的活性强。另外,若肽的浓度高,则JAL7-22的活性下降。Aβ1-19:DAEFRHDSGYEVHHQKLVF(5)对Aβ各种片段的活性除了使用JAL12-20C19M作为加水分解肽,使用Aβ11-29作为底物外,与所述(1)同样地进行活性的测定。其结果是对Aβ11-29可观察到强活性(图21)。(6)蛋白酶种类的研究使用JAL12-20C19M作为加水分解肽、使用Aβ11-29作为底物来研究自我分解的机理。除了在JAL12-20C19M的反应液中加入蛋白酶抑制剂(商品名RochecOmplete或AEBSF)且以培养时间为0天、1天进行反应外,与所述(1)同样地进行活性的测定。其结果是作为丝氨酸蛋白酶抑制剂的AEBSF对自我分解有阻碍(图22)。从该情况来看可认为JAL可能为丝氨酸蛋白酶型肽。[实施例5]确认了JAL的变体对Aβ具有加水分解活性。(1)对Aβ的活性的研究在JAL14-18(序列GSGFR)中,能够确认与JAL同样的活性(实施例3(6)),因此合成JAL14-18和其变体并用作加水分解肽,进行活性的测定。使用Aβ1-20(上图)或Aβ11-29(下图)作为底物。活性的测定和所述实施1(1)同样地进行。其结果为GSGFR、GSGVR、GSGYR、DSGFR对Aβ1-20的活性强,GSGHR、GSGQR对Aβ11-29的活性强(图23)。从该结果可明确由于氨基酸1个残基的不同,底物特异性会变化。(2)对固体(不溶性)Aβ1-42的活性的研究除了使用JAL12-20C19M作为加水分解肽、使用合成的固体(不溶性)Aβ1-42作为底物且培养时间为0天、7天之外,和所述(1)同样地进行活性的测定。其结果可见由于JAL12-20C19M,作为不溶性固体的Aβ1-42被切断(图24)。从该结果可推测,对于在生物体内作为不溶性凝集体存在的Aβ1-42,分解也是可能的。(3)对可溶性Aβ的活性的研究除了使用JAL12-20C19M作为加水分解肽、使用购买的Aβ1-42(肽研究所制造)作为底物之外,与所述(1)同样地进行活性的测定。其结果为可观察到由于JAL12-20C19M,Aβ1-42被切断(图25)。[实施例6](1)BoxB的自我分解在BoxB中确认了自我分解。除了使用BoxB的BTG18-20或BoxB的Tob18-20作为加水分解肽并加入HSA,培养时间为0天、5天之外,和所述实施例(1)同样地进行活性的测定。其结果观察到示出自我分解的片段(图26)。(2)来自Tob1的中间区域的片段肽的自我分解除了使用Tob1198-221或Tob1221-236作为加水分解肽且培养时间为0天、5天之外,和所述(1)同样地进行活性的测定。其结果可观察到在Tob1221-236中示出自我分解的片段(图27)。(3)对Aβ的活性的研究除了使用Tob1198-221、Tob1221-236、BoxB的Tob18-20或BoxB的BTG18-20作为加水分解肽,使用Aβ11-29作为底物之外,与所述(1)同样地进行活性的测定。其结果在Tob1221-236、BoxB的BTG18-20中观察到活性(图28)。[实施例7]对于作为JAL变体的所述JAL1-22C19M的部分序列JAL-TA9,进行了各种性质的研究及结构解析。JAL1-22C19M:KYEGHWYPEKPYKGSGFRMIHIJAL-TA9:PYKGSGFRMI(序列号50)使用可溶性粉末Aβ42(标准样品、肽研究所制造)、作为其断片肽的Aβ1-20、Aβ11-29、可溶性Aβ28-42作为底物。就活性的测定而言,除了使用具有下述反应液组成1的反应液、将所述反应液在37℃下培养规定时间并将10μL所述反应液供至HPLC之外,和所述实施例1(1)同样地进行。在MS分析的情况下,将20μL所述反应液供至HPLC并分离峰后,进行MS分析。Aβ1-42:DAEFRHDSGYEVHHQKLVFFAEDVGSNKGAIIGLMVGGVVIAAβ1-20:DAEFRHDSGYEVHHQKLVFFAβ11-29:EVHHQKLVFFAEDVGSNKGAβ28-42:KGAIIGLMVGGVVIA[表9](反应液组成1)※DMSO在Aβ1-20及Aβ11-29的情况下添加使用Aβ42的结晶作为固体底物。活性的测定除了使用具有所述反应液组成2的反应液、将所述反应液在37℃下培养规定时间并将10μL所述反应液供至HPLC之外,与所述实施例1(1)同样地进行。在MS分析的情况下,将100μL所述反应液供至HPLC并分离峰之后,进行MS分析。(1)来自Aβ的片段(Aβ-F)(1-1)JAL-TA9对Aβ-F的活性将这些结果示于图29中。图29为所述反应液的HPLC结果,左侧为反应0时间的结果,右侧为反应一晚后的结果。如图29所示,已明确JAL-TA9分解了任一Aβ-F,并显示了对它们的活性。(1-2)鉴定对Aβ-F的切断点将这些结果示于图30中。图30为通过规定时间反应后的MS鉴定片段的结果,示出分解而得的片段序列。在图30中,“J”示出来自JAL-TA9的片段,“A”示出来自Aβ-F的片段。如图30所示,任一Aβ-F都在多个位点被切断。特别是就Aβ而言,对报告为凝集核的中间区域示出了强切断活性。(2)对Aβ1-20及Aβ11-29的反应速度以反应液中的Aβ-F浓度为0.05、0.2、0.4mmol/L,以反应时间为0、1小时进行HPLC。然后由Aβ-F的峰的减少率来求Km值。将这些结果示于图31中。图31为示出底物浓度和反应速度关系的图表。其结果可知与Aβ1-20相比,Aβ11-29对JAL-TA9的亲和性高。(3)Aβ42(3-1)JAL-TA9对Aβ42的活性使用所述标准样品和所述固体作为Aβ42。将这些结果示于图32中。图32为所述反应液的HPLC结果,左侧为固体Aβ42的结果,右侧为标准样品Aβ42的结果。如图32所示,已明确JAL-TA49分解了任一Aβ42,且示出对它们的活性。(3-2)鉴定对Aβ42的切断点将这些结果示于图33~36中。图33及图34为固体Aβ42的结果,图35及36为可溶性标准样品Aβ42的结果。在图33~36中“J”示出了来自JAL-TA9的片段,“A”示出来自Aβ42的片段。图33为根据固体Aβ42在规定时间反应后的MS鉴定片段的结果,图34为根据MS鉴定片段A5、A7、A8的结果。图35为根据可溶性标准样品Aβ42在规定时间反应后的MS鉴定片段的结果,图36为根据MS鉴定A1、A4片段的结果。可溶性标准样品Aβ42在反应3天的阶段出现了新的峰,且如图35及图36所示,在7天反应中,多个位点被切断。另外,确认其切断点时,特别是对Aβ而言,对报告为凝集核的中间区域示出了强切断活性。另外同样地,如图33及图34所示,对固体Aβ42也观察到活性。(4)JAL-TA9的自我分解(4-1)自我分解的确认对JAL-TA9,除了不添加底物外,同样地进行反应并确认了自我分解。将该结果示于图37中。如图37所示,已确认了JAL-TA9自我分解。(4-2)由抑制剂造成的对自我分解的影响就JAL-TA9而言,已确认了抑制剂对自我分解的影响。除了在所述反应液中添加蛋白酶抑制剂使得最终浓度为0mmol/L或6mmol/L之外,同样地测定活性。另外,就蛋白酶抑制剂而言,在所述实施例4(6)中,使用了示出抑制JAL12-22C19M自我分解的丝氨酸蛋白酶抑制剂AEBSF。将该结果示于图38中。在图38中,右边的图表为添加了丝氨酸蛋白酶的反应液的MS结果。如图38所示,通过添加AEBSF,抑制了自我分解。从该结果可认为JAL-TA9为丝氨酸蛋白酶型肽。基于所述(1)~(4)的结果,将Aβ42及来自Aβ的片段的切断点示于图39中。如图39所示,可知对Aβ42的中间区域示出了强切断活性。(5)JAL-TA9对Aβ42及Aβ-F的分子间相互作用就JAL-TA9对Aβ42及Aβ-F的分子间相互作用而言,使用AFFINXQNμ(商品名,initiun公司制造)并根据其协议进行了确认。将这些结果示于图40的图表中。在图40中,X为铂电极上未固定JAL-TA9的情况的结果,Y为铂电极上固定了JAL-TA9的情况的结果。如图40所示,JAL-TA9对Aβ11-29及Aβ42示出了强相互作用,这与切断的活性相关。(6)JAL-TA9的结构解析对JAL-TA9进行了NMR。将其结果示于图41中。另外,图42中示出了JAL-TA9的立体结构和活性部位。就JAL-TA9而言,由于LysHε和MetHγ及SerHβ和ArgHδ在空间上位置接近而非常紧凑,可推测具有丝氨酸蛋白酶型的立体结构。另外,JAL-TA9以羟基(Ser)为中心,由两个氨基(Gly)形成负氧离子孔(OxyanionHole),可推测丝氨酸蛋白酶型活性所需要的碱性氨基酸、羟基、C末端羰基存在于立体接近的位置。可理解为这种低分子的JAL-TA9对Aβ的低聚物侵入内部并从内部通过加水分解活性而进行分解。另外,本发明不限于这种推测。[实施例8]确认了由JAL-TA9造成的作为阿尔茨海默症的原因物质之一的Tau蛋白质的分解。(1)活性使用来自TauMBD(微管结合结构域)的片段(TauMBD1-30)作为底物。活性的测定除了使用具有下述反应液组成3的反应液、将所述反应液在37℃下培养规定时间后并将10μL所述反应液供至HPLC之外,与所述实施例1(1)同样地进行。在MS分析的情况下,将20μL所述反应液供至HPLC并分离峰后,进行MS分析。TauMBD1-30:GSKDNIKHVPGGGSVQIVYKPVDLSKVTSK(序列号51)[表10](反应液组成3)将这些结果示于图43中。图43为所述反应液的HPLC结果,左侧为反应0时间的结果,右侧为反应一晚后的结果。如图43所示,明确了JAL-TA9分解TauMBD1-30并示出活性。(2)鉴定切断点图44及图45为通过反应1天及5天后的MS鉴定片段的结果并示出了分解而得的片段序列。在图44及图45中,上图为使JAL-TA9和TauMBD1-30反应的结果,下图为在所述反应液中未添加JAL-TA9的结果。如图44(反应1天)的下图所示,已确认TauMBD1-30在不添加JAL-TA9的状态下分解。另外,如图44的上图所示,通过使JAL-TA9和TauMBD1-30反应,除了得到了和下图相同的TauMBD1-30的分解断片(9、11)和JAL-TA9的自我分解断片(1~5、7、8、12、13)之外,还得到了由于JAL-TA9而被切断的TauMBD1-30的断片(图中下划线所示出的6、10)。进一步,如图45(反应5天)所示,通过使JAL-TA9和TauMBD1-30反应,除了得到了和下图相同的TauMBD1-30的分解断片(12、13)和JAL-TA9的自我分解断片(1~6、9、10、14-16)之外,还得到了由于JAL-TA9而被切断的TauMBD1-30的断片(图中下划线所示出的4、7、8、11、13、14)。基于这些结果,将TauMBD1-30的切断点示于图46中。[实施例9]合成JAL-TA9的嵌合肽,并确认了对Aβ的活性。(1)Aβ11-29合成了将作为Aβ结合位点的a-AC肽结合至JAL-TA9的N末端的嵌合肽。使用作为Aβ42的断片肽的Aβ11-29作为底物。就活性的测定而言,除了使用具有下述反应液组成的反应液并将所述反应液在37℃下培养规定时间后,将10μL所述反应液供至HPLC以外,与所述实施例1(1)同样地进行。在MS分析的情况下,将反应6天后的所述反应液20μL供至HPLC并分离峰之后,进行MS分析。嵌合肽(Aβ结合位点AAJAL-TA9)FVIFLDVKHFSPEDLTVK-AA-YKGSGFRMI(序列号52)[表11](反应液组成)将这些结果示于图47中。图47为所述反应液的HPLC结果,左侧为添加底物的结果,右侧为未添加底物的结果。如图47所示,已明确所述嵌合肽分解了Aβ11-29并示出了活性。图48为根据反应6天后的MS鉴定片段的结果并示出了分解而得的片段序列。(2)Aβ42使用了Aβ42作为底物。就活性的测定而言,除了使用具有下述反应液组成的反应液并将所述反应液在37℃下培养规定时间后,将10μL所述反应液供至HPLC以外,和所述实施例1(1)同样地进行。在MS分析的情况下,将反应7天后的20μL所述反应液供至HPLC,并分离峰后进行MS分析。[表12](反应液组成)将这些结果示于图49中。图49为所述反应液的HPLC结果,左列为仅有底物的结果,正中间的一列为仅有嵌合肽的结果,右列为使底物和嵌合肽反应的结果。如图49所示,已明确所述嵌合肽从反应第1天开始分解了Aβ4211-29并示出了活性。图50及图51为根据反应7天后的MS鉴定片段的结果,示出分解而得的片段序列。在图50中,下划线的序列为由于嵌合肽而被切断的Aβ42的断片。图50中同时示出了由嵌合肽造成的Aβ42的切断点。[实施例10]对作为BoxA的BTG3(序列号47:HWYPEKPSKGQAYRCIRV)的部分序列的变体的ANA-TA9,确认了加水分解活性。以下将所述BTG3称为BTG/ANA。另外,将所使用的反应液组成示于图52中。ANA-TA9:SKGQAYRMI(序列号53)(1)自我分解将图52的反应液I在37℃下培养规定时间并通过HPLC确认ANA-TA9的自我分解。将该结果示于图53中。如图53所示,ANA-TA9示出了自我分解。图53同时示出了因自我分解而检测到的断片的序列。(2)Aβ-Fs的切断确认了对所述实施例7所示的Aβ-Fs的活性。反应液组成使用图52的反应液Ⅱ。将该结果示于图54中。在图54中,第一行示出了反应0小时、第二行示出了反应1天、第三行示出了反应5天的结果。如图54所示,ANA-TA9能够切断任一Aβ-Fs。在图54中,下划线的序列为由于ANA-TA9而被切断的Aβ-Fs的断片。(3)Aβ-42的切断确认了对所述实施例7所示的标准样品Aβ42的活性。反应液组成使用图52的反应液Ⅲ。将该结果示于图55及图56中。如图55及图56所示,ANA-TA9能够切断Aβ42。在图55中,下划线的序列为由于ANA-TA9而被切断的Aβ42的断片。(4)由蛋白酶抑制剂造成的影响使用图57所示的反应液Ⅳ,确认了由蛋白酶抑制剂造成的对ANA-TA9的自我分解的影响。图57中也同时示出了JAL-TA9的结果。在图57中,就各反应体系而言,上段为反应0小时的结果,下段为6小时的结果。如图57所示,ANA-TA9及JAL-TA9分别被蛋白酶抑制剂抑制了自我分解。[实施例11]对因ANA-TA9的自我分解出现的ANA-YA4(也称作YRMI),确认了加水分解活性。ANA-SA4:YRMI(序列号54)(1)Aβ1-20的切断将图52的反应液V在37℃下培养规定时间,确认ANA-YA4(YRMI)的自我分解和由于ANA-YA4造成的Aβ1-20的切断。该结果示于图58中。如图58所示,ANA-SA4自我分解并分解了Aβ1-20。图59中示出了反应1天的MS结果。在图59中,下划线的序列为由于ANA-YA4而被切断的Aβ1-20的断片。(2)Aβ11-29Aβ-F的切断将图52的反应液V在37℃下培养规定时间,确认ANA-YA4(YRMI)的自我分解和由于ANA-YA4造成的Aβ11-29的切断。将该结果示于图60中。如图60所示,ANA-SA4自我分解并分解了Aβ11-29。在图60中,下划线的序列为由于ANA-YA4而被切断的Aβ11-29的断片。图61中示出了反应1天的MS结果。在图61中,下划线的序列为由于ANA-YA4而被切断的Aβ11-29的断片。另外,在图61中示出了由ANA-YA4造成的Aβ11-29的切断点。[实施例12]对因ANA-TA9的自我分解出现的ANA-SA5,确认了加水分解活性。ANA-SA5:SKGQA(序列号55)将图52的反应液Ⅵ在37℃下培养规定时间,确认由于ANA-SA5造成的Aβ1-20、Aβ11-29的切断。将该结果示于图62中。如图62所示,ANA-SA4分解了Aβ1-20,且反应1天,峰减少至49.6%,5天基本消失。另外,如图63所示,在5天反应中,检测出12种Aβ1-20的断片。另外,如图62所示,ANA-SA4分解了Aβ11-29,且反应1天,峰减少至72%,5天基本消失。另外,如图64所示,在5天反应中,检测出13种Aβ11-29的断片。图63及图64同时示出了由ANA-SA5造成的Aβ-Fs的切断点。[实施例13]αA-晶体蛋白具有分子伴侣型活性而维持晶状体的透明性。另外,有报告称αA-晶体蛋白的71-88的肽会抑制β淀粉样蛋白的凝集,且该肽自身也凝集形成淀粉样纤维。因此,关于实施例7的JAL-TA9,确认了αA-晶体蛋白的分解活性。使用αA-晶体蛋白的71-88的下述序列的片段肽(由摄南大学合成)作为底物。就活性的测定而言,除了使用具有下述反应液组成的反应液并将所述反应液在37℃下培养规定时间后,将10μL所述反应液供至HPLC以外,和所述实施例1(1)同样地进行。在MS分析的情况下,将20μL所述反应液供至HPLC并分离峰后,进行MS分析。αA-晶体蛋白:FVIFLDVKHFSPEDLTVK(序列号56)[表13](反应液组成)将该结果示于图65中。如图65所示,JAL-TA9能够自我分解,另外,从反应1天开始能分解αA-晶体蛋白。另外,如图66所示,检测出了由于JAL-TA9而被切断的αA-晶体蛋白的断片。在图66中,下划线的序列为由于JAL-TA9而被切断的αA-晶体蛋白的断片。另外,图65中同时示出了αA-晶体蛋白的切断点。[实施例14]JAL-TA9来自Tob1的BoxA结构域。因此,对作为来自Tob1的BoxB结构域(序列号34)的肽(Tob1BoxB8-20:WIDPFEVSYQIGE)进行了活性的测定。使用和所述实施例7同样的Aβ1-20、Aβ11-29作为底物。就活性的测定而言,除了使用具有下述反应液组成的反应液之外,与所述实施例7同样地进行。[表14](反应液组成)(1)对Aβ-F的活性将这些结果示于图66中。图66为所述反应液的HPLC结果。如图66所示,已明确Tob1BoxB8-20与来自BoxA的肽同样会分解Aβ-F并对其示出活性。(2)鉴定对Aβ-F的切断点将这些结果示于图67及68中。图67及68为通过MS鉴定片段的结果,示出了分解而得的片段序列。在各图中,下划线的序列示出了来自Aβ-F的片段。如图67及68所示,任一Aβ-F都在多个位点被切断了。[实施例15]对于JAL12-17(YKGSGF)及12-16(YKGSG),确认了自我分解及对Aβ-F的活性。就活性的测定而言,除了使用具有下述反应液组成的反应液之外,与所述实施例7同样地进行。使用了与所述实施例7相同的Aβ11-29作为底物。就自我分解而言,除了未添加底物之外,同样地进行了反应。[表15](反应液组成)将这些结果示于图69及70中。两图为所述反应液的HPLC结果。如两图所示,已经确认了JAL12-17及JAL12-16都能自我分解及分解Aβ-F。另外,图71中,作为反应3天后通过MS鉴定片段的结果,示出了分解而得的片段序列。图71为自我分解的结果,图72为分解Aβ-F的结果。如图71的上图所示,在JAL12-16中,可见JAL12-14(P2)的增加,如图71的下图所示,在JAL12-17中,可见JAL13-17(P5)的增加。图72中,作为通过MS鉴定片段的结果,示出了分解而得的片段序列。在图72中,下划线的序列示出了来自Aβ-F的片段。如图72所示,在JAL12-17及JAL12-16任一者中,对Aβ-F的切断点都相同。以上参照实施方式及实施例解释了本发明,不过本发明不受上述实施方式及实施例的限定。本发明的结构和具体内容在本发明的范围内能够进行本领域技术人员所能理解的各种变形。本申请主张以2016年1月6日申请的美国专利临时申请US62/275,599以及2016年3月30日申请的日本专利申请2016-068496为基础的优先权,其公开的全部内容都将纳入本文中。产业上利用的可能性通过本发明的催化性肽能够催化加水分解反应。本发明的催化性肽由于与酶蛋白不同,为分子量小的肽,因此能够作为与所述蛋白质不同的新型催化分子适用于加水分解反应。序列表<110>OkinawaInstituteofScienceandTechnologyGraduateUniversity<120>新肽及其用途<130>TF15112WO<150>US62/275,599<151>2016-01-06<150>JP2016-068496<151>2016-03-30<160>56<170>SIPOSequenceListing1.0<210>1<211>18<212>PRT<213>人工序列(artificialsequence)<400>1HisTrpXaaXaaXaaXaaProXaaLysGlyXaaXaaXaaArgCysXaa151015XaaXaa<210>2<211>22<212>PRT<213>人工序列(artificialsequence)<400>2LysTyrGluGlyHisTrpTyrProGluLysProTyrLysGlySerGly151015PheArgCysIleHisIle20<210>3<211>18<212>PRT<213>人工序列(artificialsequence)<400>3HisTrpTyrProGluLysProTyrLysGlySerGlyPheArgCysIle151015HisIle<210>4<211>16<212>PRT<213>人工序列(artificialsequence)<400>4TyrProGluLysProTyrLysGlySerGlyPheArgCysIleHisIle151015<210>5<211>16<212>PRT<213>人工序列(artificialsequence)<400>5TyrProGluLysProLeuLysGlySerGlyPheArgCysValHisIle151015<210>6<211>16<212>PRT<213>人工序列(artificialsequence)<400>6PheProGluLysProCysLysGlySerGlyTyrArgCysIleArgIle151015<210>7<211>16<212>PRT<213>人工序列(artificialsequence)<400>7PheProGluLysProSerLysGlySerGlyTyrArgCysIleArgIle151015<210>8<211>16<212>PRT<213>人工序列(artificialsequence)<400>8TyrProGluLysProSerLysGlyGlnAlaTyrArgCysIleArgVal151015<210>9<211>16<212>PRT<213>人工序列(artificialsequence)<400>9HisSerAspCysProSerLysGlyGlnAlaPheArgCysIleArgIle151015<210>10<211>17<212>PRT<213>人工序列(artificialsequence)<400>10TyrGluGlyHisTrpTyrProGluLysProTyrLysGlySerGlyPhe151015Arg<210>11<211>7<212>PRT<213>人工序列(artificialsequence)<400>11TyrLysGlySerGlyPheArg15<210>12<211>5<212>PRT<213>人工序列(artificialsequence)<400>12LysGlySerGlyPhe15<210>13<211>5<212>PRT<213>人工序列(artificialsequence)<400>13GlySerGlyPheArg15<210>14<211>9<212>PRT<213>人工序列(artificialsequence)<400>14GlySerGlyPheArgCysIleHisIle15<210>15<211>7<212>PRT<213>人工序列(artificialsequence)<400>15LysGlySerGlyPheArgMet15<210>16<211>22<212>PRT<213>人工序列(artificialsequence)<400>16LysTyrGluGlyHisTrpTyrProGluLysProTyrLysGlySerGly151015PheArgMetIleHisIle20<210>17<211>16<212>PRT<213>人工序列(artificialsequence)<400>17TyrProGluLysProTyrLysGlySerGlyPheArgMetIleHisIle151015<210>18<211>16<212>PRT<213>人工序列(artificialsequence)<400>18TyrProAlaLysProTyrLysGlySerGlyPheArgMetIleHisIle151015<210>19<211>16<212>PRT<213>人工序列(artificialsequence)<400>19TyrTrpAlaLysProTyrLysGlySerGlyPheArgMetIleHisIle151015<210>20<211>16<212>PRT<213>人工序列(artificialsequence)<400>20AlaProGluLysProTyrLysGlySerGlyPheArgMetIleHisAla151015<210>21<211>16<212>PRT<213>人工序列(artificialsequence)<400>21AlaProGluAlaProTyrLysGlySerGlyPheArgMetIleHisAla151015<210>22<211>12<212>PRT<213>人工序列(artificialsequence)<400>22GluLysProTyrLysGlySerGlyPheArgMetIle1510<210>23<211>11<212>PRT<213>人工序列(artificialsequence)<400>23TyrLysGlySerGlyPheArgMetIleHisAla1510<210>24<211>9<212>PRT<213>人工序列(artificialsequence)<400>24TyrLysGlySerGlyPheArgMetIle15<210>25<211>9<212>PRT<213>人工序列(artificialsequence)<400>25AlaLysGlySerGlyPheArgMetIle15<210>26<211>7<212>PRT<213>人工序列(artificialsequence)<400>26TyrLysGlyAlaGlyPheArg15<210>27<211>5<212>PRT<213>人工序列(artificialsequence)<400>27XaaSerGlyPheArg15<210>28<211>6<212>PRT<213>人工序列(artificialsequence)<400>28GlyXaaSerGlyPheArg15<210>29<211>5<212>PRT<213>人工序列(artificialsequence)<400>29GlySerXaaPheArg15<210>30<211>5<212>PRT<213>人工序列(artificialsequence)<400>30GlySerGlyXaaArg15<210>31<211>5<212>PRT<213>人工序列(artificialsequence)<400>31GlySerGlyPheXaa15<210>32<211>20<212>PRT<213>人工序列(artificialsequence)<400>32XaaProXaaXaaXaaXaaXaaTrpXaaAspProXaaXaaValXaaXaa151015XaaXaaGlyGlu20<210>33<211>20<212>PRT<213>人工序列(artificialsequence)<400>33LeuProSerGluLeuThrLeuTrpValAspProTyrGluValSerTyr151015ArgIleGlyGlu20<210>34<211>20<212>PRT<213>人工序列(artificialsequence)<400>34LeuProGlnAspLeuSerValTrpIleAspProPheGluValSerTyr151015GlnIleGlyGlu20<210>35<211>20<212>PRT<213>人工序列(artificialsequence)<400>35LeuProLysGluLeuThrLeuTrpValAspProCysArgValCysCys151015ArgTyrGlyGlu20<210>36<211>13<212>PRT<213>人工序列(artificialsequence)<400>36TrpValAspProTyrGluValSerTyrArgIleGlyGlu1510<210>37<211>13<212>PRT<213>人工序列(artificialsequence)<400>37TrpIleAspProPheGluValSerTyrGlnIleGlyGlu1510<210>38<211>13<212>PRT<213>人工序列(artificialsequence)<400>38TrpAsnAspProCysArgValCysCysArgTyrGlyGlu1510<210>39<211>24<212>PRT<213>人工序列(artificialsequence)<400>39SerAsnLysValAlaArgThrSerProIleAsnLeuGlyLeuAsnVal151015AsnAspLeuLeuLysGlnLysAla20<210>40<211>16<212>PRT<213>人工序列(artificialsequence)<400>40AlaIleSerSerSerMetHisSerLeuTyrGlyLeuGlyLeuGlySer151015<210>41<211>14<212>PRT<213>人工序列(artificialsequence)<400>41AspArgAsnHisTrpIleAsnProHisMetLeuAlaProHis1510<210>42<211>14<212>PRT<213>人工序列(artificialsequence)<400>42AspArgAsnHisTrpIleAsnAlaHisMetLeuAlaProHis1510<210>43<211>14<212>PRT<213>人工序列(artificialsequence)<400>43AspArgAsnHisTrpIleAsnAlaHisMetLeuAlaAlaHis1510<210>44<211>18<212>PRT<213>人工序列(artificialsequence)<400>44HisTrpTyrProGluLysProLeuLysGlySerGlyPheArgCysVal151015HisIle<210>45<211>18<212>PRT<213>人工序列(artificialsequence)<400>45HisTrpPheProGluLysProCysLysGlySerGlyTyrArgCysIle151015ArgIle<210>46<211>18<212>PRT<213>人工序列(artificialsequence)<400>46HisTrpPheProGluLysProSerLysGlySerGlyTyrArgCysIle151015ArgIle<210>47<211>18<212>PRT<213>人工序列(artificialsequence)<400>47HisTrpTyrProGluLysProSerLysGlyGlnAlaTyrArgCysIle151015ArgVal<210>48<211>18<212>PRT<213>人工序列(artificialsequence)<400>48HisTrpHisSerAspCysProSerLysGlyGlnAlaPheArgCysIle151015ArgIle<210>49<211>42<212>PRT<213>人工序列(artificialsequence)<400>49MetArgLeuThrValLeuCysAlaValCysLeuLeuProGlySerLeu151015AlaLeuProLeuProGlnGluAlaGlyGlyMetSerGluLeuGlnTrp202530GluGlnAlaGlnAspTyrLeuLysArgPhe3540<210>50<211>10<212>PRT<213>人工序列(artificialsequence)<400>50ProTyrLysGlySerGlyPheArgMetIle1510<210>51<211>30<212>PRT<213>人工序列(artificialsequence)<400>51GlySerLysAspAsnIleLysHisValProGlyGlyGlySerValGln151015IleValTyrLysProValAspLeuSerLysValThrSerLys202530<210>52<211>29<212>PRT<213>人工序列(artificialsequence)<400>52PheValIlePheLeuAspValLysHisPheSerProGluAspLeuThr151015ValLysAlaAlaTyrLysGlySerGlyPheArgMetIle2025<210>53<211>9<212>PRT<213>人工序列(artificialsequence)<400>53SerLysGlyGlnAlaTyrArgMetIle15<210>54<211>4<212>PRT<213>人工序列(artificialsequence)<400>54TyrArgMetIle1<210>55<211>5<212>PRT<213>人工序列(artificialsequence)<400>55SerLysGlyGlnAla15<210>56<211>18<212>PRT<213>人工序列(artificialsequence)<400>56PheValIlePheLeuAspValLysHisPheSerProGluAspLeuThr151015ValLys当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1