一种针对尿路上皮癌的尿脱落肿瘤细胞微流控芯片检测技术的制作方法
本发明属于生物体液体外检测领域,具体涉及一种针对尿路上皮癌的尿脱落肿瘤细胞微流控芯片检测技术。
背景技术:
1、临床现役技术-尿脱落细胞学检查:尿脱落细胞学检查(Cytology)是目前临床上普遍使用的尿路上皮癌检测方法。为寻找肿瘤细胞,该方法依赖病理医生对涂片进行主观观察(针对细胞的细胞核、染色质、胞浆等因素对细胞进行判断),主要有以下缺点:
(1)检测敏感度低,一般只有30-50%。
(2)阅片完全依赖于病理医生的主观经验,不同病理医生之间的判断结果或不一致。
(3)染色过程繁琐,人工参与度大、工作强度大。细胞染色效果受人员经验、熟练度的影响。
2、临床现役技术-膀胱镜、输尿管软镜检查
膀胱镜、输尿管软镜检查是目前临床诊断尿路上皮癌的金标准。其通过导管将窥镜经尿道传送至目标区域,对可疑占位进行成像、观察。但仍具有如下缺陷:
(1)属于侵入式检查,患者所承受的痛苦大;
(2)肿瘤发展到肉眼可见时才能被观察到,不利于早期诊断.
3、其他在研技术-基于微滤膜的尿液细胞检查
为克服传统尿脱落细胞学检查敏感度低的缺点,一些研究组使用微滤膜来检测尿脱落肿瘤细胞。相较于传统尿脱落细胞学检查,该方法利用滤膜过滤的原理捕获尿脱落细胞,敏感度略有提升,但仍具有以下缺陷:
(1)捕获到细胞后,仍仅采用传统的病理学染色方法(巴氏染色),该方法如同临床现役的尿脱落细胞学检查,高度依赖病理科医生,受主观因素的制约;
(2)该滤膜的滤孔口径单一,为7.5um;然而尿路上皮癌患者尿液中的细胞成分复杂,除了肿瘤细胞,还有正常脱落的尿路上皮细胞、白细胞、红细胞等,这些细胞尺寸均不一致,若使用单一孔径,仍将导致视野中细胞成分混乱,干扰后续的判断分析;
(3)无法对细胞的捕获过程进行实时成像、监测、调控,例如:(a)在细胞量过剩导致滤膜堵塞的情况下,无法及时终止进程;(b)在流速过高导致细胞破损严重的情况下,无法实时控制流速;
(4)受最大载荷量的限制,当细胞数量过高,所有滤孔均被占据,该滤膜随即失效;随后而来的细胞将全部堵塞于滤膜,导致视野混乱,难以进行下一步细胞层面的判读。
技术实现要素:
为了克服现有技术中所存在的问题,本发明的目的在于提供一种针对尿路上皮癌的尿脱落肿瘤细胞微流控芯片检测技术。
为了实现上述目的以及其他相关目的,本发明采用如下技术方案:
本发明的第一方面,提供了一种微流控芯片,包括依次连接的样本入口、细胞捕获区域以及样本出口,所述细胞捕获区域设有多个细胞分选器,所述细胞分选器由三个整体呈弧形排布的柱状凸起构成,柱状凸起之间存在间隙,弧形开口作为液流入口,中间柱状凸起两侧的间隙作为液流出口,两个液流出口呈对称分布。
优选地,所述细胞捕获区域设有三种不同尺寸规格的细胞分选器,分别为第一尺寸细胞分选器、第二尺寸细胞分选器和第三尺寸细胞分选器,所述第一尺寸细胞分选器、第二尺寸细胞分选器和第三尺寸细胞分选器的尺寸依次减小。
优选地,相邻的细胞分选器尺寸不同。
优选地,所述微流控芯片包括多个细胞分选单元,每个所述细胞分选单元由一个第一尺寸细胞分选器、一个第二尺寸细胞分选器和一个第三尺寸细胞分选器组成。
优选地,位于同一行的细胞分选单元中各尺寸细胞分选器的排布方式相同。
优选地,横向相邻的细胞分选器,边距相同。
优选地,横向依次等边距排列的一个第一尺寸细胞分选器、一个第二尺寸细胞分选器和一个第三尺寸细胞分选器组成一个第一细胞分选单元;横向依次等边距排列的一个第一尺寸细胞分选器、一个第三尺寸细胞分选器和一个第二尺寸细胞分选器组成一个第二细胞分选单元;多个第一细胞分选单元横向循环排布构成第一细胞分选阵列,多个第二细胞分选单元横向循环排布构成第二细胞分选阵列,相互平行的一个第一细胞分选阵列和一个第二捕获阵列组成一个细胞分选二级阵列,细胞捕获区域中多个相互平行的细胞分选二级阵列纵向等边距循环排布。
优选地,在每个细胞分选二级阵列中,第二细胞分选阵列的第一尺寸细胞分选器的液流入口的中点与对应第一细胞分选阵列的第三尺寸细胞分选器和第二尺寸细胞分选器横向边距的中点对齐。
优选地,各奇数行细胞分选二级阵列的首行首列细胞分选器纵向位置对齐;各偶数行细胞分选二级阵列较相邻的前一奇数行细胞分选二级阵列向右侧等距偏移。
优选地,第一尺寸细胞分选器的液流入口的宽度为60±5μm,液流出口的宽度为22±5μm;第二尺寸细胞分选器的液流入口的宽度为30±3μm,液流出口的宽度为10±3μm;第三尺寸细胞分选器的液流入口的宽度为16μ±1m,液流出口的宽度为4±1μm。
本发明的第二方面,提供前述微流控芯片的制备方法,包括:按照聚二甲基硅氧烷标准工艺,采用常规载玻片作为基底,通过等离子处理键合,制备获得微流控芯片。
本发明的第三方面,提供了前述微流控芯片用于捕获或回收尿脱落细胞的用途。
优选地,所述尿脱落细胞中含有尿脱落肿瘤细胞。
优选地,所述尿脱落细胞中含有尿路上皮癌细胞。所述上皮癌包括膀胱癌、输尿管癌、肾盂癌。
本发明的第四方面,提供了一种捕获或回收尿脱落细胞的方法,包括步骤:将待处理的尿液样本或者尿沉渣的悬浮液,通入本发明的微流控芯片。
优选地,所述尿脱落细胞中含有尿脱落肿瘤细胞。
优选地,所述尿脱落细胞中含有尿路上皮癌细胞。所述上皮癌包括膀胱癌、输尿管癌、肾盂癌。
本发明的第五方面,提供一种巴氏染色方法,包括步骤:先用本发明的微流控芯片捕获和分选尿脱落细胞,然后将捕获的尿脱落细胞进行巴氏染色。
与现有技术相比,本发明具有如下有益效果:
针对目前尿路上皮癌临床诊断中存在的敏感度低、依赖病理医生的主观判断、有创、低效等问题,本发明所提供的微流控芯片可依据物理尺寸差异实现人尿液中各类细胞的分离捕获、并可兼容多种下游细胞学染色方法以实现细胞识别。该技术提高了人尿液中的尿脱落肿瘤细胞的检测准确度,摆脱了常规方法对于病理医生主观经验的依赖,且全程无创。此外,其无损的细胞捕获、回收方式为下游的分子生物学分析奠定了基础。
附图说明
图1:微流控芯片结构及基本原理示意图。
图2:细胞分选器的结构示意图。
图3:不同尺寸的细胞分选器依据细胞尺寸差异分级捕获细胞原理示意图。
图4:微流控芯片细胞捕获区中细胞分选单元示意图。
图5:微流控芯片细胞捕获区中细胞捕获阵列示意图。
图6:本发明微流控芯片捕获到的尿脱落细胞,比例尺:20μm。
图7:微流控芯片捕获到的尿脱落肿瘤细胞的免疫荧光图像:DAPI+、CK20+、CD44v6+。
图8:尿路上皮癌尿脱落细胞微流检测技术所得的ROC曲线。
图9:经巴氏染色后的细胞:(a-b)细胞团(c)核异型(d)细胞异型(e)高核质比(f)正常尿路上皮细胞(比例尺:20μm)。
图10:利用本发明微流控芯片捕获、回收的6个尿脱落细胞进行单细胞测序,并分析其CNV情况。
元件标号说明
1-1 样本入口
1-2 细胞捕获区域
1-3 样本出口
2 细胞分选器
201 柱状凸起
202 液流入口
203 液流出口
2-1 第一尺寸细胞分选器
2-2 第二尺寸细胞分选器
2-3 第三尺寸细胞分选器
3 细胞分选单元
3-1 第一细胞分选单元
3-2 第二细胞分选单元
4 细胞分选二级阵列
4-1 第一细胞分选阵列
4-2 第二细胞分选阵列
具体实施方式
一、微流控芯片
本发明的微流控芯片的结构及原理示意图可参见图1。具体地,所述微流控芯片,包括沿液流方向A依次连接的样本入口1-1、细胞捕获区域1-2以及样本出口1-3。待处理的液体样本如尿液,从样本入口1-1进入微流控芯片,细胞捕获区域1-2是目标细胞的捕获与分选的核心区域,途径细胞捕获区域1-2时目标细胞如尿脱落细胞B在分选的过程中被捕获,剩余液体从样本出口1-3流出微流控芯片。
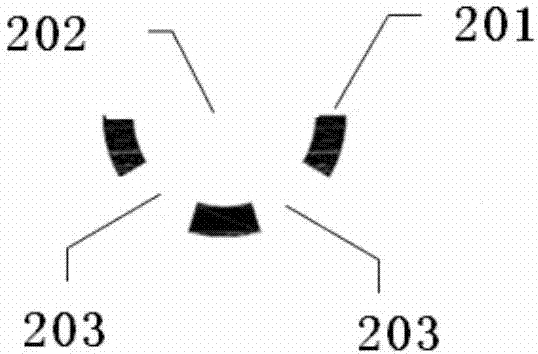
为了适用于目标细胞如尿脱落细胞的分选与捕获,细胞捕获区域1-2设有多个细胞分选器2,如图2所示,所述细胞分选器2由三个整体呈弧形排布的柱状凸起201构成,柱状凸起之间存在间隙,弧形开口202作为液流入口,中间柱状凸起两侧的间隙203作为液流出口,两个液流出口呈对称分布。
进一步地,各细胞分选器的底部呈弧状,有助于最大程度保持细胞形态完整,该设计是一种适应于回收被捕获细胞的优化设计。在回收所捕获的细胞时,缓冲液会从反向流入芯片(从样本出口1-3方向流向样本入口1-1方向),当细胞被冲出原细胞分选器时,将遇到前方众多的其他细胞分选器。此时,因细胞分选器的底部为弧形,细胞便更容易绕过细胞分选器而被顺利回收,从而大大降低了细胞受到的物理损伤。
进一步地,如图3所示,为了依据细胞尺寸差异分级捕获细胞细胞,捕获区域1-2设有三种不同尺寸规格的细胞分选器2,分别为第一尺寸细胞分选器2-1、第二尺寸细胞分选器2-2和第三尺寸细胞分选器2-3,第一尺寸细胞分选器2-1、第二尺寸细胞分选器2-2和第三尺寸细胞分选器2-3的尺寸依次减小。相邻的细胞分选器尺寸不同,在整个细胞捕获区域1-2内营造紊乱的液流环境。因此,液体样本中的目标细胞,如尿脱落细胞随机流经各个不同尺寸规格的细胞分选器,当小尺寸的细胞进入大尺寸细胞分选器后,会从大尺寸细胞分选器底部的两个液流出口,并随着液流继续往前行,直到遇到尺寸相匹配的细胞分选器而被捕获。所以,不同尺寸的细胞只被对应尺寸的细胞分选器捕获,可针对性地捕获不同大小的目标细胞如尿脱落细胞。小尺寸细胞不会占据大尺寸细胞分选器的空间,大幅提高了各细胞分选器的利用率。本发明的一些实施方式中列举了:第一尺寸细胞分选器2-1的液流入口的宽度为60±5μm,两个液流出口的宽度均为22±5μm,可捕获直径在22~60μm范围内的细胞(或细胞团)。第二尺寸细胞分选器2-2的液流入口的宽度为30±3μm,两个液流出口的宽度均为10±3μm,可捕获直径在10~22μm范围内的细胞。第三尺寸细胞分选器2-3的液流入口的宽度为16μ±1m,两个液流出口的宽度均为4±1μm,可捕获直径在4~10μm范围内的细胞。尿液中的细胞普遍比血液中大,且常常存在细胞团的情况,针对尿液细胞特定设计的三种不同尺寸规格的细胞分选器,可避免出现细胞团的缺陷。
如图4所示,所述捕获区域1-2包括多个细胞分选单元3,每个所述细胞分选单元3由一个第一尺寸细胞分选器2-1、一个第二尺寸细胞分选器2-2和一个第三尺寸细胞分选器2-3组成。进一步地,位于同一行的细胞分选单元中各尺寸细胞分选器的排布方式相同。横向相邻的细胞分选器,边距d1相同。本发明的一些实施例中,列举了横向相邻的细胞分选器之间的边距d1为60±3μm,该尺寸允许尿液中可能出现的其他杂质顺利通过,避免了芯片的堵塞。即便是当患者尿液中有大量的细胞而将微流控芯片内所有细胞分选器均已被占据时,60±3μm的间距也能允许过剩的细胞通过,从而避免了传统滤膜法中视野混乱的问题。
如图5所示,横向依次等边距排列的一个第一尺寸细胞分选器2-1、一个第二尺寸细胞分选器2-2和一个第三尺寸细胞分选器2-3组成一个第一细胞分选单元3-1;横向依次等边距排列的一个第一尺寸细胞分选器2-1、一个第三尺寸细胞分选器2-3和一个第二尺寸细胞分选器2-2组成一个第二细胞分选单元3-2;多个第一细胞分选单元3-1横向循环排布构成第一细胞分选阵列4-1,多个第二细胞分选单元3-2横向循环排布构成第二细胞分选阵列4-2,相互平行的一个第一细胞分选阵列和一个第二捕获阵列组成一个细胞分选二级阵列4,细胞捕获区域中多个相互平行的细胞分选二级阵列纵向等边距循环排布。
进一步地,在每个细胞分选二级阵列4中,第二细胞分选阵列4-2的第一尺寸细胞分选器2-1的液流入口的中点与对应第一细胞分选阵列4-1的第三尺寸细胞分选器2-2和第二2-3尺寸细胞分选器横向边距的中点对齐。
进一步地,各奇数行细胞分选二级阵列的首行首列细胞分选器纵向位置对齐;各偶数行细胞分选二级阵列较相邻的前一奇数行细胞分选二级阵列向右侧等距偏移。有助于营造紊乱、随机的液流环境,避免细胞沿单一路径取向,从而提升微流控芯片的捕获效率。
流经本发明的前述微流控芯片的所有目标细胞如尿脱落细胞将以同等概率遭遇各级细胞分选器,从而达到“依据细胞尺寸差异分级捕获细胞”的目的。当细胞可以依据尺寸差异被分别捕获开来,则观察视野更整洁、细胞形态更清晰,有利于下一步针对细胞形态的分析判读(如现今临床通用的尿脱落细胞学检查)。
二、微流控芯片的制备方法
可按照聚二甲基硅氧烷(PDMS)标准工艺,采用常规载玻片作为基底,通过等离子处理键合,来制备本发明的微流控芯片。
PDMS是聚二甲基硅氧烷的英文缩写。聚二甲基硅氧烷属于固化型聚合物,固化型聚合物与固化剂混合后,经过一段时间可固化变硬得到一定结构的微流控芯片。
三、微流控芯片的用途
本发明的微流控芯片可用于捕获或回收尿脱落细胞。
四、捕获或回收尿脱落细胞的方法
本发明的捕获或回收尿脱落细胞,包括步骤:(1)捕获:待处理的尿液样本或者尿沉渣的悬浮液,在注射泵的推动下由样本入口进入本发明的微流控芯片,细胞被捕获于微流控芯片内,废液从样本出口流出;(2)回收:磷酸盐缓冲液在注射泵的推动下由样本出口进入本发明的微流控芯片,沿着与细胞捕获过程相反的方向流动,所回收的细胞从样本入口流出。
五、微流控芯片内原位巴氏染色方法
本发明的巴氏染色方法,包括步骤:先用本发明的微流控芯片捕获和分选尿脱落细胞,然后将捕获的尿脱落细胞进行微流控芯片内原位巴氏染色。所述微流控芯片内原位巴氏染色可采用现有技术中的方法。
本发明的一些实施方式中例举了:微流控芯片内原位巴氏染色详细步骤为:
(1)在注射泵的控制下,浓度为95%的酒精以0.5-4ml/h的流速通过捕获有尿脱落细胞的微流控芯片,维持15min;
(2)在注射泵的控制下,洁净清水以0.5-4ml/h的流速通过微流控芯片,维持1min;
(3)在注射泵的控制下,苏木素染液以0.5-4ml/h的流速通过微流控芯片,维持3min;
(4)在注射泵的控制下,洁净清水以0.5-4ml/h的流速通过微流控芯片,维持1min;
(5)在注射泵的控制下,碳酸锂溶液以0.5-4ml/h的流速通过微流控芯片,维持30s;
(6)在注射泵的控制下,洁净清水以0.5-4ml/h的流速通过微流控芯片,维持1min;
(7)在注射泵的控制下,EA-OG溶液以0.5-4ml/h的流速通过微流控芯片,维持3min;
(8)在注射泵的控制下,浓度为95%的酒精以0.5-4ml/h的流速通过微流控芯片,维持1min;
(9)在注射泵的控制下,无水酒精以0.5-4ml/h的流速通过微流控芯片,维持1min;
(10)镜下观察。
六、微流控芯片内原位免疫荧光染色方法
本发明的免疫荧光染色方法,包括步骤:先用本发明的微流控芯片捕获和分选尿脱落细胞,然后将捕获的尿脱落细胞进行微流控芯片内原位免疫荧光染色。所述微流控芯片内原位免疫荧光染色可采用现有技术中的方法。
本发明的一些实施方式中例举了:微流控芯片内原位免疫荧光染色详细步骤为:
(1)在注射泵的控制下,多聚甲醛以0.5~4ml/h的流速通过捕获有尿脱落细胞的微流控芯片,维持30min;
(2)在注射泵的控制下,PBS以0.5~4ml/h的流速通过所述微流控芯片,维持3-5min;
(3)在注射泵的控制下,浓度为0.1%的Triton X-100溶液以0.5~4ml/h的流速通过所述微流控芯片,维持10min;
(4)在注射泵的控制下,PBS以0.5~4ml/h的流速通过所述微流控芯片,维持3-5min;
(5)在注射泵的控制下,BSA溶液以0.5~4ml/h的流速通过所述微流控芯片,维持30min;
(6)在注射泵的控制下,抗-CK20一抗(abcam,ab76126)、抗-CD44v6一抗(abcam,ab78960)混合溶液以0.5ml/h的流速通过所述微流控芯片,维持60min;
(7)在注射泵的控制下,PBS以0.5~4ml/h的流速通过微流控芯片,维持3-5min;
(8)在注射泵的控制下,CK20对应二抗(Invitrogen,A11070)、CD44v6对应二抗(abcam,ab150116)、DAPI(Invitrogen,MP01306)混合溶液以0.5ml/h的流速通过所述微流控芯片,维持30min;
(9)在注射泵的控制下,PBS以0.5~4ml/h的流速通过所述微流控芯片,维持3-5min;
(10)在注射泵的控制下,最后,在荧光显微镜对应波长的激发光下,寻找CK20、CD44v6、DAPI三者同时阳性的细胞,为尿脱落肿瘤细胞。
本发明的优势在于(1)经微流控芯片捕获的细胞依据尺寸差异而分布开来,使得观察视野清晰,方便病理医师阅片(2)所用试剂由微流注射泵控制,染色时间精确、染色过程自动化。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。下列实施例中未注明具体条件的试验方法,通常按照常规条件,或者按照各制造商所建议的条件。
当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组DNA技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见Sambrook等MOLECULAR CLONING:A LABORATORY MANUAL,Second edition,Cold Spring Harbor Laboratory Press,1989and Third edition,2001;Ausubel等,CURRENT PROTOCOLS IN MOLECULAR BIOLOGY,John Wiley&Sons,New York,1987and periodic updates;the series METHODS IN ENZYMOLOGY,Academic Press,San Diego;Wolffe,CHROMATIN STRUCTURE AND FUNCTION,Third edition,Academic Press,San Diego,1998;METHODS IN ENZYMOLOGY,Vol.304,Chromatin(P.M.Wassarman and A.P.Wolffe,eds.),Academic Press,San Diego,1999;和METHODS IN MOLECULAR BIOLOGY,Vol.119,Chromatin Protocols(P.B.Becker,ed.)Humana Press,Totowa,1999等。
实施例1微流控芯片捕获尿脱落细胞
如图1~5所示,本发明的微流控芯片,包括沿液流方向A依次连接的样本入口1-1、细胞捕获区域1-2以及样本出口1-3。细胞捕获区域1-2设有多个细胞分选器2,如图2所示,所述细胞分选器2由三个整体呈弧形排布的柱状凸起201构成,柱状凸起之间存在间隙,弧形开口202作为液流入口,中间柱状凸起两侧的间隙203作为液流出口,两个液流出口呈对称分布。细胞捕获区域1-2设有三种不同尺寸规格的细胞分选器2,分别为第一尺寸细胞分选器2-1、第二尺寸细胞分选器2-2和第三尺寸细胞分选器2-3,第一尺寸细胞分选器2-1、第二尺寸细胞分选器2-2和第三尺寸细胞分选器2-3的尺寸依次减小。其中,第一尺寸细胞分选器2-1的液流入口的宽度为60μm,两个液流出口的宽度均为22μm,可捕获直径在22~60μm范围内的细胞。第二尺寸细胞分选器2-1的液流入口的宽度为30μm,两个液流出口的宽度均为10μm,可捕获直径在10~22μm范围内的细胞。第三尺寸细胞分选器2-3的液流入口的宽度为16μm,两个液流出口的宽度均为4μm,可捕获直径在4~10μm范围内的细胞。相邻的细胞分选器尺寸不同,在整个细胞捕获区域1-2内营造紊乱的液流环境。
所述捕获区域1-2包括多个细胞分选单元3,每个所述细胞分选单元3由一个第一尺寸细胞分选器2-1、一个第二尺寸细胞分选器2-2和一个第三尺寸细胞分选器2-3组成。进一步地,位于同一行的细胞分选单元中各尺寸细胞分选器的排布方式相同。横向相邻的细胞分选器,边距d1相同,均为60μm。横向依次等边距排列的一个第一尺寸细胞分选器2-1、一个第二尺寸细胞分选器2-2和一个第三尺寸细胞分选器2-3组成一个第一细胞分选单元3-1;横向依次等边距排列的一个第一尺寸细胞分选器2-1、一个第三尺寸细胞分选器2-3和一个第二尺寸细胞分选器2-2组成一个第二细胞分选单元3-2;多个第一细胞分选单元3-1横向循环排布构成第一细胞分选阵列4-1,多个第二细胞分选单元3-2横向循环排布构成第二细胞分选阵列4-2,相互平行的一个第一细胞分选阵列和一个第二捕获阵列组成一个细胞分选二级阵列4,细胞捕获区域中多个相互平行的细胞分选二级阵列纵向等边距(d3=120μm)循环排布。
各奇数行细胞分选二级阵列的首行首列细胞分选器纵向位置对齐;各偶数行细胞分选二级阵列较相邻的前一奇数行细胞分选二级阵列向右侧等距(d2=50μm)偏移。按次规律,直至填满总长度和总宽度均为6000μm的微流控芯片捕获区域1-2。
按照聚二甲基硅氧烷(PDMS)标准工艺,采用常规2.5*7.5cm载玻片作为基底,通过等离子处理键合,来制备本发明的微流控芯片。
在注射泵的控制下,待处理的尿液样本或者尿沉渣的PBS(磷酸盐缓冲液)悬浮液,从样本入口1-1进入微流控芯片,途径细胞捕获区域1-2时尿脱落细胞被捕获,剩余液体从样本出口1-3流出微流控芯片。液体样本中的尿脱落细胞B随机流经各个不同尺寸规格的细胞分选器,不同尺寸的尿脱落细胞B被对应尺寸的细胞分选器2捕获。因此,不同尺寸的细胞在芯片内部规则分布开来,视野清晰,细胞形态完好,特别适用于下一步的分析。
实施例2免疫荧光法判定尿脱落肿瘤细胞
尿脱落细胞被实施例1中的微流控芯片捕获后,如图6所示,不同尺寸的细胞在芯片内部规则分布开来,视野清晰,细胞形态完好,特别适用于下一步的分析。
本实施例通过免疫荧光法来区别尿脱落肿瘤细胞与正常尿路上皮细胞。
免疫荧光染色步骤:多聚甲醛以0.5~4ml/h的流速通过捕获有尿脱落细胞的微流控芯片,维持30min;PBS以0.5~4ml/h的流速通过所述微流控芯片,维持3-5min;浓度为0.1%的Triton X-100溶液以0.5~4ml/h的流速通过所述微流控芯片,维持10min;PBS以0.5~4ml/h的流速通过所述微流控芯片,维持3-5min;BSA溶液以0.5~4ml/h的流速通过所述微流控芯片,维持30min。抗-CK20一抗(abcam,ab76126)、抗-CD44v6一抗(abcam,ab78960)混合溶液以0.5ml/h的流速通过所述微流控芯片,维持60min;PBS以0.5~4ml/h的流速通过微流控芯片,维持3-5min;CK20对应二抗(Invitrogen,A11070)、CD44v6对应二抗(abcam,ab150116)、DAPI(Invitrogen,MP01306)混合溶液以0.5ml/h的流速通过所述微流控芯片,维持30min;PBS以0.5~4ml/h的流速通过所述微流控芯片,维持3-5min。
最后,在荧光显微镜对应波长的激发光下,寻找CK20、CD44v6、DAPI三者同时阳性的细胞,为尿脱落肿瘤细胞。如图7所示。
具体地,CK20:激发波长450nm-480nm,发射波长515nm;CD44v6:激发波长515nm-585nm,发射波长610nm;DAPI:激发波长330nm-385nm,发射波长420nm。
实施例3本发明的检测准确率
为了验证本发明的准确率,我们收集了50位确诊的尿路上皮癌患者、13位非癌症志愿者的尿液采用上述实施例2中的方法进行检测。寻找CK20、CD44v6、DAPI三者同时阳性的细胞,为尿脱落肿瘤细胞。基于所有案例尿液中所检测到肿瘤细胞数目绘制ROC曲线(如图8所示),得本发明的敏感度为:88.9%;特异度为:76.9%,ROC曲线下面积为0.808。
此外,我们也实施了与临床现役尿脱落细胞学检查的一对一比较。共采集17位尿路上皮癌确诊患者的尿液,其中一半尿液送往医院病理科进行尿脱落细胞学检查,另外一半尿液送往实验室采用本发明上述实施例2中的方法进行检测。寻找CK20、CD44v6、DAPI三者同时阳性的细胞,为尿脱落肿瘤细胞。结果为:17例确诊患者中,传统尿脱落细胞学检查呈阳性(包含疑似病例)的仅4例,准确率23.5%;而本发明在17位患者中检测出了15例阳性结果,准确率88.2%。详见下表1所示:
表1:本发明与传统尿脱落细胞学检查的比较
N:阴性;S:疑似;P:阳性
实施例4巴氏染色法判定尿脱落肿瘤细胞
在尿脱落肿瘤细胞的判定方面,本发明除了可使用上述免疫荧光法,还兼容传统的病理学染色法。在捕获到细胞后进行芯片内巴氏染色,所用试剂与流程和临床用巴氏染色法一致。染色后可清晰呈现细胞形态,以供病理医生阅片。如下图9所示。
实施例5回收细胞进行单细胞测序
对肿瘤细胞进行分子层面的分析具有巨大的临床价值,也充分体现了精准医疗的理念。本发明的一大优势为:可无损捕获、回收单个尿脱落肿瘤细胞,从而为下游的单细胞测序打下基础。我们使用本发明上述实施例1中的微流控芯片捕获并回收了一位尿路上皮癌患者的6个尿脱落细胞(1个正常尿路上皮细胞、5个肿瘤细胞),然后对该6个细胞分别进行单细胞测序,最后分析其拷贝数变异(CNV)情况。
如图10结果显示,肿瘤细胞均如预期出现了拷贝数紊乱的情况,而正常尿路上皮细胞的拷贝数则符合正常的二倍体特征。
这个例子充分证明了本发明可以高效地捕获并回收单个尿脱落细胞,全过程对目标细胞的损伤极小,可以衔接下游一系列的分子分析手段,因此具有重大价值与潜力。
以上所述,仅为本发明的较佳实施例,并非对本发明任何形式上和实质上的限制,应当指出,对于本技术领域的普通技术人员,在不脱离本发明方法的前提下,还将可以做出若干改进和补充,这些改进和补充也应视为本发明的保护范围。凡熟悉本专业的技术人员,在不脱离本发明的精神和范围的情况下,当可利用以上所揭示的技术内容而做出的些许更动、修饰与演变的等同变化,均为本发明的等效实施例;同时,凡依据本发明的实质技术对上述实施例所作的任何等同变化的更动、修饰与演变,均仍属于本发明的技术方案的范围内。
- 还没有人留言评论。精彩留言会获得点赞!