一种人血浆蛋白α1‑抗胰蛋白酶的分离纯化方法与流程
本发明涉及分离纯化技术领域,具体地,涉及一种人血浆蛋白α1-抗胰蛋白酶的分离纯化方法。
背景技术:
科技飞速发展的21世纪,血液制品行业已成为生物医药产业的重要组成部分。目前血浆来源的血液制品(血浆蛋白药物)主要有白蛋白、免疫球蛋白、凝血因子、蛋白酶抑制剂四大类,欧美的血液制品企业可以从血浆中获取超过20种的血浆蛋白药物。然而,受人才、技术、临床认知水平等因素制约,国内的血液制品企业最多只能获得7-8种,且主要是基于低温乙醇沉淀工艺分离提纯的产品,包括人血白蛋白、免疫球蛋白和凝血因子ⅷ产品等。目前国内主要提纯血浆蛋白药物仍基于cohn等人二十世纪四十年代发明的低温乙醇法,通过调节乙醇浓度、盐浓度、温度和ph,依靠血浆蛋白的溶解度不同来分离,此方法虽然程序简单、溶剂价廉,适用于工业化生产,并能有效保持蛋白的活性,但有较大的局限性,主要可分离血浆中含量较高的蛋白(如白蛋白和免疫球蛋白),对含量较少的蛋白(如α1-抗胰蛋白酶等)则很难提纯。
α1-抗胰蛋白酶(α1-antitrypsin,aat),又称α1-蛋白抑制酶(α1-proteaseinhibitor,α1-pi)。它是人类血浆中最重要的蛋白抑制剂,占血浆总蛋白酶抑制能力的90%以上。它能抑制多种丝氨酸内切肽酶,如中性粒细胞弹性蛋白酶、胰蛋白酶、凝血酶等,其主要作用是保护机体正常细胞和器官不受蛋白酶的损伤,抑制感染和炎症,维持机体内环境的平衡。血浆中的aat主要是由肝脏合成的单链糖蛋白,肽链由394个氨基酸组成,总含糖量12~14%,它的分子量为~52kd,等电点(pi)为4.7~5.0,正常人血浆中aat的含量为(2.9±0.45)g/l,在体内的半衰期为3~5天。aat具有较强的血管通透性,在肺组织中的浓度较高,而且对弹性蛋白酶的专一性更强,因此,aat的主要功能是抑制肺弹性蛋白酶的活性,使肺部不受弹性蛋白酶的酶解损伤,保护肺部。临床上,aat制剂可以用来治疗先天或后天性aat缺乏所致肺气肿、急性肺损伤、囊性纤维化、成人呼吸紧迫综合症等疾病,在临床上具有较高的应用价值。
先天性aat缺乏症患者15%-25%需要替代治疗,意味着美国约2万人需要治疗,而欧洲至少约4万4至7万3千人需要治疗。替代性治疗病人每周需按60mgaat/kg体重进行静脉注射,每年每人需要约208gaat。然而用于治疗用的aat全部是来源于人血浆,来源的限制导致全球aat供不应求,而且我国还不具备成熟的aat分离纯化技术。因此,开发aat分离纯化技术,提高收率、蛋白活性以及纯度显得尤为重要。
从人血浆中分离纯化aat的方法繁多,主要是层析法与沉淀等其他方法共同使用,其中的层析方法包括离子交换层析、凝胶过滤层析、疏水作用层析和亲和层析法[11-14]。下面列举几个具有代表性的aat纯化方法方法。glaser等人上个世纪80年代利用aat的半胱氨酸残基并未在肽键内形成二硫键这个特性,将cohn法fiv-1沉淀溶解液经1,4-二硫苏糖醇处理,再经50%硫酸铵沉淀后,用含半胱氨酸的缓冲液透析除去硫酸铵,用deae-cellulose离子交换层析进一步纯化得到的aat,经透析冻干得到aat浓缩制剂,没有病毒灭活。其纯度约为70%,产率约为45%(glaser,c.b.etal.anal.biochem.1982,124,364-371.)。hein和coan等人利用cohn法fiv-1沉淀废弃物出发,经过peg沉淀和弱阴离子交换层析得到aat,但此法得到的aat纯度只有60%左右,回收率为45%(hein,r.h.etal.eur.respir.j.suppl.1990,9,16-20.coan,m.h.etal.vox.sang,1985,48,333-342.)。这两种方法得到的aat纯度和活性不高,而且回收率较低。alphatherapeuticcorporation从cohnfiv-1悬浮液出发,经过peg沉淀和zncl2沉淀,病毒灭活后再进行阴离子交换层析,aat洗脱液通过超滤、无菌过滤和冻干即可得到aat制剂,此为aralast制剂的生产工艺(hwang,d.s.etal.1997,us5616693.),制品中α1-at特异活性为每毫克总蛋白功能性aat≥0.55mg,纯度≥90%,并于2003年11月获准上。cslbehring公司先用还原剂1,4-二流苏糖醇(dtt)和气溶性硅胶处理cohnfiv-1悬浮液,再经过阴离子交换树脂层析和疏水树脂层析、60℃10h灭活病毒和两步连续的纳米膜过滤去除病毒,除菌过滤分装冻干等步骤,所生产的α-at特异活性为每毫克总蛋白功能性aat≥0.70mg,纯度≥90%,单体(hplc)>95%,于2003年8月获准上市(cook,p.i.etal.2011,ep2295126a1.)。kumpalume等报到了从nitchman和kistler低温乙醇法的组分a+1上清中,使用一个阴离子交换柱和两个金属螯合柱分离纯化人α1-at,结果α1-at的回收率大于60%,纯度大于90%,并且在无任何稳定剂的情况下,生产的α1-at在4℃下可稳定12个月(kumpalume,p.etal.j.chromatogr.a2007,1148,31-37.)。我国上海生物制品研究生朱威等人对cohnfiv抽提液经过peg、等电点沉淀和有机溶剂沉淀后,作病毒灭活处理,然后用离子交换凝胶进行吸附,再经过分子筛层析,可制备得到aat(朱威等,中国生物制品学杂志,2001,14(2),97-101.)。综合以上的aat制备方法可以看出,目前aat的制备方法存在以下问题:(1)纯度及活性低、回收率低,尽管纯度及活性能够达到要求,也是以牺牲回收率为代价,三者不能同时达到最优。(2)大部分方法中都对fiv-1溶解液进行前期沉淀或者吸附除杂蛋白处理,增加了操作步骤和成本,降低回收率。(3)有些方法使用了昂贵或者不易规模化方法的层析方式。如金属离子螯合层析中金属螯合层析柱昂贵,而且易发生金属泄漏。凝胶过滤层析则在处理量以及后续规模化生产上存在一定缺点。因此,寻求一种可以得到高活性高纯度以及高回收率aat的高效分离纯化方法显得非常重要。
技术实现要素:
本发明的目的是为了克服现有技术的上述不足,提供一种人血浆蛋白α1-抗胰蛋白酶的分离纯化方法。本发明从低温乙醇-cohn法分离血浆蛋白工艺产生的fiv-1蛋白沉淀废弃物出发,主要经过一步阴离子交换层析和一步阳离子交换层析,即可分离纯化出高纯度高活性高回收率的α1-抗胰蛋白酶。本发明制备出的α1-抗胰蛋白酶具有高纯度、高活性、高回收率、步骤简单、重复性好以及易规模化生产的特点,解决了目前其生产工艺中存在的问题。
为了实现上述目的,本发明是通过以下技术方案予以实现的:
一种人血浆蛋白α1-抗胰蛋白酶的分离纯化方法,包括如下步骤:
(1)将低温乙醇-cohn法分离血浆蛋白工艺产生的fiv-1蛋白沉淀溶解于缓冲液中,待蛋白充分溶解完,过滤,取滤液备用;
(2)滤液经过阴离子交换层析,收集含aat的洗脱液,所述阴离子交换层析的填料为deaesepharosehighperformance;
(3)含aat的洗脱液进行干热灭活和s/d灭活,得到灭活后的含aat洗脱液;
(4)灭活后的含aat洗脱液经过阳离子交换层析,得到高纯度高活性的aat穿透液,所述阳离子交换层析的填料为macro-prephighs;
(5)aat穿透液经过超滤浓缩、除菌过滤和分装冻干,即可得到aat制剂。
作为优选实施方式,步骤(1)所述的缓冲液为ph7.0-9.0,10-100mm磷酸盐缓冲液或tris-hcl缓冲液,溶解温度为20-45℃,溶解时间为5-10h,利于fiv-1沉淀中aat的复性。
作为优选实施方式,步骤(2)所述阴离子交换层析使用的缓冲液ph为6.5-9.0,缓冲液类型为10-100mmtris-hcl缓冲液或磷酸盐缓冲液。
作为优选实施方式,步骤(4)所述阳离子交换层析使用的缓冲液ph为4.5-6.0,缓冲液类型为10-100mm柠檬酸或磷酸盐缓冲液。
一种人血浆蛋白α1-抗胰蛋白酶的分离纯化方法,包括如下步骤:
(1)fiv-1沉淀的溶解:将低温乙醇-cohn法分离血浆蛋白工艺产生的fiv-1蛋白沉淀溶解于ph7.0-9.0、10-100mmtris-hcl缓冲液或磷酸盐缓冲液中,搅拌5-10h,温度范围为20-45℃,待蛋白充分溶解完,过滤,取滤液备用;
(2)阴离子交换层析:取阴离子交换凝胶悬浮液,室温放置达到温度平衡后装柱,用平衡缓冲液平衡5-8个柱体积,将fiv-1沉淀溶解液的滤液ph调至与平衡缓冲液相同,再进行上样,上样体积为1-5个柱体积,用洗脱缓冲液进行洗脱,收集含aat的洗脱液,层析结束后,用5-8个柱体积的0.5mnaoh清洗柱子,然后用5-8个柱体积的20%乙醇水溶液平衡柱子,整个层析过程在geäktaexplore100蛋白纯化仪上进行;所述阴离子交换层析的填料为deaesepharosehighperformance;
(3)病毒灭活:将含aat的阴离子交换层析洗脱液进行冻干,冻干的过程如下:先在空气氛围总中-25℃保持2-4h,再-40℃2-4h,然后在真空条件下,-10℃保持30-40h,升温至35℃再保持20-30h,冻干好的样品再于80℃干热病毒灭活72h,干热灭活后的样品再次溶解于水中,加入蔗糖稳定aat,最终浓度为30-40%,然后加入磷酸三正丁酯和吐温-80进行s/d灭活,最终浓度分别为0.2-0.4%和0.1-0.3%,30℃灭活3-5h后,进行过滤和透析,透析后调节溶液ph与下一步的阳离子交换层析平衡缓冲液的ph相同;
(4)阳离子交换层析:取阳离子交换凝胶悬浮液,室温放置达到温度平衡后装柱,用平衡缓冲液平衡5-8个柱体积,将病毒灭活后的透析液ph调至与起始平衡缓冲液相同,再进行上样,上样体积为1-5个柱体积,用缓冲液进行洗脱,收集aat的流穿液,层析结束后,用5-8个柱体积的0.5mnaoh清洗柱子,然后用5-8个柱体积的20%乙醇水溶液平衡柱子,整个层析过程在geäktaexplore100蛋白纯化仪上进行;所述阳离子交换层析的填料为macro-prephighs;
(5)超滤、除菌过滤、分装、冻干:将阳离子交换层析的aat流穿液超滤浓缩,蛋白浓度为10-50mg/ml,之后进行除菌过滤、分装冻干;冻干过程:先在空气氛围总中-25℃保持2-4h,再-40℃2-4h,然后在真空条件下,-10℃保持30-40h,升温至35℃再保持20-30h,冻干完成后,即制备出aat制剂。
与现有技术相比,本发明具有如下有益效果:
首先,本发明制备出的α1-抗胰蛋白酶具有高纯度、高活性和高回收率。纯度≥95%,比活≥0.9,每步层析回收率≥90%,解决了目前aat制备方法中纯度、活性和回收率低的缺点。其次,本发明制备α1-抗胰蛋白酶的步骤简单,主要有两步离子交换层析,没有大部分方法中对fiv-1溶解液进行前期沉淀或者吸附除杂蛋白处理等步骤,具有操作简单和成本低等优点。再次,本发明中的层析方式为阴离子交换层析和阳离子交换层析,具有易放大,且填料易得等优点。
附图说明
图1是本发明aat分离纯化的路线图。
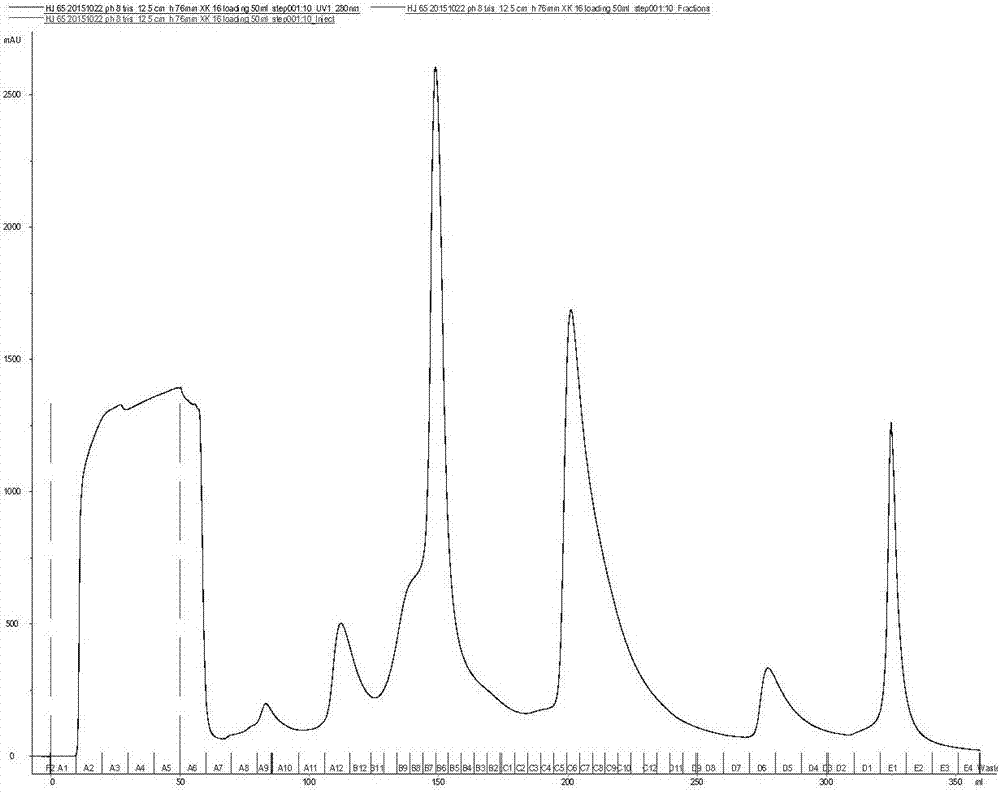
图2是fiv-1溶解滤液的阴离子交换层析图。
图3是病毒灭活后的阳离子交换层析图。
图4是aat分离纯化过程的sds-page图。
具体实施方式
下面结合说明书附图和具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
实施例1
1.fiv-1沉淀的溶解:称取1gfiv-1沉淀溶解于10ml20mmph7.5磷酸盐缓冲液中,充分混合,于摇床上室温溶解5h。溶解结束后,用0.45μm针筒式滤膜过滤,取滤液备用。
2.阴离子交换层析:取35ml20%乙醇保存的deaesepharosehighperformance凝胶,用水反复置换,去除乙醇,放置达到温度平衡后用xk16/20装柱。以下层析过程都在geäktaexplore100蛋白纯化仪上进行。装柱完成后,柱高为13.2cm,用1%丙酮测其柱效为4865n/m。测完柱效后,柱子用水平衡5个柱体积,再用起始平衡缓冲液20mmph7.0磷酸盐缓冲液平衡5个柱体积。将fiv-1沉淀溶解液的滤液15ml调ph至7.0。以10个柱体积达到20mmph7.0磷酸盐缓冲液+0.1mnacl的线性梯度进行洗脱,收集含aat的洗脱液。洗脱结束后,用5个柱体积的0.5mnaoh清洗柱子,洗去未洗脱的结合蛋白。再用5个柱体积的20%乙醇溶液平衡柱子保存。此步阴离子交换层析得到的aat洗脱液纯度为65%,比活为0.59,回收率为98%。
3.病毒灭活:在进行第二步层析前,含aat的洗脱液需经过两步病毒灭活,干热灭活和s/d灭活。首先,将含aat的阴离子交换层析洗脱液进行冻干,冻干的过程如下:先在空气氛围总中-25℃保持2-4h,再-40℃2-4h。然后在真空条件下,-10℃保持30-40h,升温至35℃再保持20-30h。冻干好的样品再于80℃干热病毒灭活72h。干热灭活后的样品再次溶解于水中,加入蔗糖稳定aat,最终浓度为35%。然后加入磷酸三正丁酯和吐温-80进行s/d灭活,最终浓度分别为0.3%和0.2%,30℃灭活3-5h后,进行过滤和透析。透析后调节溶液ph与下一步的阳离子交换层析平衡缓冲液的ph相同。
4.阳离子交换层析:取30ml20%乙醇保存的macro-prephighs凝胶,用水反复置换,去除乙醇,放置达到温度平衡后用xk16/20装柱。以下层析过程都在geäktaexplore100蛋白纯化仪上进行。装柱完成后,柱高为12cm,用1%丙酮测其柱效为4102n/m。测完柱效后,柱子用水平衡5个柱体积,再用起始平衡缓冲液20mmph5.5柠檬酸缓冲液平衡5个柱体积。将病毒灭活后的aat洗脱液调ph至5.5。上样量为15ml,以10个柱体积达到20mmph5.5柠檬酸缓冲液+0.1mnacl的线性梯度进行洗脱,其中aat在穿透液中,收集穿透液。洗脱结束后,用5个柱体积的0.5mnaoh清洗柱子,洗去未洗脱的结合蛋白。再用5个柱体积的20%乙醇溶液平衡柱子保存。此步阳离子交换层析得到的aat穿透液中aat纯度为96%,比活为0.93,回收率为91%。
5.超滤、除菌过滤、分装、冻干:将阳离子交换层析的aat流穿液超滤浓缩,蛋白浓度为15mg/ml,之后进行除菌过滤、分装冻干。冻干过程:先在空气氛围总中-25℃保持2-4h,再-40℃2-4h。然后在真空条件下,-10℃保持30-40h,升温至35℃再保持20-30h。冻干完成后,即制备出aat制剂。
实施例2
1.fiv-1沉淀的溶解:称取1gfiv-1沉淀溶解于10ml20mmph8.0磷酸盐缓冲液中,充分混合,于摇床上35℃溶解5h。溶解结束后,放至室温,用0.45μm针筒式滤膜过滤,取滤液备用。
2.阴离子交换层析:取35ml20%乙醇保存的deaesepharosehighperformance凝胶,用水反复置换,去除乙醇,放置达到温度平衡后用xk16/20装柱。以下层析过程都在geäktaexplore100蛋白纯化仪上进行。装柱完成后,柱高为13.2cm,用1%丙酮测其柱效为4865n/m。测完柱效后,柱子用水平衡5个柱体积,再用起始平衡缓冲液20mmph8.0磷酸盐缓冲液平衡5个柱体积。以10个柱体积达到20mmph8.0磷酸盐缓冲液+0.1mnacl的线性梯度进行洗脱,收集含aat的洗脱液。洗脱结束后,用5个柱体积的0.5mnaoh清洗柱子,洗去未洗脱的结合蛋白。再用5个柱体积的20%乙醇溶液平衡柱子保存。此步阴离子交换层析得到的aat洗脱液纯度为63%,比活为0.57,回收率为99%。
3.病毒灭活:在进行第二步层析前,含aat的洗脱液需经过两步病毒灭活,干热灭活和s/d灭活。首先,将含aat的阴离子交换层析洗脱液进行冻干,冻干的过程如下:先在空气氛围总中-25℃保持2-4h,再-40℃2-4h。然后在真空条件下,-10℃保持30-40h,升温至35℃再保持20-30h。冻干好的样品再于80℃干热病毒灭活72h。干热灭活后的样品再次溶解于水中,加入蔗糖稳定aat,最终浓度为35%。然后加入磷酸三正丁酯和吐温-80进行s/d灭活,最终浓度分别为0.3%和0.2%,30℃灭活3-5h后,进行过滤和透析。透析后调节溶液ph与下一步的阳离子交换层析平衡缓冲液的ph相同。
4.阳离子交换层析:取30ml20%乙醇保存的macro-prephighs凝胶,用水反复置换,去除乙醇,放置达到温度平衡后用xk16/20装柱。以下层析过程都在geäktaexplore100蛋白纯化仪上进行。装柱完成后,柱高为12cm,用1%丙酮测其柱效为4102n/m。测完柱效后,柱子用水平衡5个柱体积,再用起始平衡缓冲液20mmph5.5柠檬酸缓冲液平衡5个柱体积。将病毒灭活后的aat洗脱液调ph至5.5。上样量为30ml,以10个柱体积达到20mmph5.5柠檬酸缓冲液+0.1mnacl的线性梯度进行洗脱,其中aat在穿透液中,收集穿透液。洗脱结束后,用5个柱体积的0.5mnaoh清洗柱子,洗去未洗脱的结合蛋白。再用5个柱体积的20%乙醇溶液平衡柱子保存。此步阳离子交换层析得到的aat穿透液中aat纯度为97%,比活为0.93,回收率为90%。
5.超滤、除菌过滤、分装、冻干:将阳离子交换层析的aat流穿液超滤浓缩,蛋白浓度为15mg/ml,之后进行除菌过滤、分装冻干。冻干过程:先在空气氛围总中-25℃保持2-4h,再-40℃2-4h。然后在真空条件下,-10℃保持30-40h,升温至35℃再保持20-30h。冻干完成后,即制备出aat制剂。
实施例3
1.fiv-1沉淀的溶解:称取1gfiv-1沉淀溶解于10ml20mmph8.0tris-hcl缓冲液中,充分混合,于摇床上室温溶解5h。溶解结束后,放至室温,用0.45μm针筒式滤膜过滤,取滤液备用。
2.阴离子交换层析:取35ml20%乙醇保存的deaesepharosehighperformance凝胶,用水反复置换,去除乙醇,放置达到温度平衡后用xk16/20装柱。以下层析过程都在geäktaexplore100蛋白纯化仪上进行。装柱完成后,柱高为13.5cm,用1%丙酮测其柱效为4562n/m。测完柱效后,柱子用水平衡5个柱体积,再用起始平衡缓冲液20mmph8.0tris-hcl缓冲液平衡5个柱体积。以10个柱体积达到20mmph8.0tris-hcl冲液+0.1mnacl的线性梯度进行洗脱,收集含aat的洗脱液。洗脱结束后,用5个柱体积的0.5mnaoh清洗柱子,洗去未洗脱的结合蛋白。再用5个柱体积的20%乙醇溶液平衡柱子保存。此步阴离子交换层析得到的aat洗脱液纯度为67%,比活为0.58,回收率为99%。
3.病毒灭活:在进行第二步层析前,含aat的洗脱液需经过两步病毒灭活,干热灭活和s/d灭活。首先,将含aat的阴离子交换层析洗脱液进行冻干,冻干的过程如下:先在空气氛围总中-25℃保持2-4h,再-40℃2-4h。然后在真空条件下,-10℃保持30-40h,升温至35℃再保持20-30h。冻干好的样品再于80℃干热病毒灭活72h。干热灭活后的样品再次溶解于水中,加入蔗糖稳定aat,最终浓度为35%。然后加入磷酸三正丁酯和吐温-80进行s/d灭活,最终浓度分别为0.3%和0.2%,30℃灭活3-5h后,进行过滤和透析。透析后调节溶液ph与下一步的阳离子交换层析平衡缓冲液的ph相同。
4.阳离子交换层析:取30ml20%乙醇保存的macro-prephighs凝胶,用水反复置换,去除乙醇,放置达到温度平衡后用xk16/20装柱。以下层析过程都在geäktaexplore100蛋白纯化仪上进行。装柱完成后,柱高为12cm,用1%丙酮测其柱效为4102n/m。测完柱效后,柱子用水平衡5个柱体积,再用起始平衡缓冲液20mmph5.5磷酸盐缓冲液平衡5个柱体积。将病毒灭活后的aat洗脱液调ph至5.5。上样量为30ml,以10个柱体积达到20mmph5.5磷酸盐缓冲液+0.1mnacl的线性梯度进行洗脱,其中aat在穿透液中,收集穿透液。洗脱结束后,用5个柱体积的0.5mnaoh清洗柱子,洗去未洗脱的结合蛋白。再用5个柱体积的20%乙醇溶液平衡柱子保存。此步阳离子交换层析得到的aat穿透液中aat纯度为99%,比活为0.93,回收率为95%。
5.超滤、除菌过滤、分装、冻干:将阳离子交换层析的aat流穿液超滤浓缩,蛋白浓度为15mg/ml,之后进行除菌过滤、分装冻干。冻干过程:先在空气氛围总中-25℃保持2-4h,再-40℃2-4h。然后在真空条件下,-10℃保持30-40h,升温至35℃再保持20-30h。冻干完成后,即制备出aat制剂。
对比例1
1.fiv-1沉淀的溶解:称取1gfiv-1沉淀溶解于10ml20mmph8.0tris-hcl缓冲液中,充分混合,于摇床上室温溶解5h。溶解结束后,放至室温,用0.45μm针筒式滤膜过滤,取滤液备用。
2.阴离子交换层析:取35ml20%乙醇保存的deaesepharosefastflow凝胶,用水反复置换,去除乙醇,放置达到温度平衡后用xk16/20装柱。以下层析过程都在geäktaexplore100蛋白纯化仪上进行。装柱完成后,柱高为13.5cm,用1%丙酮测其柱效为4562n/m。测完柱效后,柱子用水平衡5个柱体积,再用起始平衡缓冲液20mmph8.0tris-hcl缓冲液平衡5个柱体积。以10个柱体积达到20mmph8.0磷酸盐缓冲液+0.1mnacl的线性梯度进行洗脱,收集含aat的洗脱液。洗脱结束后,用5个柱体积的0.5mnaoh清洗柱子,洗去未洗脱的结合蛋白。再用5个柱体积的20%乙醇溶液平衡柱子保存。此步阴离子交换层析得到的aat洗脱液纯度为55%,比活为0.39,回收率为90%。
3.病毒灭活:在进行第二步层析前,含aat的洗脱液需经过两步病毒灭活,干热灭活和s/d灭活。首先,将含aat的阴离子交换层析洗脱液进行冻干,冻干的过程如下:先在空气氛围总中-25℃保持2-4h,再-40℃2-4h。然后在真空条件下,-10℃保持30-40h,升温至35℃再保持20-30h。冻干好的样品再于80℃干热病毒灭活72h。干热灭活后的样品再次溶解于水中,加入蔗糖稳定aat,最终浓度为35%。然后加入磷酸三正丁酯和吐温-80进行s/d灭活,最终浓度分别为0.3%和0.2%,30℃灭活3-5h后,进行过滤和透析。透析后调节溶液ph与下一步的阳离子交换层析平衡缓冲液的ph相同。
4.阳离子交换层析:取30ml20%乙醇保存的spsepharosefastflow凝胶,用水反复置换,去除乙醇,放置达到温度平衡后用xk16/20装柱。以下层析过程都在geäktaexplore100蛋白纯化仪上进行。装柱完成后,柱高为12cm,用1%丙酮测其柱效为4102n/m。测完柱效后,柱子用水平衡5个柱体积,再用起始平衡缓冲液20mmph5.5磷酸盐缓冲液平衡5个柱体积。将病毒灭活后的aat洗脱液调ph至5.5。上样量为30ml,以10个柱体积达到20mmph5.5磷酸盐缓冲液+0.1mnacl的线性梯度进行洗脱,其中aat在穿透液中,收集穿透液。洗脱结束后,用5个柱体积的0.5mnaoh清洗柱子,洗去未洗脱的结合蛋白。再用5个柱体积的20%乙醇溶液平衡柱子保存。此步阳离子交换层析得到的aat穿透液中aat纯度为83%,比活为0.79,回收率为70%。回收率和纯度明显低于实施例3。
5.超滤、除菌过滤、分装、冻干:将阳离子交换层析的aat流穿液超滤浓缩,蛋白浓度为15mg/ml,之后进行除菌过滤、分装冻干。冻干过程:先在空气氛围总中-25℃保持2-4h,再-40℃2-4h。然后在真空条件下,-10℃保持30-40h,升温至35℃再保持20-30h。冻干完成后,即制备出aat制剂。
对比例2
1.fiv-1沉淀的溶解:称取1gfiv-1沉淀溶解于10ml20mmph7.5磷酸盐缓冲液中,充分混合,于摇床上室温溶解5h。溶解结束后,用0.45μm针筒式滤膜过滤,取滤液备用。
2.阳离子交换层析:取30ml20%乙醇保存的macro-prephighs凝胶,用水反复置换,去除乙醇,放置达到温度平衡后用xk16/20装柱。以下层析过程都在geäktaexplore100蛋白纯化仪上进行。装柱完成后,柱高为12cm,用1%丙酮测其柱效为4102n/m。测完柱效后,柱子用水平衡5个柱体积,再用起始平衡缓冲液20mmph5.5柠檬酸缓冲液平衡5个柱体积。将fiv-1沉淀溶解液的滤液15ml调ph至5.5。上样量为15ml,以10个柱体积达到20mmph5.5柠檬酸缓冲液+0.1mnacl的线性梯度进行洗脱,其中aat在穿透液中,收集穿透液。洗脱结束后,用5个柱体积的0.5mnaoh清洗柱子,洗去未洗脱的结合蛋白。再用5个柱体积的20%乙醇溶液平衡柱子保存。此步阳离子交换层析得到的aat穿透液中aat纯度为65%,比活为0.60,回收率为81%。
3.病毒灭活:在进行第二步层析前,含aat的穿透液需经过两步病毒灭活,干热灭活和s/d灭活。首先,将含aat的阴离子交换层析洗脱液进行冻干,冻干的过程如下:先在空气氛围总中-25℃保持2-4h,再-40℃2-4h。然后在真空条件下,-10℃保持30-40h,升温至35℃再保持20-30h。冻干好的样品再于80℃干热病毒灭活72h。干热灭活后的样品再次溶解于水中,加入蔗糖稳定aat,最终浓度为35%。然后加入磷酸三正丁酯和吐温-80进行s/d灭活,最终浓度分别为0.3%和0.2%,30℃灭活3-5h后,进行过滤和透析。透析后调节溶液ph与下一步的阳离子交换层析平衡缓冲液的ph相同。
4.阴离子交换层析:取35ml20%乙醇保存的deaesepharosehighperformance凝胶,用水反复置换,去除乙醇,放置达到温度平衡后用xk16/20装柱。以下层析过程都在geäktaexplore100蛋白纯化仪上进行。装柱完成后,柱高为13.2cm,用1%丙酮测其柱效为4865n/m。测完柱效后,柱子用水平衡5个柱体积,再用起始平衡缓冲液20mmph7.0磷酸盐缓冲液平衡5个柱体积。将病毒灭活后的aat洗脱液调ph至7.0。以10个柱体积达到20mmph7.0磷酸盐缓冲液+0.1mnacl的线性梯度进行洗脱,收集含aat的洗脱液。洗脱结束后,用5个柱体积的0.5mnaoh清洗柱子,洗去未洗脱的结合蛋白。再用5个柱体积的20%乙醇溶液平衡柱子保存。此步阴离子交换层析得到的aat洗脱液纯度为85%,比活为0.81,回收率为89%。回收率和纯度明显低于实施例1、2和3。
5.超滤、除菌过滤、分装、冻干:将阴离子交换层析的aat流穿液超滤浓缩,蛋白浓度为15mg/ml,之后进行除菌过滤、分装冻干。冻干过程:先在空气氛围总中-25℃保持2-4h,再-40℃2-4h。然后在真空条件下,-10℃保持30-40h,升温至35℃再保持20-30h。冻干完成后,即制备出aat制剂。
- 还没有人留言评论。精彩留言会获得点赞!