一种永生化兔小肠上皮细胞系及其构建方法与流程
本发明涉及分子生物学领域,具体地说,涉及一种永生化兔小肠上皮细胞系及其构建方法。
背景技术:
兔是一种重要的肉制品和皮毛来源,在畜牧生产、餐饮、公共健康等领域都有重要作用。目前,兔的重大疫病如兔瘟、兔球虫、巴氏杆菌病等越来越受到重视。这类病原体多数都侵害消化道。然而,目前的研究中,研究这些疾病的科学工具严重缺乏,制约了相关领域的技术发展。目前兔来源的细胞系较少,因此获得更多兔来源的细胞系将促进兔重大疫病防控的研究。
小肠来源的细胞系是研究各类肠侵袭性病原的可靠细胞学工具,而小肠隐窝来源的带有lgr5的隐窝干细胞更是研究小肠上皮发育分化的有利工具。因此亟需开发一种可获得隐窝来源的永生化兔小肠上皮细胞系的方法,用以推进兔疫病防控和细胞学方面的研究。
技术实现要素:
为了解决现有技术中存在的问题,本发明的目的是提供一种永生化兔小肠上皮细胞系及其构建方法。
为了实现本发明目的,本发明的技术方案如下:
第一方面,本发明提供一种永生化兔小肠上皮细胞系的构建方法,采集新生兔的小肠,利用含有胶原酶和中性蛋白酶的酶消化液进行消化,消化后使用重悬离心和相差贴壁的方法对细胞进行提纯,获得原代隐窝细胞,进行培养与传代,对获得的细胞转染sv40大t抗原质粒,再连续细胞传代筛选得到永生化兔小肠上皮细胞系。
作为优选,所述酶消化液为含有0.1~0.2mg/ml胶原酶和0.4~0.6mg/ml中性蛋白酶的dmem培养液。例如,所述酶消化液为含有0.2mg/ml胶原酶和0.5mg/ml中性蛋白酶的dmem培养液。
进一步地,所述sv40大t抗原质粒包括鸡球蛋白/兔球蛋白混合启动子,sv40大t抗原基因和neo药筛基因。所述sv40大t抗原质粒的构建方法为:将sv40大t抗原基因(geneid29031019)和neo药筛基因(ng-047417.1)按顺序插入到pcaggs载体内。
需要说明的是,目的基因插入质粒的顺序不限于上述顺序。所述pcaggs载体为市售可得商品,例如可购自belgianco-ordinatedcollectionsofmicro-organisms(bccm),产品代码为lmbp2453(http://bccm.belspo.be/catalogues/lmbp-plasmids-plasmid-details?nm=pcaggs)。
进一步地,在所述培养与传代的过程中,所述原代隐窝细胞进行初代培养时的培养基为添加10%fbs,20μg/l表皮生长因子,200iu/ml链霉素和青霉素,50μg/ml的庆大霉素,1×insulin-transferrin-selenium(胰岛素-转铁蛋白-硒添加剂;gibco,货号1805428)的dmem培养基。
更为具体地,本发明所述方法包括如下步骤:
(1)细胞分离:在无菌条件下取新生兔的小肠,切碎肠组织,dmem培养基冲洗肠组织2~3遍,使用上述含有胶原酶和中性蛋白酶的酶消化液在37℃下对肠组织进行消化,消化后使用重悬离心和相差贴壁方法对细胞进行提纯,获得原代隐窝细胞团;
(2)细胞培养:使用添加10%fbs,表皮生长因子20μg/l,200iu/ml链霉素和青霉素,50μg/ml的庆大霉素,1×insulin-transferrin-selenium(胰岛素-转铁蛋白-硒添加剂)的dmem培养基,在包被有质量比0.5%明胶(sigma,货号#slbn4365v)的培养板上对原代隐窝细胞进行初代培养;
(3)细胞传代:当细胞团块贴壁后生长至90%铺满状态时进行细胞传代,使用pbs洗涤去除培养基后,加入含质量比(m/m)0.02%edta的0.25%胰酶消化液进行消化,消化后将细胞重悬传代到新的细胞瓶内,添加适量新细胞培养液;所述含质量比(m/m)0.02%edta的0.25%胰酶消化液为市售产品(macgene,中国;货号g270220);
(4)细胞转染:当细胞密度到达80%,铺板时间36小时内,使用脂质体(lipofectamineltx,invitrogen公司,货号1657815)转染sv40大t抗原质粒,再连续细胞传代,最终筛选得到永生化兔小肠上皮细胞系。
其中,步骤(3)中第1代到第5代使用的细胞培养液为10%fbs,表皮生长因子20μg/l,200iu/ml链霉素和青霉素,50μg/ml的庆大霉素,1×insulin-transferrin-selenium(胰岛素-转铁蛋白-硒添加剂)的dmem培养基;第五代后使用的细胞培养液为7.5%fbs,表皮生长因子20μg/l,200iu/ml链霉素和青霉素,50μg/ml的庆大霉素,1×insulin-transferrin-selenium(胰岛素-转铁蛋白-硒添加剂)的dmem培养基。
第二方面,本发明还提供了利用本发明所述方法建立得到一种永生化兔小肠上皮细胞系。
该永生化兔小肠上皮细胞系可同时表达肠上皮表面标志分子和隐窝基层干细胞的表面分子。所述肠上皮表面标志分子包括但不限于角蛋白8,e-降钙素和ki67;所述隐窝基层干细胞的表面分子包括但不限于lgr5,sox9。
第三方面,本发明还提供了所述永生化兔小肠上皮细胞系在建立兔小肠上皮体外模型中的应用,以及用于营养吸收,细胞通路,病原体研究等方向的研究。
本发明涉及到的原料或试剂,如无特殊说明均为普通市售产品,涉及到的操作如无特殊说明均为本领域常规操作。
在符合本领域常识的基础上,上述各优选条件,可以相互组合,得到具体实施方式。
本发明的有益效果在于:
本发明提供了一种兔小肠隐窝来源的细胞系,该细胞系表达多种肠上皮细胞的表面标志性分子,可以用于细胞生物学,病原与宿主相互作用的体外研究。该细胞系为促进兔健康养殖及其疫病防控提供了很好的细胞学工具。同时也为体外药物评估,生物制药等诸多行业提供了一种潜在的工具。
附图说明
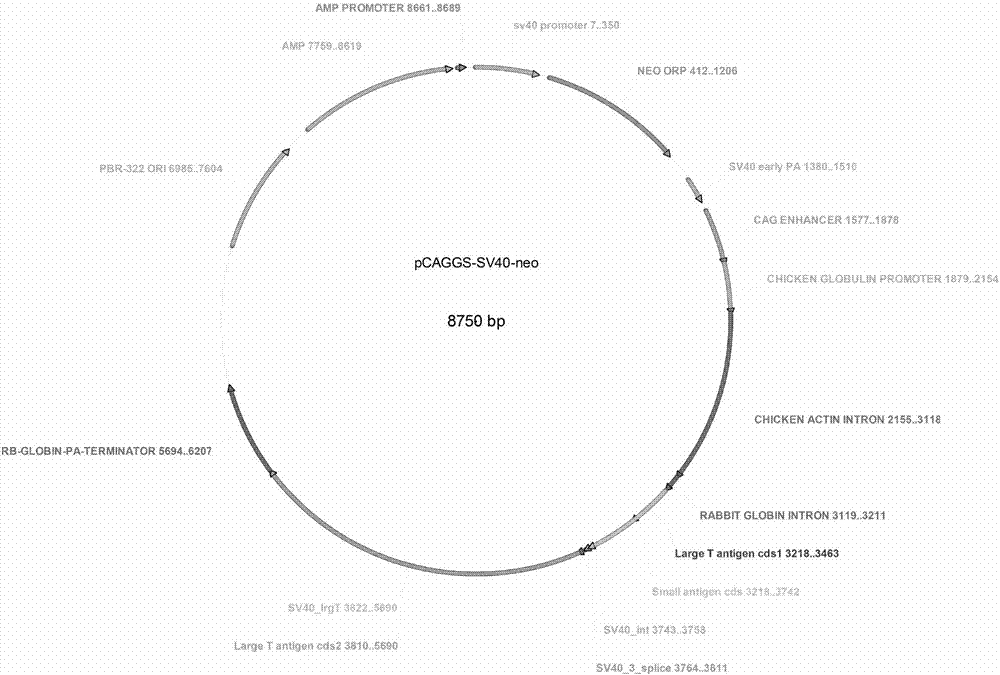
图1为本发明所述sv40大t抗原质粒图谱。
图2为本发明所述永生化兔小肠上皮细胞形态;a:第3代原代兔小肠上皮细胞传代后12h(标尺=100μm);b:第50代永生化兔小肠上皮细胞传代后10h(标尺=100μm);c:第3代原代兔小肠上皮细胞铺满培养瓶后形态(标尺=100μm);d:铺满培养瓶的第50代永生化兔小肠上皮细胞(标尺=100μm)。
图3为本发明第50代永生化兔小肠上皮与第3代兔小肠上皮生长曲线。
图4为rt-pcr鉴定sv40大t抗原在兔小肠上皮细胞内的表达;泳道1:转染24h后rt-pcr扩增出sv40大t抗原基因目的条带;泳道2:转染48h后rt-pcr扩增出sv40大t抗原基因的目的条带;泳道3:第65代兔小肠上皮细胞系扩增出sv40大t抗原基因的目的条带。
图5为本发明所述永生化兔小肠上皮细胞培养兔大型艾美耳球虫;a:培养24h,子孢子发育为子孢子形状的裂殖子(标尺=50μm);b:培养48h,可见4核裂殖子(标尺=10μm);c:培养48h后,可见第一代裂殖体(标尺=10μm);d,e:培养72h后,可见发育即将成熟的第二代裂殖体(d标尺=50μm,e标尺=30μm);f:培养96h,成熟的二代裂殖体;g:培养96h后,释放出的第二代裂殖子(标尺=20μm);h:培养120h,发育中的第三代滋养体(标尺=15μm)。
具体实施方式
下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
材料:新生兔来源于新西兰白兔
仪器与试剂:二氧化碳培养箱(thermo,中国),倒置显微镜(olympus,日本),超净工作台(中国苏净集团泰安公司),高压蒸汽灭菌锅(sanyo,日本),细胞培养板与细胞培养瓶(costar,美国),dmem(macgene,中国,货号g1004200),mem199(macgene,中国;货号g1702020),带有质量比(m/m)0.02%edta的0.25%的胰酶(macgene,中国;货号g270220),胎牛血清(macgene,中国;货号g20uno2),insulin-transferrin-selenium(gibco,美国;货号1805428),冷水鱼皮明胶(sigma,美国;货号#slbn4365v),胶原酶(sigma,美国;产品编号c9722),中性蛋白酶(sigma,美国;产品编号d4818),lipofectamineltx(invitrogen,美国;货号1657815),表皮生长因子(sigma,美国;产品编号e5036)。其他所用的材料试剂,若无特殊说明均可从商业渠道获得。
实施例1
1、兔小肠上皮隐窝细胞团的分离与培养
在超净台内无菌取新生兔的小肠细胞,使用无菌剪刀纵向剪开小肠,再使用无菌手术刀片切碎肠组织为2mm2的组织碎片。dmem培养基冲洗肠道组织2~3遍。使用酶消化液对肠组织在37℃下进行消化20min,消化过程中需要不断搅拌消化液。消化完成后,使用孔径为0.5mm的铜滤网对消化产物进行过滤。过滤液500g离心5min,弃去上清液。使用质量比(m/m)2.5%的山梨醇溶液对沉淀物进行重悬,悬液300g离心2分钟,收集上清于新的离心管内,再使用质量比(m/m)2.5%山梨醇重悬沉淀物,重复2~3次。收集的所有重悬液400g离心3min,弃去上清,并继续加入质量比(m/m)2.5%山梨醇进行4~6次离心。最后可获得的沉淀物为高纯度的小肠上皮隐窝细胞团块。将沉淀物加入培养基重悬后放于细胞培养板内培养1h后,然后水平十字摇动培养板后吸取培养液转移隐窝团块。这样可以使成纤维细胞率先贴壁,进一步对隐窝细胞进行提纯。
2、细胞培养
原代兔小肠上皮培养需要使用质量比(m/m)0.5%明胶包被的培养板。具体方法为,在细胞培养板或者细胞培养瓶内加入适量质量比(m/m)0.5%的明胶溶液,37℃细胞培养箱内孵育2h后放入4℃冰箱保存。使用前吸出明胶液体,使用pbs清洗一遍即可。新分离的隐窝细胞经过相差贴壁处理后,接种于培养板内既可以正常培养。前5代细胞贴壁性较差,所有使用的细胞培养板或者培养瓶必须经过质量比0.5%明胶包被。使用的培养基为加入了10%fbs,表皮生长因子20μg/l,200iu/ml链霉素和青霉素,50μg/ml的庆大霉素,1×insulin-transferrin-selenium(胰岛素-转铁蛋白-硒添加剂)的dmem培养基。
3、细胞传代
待兔小肠上皮细胞铺满90%细胞培养板或细胞培养瓶就可以进行细胞传代。弃去瓶中陈旧的培养基,使用无菌pbs洗涤3次,25cm2的细胞培养瓶加入500μl含有质量比(m/m)0.02%edta的0.25%胰酶,十字摇晃保证铺满细胞瓶。37℃温箱孵育3min。取出细胞培养瓶,拍击细胞培养皿侧壁,使贴壁细胞震落。在超净台内加入肠上皮细胞培养液,并轻柔吹散细胞团块。收集消化细胞,等分加入到新的细胞培养瓶中,并加入5ml细胞培养液,左右摇匀,做好标记,稍作静置后放入到co2细胞培养箱中。上述肠上皮细胞培养液配方为加入了10%fbs,表皮生长因子20μg/l,200iu/ml链霉素和青霉素,50μg/ml的庆大霉素,1×insulin-transferrin-selenium(胰岛素-转铁蛋白-硒添加剂)的dmem培养基。若培养5代以后的细胞,上述培养基中的fbs含量可以调整为7.5%。
4、质粒转染
在细胞6孔板中,接种106个细胞,待细胞长至80%的密度后,开始转染实验。分别250μl的opti-mem稀释脂质体(lipofectamineltx)和总量5μg的sv40大t抗原质粒,均匀混合,室温静置10min。将两种溶液均匀混合,室温静置20min,以便形成dna-脂质体复合物。将混合液体均匀加入培养皿中,轻轻摇晃培养皿混匀。37℃,5%co2培养6h,使用预热好的pbs清洗,换新鲜培养液后继续培养。待铺满细胞培养板后,正常传代。
5、细胞的连续传代培养
在细胞培养瓶中继续培养已经转染过sv40大t抗原质粒的细胞。在处于90%铺满状态时进行传代。在第5代后,将培养液中的血清含量调整为7.5%。细胞传代过程中每隔20代对传代细胞进行一次冻存备份,细胞继续传代至50代。
实施例2
1、细胞系的鉴定(转录组测序分析)
待培养至50代的兔小肠上皮细胞系生长至100%铺满时,加入含edta的0.25%胰酶消化液0.5ml,于含5%co2的37℃细胞培养箱中孵育5min,然后用吸管吹打使细胞脱落,加入培养基终止消化后,800g离心5min收集细胞,加入1mltrizol试剂(ambion,美国,货号139605)。用试剂厂商提供的标准方法提取样品总rna。
用分光光度计测定所提取的rna的浓度及纯度。然后根据1%mops凝胶电泳(总rna上样量约为1μg)结果,对提取的总rna进行rna完整性以及是否有基因组dna污染的评价。
使用试剂盒ribo-zero消化核糖体rna后;加入打断试剂将rna打断成短片段,以打断后的rna为模板,用六碱基随机引物合成一链cdna,然后配制二链合成反应体系合成二链cdna,在cdna二链合成时以dutp代替dttp,然后连接不同接头,再利用ung酶法将含有dutp的一条链进行消化,只保留连接链不同接头的cdna一链;使用试剂盒纯化cdna一链;纯化的cdna一链再进行末端修复、加a尾并连接测序接头,然后进行片段大小选择,最后进行pcr扩增;构建好的文库用agilent2100bioanalyzer质检合格后,使用illuminahiseqtm2500或其他测序仪进行测序。
经测序平台测序所得的数据称经过滤得到cleanreads,用tophat/bowtie2将cleanreads比对到兔基因组的参考序列。然后比对基因的转录情况。
发现该细胞系表达角蛋白8,e-降钙素,ki67等肠上皮表面标志分子,并且同时表达如lgr5,sox9等隐窝基底层干细胞的表面分子。说明本细胞系保留了分化特征。
2、永生化细胞生长速度测定
取第3代原代细胞与第50代传代细胞1200个接种于24孔板内,使用5%的dmem培养液培养。每日对3孔细胞计数,求平均数后绘制生长曲线。生长曲线见图3.
3、rt-pcr鉴定sv40大t抗原在兔小肠上皮细胞内的表达
提取转染了永生化质粒后24h,48h后的第3代原代与第65代永生化兔小肠上皮细胞总rna并反转录为rna。具体方法参照下文。使用sv40大t抗原鉴定引物:上游引物:actgcaaacaatggcctgag。下游引物:taaaggcattccaccactgct。pcr反应条件为:预热94℃,5min;变性94℃,30s;退火56℃,30s;延展72℃,30s;30个循环;最后延伸5min。使用百分之一琼脂糖凝胶电泳,凝胶摄像系统拍照。由照片可得成功扩增出sv40大t抗原目的条带,说明质粒可以在细胞内表达。电泳照片见图4。
实施例3大型艾美耳球虫体外培养
消化长满一个25cm2细胞培养瓶的兔小肠上皮细胞,计数,并稀释细胞。向细胞培养用6孔板中每孔加入106个细胞,并培养12h。待细胞贴壁之后,每孔均匀加入106个子孢子,继续培养6h后。待细胞铺满后,使用加有5倍双抗轻轻冲洗细胞培养板,冲洗掉没入侵的子孢子,然后加入5%fbs,mem199培养基。培养换液时间设定为48h,94h。抽取出的旧培养液显微镜下镜检后,确保不存在逸出的裂殖子再弃去,如果存在裂殖子,离心后重新加入到新的细胞中继续培养。在96h后,使用含有2.5%fbs的低血清mem199培养基继续培养裂殖子。若细胞培养板细胞生长过满,使用带有edta的胰酶消化正常对细胞进行一传二传代。每天使用倒置荧光显微镜进行观察。发现培养24h球虫可发育到第一代裂殖体,第72h发育到第二代裂殖体,120h可以形成第三代滋养体。培养照片见图5。
对比例1
将分离的隐窝细胞分别用培养基1(dmemf12,10%fbs,表皮生长因子20μg/l,200iu/ml链霉素和青霉素,50μg/ml的庆大霉素,1xinsulin-transferrin-selenium)。培养基2(dmemf12,10%fbs,表皮生长因子20μg/l,200iu/ml链霉素和青霉素,1xinsulin-transferrin-selenium)进行培养。发现使用培养基2进行培养,细胞在传代2~3代后有明显的细菌污染。而使用培养基1细胞生长正常。
对比例2
分别连续传代原代上皮细胞以及转染的sv40大t基因的上皮细胞。可发现原代上皮细胞在第10代出现生长速度减缓,传至15代后可见大部分细胞凋亡。而转染sv40大t基因的上皮细胞可以不断的在体外连续传代,不存在生长停滞的现象。说明sv40大t基因可以永生化兔来源的小肠上皮细胞。
对比例3
分别将分离出来的隐窝细胞接种于质量比0.5%明胶包被和没有包被的细胞培养板中。可发现使用明胶包被后的培养板中细胞团块迅速贴壁并平铺生长;而不使用明胶包被的培养板中细胞不能贴壁。
对比例4
在分离细胞的过程中,同时使用上述含有0.1~0.2mg/ml胶原酶和0.4~0.6mg/ml中性蛋白酶的消化液和质量比(m/m)2.5%的胰酶对兔小肠组织块在37℃下进行消化。消化过程中不断震荡并使用显微镜随时观察,至隐窝细胞团大量释放后终止消化。通过上述相差贴壁与重悬离心法提纯的隐窝细胞团,并分别接种这两种处理得到的隐窝细胞团于包被好明胶的细胞培养板内。可发现使用胰酶消化的隐窝细胞团块不能良好的贴壁生长,而使用含有0.1~0.2mg/ml胶原酶和0.4~0.6mg/ml中性蛋白酶的消化液消化的隐窝细胞团块是可以正常贴壁生长。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!