用于real‑timeRPA快速检测和区分PRV野毒和疫苗毒的核酸及方法与流程
本发明属于生物技术领域,具体涉及用于real-timerpa快速检测和区分prv野毒和疫苗毒的核酸及方法。
背景技术:
伪狂犬(pseudorabies,pr),也称为aujeszky氏病,是由伪狂犬病毒(pseudorabiesvirus,prv)引起的一种可发生于猪和其他动物的重要疫病,能够引起养猪业严重的经济损失。prv,属于疱疹病毒科,水痘病毒属,是一种具有囊膜的双链dna病毒。猪是prv的自然宿主,也是唯一能够耐受prv感染,形成潜伏感染的动物。prv可以感染不同生长阶段的猪并呈现不同的临床症状:在新生仔猪主要表现为神经症状和高死亡率;在成年猪主要表现为呼吸道症状;在怀孕母猪主要表现为繁殖障碍。除了猪之外,prv还可以感染多种不同的哺乳动物,包括反刍动物、犬科和啮齿类动物,感染后一般表现后死亡。
在我国,猪场尤其是小型和中型猪场对生物安全的重视程度很低,而这也导致了伪狂犬的控制和清除更加困难。在许多农场,没有对感染prv或死于prv感染的猪进行深埋或焚烧处理,而是进行了不同形式的销售,这也导致了我国伪狂犬的广泛传播。
bartha-k61株病毒缺失了ge基因,是目前应用最为广泛的伪狂犬弱毒疫苗株。我国目前使用的所有伪狂犬弱毒疫苗均为bartha-k61株。伪狂犬弱毒疫苗的使用可以有效的控制伪狂犬疫情,大大降低新生仔猪的发病率和死亡率,但是使用疫苗后并不能清除猪体内原来存在的prv野毒,也不能防止后续的野毒感染。在感染猪体内,prv可以形成终身的潜伏感染,并且一旦激活,就能够造成prv野毒的广泛传播。自2011年末以来,一种具有更高致病力的prv变异株在我国多个地区免疫过bartha-k61疫苗的猪场中出现,并造成了严重的经济损失。因此,建立一种简单、快速的检测和区分prv野毒株和疫苗毒的方法,具有非常重要的意义。
目前已经建立多种基于dna扩增技术的prv检测和鉴别方法,如实时荧光pcr方法(real-timepcr)、环介导等温扩增方法(lamp)和纳米颗粒pcr(nanopcr)方法。但是,上述方法均存在一定的不足,不能有效的应用于生产一线和现场检测。real-timepcr方法需要专业昂贵的设备和专门的技术人员操作;lamp方法和nanopcr方法的结果判定需要进行琼脂糖凝胶电泳,大大降低了检测效率,并且假阳性率较高,结果不可靠。
重组酶聚合酶扩增(rpa)是一种等温dna扩增技术,重组酶结合引物形成蛋白-dna混合物并启动寻找模板dna上的同源序列。同源序列定位后,则会引发链置换反应,引物结合到对应模板上,聚合酶进而从引物3’末端开始启动dna合成。同pcr一样,两条引物可以启动对靶基因的级数级扩增。实时荧光(real-time)rpa反应体系中需要加入一个exo探针,扩增过程中产生的荧光信号通过荧光检测仪实现实时检测。但目前由于引物及exo探针的设计难度较大,一般较难达到理想的检测效果。
技术实现要素:
本发明的目的在于提供一组用于real-timerpa快速检测prv病毒的核酸,本发明的另一个目的在于提供一组用于real-timerpa快速鉴别检测prv野毒和疫苗毒的核酸。本发明的再一个目的是提供一种用于real-timerpa快速鉴别检测prv野毒和疫苗毒的核酸的试剂盒及其检测方法。
为实现上述目的,本发明采用以下的技术方案为:
一组用于real-timerpa快速检测prv病毒的核酸,包括用于检测prv的上游引物1、下游引物1和exo探针1;其中,所述上游引物1的序列如seqidno.1所示,所述下游引物1的序列如seqidno.2所示,所述exo探针1的序列如seqidno.3所示,其中,所述exo探针1的第31位t碱基标记荧光基团,第32位t碱基标记荧光淬灭基团,所述第31位t碱基与所述第32位t碱基之间设有四氢呋喃分子,所述exo探针1的3’端标记有c3、磷酸基团、生物素-teg或氨基。
如上所述的核酸,优选地,其还包括prv病毒检测的阳性扩增产物序列1,所述阳性扩增产物序列1包含如seqidno.4所示的序列。
一组用于real-timerpa快速鉴别检测prv野毒和疫苗毒的核酸,包括如上所述的核酸和用于检测prv野毒的上游引物2、下游引物2和exo探针2,所述上游引物2的序列如seqidno.5所示,所述下游引物2的序列如seqidno.6所示,所述exo探针2的序列如seqidno.7所示,所述exo探针2的第31位t碱基标记有不同于所述exo探针1的荧光基团,第32位t碱基标记荧光淬灭基团,所述第31位t碱基与所述第32位t碱基之间设有四氢呋喃分子,所述exo探针2的3’端标记有c3、磷酸基团、生物素-teg或氨基。
如上所述的核酸,优选地,该组核酸还包括prv野毒检测的阳性扩增产物序列2,所述阳性扩增产物序列2包含如seqidno.8所示的序列。
如上所述的核酸,优选地,所述荧光基团为fam、rox或tamara,所述荧光淬灭基团为bhq1或bhq2。
一种用于用于real-timerpa快速鉴别检测prv野毒和疫苗毒的检测试剂盒,其含有如上所述的核酸。
如上所述的试剂盒,优选地,该试剂盒还包括:reca重组酶、bsudna聚合酶、单链结合蛋白和exo外切核酸酶、反应buffer、醋酸镁溶液。
一种用于real-timerpa快速鉴别检测prv野毒和疫苗毒的方法,该方法是非诊断目的的检测方法,具体包括以下步骤:
(1)准备检测样本的dna;
(2)对步骤(1)所述dna进行等温扩增;其中,在反应体系中,采用如权利要求3中所述的核酸,置于39℃恒温反应;
(3)在所述恒温反应进行20min,同时收集荧光信号;
(4)结果判定:
若待测样品中所述exo探针1标记的荧光基团有明显扩增曲线,同时所述exo探针2标记的荧光基团若有明显扩增曲线,即判断为prv野毒阳性;
若待测样品中所述exo探针1标记的荧光基团有明显扩增曲线,同时若所述exo探针2标记的荧光基团无明显扩增曲线,判断为prv疫苗毒阳性;
若待测样品中所述exo探针1标记的荧光基团无扩增曲线,则判断为prv病毒阴性。
如上所述的方法,优选地,所述步骤(2)中的反应体系中,含所述上游引物1、下游引物1的终浓度为200nmol/l,所述exo探针1的终浓度为60nmol/l,所述上游引物2、下游引物2的终浓度为600nmol/l,所述exo探针2的终浓度为160nmol/l。
如上所述的方法,优选地,所述步骤(2)中,同时设置无核酸酶水为阴性对照;采用包含如seqidno.4和seqidno.8所示的序列作为阳性对照。
在检测过程中,同时设置有阴性对照和阳性对照,用于监测检测过程中是否有污染或操作是否规范,及所用试剂是否有效,能充分保证检测结果的准确、可靠,有效避免假阳性及假阴性结果的发生。
本发明的有益效果为:
本发明提供了能够用于real-timerpa快速鉴别检测prv野毒和疫苗毒的核酸及方法。其中,快速鉴别检测prv野毒和疫苗毒的双重real-timerpa方法实现了对prv的检测和区分是野毒还是疫苗毒,在同一个反应体系中完成。进一步分析表明,所提供的方法能够同时检测prv经典株和变异株。使用临床样品对所提供的方法进行验证,结果表明,real-timerpa和real-timepcr方法的检测一致性为100%,但是本发明方法(7-12min)明显快于real-timepcr(28-38min)。本发明提供的双重real-timerpa方法对于我国伪狂犬的控制具有重要意义,尤其是目前我国使用的所有伪狂犬疫苗均为ge缺失,而保留了gb基因。
本发明提供real-timerpa检测方法现有技术相比较,还具有的优点第一,rpa在20min内完成检测,而real-timepcr完成检测需要大约55min,lamp方法需要60min,而nanopcr则需要90min。第二、rpa引物和探针能够耐受5-9个碱基错配而不影响检测结果,而探针碱基的错配会导致real-timepcr检测灵敏性降低,第三、双重real-timerpa的检测结果可以通过两个通道实现实时检测,结果分析简单,可直接获知结果,而lamp方法和nanopcr方法则需要进行琼脂糖凝胶电泳进行结果分析,操作繁琐,结果需要多等待至少20min后才能获得。本发明方法可使用的荧光检测仪genieiii,genieiii仅重1.75kg,可充电电池能够持续工作一天,使得对prv的现场鉴别检测成为可能,这对于位于偏远地区农场尤为重要。
附图说明
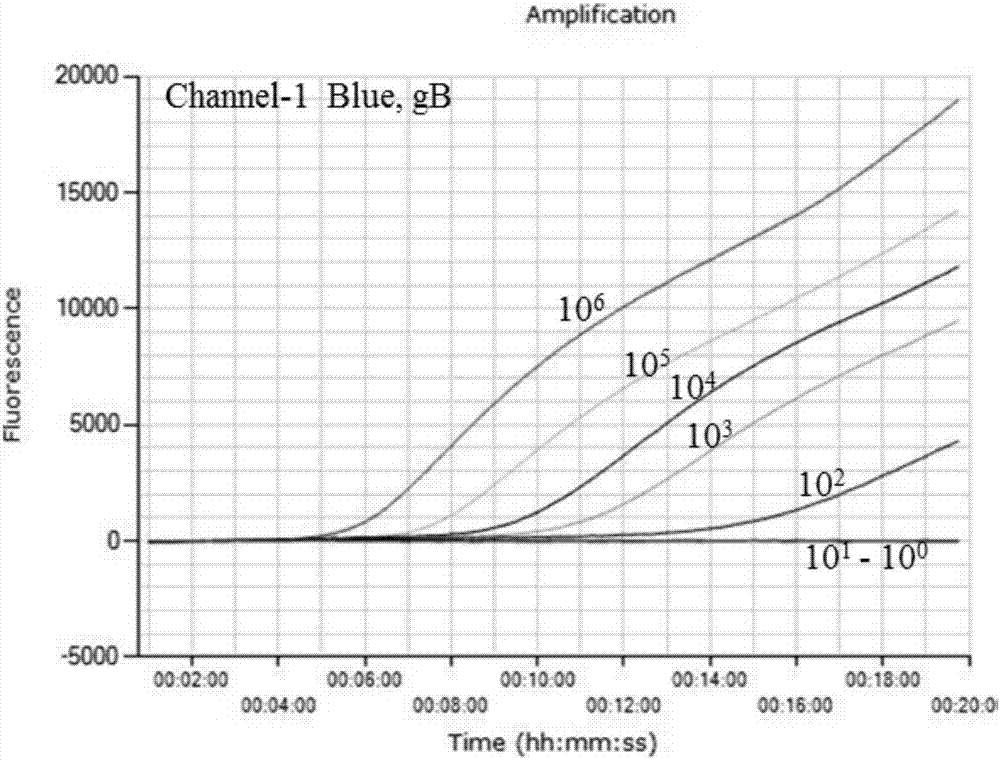
图1为本发明中一优选方法对gb基因的灵敏度扩增曲线图。
图2为本发明的一优选方法对ge基因的灵敏度扩增曲线图。
图3为本发明中一优选方法对gb基因的特异性扩增曲线图。
图4为本发明的一优选方法对ge基因的特异性扩增曲线图。
图5为本发明的real-timerpa方法和荧光pcr方法对gb基因检测结果比较图。
图6为本发明的real-timerpa方法和荧光pcr方法对ge基因检测结果比较图。
具体实施方式
下面结合具体的实施例来说明本发明内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例1引物、探针的设计
本发明中,选用伪狂犬病毒的gb基因作为检测的靶基因,因gb基因具有高度保守且存在所有野毒和疫苗毒中,所以选用gb基因作为检测狂犬病毒;在所有的伪狂犬疫苗毒均缺失了ge基因,所以采用检测ge基因用于区分ge基因是疫苗毒还是野毒。
采用重组酶聚合酶扩增技术(rpa),进行对伪狂犬病毒的检测和鉴别,引物对及exo探针的本发明成功的关键,且该技术的引物及探针设计没有专门的软件进行,只能依靠人工设计,并需要设计不同的引物探针组合进行验证,从而保证检测的特异性和灵敏性。在rpa引物设计时,(1)应该避免引物5端前3-5个碱基为连续的g,而5端宜为c(或者为嘧啶)。引物3端最后3个碱基宜为g和c。(2)尽量避免引物中出现特殊序列,如重复出现的长串的某一碱基。(3)gc含量适中,不能过高(>70%)或过低(<30%)。(4)引物内或引物间的配对应尽量避免,防止引物二聚体的产生。(5)尽量避免引物二级结构的形成、防止引物间互作、避免形成发夹结构。exo探针是同靶扩增序列同源的一段核苷酸,其中包含一个脱碱基核苷酸模拟物(thf),其两侧分别为dt-荧光基团和dt-荧光淬灭基团。同时,探针3端通过适当的修饰(c3-spacer、磷酸基团、生物素-teg或氨基)被封闭,从而防止可能的聚合酶扩增和延伸。目前,exo探针的内部标记只能发生在t碱基上,并且探针中的两个dt相距不能超过6个(1-5个)碱基。在本发明中,对目前genbank中所有的prv序列进行了比对,在gb和ge基因的高度保守区设计引物探针,在同一反应体系中能够区分prv野毒和疫苗毒,引物、exo探针之间均既要求没有交叉反应,又要充分保证引物探针扩增的特异性,设计合成了多对引物探针组合,进行充分验证,筛选扩增效果最佳的引物探针组合。
具体地,根据genbank中gq325658.1、kt948054.1、kp009898.1、kt948053.1、kt818618.1、kp009897.1、kt948054.1、kp710982.1、kj526438.1,检索伪狂犬病毒的gb基因片段,设计上、下游引物1及exo探针1。用于恒温扩增检测伪狂犬病毒的上游引物1、下游引物1(rpa-gb-f、rpa-gb-r)及exo探针1(rpa-gb-p),具体如表1中所示。
exo探针含有一个碱基模拟物四氢呋喃分子(tetrahydrofuran,thf),thf分子两侧分别带有荧光基团和荧光淬灭基团,探针3'端带有防止探针延伸的阻断物。当探针与靶dna结合形成双链杂合dna结构后,exoⅲ作为一种dna修复酶,识别thf位点并切割探针使荧光基团和荧光淬灭基团分离从而产生荧光,在exo探针1中间位置的两个胸腺嘧啶核苷酸上分别标记一个荧光基团和一个荧光淬灭基团,两个基团之间设计有thf,该位点可被具有3'-5'外切酶活性的核酸外切酶iii识别、切割,游离荧光基团,从而发出荧光信号随后被荧光检测的仪器捕获。经过大量的实验验证,结果表明,本发明选择在exo探针1的第31位t碱基标记荧光基团,第32位t碱基标记荧光淬灭基团,第31位t碱基与第32位t碱基之间设有thf,exo探针1的3’端连接c3、磷酸基团、生物素-teg或氨基,检测效果最优,所标记的荧光基团为fam时,对应的淬灭基团为bhq1;当标记的荧光基团为tamara或rox时,对应的淬灭基团为bhq2;探针的3’端连接c3、磷酸基团、生物素-teg或氨基,经验证,采用上述基团检测时,检测效果相同。在本实施例中exo探针1具体合成时采用tctactacaagaacgtcatcgtcacgaccg(fam-dt)(thf)(bhq1-dt)-ggtccgggagcacgta-c3。
rpa-gb-f和rpa-gb-r扩增的产物为333bp,具体序列如seqidno.4所示:gctcttcaaggagaacatcgccccgcacaagttcaaggcccacatctactacaagaacgtcatcgtcacgaccgtgtggtccgggagcacgtacgcggccatcacgaaccgcttcacggaccgcgtgcccgtccccgtgcaggagatcacggacgtgatcgaccgccgcggcaagtgcgtctccaaggccgagtacgtgcgcaacaaccacaaggtgaccgccttcgaccgcgacgagaaccccgtcgaggtggacctgcgcccctcgcgcctgaacgcgctcggcacccgcggctggcacaccaccaacgacacctacaccaagatcggcgc。可采用含有seqidno.4的序列作为阳性对照物使用。
在设计优化好的用于real-timerpa检测prv病毒的引物、exo探针的基础上,设计用于区分prv野毒和疫苗毒的核酸,选用ge基因(af207700.1、kf017615.1、km189913.1、km983048.1、kf360835.1、kj789182.1、ku057086.1、ay170318.1),优化后上游引物2、下游引物2(rpa-ge-f、rpa-ge-r)和exo探针2(rpa-ge-p)的序列,如表1中所示。其中,具体在exo探针2合成时在为第31位和第32位中间设有thf,两边的两个t碱基标记分别标记荧光基团和荧光淬灭基团,合成时荧光基团采用rox和荧光淬灭基团采用bhq2,3’端连接c3。即具体为ccgaggaggcgccccgctccggcttcgacg(rox-dt)(thf)(bhq2-dt)ggttccgcgatccgga-c3。
上游引物2、下游引物2的扩增产物的大小为156bp,其序列为如seqidno.8所示:accccgaggacgagttcagcagcgacgaggacgacgggctgtacgtgcgccccgaggaggcgccccgctccggcttcgacgtctggttccgcgatccggagaagccggaagtgacgaatggacccaactatggcgtgaccgccaaccgcctgttga。
引物和探针序列见表1,并且所有的引物和探针均由上海生工合成。
表1引物探针序列信息
其中,r表示a或g,y表示c或t。实施例2双重实时荧光rpa方法
用于real-timerpa快速鉴别检测prv野毒和疫苗毒的方法,即双重实时荧光rpa方法快速鉴别检测prv野毒和疫苗毒,具体包括以下步骤:(1)准备检测样本的dna;
(2)对步骤(1)中dna样品进行等温扩增:使用twist公司的twistamptmexokit(twistdx,cambridge,uk),反应体系采用50μl。在50μl反应体系中,针对gb基因的引物(rpa-gb-f/rpa-gb-r)和ge基因的引物(rpa-ge-f/rpa-ge-r)浓度可分别采用200nm、400nm、500nm和600nm,针对gb基因的exo探针(rpa-gb-p)和ge基因的exo探针(rpa-ge-p)探针浓度分别为60nm、120nm、160nm和200nm。反应体系中还包括29.5μlexobuffer、2.5μl浓度为280mm的醋酸镁、1μl病毒dna和11.9μlddh2o。将模板和醋酸镁之外的所有试剂预混后转入含有冻干酶制剂(reca重组酶、bsudna聚合酶、单链结合蛋白和exo外切核酸酶)的0.2ml反应管中,并充分均匀。将1μl模板加入反应管中,并将2.5μl醋酸镁加在反应管盖中,盖紧后瞬时离心并涡旋,放入genieiii中,39℃恒温反应;
(3)在39℃恒温反应进行20min,同时收集荧光信号:使用channel-1通道(blue,激发波长为470nm,检测波长为510-560nm)收集gb基因扩增的荧光信号;使用channel-2通道(yellow,激发波长590nm,检测波长大于620nm)收集ge基因扩增的荧光信号。
(4)结果判定:若待测样品中所述exo探针1标记的荧光基团有明显扩增曲线,同时所述exo探针2标记的荧光基团若有明显扩增曲线,即判断为prv野毒阳性,若同时所述exo探针2标记的荧光基团无明显扩增曲线,判断为prv疫苗毒阳性;若待测样品中所述exo探针1标记的荧光基团无扩增曲线,则判断为prv病毒阴性。
优选地,当gb基因的引物浓度为200nm,探针浓度为60nm,而ge基因的引物浓度为600nm,探针浓度为160nm时,channel-1(gb基因)和channel-2(ge基因)通道均能检测到荧光信号,并呈现良好的扩增曲线。
本发明建立的方法中为了避免所用试剂失效或受到污染,还设置有作为阳性对照及阴性对照试剂,阴性对照采用无核酸酶水;
阳性对照采用携带有扩增产物的质粒dna,扩增产物的核苷酸序列含有如seqidno.4和seqidno.8所示的序列。
阴性对照的设计能有效验证所用试剂是否受到污染,避免假阳性发生,阳性对照的设计能有效验证所用试剂的有效性,避免假阴性的发生。
实施例3灵敏度的检测
1.dna标准品的制备
以prvfa株病毒基因组dna为模板,以表1中prvgb-f/prvgb-randprvge-f/prvge-r为引物,分别进行pcr扩增,获得gb基因和ge基因全长。将pcr产物回收后,连接pmd19-t载体,构建重组质粒prv-gb和prv-ge,并转化入感受态细胞dh5α。将测序正确的阳性克隆过夜培养后提取质粒并使用nd2000c测定浓度。根据公式:拷贝数(copies/μl)=6.02×1023×浓度(ng/μl)×10-9/(碱基数×660),计算重组质粒拷贝数。将重组质粒prv-gb和prv-ge进行10倍倍比稀释,使其范围为106-100拷贝/μl,作为dna标准品,保存于-80℃备用。
2.采用实施例2中的双重实时荧光rpa方法灵敏度检测
取1μl系列稀释的dna标准品作为模板,采用实施例2中优选地方法进行灵敏度分析,其中,反应液中gb基因的引物浓度为200nm,探针浓度为60nm,ge基因的引物浓度为600nm,探针浓度为160nm。
以浓度为106到100copies的gb和gedna标准品作为模板,进行灵敏度检测,每个浓度进行8次real-timerpa检测。结果表明,当gb和ge标准品浓度为106到102copies时,gb和ge基因8次检测均为阳性;其检测结果,channel-1(gb基因)的扩增曲线如图1所示,channel-2(ge基因)扩增曲线如图2所示。当gb和ge标准品浓度为101copies时,gb基因4次检测为阳性,而ge基因3次检测为阳性;当gb和ge标准品浓度为100copies时,gb和ge基因8次检测均为阴性。结果说明,对于gb和ge基因,本发明的检测灵敏度均可达到101copies。
实施例4特异性的检测
采用实施例2中优选地双重实时荧光rpa方法,对保存于河北出入境检验检疫局检验检疫技术中心实验室的伪狂犬病毒(rpv,fa、sh151218株)、猪繁殖与呼吸综合征病毒(prrsv,strainhb-xl)、脑心肌炎病毒(emcv,strainbd)和猪圆环病毒2型(pcv-2,strainhb-mc1);其中prvsh151218株为分离自免疫过bartha-k61疫苗的河北猪场的变异株。
及来自我国商品化弱毒疫苗:伪狂犬病毒(bartha-k61)、猪瘟病毒(csfv,strainav1412)、猪细小病毒(ppv,strainbj-2),这8种病毒进行检测。
使用这些病毒基因组dna或cdna作为模板,双重荧光rpa的反应条件为:39℃,20min。
结果是prv病毒疫苗株bartha-k61仅gb基因阳性(a),而prv野毒株fa和sh151218则gb和ge均为阳性(b)。扩增曲线如图3和图4所示,其中,1:伪狂犬病毒(fa);2:伪狂犬病毒(sh151218);3:伪狂犬病毒(bartha-k61)4:猪瘟病毒;5:猪繁殖与呼吸综合征病毒;6:猪脑心肌炎病毒;7:猪细小病毒;8:猪圆环病毒2型。
结果表明,本发明提供的双重荧光rpa能够特异性的检测并区分prv疫苗株和野毒株。
实施例5对病毒株和临床样品的检测
1.病毒株和临床样品的来源
伪狂犬病毒(rpv,fa株、sh151218株和nqy160308株)保存于河北出入境检验检疫局检验检疫技术中心实验室。prvsh151218株和nqy160308株均为分离自免疫过bartha-k61疫苗的河北猪场的变异株。prvbartha-k61株我国商品化弱毒疫苗.
37份临床样品,包括9份死亡仔猪的脑、淋巴结、肺、肾和全血,8份死亡貉子的脑、淋巴结、肺、肾,以及20份来自健康屠宰猪的脑和淋巴结,均来自河北地区养殖场。对于组织样品,取10mg在1ml无菌pbs中充分匀浆处理,2000rpm离心10min后,取上清用于病毒dna提取。对于全血样品,取1ml用于病毒dna提取。
2.病毒dna/rna提取以及rna的反转录
使用tianampvirusgenomicdna/rnakit(天根生化科技(北京)有限公司,北京)进行病毒核酸提取。取100ng病毒rna,使用primescriptii1ststrandcdnasynthesiskit(宝生物工程(大连)有限公司,大连)进行转录获得cdna。使用nd-2000c核酸浓度测定仪(wilmington,usa)进行病毒dna、cdna浓度测定。所有的病毒dna和cdna均保存于-80℃。
3.对双重real-timerpa方法的验证
使用实施例2中优选地双重real-timerpa方法对3株prv野毒(fa,sh151218和nqy160308),1株疫苗毒(bartha-k61),以及37份临床样品进行prv的鉴别检测,并将检测结果同文献w.ma,k.m.lager,j.a.richt,w.c.stoffregen,f.zhou,k.j.yoon,developmentofreal-timepolymerasechainreactionassaysforrapiddetectionanddifferentiationofwild-typepseudorabiesandgene-deletedvaccineviruses,jvetdiagninvest,20(2008)440-447.中的real-timepcr方法进行比较,其中real-timepcr所用的引物及探针的序列见表1,使用premixextaq(宝生物工程(大连)有限公司,大连)代替原文献中使用的quantitectprobepcrmastermix,使用abi7500进行prv实时荧光pcr检测。
4.结果
本发明提供的real-timerpa和现有的real-timepcr对所有样品的检测结是一致的(21份阳性、20份阴性),其中,21份阳性的检测结果见表2。进一步分析表明,两种方法的检测一致性为100%。所有来自仔猪和貉子的样品prvgb和ge基因均为阳性(见表2),而健康猪的样品prvgb和ge基因均为阴性。所有的prv病毒株(fa,sh151218,nqy160308和bartha-k61)均为gb基因阳性,而仅有bartha-k61为ge基因阴性(见表2)。对于阳性临床样品,real-timerpa的检出时间为7-12min,而real-timepcr所需要的时间约为28-38min,充分说明了real-timerpa方法的快速。
以real-timerpa方法的检测结果(tt)为纵坐标,以real-timepcr方法的检测结果(ct)为横坐标,使用prism软件进行的线性回归分析表明,两种方法对gb基因(a)的检测相关性(r2)为0.983,对ge基因(b)的检测相关性(r2)为0.992,结果见图5和图6。
表2双重荧光rpa和荧光pcr对不同prv和临床样品检测结果比较
本实施例中所有来自死亡仔猪和貉子的临床样品均为prv野毒阳性,后续通过prv分离结果也证实了仔猪和貉子的prv感染。进一步调查表明,貉子在食用了死亡的仔猪后,出现了伪狂犬临床症状并死亡。
本发明提供能够同时鉴别检测prv野毒和疫苗毒的双重real-timerpa方法。该方法的便携性使其能够有效地应用于伪狂犬的现场检测,尤其是资源匮乏地区,同时对伪狂犬的流行病学调查、防控和清除也具有重要意义。
sequencelisting
<110>河北出入境检验检疫局检验检疫技术中心,北京佰鸥创投生物科技有限公司
<120>用于real-timerpa快速检测和区分prv野毒和疫苗毒的核酸及方法
<130>
<160>18
<170>patentinversion3.5
<210>1
<211>30
<212>dna
<213>人工合成
<400>1
gctcttcaaggagaacatcgccccgcacaa30
<210>2
<211>31
<212>dna
<213>人工合成
<400>2
gcgccgatcttggtgtaggtgtcgttggtgg31
<210>3
<211>48
<212>dna
<213>人工合成
<400>3
tctactacaagaacgtcatcgtcacgaccgttggtccgggagcacgta48
<210>4
<211>333
<212>dna
<213>人工合成
<400>4
gctcttcaaggagaacatcgccccgcacaagttcaaggcccacatctactacaagaacgt60
catcgtcacgaccgtgtggtccgggagcacgtacgcggccatcacgaaccgcttcacgga120
ccgcgtgcccgtccccgtgcaggagatcacggacgtgatcgaccgccgcggcaagtgcgt180
ctccaaggccgagtacgtgcgcaacaaccacaaggtgaccgccttcgaccgcgacgagaa240
ccccgtcgaggtggacctgcgcccctcgcgcctgaacgcgctcggcacccgcggctggca300
caccaccaacgacacctacaccaagatcggcgc333
<210>5
<211>32
<212>dna
<213>人工合成
<400>5
accccgaggacgagttcagcagcgacgaggac32
<210>6
<211>31
<212>dna
<213>人工合成
<400>6
tcaacaggcggttggcggtcacgccatagtt31
<210>7
<211>48
<212>dna
<213>人工合成
<400>7
ccgaggaggcgccccgctccggcttcgacgttggttccgcgatccgga48
<210>8
<211>156
<212>dna
<213>人工合成
<400>8
accccgaggacgagttcagcagcgacgaggacgacgggctgtacgtgcgccccgaggagg60
cgccccgctccggcttcgacgtctggttccgcgatccggagaagccggaagtgacgaatg120
gacccaactatggcgtgaccgccaaccgcctgttga156
<210>9
<211>24
<212>dna
<213>人工合成
<400>9
atgcccgctggtggcggtctttgg24
<210>10
<211>19
<212>dna
<213>人工合成
<400>10
ctacagggcgtcggggtcc19
<210>11
<211>19
<212>dna
<213>人工合成
<400>11
atgcggccctttctgctgc19
<210>12
<211>21
<212>dna
<213>人工合成
<400>12
ttaagcggggcgggacatcaa21
<210>13
<211>23
<212>dna
<213>人工合成
<400>13
acaagttcaaggcccacatctac23
<210>14
<211>21
<212>dna
<213>人工合成
<400>14
gtcygtgaagcggttcgtgat21
<210>15
<211>17
<212>dna
<213>人工合成
<400>15
acgtcatcgtcacgacc17
<210>16
<211>21
<212>dna
<213>人工合成
<400>16
cttccactcgcagctcttctc21
<210>17
<211>19
<212>dna
<213>人工合成
<400>17
gtraagttctcgcgcgagt19
<210>18
<211>16
<212>dna
<213>人工合成
<400>18
ttcgacctgatgccgc16
- 还没有人留言评论。精彩留言会获得点赞!