miR‑133b在前列腺癌骨转移诊断、预测、治疗中的应用的制作方法
本发明属于分子生物学领域,更具体地涉及mir-133b在前列腺癌骨转移诊断、预测、治疗中的应用。
背景技术:
前列腺癌(prostatecancer,pca)是男性泌尿生殖系统最常见的恶性肿瘤之一。癌症转移会大大增加前列腺癌患者的死亡率,骨是癌症转移的第二最常见部位,在我国超过80%的前列腺癌患者在确诊时已经发生骨转移,而骨转移是导致前列腺癌患者死亡的重要原因,因此,对骨转移的早期诊断,是临床诊疗和预后的关键。此外,对于中晚期前列腺癌患者,手术治疗的效果差,大多数采用药物治疗。根据不同的病情可以采用化学药物治疗、外放射治疗、放射性核素内放射治疗以及各种疗法的综合应用等。然而,放化疗药物不仅作用于肿瘤,还可以作用于肿瘤周围健康的组织,因而在杀伤肿瘤的同时,也给机体带来了很大的副作用,最终影响对肿瘤的治疗效果。因此,本领域迫切需要开发早期判断前列腺癌骨转移的特异性标志物及前列腺癌骨转移的靶向药物。
mirna是具有18~24个核苷酸的非编码rna,其结合信使rna的3’未翻译区域中的互补性位点且抑制它们的翻译。单一mirna能够靶向若干mrna且调控细胞通路和细胞命运。已有研究表明,一些mirna会促进肿瘤细胞转移,如脑癌中的mir-10b、结肠直肠癌中的mir-21、前列腺癌中的mir-184。也有发现抑制前列腺癌骨转移的一些mirna,如mir-143、mir-145和mir-203。目前尚没有mir-133b与前列腺癌骨转移之间的报道。
技术实现要素:
本发明的目的在于提供mir-133b在制备前列腺癌骨转移诊断试剂、预测试剂、抑制骨转移药物中的应用。
本发明所采取的技术方案是:
mir-133b在制备前列腺癌骨转移诊断和/或预测试剂盒中的应用。
作为上述应用的优选,所述试剂含有能定量检测mir-133b和/或其编码基因的试剂。
作为上述应用的优选,所述试剂含有mir-133b的特异性引物、探针及芯片中的一种或多种。
作为上述应用的优选,所述mir-133b选自pri-mirna、pre-mirna、成熟mirna、dsmirna及其片段或变体中的一种或几种。
诊断和/或预测前列腺癌骨转移的试剂盒,含有能定量检测mir-133b和/或其编码基因的试剂。
mir-133b在制备抑制前列腺癌骨转移的药物中的应用。
作为上述应用的优选,所述药物含有以下物质中的一种或多种:1)能促进mir-133b表达的物质;2)能增强mir-133b活性的物质;3)能增长mir-133b有效作用时间的物质;4)能增强mir-133b稳定性的物质;5)模拟mir-133b结构的物质。
作为上述应用的优选,所述药物含有以下物质中的一种或多种:1)mir-133b分子;2)mir-133b修饰物;3)mir-133b模拟物;4)编码mir-133b的dna;5)表达mir-133b的载体或病毒。
作为上述应用的优选,所述mir-133b选自pri-mirna、pre-mirna、成熟mirna、dsmirna及其片段或变体中的一种或几种。
抑制前列腺癌骨转移的药物,所述药物含有以下物质中的一种或多种:1)能促进mir-133b表达的物质;2)能增强mir-133b活性的物质;3)能增长mir-133b有效作用时间的物质;4)能增强mir-133b稳定性的物质;5)模拟mir-133b结构的物质。
本发明的有益效果是:
本发明研究发现mir-133b在前列腺癌中低表达,在前列腺癌骨转移中表达量更低,且进一步研究发现,mir-133b低表达与前列腺癌骨转移相关,并预示着更短的无骨转移生存时间,此外,过表达mir-133b能在体外抑制前列腺癌迁移和侵袭,在体内抑制前列腺癌骨转移,并且mir-133b模拟物同样能在体内抑制前列腺癌骨转移,以上结果表明,mir-133b可应用于制备前列腺癌骨转移诊断试剂、预测试剂及抑制骨转移药物中。
附图说明
图1:临床样品及细胞系中mir-133b的表达情况;其中,图a为前列腺癌组织(206例)和良性前列腺组织(48例)中mir-133b的表达情况,图b为20对配对的前列腺癌组织和癌旁组织中mir-133b的表达情况,图c为前列腺癌骨转移和无骨转移组织中mir-133b的表达情况;图d为良性前列腺细胞及前列腺癌细胞中mir-133b的表达情况;图中,癌症/良性表示前列腺癌组织中mir-133b的表达量/良性前列腺组织中mir-133b的表达量;癌症/癌旁表示前列腺癌组织中mir-133b的表达量/癌旁组织中mir-133b的表达量;
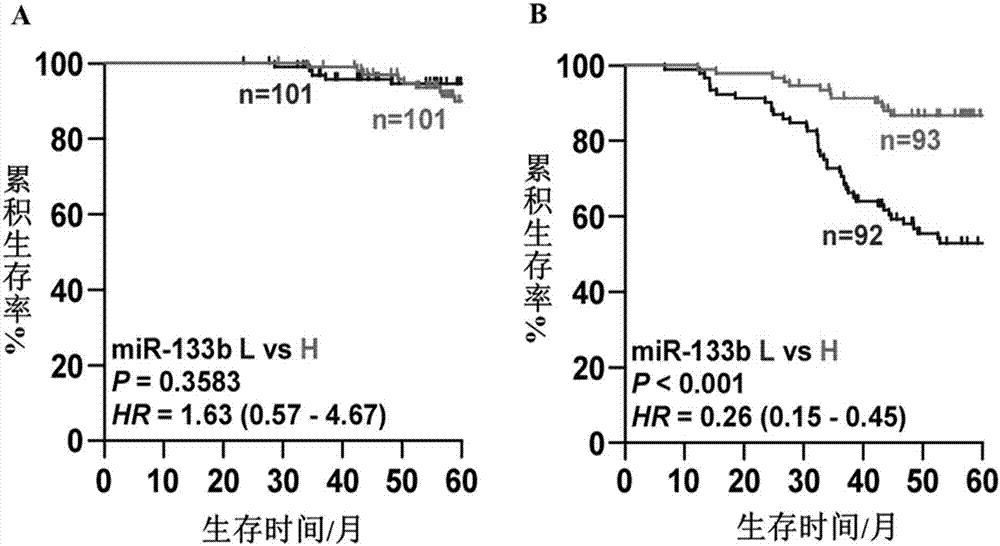
图2:前列腺癌总生存时间和无骨转移生存时间与mir-133b表达量的关系;其中,图a为前列腺癌总生存时间与mir-133b表达量的关系,图b为无骨转移生存时间与mir-133b表达量的关系,图中,l为mir-133b低表达组,h为mir-133b高表达组;
图3:构建的表达载体转染到前列腺癌细胞系中mir-133b的表达情况;
图4:mir-133b过表达在体外抑制前列腺癌迁移和侵袭结果;
图5:mir-133b过表达在体内抑制前列腺癌骨转移结果;其中,图a为bli成像示意图,图b为骨x射线图,图c为骨he染色图,图d为x射线检测骨转移评分结果;图e为bli信号结果图;图f为无骨转移生存曲线,图g为总生存曲线,图中,vector表示对照组,mir-133b表示mir-133b组;
图6:mir-133模拟物能抑制前列腺癌骨转移结果。其中,图a为bli成像示意图,图b为骨x射线图,图c为骨he染色图,图d为x射线检测骨转移评分结果;图e为bli信号结果图;图f为总生存曲线,图中,vector表示对照组,agomir-133b表示mir-133b模拟物组。
具体实施方式
现结合具体实验例进一步阐述本发明,但并不局限于此。下述实验例中所使用的实验方法如无特殊说明,均为常规方法,具体条件未注明的,按常规操作或厂家所建议的条件,下述实验例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
本发明的人前列腺癌细胞系22rv1、pc-3、vcap、du145、lncap和正常的人前列腺上皮细胞rwpe-1由中科院上海细胞库提供;人前列腺癌细胞c4-2b购自md安德森癌症中心;以上细胞系培养方法按本领域常规操作;202例前列腺癌组织(包括20例配对的前列腺癌组织及癌旁组织)、48例良性前列腺组织由广东省医学分子诊断协同创新发展中心临床生物样品库(江门市中心医院)提供,以上临床标本均来自手术过程或穿刺活检,经临床病理学确诊。
实验例1、mir-133b在前列腺癌组织中低表达,在骨转移前列腺癌组织中进一步低表达
方法:
rna提取、逆转录和实时定量rt-pcr检测mir-133b:根据rna提取试剂(qiagen公司)说明书提取所有组织和细胞的总rna,按照revertaidfirststrandcdnasynthesiskit(thermofisher公司)说明书进行逆转录,利用iqsybrgreen试剂和cfx96实时定量pcr系统(bio-rad公司),选用2-ddct相对定量法进行荧光定量检测,以u6为内参,求算mir-133b的相对表达量,mir-133b和u6的引物由广州市锐博生物科技有限公司设计、合成和纯化。
结果:
临床标本和细胞系中mir-133b表达量结果如图1所示,图1a表明,相对于良性前列腺组织,前列腺癌组织中mir-133b呈现低表达,同样的,图1b表明,相对于配对的癌旁组织,配对的前列腺癌组织中mir-133b呈现低表达。图1c进一步显示,与非骨转移前列腺癌组织相比,骨转移前列腺癌组织中mir-133b表达量更低。另外,参考图1d,对比正常的人前列腺上皮细胞系rwpe-1,前列腺癌细胞系22rv1、pc-3、vcap,du145、lncap、c4-2b均呈现mir-133b低表达,其中,骨转移前列腺癌细胞系pc-3、c4-2b中mir-133b表达量更低,以上结果一致表明,mir-133b在前列腺癌组织/细胞中低表达,在骨转移前列腺癌组织/细胞中进一步低表达,因此,mir-133b可作为前列腺癌骨转移的生物标志物,可应用于制备前列腺癌骨转移的诊断试剂。
实验例2、mir-133b低表达与前列腺癌患者骨转移状态和无骨转移生存时间相关
根据临床标本骨转移状态,结合检测的mir-133b表达量进行相关性分析,根据前列腺癌组织中mir-133b表达量的中位值将患者划分为mir-133b高表达组和mir-133b低表达组,分析结果如表1所示,mir-133b表达量与前列腺癌骨转移相关。
表1、mir-133b表达量与前列腺癌患者骨转移状态的相关性
根据临床标本的随访数据,采用kaplan-meier法统计mir-133b的表达量与前列腺癌患者的5年总生存时间和5年无骨转移生存时间的相关性,结果图2所示,参照图2a,mir-133的表达量与前列腺癌患者的总生存时间无关,然而,出人意料的是,图2b显示,mir-133的低表达则与更短的无骨转移生存时间相关。以上结果表明,mir-133b低表达预示着更高的骨转移风险,可作为前列腺癌骨转移的预测试剂。
实验例3、mir-133b过表达能在体外抑制前列腺癌迁移和侵袭
方法:
将人mir-133b(mirbase编号mimat0000770)基因克隆到pmscv-puro逆转录病毒载体(clontech公司)中,获得mir-133b表达质粒,分别将阴性对照质粒或mir-133b表达质粒转染到pc-3细胞、c4-2b细胞和vcap细胞中,采用transwell小室法检测细胞迁移和侵袭情况,采用荧光定量检测mir-133b的表达情况。
结果:
构建的mir-133b表达质粒转染到pc-3细胞、c4-2b细胞和vcap细胞中,mir-133b的表达量图3所示,mir-133b表达质粒能上调的mir-133b表达,可用于进一步研究。
细胞迁移和侵袭实验结果如图4所示,在体外,过表达mir-133b能显著抑制pc-3细胞、c4-2b细胞和vcap细胞的迁移和侵袭。
实验例4、mir-133b过表达能在体内抑制前列腺癌骨转移
实验分组及动物模型构建:
①mir-133b组
将荧光酶素基因转染到pc-3细胞,形成稳定表达的荧光酶素的pc-3细胞(pc-3-luc),将实验例3构建的mir-133b表达质粒转染到pc-3-luc中,形成稳定高表达mir-133b的pc-3-luc,将其通过左心室注射到5~6周龄的雄性balb/c裸鼠中。
②对照组
将荧光酶素基因转染到pc-3细胞,形成稳定表达的荧光酶素的pc-3细胞(pc-3-luc),将对照载体pmscv-puro转染到pc-3-luc中,形成阴性对照的pc-3-luc,将其通过左心室注射到5~6周龄的雄性balb/c裸鼠中。
影像学检测:
通过生物荧光成像系统(bli)监测前列腺癌骨转移情况,x射线拍片检查骨转移处骨质破坏情况,并测量骨质破坏区的大小(以平方毫米计),根据骨质破坏程度进行评分,0:无转移,1:骨质破坏区域占总骨区域<1/4;2:骨质破坏区域占总骨区域的1/4~1/2,3:骨质破坏区域占总骨区域的1/2~3/4,4:骨质破坏区域占总骨区域大于3/4,计算四肢总和;最后he染色小鼠胫骨肿瘤切片,进行组织病理学鉴定。
结果:
影像学检测前列腺癌骨转移情况如图5所示,其中,bli监测结果如图5a显示,与对照组相比,45天后,mir-133b组的骨转移区域显著减少;x射线检测如图5b显示,与对照组相比,mir-133b组小鼠的溶骨破坏程度小,he染色小鼠胫骨肿瘤切片结果如图5c,与对照组相比,mir-133b组小鼠骨中的肿瘤量更低;更进一步的,可以发现mir-133b组小鼠的骨转移位点更少,骨质破坏程度更低,总生存时间和无骨转移生存时间更长(参照图5d~5g)。以上结果均说明,mir-133b过表达能在体内抑制前列腺癌骨转移,该结果预示着mir-133b可应用于制备抑制前列腺癌骨转移药物。
实验例5、mir-133b模拟物能抑制前列腺癌骨转移
方法:
前列腺癌动物模型的建立:将pc-3-luc从左心室注射到5~6周龄的balb/c裸鼠中。
实验分组:①mir-133b模拟物组:将mir-133b模拟物(agomir-133b)通过尾静脉注射到骨转移小鼠体内;②对照组:将对照质粒模拟物通过尾静脉注射到骨转移小鼠体内。
当骨转移肿瘤能被检测到时,采用影像学检测方法进行骨转移检测。
结果:
如图6所示,与对照组相比,mir-133b模拟物能抑制前列腺癌骨转移,接种mir-133b模拟物能使前列腺癌小鼠骨转移位点更少,溶骨破坏程度更低,骨中的肿瘤量更少,总生存时间更长(参考图6a~6f);以上结果均说明,mir-133b模拟物有望作为前列腺癌的治疗药物,用于抑制前列腺癌骨转移。
- 还没有人留言评论。精彩留言会获得点赞!