一种有效抑制大曲中土味素形成的微生物菌剂的制作方法
本发明涉及一种有效抑制大曲中土味素形成的微生物菌剂,属于白酒酿造技术领域。
背景技术:
白酒是我国特有的一种蒸馏酒,并深得消费者的喜爱。白酒香味成分复杂是众所周知的,每种白酒都是由几百种香味成分组分的集合体。而这些呈香物质的来源,与白酒的生产过程是离不开的。
土霉味物质土臭素(geosmin),是白酒酿造或者大曲生产过程中存在的一种异味物质。在前期的研究中,已有报道从清香型白酒厂生产的大曲中筛选得到四株产geosmin的菌株,解决了清香型白酒中土霉味物质geosmin来源的问题。筛选得到的四株链霉菌可以作为模式菌,用于白酒生产中产geosmin菌株的检测及其产生机理的研究。
因此,开发一些能够抑制大曲中土味素形成的方法,对于提高白酒风味品质具有深远影响。
技术实现要素:
基于现有技术,本发明提供了一种能够有效抑制大曲中土味素形成的方法。本发明方法,通过使用组合菌剂,以方便有效地降低了大曲中土味素的含量,另一方面得到的大曲应用于白酒酿造时会白酒的风味成分、理化指标几无影响。
本发明的第一个目的是提供一种能够抑制土味素形成的微生物菌剂,所述微生物菌剂中含有:发酵毕赤酵母、酿酒酵母、米曲霉、东方伊萨酵母、异常威克汉姆酵母、库德毕赤酵母、解淀粉芽孢杆菌。
在一种实施方式中,发酵毕赤酵母可以是cgmcc2.3679、cgmcc2.1838或cgmcc2.3995。
在一种实施方式中,酿酒酵母可以是cgmcc2.3852、cgmcc2.2679、cgmcc2.2078或cgmccm4744(已在申请公布号cn102226155a、申请公布日2011.10.26的专利申请文件中公开)。
在一种实施方式中,米曲霉可以是cgmcc3.4383、cgmcc3.2792或cgmcc3.765。
在一种实施方式中,东方伊萨酵母可以是cgmcc2.192、cgmcc2.2734或cgmccm4741。
在一种实施方式中,异常威克汉姆酵母可以是cgmccno.12416,已在申请公布号cn105861346a、申请公布日2016.08.17的专利申请文件中公开。
在一种实施方式中,库德毕赤酵母为cgmccno.12418,已在申请公布号cn105861345a、申请公布日2016.08.17的专利申请文件中公开。
在一种实施方式中,解淀粉芽孢杆菌可以是cgmccno.1.398、cgmccno.1.414或cgmccno.1.769。
在一种实施方式中,所述微生物菌剂为发酵毕赤酵母cgmcc2.1838、酿酒酵母cgmccm4744、米曲霉cgmcc3.2792、东方伊萨酵母cgmccm4741、异常威克汉姆酵母cgmccno.12416、库德毕赤酵母cgmccno.12418、解淀粉芽孢杆菌cgmccno.1.414。
在一种实施方式中,所述微生物菌剂中各菌的含量依次为(106~1010)cfu/g、(106~1010)cfu/g、106~109个/g、(106~1010)cfu/g、(106~1010)cfu/g、(106~1010)cfu/g、(107~109)cfu/g。
在一种实施方式中,所述微生物菌剂是将各菌分别活化培养后,按照体积质量比为(1~2):(1~2):(1~2):(1~2):(1~2):(1~2):(1~2)的比例混合得到的。
在一种实施方式中,酵母菌液制备方法:接一环酵母菌体于液体酵母菌剂培养基1或2中,30℃培养24h。其中液体酵母菌剂培养基1(g/l):酵母膏10,蛋白胨20,葡萄糖20,蒸馏水配制,1×105pa灭菌20min;液体酵母菌剂培养基2:以白酒酿造所用的原料为培养基成分,原料选用高粱、大麦、小麦、豌豆、麸皮及其各种不同比例的混合配方制取液体种子培养基,制作方式为:原料样品经粉碎后,与水按1︰1~4(w/v)的比例混合后,蒸煮1~5h,冷却后加入糖化酶10~50单位/g原料,于40~80℃保持2~10h,过滤、离心所得滤液,调节。
在一种实施方式中,细菌菌剂的制作方法:接一环细菌菌体于液体细菌菌剂培养基1或2中,37℃培养24h。其中液体细菌菌剂培养基1(g/l):牛肉膏5,蛋白胨10,nacl5,蒸馏水配制,ph7.0,1×105pa灭菌20min。液体细菌菌剂培养基2:以白酒酿造所用的原料为培养基成分,原料选用高粱、大麦、小麦、豌豆、麸皮及其各种不同比例的混合配方制取液体种子培养基,制作方式为:原料样品经粉碎后,与水按1︰1~4(w/v)的比例混合后,蒸煮1-5h,冷却后加入糖化酶10~50单位/g原料,于40~80℃保持2~10h,过滤、离心所得滤液,调节糖度为10~15°bx,调节ph为4~7。液体细菌菌剂培养方法,。
在一种实施方式中,霉菌菌剂的制作方法:接一环霉菌菌体于固体霉菌菌剂培养基1或2中,30℃培养2~3h。其中固体霉菌菌剂培养基1:选用高粱、大麦、小麦、豌豆、麸皮及其各种不同比例的混合配方制取固体种子培养基,制作方式为:原料样品经粉碎后,与水w/v按1︰0.5~2的比例混合后,80~100℃蒸煮30min。固体霉菌菌剂培养基2:在新鲜酒糟加入0.1-1mol/lnaoh溶液调节酸度为0~5;
按照上述培养方法制作得到菌液或者菌剂,酵母总活菌数达到106~1010cfu/g,细菌总活菌数达到107-109cfu/g,霉菌孢子总数106~109个/g。
在一种实施方式中,所述微生物菌剂中还包括基质载体,比如小麦、大麦、高粱、麸皮等等。
本发明的第二个目的是提供所述微生物菌剂的应用。
在一种实施方式中,所述应用,是用于酿造技术领域中抑制土味素形成。
在一种实施方式中,所述应用是用于白酒酿造。
在一种实施方式中,所述应用是在白酒酿造过程中微生物菌剂。
在一种实施方式中,所述应用是在白酒大曲的制备原料中接种微生物菌剂进行大曲制备。
本发明的第三个目的是提供一种大曲的生产方法,所述方法是在白酒大曲的制备原料中接种微生物菌剂进行大曲制备。
在一种实施方式中,所述大曲为中高温大曲。
本发明的优点和效果:
本发明的微生物菌剂中,含有能够有效抑制产土味素的白色链霉菌菌株的抑制菌,有效地降低了大曲中土味素的形成;同时,这些抑制菌也是白酒生产过程中一些主要菌种,通过协同效应,有效地保证了大曲微生物的平衡,在不会对白酒生产产生不利影响,而且还能提高风味物质以及酒精产量。本发明的微生物菌剂,组分简单,配制简便,使用方法简单。
附图说明:
图1:土味素标准曲线;
图2:不同培养时期大曲中土味素含量;
图3:共培养示意图;
图4:试验曲块中土味素含量;其中同一培养天数下的柱状从左到右依次为实验组a、实验组b、空白。
具体实施方案
大曲中土味素的测定方法:
(1)样品处理:称取大曲样品10g于50ml离心管中,加入20ml煮沸10min的超纯水混匀,于30℃条件下超声30min,4000rpm离心10min,收集上清液。重复上述操作两次,加水量分别为10ml和5ml。收集3次超声后的上清液,混匀后备用。
分别取大曲的提取液8ml于顶空瓶,加入10μl浓度为4μg/ml的内标薄荷醇,使得终浓度为5μg/l,gc-ms分析检测。
(2)样品的检测:gc-ms检测条件:在60℃恒温萃取45分钟,样品通过上述气相毛细管柱进行分离,分离后的样品用质谱仪鉴定。其中ms条件:ei电离源能量70ev,离子源温度:230℃,扫描离子范围30-350amu。检测获得质谱数据经过与nist05a.ldatabase(agilenttechnologiesinc.)进行比对。
(3)制备标准曲线
取土味素含量最低的培养阶段的大曲,制得大曲浸泡液。设置6个浓度梯度,分别为25μg/l、12.5μg/l、6.5μg/l、3.5μg/l、2μg/l、1μg/l,标样中分别加入10μl薄荷醇(终浓度5μg/l)和8ml大曲浸泡液,进行gc-ms检测,方法同(2)。
下面是对本发明进行具体描述。
实施例1:不同时期传统凤香型大曲中土味素含量变化结果与分析
(1)通过gc-ms气质联用提特征离子112/95的方法检测样品中土味素含量,根据加入的土味素标准样出峰时间作为参照,确定土味素的保留时间在23.6min左右。加入的内标薄荷的保留时间19.7-19.8min左右。
以土味素和薄荷醇的峰面积比为横坐标s/s,以两者的浓度比c/c为纵坐标,制作标准曲线,得到拟合方程y=0.3297x+0.2787,拟合系数r为0.9857。
土味素标准曲线如图1所示。
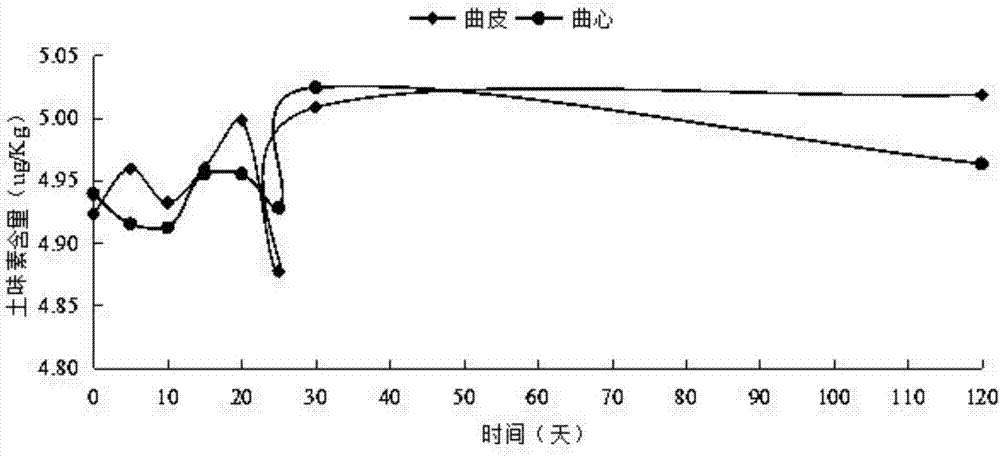
(2)如图2所示,为不同培养时期大曲中土味素含量
从图2可看出,大曲培养期间,土味素的含量在5μg/kg曲左右,曲皮中土味素含量略高于曲心,随着培养时间的延长,两者的土味素含量均呈现逐渐升高的趋势,以出房(30d)时期曲心中土味素含量达到最高。从出房到投产期间,曲皮中土味素含量不再呈大幅升高的趋势。刚入房的大曲曲皮微生物种类、数量均多于曲心,菌体代谢产物量多,因此入房初期的曲皮土味素含量会比曲心高,随着培养时间延长,微生物逐渐向曲心生长,土味素含量变化也符合微生物从曲皮到曲心生长的规律,入房25d后的曲心土味素含量明显高于曲皮,这是大曲后期曲皮中的水分减少,微生物生长集中至曲心,因此代谢产物在曲心中得到大量积累。
实施例2:产土味素菌株的筛选
(1)平板初筛
将大曲中分离纯化的菌种进行平板培养,培养结束后,由3位经过培训,熟知目的香气的闻香人员通过闻香检测,以闻香是否产生土霉味作为初筛依据。
(2)液体复筛
将初筛的菌株进行液体培养一周,发酵结束后,6000rpm离心15min,收集上清液。顶空固相微萃取(hs-spme-gc-ms)检测产物中的风味物质:20ml顶空瓶中加入8ml菌体发酵上清液,3gnacl,10μl4ppm的内标薄荷醇。gc条件:样品通过db-ffap(60m×0.25mm×0.25μm,j&wscientific)色谱柱进行分离,进样口温度250℃,载气he,流速2mlmin-1,不分流进样,程序升温为:50℃保持2min,以6℃min-1速率升温至230℃,并保持15min;ms条件:ei电离源,离子源温度230℃,电子能量70ev,扫描范围35.0~350.0amu。检测分析发酵产物中是否产生土味素。
(3)筛选结果
从大曲中筛选到的产土霉素菌株f5a-1菌落微小,表面白色粉末状,较干燥,在培养基上有浓烈的土霉气味。将分离得到的菌株f5a-1单菌落接种到ypd液体培养基上,30℃下培养48h后提取基因组。应用放线菌/链霉菌特异分类引物完成pcr反应。经凝胶电泳检测,克隆结果呈阳性。分子鉴定后,在ncbi上进行序列比对,其核酸序列与白色链霉菌相似度达到99%,结合碱性美兰染色法的显微镜观察,确定其为链霉菌属的白色链霉菌。
此外,在前期研究中,还得到了一株产土臭素的白色链霉菌lbg-fxj,保藏编号cgmccno.4206,已在cn102719375b中公开。
实施例3:产土味素菌株的抑制菌的效果确认
抑制菌与白色链霉菌f5a-1平板共培养:将液体培养好的各抑制菌的发酵液分别吸取100ul与100ul的白色链霉菌发酵液混合涂布平皿,30℃培养箱培养(如图3)。
空白对照1:分别吸取100ul的各抑制菌发酵液涂布平皿,30℃培养箱培养。
空白对照2:吸取100ul的白色链霉菌发酵液涂布于平皿上,30℃培养箱培养。
观察实验组与空白组,研究抑制菌抑菌情况。
结果如表1所示。采用白色链霉菌lbg-fxj替代f5a-1,结果类似。
表1菌株对传统凤型大曲中白色链霉菌的抑制
酿酒酵母在白酒发酵中起主要作用,主要代谢产生酒精,在酒醅发酵后期起主要作用。发酵毕赤酵母为白酒中既产生白酒香味物质又能够进行发酵的菌株,对白酒发酵中酯类产生具有一定贡献。异常威克汉姆酵母在白酒生产中既能有一定的酒精产量,又能很好地满足白酒对酯香的要求,特别是乙酸乙酯,兼具了酒精酵母和产酯酵母的双重特性。
实施例4:产土味素菌株的抑制菌的相互作用分析
(1)菌种的活化
将抑制菌(组合1:发酵毕赤酵母cgmcc2.1838、酿酒酵母cgmccm4744、米曲霉cgmcc3.2792、东方伊萨酵母cgmccm4741、库德毕赤酵母cgmccno.12418、枯草芽孢杆菌cgmcc1.629;组合2:发酵毕赤酵母cgmcc2.1838、酿酒酵母cgmccm4744、米曲霉cgmcc3.2792、东方伊萨酵母cgmccm4741、异常威克汉姆酵母cgmccno.12416、库德毕赤酵母cgmccno.12418、解淀粉芽孢杆菌cgmccno.1.414)从甘油管转接至ypd培养基上,酵母30℃、芽孢杆菌37℃,培养箱培养。
(2)液体培养
将ypd平板上长好的菌株分别接至yped培养基中,酵母30℃、细菌37℃,200r/min条件下液体培养。
(3)单菌落的培养
将培养好的菌液进行稀释,酵母稀释10-3、10-4倍,细菌稀释10-6、10-7倍。将稀释液吸取100ul,涂布于ypd培养基上,酵母30℃、细菌37℃培养箱培养,至长出单菌落。
(4)抑制菌相互关系研究
将其中一株菌以适宜的浓度(可以覆盖培养基)接种于ypd培养基上,1h后接入另一株菌的单菌落的菌饼,共培养并观察有无抑制现象,每组两个平行试验。
结果显示,主要抑制剂之间相互没有抑制关系,可以相互组合。
实施例5:低土味素大曲的制备
设置两组抑制菌组合,组合1:抑制白色链霉菌f5a-1效果好,高产异戊醇;组合2:抑制白色链霉菌f5a-1效果较好,相对低产异戊醇、高产乙酸乙酯,且能够水解蛋白质和淀粉。
组合1:发酵毕赤酵母cgmcc2.1838、酿酒酵母cgmccm4744、米曲霉cgmcc3.2792、东方伊萨酵母cgmccm4741、库德毕赤酵母cgmccno.12418、枯草芽孢杆菌cgmcc1.629。
组合2:发酵毕赤酵母cgmcc2.1838、酿酒酵母cgmccm4744、米曲霉cgmcc3.2792、东方伊萨酵母cgmccm4741、异常威克汉姆酵母cgmccno.12416、库德毕赤酵母cgmccno.12418、解淀粉芽孢杆菌cgmccno.1.414。
(1)抑制菌组合的发酵液配制
将以上各单菌株摇瓶培养或者制备孢子悬液,使其浓度达到108~109后停止培养,然后按照各菌按照等浓度混合,得到组合菌剂。
(2)白色链霉菌f5a-1孢子悬液的制备
将白色链霉菌f5a-1涂布于平板上培养,待长出孢子且较多时停止培养,将孢子从培养基表面轻轻刮于适量的无菌生理盐水中,混合均匀后用无菌脱脂棉塞住漏斗口进行过滤,得到孢子悬液,血球计数板计数,按表2进行稀释。
(3)制做试验曲块
按表2配菌液组合,然后与30g大曲原料及水,使得曲块含水量为43%,混合均匀后转入模型中,制作试验曲块。
表2抑制菌组合浓度配比
(4)试验曲块的培养
将制好的试验曲块放入铺有纱布的平皿中,盖上扎了孔的保鲜膜,置于培养箱进行模拟传统凤型大曲培养过程,适时调节温度及湿度,培养30天。
(5)取样
在曲块培养0、4、8、12、16、20、30天时取样,前20天每隔3天取一次样,后10天取一次样。每次取不同组合、不同浓度比例的曲块,2个平行。
(6)gc-ms检测大曲培养过程中土味素变化情况
①样品的处理
称取不同培养时期的试验曲10g于50ml离心管中,加入20ml煮沸10min的超纯水混匀,于30℃条件下超声30min,4000rpm离心10min,收集上清液。重复上述操作两次,加水量分别为10ml和5ml。收集3次超声后的上清液,混匀后备用。
②样品的检测
分别取不同培养时期试验曲的提取液8ml于顶空瓶,加3gnacl,10μl浓度为4μg/ml的内标薄荷醇,使得终浓度为5μg/l,gc-ms分析检测。
gc-ms检测条件:在60℃恒温萃取45分钟,样品通过上述气相毛细管柱进行分离,分离后的样品用质谱仪鉴定。其中ms条件:ei电离源能量70ev,离子源温度:230℃,扫描离子范围30-350amu。检测获得质谱数据经过与nist05a.ldatabase(agilenttechnologiesinc.)进行比对。
结果如图4所示。由图4可以看出,白色链霉菌空白对照的曲块在培养过程中土味素含量逐渐升高,到后期趋于稳定,约14ug/kg。菌株组合1在大曲培养过程中土味素含量也是逐渐升高的,但在16天前比空白对照中土味素含量低很多,20天至30天阶段比对照稍低,约为13ug/kg。组合2中土味素含量呈现先增加后减少的趋势,在16天含量达到最高13.9ug/kg,20天至30天逐渐降低至9.2ug/kg。
由现有的数据可以看出,组合1和组合2均有抑制白色链霉菌的效果,不过相比之下,组合1最终降低土味素约7.14%,组合2最终降低土味素约34.28%,组合2比组合1的效果要好。
此外,发明人还大量实验了其他微生物组合,比如:
组合3:发酵毕赤酵母cgmcc2.3679、酿酒酵母cgmccm4744、米曲霉cgmcc3.2792、东方伊萨酵母cgmcc2.192、异常威克汉姆酵母cgmccno.12416、库德毕赤酵母cgmccno.12418、解淀粉芽孢杆菌cgmccno.1.398。结果显示,培养30d后最终降低了土味素24%左右。
组合4:发酵毕赤酵母cgmcc2.3995、酿酒酵母cgmccm4744、米曲霉cgmcc3.765、东方伊萨酵母cgmccm4741、异常威克汉姆酵母cgmccno.12416、库德毕赤酵母cgmccno.12418、解淀粉芽孢杆菌cgmccno.1.769。结果显示,培养30d后最终降低了土味素15%左右。
- 还没有人留言评论。精彩留言会获得点赞!