用于微生物共培养的组合物和方法与流程
本申请要求2016年5月26日提交的临时专利申请62/341,984的优先权,其全部内容通过引用并入本文。
关于联邦政府资助的研究或开发的声明
本发明是在由国家科学基金会(nationalsciencefoundation)授予的拨款号1355957和1448990的政府支持下完成的。政府拥有本发明中的某些权利。
发明领域
本文提供了用于生产γ-聚谷氨酸(pga)的组合物和方法。具体地,本文提供了用于生产pga的微生物共培养系统和方法。
发明背景
γ-聚谷氨酸(pga)是谷氨酸的阴离子聚合物,其由于其独特的可吸收的、无毒的、可生物降解的、非免疫原性的以及富含可用的羧酸基团(bajaj和singhal,2011)的特性,具有大范围的潜在商业应用。pga是相对较新的材料,但对其的商业利益正在增长。
pga可以通过谷氨酸的化学聚合或经由微生物生物合成来生产,其中后者更具成本效益。然而,微生物生物合成需要添加柠檬酸和其他试剂,这增加了成本。
需要用于生产pga的改进方法。
技术实现要素:
本文提供了用于生产γ-聚谷氨酸(pga)的组合物和方法。具体地,本文提供了用于生产pga的细菌共培养系统和方法。
在一些实施方式中,本文提供了生产γ-聚谷氨酸(pga)的方法,包括:a)使真菌与第一原料接触;b)发酵该真菌以产生柠檬酸;c)使来自步骤b)的柠檬酸与芽孢杆菌属(bacillussp.)和第二原料接触;以及d)发酵该芽孢杆菌属(bacillussp.)细菌以产生pga。在一些实施方式中,该一个或多个步骤还包括添加甘油、谷氨酸或谷氨酰胺中的一种或多种。在一些实施方式中,步骤b)和d)在相同或不同的生物反应器中进行。本公开不限于特定的真菌。实例包括但不限于黑曲霉(aspergillusniger),解脂耶氏酵母(yarrowialipolytica)或假丝酵母(candidaoleophila)。本公开不限于特定细菌。实例包括但不限于枯草芽孢杆菌(bacillussubtilis)(例如,菌株ifo3335、tam-4、c1、c10、chungkookjang、nx-2、mr-141、cgmcc0833、r23、er1001、er1007、er1064、er1012或rky3)或地衣芽孢杆菌(bacilluslicheniformis)(例如,菌株sab-26、a35、atcc9945、cc12826、wbl-3或ncim2324)。在一些实施方式中,在步骤b)之后分离柠檬酸。在一些实施方式中,第一和第二原料选自,例如,糖蜜、提余液、果渣、果皮、玉米淀粉、小麦淀粉、高粱、啤酒厂废弃物、玉米秸秆、废藻饼或甘油。在一些实施方式中,第一和第二原料是来自农作物和食品加工、生物燃料或生物化学品生产或生物柴油生产的副产物。在一些实施方式中,生物反应器包括选自例如分布器、混合/搅拌系统、温度控制系统、ph控制系统或消泡控制系统的一种或多种组件。在一些实施方式中,混合/搅拌系统是例如由马达驱动的叶轮、涡轮或桨叶中的一种或多种。在一些实施方式中,步骤a)或b)还包括使真菌细菌与一种或多种选自例如氮源、磷源、碳源、盐或一种或多种额外营养素的额外成分接触。在一些实施方式中,氮源以约0.1-50g总n/l的浓度存在,并且选自例如酵母提取物、蛋白胨、胰蛋白胨、尿素、玉米浸出液、麦芽提取物、大豆豆粉、大豆胨、(nh4)2so4、nh4cl、nh4no3、kno3或nano3。在一些实施方式中,磷源以约0.1-25g总p/l的浓度存在,并且选自例如kh2po4、k2hpo4或na2hpo4。在一些实施方式中,第一和第二原料以2.5-75%v/v或50-250g/l的浓度存在。在一些实施方式中,盐选自,例如,kh2po4、k2hpo4、na2hpo4、mgso4、fecl3、fecl2、cacl2、mnso4、nacl、kcl和na2so4。在一些实施方式中,该一种或多种营养素是生物素和/或维生素。在一些实施方式中,步骤a)和b)以约0.1至2vvm的通气速率,约2-8的ph,约25-50℃的温度和约50-1000ppm的搅拌速率进行。
另外的实施方式提供了系统,包括:a)第一生物反应器,包括真菌和第一原料;b)第二生物反应器,包括在第一生物反应器中发酵的柠檬酸、芽孢杆菌属(bacillussp.)和第二原料。
进一步实施方式提供了系统,包括:生物反应器,包括真菌、第一原料,从真菌发酵的柠檬酸,芽孢杆菌属(bacillussp.)和第二原料。
本文描述了另外的实施方式。
附图说明
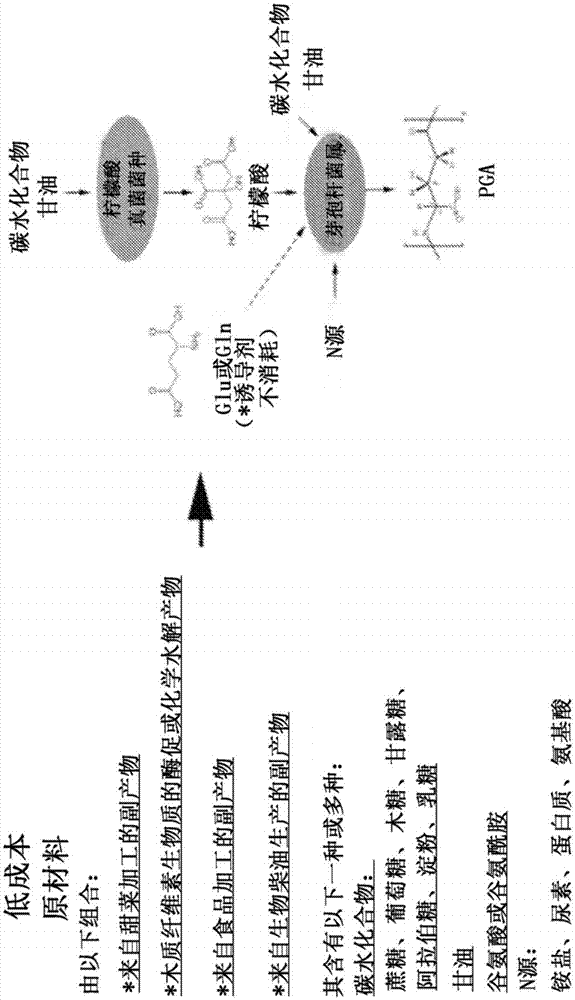
图1示出了用于经由原位前体生产(ispp)制造pga的示例性共培养。
图1示出了用于生产pga的具有谷氨酸非依赖性芽孢杆菌属(bacillussp.)的示例性分区连续生物反应器培养物。
图2示出了用于生产pga的具有谷氨酸非依赖性芽孢杆菌属(bacillussp.)的示例性合并连续培养物。
图3示出了经由黑曲霉nrrl599(a.nigernrrl599)和生产pga的芽孢杆菌属nrrl14202(bacillussp.nrrl14202)的分区连续培养物的pga生产。(a)对固体培养基分区连续培养方法。(b)经由在板上出现黏液状菌落的pga生产的证据。(c)通过sds-page证实pga。
图4示出了在分区连续培养物(“黑曲霉(ngpp)”系列)和用商购柠檬酸和与用黑曲霉(a.niger)上清液配制的培养基相似的蔗糖浓度配制的对照培养物(“ngpp蔗糖对照”系列)中枯草芽孢杆菌(bacillussubtilis)nrrl14202o的生长(在不同时间点的od600)。
图5示出了在分区连续培养物(“黑曲霉(ngpp)”系列)和用商购柠檬酸和与用黑曲霉(a.niger)上清液配制的培养基相似的蔗糖浓度配制的对照培养物(“ngpp蔗糖对照”系列)中用枯草芽孢杆菌(bacillussubtilis)nrrl14202o的pga生产(pga滴度,g/l,在终点)。
图7示出了解脂耶氏酵母(y.lipolytica)培养物中的柠檬酸产生和甘油消耗(在接种芽孢杆菌(bacillussp)之前)
图8示出了解脂耶氏酵母(y.lipolytica)培养物中的柠檬酸产量(在接种芽孢杆菌(bacillussp)之前)
图9示出了分区连续共培养物(a1-3),合并连续共培养物(b1-6)和对照(c1-3)中的甘油消耗。
图10示出了分区连续共培养物(a1-3),合并连续共培养物(b1-6)和对照(c1-3)中的柠檬酸消耗。
图11示出了对于解脂耶氏酵母(y.lipolytica)nrrl1094/芽孢杆菌属(bacillussp.)er1064分区连续共培养物(a1-3)、合并连续共培养物(b1-6)和对照(c1-3)的pga滴度
图12示出了对于解脂耶氏酵母(y.lipolytica)nrrl1094/芽孢杆菌属(bacillussp.)er1064分区连续共培养物(a1-3)、合并连续共培养物(b1-6)和对照(c1-3)的pga产量和产率
图13示出了对于芽孢杆菌属(bacillussp.)菌株er1001、er1007和er1012的单培养物的pga滴度(g/l)、产量(g/gc源)和产率(g/l/h):(a)在富集筛选培养基(richscreeningmedia)(c源:0.7g/l酵母提取物、3.5g/l蛋白胨、31.5g/l谷氨酸、14g/l柠檬酸和14g/l甘油)上,(b)在基本培养基(minamalmedia)(c源:22.7g/l柠檬酸和14g/l甘油)上,和(c)在用生物柴油废弃甘油配制的基本培养基(c源:14g/l柠檬酸和14g/l甘油)上。
图14示出了(a)pga/经由原位前体生产(ispp)的生产、(b)分区连续培养方案、(c)合并连续培养方案和(d)同时共培养方案。
图15示出了连续培养物中的pga滴度(g/l)、产量(g/gc源)和产率(g/l/h)。(a)在基本培养基上用芽孢杆菌属(bacillussp.)/解脂耶氏酵母(y.lipolytica)nrrl1094的pga生产。(b)在基本废弃甘油培养基上用芽孢杆菌属(bacillussp.)/解脂耶氏酵母(y.lipolytica)的pga生产。(c)在基本培养基上用芽孢杆菌属(bacillussp.)/黑曲霉(a.niger)599,用芽孢杆菌属(bacillussp.)单培养物对照的pga生产。
图16示出了2.5l生物反应器规模的发酵性能。(a)对于在富集培养基中的芽孢杆菌属(bacillussp.)er1001单培养物的pga滴度(g/l),产量(g/g)和产率(g/l/h)。(b)对于在富集培养基中的芽孢杆菌属(bacillussp.)er1001单培养物的细胞密度(od600)、pga滴度(g/l)和基质浓度(g/l)。(c)对于在基本培养基中的芽孢杆菌属(bacillussp.)er1001/黑曲霉(a.niger)nrrl599的连续培养物的pga滴度(g/l)、产量(g/g)和产率(g/l/h)。
图17示出了纯化研究的总结:(a)乙醇沉淀,(b)cu2+沉淀,然后透析,和(c)切向流过滤(tff)。(d)对于每种方法的结果/见解的总结,与测量的产量/纯度范围。
定义
为了便于理解本发明,以下定义了许多术语和短语:
如本文所用,术语“宿主细胞”是指任何真核或原核细胞(例如,细菌细胞,诸如大肠杆菌(e.coli),酵母细胞,哺乳动物细胞,禽类细胞,两栖动物细胞,植物细胞,鱼类细胞和昆虫细胞),无论位于体外还是体内。例如,宿主细胞可位于转基因动物中。
如本文所用,术语“原核生物”是指通常缺乏细胞核或任何其他膜结合细胞器的生物体组。在一些实施方式中,原核生物是细菌。术语“原核生物”包括古生菌和真细菌两者。
如本文所用,术语“体外”是指人工环境以及在人工环境中发生的过程或反应。体外环境包括但不限于试管和细胞培养物。术语“体内”是指自然环境(例如动物或细胞)以及在自然环境中发生的过程或反应。
如本文所用,术语“毒性”是指与施用有毒物之前的同一细胞或组织相比对受试者、细胞或组织的任何有害或不良影响。
如本文所用,术语“微生物”是指微生物体,并且旨在涵盖单个生物体或包括任何数量的生物体的制剂两者。
如本文所用,术语“微生物体”是指任何种类或类型的微生物体,包括但不限于细菌、古生菌、真菌、原生动物、支原体和寄生生物体。
如本文所用,术语“真菌”用于指真核生物体,诸如霉菌和酵母,包括双态性真菌。
术语“细菌(bacteria)”和“细菌(bacterium)”是指所有原核生物体,包括原核生物界(kingdomprocaryotae)所有门中的那些。该术语旨在涵盖被认为是细菌的所有微生物体,包括支原体(mycoplasma)、衣原体(chlamydia)、放线菌(actinomyces)、链霉菌属(streptomyces)和立克次氏体(rickettsia)。所有形式的细菌都包括在该定义中,包括球菌、杆菌、螺旋菌、原生质球、原生质体等。该术语还包括革兰氏阴性或革兰氏阳性的原核生物体。“革兰氏阴性”和“革兰氏阳性”是指具有革兰氏染色过程的染色模式,这是本领域熟知的。(参见例如,finegold和martin,diagnosticmicrobiology,第6版,cvmosbyst.louis,pp.13-15(1982))。“革兰氏阳性细菌”是保留革兰氏染色中使用的主要染料,导致染色的细胞在显微镜下通常呈现深蓝色至紫色的细菌。“革兰氏阴性细菌”不保留革兰氏染色中使用的主要染料,但被复染剂染色。因此,革兰氏阴性细菌通常呈现红色。
如本文所用,术语“细胞培养”是指细胞的任何体外培养,包括例如原核细胞和真核细胞。该术语包括连续细胞系(例如,具有永生表型)、原代细胞培养物、转化细胞系、有限细胞系(例如,非转化细胞),固体或液体培养基中或上的细菌培养物,以及体外维持的任何其他细胞群体。
具体实施方式
本文提供了用于生产γ-聚谷氨酸(pga)的组合物和方法。具体地,本文提供了用于生产pga的细菌共培养系统和方法。
pga具有多种商业用途(参见例如下表1)。pga由许多芽孢杆菌属(bacillussp.)细菌天然产生,并且最丰富地存在于纳豆中,其是通过用枯草芽孢杆菌(bacillussubtilis)“纳豆”菌株发酵大豆而产生的传统日本食品。生产pga的芽孢杆菌属(bacillussp.)在代谢上是多功能的并且能够利用大范围的碳源合成pga和多糖副产物,诸如果聚糖(bajaj和singhal,bioresourcetechnology,5551-5561,2011)。最广泛使用的菌株是地衣芽孢杆菌(b.licheniformis)atcc9945和9945a,以及枯草芽孢杆菌(b.subtilis)“纳豆”菌株,其中枯草芽孢杆菌(b.subtilis)纳豆ifo3335是众所周知的。对于地衣芽孢杆菌(b.licheniformis)atcc9945,当柠檬酸、谷氨酸和甘油被提供作为碳源时,pga生产是最佳的(bajaj和singhal,2011;同上)。枯草芽孢杆菌(b.subtilis)ifo3335使用柠檬酸作为碳源和谷氨酸或谷氨酰胺作为诱导剂,以高产量和选择性产生pga。在这些条件下,pga由内源性产生的谷氨酸(存在于培养基中的谷氨酰胺和谷氨酸作为诱导剂但不被消耗)以高选择性(最小多糖副产品)合成,具有的滴度高达20g/l以及产量为0.6摩尔pga/摩尔柠檬酸(bajaj和singhal,2011)。然而,这些方法需要在生产期间添加柠檬酸,因此增加了生产成本。因此,本文提供了改进的共培养方法,其不需要添加纯化的柠檬酸。
例如,在一些实施方式中,本文提供了使用低成本原材料经由原位前体生产用于有效的pga生产的微生物共培养物(参见例如图1)。本文描述的系统和方法提供了共培养系统和方法,其利用第一发酵反应以产生柠檬酸以及产生pga的第二发酵反应。本公开不限于用于发酵的特定试剂和微生物体。在下文和图1中描述了示例性的非限制性微生物体和试剂。
在图1所示的方案中,低成本原材料通过真菌(例如,黑曲霉(aspergillusniger)或解脂耶氏酵母(yarrowialipolytica)或其他合适的真菌)发酵为柠檬酸(阶段1)。在下一步骤(阶段2)中,阶段1中产生的柠檬酸(且取决于菌种、甘油)通过谷氨酸非依赖性的生产pga的芽孢杆菌(bacillussp)转化为pga,其中pga生产由谷氨酸或谷氨酰胺诱导,或者完全不依赖谷氨酸或谷氨酰胺,但这些物质实际上并不被芽孢杆菌(bacillussp)消耗。
本公开提供了经由低成本材料(例如糖)的发酵原位生产柠檬酸的优点。与必须购买柠檬酸前体相比,原位生产降低了原材料成本。在一些实施方式中,将发酵整合到用于生产pga的完整生物过程中(原材料制备/预处理,ispp发酵,纯化和最终干燥/研磨/包装),并且大体上降低pga的总生产成本。
表1
i.发酵试剂
如本文所述,本公开提供了用于生产pga的共培养系统和方法。示例性微生物体和试剂描述如下。
a.原料
在一些实施方式中,发酵反应(例如,pga发酵和/或柠檬酸发酵)利用碳水化合物原料作为用于发酵微生物体的进料来源。本公开不限于用于在生产pga中使用的特定原料。主要原料的选择基于成本、所需的供应规模、有助于柠檬酸和/或pga生产的营养素(诸如碳源、氮源和盐)的组合物、抑制微生物生长或代谢物生产的污染物或杂质的水平、以及对最终pga产品的任何可适用的法规或认证的满意度(例如,usda有机认证(usdaorganic))。可用于柠檬酸和/或pga生产的营养素的实例在图1和表2中给出。含有有用营养素并且是使用共培养方案的pga生产所需的低成本主要原料材料的实例描述于图1中并且在表3中给出。应该理解的是,可以使用主要原料以及补充营养素的各种组合,并且这些列表并非详尽无遗的。
在一些实施方式中,在阶段1或2发酵反应中使用额外的营养素和/或微量营养素。示例性营养素和/或微量营养素和合适的浓度在表7-8中示出。
表2:用于经由ispp共培养方案生产pga的有用营养素的实例
表3:用于经由ispp共培养物的pga生产所需的低成本主要原料(含有一种或多种有用营养素)的实例
b.柠檬酸发酵
pga生产过程的阶段1包括柠檬酸的真菌生产。本公开不限于用于在生产柠檬酸中使用的特定真菌。特异性生产柠檬酸的真菌是基于一种或多种性质选择的,诸如包括但不限于,有效利用所需原材料,以高滴度(最终浓度)、产量(每消耗的原材料质量的柠檬酸质量)和产率(生产的速率)生产柠檬酸的能力,对原材料中发现的抑制性或毒性分子(例如盐、有机酸等)的高耐受性,最低营养素需求,低或不产生抗细菌化合物,和与生产pga的芽孢杆菌属(bacillussp.)的最大环境相容性,包括相容的生长温度、ph、盐度/摩尔渗透压浓度和溶解氧水平,对mn或其他二价金属不敏感性,以及对氮浓度不敏感性。在理解该列表并非详尽无遗的情况下,表4中给出了合适的生产柠檬酸的真菌菌种和菌株的实例。
生物反应器装有适合于真菌柠檬酸发酵的主要原料和额外营养素(氮和磷源)的含水混合物,诸如表6中给出的那些,其已经适当地预处理(例如,甜菜糖蜜可以用亚铁氰化物沉淀以除去痕量金属)。主要原料,氮源和磷源,包括但不限于表6中列出的那些,单独或以各种组合使用,并且按照适当的浓度范围配制,诸如表6中列出的那些。在一些实施方式中,最终生长培养基(包括主要原料和额外营养素的含水混合物)具有有助于柠檬酸发酵的总c源浓度、c:n、c:p、痕量金属浓度和mn浓度,包括但不限于表8中列出的范围。在一些实施方式中,将原料和营养素的含水混合物巴氏灭菌或用加热灭菌(例如,用蒸汽加热至121℃,持续25-30分钟)或过滤(例如,通过0.22μm膜过滤)以消除微生物污染,其可以在添加到生物反应器之前或之后进行。
然后用较小的(例如,1/10至1/10,000体积)生产柠檬酸的真菌的培养物接种生物反应器,该真菌包括但不限于表4中列出的一种或多种菌株,其使用标准真菌微生物学制备。在一些实施方式中,曲霉属(aspergillussp.)(例如,表4中列出的菌株)在主要原料富含碳水化合物(诸如表6中列出的农作物和食品加工残余物)时使用,而耶氏酵母属(yarrowia)或假丝酵母属(candidasp.)(例如,表4列出的菌株)用于富含甘油的主要原料(例如,诸如来自生物柴油生产的废弃甘油)。接种后,保持生物反应器通气速率、搅拌速率、ph和温度,以便促进主要原料的碳水化合物或甘油级分(组分)真菌发酵成柠檬酸。适合于真菌柠檬酸发酵的通气、搅拌、ph和温度参数的实例在表8中给出,应当理解有用的参数和范围不限于此处给出的那些。柠檬酸发酵进行足够的持续时间以使最终滴度(浓度)和产量(g柠檬酸每g主要原料)最大化,通常的发酵时间在表8中给出。在柠檬酸发酵过程期间,真菌消耗主要原料和额外营养素,并且分泌柠檬酸,产生富含柠檬酸的培养液。
在柠檬酸发酵完成后,将富含柠檬酸的培养液转移至第二生物反应器以用作用于pga发酵的主要原料。第二生物反应器装有富含柠檬酸的原始培养液,或者,替代地,通过标准方法(例如,离心分离或通过0.22μm膜过滤)去除富含柠檬酸的培养液中的残余真菌生物质,和/或通过巴氏灭菌或用加热灭菌(例如,用蒸汽加热至121℃,持续25-30分钟)灭活。
表4:用于ispp共培养的生产柠檬酸的真菌的实例。
表5:用于真菌柠檬酸发酵的主要原料和营养素,以及所需的配方范围。
c.pga生产
发酵过程的阶段2包括通过生产pga的芽孢杆菌菌种(bacillus)菌株的pga生产。本公开不限于特定的生产pga的菌株。在一些实施方式中,一般基于一种或多种性质选择特异性生产γ-聚谷氨酸(pga)的芽孢杆菌属(bacillussp.),包括但不限于,优先的有效利用在第一步骤中由所需原材料生产的柠檬酸,以高滴度(最终浓度)、产量(每消耗的原材料质量的pga质量)和产率(生产的速率)生产pga的能力,对原材料中发现的抑制性或毒性分子(例如盐、有机酸等)的高耐受性,最低营养素需求,和与生产柠檬酸的真菌的最大环境相容性,包括相容的生长温度、ph、盐度/摩尔渗透压浓度和溶解氧水平,以及利用不妨碍柠檬酸生产的氮源的能力。在理解该列表并非详尽无遗的情况下,表5中给出了合适的生产pga的芽孢杆菌(bacillus)菌种和菌株的实例。
在一些实施方式中,使用将pga生产与外源性谷氨酸或谷氨酰胺分离的芽孢杆菌属(bacillussp.)。这些菌株可以完全不依赖外源性谷氨酸或谷氨酰胺(例如,生产pga无论外源性谷氨酸或谷氨酰胺是否存在),或者可以起作用,使得外源性谷氨酸或谷氨酰胺作为用于pga生物合成的诱导剂,但实际上并不消耗。在理解该列表并非详尽无遗的情况下,在表5的上半部分中给出了生产pga的芽孢杆菌(bacillus)菌种的优选菌株的实例,其将pga生产与外源性谷氨酸或谷氨酰胺分离。
pga发酵步骤可以使用任何合适的培养芽孢杆菌属(bacillussp.)的方法和装置(例如,试管、烧瓶、培养皿或生物反应器)进行。在一些实施方式中,发酵在配备有分布器(以经由压缩空气提供通气)、混合/搅拌系统(例如,连接至马达的叶轮、涡轮或桨叶)、温度控制系统、ph控制系统和消泡控制系统的生物反应器中进行。
生物反应器装有含水混合物,包括富含柠檬酸的真菌培养液(例如,如上所述),其作为主要原料,额外的次要原料和额外营养素(pga前体/诱导剂、氮源、盐、磷源和其它补充剂),适合于pga发酵,诸如表7中给出的那些,其已经适当地预处理(例如,按照上述针对真菌柠檬酸培养液可能的真菌生物质去除和/或巴氏灭菌或灭菌)。主要原料、次要原料、pga前体或诱导剂、氮源、磷源、金属盐、痕量元素和其他补充剂,包括但不限于表7中列出的那些,单独或以各种组合使用,并且按照适当的浓度范围配制,诸如表7中列出的那些。在一些实施方式中,最终生长培养基(例如,包括主要原料和额外营养素的含水混合物)具有有助于pga发酵的总c源浓度、c:n、c:p、金属盐/痕量金属浓度、pga诱导剂/前体浓度和mn浓度,包括但不限于表8中列出的范围。取决于所选择的生产pga的芽孢杆菌属(bacillussp.)的特异性pga生物合成特性,可能或可能不需要pga诱导剂/前体的使用。
在一些实施方式中,将原料和营养素的含水混合物经巴氏灭菌或用加热灭菌(例如,用蒸汽加热至121℃,持续25-30分钟)或过滤(例如,通过0.22μm膜过滤)以消除微生物污染,其可以在添加到生物反应器之前或之后进行。然后用较小的(1/10至1/10,000体积)生产pga的芽孢杆菌属(bacillussp.)的培养物接种生物反应器,包括但不限于表6中列出的一种或多种菌株,其可使用本领域技术人员熟知的标准芽孢杆菌属(bacillussp.)微生物学技术制备。优选地,芽孢杆菌属(bacillussp.)能够以高滴度(最终浓度)和产量(g-pga每g柠檬酸)将柠檬酸发酵成pga,并且其是谷氨酸非依赖性的,其中pga生产由外源性谷氨酸或谷氨酰胺诱导,或不依赖谷氨酸或谷氨酰胺发生,包括但不限于表6中列出的这些菌株。
接种后,保持生物反应器通气速率、搅拌速率、ph和温度,以便促进芽孢杆菌(bacillussp)发酵柠檬酸,伴随的次要原料和额外营养素发酵成pga。适合于该发酵的通气、搅拌、ph和温度参数的实例在表8中给出,应当理解有用的参数和范围不限于此处给出的那些。pga发酵进行足够的持续时间以使最终滴度(浓度)和产量(gpga每g柠檬酸)最大化,一般的发酵时间在表8中给出。在pga发酵的过程期间,芽孢杆菌属(bacillussp.)将柠檬酸和伴随的次要原料发酵成pga,这一过程可以通过pga前体或诱导剂加速,这取决于所用的特异性菌株的特性。在一些实施方式中,在pga发酵完成后,从第二生物反应器收获富含pga的培养液,并且进一步加工和纯化以产生最终所需的pga产物,使用细胞去除和pga提取/纯化方法的任何组合(例如,本文描述的那些)。
表6:芽孢杆菌菌种(bacillus)菌株
表7:用于谷氨酸相互依赖的芽孢杆菌属(bacillussp.)pga发酵的主要原料和营养素,及其示例性配方范围。
表8:用于柠檬酸和pga发酵的示例性发酵参数范围的实例。
ii.共培养方法
以上讨论的共培养方案可以以各种方式进行以生产pga。本文描述了本公开实施方式的用于进行共培养方案的示例性方法。
在一些实施方式中,利用分区连续培养方法(参见例如图2)。在该方法中,首先使用适当的原料和营养素(例如,如上所述)在许可条件下在生物反应器中培养生产柠檬酸的真菌。然后将富含柠檬酸的培养液转移到第二生物反应器中,其中生产pga的芽孢杆菌属(bacillussp.)在许可条件下并且与适当的额外原料和营养素补充剂一起培养。然后芽孢杆菌属(bacillussp.)将柠檬酸和额外原料和营养素发酵为pga。然后收获来自第二生物反应器的含有pga的培养液并且纯化以产生最终的pga产物。在一些实施方式中,在进入第二生物反应器之前,处理来自第一生物反应器的富含柠檬酸的培养液以去除或灭活真菌细胞。该过程的概述在图2中示出。
在一些实施方式中,阶段1和阶段2发酵在单个生物反应器中进行。在该方法中,使用适当的原料(例如,糖或甘油)在许可条件下在生物反应器中培养生产柠檬酸的真菌(黑曲霉(a.niger)或解脂耶氏酵母(y.lipolytica))。柠檬酸发酵结束后,生物反应器直接接种生产pga的芽孢杆菌属(bacillussp.)。然后转变生物反应器条件以利于生产pga的芽孢杆菌属(bacillussp.)并且添加适当的额外原料和营养素补充剂用于生产pga的芽孢杆菌(bacillussp)。然后芽孢杆菌属(bacillussp.)将柠檬酸和额外原料和营养素发酵为pga。然后收获来自生物反应器的含有pga的培养液并且纯化以产生最终的pga产物。在用生产pga的芽孢杆菌(bacillussp)接种生物反应器的第二步骤之前,可以去除或灭活真菌。与分区连续培养物(图2)相比,该方法通过合并成单个生物反应器从而实现了进一步的成本降低。该过程的概述在图3中示出。
在选择用单个生物反应器方法生产柠檬酸的真菌菌株时,优先考虑的真菌菌株:在有利于pga生产的发酵条件下具有降低的代谢活性或活力,对pga生产中使用的氮源不敏感,与生产pga的芽孢杆菌属(bacillussp.)在生态学上相容(例如,其在使用的培养条件下不产生抗微生物代谢物,并且其在其他方面不与芽孢杆菌属(bacillussp.)拮抗地相互作用),并且在有利于pga生产的发酵条件下具有最小的柠檬酸再摄取的能力(包括但不限于表5中列出的那些菌株)。
使用本领域技术人员已知的任何合适的培养方法和装置(例如,试管、烧瓶、培养皿或生物反应器)进行柠檬酸和pga发酵步骤。在一些实施方式中,发酵在配备有分布器(以经由压缩空气提供通气)、混合/搅拌系统(诸如,由马达驱动的叶轮、涡轮或桨叶)、温度控制系统、ph控制系统和消泡控制系统中的一种或多种的生物反应器中进行。
iii.用途
使用所述方法生产的pga可用于各种研究和商业用途。在一些实施方式中,pga用于增粘剂(vaughn等人,industrialcropsandproducts,2013.43:p.798-801)或超吸收性聚合物生产。交联的pga超吸收性聚合物(sap)可用于吸收性卫生产品(ahp)应用及其他用途。sap(通常基于pac/pam或淀粉接枝聚合物)广泛用于卫生产品的吸收性芯材,其中一次性尿布占约85%的$5b的全球sap市场(trendsandforecast,2014-2020.2015,transparencymarketresearch)。越来越多的消费者对安全和可持续的个人护理产品的偏好推动了环保和天然标签ahp品牌(尤其是尿布)的发展,并且这些产品目前正经历强劲增长(trendsandforecast,2014-2020.2015,transparencymarketresearch)。
试验研究
提供以下实施例是为了证明和进一步说明本发明的某些优选实施方式和方面,而不应解释为限制其范围。
实施例1
经由黑曲霉(a.niger)nrrl599和生产pga的芽孢杆菌属(bacillussp.)nrrl14202o的分区连续培养物的pga生产
生产pga的芽孢杆菌属(bacillussp.)nrrl14202o在由来自蔗糖培养基上生长的产生柠檬酸的黑曲霉(a.niger)培养物的上清液(无细胞的培养液)制备的固体和液体培养基上以实验室规模培养(参见图4a中的方案,其说明固体培养基实验)。
材料和方法
用黑曲霉(a.niger)nrrl599的柠檬酸生产。将5ml无菌黑曲霉(a.niger)接种体培养基(2.50g/l(nh4)2so4,0.6g/lkh2po4,1.66mmmgso4,20g/l蔗糖,2g/l酵母提取物和1g/l蛋白胨,ph调节至5.5)等分至无菌的50ml培养管中,并且接种冷冻保存的黑曲霉(a.niger)nrrl599的芽孢(从usdaars培养物保藏获得)。将接种的培养物在30℃以温和振荡(150-200rpm)温育48小时。48小时后,将培养物通过0.22μm膜无菌过滤以除去真菌菌丝体。重复洗涤真菌菌丝体以除去接种体培养基,并且然后接种到在无菌的1000ml烧瓶中的300ml无菌的生产柠檬酸的培养基(由2.50g/l(nh4)2so4,0.6g/lkh2po4,1.66mmmgso4和140g/l蔗糖组成,ph调节至2.5)中。接种后,用粘性纸密封该烧瓶(以提供用于通气的多孔密封),并且在30℃以温和振荡(150-200rpm)温育9天。定期地,从培养物中无菌地取出1ml样品,用于经由hplc定量柠檬酸和蔗糖(以下在“分析方法:小分子代谢物的hplc分析”中描述)。培养9天后,黑曲霉(a.niger)nrrl599培养物产生22.1g/l柠檬酸并且消耗80g/l蔗糖(大约60g/l蔗糖剩余)。
用黑曲霉(a.niger)nrrl599上清液制备的琼脂平板的pga生产。在柠檬酸发酵完全后,将培养液的ph调节至7.2,并且通过0.22μm膜的无菌过滤除去残留的黑曲霉(a.niger)菌丝体。使用黑曲霉(a.niger)上清液作为柠檬酸源制备非糖酵解前体生产pga琼脂培养基(ngpp)并且灭菌,具有以下组成:1g/lkh2po4、1g/lk2hpo4、0.5g/lmgso4*7h2o、0.05g/lfecl3*6h2o、0.2g/lcacl2*2h2o、0.02g/lmnso4*h2o、7.5g/l(nh4)2so4、0.7g/l酵母提取物、3.5g/l蛋白胨、7g/l甘油、11.6g/l谷氨酸(一水合物)、0.5mg/l生物素、15g/l琼脂和265.9ml/l过滤的黑曲霉(a.niger)上清液(在最终培养基配方中产生5.9g/l柠檬酸),ph调节至7.0。作为对照,用市售的纯化的柠檬酸制备单独批次的ngpp培养基,其中将16g/l蔗糖加入对照,用于黑曲霉(a.niger)上清液中残留的蔗糖。将培养基倾倒入100mm直径的无菌培养皿中并且使其固化。将冷冻保存的芽孢杆菌属(bacillussp.)nrrl14202o的培养物(从usdaars培养物保藏获得)接种到2ml液体ngpp培养基(用商业柠檬酸配制)中,在无菌的15ml培养管中,并且在40℃以温和振荡(150-200rpm)温育24小时。温育24小时后,将培养物离心并且洗涤,并且然后在用真菌上清液制备的ngpp平板和用商购柠檬酸制备的ngpp平板(对照)上无菌地分离划线。将平板包裹并且在40℃温育24小时。通过黏液状菌落的出现初步评估pga生产。通过将来自每个平板的黏液状材料重悬在30ml0.85%w/vnacl中,离心以除去细胞物质,并且用sds-page和亚甲蓝染色分析所得上清液来确认pga生产(以下在“分析方法:经由sds-page的pga定量”中描述)。
用黑曲霉(a.niger)nrrl599上清液制备的液体培养基上的pga生产。如上所述制备ngpp培养基,不同之处在于省略琼脂以产生液体培养基。如上,将真菌柠檬酸上清液以265.9ml/l加入到一个批次的培养基中(在最终培养基配方中产生5.9g/l柠檬酸),而对照批次用商购柠檬酸配制(其中将16g/l蔗糖加入对照,用于黑曲霉(a.niger)上清液中残留的蔗糖)。将冷冻保存的芽孢杆菌属(bacillussp.)nrrl14202o的培养物(从usdaars培养物保藏获得)在ngpp琼脂培养基上分离划线,并且在40℃温育24小时。温育24小时后,将来自平板的黏液状菌落用于接种由在125ml无菌烧瓶中用真菌上清液配制的25mlngpp培养基组成的三个液体培养物,和由在125ml无菌烧瓶中用商购柠檬酸配制的25mlngpp培养基组成的三个对照培养物。将培养物在40℃以温和振荡(150-200rpm)温育72小时,并且每24小时无菌取出1ml样品以测量细胞生长(600nm波长处的光密度,od600)并且分析pga生产。通过培养物的粘性增加来初步评估pga生产。通过离心培养液以去除细胞物质,并且用sds-page和亚甲蓝染色分析所得上清液来确认和定量pga生产(以下在分析方法:“经由sds-page的pga定量”中描述)。
分析方法
经由sds-page的pga定量。通过sds-page随后亚甲蓝染色定量pga。使用0.25、0.5、0.75、1.0、1.25和1.5μgpga(商购自sigma-aldrich)的校准梯来构建标准曲线,以便经由光密度测定法定量从共培养发酵液中纯化的pga。将每个培养物样品离心并且将得到的无细胞上清液稀释至符合校准范围(通常使用两至三次稀释以确保数据符合校准范围)。将15μl稀释的样品与15μl的2xlaemmli缓冲液(bio-rad)混合,并且在95℃下加热5min.以确保变性。将12μl的每种变性的/制备的样品加载到标准4-15%sds-page凝胶的孔中(标准4-20%tris-hcl,1.0mm,26孔梳,15μl)。凝胶在200伏特运行55min.。imagej光密度测定法分析用于构建标准曲线以将像素强度与pga浓度相关联。对每个样品进行光密度测定,并且经由标准曲线与pga浓度相关联。
小分子代谢物的hplc分析。使用高效液相色谱法(hplc)定量甘油和柠檬酸,连同谷氨酸衍生产物。将培养物样品离心,并且将得到的无细胞上清液通过0.22μm膜过滤。然后在配备有rezexroa离子交换柱的agilent1100hplc上分析样品,使用5μl进样体积,60℃柱温,以0.5ml/min.的0.005nh2so4流动相,和折光率检测器(rid),用于分析物定量。
结果
用以黑曲霉(a.niger)nrrl599上清液制备的琼脂平板的pga生产。芽孢杆菌属(bacillussp.)nrrl14202o的菌落形态在用真菌柠檬酸上清液(固相分区连续培养物)和商购柠檬酸(对照)制备的nggp平板之间是相似的。两种类型的培养基都产生具有褶皱结构的大菌落。在目视检查时,大量的黏液状物质是明显的,表明在对照和用真菌柠檬酸上清液制备的平板两者上的强的pga生产(图4b)。使用合成的pga作为对照,通过用pga选择性亚甲蓝染色进行sds-page,确认用真菌柠檬酸上清液制备的ngpp平板(固相分区连续培养物)上的pga生产;sds-page显示了与合成的pga对照相似分子量的染色带,用于固相分区连续培养物样品。这些结果表明,在固体-基质生长条件下,生产pga的芽孢杆菌属(bacillussp.)能够在生产柠檬酸的黑曲霉(a.niger)属的上清液中旺盛生长以及生产pga。
用黑曲霉(a.niger)nrrl599上清液制备的液体培养基上的pga生产。用真菌柠檬酸上清液(分区连续培养物)和商购柠檬酸(对照)制备的ngpp培养基中的芽孢杆菌属(bacillussp.)nrrl14202o的液体培养物具有相似的生长曲线并且达到相似的细胞密度(图5),尽管分区连续培养物具有略低的生长速率和最大od600,并且具有较高的固定相死亡率。分区连续培养物和对照两者均在液体生长条件下生产pga(图6)。最终pga滴度在每个样品组中的重复之间变化很大,然而,与对照相比,分区连续培养物具有更低的平均滴度(图6)。
这些结果说明生产pga的芽孢杆菌属(bacillussp.)在液体培养条件下,能够在生产柠檬酸的黑曲霉(a.niger)菌种的上清液中生长和pga生产,但也说明黑曲霉(a.niger)nrrl599可以产生副产物,其拮抗芽孢杆菌属(bacillussp.)nrrl14202o中的pga生产的,基于与对照相比在分区连续培养物中降低的pga滴度。
实施例2
经由解脂耶氏酵母(y.lipolytica)nrrl1094和谷氨酸非依赖性生产pga的芽孢杆菌属(bacillussp.)er1064的分区连续共培养物和合并连续共培养物的pga生产
进行该实验以证明经由解脂耶氏酵母(y.lipolytica)和谷氨酸/谷氨酰胺非依赖性生产pga的芽孢杆菌(bacillussp)的分区连续培养物和合并连续培养物的pga生产。在柠檬酸积累阶段,解脂耶氏酵母(y.lipolytica)在许可条件下培养,以允许在pga生产阶段起始之前(通常在解脂耶氏酵母(y.lipolytica)接种后72-96hr)产生必需量的柠檬酸。为了开始pga生产阶段,使用解脂耶氏酵母(y.lipolytica)上清液在许可条件下培养生产pga的芽孢杆菌属(bacillussp)。在分区连续共培养实验(例如,图2中描绘的方法)中,经由无菌过滤除去所有解脂耶氏酵母(y.lipolytica)细胞,而在合并共培养实验中,不除去解脂耶氏酵母(y.lipolytica)细胞(例如,图3中描绘的方法)。作为对照,芽孢杆菌属(bacillussp.)在完全合成的“模拟”培养基上培养,该培养基模拟解脂耶氏酵母(y.lipolytica)上清液的组成。以这种方式,以与实际的解脂耶氏酵母(y.lipolytica)上清液相同的营养素水平/ph培养芽孢杆菌属(bacillussp.),但未曾接触由解脂耶氏酵母(y.lipolytica)生长产生的任何次级代谢物/细胞外成分。每个实验和对照以生物学一式三份进行;对于合并连续共培养实验进行两组一式三份。对实验样品的命名惯例如下:
培养物标签方案:
a1-3:分区连续共培养物(对应于图2中的方法)
b1-6:合并连续共培养物(对应于图3中的方法)
c1-3:对照(具有芽孢杆菌属(bacillussp.)的解脂耶氏酵母(y.lipolytica)上清液模拟培养基)
材料和方法
用解脂耶氏酵母(y.lipolytica)nrrl1094的柠檬酸生产。用冷冻保存的解脂耶氏酵母(y.lipolytica)nrrl1094细胞(从usdaars培养物保藏获得)接种30ml无菌胰蛋白酶大豆消化物(tsb)肉汤。将接种的培养物在30℃和180rpm下温育24hr。24小时后,将2ml培养物无菌转移至含有20ml无菌柠檬酸生产培养基的无菌125ml摇床烧瓶(9x总重复)中,该培养基由以下组成:1.7g/lkh2po4、12g/lna2hpo4、1.25g/lmgso4*7h2o、0.25g/l(nh2)2so4、40g/l甘油、0.006g/l硫胺hcl、0.25g/l酵母提取物,并且以ph6.0。将培养物在30℃下以180rpm温育。定期地,无菌地取出1ml样品以经由hplc监测柠檬酸生产/甘油消耗(在“分析方法:小分子代谢物的hplc分析”中描述)。通过添加无菌的2mnaoh将培养物ph维持在6以允许最佳的柠檬酸生产。温育128小时后,所有甘油(40g/l)被培养物消耗,15+/-0.8g/l柠檬酸产生(图7)。柠檬酸的总产量为0.4+/-0.05g柠檬酸/g甘油,柠檬酸产率为0.118+/-0.004g/l/h(图8)。
用解脂耶氏酵母(y.lipolytica)nrrl1094无细胞上清液(分区连续共培养物)制备的液体培养基上的pga生产。如下进行分区连续共培养(a1-3,总共三次重复)。在柠檬酸发酵完成后,经由通过0.22μm膜的无菌过滤从解脂耶氏酵母(y.lipolytica)发酵液的等分试样中除去解脂耶氏酵母(y.lipolytica)细胞,并且将上清液的ph调节至7。将非糖酵解前体pga生产培养基(ngpp)组分作为浓缩溶液直接加入到无细胞解脂耶氏酵母(y.lipolytica)上清液中,其用作柠檬酸源,最终组合物由以下组成:1.7g/lkh2po4、12g/lna2po4、1.25g/lmgso4*7h2o、0.05g/lfecl3*6h2o、0.2g/lcacl2*2h2o、14.5g/l(nh4)2so4、0.0005g/l生物素。在柠檬酸发酵完成前48小时,将冷冻保存的芽孢杆菌属(bacillussp.)er1064的培养物(分离指数“nrrl_14202_mod_1_3_15”,nrrl14202突变体,从ecoviarenewablesl.l.c.获得)在ngpp琼脂培养基上分离划线,并且在40℃下温育24小时。温育24小时后,将来自平板的黏液状菌落用于接种30ml接种体培养基(ngpp“模型1”培养基),由1.0g/lkh2po4、1.0g/lk2hpo4、1.25g/lmgso4*7h2o、0.05g/lfecl3*6h2o、0.2g/lcacl2*2h2o、14.5g/l(nh4)2so4、0.0005g/l生物素组成,ph7。将接种体在40℃下以180rpm温育24小时。24小时后,将2ml接种体无菌转移至含有20ml制备的ngpp“模型1”/解脂耶氏酵母(y.lipolytica)上清液培养基的无菌的125ml摇床烧瓶中,并且使其在40℃下以180rpm温育67小时。实验以生物学一式三份进行。定期地无菌取出1ml培养物样品以经由hplc监测甘油和柠檬酸消耗(以下在“分析方法:小分子代谢物的hplc分析”中描述),测量细胞生长(600nm波长下的光密度,od600),并且分析pga生产(在“分析方法:经由sds-page的pga定量”中描述)。
用解脂耶氏酵母(y.lipolytica)nrrl1094发酵液(合并连续共培养物)制备的液体培养基上的pga生产。合并连续共培养物(b1-6,总共六次重复)以与在“用解脂耶氏酵母(y.lipolytica)nrrl1094无细胞上清液制备的液体培养基上的pga生产”中描述的培养物a1-3完全相同的方式进行。然而,没有除去解脂耶氏酵母(y.lipolytica)细胞。
对照。使用合成的“模拟”培养基(利用商购的柠檬酸)实施一式三份的对照组(c1-3)。该培养基配方由与“ngpp模型1/解脂耶氏酵母(y.lipolytica)上清液”(如上所述)相同的营养素和ph水平组成。以与上述那些完全相同的方式进行、取样和分析培养物。
结果
用解脂耶氏酵母(y.lipolytica)nrrl1094无细胞上清液(分区连续共培养物)制备的液体培养基上的pga生产。在用解脂耶氏酵母(y.lipolytica)柠檬酸上清液(分区连续共培养物,a1-3)和商购柠檬酸(对照,c1-3)制备的ngpp“模型1”中的谷氨酸/谷氨酰胺非依赖性生产pga的芽孢杆菌属(bacillussp.)er1064的液体培养物产生12.7+/-2.0g/lpga和19.6+/-7.0g/lpga,总产量分别为0.5+/-0.1g/g和0.9+/-0.4g/g(图11&12)。分区连续共培养物(a1-3)消耗所有可用的甘油(16.1+/-0.03g/l)和大部分可用的柠檬酸(图9&10),而类似地,对照(c1-3)消耗所有甘油但较少的柠檬酸(图9&10)。
用解脂耶氏酵母(y.lipolytica)nrrl1094发酵液(合并连续共培养物)制备的液体培养基上的pga生产。在ngpp“模型1”培养基中的解脂耶氏酵母(y.lipolytica)nrrl1094/芽孢杆菌属(bacillussp.)er1064合并连续共培养物(b1-6)产生14.4+/-6.2g/l,总产量为0.54+/-0.24g/g(图11&12)。共培养物b1-6消耗了所有可用的甘油和大部分可用的柠檬酸(图9&10);甘油和柠檬酸消耗曲线在分区连续共培养物(a1-3)和合并连续共培养物(b1-6)之间定性地相似。
总之,这些结果表明谷氨酸/谷氨酰胺非依赖性生产pga的芽孢杆菌属(bacillussp.)能够在生产柠檬酸的解脂耶氏酵母(y.lipolytica)nrrl1094的上清液中生长和生产pga,而不经由外源性谷氨酸或谷氨酰胺诱导。在分区连续共培养物(a1-3),合并连续共培养物(b1-6)和对照(c1-3)之间,pga滴度、产量和产率没有统计学上显着的差异。然而,对照培养物(c1-3)的pga生产性能更好,可能表明由于柠檬酸发酵期间产生的细胞外成分对pga生产的潜在抑制作用。合并连续共培养物(b1-6)与分区连续共培养物(a1-3)表现的非常相当。该结果表明解脂耶氏酵母(y.lipolytica)细胞(存在于合并连续共培养物中)不与芽孢杆菌属(bacillussp.)竞争营养素或释放抗菌化合物。
实施例3
培养方法的优化用于共培养物的芽孢杆菌属(bacillussp.)菌株的选择
为了在共培养条件下实现最佳和具成本效益的pga生产,具有高pga生产(如通过滴度、产量和产率定量),最小营养需求以及对原料抑制剂和真菌发酵副产物的耐受性的芽孢杆菌属(bacillussp.)菌株是有利的。基于这些标准,具有高pga生产和在生物柴油废弃甘油上生长的能力三种原养型芽孢杆菌属(bacillussp.)分离株(指定为菌株er1001、er1007和er1012;从ecoviarenewablesinc.获得),在共培养中被选择用于评估。
为了参考和比较目的,简要描述了这些菌株的单培养性能和特性(图13)。在单培养条件下,在富集培养基中er1001、er1007和er1012产生高mw(~1000kda)pga,具有高滴度(28±4至32±3g/l),产量(0.56±0.1至0.63±0.2g/g;理论值为71±10至80±20%),以及产率(0.60±0.08至0.69±0.06g/l/h)(图13a)。此外,在“模拟”基本培养基中,大致模拟共培养条件(仅含有盐、无机n源,以及甘油/柠檬酸作为c源),这些菌株的单培养物能够生长和pga生产(图13b)。基本培养基中略低的滴度(图13b对13a)可能是由于较低的c源浓度(因此限制了用于pga生产的可用底物),其与在富集培养基配方中的63.7g/l总c源相比,在基本培养基配方中降低至36.7g/l总c源,由于从基本培养基中除去酵母提取物,蛋白胨和谷氨酸。此外,芽孢杆菌属(bacillussp.)菌株er1001、er1007和er1012的单培养物能够在废弃甘油培养基上生长和pga生产(图13c),但与富集模型和基本培养基相比,性能降低,可能是由于废弃甘油中存在抑制剂(高盐浓度,游离脂肪酸等)。虽然在模型培养基中分离株之间的性能相当,但在废弃甘油上,er1012似乎略微优于其他菌株(图13c)。
不同的共培养方案的优化考虑了三种不同的用于ispp共培养的生物过程方案:
i)分区连续培养(图14b):在该方案中,生产柠檬酸的真菌在许可条件下在生物反应器中培养。然后将培养液转移到第二生物反应器中,装入额外营养素/甘油,并且然后用生产pga的芽孢杆菌(bacillussp)发酵。
ii)合并连续培养(图14c):在该方案中,生产柠檬酸的真菌在许可条件下在生物反应器中培养。在柠檬酸发酵结束后,向生物反应器中装入额外营养素/甘油,并且接种生产pga的芽孢杆菌(bacillussp)。
iii)同时共培养(图14a&d):在该方案中,生产柠檬酸的真菌与生产pga的芽孢杆菌属(bacillussp.)共培养以实现柠檬酸和pga的同时生产。
由于生产pga的芽孢杆菌属(bacillussp.)和生产柠檬酸的真菌之间的生理和生态不相容性,向同时共培养的实施提出了挑战。低碳:氮(c:n)和碳:磷(c:p)比率,高温(37℃至45℃),温和的ph(6.5至7.5),以及痕量金属离子的存在,尤其是mn2+(bajaj,i.和r.singhal,poly(glutamicacid)--anemergingbiopolymerofcommercialinterest.bioresourtechnol,2011.102(10):p.5551-61)通常对通过芽孢杆菌属(bacillussp.)的pga生产有利。由于由生理失衡导致的溢出代谢,真菌,诸如黑曲霉(a.niger)和解脂耶氏酵母(y.lipolytica)产生柠檬酸(roehr,m.,c.p.kubicek,和j.komínek,citricacid,inbiotechnologyset.2008,wiley-vchverlaggmbh.p.307-345)。因此,与pga相反,有利于柠檬酸生产的条件包括高c:n和c:p比率、温和的生长温度(25℃-30℃)、低浓度的痕量金属(尤其是mn2+),以及对于黑曲霉(a.niger),低ph(2至3)(roehr等人,同上)。除了这些环境不相容性,初步研究确定了芽孢杆菌属(bacillussp.)和生产柠檬酸的真菌之间显着的拮抗相互作用;例如,在芽孢杆菌属(bacillussp.)er1001和解脂耶氏酵母(y.lipolytica)nrrl1094的同时共培养中,解脂耶氏酵母(y.lipolytica)被观察到在24小时内从~106细胞/ml的初始细胞密度下降至<102细胞/ml。
考虑了许多策略来解决菌株相容性问题,诸如工程化生产柠檬酸的真菌以调节氮吸收,或敲除用于在芽孢杆菌属(bacillussp)中抗真菌代谢物的途径。
以芽孢杆菌属(bacillussp.)分离株er1001、er1007和er1012,以解脂耶氏酵母(y.lipolytica)nrrl1094或黑曲霉(a.niger)nrrl599用于柠檬酸生产步骤来实施和表征分区连续培养。这些生产柠檬酸的真菌先前被鉴定为用于ispp共培养的有希望的候选物。解脂耶氏酵母(y.lipolytica)是能够将甘油代谢为柠檬酸的酵母,并且因此能够实现利用低成本的废弃甘油作为唯一c源的ispp发酵(rymowicz,w.,等人,2006.60(5):p.391-394)。相反,黑曲霉(a.niger)是丝状真菌,其将碳水化合物(更昂贵的原料)发酵成柠檬酸,但实现了高达两倍的解脂耶氏酵母(y.lipolytica)的柠檬酸滴度/产量,并且用于商业柠檬酸生产(roehr等人,同上)。
每种选择的芽孢杆菌属(bacillussp.)分离株(er1001、er1007和er1012)与解脂耶氏酵母(y.lipolytica)nrrl1094在连续培养研究中(甘油作为柠檬酸底物),以及与黑曲霉(a.niger)nrrl599在研究中(蔗糖或葡萄糖作为柠檬酸底物)进行评估,使用适合于真菌发酵步骤的基本培养基的菌种,以及适合于pga生产阶段的芽孢杆菌属(bacillussp.)基本培养基(14g/l甘油和来自真菌发酵的13.7至22.7g/l柠檬酸)的菌种。对于这些研究中的柠檬酸生产步骤,解脂耶氏酵母(y.lipolytica)nrrl1094通常获得35至40g/l柠檬酸滴度,产量为0.4至0.45g/g-甘油,而黑曲霉(a.niger)nrrl599达到75至100g/l的滴度,产量高达0.85g/g-糖。用芽孢杆菌属(bacillussp.)分离株/解脂耶氏酵母(y.lipolytica)nrrl1094的研究也使用生物柴油废弃甘油完成,用于柠檬酸和pga生产阶段两者。芽孢杆菌属(bacillussp.)单培养以平行实验进行,其作为每项研究的对照/参考。
所有三种被测试的芽孢杆菌属(bacillussp.)分离株能够在用解脂耶氏酵母(y.lipolytica)nrrl1094或黑曲霉(a.niger)nrrl599的分区连续培养物中生长和pga生产(图15)。对于用解脂耶氏酵母(y.lipolytica)nrrl1094的连续培养物,pga滴度范围从24±3至27±5g/l(产率为0.5±0.02至0.6±0.1g/l/h),产量约为0.8±0.2g/g(理论值为120±30%),在模型培养基中(图15a)。在废弃甘油培养基中,与模型培养基相比,pga滴度、产量和产率降低了约一半(图15b)。与解脂耶氏酵母(y.lipolytica)nrrl1094相比,黑曲霉(a.niger)nrrl599连续培养物中的pga生产较低(图15c)。然而,在与黑曲霉(a.niger)nrrl599研究同时进行的单培养对照中,pga生产也降低(图15c)。而解脂耶氏酵母(y.lipolytica)/芽孢杆菌属(bacillussp.)连续培养物在初步测试中优于用黑曲霉(a.niger)的那些(图15a对15c),由于更高的柠檬酸滴度/产量以及商业柠檬酸生产中黑曲霉(a.niger)的使用,用黑曲霉(a.niger)的连续培养物对于商业化可能更有利。
总之,pga生产在用解脂耶氏酵母(y.lipolytica)nrrl1094的连续培养物和芽孢杆菌属(bacillussp)单培养物之间是相当的(图13b对图15a)。然而,在废弃甘油培养基中以及用黑曲霉(a.niger)nrrl599连续培养物,相对于单培养物,pga生产降低。由于微生物代谢可能高度依赖于环境/生理背景,单培养和共培养条件之间的菌株行为可能不同,如之前的工作中已经观察到的(minty,j.j.,等人,procnatlacadsciusa,2013.110(36):p.14592-7)。特别地,已知解脂耶氏酵母(y.lipolytica)和黑曲霉(a.niger)两者产生许多次级代谢物(bourdichon,f.,等人,internationaljournaloffoodmicrobiology,2012.154(3):p.87-97),其可能是抗菌的或以其他方式影响芽孢杆菌属(bacillussp.)生理机能。芽孢杆菌属(bacillussp.)分离株er1012在废弃甘油培养基上以及在用黑曲霉(a.niger)nrrl599的连续培养物(图15c)中具有优异的pga滴度/产量,表明该分离株与其他分离株相比可具有更高的内在胁迫耐受性。
生物反应器共培养物&共培养过程整合的示范
通过实施台式生物反应器规模的规模单培养和ispp连续培养以及通过pga分离方法的实验评价来进行扩大/过程整合技术风险的评估。
最初的生物反应器研究集中在首先扩大芽孢杆菌属(bacillussp.)单培养发酵。最初的芽孢杆菌属(bacillussp.)单培养发酵在具有芽孢杆菌属(bacillussp.)分离株er1001的富集培养基上以2.5l培养规模进行,使用newbrunswickscientificbioflo3000生物反应器。在成功实施生物反应器规模er1001单培养后,在基本培养基上(使用蔗糖作为黑曲霉(a.niger)的碳源)用黑曲霉(a.niger)nrrl599/芽孢杆菌属(bacillussp.)er1001的ispp连续培养以2.5l规模实施。
初始研究中发生严重起泡(导致培养物损失和不良的pga生产),可能是由于芽孢杆菌属(bacillussp.)er1001分泌表面活性分子和培养液粘性。测试了市售消泡剂,但发现无效。通过简短的优化研究,开发了泡沫控制方案,其需要用消泡剂204和2.5%w/vnacl扩充培养基,并且在发酵的前18至24小时内将通气减少至0.1至0.2vvm。实现泡沫控制后,2.5l规模的er1001生物反应器培养物的发酵性能显着超过烧瓶规模培养物,具有54±4g/l的pga滴度、1±0.3g/gc源的产量(理论值为130±47%)和2.3±0.5g/l/h的产率(图16a&b)。同样地,基本培养基中黑曲霉(a.niger)nrrl599/芽孢杆菌属(bacillussp.)er1001的2.5l生物反应器规模的ispp连续培养物也基本上优于烧瓶规模培养物,具有11±2.6g/l的pga滴度(0.34±0.08g/l/h产率)和0.22±0.02g/gc源的产量(理论值为29±3%)(图16c)。
对于许多应用需要高纯度pga,诸如个人护理;例如,制造商对颜色、气味、微生物污染(cfu/g)和有机可提取物有严格的规范。关键的纯化方面/考虑因素包括从培养液中分离微生物细胞,去除大量盐和有机污染物(残留的发酵底物等),以及去除有问题的痕量污染物(包括颜色/气味化合物)。确定细胞去除的最佳方法是离心酸化发酵液(低ph最小化细胞的zeta电位,并且经由ph依赖性螺旋-卷曲转变降低pga粘性(do,j.h.,h.n.chang,和s.y.lee,2001.76(3):p.219-223),其应用于所有研究中。使用文献中的用于pga/生物聚合物纯化的方法(乙醇沉淀,cu2+沉淀随后透析,以及切向流过滤(bajaj,i.和r.singhal,2011.102(10):p.5551-61))实验研究了无细胞pga液的后续纯化。对于被评估的每种纯化方法,测量pga产量和%纯度。
每种纯化方案的结果总结在图17d中。在所研究的纯化方法中,经由乙醇或cu2+的pga沉淀给出最高的产量(图17a&b)。切向流过滤(tff;图17c)给出了优异的pga纯度,但是尽管pga的mw高,还存在渗透的大的产量损失(可能是由于在低ph下pga的致密结构)。这些结果表明,使用上述方法可以容易地纯化经由共培养发酵生产的pga,产生商业上可接受的产品。
以上说明书中提及的所有出版物、专利、专利申请和检索号的全部内容均通过引用并入本文。尽管已经结合具体实施方式描述了本发明,但是应该理解,要求保护的本发明不应该过度地限于这些具体实施方式。事实上,本发明所述组合物和方法的各种修改和变化对于本领域普通技术人员将是显而易见的,并且旨在落入所附权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!