包封的肝组织的制作方法
本申请要求2017年11月23日提交的美国临时专利申请62/425,811的优先权,所述申请的内容整体包括在此。
技术领域
本公开涉及包含肝细胞、间充质细胞和任选的内皮细胞的肝类器官,所述肝类器官可被包封在生物相容性交联聚合物中,以及所述肝类器官用于恢复或改善肝功能以及确定剂(例如先导化合物或研究性新药物)的肝代谢和/或肝毒性的用途。
背景技术:
肝硬化和慢性肝衰竭(LF)是大多数进行性肝病的常见结果。肝脏的合成和解毒功能的丧失引起严重的全身性后果,如腹水、肝性脑病和胃肠道出血等。此外,几乎10%的所有非癌症、肝相关的死亡都是由于急性LF所致,急性LF是由于肝上的突然损伤超过器官的先天性再生能力而引起的极其严重的进行性综合征。儿童和青少年的急性LF具有不良后果,仅50%的患者在他们的原生肝脏下存活。此外,存在大量肝疾患,如先天性肝代谢缺陷(尿素循环缺陷、克-纳二氏综合征(Criggler-Najjar syndrome)、家族性高胆固醇血症等),其不会导致肝衰竭,但是引起严重的肝和肝外后果。虽然单独罕见,但综合考虑,基于肝的代谢疾病占小儿肝移植的10%以上。仅少数此类疾患可获得治疗。在所有情况下,治疗可减轻症状并改善预后,但不能治愈疾病。对于大多数先天性肝代谢缺陷,用于急性、慢性和慢加急性LF的护理标准是肝移植,但加拿大每年仅进行400例移植,超过5 000例肝性死亡/年。对于有资格进行肝移植的少数患者,在等待合适的器官供体时死亡是非常常见的。患有急性LF的儿童需要在诊断后数天内移植,之后他们的疾病变得不可逆转地过于严重(20%死于等待供体)。婴儿的风险甚至更大,在移植前几乎一半死亡,并且移植的那些中的50%在手术后死亡。此外,肝移植具有很大的局限性。除了引起显著短期死亡率和发病率风险外,它还需要终身免疫抑制并且常常因严重的长期肝和肝外疾病而复杂化。患有先天性肝代谢缺陷的儿童的结果要好得多,但此类患者在等候名单上的优先级非常低,并且在等待移植时常常发展全身并发症。对于仅需要在他们的肝再生时临时替代肝功能地许多急性LF患者以及特征在于单一酶缺乏、但肝实质正常的许多代谢性肝病来说,此类高风险是不成比例的。因此,迫切需要新的疗法来恢复患有LF和代谢性肝病的儿童和成人的肝功能。
多年来已经开发了基于部分肝移植或体外解毒装置的几种替代方法来临时替代肝功能,其结果大多不令人满意。在过去二十年中,显示来自健康供体的原代肝细胞的移植诱导患有慢性LF和先天性肝代谢缺陷的患者中的短暂改善。这种方法显示肝病的细胞疗法的可行性,但它受器官短缺、重复注射和终身免疫抑制的需要以及细胞质量的极端可变性的限制。
此外,用于评价化学毒性的金标准毒理学方法涉及耗时且成本高的复杂体内研究。动物测试引起对动物福利、时间和成本的关注。此外,针对人不良健康影响的啮齿动物体内测试的预测准确性近年来已成为争议问题。在毒性测试中使用体外模型系统具有许多优点,包括动物数量减少、动物维护和护理的成本降低、测试所需的化学品的量较少、所需的时间缩短以及用于评价多种化学品及其代谢物的通量增加。体外系统还允许研究化学代谢、评价毒性机制、测量酶动力学并且检查剂量-反应关系。肝在通过肠道吸收或经由皮下、肌内或静脉内途径注射的任何化合物的代谢、活化或灭活方面具有关键作用。原代人肝细胞的使用受限于它们的稀缺可用性和它们的质量的极端变化性以及体外代谢活性,而可用的细胞系不完全代表肝生理学。因此需要建立用于评估先导化合物或研究药物如何被肝代谢以及是否诱导肝毒性的可行体外培养系统。
技术实现要素:
根据第一方面,本公开提供了一种包封的肝组织,其包含至少部分地被第一生物相容性交联聚合物覆盖的至少一个肝类器官。所述肝类器官包含含有肝细胞、间充质细胞和任选的内皮细胞的细胞核心。所述肝类器官具有基本上球形的形状和介于约50与约500μm之间的相对直径。在一个实施方案中,所述至少一个肝类器官基本上被所述第一生物相容性交联聚合物覆盖。在另一个实施方案中,所述细胞核心包含肝细胞和/或胆管上皮细胞。在另一个实施方案中,所述第一生物相容性交联聚合物包含聚(乙)二醇(PEG)。在另一个实施方案中,所述包封的肝组织还包含第二生物相容性交联聚合物,并且其中所述第一生物相容性交联聚合物至少部分地被所述第二生物相容性交联聚合物覆盖。在一个实施方案中,所述第一生物相容性交联聚合物基本上被所述第二生物相容性交联聚合物覆盖。在另一个实施方案中,所述第一生物相容性交联聚合物是至少部分生物可降解的和/或所述第二生物相容性交联聚合物至少部分地抗生物降解。在另一个实施方案中,所述第二生物相容性交联聚合物包含聚(乙)二醇(PEG)。在另一个实施方案中,所述包封的肝组织包含分散在整个所述第一生物相容性交联聚合物中的多个肝类器官。
根据第二方面,本公开提供了一种用于制备包封的肝组织的方法。概括地说,所述方法首先包括在悬浮液中组合并培养肝细胞、间充质细胞和任选的内皮细胞,以获得至少一个肝类器官,所述至少一个肝类器官具有(i)包含肝细胞、间充质细胞和任选的内皮细胞的细胞核心,(ii)基本上球形的形状,以及(iii)介于约50与约500μm之间的相对直径。所述方法还包括用第一生物相容性交联聚合物至少部分地覆盖所述至少一个肝类器官。在一个实施方案中,在培养之前,将所述肝细胞和间充质细胞以1:0.2-7的比例组合。在另一个实施方案中,在培养之前,将所述肝细胞和内皮细胞以1:0.2-1的比例组合。在一个实施方案中,所述肝细胞、间充质细胞和内皮细胞中的至少一种从分化干细胞、例如像多能干细胞获得。在另一个实施方案中,所述肝细胞可源自定形内胚层、前肠后段或成肝细胞,可以是成肝细胞或肝细胞。在另一个实施方案中,所述间充质细胞是间充质干细胞或间充质祖细胞。在另一个实施方案中,所述内皮细胞是内皮祖细胞。在一个实施方案中,所述方法包括用所述第一生物相容性交联聚合物基本上覆盖至少一个肝类器官。在另一实施方案中,所述第一生物相容性交联聚合物包含聚(乙)二醇(PEG)。在另一个实施方案中,所述方法包括用第二生物相容性交联聚合物至少部分地覆盖所述第一生物相容性交联聚合物。在另一个实施方案中,所述方法包括用所述第二生物相容性交联聚合物基本上覆盖所述第一生物相容性交联聚合物。在另一个实施方案中,所述第一生物相容性交联聚合物是至少部分生物可降解的和/或所述第二生物相容性交联聚合物至少部分地抗生物降解。在一个实施方案中,所述第二生物相容性交联聚合物包含聚(乙)二醇(PEG)。在另一个实施方案中,所述方法还包括在所述第一生物相容性交联聚合物中包含多个肝类器官。
根据第三方面,本公开提供了一种通过本文所述的方法可获得或获得的包封的肝组织。
根据第四方面,本公开提供了一种如本文定义的包封的肝组织,其用于制造药物。
根据第五方面,本公开提供了一种如本文定义的包封的肝组织,其用于恢复或改善有需要的受试者的肝功能。所述包封的肝组织可用于治疗或缓解与肝衰竭相关的症状。在一个实施方案中,肝衰竭可以是急性、慢性或慢加急性肝衰竭。在另一个实施方案中,所述包封的肝组织可用于治疗或缓解与先天性肝代谢缺陷相关的症状。在另一个实施方案中,所述包封的肝组织包含在所述第一生物相容性交联聚合物中的多个肝类器官。所述受试者可以是哺乳动物,例如人。
根据第六方面,本公开提供了一种恢复或改善有需要的受试者的肝功能的方法。概括地说,所述方法包括使有效量的本文所述的包封的肝组织的肝类器官与所述受试者的生物流体接触,以改善所述受试者的肝功能。在一个实施方案中,所述方法用于恢复或改善肝功能,用于治疗或缓解与肝衰竭相关的症状。在一个实施方案中,肝衰竭是急性、慢性或慢加急性肝衰竭。在另一个实施方案中,所述方法用于恢复或改善与先天性代谢缺陷相关的肝功能。在另一个实施方案中,所述包封的肝组织包含第一和第二生物相容性交联聚合物。所述受试者可以是哺乳动物,例如人。
根据第七方面,本公开提供了一种确定剂的肝代谢或肝毒性的方法。概括地说,该方法包括:a)使所述剂与如所述的包封的肝组织接触以获得测试混合物;b)确定所述测试混合物中的至少一个剂相关肝代谢物或肝参数;以及c)将步骤b)的所述至少一个剂相关肝代谢物或肝参数与对照剂相关肝代谢物或肝参数进行比较,以确定所述剂的肝代谢或肝毒性。在一个实施方案中,所述方法用于确定所述剂是否在所述包封的组织的至少一个肝类器官的至少一种细胞类型中(例如像在肝细胞或胆管上皮细胞中)诱导肝毒性。在一个实施方案中,所述方法包括使所述剂与包含第一肝类器官的第一包封的肝组织和包含第二肝类器官的第二包封的肝组织接触,并且其中所述第一肝类器官的细胞(例如肝细胞和/或胆管上皮细胞)是与所述第二肝类器官的细胞(例如肝细胞和/或胆管上皮细胞)同种异体的。在另一个实施方案中,所述包封的肝组织基本上由所述第一生物相容性交联聚合物和所述至少一个肝类器官组成。
根据第八方面,本公开涉及一种用于确定剂的肝代谢的试剂盒,所述试剂盒包括本文所述的包封的肝组织和用于进行本文所述的方法的说明书。在一个实施方案中,所述试剂盒还包括组织培养载体。在另一个实施方案中,所述组织培养载体包括至少一个孔。在另一个实施方案中,所述包封的肝组织位于所述至少一个孔的底部。
附图说明
已因此总体上描述了本发明的性质,现将参考通过说明方式显示本发明的优选实施方案的附图,并且其中:
图1A至1D示出在严格的无异源和无饲养条件下由外周血单核细胞产生的人诱导型多能干细胞(iPSC)的实施方案。(A)如通过显微术测定,在E8 Flex培养基中玻连蛋白上的iPSC集落的代表性方面(比例尺1 000μM顶部,200μM底部)。(B)如通过逆转录实时PCR(RT-qPCR)测定的成纤维细胞(浅灰色条)、胚胎干细胞(ESC,白色条)和iPSC(对角条)中的多能性基因(NANOG、POU5F1和SOX2)的表达。(C)示出多能性标志物(SSEA4和TRA-1-81(90.8%的门控细胞)、TRA-1-81和NANOG(88.8%的门控细胞)表达的高度均匀性的iPSC的代表性流式细胞术分析。(D)如通过免疫荧光测定的与皮肤成纤维细胞(底行)(比例尺200μM)相比,iPSC(顶行)中多能性标志物(SOX2、TRA-1-81、NANOG、SSEA4和POU5F1)的表达。插图示出核(DAPI)染色。
图2A至2N示出iPSC的体外分化。(A)如通过RT-qPCR测量的当与iPSC(浅灰色条)相比时,iPSC来源的内胚层细胞(白色条)中内胚层特异性基因(SOX17、FOXA2、CXCR4、GATA4)的上调和多能性基因(SOX2、NANOG、POU5F1)的下调。结果显示为所测试的各种基因中的对数倍数变化。(B)如通过免疫荧光测定的在体外分化后iPSC中的内胚层特异性标志物(SOX17、FOXA2、CXCR4、GATA4)的表达(比例尺200μM)。示出定形内胚层(顶行)和未分化的iPSC(底行)的结果。插图示出核(DAPI)染色。(C)对于FOXA2、CXCR4和SOX17标志物,在定形内胚层细胞中分化的iPSC的代表性流式细胞术分析。87.2%的细胞是FOXA2+和CXCR4+,其中98.4%也是SOX17+(85.8%的三阳性细胞)。(D)iPSC来源的腹侧前肠后段细胞中HNF4α的表达增加,其产生肝祖细胞。结果显示为iPSC、定形内胚层中分化的iPSC和前肠后段中分化的iPSC中HNF4α基因的mRNA表达的倍数变化。(E)如通过RT-qPCR测定的与未分化的iPSC(浅灰色条)相比,iPSC来源的肝细胞(白色条)中肝特异性基因(AFP、白蛋白和HNF4α)的上调。结果显示为所测试的各种基因(在X轴上鉴定)的对数倍数变化。(F)如通过免疫荧光测量的iPSC来源的肝细胞(右列)和未分化的iPSC(左列)(比例尺200μM)中肝特异性标志物(AFP,上图;白蛋白,中图;E-钙粘蛋白,下图)的表达。(G)iPSC来源的肝细胞的代表性形态。(H)iPSC源性的肝细胞获得肝特异性功能,如CyP3A4活性(左图)、白蛋白(中图)和尿素(左图)合成。提供未分化的iPSC(标记为“iPSC”)、iPSC来源的肝细胞(标记为“iPSC-Hep”)、iPSC来源的肝细胞祖细胞(标记为“成肝细胞”)、iPSC来源的内胚层细胞(标记为“内胚层”)和原代人肝细胞(标记为“PHH”)的结果。括号中的数字是指从iPSC获得每种细胞类型所需的分化天数。(I)如通过显微术测定的源自iPSC的间充质祖细胞的代表性形态(比例尺200μM)。(J)如通过免疫荧光(平滑肌肌动蛋白(αSMA)-左和纤连蛋白-右)或流式细胞术(CD90、CD117和CD133)和iPSC来源的间充质祖细胞(白色条)所示的品系特异性标志物的表达。结果显示为iPSC来源的间充质细胞(顶行)和未分化的iPSC(下部行)的免疫荧光(左图)(比例尺200μM)。结果还显示为脐带基质干细胞(UCMSC,浅灰色条)和iPSC来源的间充质细胞(iPSC-MPC,白色条)的流式细胞术(右图)。(K)iPSC-MPC可分化为骨细胞或脂肪细胞,如分别通过茜素红S染色(上图)和LipidTox染色所示。比例尺200μm。(L)iPSC来源的内皮祖细胞(iEPC)的表征。结果示出为通过显微术的代表性形态(左上图,比例尺200μM),如通过HUVEC(浅灰色条)和iPSC分化的内皮祖细胞(白色条)中的流式细胞术(右上图)或通过iPSC(左图)、iPSC分化的内皮祖细胞(中图)或HUVEC(右图)的免疫荧光(下图)测量的品系特异性标志物(CD31)的表达。(M)如通过代表性显微术所示,当在(内皮管形成测定)中培养时,iEPC能够形成3D血管结构。比例尺1000μm左图,200μm右图。
图3A至3H示出由iPSC来源的细胞制成的肝类器官的实施方案。(A)接种后1、2、3、7、9或11天用iPSC来源的内胚层来源的/肝细胞、UCMSC和HUVEC(1类型)(上图)或iPSC来源的内胚层来源的/肝细胞、内皮细胞和间充质细胞(3类型)(下图)产生的悬浮生长的肝脏器官的微观视图)。(B)1类型(左图)和3类型(右图)肝类器官的苏木精-曙红染色。(C)肝类器官的白蛋白、细胞角蛋白19(CK19)、EpCam、α-胎蛋白(AFP)、ZO1和CD31的免疫荧光。比例尺200μM。(D)如通过RT-qPCR测定的未分化的iPSC(对角条)、培养28天后iPSC来源的肝细胞(白色条)和培养10天后的肝类器官(浅灰色条)中肝特异性标志物(AFP和白蛋白)的表达。结果显示为不同基因(在X轴下方鉴定)的mRNA表达的对数倍数变化。(E)iPSC来源的肝类器官发挥原代肝细胞所特有的功能,如尿素和白蛋白合成。结果显示为未分化的iPSC、iPSC来源的内胚层细胞(分化10天后)、iPSC来源的成肝细胞(d18:分化18天后)、肝芽(d10:接种10天后)、1类型肝类器官(d10:接种10天后)、3类型肝类器官(d10:接种10天后)和原代人肝细胞的白蛋白(ng/24h/1x 106个细胞,左图)或尿素(μg/24h/1x 106个细胞,右图)分泌。(F)iPSC来源的肝类器官表现出CyP3A4活性。结果显示为成肝细胞(d16:分化16天后)、iPSC来源的肝细胞(d28:分化28天后)或3类型肝类器官(d10:接种10天后)的Cyp3A4活性的倍数增加(与iPSC相比)。
图4A至4T示出包封的肝组织的实施方案。(A)包封肝类器官和制备包封的肝组织的方法的实施方案。(B)PEG包封的肝类器官(包封的肝组织)的宏观方面和包封的肝组织的操作(顶行:准备移植在小鼠中的包封的肝组织;左下和中心:96孔格式的包封的肝组织;右下:生物材料内的肝类器官的微观方面,比例尺1000μM)。(C)三种不同的包封的肝组织的细胞活力的代表性免疫荧光(存活/死亡测定)。对于3个左上图比例尺为1000μM,对于右上图和三个右下图比例尺为200μM,并且左下图比例尺为100μM。(D)两种代表性包封的肝组织的组织学图像。比例尺50μm。(E)原代肝细胞(PHH)、HepG2细胞系的细胞(HepG2)、iPSC、iPSC来源的肝细胞(iHep,28天分化后)和包封的肝类器官(ELT)中的CyP3A4活性、尿素产生、α-胎蛋白(AFP)分泌和白蛋白分泌的比较。对于CyP3A4活性,结果显示为随细胞/类器官类型变化的活性(表示为RLU,或相对光单位/106个肝细胞,***=p<0.001)。对于尿素产生,结果显示为随细胞/类器官类型变化产生的尿素(μg/24h/106个细胞)。对于AFP分泌,结果显示为在培养中包封的肝组织随时间推移分泌的AFP的量(以ng/106个细胞/24h测量,*=p<0.05)。对于白蛋白分泌,结果显示为在培养中随时间变化产生的白蛋白的量(ng/24h/1X106个细胞)(**=p<0.01)。(F)包封的肝组织在体外的氨代谢(左图)和尿素产生(右图)。对于氨代谢,结果显示为培养中随时间(h)变化的氨的浓度(mmol/L)(*=p<0.05)。对于尿素产生,结果显示为在氨(1mM)不存在(-)或存在(+)下,产生的尿素(μg/24h/106个细胞,***=p<0.001)。(G)包封的肝组织在体外的他克莫司代谢。在利福平存在(■)或不存在(●)下,结果显示为随孵育时间(h)变化的他克莫司浓度(ng/mL,***=p<0.001)。(H)在冷冻前、解冻后和解冻后7天(d7),包封的肝组织的白蛋白分泌(左图)和CyP3A4活性(右图)。对于白蛋白分泌,结果显示为随所测试的条件变化产生的白蛋白的量(ng/24h/1X106个细胞)。对于CyP3A4活性,结果显示为随所测试的条件变化的活性(RLU/106个细胞)。(I)在包封的肝组织的腹腔内植入期间获得的宏观视图。(J)在腹内植入包封的肝类器官后1周(左图)或4周(右图)获宏观视图(外植ELT的图片,无任何可见的粘连或炎症)。(K)未包封的iPSC的宏观(左图)和微观视图(苏木精和曙红染色,中图和右图),其示出在免疫抑制小鼠中形成畸胎瘤。(L)在植入小鼠后8周,包封的iPSC的代表性宏观视图,其示出动物中没有形成畸胎瘤。(M)如通过已经进行混合淋巴细胞反应(MLR)的细胞的流式细胞术测量的CD25、HLA-DR、增殖(羧基荧光素琥珀酰亚胺酯,CFSE)干扰素-γ(IFNg)、CD3+IFNg和CD69表达。MLR的条件在图的左侧提供。(N)在仅同种异体PBMC(仅效应PBMC)存在下,单独包封生物材料(生物材料)、成熟树突细胞(mDC)、包封的mDC、肝类器官和包封的肝类器官(ELT)的混合淋巴细胞反应中的干扰素-γ(IFNg)产生。结果显示为随所测试的条件变化的IFNg的量(pg/mL)。(O)细胞和类器官的包封防止同种异体T细胞增殖(MLR测定)。肝类器官仅引发最小T细胞增殖。在包封同种异体肝类器官、PBMC或甚至成熟树突细胞后未观察到T细胞活化。缩写:ctrl=无细胞;+凝胶=包封在生物材料内;allo DC=同种异体成熟树突细胞;PBMC=同种异体外周血单核细胞;肝org=未包封的iPSC来源的肝类器官;肝org+凝胶=ELT。结果显示为增殖细胞或对CD25、HLA-DR、CD69或IFNg阳性的细胞的百分比(使用流式细胞术测量的)。(S)在假手术处理的动物或用包封的肝组织(ELT)处理的动物中的存活(左图)和体重增加或减轻(右图)。为了存活,结果显示为在假手术处理的(虚线)和ELT处理的(实线)动物中诱导肝衰竭后30天的存活百分比。对于体重增加或减轻,结果显示为与假手术处理的(■)和ELT处理的(●)动物的肝衰竭第0天的动物体重相比,第7天动物体重的百分比。p=0.0095。(Q)双PEG包封(顶部)和双PEG包封的卵泡的微观视图的示意性图示(比例尺500μM,ND:不可降解,D:可降解)。
具体实施方式
包封的肝组织
所述包封的肝组织包含至少一个(并且在一个实施方案中多个)肝类器官,所述至少一个肝类器官至少部分地被生物相容性交联聚合物覆盖。如在本公开的上下文中使用的,“肝类器官”是指培养的肝细胞、间充质细胞和任选的内皮细胞的混合物。在一些实施方案中,所述肝类器官包含培养的肝细胞、间充质细胞和内皮细胞的混合物。所述肝类器官通常为球形的形状并且其表面可以是不规则的。所述肝类器官的相对直径介于约50与约500μm之间。所述肝的细胞核心由肝细胞、间充质细胞和任选的内皮细胞组成,并且在一些实施方案中,所述肝细胞、间充质细胞和任选的内皮细胞的细胞外基质在培养时产生和组装。可通过在悬浮液中培养所述细胞来获得肝类器官。在一些实施方案中,特别是在包封的肝组织的培养/分化之前,所述肝类器官的表面至少部分地被(并且在一些实施方案中基本上被)内胚层(例如肝)来源的肝细胞、例如像肝细胞和/或胆管上皮细胞覆盖。在另一个实施方案中,所述肝细胞分散在整个细胞核心中(但不必是均匀的)。存在于包封的肝组织中的类器官至少部分地被(并且在一些实施方案中基本上被)第一生物相容性交联聚合物覆盖。
在被包封之前,所述肝类器官不含外源性细胞外基质。所述肝类器官基本上由培养的肝细胞、间充质细胞和任选的内皮细胞组成。此外,所述肝类器官(包封或未包封在第一生物相容性聚合物中)表现出肝功能,例如,所述肝类器官能够合成白蛋白以及凝血因子、表现出CyP3A4活性、将氨解毒成尿素并进行药物(即他克莫司或利福平)的肝特异性代谢。
本公开的肝类器官基本上是球形的形状并且具有在微米范围内的相对直径(例如,直径小于1mm)。在一个实施方案中,所述肝类器官在其包封之前具有至少约50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370、380、390、400、410、420、430、440、450、460、470、480或490μm的相对直径。在另一个实施方案中,所述肝类器官在其包封之前具有等于或小于约500、490、480、470、460、450、440、430、420、410、400、390、380、370、360、350、340、330、320、310、300、290、280、270、260、250、240、230、220、210、200、190、180、170、160、150、140、130、120、110、100、90、80、70或60μm的相对直径。在另一个实施方案中,所述肝类器官在其包封之前具有介于至少约50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290、300、310、320、330、340、350、360、370、380、390、400、410、420、430、440、450、460、470、480或490μm与等于或小于约500、490、480、470、460、450、440、430、420、410、400、390、380、370、360、350、340、330、320、310、300、290、280、270、260、250、240、230、220、210、200、190、180、170、160、150、140、130、120、110、100、90、80、70或60μm之间的相对直径。在一些实施方案中,所述肝类器官在其包封之前具有介于至少约100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280或290μm与等于或小于约300、290、280、270、260、250、240、230、220、210、200、190、180、170、160、150、140、130、120、110、100、90、80、70或60μm之间的相对直径。在又一个实施方案中,所述肝类器官在其包封之前具有至少约100μm且等于或小于约300μm的相对直径。例如,所述肝类器官在其包封之前具有至少约150、160、170、180或190μm且低于200、190、180、170或160μm的相对直径。在另一实施方案中,所述肝类器官在其包封之前具有至少约150μm且等于或低于约200μm的相对直径。所述肝类器官的大小允许其包含的细胞增加其对各种营养物的暴露以及与包封的肝组织接触的生物流体/细胞。在一些实施方案中,这允许肝类器官能够在体内保持活力和生物活性,而不需要用宿主的血管系统使它们血管化(例如,宿主的血管系统已经接受了包封的肝组织)。
所述肝类器官的内胚层(肝)细胞可分散在整个类器官中,并且在一些实施方案中,它们中的一些可位于肝类器官的细胞核心的表面处。所述肝类器官的肝细胞可以是例如来自定形内胚层、前肠后段细胞、成肝细胞或肝祖细胞的细胞。所述肝类器官的肝细胞可以是肝细胞和/或胆管上皮细胞。所述肝类器官的肝细胞可来自单一细胞类型(例如,定形内胚层细胞、前肠后段细胞、成肝细胞、肝细胞或胆管上皮细胞)或来自多种细胞类型的混合物(例如,以下细胞类型中的至少两种的混合物:定形内胚层细胞、前肠后段细胞、成肝细胞、肝细胞和/或胆管上皮细胞)。在肝类器官的体外细胞培养期间或甚至当肝类器官置于体内时,所述一种或多种肝细胞类型可改变或分化。例如,在与间充质细胞和任选的内皮细胞共培养期间或置于体内时,所述肝类器官的肝细胞可分化(从定形内胚层、前肠后段细胞或成肝细胞至肝细胞或胆管上皮细胞)。为了确定肝类器官中是否存在肝细胞,可通过本领域中已知的方法来测定细胞色素P450家族3亚家族A成员4(CyP3A4)α-胎蛋白(AFP)的表达。还可监测白蛋白、凝血因子和尿素的合成/产生以及CyP3A4的活性,以确定所述肝类器官中是否存在肝细胞。为了确定肝类器官中是否存在定形内胚层或前肠后段细胞,可通过本领域中已知的方法来测定SOX17、FOXA2、CXCR4、GATA4或HNF4α的表达。
肝类器官的间充质细胞可以是例如不同起源(骨髓(包括血液)、脐带或脂肪组织)的间充质干细胞/祖细胞、脂肪细胞、肌细胞、肝星状细胞、成肌纤维细胞和/或成纤维细胞。肝类器官的间充质细胞可来自单一细胞类型(例如,间充质干细胞/祖细胞、脂肪细胞、肌细胞或成纤维细胞)或来自多种细胞类型的混合物(例如,以下细胞类型中的至少两种的混合物:间充质干细胞/祖细胞、脂肪细胞、肌细胞、肝星状细胞、成肌纤维细胞和/或成纤维细胞)。在与肝细胞和任选的内皮细胞共培养期间或置于体内时,肝类器官的间充质细胞的类型可分化(从间充质干细胞/祖细胞至成纤维细胞、脂肪细胞或肌细胞)。已知间充质干细胞/祖细胞除了其他基因外还表达α平滑肌肌动蛋白(αSMA)、纤连蛋白、CD90和CD73。为了确定肝类器官中间充质细胞的位置或存在,尤其可能确定对间充质谱系具有特异性或与间充质谱系相关的基因或蛋白质的表达。
当存在时,肝类器官的内皮细胞可以是例如内皮祖细胞和/或各种起源的内皮细胞。肝类器官的内皮细胞可来自单一细胞类型(例如,内皮祖细胞或内皮细胞)或来自多种细胞类型的混合物(例如,内皮祖细胞和内皮细胞的混合物)。在与内胚层细胞和间充质细胞体外共培养期间或置于体内时,肝类器官的内皮细胞的类型可分化(从内皮祖细胞至内皮细胞)。在一些实施方案中,肝类器官的内皮细胞可以毛细血管或毛细血管样构型组构,其中内皮细胞排列在管腔的内表面(其可以是部分的)。
如上所述,肝类器官的细胞核心由肝细胞、间充质细胞和任选的内皮细胞组成,并且在一些实施方案中,由在培养期间由所述细胞产生和假定的细胞外基质组成。肝类器官的细胞核心在坏死/凋亡细胞中基本上较差(例如,当通过组织学进行检查时它没有坏死区域),因为来自培养肝类器官的培养基的营养物可扩散跨过细胞核心,并且因此可递送至所述细胞核心内的细胞,并且所述细胞核心的细胞的代谢废物可扩散出肝类器官。肝类器官本身(在封装前)不包含(,例如不含)外源性细胞外基质或合成聚合物材料。在一些实施方案中,肝细胞可存在于细胞核心的表面上。在另一个实施方案中,肝细胞可与细胞核心的细胞组合产生并组装细胞外基质材料(例如胶原蛋白和纤连蛋白),并且在一些实施方案中产生并组装基底膜材料。
如上所述,肝细胞可至少部分地覆盖肝类器官的细胞核心的表面。在本公开的上下文中,表述“肝细胞至少部分地覆盖细胞核心的表面”表示肝细胞占据细胞核心的表面的至少约10%、20%、30%或40%。在一些实施方案中,肝细胞基本上覆盖细胞核心的表面。在本公开的上下文中,表述“肝细胞基本上覆盖细胞核心的表面”表示肝细胞占据细胞核心的表面的大部分,例如细胞核心的表面的至少约50%、60%、70%、80%、90%、95%、99%。在一个实施方案中,肝细胞完全覆盖细胞核心的表面(例如,细胞核心的超过99%的表面被肝细胞覆盖)。
在一个实施方案中,本公开的肝类器官在包封于第一交联的生物相容性聚合物中之前具有比在哺乳动物肝脏中观察到的肝细胞和/或胆管上皮细胞更高比例的间充质细胞(和当存在时内皮细胞)。然而,在包封于第一交联的生物相容性聚合物中之后,与间充质细胞(和当存在时内皮细胞)相比时,本公开的肝类器官具有更高比例的肝细胞。已知哺乳动物肝脏由约90%的肝细胞组成。因此,在本公开的一些实施方案中,肝类器官中肝细胞的比例低于约90%、85%、80%或75%(与肝类器官的细胞总数相比)。
肝类器官可由不同起源的细胞制成。在一个实施方案中,所述肝细胞、间充质细胞或内皮细胞中的至少一种是来自哺乳动物,例如人。在另一个实施方案中,所述肝细胞、间充质细胞或内皮细胞中的至少两种是来自哺乳动物,例如人。在另一个实施方案中,所述肝细胞、间充质细胞和内皮细胞都来自哺乳动物,例如人。在肝类器官内,可组合来自不同起源的细胞。例如,间充质细胞和内皮细胞可来自鼠或猪起源,而肝细胞可来自人起源。这些组合并非详尽的,并且本领域技术人员将设想可适用于本公开背景下的另外组合。
肝类器官的细胞可源自不同来源。例如,肝类器官的细胞可源自原代细胞培养物、已建立的细胞系或分化的干细胞。在肝类器官内,可组合来自不同来源的细胞。例如,肝细胞可来自原代细胞培养物,间充质细胞可来自已建立的细胞系,并且内皮细胞可来自分化的细胞系。或者,在肝类器官内,也可组合来自相同来源(例如分化的干细胞)的细胞。在一个具体实施方案中,肝类器官的细胞源自单一干细胞群体,其已在肝细胞、间充质细胞和任选的内皮细胞中分化。干细胞群体可来自胚胎干细胞或诱导型多能干细胞。在一个具体实施方案中,肝类器官的细胞源自单一多能干细胞群体,其已在肝细胞、间充质细胞和任选的内皮细胞中分化。
可用于包封的肝组织中的聚合物(也称为聚合物基质)在一个或多个肝类器官周围形成水凝胶。如本领域已知的,水凝胶是指亲水性的聚合物链,其中水是分散介质。水凝胶可从天然或合成的聚合物网络获得。在本公开的上下文中,包封在水凝胶内防止包埋的肝类器官从聚合物中泄漏,从而消除或降低肝类器官的细胞可能在植入后在受体体内引起免疫反应或肿瘤的风险。在一个实施方案中,每个肝类器官被单独包封,并且在另一个实施方案中,包封的肝类器官可进一步包含在聚合物基质中。在另一个实施方案中,肝类器官包含在聚合物基质中以包封它们。
在本公开的上下文中,当被引入受试者(例如,例如人)时不表现出毒性时,聚合物被认为是“生物相容性的”。在本公开的上下文中,优选生物相容性聚合物当置于受试者(例如,例如人)体内时不表现出对肝类器官的细胞的毒性。可例如通过测定以下来测量肝毒性:肝细胞凋亡死亡率(例如,其中细胞凋亡增加指示肝毒性)、转氨酶水平(例如,其中转氨酶水平增加指示肝毒性)、肝细胞膨胀(例如,其中膨胀增加指示肝毒性)、肝细胞中的微泡性脂肪变性(例如,其中脂肪变性增加指示肝毒性)、胆管细胞死亡率(例如,其中胆管细胞死亡率增加指示肝毒性)、γ-谷氨酰转肽酶(GGT)水平(例如,其中GGT水平增加指示肝毒性)。生物相容性聚合物包括但不限于碳水化合物(糖胺聚糖如透明质酸(HA)、硫酸软骨素、硫酸皮肤素、硫酸角质素、硫酸乙酰肝素、藻酸盐、壳聚糖、肝素、琼脂糖、葡聚糖、纤维素和/或其衍生物)、蛋白质(胶原蛋白、弹性蛋白、纤维蛋白、白蛋白、聚(氨基酸)、糖蛋白、抗体和/或其衍生物)和/或合成聚合物(例如,基于聚(乙二醇)(PEG)、聚(甲基丙烯酸羟乙酯)(PHEMA)和/或聚(乙烯醇)(PVA))。生物相容性聚合物可以是单一聚合物或不同聚合物的混合物(例如US2012/0142069中描述的那些)。示例性生物相容性聚合物包括但不限于聚(乙)二醇、聚乳酸(PLA)、聚乙醇酸(PGA)、聚己内酯(PCL)、纤维蛋白、多糖材料(如壳聚糖、蛋白聚糖或糖胺聚糖(GAG))、藻酸盐、胶原蛋白、硫醇化肝素以及其混合物。在一些实施方案中,生物相容性聚合物可以是线性的、支化的并且任选地与肽(例如,RGD)、生长因子、整联蛋白或药物接枝。
在一些实施方案中,所述聚合物是“低免疫原性聚合物”,并且在接受者中不会引发免疫应答或仅引发最小的免疫应答(即不导致聚合物的降解、修饰或功能丧失)。当将这种抗原决定簇引入同种异体受试者时,这种低免疫原性聚合物还能够掩蔽细胞的一种或多种抗原决定簇并降低或甚至防止对抗原决定簇的免疫应答。
存在于本公开的包封的肝组织中的聚合物优选地是可交联的,例如,能够交联。所述聚合物可热交联、化学交联(例如,通过使用一种或多种肽,如VPMS、RGD等)或通过使用pH或光(例如,光聚合,例如使用UV光)交联。在一些实施方案中,交联可在肝类器官(被或不被聚合物基质包封)已经分散在聚合物基质中之后进行。
本公开的聚合物可以是完全或部分生物可降解的(例如,易于通过活生物体的代谢水解)或完全或部分抵抗生物降解(例如,当经受活生物体的代谢时抗水解)。示例性生物相容性且生物可降解的聚合物包括但不限于聚(乙二醇)-马来酰亚胺(PEG-Mal)8-臂。示例性生物相容性和抗生物降解性聚合物包括但不限于聚(乙二醇)-乙烯基砜(PEG-VS)。
包封的肝组织包含第一生物相容性且交联的聚合物,所述聚合物至少部分地(并且在一些情况下基本上)覆盖肝类器官。所述第一生物相容性聚合物与肝类器官的细胞物理接触。在本公开的上下文中,表述“一个或多个肝类器官至少部分地被第一生物相容性且交联的聚合物覆盖”表示第一生物相容性且交联的聚合物占据肝类器官的表面的至少约10%、20%、30%或40%。在一些实施方案中,所述第一生物相容性且交联的聚合物基本上覆盖一个或多个肝类器官的表面。在本公开的上下文中,表述“一个或多个肝类器官基本上由第一生物相容性且交联的聚合物覆盖”表示第一生物相容性且交联的聚合物占据肝类器官的表面的大部分,例如类器官的表面的至少约50%、60%、70%、80%、90%、95%、99%。在一个实施方案中,所述第一生物相容性且交联的聚合物完全覆盖肝类器官的表面(例如,超过99%的肝类器官的表面被第一生物相容性且交联的聚合物)覆盖。
在一些实施方案中,包封的肝组织还可包含第二生物相容性且交联的聚合物,所述第二生物相容性且交联的聚合物至少部分地(并且在一些情况下基本上)覆盖第一生物相容性且交联的聚合物。第二生物相容性聚合物与第一生物相容性交联聚合物物理接触,并且在实施方案中,与肝类器官的细胞物理接触。在本公开的上下文中,表述“第一生物相容性交联聚合物至少部分地被第二生物相容性且交联的聚合物覆盖”表示第二生物相容性且交联的聚合物占据第一生物相容性且交联的第一聚合物的表面的至少约10%、20%、30%或40%。在一些实施方案中,第二生物相容性且交联的聚合物基本上覆盖第一生物相容性且交联的聚合物的表面。在本公开的上下文中,表述“第一生物相容性且交联的聚合物基本上由第二生物相容性且交联的聚合物覆盖”表示第二生物相容性且交联的聚合物占据第一生物相容性且交联的聚合物的表面的大部分,例如,第一生物相容性且交联的第一聚合物的表面的至少约50%、60%、70%、80%、90%、95%、99%。在一个实施方案中,第二生物相容性且交联的聚合物完全覆盖第一生物相容性且交联的聚合物的表面(例如,第一生物相容性且交联的聚合物的超过99%的表面被第二生物相容性且交联的聚合物覆盖)。在另一个实施方案中,第二生物相容性且交联的聚合物形成基质,肝类器官(其至少部分地被第一生物相容性且交联的聚合物覆盖)散布在所述基质中。在这样的实施方案中,肝类器官(其至少部分地被第一生物相容性且交联的聚合物覆盖)可被第二生物相容性且交联的基质包围或可与另一个肝类器官(其至少部分地被第一生物相容性且交联的聚合物覆盖)物理接触。包封的肝组织可包含另一种生物相容性且交联的聚合物,以覆盖第二生物相容性且交联的聚合物。
第一和第二生物相容性且交联的聚合物可相同或不同。在一个实施方案中,第一生物相容性且交联的聚合物是至少部分(并且在一些实施方案中完全)生物可降解的聚合物。在另一个实施方案中,第二生物相容性且交联的聚合物至少部分(并且在一些实施方案中完全)抗生物降解。在另一个实施方案中,第一生物相容性且交联的聚合物是生物可降解的聚合物,并且第二生物相容性且交联的聚合物抗生物降解。在这样的实施方案中,第一生物相容性交联聚合物可比第二生物相容性交联聚合物更生物可降解(例如抗生物降解性更低)。
在一些实施方案中,第一生物相容性且交联的聚合物包含多个肝类器官。在这样的实施方案中,包封的肝组织可包含每cm2至少约50、60、70、80、90、100、125、150、175、200、250、300、350、400、450或500个肝类器官。在另一个实施方案中,包封的肝组织可包含每cm2至多约500、450、400、350、300、250、200、175、150、125、100、90、80、70、60或50个肝类器官。在又一个实施方案中,包封的肝组织包含每cm2介于约50、60、70、80、90、100、125、150、175、200、250、300、350、400或450与约500、450、400、350、300、250、200、175、150、125、100、90、80、70或60个之间的肝类器官。在另一个实施方案中,包封的肝组织包含每cm2介于约50与500个之间的肝类器官。在另一个实施方案中,包封的肝组织包含每cm3至少约250、300、350、400、450、500、550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400或2500个肝类器官。在另一实施方案中,包封的肝组织包含每cm3至多约2500、2400、2300、2200、2100、2000、1900、1800、1700、1600、1500、1400、1300、1200、1100、1000、950、900、850、800、750、700、650、600、550、500、450、400、350、300或250个肝类器官。在另一个实施方案中,包封的肝组织包含每cm3介于约250、300、350、400、450、500、550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300或2400与约2500、2400、2300、2200、2100、2000、1900、1800、1700、1600、1500、1400、1300、1200、1100、1000、950、900、850、800、750、700、650、600、550、500、450、400、350或300个之间的肝类器官。在另一个实施方案中,包封的肝组织包含每cm3介于约250与2500个之间的肝类器官。
在一个实施方案中,在培养中或在植入体内时包封的肝组织能够表达与肝细胞、间充质细胞和任选的内皮细胞相关的基因和蛋白质。在另一实施方案中,包封的肝组织(体外或体内)能够产生白蛋白、由氨制备尿素、表现出CyP3A4活性和/或代谢药物(已知由肝代谢,如他克莫司和/或利福平)。在一些实施方案中,包封的肝组织能够产生所述组织中的每g肝类器官1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20mg的白蛋白。在另一个实施方案中,在一个或多个冻融循环后,包封的肝组织能够表达与肝细胞、间充质细胞和任选的内皮细胞相关的基因和蛋白质、产生白蛋白、从氨制备尿素、表现出CyP3A4活性和/或药物(如他克莫司和/或利福平)的肝特异性代谢。在一些实施方案中,在冷冻后,包封的肝组织能够产生所述组织中的每g肝类器官1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20mg的白蛋白。
用于制备包封的肝组织的方法
用于制备包封的肝组织的方法首先需要制备一个或多个肝类器官,且然后将它(它们)(至少部分地)包封在第一生物相容性且交联的聚合物中(并且任选地包封在第二和另一种生物相容性交联聚合物中)。
所述肝类器官可通过在获得肝类器官所需的条件下共培养肝细胞、间充质细胞和任选的内皮细胞(全部如上所述)来制备,所述肝类器官具有(i)包含肝细胞、间充质细胞和任选的内皮细胞的细胞核心,(ii)基本上球形的形状,以及(iii)在介于约50与约500μm之间的相对直径。在一些实施方案中,这些条件包括在悬浮液中(例如,超低粘附条件)培养细胞,从而促进肝类器官的形成。
待包含在包封的肝组织中的肝细胞可从不同起源(例如哺乳动物)和来源(原代细胞培养物、细胞系、分化的干细胞)获得。肝细胞可来自不同类型,如定形内胚层细胞、前肠后段细胞、成肝细胞、肝细胞和/或胆管上皮细胞。来自单个类器官的肝细胞可来自相同或不同的起源、相同或不同的来源以及相同或不同的类型。在一个实施方案中,使用定形内胚层细胞。在另一个实施方案中,定形内胚层细胞从分化干细胞(如多能干细胞)获得。在另一个实施方案中,源自定形内胚层的细胞从分化多能干细胞(例如通过用活化素A与CHIR99021的组合和剔除血清替代物培养多能干细胞)获得。在一个实施方案中,使用来自前肠后段的细胞。在另一个实施方案中,来自前肠后段的细胞从分化干细胞(如多能干细胞)获得。在另一个实施方案中,来自前肠后段的细胞从分化多能干细胞(例如通过用BMP4与bFGF的组合、剔除血清替代物、有或没有胰岛素和/或IWP2和/或或A83-01培养多能干细胞)获得。在一个实施方案中,使用肝细胞和成肝细胞。在另一个实施方案中,肝细胞和成肝细胞从分化干细胞(如多能干细胞)获得。在另一个实施方案中,肝细胞和成肝细胞从分化多能干细胞(例如通过用BMP4组合、bFGF、剔除血清替代物、有或没有胰岛素和/或CHIR99021、IWP2、A83-01、HGF、制瘤素M和/或地塞米松培养多能干细胞)获得。在形成肝类器官之前,肝细胞可新鲜使用或冷冻保存。
待包含在包封的肝组织中的间充质细胞可从不同起源(例如哺乳动物)和来源(原代细胞培养物、细胞系、分化的干细胞)获得。间充质细胞可来自不同的类型,如间充质干细胞、脂肪细胞、肌细胞或成纤维细胞。来自单个类器官的间充质细胞可来自相同或不同的起源、相同或不同的来源以及相同或不同的类型。在一个实施方案中,使用间充质干细胞/祖细胞。在另一个实施方案中,间充质干细胞/祖细胞从分化干细胞(如多能干细胞)获得。在另一个实施方案中,间充质干细胞/祖细胞从分化多能干细胞(例如通过在塑料上培养多能干细胞而不包被在补充有剔除血清替代物的DMEM高葡萄糖中)获得。在形成肝类器官之前,间充质细胞可新鲜使用或冷冻保存。
当存在时,待包含在包封的肝组织中的内皮细胞可从不同起源(例如哺乳动物)和来源(原代细胞培养物、细胞系、分化的干细胞)获得。内皮细胞可来自不同的类型,如内皮祖细胞和内皮细胞。在一个实施方案中,使用内皮祖细胞。来自单个类器官的内皮细胞可来自相同或不同的起源、相同或不同的来源以及相同或不同的类型。在另一个实施方案中,内皮祖细胞从分化干细胞(如多能干细胞)获得。在另一个实施方案中,内皮祖细胞从分化多能干细胞(例如通过用CHIR99021和/或活化素A与BMP4、bFGF和/或VEGF的组合培养多能干细胞)获得。在形成肝类器官之前,内皮细胞可新鲜使用或冷冻保存。
在一个实施方案中,肝类器官由单一多能干细胞群体制备。可使用本领域已知的方法,如病毒转导(例如通过使用仙台病毒系统)或使用合成mRNA方法来诱导多能干细胞。多能干细胞群体可从诱导型多能干细胞(iPSC)的一个或多个集落获得。在从同一多能干细胞群体制备肝类器官的实施方案中,将iPSC群体分成至少两个(并且在一些实施方案中至少三个)亚群体,每个亚群体经受不同的培养条件以产生肝细胞和间充质细胞(并且,在一些实施方案中,内皮细胞)。
一旦获得不同的细胞中的每种,就将它们在悬浮液中组合并培养以产生肝类器官。为了控制肝类器官的大小,有可能在极低粘附条件下(例如在悬浮液中)使用直径介于100至1000μm之间的微腔培养细胞。在一些实施方案中,所述微腔具有每cm2约500μm的直径和深度。在一些实施方案中,一旦形成原始肝类器官,就可将它们在生物反应器中悬浮培养(用于扩增)。为了促进内胚层来源的细胞分化为肝细胞和/或胆管上皮细胞,可在剔除血清替代物和/或胰岛素、EGF、HGF、VEGF、bFGF、制瘤素M和/或地塞米松存在下培养肝类器官。在一个实施方案中,将肝细胞和间充质细胞在培养之前以1个内胚层细胞与0.1-0.7个间充质细胞的比例组合。在另一个实施方案中,当存在内皮细胞时,在培养之前将它们与内胚层细胞以1个内胚层细胞0.2-1个内皮细胞的比例组合。在另一个实施方案中,在培养之前,肝细胞、间充质细胞与内皮细胞之间的比例是1:0.2:0.7。应理解,在培养期间,不同细胞之间的比例可改变,因为一些将优先增殖,而其他将优先分化。还应理解,可使用其他比例来获得如本文所述的肝类器官。在制备肝类器官的过程中,不需要物理支架或外源性基质材料(除组织培养容器外)。
肝类器官可直接用于制备包封的肝组织。在一个实施方案中,所述肝类器官可在它们被引入包封的肝组织之前冷冻保存。
可用于包封的肝组织中的聚合物在一个或多个肝类器官周围形成水凝胶。如本领域已知的,水凝胶是指亲水性的聚合物链,其中水是分散介质。水凝胶可从天然或合成的聚合物网络获得。在本公开的上下文中,包封在水凝胶内防止包埋的肝类器官从聚合物中泄漏,从而消除或降低肝类器官的细胞可能在植入后在受体体内引起免疫反应或肿瘤的风险。
在本公开的上下文中,当被引入受试者(例如,例如人)时不表现出对肝类器官的细胞的毒性时,聚合物被认为是“生物相容性的”。在本公开的上下文中,优选生物相容性聚合物当置于受试者(例如,例如人)体内时不表现出对肝类器官的细胞的毒性。可例如通过测定以下来测量肝毒性:肝细胞凋亡死亡率(例如,其中细胞凋亡增加指示肝毒性)、转氨酶水平(例如,其中转氨酶水平增加指示肝毒性)、肝细胞膨胀(例如,其中膨胀增加指示肝毒性)、肝细胞中的微泡性脂肪变性(例如,其中脂肪变性增加指示肝毒性)、胆管细胞死亡率(例如,其中胆管细胞死亡率增加指示肝毒性)、γ-谷氨酰转肽酶(GGT)水平(例如,其中GGT水平增加指示肝毒性)。生物相容性聚合物包括但不限于碳水化合物(糖胺聚糖如透明质酸(HA)、硫酸软骨素、硫酸皮肤素、硫酸角质素、硫酸乙酰肝素、藻酸盐、壳聚糖、肝素、琼脂糖、葡聚糖、纤维素和/或其衍生物)、蛋白质(胶原蛋白、弹性蛋白、纤维蛋白、白蛋白、聚(氨基酸)、糖蛋白、抗体和/或其衍生物)和/或合成聚合物(例如,基于聚(乙二醇)(PEG)、聚(甲基丙烯酸羟乙酯)(PHEMA)和/或聚(乙烯醇)(PVA))。生物相容性聚合物可以是单一聚合物或聚合物的混合物(例如US2012/01420069中描述的那些)。示例性生物相容性聚合物包括但不限于聚(乙)二醇、聚乳酸(PLA)、聚乙醇酸(PGA)、聚己内酯(PCL)、纤维蛋白、多糖材料(如壳聚糖、蛋白聚糖或糖胺聚糖(GAG))、藻酸盐、胶原蛋白、硫醇化肝素以及其混合物。在一些实施方案中,生物相容性聚合物可以是线性的、支化的并且任选地与肽(例如,RGD)、生长因子、整联蛋白或药物接枝。
在一些实施方案中,所述聚合物是“低免疫原性聚合物”并且在接受者中不会引发免疫应答或仅引发最小免疫应答。当将这种抗原决定簇引入同种异体受试者时,这种低免疫原性聚合物还能够掩蔽细胞的一种或多种抗原决定簇并降低或甚至防止对抗原决定簇的免疫应答。
存在于本公开的包封的肝组织中的聚合物优选地是可交联的,例如,能够交联。所述聚合物可热交联、化学交联(例如,通过使用一种或多种肽,如VPMS、RGD等)或通过使用pH或光(例如,光聚合,例如使用UV光)交联。
本公开的聚合物可以是生物可降解的(例如,易于通过活生物体的代谢水解)或完全或部分抵抗生物降解(例如,当经受活生物体的代谢时抗水解)。示例性生物相容性且生物可降解的聚合物包括但不限于聚(乙二醇)-马来酰亚胺(PEG-Mal)8-臂。示例性生物相容性和抗生物降解性聚合物包括但不限于聚(乙二醇)-乙烯基砜(PEG-VS)。
一旦获得肝类器官,就使它们与第一生物相容性且可交联的聚合物接触,以至少部分地(并且在一些实施方案中基本上)覆盖所述肝类器官。所述聚合物可以不同的浓度使用。在一个实施方案中,在接触肝类器官时,聚合物的浓度介于约1%与15%(重量/体积)之间。在一个实施方案中,在接触肝类器官时,聚合物的浓度是至少约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%或14%。在另一个实施方案中,在接触肝类器官时,聚合物的浓度等于或低于约15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%或2%。一旦肝类器官已经与第一聚合物接触,后者就交联(热、化学或通过使用pH或光)。第一生物相容性聚合物的交联通过在聚合物的不同分子之间和/或在聚合物的相同分子内产生额外的键(和在一些实施方案中额外的共价键)来实现。在一些实施方案中,第一生物相容性聚合物的交联将在聚合物分子与肝类器官的表面之间产生额外的键(并且在一些实施方案中为额外的共价键)。在一些实施方案中,所述第一聚合物是至少部分生物可降解的。
在一些实施方案中,已经被第一生物相容性交联聚合物(至少部分地)覆盖或包封的肝类器官可与第二生物相容性可交联聚合物接触,以至少部分地(并且在一些实施方案中基本上)覆盖包封的肝组织。一旦包封的肝类器官已经与第二聚合物接触,后者就交联(热、化学或通过使用pH或光)。第二生物相容性聚合物的交联通过在聚合物的不同分子之间和/或在聚合物的相同分子内产生额外的键(和在一些实施方案中额外的共价键)来实现。在一些实施方案中,所述第二生物相容性聚合物的交联将在聚合物分子与第一生物相容性且交联的聚合物并且在一些实施方案中肝类器官表面之间产生额外的键(并且在一些实施方案中额外的共价键)。在一些实施方案中,所述第二聚合物至少部分地抗生物降解。
在一些实施方案中,所述方法还包括使所述包封的肝类器官(至少部分地被第一/第二生物相容性交联聚合物覆盖)与另一种生物相容性且可交联的聚合物接触以覆盖所述包封的肝类器官的步骤。一旦肝类器官已经与所述另一种聚合物接触,后者就交联(热、化学或通过使用pH或光)。所述另一种生物相容性聚合物的交联通过在聚合物的不同分子之间和/或在聚合物的相同分子内产生额外的键(和在一些实施方案中额外的共价键)来实现。在一些实施方案中,所述另一种生物相容性聚合物的交联将在聚合物分子与第二生物相容性且交联的聚合物并且在一些实施方案中第一生物相容性且交联的聚合物和/或肝类器官的表面之间产生额外的键(并且在一些实施方案中额外的共价键)。
所述方法可被设计成在第一生物相容性且交联的聚合物内提供多个单分散的肝类器官,如图4A所示。在图4A所示的实施方案中,成肝细胞、内皮祖细胞和间充质祖细胞从分化单一iPSC获得。将细胞在悬浮液中混合并共培养以形成肝类器官。在图4A所示的肝类器官的实施方案中,成肝细胞已分化成肝细胞,所述肝细胞基本上覆盖由间充质细胞和内皮祖细胞形成的细胞核心(在引入包封的肝组织中的肝类器官之前)。图4A所示的肝类器官的实施方案基本上是球形形状的并且具有约150μM的相对直径。然后使用交联剂(图4A中所示的UV光)将肝类器官包封在第一相容性且可交联的基质中。包封的肝组织可用作再生医学中的可移植肝组织(具有例如介于5mm与10cm之间的大小)。或者,肝类器官可被设计成多孔板并用于药物开发以确定所筛选化合物的代谢或肝毒性。
所述方法可被设计成提供(至少部分地)被第一生物相容性且交联的聚合物单独覆盖的多个肝类器官,然后将所述多个肝类器官掺入由第二生物相容性且交联的聚合物制成的基质中。在这样的实施方案中,首先形成(至少部分地)被第一生物相容性且交联的聚合物单独覆盖的多个肝类器官,且然后使其与第二生物相容性且可交联的聚合物接触以进行交联。
所述方法还可被设计为提供多个单独(例如,单分散的肝类器官,所述肝类器官被第一和任选的第二相容性且交联的聚合物覆盖。在这样的实施方案中,包封的肝组织可包含每cm2至少约50、60、70、80、90、100、125、150、175、200、250、300、350、400、450或500个肝类器官。在另一个实施方案中,包封的肝组织可包含每cm2至多约500、450、400、350、300、250、200、175、150、125、100、90、80、70、60或50个肝类器官。在又一个实施方案中,包封的肝组织包含每cm2介于约50、60、70、80、90、100、125、150、175、200、250、300、350、400或450与约500、450、400、350、300、250、200、175、150、125、100、90、80、70或60个之间的肝类器官。在另一个实施方案中,包封的肝组织包含每cm2介于约50与500个之间的肝类器官。在另一个实施方案中,包封的肝组织包含每cm3至少约250、300、350、400、450、500、550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300、2400或2500个肝类器官。在另一实施方案中,包封的肝组织包含每cm3至多约2500、2400、2300、2200、2100、2000、1900、1800、1700、1600、1500、1400、1300、1200、1100、1000、950、900、850、800、750、700、650、600、550、500、450、400、350、300或250个肝类器官。在另一个实施方案中,包封的肝组织包含每cm3介于约250、300、350、400、450、500、550、600、650、700、750、800、850、900、950、1000、1100、1200、1300、1400、1500、1600、1700、1800、1900、2000、2100、2200、2300或2400与约2500、2400、2300、2200、2100、2000、1900、1800、1700、1600、1500、1400、1300、1200、1100、1000、950、900、850、800、750、700、650、600、550、500、450、400、350或300个之间的肝类器官。在另一个实施方案中,包封的肝组织包含每cm3介于约250与2500个之间的肝类器官。
在一个实施方案中,所述包封的肝组织可直接用于本文所述的治疗和筛选方法中,或者可冷冻保存以增加其储存时间。
包封的肝组织的治疗用途
本文所述的包封的肝组织可用作药物。因为它表现出肝脏的一些生物学功能,并且因此可在体内或离体用于恢复或改善有需要的受试者中的肝功能。例如,可通过测定白蛋白和凝血因子(例如,纤维蛋白原、凝血酶原、因子V、VII、VIII、IX、X、XI、XIII以及蛋白质C、蛋白质S和抗凝血酶)的合成来评估肝功能,而白蛋白和/或凝血因子合成的增加指示肝功能恢复或改善。肝功能也可通过测量国际标准化比率或INR来评估(例如,INR降低指示肝功能恢复或改善)。也可通过测量氨解毒为尿素来评估肝功能(例如,氨水平降低和/或尿素水平增加指示肝功能恢复或改善)。
包封的肝组织必须与意图治疗的受试者的生物流体接触。在这样的实施方案中,包封的肝将受试者所需的合成蛋白质和代谢物(白蛋白、凝血因子和/或尿素)释放到生物流体中,并且甚至可吸收来自所述生物流体的待代谢的有毒物质(氨、未结合的胆红素、胆固醇、酪氨酸等)。包封的肝组织可用于恢复先天性肝代谢缺陷中的缺乏/降低的酶功能。
为了恢复或改善肝功能,可将包封的肝组织移植在在具有降低的肝功能、几乎没有肝功能的受试者体内。因此,包封的肝组织可例如与腹膜液结合植入腹膜腔中。或者,可将包封的肝组织与肝流体结合移植到接受者的肝脏上。在另一个实例中,包封的肝组织可与淋巴液或血液结合皮下或肌内移植。
或者,为了恢复或改善肝功能,包封的肝组织可用作离体解毒装置(例如,体外装置)的细胞组分。在这样的实施方案中,经治疗的受试者的血液和/或腹膜液与包封的肝组织离体接触,以提供蛋白质和代谢物(白蛋白、凝血因子和/或尿素),吸附或代谢潜在有毒物质(氨、未缀合的胆红素、胆固醇、酪氨酸等)。
包封的肝组织可用于各种受试者(包括哺乳动物并且尤其是人),所述受试者将受益于恢复或改善肝功能。包封的肝组织的细胞对于意图治疗的受试者可以是自体的、同种异体的或异种的。然而,因为可设计包封的肝组织以防止与预期接受者的细胞(特别是免疫细胞)的物理接触,所以不需要使用自体细胞或免疫抑制药物来防止预期接受者的免疫识别和反应。这可通过例如使用包含仅一种生物相容性且交联的聚合物或第一和第二生物相容性且交联的聚合物两者的包封的肝组织和/或使用低免疫原性聚合物来进行。
在一些实施方案中,可将包封的肝组织设计成通过手术操作并引入受试者,例如使用腹腔镜手术。另外,因为肝组织被包封在生物相容性(并且在一些实施方案中,低免疫原性)聚合物中,所以一旦肝功能已经恢复或包封的肝组织不再能够改善肝功能,就有可能从受试者中除去包封的肝组织。
包封的肝组织可用于治疗肝衰竭。当大部分肝损伤无法修复并且肝不再能够发挥作用时,发生肝衰竭。肝衰竭的早期症状包括恶心、食欲不振、疲劳和腹泻。随着疾患进展,也可观察到以下症状:黄疸、出血、腹部肿胀、精神错乱或混乱(称为肝性脑病)、嗜睡以及昏迷。肝衰竭可以是急性、慢性或慢加急性的。慢性肝衰竭的最常见原因是非酒精性脂肪性肝炎、乙型肝炎、丙型肝炎、长期酒精消耗、肝硬化、血色素沉着症和营养不良。在慢性肝衰竭中,肝细胞移植最常经由门静脉循环实施。然而,在继发于肝硬化的慢性肝衰竭的情况下,肝窦开窗部(毛细血管化)的消失可防止通过门静脉循环注射的注射细胞到达肝实质并植入肝小叶中。这可能妨碍移植细胞的成熟和功能,并引起诸如窦状和门静脉血栓形成的并发症。由于它不需要门静脉注射或免疫抑制,本文所述的包封的肝组织将允许治疗成千上万的患有肝硬化和慢性(或慢加急性)肝衰竭的患者,即使是不符合移植条件的那些,从而预防或减轻严重并发症(肝性脑病、凝血病等)和改善存活。
本文所述的包封的肝组织也可用于治疗急性肝衰竭。急性肝衰竭的最常见原因是处方和草药的反应或过量、病毒感染(包括甲型、乙型和丙型肝炎)以及摄入有毒的野生蘑菇、自身免疫性肝炎或威尔逊病。急性肝衰竭可快速发生,有时在不到48小时内,并且因此难以预防。此外,在急性肝衰竭中,肝功能如此受损的受试者需要移植完全成熟和功能性肝细胞。在一些实施方案中,包封的肝组织可用于治疗或缓解急性肝衰竭的症状。将包封的肝组织移植在有需要的受试者中或用作外部(离体)解毒装置,以治疗有需要的受试者的血液(体外肝脏支持物、生物人工肝脏装置或肝脏透析)。取决于包封的肝组织中的肝类器官的数量和疾患的严重程度,可使用一种或多于一种包封的肝组织来治疗受试者。一种或多种包封的肝组织可同时或依次使用。当包封的肝组织用于治疗或缓解肝衰竭的症状时,可使用与待治疗的受试者同种异体的细胞。
包封的肝组织也可用于治疗或缓解单基因先天性肝代谢缺陷的症状(例如,克-纳二氏综合征、家族性高胆固醇血症、尿素循环障碍如N-乙酰谷氨酸合成酶缺乏症、氨甲酰磷酸合成酶缺乏症、鸟氨酸转氨甲酰酶缺乏症、瓜氨酸血症、精氨基琥珀酸裂解酶缺乏症、精氨酸酶缺乏症、I型遗传性酪氨酸血症等)。在此实施方案中,包封的肝组织提供缺乏的代谢功能、减轻症状、预防或减少并发症和/或减少或消除对终身治疗或饮食的需要。
包封的肝组织可被设计为可植入产品(例如包封的肝组织片)以治疗急性和慢性肝衰竭而无需免疫抑制。在这样的实施方案中,可植入组织片包含每cm2约数千个肝类器官。在一些实施方案中,包封的肝组织片可定位在容器(例如像,定制的、可渗透的袋)内,以便于操作和固定至所需的植入部位。在其他实施方案中,为了易于操作,可植入组织片可以是至少1mm厚,并且在一些另外的实施方案中,至少5mm至10cm宽。可将包封的肝组织制成所需的任何形状或尺寸,并且可在实施期间修整或切割。
肝代谢和肝毒性筛查方法和试剂盒
由于本文所述的包封的肝组织保留至少一些肝功能,因此它可用作体外模型来确定剂(如潜在药物)如何被肝代谢,以使药物的发现和开发合理化。它还可用于确定剂是否表现出肝毒性。当施用至全身循环时,绝大多数(可疑的)治疗剂(批准的或正在开发中)以某种方式或另一种方式被肝脏的细胞代谢。在一些实施方案中,本文所述的包封的肝组织可用于确定(如果有的话)剂(如推定治疗剂)的肝毒性(例如,药物诱导的肝毒性)。药物(批准的和研究)是肝损伤的重要原因。超过900种药物、毒素和药草据报道引起肝损伤,并且药物占所有暴发性肝衰竭病例的20%-40%。大约75%的特质性药物反应导致肝移植或死亡。药物诱导的肝损伤是撤回批准的药物的最常见原因。早期确定剂(如药物)的肝毒性概况可用于合理化药物发现和开发。
本文所述的包封的肝组织确实表现出至少一些肝功能,并且因此可体外用于确定剂(如化学剂、生物剂、天然药物产品或混合物)的肝代谢和/或肝毒性。所述方法可用于确定单一剂或剂的组合的肝代谢。
为了这样做,将待测试的剂或剂的组合与包封的肝组织接触,以在足以允许所述剂对包封的肝组织的至少一个肝类器官的至少一种(并且在一些实施方案中两种或三种)细胞类型的作用的条件下提供测试混合物。所述测试混合物包含所述剂和包封的肝组织。然后,测定所述包封的肝组织的至少一个肝类器官的至少一种(并且在一些实施方案中,至少两种或三种)细胞类型中或所述测试混合物中的所述剂的至少一种剂相关的肝代谢物。如在本公开的上下文中所使用的,表述“剂相关代谢物”是指可通过水解正测试的剂形成的代谢物。
或者或组合地,确定所述包封的组织的至少一个肝类器官的至少一种(并且在一些实施方案中至少两种或三种)细胞类型中或所述测试混合物中的至少一个肝参数。可确定的肝参数包括但不限于白蛋白产生、尿素产生、ATP产生、谷胱甘肽产生、细胞色素P450(CYP)代谢活性、肝特异性基因或蛋白质(例如,CYP酶(CyP2C9、CyP3A4、CyP1A1、CyP1A2、CyP2B6和/或CyP2D6)的表达、对肝毒素的反应、细胞死亡(例如通过测量测试混合物中的乳酸脱氢酶或转氨酶)、细胞凋亡、细胞坏死、细胞代谢活动(例如存活/死亡测定、半胱天冬酶3/7测定、MTT测定或基于WST-1的测试)、线粒体功能和/或胆汁酸产生。一旦已经获得至少一个(或多个)肝参数,就将其与相应的对照肝参数进行比较。在一个实施方案中,所述对照肝参数可在筛选的剂(或筛选的剂的组合)不存在下或在用于溶解所述筛选的剂(筛选的剂的组合)的媒介物存在下获得。可对包封的肝组织的全部或一些细胞进行确定步骤。在一个实施方案中,所述确定步骤在包封的肝组织的肝细胞和/或胆管上皮细胞上进行。
所述方法还包括比较以确定所述剂是否被包封的肝组织的肝类器官代谢和/或所述剂是否表现出对包封的肝组织的肝类器官的细胞的肝毒性。为此,在测量的剂相关肝代谢物与对照剂相关的肝代谢物之间进行比较。例如,对照剂相关的代谢物本身可以是呈完整(例如,未水解)形式的所述剂。当确定存在与对照剂相关的代谢物不同的剂相关代谢物时,则确定所述剂如何被肝细胞代谢。还可在测量的肝参数与对照肝参数之间进行比较。例如,可在所述剂不存在下获得对照肝参数。当确定肝参数不同于对照肝参数时,则确定所述剂是否表现出肝毒性。
在一个实施方案中,所述方法用于确定所述筛选的剂(或筛选的剂的组合)是否表现出肝毒性。在这样的实施方案中,确定接触所述筛选的剂(或筛选的剂的组合)是否在包封的肝组织的肝类器官的至少一种细胞(例如肝细胞或胆管上皮细胞)中诱导毒性。可例如通过确定以下来测量毒性:细胞死亡(例如通过测量测试混合物中的乳酸脱氢酶或转氨酶)、细胞代谢活力(例如存活/死亡测定、半胱天冬酶3/7测定、MTT测定或基于WST-1的测试)、线粒体功能(例如,线粒体功能的降低指示具有肝毒性)、细胞色素P450系统中的一种或多种酶(例如像CYP2E1)的活性的调节(例如,细胞色素P450系统的所述一种或多种酶的活性增加指示肝毒性)和/或胆汁酸产生的调节(例如,胆汁酸产生的增加指示肝毒性)。所述方法可包括将所述筛选的剂与对照剂(已知不会诱导肝毒性或已知诱导肝毒性)的毒性结果进行比较。
所述方法还可包括使所述筛选的剂(或多种筛选的剂)与获得的具有带不同代谢活性的肝类器官的包封的肝组织接触。例如,可使用来自不同起源和来源的细胞制备肝类器官,以在不同水平下执行特定代谢功能(因此代表在一般群体中的个体之间发现的变异)。例如,可在单个板的不同孔中产生具有不同代谢活性的所获得的包封的肝组织,以允许在它们中的每一者和全部上比较地测试所述筛选的剂。在一个实施方案中,肝类器官可源自不同性别、种族和/或基因型。可针对这些不同性别、种族和/或基因型测试所述筛选的剂以确定代谢的差异或者是否在所有或仅一些性别、种族和/或基因型中存在肝毒性。在一个实施方案中,所述肝类器官的间充质和/或内皮组分在多个肝类器官之间可以是相似的,但肝细胞和胆管上皮细胞来自不同的性别、种族和/或基因型。例如,每一不同的包封的肝组织可位于不同的孔中(如果需要多次重复),并且相同的筛选的剂可与每一不同的包封的肝组织接触。
在一些实施方案中,在筛选方法中使用的包封的肝组织不包含第二或另一种生物相容性交联聚合物,而是基本上由肝类器官和如本文所述的第一生物相容性交联聚合物组成。
所述筛选方法可使用已经单独包封的肝类器官或已经包封在含有一个以上肝类器官的基质中的肝类器官。在后者中,包封的肝组织可位于孔的底部,从而使得非常方便地添加筛选的剂和在确定步骤之前洗涤包封的肝组织。
本公开还提供了用于确定肝代谢或肝毒性的试剂盒。所述试剂盒包括本文所述的包封的肝组织和用于进行所述方法的说明书。在一些实施方案中,所述试剂盒还包括组织培养载体,所述组织培养载体可任选地包括至少一个孔。在另外的实施方案中,所述包封的肝组织可位于至少一个孔的底部,并且如果需要,附接(共价或不共价)至所述孔的表面。所述试剂盒还可包括用于进行肝代谢或肝毒性测量(例如,例如存活/死亡测定、半胱天冬酶3/7测定、MTT测定、WST-1测定和/或LDH测量)的试剂。
本发明将通过参考以下实施例而更易于理解,所述实施例被给出来说明本发明而非限制本发明的范围。
实施例I-肝类器官的制备
外周血单核细胞(PBMC)分离。将血液直接收集到具有肝素钠8mL的BDCPTTM管中。如果不立即进行加工,则将所述BDCPTTM管在室温下储存,但不超过4小时(h)。将所述BDCPTTM管以1 800g(2 800rpm)在室温下离心20分钟(min)。在离心后,使用5mL移液管,将血浆抵靠凝胶塞轻轻地上下吸移,以除去可能粘在凝胶顶部的细胞。将细胞悬浮液转移至50mL FalconTM管,如果必要汇集来自每个管的细胞。添加无血清培养基StemPro-至40mL总体积。获得所述悬浮液的10μL等分试样以用于计数(血细胞计数器或自动细胞计数器)和用于确定细胞活力(使用Trypan BlueTM排除方法)。将细胞悬浮液在室温下以250g(1 200rpm)离心7分钟。将离心的细胞以5X 106个活细胞/mL的浓度悬浮在完全StemPro-34TM培养基中并任选地冷冻保存。
PBMC重新编程。在重新编程之前四天,将新鲜或解冻的PBMC重新悬浮于补充有细胞因子(SCF、FLT3、IL3、IL6)的完全StemPro-34TM(cStemPro-34TM)培养基中至5X 105个细胞/mL,接种并在37℃/5%CO2下孵育。在重新编程PBMC当天,对细胞进行计数并用仙台病毒CytoTune 2.0TM(根据制造商的说明书)转导。更具体地,对细胞进行计数并且达到目标感染复数(MOI)所需的每种病毒的体积和关于防伪证明书(CoA)的滴度信息如下确定:
病毒Vol(μl)=MOI(细胞感染单位或CIU/细胞)X n°细胞/病毒滴度(CIU7mL)X 10-3(μl/mL)
收获细胞并接种在具有2,5-5X 105个细胞/孔的6孔板中用于转导。将3 CytoTune 2.0TM仙台管中的每个的计算体积添加至预温热至37℃的1mL的cStemPro-34TM培养基中。将混合物轻轻地上下吸移。将板的边缘用ParafilmTM密封并在室温下以2 250rpm离心90分钟。将另外1mL的cStemPro-34TM培养基添加至各孔,并将细胞孵育过夜。在第二天,将细胞和培养基从培养板中取出并转移至15mL管。用1mL的-34培养基轻轻冲洗细胞,以确保收获大部分细胞。将细胞悬浮液以1 200rpm离心10分钟。丢弃上清液并将细胞重新悬浮于6孔板的每孔0,5mL的cStemPro-34TM培养基中。将细胞在37℃/5%CO2下培养两天。在重新编程后三天,将细胞置于涂有玻连蛋白或层粘连蛋白的培养皿上,每培养皿不含细胞因子的-34培养基10 000和50 000个活细胞。在重新编程后七天,将细胞转向iPSC培养基(Essential 8 Flex培养基,首先与-34以1:1的比例,然后仅在Essential 8 FlexTM培养基中)。集落(例如细胞团块)通常在重新编程后15-21天出现。鉴定重新编程的集落,并在针对细胞膜标志物TRA1-60的活染色后选择用于挑选。详细地,将细胞用温热PBS洗涤且然后与FITC缀合的抗体抗人TRA1-60(在新鲜Essential 8 Flex培养基中1:100稀释,并使用注射器过滤器SFCA膜0.2μm过滤)一起在37℃下孵育1小时。在孵育后,用新鲜Essential 8 Flex培养基洗涤细胞且然后在荧光显微镜下检查。将成功重新编程的集落标记并手动挑选用于在玻连蛋白包被的板上扩增。将挑选的细胞集落在完全Essential 8 FlexTM培养基中的玻连蛋白包被的培养板上在37℃/4%O2/5%CO2下培养。在每天更换培养基之前,使细胞集落附着24小时。然后将iPSC在Essential 8 Flex培养基中和涂有玻连蛋白的培养容器中培养,每天更换培养基。
皮肤成纤维细胞重新编程。在转导前两天,将成纤维细胞以适当的密度接种在6孔板上以在成纤维细胞培养基(DMEM高葡萄糖)中转导当天达到2x 105-3x 105个细胞/孔。在重新编程成纤维细胞当天,对细胞进行计数并用仙台病毒CytoTune 2.0TM(根据制造商的说明书)转导。更具体地,对细胞进行计数并且达到目标感染复数(MOI)所需的每种病毒的体积和关于CoA的滴度信息如下确定:
病毒Vol(μl)=MOI(CIU/细胞)X n°细胞/病毒滴度(CIU/mL)X10-3(μl/mL)
收获细胞并接种在具有2,5-5X 105个细胞/孔的6孔板中用于转导。将3 CytoTune 2.0TM仙台管中的每个的计算体积添加至预温热至37℃的1mL的成纤维细胞培养基中。将混合物轻轻地上下吸移。将另外1mL的成纤维细胞培养基添加至各孔,并将细胞孵育过夜。在第二天除去含有病毒的培养基,并添加新鲜培养基。在重新编程后七天,使成纤维细胞通过并将5x 105个细胞置于涂有玻连蛋白的培养皿(100mm培养皿)上。在重新编程后八天,将细胞置于Essential 8 FlexTM培养基中。集落(例如细胞团块)通常在重新编程后15-20天出现。在活染色后进行重新编程的集落的选择,参见上述用于PBMC重新编程的程序。手动挑选细胞集落并转移在玻连蛋白或层粘连蛋白包被的板上。在重新编程后,所获得的临床级iPSC获得多能干细胞所特有的多能基因的自我更新能力和表达水平,同时在单细胞分析下显示出跨群体的高水平均匀性。
iPSC分化为内胚层。在分化前三天,用AccutaseTM进行单细胞传代并将细胞接种在层粘连蛋白(重组人层粘连蛋白521)包被的板上。将细胞在补充有Revita CellTM的Essential 8 FlexTM培养基中培养持续接种后的前24小时。将细胞在37℃下置于环境O2/5%CO2中过夜,之后开始分化。为了促进内胚层特化(在第1天和第2天),将细胞用DMEM/F-12培养基洗涤且然后在补充有1%剔除血清替代物、100ng/mL活化素A和3μM CHIR99021的RPMI/B27(无胰岛素)培养基中培养。将细胞在环境O2/5%CO2下在37℃培养2天。为了促进内胚层定型(定形内胚层,在第3天至第5天),将细胞用DMEM/F-12培养基洗涤且然后在补充有100ng/mL活化素A的RPMI/B27(无胰岛素)中培养。将细胞在环境O2/5%CO2下在37℃培养3天。为了促进前肠后段的分化(第6天至第8天),将细胞用DMEM/F-12培养基洗涤且然后在补充有2%剔除血清替代物、20ng/mL BMP4和10ng/mL bFGF的RPMI/B27培养基(含胰岛素)中培养三天。从iPSC分化的内胚层细胞表达衍生的定形内胚层细胞和前肠后段细胞所特有的标志物,两者均在mRNA和蛋白质水平。
内胚层分化成肝细胞样细胞(iHep)。为了促进肝特化(成肝细胞形成),将细胞在补充有2%剔除血清替代物、20ng/mL BMP4和10ng/mL bFGF的RPMI/B27培养基(含胰岛素)中培养2天。为了促进肝成熟的第一步(例如,未成熟的肝细胞形成),将细胞在DMEM/F-12培养基中洗涤,并在补充有2%剔除血清替代物和20ng/mL HGF的RPMI/B27(含胰岛素)中培养五天。为了促进肝成熟的第二步(例如,成熟肝细胞形成),将细胞用DMEM/F-12培养基洗涤,并在补充有原代肝细胞维持补充剂、20ng/mL OSM和10μM地塞米松的威廉姆氏(William's)E培养基中培养10天。在2D分化时,内胚层细胞获得未成熟和成熟肝细胞样细胞所特有的标志物,并执行成熟肝细胞所独特的功能(如白蛋白分泌、尿素合成和细胞色素P450 3A4活性)。
iPSC分化为间充质祖细胞(iMPC或iMSC)。在分化前三天,进行使用AccutaseTM的单细胞传代,将细胞接种在玻连蛋白包被的板上,并在接种后在补充有Revita CellTM的Essential 8 FlexTM培养基中培养前24小时。将细胞在DMEM/F-12培养基中洗涤,且然后用间充质干细胞(MSC)培养基(DMEM/高葡萄糖、10%剔除血清替代物、1%Pen/Strep、谷氨酰胺、HEPES、非必需氨基酸)培养两周。之后,将细胞在板上培养,而不在MSC培养基中包被。从第4代开始,细胞被认为是间充质祖细胞。它们在免疫荧光和流式细胞术下与脐带基质干细胞无法区分,并且它们的多能性通过成骨和成脂分化潜力得到证实。
iPSC分化为内皮祖细胞(iEPC)。在分化前三天,进行使用AccutaseTM的单细胞传代,将细胞接种在层粘连蛋白(重组人层粘连蛋白521)包被的板上,并在接种后在补充有Revita cellTM的Essential 8 FlexTM培养基中培养前24小时。为了开始分化并促进中胚层诱导,将细胞用DMEM/F-12培养基洗涤并在补充有6μM CHIR99021、10ng/ml活化素A和20ng/ml BMP4的StemDiffTM APELTM培养基中培养两天。为了促进内皮分化,将细胞用DMEM/F-12培养基洗涤,在补充有10ng/mL bFGF、20ng/mL BMP4和50ng/mL VEGF的StemDiffTM APELTM培养基中培养5天。所获得的iEPC获得与脐带血管内皮细胞(HUVEC)相当的形态、表达人祖细胞内皮细胞所特有的标志物(如免疫荧光下的VE-钙粘蛋白和流式细胞术下至少60%细胞中的CD-31),并且在中培养时能够形成血管(管形成测定)。从第7天,将细胞维持在玻连蛋白包被的板上的内皮扩增培养基(完全EBM2培养基:补充有来自Lonza的EGM2 BulletKit的EBM2基础培养基)中。
类器官产生。将iEPC使用AccutaseTM解离并以700 000个活细胞/mL的密度重新悬浮于完全EBM2培养基中。将iMPC用AccutaseTM解离并以200 000个活细胞/mL的密度重新悬浮于完全DMEM培养基中。将肝细胞用AccutaseTM解离并以1 000 000个活细胞/mL的密度重新悬浮于完全威廉姆氏E培养基/完全EBM2(1:1)培养基中。将iEPC、iMPC和肝细胞以1(肝细胞):0.7(iEPC):0.2(iMPC)的比例混合,并接种于具有每cm2 500μm直径和深度的157个微腔(总共3200个微腔/烧瓶)(数字是近似值)、具有补充有20ng/mL OSM和10μM地塞米松的完全威廉姆氏E培养基/完全EMB2(1:1)培养基的超低附着T-25球状微腔烧瓶(Corning)中。将细胞在环境O2/5%CO2下在37℃培养5天。
受控尺寸的类器官形成(图3C)。将iEPC、iMPC和肝细胞以1(肝细胞):0.7(iEPC):0.2(iMPC)的比例组合,并接种到超低附着(ULA)T-25球状微腔烧瓶(Corning)中。存在157个微腔/cm2,并且微腔的直径和深度为500μm,总共有3200个微腔/烧瓶(数字是近似值)。得到的类器官尺寸非常均匀,具有约50-250μm的直径。它们都呈现相同的构型,核心中的大部分间充质细胞和内皮细胞以及肝细胞和胆管细胞大部分位于外表面。在这些类器官的核心中未观察到坏死。类器官表达肝特异性标志物并且能够执行成熟肝功能,如在条件培养基中白蛋白分泌、尿素合成和CyP3A4活性。
类器官包封(图4A)。从超低附着烧瓶收获类器官并以低速离心(400g持续5分钟)以形成团块。将团块(约3 000个类器官)重新悬浮于补充有0.1%N-乙烯基-2-吡咯烷酮和0.4mg/mL Irgacure 2959的不含钙和镁的无菌PBS中的5%4臂PEG-乙烯基砜(20kDa)溶液中。产生50μL这种溶液的微滴(含有约100个类器官)并在96孔板的孔中沉积,且随后在UV光下交联(在4cm的距离下5分钟1090μW/cm2)。将产生的包封的肝组织在补充有20ng/mL OSM和10μM地塞米松的完全威廉姆氏E培养基/完全EMB2(1:1)培养基中维持5天。在包封后五天,暂停OSM补充并将完全威廉姆氏E培养基/完全EBM2培养基的比例从1:1改变为4:1。将组织在环境O2/5%CO2下在37℃培养并且每隔一天更换培养基。每周在条件培养基中评估白蛋白分泌。在超过7周的培养过程中,包封的类器官保留通过水凝胶分泌白蛋白的能力,从而证明了它们在聚合物中的存活和维持其分化状态,同时证实了分泌的蛋白质在其外部的扩散。包封的肝组织足够坚固以便可用仪器操作而不会失去其形状和完整性。
可降解的水凝胶制剂。用从JenKem获得、目录号“8ARM(TP)-VS”的8臂PEG-VS(三季戊四醇核心;Mw=40kDa)制备可蛋白水解降解的PEG乙烯基砜水凝胶(“D-PEG-VS”)。将8臂PEG-VS在等渗HEPES缓冲液(0.1M HEPES,0.1M NaCl,pH 7.4)中以5%至10%(w/v)最终浓度溶解,以制备可降解的PEG乙烯基砜水凝胶前体溶液。然后将可降解的PEG乙烯基砜水凝胶前体溶液与具有3个-SH和-VS基团的摩尔比为1:1的反应性硫醇的纤溶酶敏感性交联剂混合。纤溶酶敏感性交联剂是定制合成(Genscript,Piscataway,NJ)并具有氨基酸序列:
Ac-GCYK↓NSGCYK↓NSCG(SEQ ID NO:1)
在纤溶酶敏感性交联的氨基酸序列中,添加N-末端乙酰基以除去此末端上的电荷。箭头指示蛋白酶裂解位点。将PEG乙烯基砜水凝胶前体溶液和纤溶酶敏感性交联剂混合引发迈克尔型加成(MTA)反应,使所述反应进行至少5分钟以交联PEG乙烯基砜水凝胶并产生可降解的PEG乙烯基砜水凝胶。
不可降解的水凝胶制剂。用从JenKem获得、目录号“A7025-1”或“4ARM-VS”的4臂PEG-VS(季戊四醇核心;Mw=20kDa)制备不可降解的PEG乙烯基砜水凝胶(“ND-PEG-VS”)。将4臂PEG-VS以5%至10%(w/v)最终浓度溶解于含有0.4mg/100μl光引发剂(例如,如α羟基酮,例如,以IRGACURE 2959(BASF,材料号55047962)出售的2-羟基-4'-(2-羟基乙氧基)-2-甲基苯丙酮(参见,例如,Elisseeff等人(2005)Biomaterials 26(11):1211-18)和0.1%(v/v)N-乙烯基-2-吡咯烷酮(PVP)(Sigma-Aldrich,St.Louis,USA)的无菌杜氏磷酸盐缓冲盐水(D-PBS)(pH 7.4)中以制备不可降解的PEG乙烯基砜水凝胶前体溶液。已显示PVP在不影响细胞相容性的情况下增强凝胶化(参见,例如Lin等人(2014)Acta Biomater 10(1):104-14,以引用的方式并入本文)。制备最终浓度为5%至10%(w/v)的不可降解的PEG乙烯基砜水凝胶前体溶液,其相当于2.5-30mg/100μl的PEG-VS。将不可降解的PEG乙烯基砜水凝胶前体溶液暴露于恒定强度(在4cm的距离下1090μW/cm2)的紫外光持续不同的辐射时间(例如,3-10分钟),以制备不可降解的PEG乙烯基砜水凝胶。
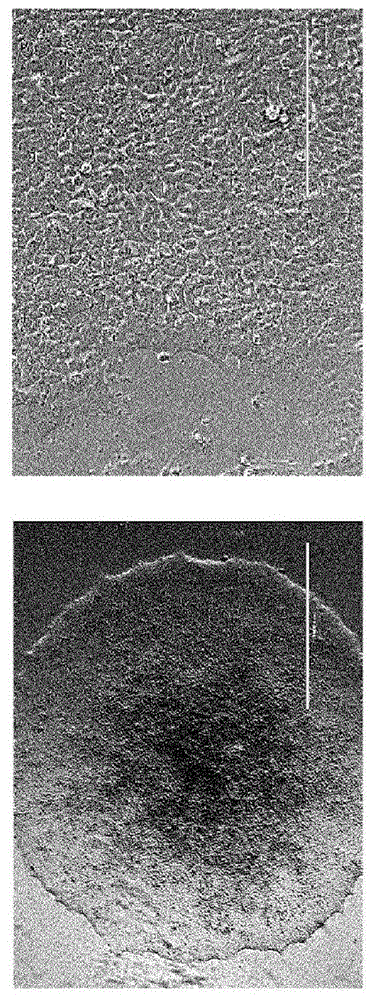
双水凝胶制剂。如上所述制备可降解的PEG乙烯基砜水凝胶(“D-PEG-VS”),以提供双PEG水凝胶制剂的“内核”。在内部(可降解的)核心的凝胶化完成后(大约7-10分钟,取决于固体浓度),将交联的内核转移至如上所述的不可降解的PEG乙烯基砜水凝胶前体溶液的10-μl珠的中心并暴露于恒定强度(在4cm的距离下1090μW/cm2)的紫外光持续不同的辐射时间(大约3-10分钟)以提供围绕“内核”的“外壳”。
D-PEG-VS、ND-PEG-VS和双PEG水凝胶中的卵巢包封。卵巢组织的包封在加热台上的无菌生物安全柜中进行,以使对组织的环境损伤最小化。为了制备基于PEG的植入物,将卵巢块从孵育箱中的维持培养基转移并使用胰岛素(27G)针置于疏水性载玻片上。每个卵巢块的体积是约1至1.5mm3。将PEG前体的微滴(5μl)吸移在同一载玻片上,并将卵巢块转移到可降解的PEG乙烯基砜水凝胶前体溶液的微滴中。为了制备D-PEG-VS,将另外5μl溶解的肽交联剂添加至PEG-VS的微滴中并混合。然后用顶部载玻片覆盖载玻片并使其形成凝胶5分钟。在凝胶化完成后,水凝胶准备好移植。
为了制备具有卵巢组织的不可降解的PEG乙烯基砜水凝胶,将具有引发剂和PVP的PEG乙烯基砜前体溶液的微滴(10μl)吸移到疏水性载玻片上。将卵巢组织块置于玻璃上并通过针转移到微滴中。将具有组织的PEG-VS前体溶液暴露于恒定强度(在4cm的距离下1090μW/cm2)的紫外光持续不同的辐射时间(例如,3至10分钟)以制备不可降解的PEG乙烯基砜水凝胶。
为了将卵巢组织块包封在双PEG水凝胶中,将卵巢块转移到可降解的PEG乙烯基砜水凝胶前体溶液的微滴中并如上所述使其凝胶化,然后将胶凝化的可降解的PEG乙烯基砜水凝胶包封在如上所述的不可降解的PEG乙烯基砜水凝胶中以用于制备双水凝胶。
实施例II-包封的组织表征
细胞免疫荧光。将细胞固定在4%多聚甲醛中并在0,2%Triton XTM-100中在室温下透化5分钟。通过将细胞与3%封闭血清(与第一抗体对应)溶液在室温下孵育30分钟来封闭非特异性位点。将固定和透化的细胞与第一抗体溶液(抗体在PBS-BSA 2%中稀释)在室温下孵育1小时。然后将细胞与第二标记的抗体溶液(荧光)一起在室温下避光孵育30分钟。在最后15分钟期间添加染料(PureblueTM核染色,BioRad)以使细胞核染色。用AntifadeTM试剂(ProLong Gold)固定细胞。在所述程序后第二天分析荧光。
肝类器官的免疫荧光。将类器官固定在4%多聚甲醛中且随后包埋在石蜡中。使用浓度递减(从100%至30%)的二甲苯和乙醇溶液对石蜡切片进行脱蜡并再水化。通过将载玻片与3%封闭血清(与第一抗体对应)溶液在室温下孵育20分钟来封闭非特异性位点。将载玻片与第一抗体溶液(抗体在PBS-BSA 2%中稀释)在室温下孵育1小时。将载玻片与第二标记的抗体溶液(荧光)在室温下避光孵育30分钟。用具有DAPI的AntifadeTM试剂(ProLong Gold)固定载玻片。在所述程序后第二天分析荧光。
用于细胞和类器官的免疫荧光的抗体。来自Novus Biological的抗人NANOG 1:10稀释;来自Fisher Scientific的抗人TRA1-81 1:50稀释;来自Fisher Scientific的抗人SSEA4 1:50稀释;来自Novus Biological的抗人POU5F1 1:50稀释;来自Novus Biological的抗人SOX2 1:50稀释;来自ABCAM的抗人FOXA2 1:100稀释;来自ABCAM的抗人SOX17 1:100稀释;来自ABCAM的抗人CXCR4 1:100稀释;来自ABCAM的抗人GATA4 1:50稀释;来自的DAKO抗人AFP 1:100稀释;来自DAKO的抗人白蛋白1:100稀释;来自BD Bioscience的抗人E-钙粘蛋白1:100稀释;来自ABCAM的抗人αSMA 1:100稀释;来自ABCAM的抗人纤连蛋白1:100稀释;来自ABCAM的抗人CD31 1:100稀释;来自ABCAM的抗人VE-钙粘蛋白1:100稀释;来自ABCAM的抗人CK19 1:100稀释;来自ABCAM的抗人ZO1 1:100稀释;来自ABCAM的抗人EpCAM 1:100稀释。
FACS分析。将0.5-1X 106细胞等分到每个测定管中。将细胞用100μL的荧光染料缀合的第一抗体溶液(膜抗原)在室温下染色20分钟(避光)。随后将细胞用4%多聚甲醛在室温下固定10分钟。将细胞用1%Triton XTM-100透化。将细胞用100μL的荧光染料缀合的抗体溶液(细胞内抗原)染色并在黑暗中在室温下孵育20分钟。将细胞重新悬浮于0.5mL PBS-BSA 1%中,保持在4℃并进行分析。用于FACS的抗体来自BD Bioscience:PE抗人SSEA4;Alexa 647抗人NANOG;PERCP-CY 5,5抗人TRA1-81;APC-R700抗人CD117;FITC抗人CD90;PE抗人CD133;PE抗人CD31、PE抗人CD25、抗人7AAD;来自Biolegends:APC抗人CD3、PEcy7抗人HLA-DR、PerCp-Cy5.5抗人CD69;来自Invitrogen:FITC抗人CFSE。
实时RT-PCR。从培养的细胞或类器官提取总RNA(ReliaPrepTMRNA Cell Miniprep System,Promega)作为合成单链cDNA的模板。进行逆转录以获得cDNA。制备PCR反应混合物且然后负载于板中。将板密封、离心且然后负载到仪器中。使用标准TaqMan qPCR反应条件。使用比较CT(ΔΔCT)方法分析数据以计算基因表达的相对定量。使用以下基因表达测定(来自Thermo Fisher scientific):Hs04399610G1 Nanog Taqman基因表达测定;Hs01895061_U1 POU5F Taqman基因表达测定;Hs1053049_S1 SOX2 Taqman基因表达测定;Hs00751752_S1 SOX17 Taqman基因表达测定;Hs00171403_M1 GATA4 Taqman基因表达测定;Hs002230853_M1 HNF4A Taqman基因表达测定;Hs00173490_M1 AFP Taqman基因表达测定;Hs00609411_M1白蛋白Taqman基因表达测定;Hs99999905_M1 GAPDH Taqman基因表达测定。所示的结果是从三次重复获得的平均表达。
Cyp3A4活性。根据制造商的说明书,使用来自Promega的P450-GloTM测定评价Cyp3A4活性。
尿素合成。使用来自Gentaur的Quantichrom尿素测定试剂盒TM根据制造商的说明书测量尿素合成。
白蛋白产生。使用微量白蛋白测定评价白蛋白产生,所述测定是Architect cSystems上的白蛋白的定量测量。它是使用针对人白蛋白的多克隆抗体的一种比浊免疫测定。当将试样(在这种情况下,来自96孔板的每个孔的200μl上清液,在培养基更换后48小时收集)与试剂混合时,所述试样中的白蛋白与试剂中的抗人白蛋白抗体(山羊)组合以产生不溶性聚集体,所述聚集体引起溶液中的浊度增加。浊度的程度与所述试样中白蛋白的浓度成比例,并且可光学测量。试剂盒:2K98-20 MULTIGENT微量白蛋白。
苏木精和曙红(H&E)染色。将肝芽、类器官和卵巢的切片放入蒸馏水中。将细胞核用明矾苏木精染色。将切片在流动的自来水中冲洗并用0.3%酸性醇分化。将切片用曙红染色2分钟。将切片脱水、清洗并安装。
混合淋巴细胞反应。MLR在由6x105个细胞组成的106个效应PBMC、105个同种异体成熟树突细胞(mDC)肝类器官上进行两次。在MLR的6天共培养之前,将靶细胞或组织照射并使其游离或包封(+凝胶)在水凝胶中。
IFN-γ的产生。根据制造商的说明书,用来自PEPROTECH的人IFN-γ标准ABTS ELISA开发试剂盒评价IFN-γ产生。
茜素红S染色。使用来自Sigma Aldrich的茜素红S染色评价iMPC来源的骨细胞的钙沉积物。将细胞固定在4%多聚甲醛中,然后用PBS洗涤并在室温下与茜素红S一起孵育5分钟。在孵育后,除去茜素红S溶液,并用PBS洗涤细胞。用显微镜检查染色的试样。
中性脂质染色。根据制造商的说明书,使用来自Invitrogen的HCS LipidTOXTM中性脂质染料进行iMPC来源的脂肪细胞中的中性脂质染料。
管形成测定。将iPSC来源的内皮祖细胞(iEPC)与AccutaseTM解离,且然后以用生长因子减少的Matrigel(Corning)包被的24孔板的7x 104/孔的密度接种在完全EBM2培养基中。将板在37℃下在环境O2/5%CO2中孵育过夜。在孵育16小时后,在光学显微镜下可视化管形成。
细胞活力测定。对于来自ThermoFisher Scientific的哺乳动物细胞,用LIVE/DEADTM活力/细胞毒性试剂盒测定包封的肝组织的细胞活力。将ELT(在96孔板中产生)各自与150μl的PBS、乙锭同二聚体-1和钙黄绿素-AM溶液(根据制造商的说明书制备)在37℃在环境O2/5%CO2下孵育30分钟。在孵育后,在荧光显微镜下分析绿色和红色荧光。
氨代谢。将ELT与补充有1mM氯化铵、4mM L-谷氨酰胺/丙氨酸和4mM L-鸟氨酸的完全ELT培养基(完全威廉姆氏E培养基/完全EBM2培养基4:1)一起孵育24小时。在24小时后,收获用过的培养基并根据制造商的说明书,使用来自ABCAM的氨测定试剂盒以500g离心5分钟以测定氨浓度。使用来自Gentaur的Quantichrom尿素测定试剂盒TM根据制造商的说明书,在补充有1mM氯化铵、4mM L-谷氨酰胺/丙氨酸和4mM L-鸟氨酸的完全ELT培养基一起孵育24小时之前和之后测量ELT的尿素产生。
他克莫司代谢(图4K):将ELT与补充有来自Fujisawa Healthcare的20ng/ml FK506(他克莫司)、有或无补充有20μM利福平的完全ELT培养基(完全威廉姆氏E培养基/完全EBM2培养基4:1)一起在环境O2/5%CO2、在37℃下孵育12小时。在12小时后,收获用过的培养基,并通过液相色谱串联质谱测定测量他克莫司浓度。使用电喷雾电离在选择性反应监测模式下测量具有m/z 821,5→768,6(他克莫司)转变的铵加合离子。
ELT冷冻后表征。将ELT在冷冻培养基(完全ELT培养基10%DMSO)中在-80℃下冷冻3天。在3天后,将ELT解冻,并且如上所述在解冻后24小时和1周测量白蛋白产生以及CyP3A4活性。
异物反应评估。将ELT植入免疫活性小鼠的腹膜腔内(如图4M所示),无需免疫抑制处理。然后在1周(图4N左)和4周(图4N右)后将ELT从腹膜腔中取出,并检查是否存在异物反应(即纤维化、炎症)的迹象。
畸胎瘤形成测定。将未分化的iPSC在包封于5%PEG-VS水凝胶后皮下注射或皮下植入NOD/SCID IL-2Rγ-/-老鼠中。在8周后,处死小鼠并评估畸胎瘤形成。
包封的肝组织在患有急性肝衰竭、无免疫抑制的免疫活性小鼠中的异种移植的短期体内功效的初步评估。在免疫活性Fah-/-(酪氨酸血症)小鼠中通过从饮用水中除去NTBC补充剂而触发急性肝衰竭。将六只动物移植包封的肝组织(在腹腔内植入从如上所述的人细胞产生的8x2mm圆柱形包封的肝组织),并跟踪30天以评估存活率。尽管进行异种移植,但未施用免疫抑制。接受空生物材料的六只小鼠作为对照。移植后第7天的体重减轻被评估为次要结果。所有在第30天仍然存活的动物被安乐死,并且根据制造商的说明书,使用来自Abcam的人白蛋白ELISA试剂盒在小鼠血清中特异性地测量人白蛋白。
产生了14个人iPSC群体,并在严格的无异源和无饲养条件下维持(图1A-1D)。从皮肤成纤维细胞或1.5mL的外周血,获得6.3±5.6高度同源的iPSC群体。iPSC可再现地分化为定形内胚层和前肠后段(图2A-2D),并且然后进一步分化为表达肝特异性标志物和功能的肝细胞样细胞(图2E-2H)。从单一iPSC群体开始,获得肝祖细胞(成肝细胞)、内皮祖细胞和间充质祖细胞(包括骨细胞和脂肪细胞)(图2I-M)。
将三种iPSC来源的细胞类型在固定尺寸、极低附着的微孔中悬浮培养(图3A)。受控尺寸的类器官(直径50-250μm,图3C)在成熟培养基中在5天后在微孔内分化,显示令人联想到人肝脏的3D结构(图3B和3C),表达肝脏标志物(图3D),并获得显著白蛋白和尿素分泌能力(图3E)以及CyP3A4活性(图3F)。
为了促进肝类器官的成熟并增强它们的体内存活,开发了包封策略(图4A和4B)。将多个肝类器官(例如50-150)分散在液体5%20kDa 4臂PEG-VS生物材料中(图4A)。光聚合允许获得包封的肝组织(ELT),其足够坚固以用手术工具操纵(图4B)。这种ELT作为可植入产品(8x2mm圆柱形)或作为体外测定(96孔格式)产生。包封程序未引起显著细胞毒性(在存活/死亡测定>90%细胞活力,图4C)。在生物材料内,肝类器官显著成熟,而它们的大小未显著变化。在包封后三十天,肝细胞分散在整个类器官中,并且胆管可见(图4D)。肝细胞成熟并获得成体表型。在包封7天后,ELT能够在体外与原代人肝细胞相比一样或更有效地发挥成熟肝功能(增加白蛋白和尿素分泌、CyP3A4活性、氨或他克莫司代谢、降低AFP分泌)(图4E-4H)。白蛋白产生、氨代谢为尿素在ELT中比在原代肝细胞中显著更有效,并且与人肝脏相当(12mg白蛋白/g组织对比20mg/g人肝脏;347μmol氨/min/可植入装置对比约400μmol/min/肝脏;图4E-4F)。CyP3A4的他克莫司代谢与人肝脏相当,并且可通过补充利福平诱导(图4G)。所有这些功能维持至少7周,并且随时间推移稳定(而原代人肝细胞在接种后几天内失去其代谢活性)。ELT能够耐受低温保存而无它的肝功能的任何显著损失(图4H),而原代人肝细胞则不然。将含有由人多能干细胞产生的肝类器官的ELT植入免疫活性小鼠的腹腔中以评估其生物相容性(图4I)。在1或4周后未注意到异物反应(无粘连,无炎症;图4J)。用于产生肝类器官的多能干细胞能够在免疫抑制的NSG小鼠中皮下注射后形成畸胎瘤(图4K)。将这种多能干细胞包封在上述基于PEG的生物材料内防止包埋的细胞扩散到受体组织中,并且因此预防畸胎瘤形成(图4L)。这表明包封可显著降低由干细胞来源的分化细胞或类器官的植入形成肿瘤的风险(因此表明ELT的缺乏或低致瘤性)。为了评估ELT的免疫原性和通过包封在生物材料内提供的免疫隔离,进行了混合淋巴细胞反应测定(图4M-4O)。未包封的肝类器官显示非常低的活化同种异体效应T细胞的能力。包封防止包封的细胞与免疫细胞之间的任何接触,从而防止T细胞活化。通过包封同种异体成熟树突细胞后缺乏T细胞活化,进一步证实了生物材料的免疫隔离能力(图4M-4O)。这些数据表明,有可能在不需要免疫抑制的情况下移植同种异体包封的肝组织。
在免疫活性小鼠中进行概念验证实验。在酪氨酸血症Fah-/-小鼠中诱导急性肝衰竭后,将人ELT移植到动物的腹腔中,没有免疫抑制。接受空生物材料的小鼠充当对照。在手术后第7天,所有接受ELT的小鼠体重增加,而所有对照均稳定或体重减轻(图4P)。在手术后三十天,与对照的0%相比,67%接受ELT的小鼠存活。在第30天,在所有存活动物的血液中检测到人白蛋白。这表明ELT在患有肝衰竭的患者中恢复肝功能和改善存活而无需免疫抑制的巨大潜力。
虽然本发明已结合其具体实施方案来描述,但是应理解权利要求书的范围应受实施例中列出的优选实施方案的限制,但是应总体上给出与描述一致的最广泛解释。
序列表
<110> HSJ增殖合伙人有限公司(VALORISATION-HSJ, LIMITED PARTNERSHIP)
密执安大学董事会(THE REGENTS OF THE UNIVERSITY OF MICHIGAN)
<120> 包封的肝组织
<130> 05015490-115PCT
<150> US 62/425,811
<151> 2016-11-23
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 14
<212> PRT
<213> 人工序列(Artificial Sequence)
<220>
<223> 纤溶酶敏感性交联剂
<400> 1
Gly Cys Tyr Lys Asn Ser Gly Cys Tyr Lys Asn Ser Cys Gly
1 5 10
- 还没有人留言评论。精彩留言会获得点赞!