纯化病毒的方法与流程
本发明提供了从感染了病毒的宿主细胞中纯化病毒颗粒的方法,其中用benzonase和聚乙二醇处理从中释放的病毒颗粒,并将所述纯化的病毒用于治疗组合物。
背景技术:
病毒疫苗的商业生产通常需要大量病毒。随着基于细胞培养的技术的发展,基于细胞培养的技术作为基于卵的生产系统的替代用于制造病毒疫苗,表现为最快速和最有潜力的解决方法,以克服与基于卵的生产系统的相关缺点和限制。
在生产后,无论是在卵上还是在细胞培养物中生产,必须从细胞培养物中回收所产生的病毒,并在适当的时候纯化。
因此,高效的疫苗生产需要从宿主系统中以高产量所生产的大量病毒的生长。尽管在培养条件病毒的生长对于实现可接受的病毒高产量具有重要意义,但病毒的多步纯化通常伴随着大量病毒材料的损失,因此是使病毒疫苗能够成功生产的关键步骤。
具体地,流感流行或者甚至大流行(pandemic)具有很高的经济影响。尽管并非所有国家都能获得有关流感致死的准确数据,但在美国,65岁以上人群中每10万人流感致死人数在30人至150人之间。在流感流行期间,最常见的发病率为1%-5%,但发病率可以达到40%-50%。疫苗接种被认为是限制流行病及其不良影响的最佳方法。
流感病毒属于正粘病毒科,根据抗原性差异分为甲型、乙型和丙型。甲型和乙型流感病毒是重要的呼吸道病原体,但甲型流感病毒是使流行病具有高死亡率的主要原因。
流感病毒具有负极性的分段的单链RNA基因组。甲型流感病毒的基因组由编码11种(一些甲型流感病毒株10种)蛋白质的8种RNA分子组成。病毒包膜由基质蛋白(M1)层上的脂质双层组成。嵌入脂质双层的是糖蛋白血凝素(HA)和神经氨酸酶(NA),它们分别负责病毒附着和渗入细胞,以及从感染细胞中释放子代病毒。两种蛋白质也决定了甲型流感病毒的亚型。由于分段的基因组,高突变率和频繁的基因重排导致极大的免疫变异性,特别是甲型流感病毒的HA和NA抗原。乙型病毒没有表现出相同程度的抗原变异,并且主要是儿童病原体,其偶尔会引起与甲型相同严重程度的流行病。
未来可能会出现新的流感流行和大流行,目前以卵为基础的疫苗生产技术似乎无法应对大流行危机。因此,需要可以快速生产新型流感疫苗的系统。这样的一种方法是基于细胞培养的方法,该方法可以容易地被放大化。但现有流感病毒疫苗的纯化无法满足该要求。最近,还描述了包括深层过滤、灭活、超滤和凝胶过滤的可放大的流感病毒纯化方法(Nayak DP等人,J.Chromatogr.B Analyt Technol Biomed Life Sci,823(2):75-81,2005)。由于病毒被灭活,该方法用于纯化感染性流感病毒的适用性仍然未知。
在US 3,989,818中描述了使用5%的聚乙二醇用于流感病毒沉淀,其中它强调由于粘度增加,较高的PEG浓度是不利的,使得分离阶段难以进行。
如上可知,已经发展出了各种不同的用于纯化病毒的方法,但是,对在不污染宿主细胞蛋白和宿主细胞DNA的情况下得到增加量的病毒的高效且经济的病毒纯化方法,仍然存在高的且未满足的需求。因此,仍然需要提供生产和纯化具有足够纯度水平的病毒的方法,以满足大规模的操作要求和高产率。
技术实现要素:
所述问题通过本发明的实施方案解决。
根据本发明的实施方案,提供了去除宿主细胞污染物的方法,具体地宿主细胞蛋白和核酸是最相关的污染物。DNA污染以及其他杂质是一巨大的挑战,其必须在来自任何连续细胞系的病毒疫苗大规模生产之前解决,这是针对高度破坏性传染病的全球疫苗接种所必需的。因此,本发明有助于解决来自连续细胞系的活疫苗和/或病毒载体生产领域的重大挑战。
本发明的方法适用于许多种病毒。
本发明的方法构思了包膜和非包膜病毒的纯化,该病毒通过从细胞膜出芽和/或通过裂解细胞(通过破坏细胞)留下感染细胞,特别是RNA病毒,例如但不限于正粘病毒,如流感病毒、副粘病毒,如麻疹病毒、披膜病毒、如风疹病毒、弹状病毒,如水疱性口炎病毒或狂犬病毒、沙粒病毒例如淋巴细胞脉络丛脑膜炎病毒、痘病毒、逆转录病毒、呼肠孤病毒,如轮状病毒、冠状病毒,如SARS冠状病毒、黄病毒科,如日本脑炎病毒、黄热病病毒,或登革热病毒、小核糖核酸病毒,如脊髓灰质炎病毒。
本发明的方法还构思了包膜和非包膜病毒的纯化,该病毒通过从细胞膜出芽和/或通过裂解细胞(通过破坏细胞)留下感染细胞,特别是RNA病毒,例如但不限于嗜肝DNA病毒,例如乙型肝炎病毒和细小病毒。
根据本发明的一实施方案,所述方法特别适用于纯化裂解病毒和从细胞膜出芽的病毒。
根据一优选的实施方案,所述方法用于流感病毒纯化。
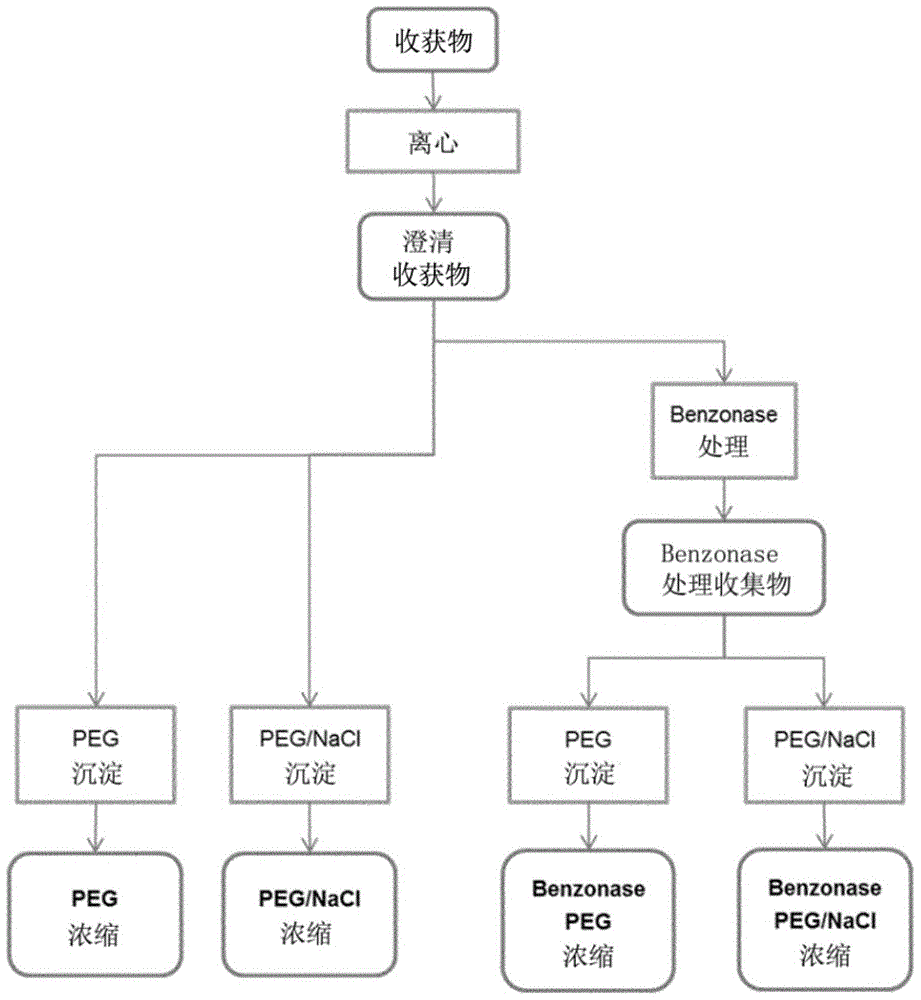
本发明提供了从感染了病毒的宿主细胞中纯化病毒颗粒的方法,包括以下顺序步骤:
a)提供感染了病毒的宿主细胞,其中所述细胞将病毒释放到细胞培养基中,
b)离心含有所述细胞的细胞培养基,
c)将包含病毒颗粒的上清液与含有细胞碎片和细胞的沉淀物分离,
d)用核酸酶孵育所述上清液,
e)用聚乙二醇(PEG)沉淀病毒颗粒,
f)离心病毒颗粒,
g)重悬沉淀的病毒颗粒。
在本发明的一具体实施方案中,宿主细胞是病毒可渗透的。
根据本发明的一实施方案,提供了从感染了病毒的宿主细胞中纯化病毒颗粒的方法,包括以所示顺序的步骤:
a)在将病毒颗粒释放到细胞培养基中的条件下培养所述宿主细胞,
b)通过离心从细胞碎片和细胞中分离出包含病毒颗粒的上清液,
c)用核酸酶孵育所述上清液,
d)用聚乙二醇(PEG)沉淀病毒颗粒,
e)离心病毒颗粒,
f)重悬沉淀的病毒颗粒。
根据本发明的另一实施方案,核酸酶是内切核酸酶,具体地是
在一个实施方案中,通过本发明的方法纯化和产生的病毒是RNA病毒,具体地属于正粘病毒家族,特别是流感病毒,更特别地是甲型、乙型或丙型流感病毒,更具体地是人流感病毒或禽流感病毒。
在一具体实施方案中,将宿主细胞应用于如本发明所描述的纯化方法而不进行先前的裂解处理。
根据进一步的实施方案,以速度1,500g至15,000g,具体地2,000至10,000g进行离心。根据实施方案,以速度至少2,000g,具体地至少3,000g,具体地至少4,000g进行离心,具体地以约4,100g进行离心。
在本发明的具体实施方案中,在沉淀步骤中使用至少7.5%,具体地大于7.5%,具体地至少8%的PEG(w/v)。
在一可替代的实施方案中,在沉淀步骤中至使用少5%(w/v)的PEG。
在本发明的具体实施方案中,针对病毒沉淀使用高达30%(w/v)PEG,具体地高达20%PEG(w/v),具体地在7.5%和15%PEG(w/v)之间,具体地在7.5%和10%PEG(w/v)之间。
根据本发明的另一方面,用8%、8.5%、9%、9.5%、10%、10.5%、11%、11.5%、12%、12.5%、13%、13.5%、14%、14.5%、15%、15.5%、16%、16.5%、17%、17.5%、18%、18.5%、19%、19.5%、20%、20.5%、21%、21.5%、22%、22.5%、23%、23.5%、24%、24.5%、26%、26.5%、27%、27.5%、28%、28.5%、29%、29.5%、30%w/v PEG进行病毒沉淀。
在本发明的实施方案中,PEG的平均分子量为约5,000(PEG5000)克/摩尔至约100,000(PEG100000)克/摩尔,具体地为约5,000(PEG5000)g/M至约5,000(PEG50000)g/M,具体地为约5,000(PEG5000)g/M至约10,000(PEG10000)g/M,具体地PEG具有约6,000(PEG 6000)g/M的平均分子量。
在本发明的实施方案中,病毒沉淀不含氯化钠。
在一可替代的实施方案中,在氯化钠存在的情况下用PEG沉淀病毒。
在进一步的实施方案中,在如本文所描述的纯化方法期间,病毒感染的宿主细胞和病毒没有被冻融。
利用本发明的方法,可以去除至少50%,具体地至少60%,具体地至少70%,具体地至少80%,具体地至少85%,具体地至少90%,具体地至少95%,更具体地至少99%的宿主细胞蛋白质。
利用本发明的方法,可以去除至少50%,具体地至少60%,具体地至少70%,具体地至少80%,具体地至少85%,具体地至少90%,具体地至少95%,更具体地至少99%的宿主细胞DNA。
根据具体的实施方案,将重悬的病毒无菌过滤。
根据进一步的实施方案,宿主细胞是哺乳动物细胞,具体地是Vero细胞、HEK-293和禽细胞。
根据进一步的实施方案,提供了包含通过本发明的方法获得的病毒颗粒,任选地进一步与赋形剂或佐剂一起的疫苗。
在进一步的实施方案中,使用通过本发明的方法获得的病毒颗粒提供了治疗或预防性治疗,具体地疫苗接种。
附图说明
图1:纯化方案的示意图
图2:使用PEG、PEG/NaCl、Benzonase+PEG,Benzonase+NaCl回收甲型流感delNS 106-P2A-GFP的比较
图3:使用PEG、Benzonase+PEG回收乙型流感delNS 106-P2A-GFP的比较
图4:使用Benzonase+PEG回收甲型流感病毒delNS106-P2A-E6E7
具体实施方式
具体实施方案中列举出了本发明的元素,但是,应该理解,它们可以以任何方式和以任何数量组合得到另外的实施方案。实施方案和优选实施方案不应该被构建为将本发明仅限于明确描述的具体实施方案。该描述应该是支持和包含将明确描述的实施例方案与任何数量已公开和/或优选元素组合的实施方案例。此外,除非上下文另有说明,否则本申请中所有描述的元素的任何排列和组合应该被认为是通过由本申请的说明书所公开的。
在整个说明书和随后的权利要求书中,除非上下文另有要求,否则词语“包括(comprise)”和诸如“包括(comprises)”和“包含(comprising)”的变体将被理解成暗示包括所述整数或步骤或整数组或步骤但不排除任何其他整数或步骤或整数组或步骤组。“组成”被认为是最接近的定义,而没有组成定义特征的其他元素。因此,“包含”更宽泛并包括“组成”的定义。
在本说明书和所附权利要求书中所使用的单数形式“一(a)”、“一(an)”和“所述(the)”包括复数指示物,除非内容另有明确说明。
本发明所用的术语“约”是指与给定值相同的值或相差+/-10%,具体地+/-5%的值。
根据具体实施方案,在宿主细胞仍保留大部分完整性的时间点收获宿主细胞,即当仅发生很少或不发生宿主细胞裂解时,进行离心以获得含有病毒的上清液。宿主细胞的裂解可以在繁殖期间自然发生,例如,由于病毒出芽期间的裂解或由于衰老和/或细胞凋亡。因此,还可以防止污染物和病毒包膜之间的复合物形成。
其中使用的术语“病毒可渗透的宿主细胞”是指宿主细胞至少在一定程度上将病毒从细胞质释放到细胞培养基中而不裂解宿主细胞。
如本文所用的,术语“可渗透的”是指宿主细胞的细胞质膜关于病毒颗粒释放的可渗透性。因此,病毒后代可以穿过细胞质膜和细胞包膜到达周围培养基而不需要使用辅助病毒、冻融或超声处理。
本文中所用的术语“孵育”或“接触”是指使含有病毒的溶液或被宿主细胞成分污染的培养基与赋形剂接触,例如但不限于核酸酶、DNA酶、蛋白酶、天然存在的或合成的酶,持续充足的时间直到达到预期效果,例如宿主细胞化合物如核酸、肽、多肽等的裂解或降解。
本文中使用的离心条件是标准条件。在适当的条件下,本领域技术人员能在的能力范围内确定合适的条件,例如离心力、操作时间、流速速度或条带时间(banding time)。所述条件应根据待纯化的含病毒的液体的类型、病毒的类型、污染杂质的类型、离心模式,是分批还是连续,分离的类型,是区带还是等密度来确定。特别地,本领域技术人员可以以制造商的说明书中提供的关于如何使用转子和离心机的信息作为指导来选择合适的离心条件。如前所述,本领域技术人员可以使用蛋白质检测的任何标准技术,例如使用病毒抗原特异性抗体进行Western印迹分析,或在流感病毒的特定情况下,利用SRID测定以检测病毒的存在和/或利用本发明预形成的线性密度梯度离心后监测是否得到可接受的病毒产量和/或病毒纯度。
通过离心例如施用低速离心可以除去细胞和细胞污染物如细胞碎片和大膜囊泡。
离心可以以连续模式、半连续模式或连续批次进行。在一个实施方案中,根据本发明纯化病毒的方法期间进行的离心是连续模式。当需要处理和纯化大量含病毒的流体时,连续模式的离心有利于大规模使用。
适当的离心力可以由本领域技术人员选择,并且可以取决于所使用的转子和离心机的类型。作为非限制性实例,在离心机中施加至少1,000g至15,000g,合适地1,500g至10,000g,合适地1,500g至5,000g,合适地2,000g至4,500g,合适地4,000g至4,500g,具体地约4,100g的离心力到转子上。本领域技术人员可以容易地确定离心时间,例如,通过测量离心收集的病毒量。离心时间可以为至少5分钟至60分钟,合适地为10分钟至40分钟,合适地为15分钟至30分钟,具体地约为15分钟。
当处理完所有含病毒的上清液或病毒颗粒,留下足够的操作时间,停止离心并收集病毒。
根据本发明的方法,待纯化的病毒可以在细胞培养物上产生。本发明的方法适用于任何类型的合适的宿主细胞,无论是在微载体上生长的贴壁细胞还是悬浮细胞。
宿主细胞可以以各种方式生长,例如,使用分批、补料分批或连续系统,例如灌注系统。当需要高细胞密度时,灌注是特别有利的。高细胞密度可以特别有利于从给定细胞类型中实现病毒产量最大化。
根据本发明的方法待纯化的用于生产含病毒流体的细胞原则上可以是任何所需类型的动物细胞,该动物细胞可以在细胞培养物中培养并且可以支持病毒复制。它们可以是原代细胞或连续细胞系。优选遗传稳定的细胞系。特别合适的是哺乳动物细胞,例如人、仓鼠、牛、猴或狗细胞。或者,昆虫细胞也是合适的,例如SF9细胞或Hi-5细胞。
在本发明的范围内,术语“细胞”或“宿主细胞”是指培养个体细胞、组织、器官、昆虫细胞、禽类细胞、哺乳动物细胞、杂交瘤细胞、原代细胞、连续细胞系和/或遗传工程细胞,例如表达病毒的重组细胞。这些可以是例如BSC-1细胞、LLC-MK细胞、CV-1细胞、CHO细胞、COS细胞、鼠细胞、人细胞、HeLa细胞、293细胞、Vero细胞、MDBK细胞、MDCK细胞、MDOK细胞、CRFK细胞、RAF细胞、TCMK细胞、LLC-PK细胞、PK15细胞、Wl-38细胞、MRC-5细胞、T-FLY细胞、BHK细胞、SP2/0细胞、NS0、PerC6(人视网膜细胞)、鸡胚细胞或衍生物、含胚卵细胞、含胚鸡蛋或其衍生物。优选地,细胞系是Vero细胞系。
许多本领域已知的哺乳动物细胞系包括Vero细胞(锚定依赖或悬浮生长)、PER.C6、HEK细胞、人胚肾细胞(293细胞)、HeLa细胞、CHO细胞、禽类细胞(连续或原代)和MDCK细胞,对于本发明的方法其是优选的。
合适的猴细胞是例如非洲绿猴细胞,例如Vero细胞系中的肾细胞。合适的犬细胞是例如MDCK细胞系中的肾细胞。
用于生长流感病毒的合适的哺乳动物细胞系也包括PER.C6细胞。这些细胞系均来源广泛,例如,来自美国典型细胞培养物(ATCC)保藏中心。或者,用于本发明的细胞系可以源自禽类来源,例如鸡、鸭、鹅、鹌鹑或野鸡。禽类细胞系可以源自多种发育阶段,该阶段包括胚胎、雏鸡和成年。特别地,细胞系可以源自胚胎细胞,例如胚胎成纤维细胞成纤维细胞、生殖细胞或个体器官,包括神经元、脑、视网膜、肾、肝、心脏、肌肉或胚外组织和保护胚胎的膜。可以使用鸡胚成纤维细胞(CEF)和连续禽类细胞系。
根据具体实施方案,当在细胞培养物上产生待纯化的病毒时,本发明的方法使用Vero细胞。
根据具体实施方案,被病毒侵染的宿主细胞的培养的停止时间点为至少20%,具体地至少30%,具体地至少40%,具体地至少50%,具体地至少60%,具体地至少70%,具体地至少80%,具体地至少90%,具体地至少95%的宿主细胞是完整的,并且宿主细胞没有由于病毒复制和病毒释放而遭到破坏。
用于细胞活力测试和定量方法的方法是本领域熟知的,并且可以由本领域技术人员选择和执行而没有过度的负担。作为示例,但不限于此,可以使用台盼蓝染料排除细胞定量和活力测定,荧光测定或同时染色程序(Altman S.A.等人,1993,Biotechnol.Prog.,9,671-674)。
可以通过台盼蓝排除测定具体地进行完整细胞百分比的定量测定。对于静态培养物和生物反应器,可以相对于平行生长的未感染培养物中的完整细胞数来确定病毒收获时完整细胞(即未被台盼蓝染色的细胞)的百分比(即,感染培养物中的完整细胞数除以平行培养物中未感染的完整细胞数)。或者,在生物反应器中,病毒收获时完整细胞的百分比可以由相对于在相同生物反应器中细胞生长期中测量的最大细胞数来确定。
具体地,离心宿主细胞用于病毒颗粒分离而无需任何先前的裂解处理,例如,宿主细胞不用酶、核酸酶、蛋白酶处理,并且不进行冻融,即在低于-20℃的温度下冷冻以及在高于4℃的温度下解冻,或进行超声波处理。
使用适当的moi(感染的复数),具体地在0.0001至0.1的范围内,使用本领域已知的任何方法用病毒感染宿主细胞。
术语“沉淀”是指从上清液中沉淀病毒颗粒。具体地,向病毒上清液中添加聚乙二醇进行沉淀。本领域技术人员可以测试和确定用于沉淀病毒的合适时间和温度。作为示例,但不限于此,将病毒悬浮液与PEG一起孵育1至48小时,具体地5至36小时,具体地10至26小时,具体地约24小时。
本发明方法中所用的聚乙二醇(PEG)的分子量是3,000至100,000g/M,具体地4,000至18,000,5,000至15,000,具体地分子量约为6000g/M。
本发明的方法所用的PEG的浓度>5%,具体地5至20%,具体地6至10%,具体地约为8%。
根据本文所述方法纯化的病毒颗粒可以悬浮在合适的溶液中,具体地缓冲液,例如但不限于,病毒重建缓冲液,例如,磷酸盐、Tris.HCl或基于Hepes的缓冲液,该缓冲液含有例如NaCl、蔗糖、氨基酸、蛋白质水解产物或白蛋白或前述物质的任何组合。
在纯化结束时,根据本发明的方法获得的病毒制剂可以直接用来配制病毒组合物。作为替代方案,可以将病毒颗粒进行无菌过滤,在药物级材料的工艺中是常见的,例如免疫原性组合物或疫苗,是本领域技术人员已知的。例如,这种无菌过滤可以将制剂通过0.22μm过滤器过滤来合适地进行。无菌制备后,如果需要,病毒或病毒抗原可以用于临床。
根据本发明所述方法纯化的病毒可以合适地配制在免疫原性组合物中,例如疫苗。因此,本发明还构思了制备疫苗(例如流感病毒疫苗)的方法,根据本发明的方法在疫苗中用作抗原的病毒至少包括纯化的步骤,并将所述纯化的病毒配制成疫苗。
免疫原性组合物,特别是疫苗,通常可以包括完整的病毒,例如减毒活全病毒、重新确认的病毒(reasserted virus)或灭活的全病毒。
根据本发明方法适于纯化的所有病毒都应包括在本发明中。病毒可以是包膜病毒,具体地它们是RNA病毒。
病毒粒子通常非特异性地与细胞组分结合。这种相互作用的感染性病毒的可接触表面可以由纯蛋白质组成,例如腺病毒和小核糖核酸病毒,或基于脂质膜的,例如甲病毒,狂犬病和痘苗病毒,流感病毒。后者被称为包膜病毒,这组病毒的纯化是特别困难的,因为病毒包膜可能含有高度复杂且可移动的不同分子的集合,其范围从糖蛋白中的磺基团到鞘脂中的脂肪醇,每个或组合存在静电作用、范德华力或疏水作用表面,可以作为来自培养基本身、生产细胞、或其他病毒颗粒的各种结合配偶体。
根据本发明适用于纯化的RNA病毒可以是正粘病毒、黄病毒、披膜病毒、冠状病毒、肝炎病毒、副粘病毒、弹状病毒、布尼病毒、丝状病毒。
具体地病毒是裂解病毒。
术语“裂解病毒”是指使在其复制周期过程中,即在复制过程中破坏(裂解)宿主细胞的病毒。
根据具体实施方案,根据本文中描述的方法流感病毒在宿主细胞中培养并纯化。
流感病毒可选自人流感病毒、禽流感病毒、马流感病毒、猪流感病毒、猫流感病毒。更特别地,流感病毒选自菌株A、B和C,优选自菌株A和B。流感抗原可以选自大流行期间的(年度或季节性)流感毒株。或者,流感抗原可以选自可能引起大流行爆发的菌株;即,与目前流行菌株中的血凝素相比具有新血凝素的流感毒株,或在禽类受试者中具有致病性并且有可能在人群中水平传播的流感毒株或对人类有致病性的流感毒株。根据特定季节和疫苗中包含抗原的性质,流感抗原可以来源于以下一种或多种血凝素亚型:H1、H2、H3、H4、H5、H6、H7、H8、H9、H10、H11、H12、H13、H14、H15或H16。优选地,流感病毒或其抗原选自亚型H1、H2、H3、H5、H7或H9。在一个实施方案中,流感病毒源自亚型H2、H5、H6、H7或H9。在可替代的实施方案中,流感病毒源自亚型H1、H3或B。
根据一具体实施方案,流感病毒是减毒流感病毒。具体地,流感病毒包含抑制宿主细胞先天免疫应答的致病因子内的缺失或修饰。衰减可以示例性地选自抗冷病毒株或由于NS1基因(ΔNS1病毒)内的缺失或修饰,如WO99/64571和WO99/64068中所描述的,通过引用将其整体并入本文。
具体地,流感病毒载体包含截短的NS1蛋白,该蛋白含有NS1蛋白的N-末端的最多122个氨基酸,优选最多121个氨基酸,优选最多120个氨基酸,优选最多119个氨基酸,优选最多118个氨基酸,优选最多117个氨基酸,优选最多116个氨基酸,优选最多115个氨基酸,优选最多114个氨基酸,优选最多113个氨基酸,优选最多112个氨基酸,优选最多111个氨基酸,优选最多110个氨基酸氨基酸,优选最多109个氨基酸,优选最多108个氨基酸,优选最多107个氨基酸,优选最多106个氨基酸,优选最多105个氨基酸,优选最多104个氨基酸,优选最多103个氨基酸酸,优选最多102个氨基酸,优选最多101个氨基酸,优选最多100个氨基酸,优选最多99个氨基酸,优选最多98个氨基酸,优选最多97个氨基酸,优选最多96个氨基酸,优先最多95个氨基酸,优选最多94个氨基酸,优选最多93个氨基酸,优选最多92个氨基酸,优选最多91个氨基酸,优选最多90个氨基酸,优选最多89个氨基酸,优选多达88个氨基酸,优选最多87个氨基酸,优选最多86个氨基酸,优选最多85个氨基酸,优选最多84个氨基酸,优选最多83个氨基酸,优选最多82个氨基酸,优选最多81个氨基酸,优选最多80个氨基酸,优选最多79个氨基酸,优选最多78个氨基酸,优选最多77个氨基酸,优选最多76个氨基酸,优选最多75个氨基酸,优选最多74个氨基酸,优选最多73个氨基酸。
已经证明,NS1蛋白的缺失或蛋白质的功能性敲除会导致流感病毒的显著减弱,这是由于在干扰素感受态细胞或生物中缺乏复制(复制缺陷型表型)。缺乏NS1蛋白的病毒不能拮抗受感染细胞的细胞因子产生,因此诱导自身辅助和免疫调节作用。用DelNS1病毒免疫后免疫应答的标志是引发Th1型免疫应答,伴随IgG2A抗体同类型响应(B.Ferko等人,2002)。
“修饰”是指与野生型NS1序列相比,有一个或多个核酸的取代或缺失。NS基因内的修饰可导致病毒颗粒在干扰素感受态细胞中的生长缺陷。生长缺陷意味着这些病毒是有复制缺陷的,因为它们在动物呼吸道中是无法成功复制的。或者,病毒可包含PB1-F2基因的缺失或修饰。
根据本发明的方法可以具体用于产生包含NS1蛋白功能性缺失的流感病毒。
术语“NS1蛋白功能性”是指拮抗细胞中宿主免疫应答的能力,特别是限制干扰素(IFN)的产生和IFN诱导蛋白的抗病毒作用,如dsRNA依赖性蛋白激酶R(PKR)和2'5'-寡腺苷酸合成酶(OAS)/RNase L。功能性NS1蛋白质使病毒具有在干扰素感受态细胞中生长的能力并且拮抗在所述细胞中细胞因子的产生。
在具体实施方案中,本发明的方法用于流感病毒纯化,其中所述流感病毒另外表达异源多肽,其可以是但不限于肿瘤相关抗原,例如WT1、MUC1、LMP2、HPV E6和E7、EGFRvIII、MART1、MAGE A3、NY ESO1、gp100和细胞因子如IFN、IL2、IL15、GM-CSF、IL-15、MIP 1α和MIP3 α或其衍生物或片段。
为了保证异源多肽的充分切割,将增殖序列另外插入异源多肽的C-末端或N-末端区域,例如但不限于另外插入泛素或小核糖核酸病毒2A蛋白。
根据本发明的纯化方法特别适用于制备流感病毒免疫原性组合物,包括疫苗。目前可获得各种形式的流感病毒。它们通常基于活病毒或灭活病毒。灭活疫苗可以基于完整病毒粒子、裂解病毒粒子或纯化的表面抗原(包括HA)。流感抗原也可以以病毒体的形式存在(无核酸的病毒样脂质体颗粒)。
用于疫苗的流感病毒株随着季节的变化而变化。三价疫苗是典型的,但是在本发明中也考虑了更高的化合价,例如四价。本发明可以使用来自大流行毒株的HA(即疫苗接种者和一般人群免疫接种的菌株),并且用于大流行毒株的流感疫苗可以是单价的或可以基于由大流行毒株补充的正常三价疫苗。
本发明的组合物可包括来自一种或多种流感病毒株的抗原,包括甲型流感病毒和/或乙型流感病毒。特别地,本发明考虑了包含抗原三价疫苗,该抗原选自两种甲型流感病毒株和一种乙型流感病毒株。或者,包含选自两种甲型流感病毒株和两种乙型流感病毒株的抗原的四价疫苗也在本发明的保护范围内。
本发明的组合物不限于单价组合物,即仅包括一种菌株类型,即仅季节性菌株或仅大流行毒株。本发明还包括含有季节性菌株和/或大流行毒株组合的多价组合物。
一旦纯化了特定菌株的流感病毒,就可以将其与来自其他菌株的病毒和/或本领域已知的佐剂相组合。
根据本发明,任何核酸酶或内切核酸酶均可用于孵育病毒颗粒上清液。例如,CyanaseTM或是众所周知的可应用的工业核酸酶。CyanaseTM是一种克隆的高活性不基于沙雷氏菌的非特异性内切核酸酶,其降解单链和双链DNA和RNA。如本文所用的或超核酸酶是核酸酶,具体地来自粘质沙雷氏菌的内切核酸酶。所述蛋白质是30kDa亚基的二聚体,具有两个必需的二硫键。该核酸内切酶攻击并降解所有形式的DNA和RNA(单链、双链,线性和环状),并且在广泛的操作条件下仍然有效。酶活的最佳pH为8.0-9.2。它将核酸完全消化为长度为3至5个碱基的5'-单磷酸终止的寡核苷酸。
单位定义如下:一个单位将超声处理的鲑鱼精子DNA消化成酸性可溶性寡核苷酸,等同于pH值8.0、37℃下30分钟内为1.0的ΔA260(反应体积2.625ml)。
本文所用的核酸酶可以以浓度10至50U/ml,具体地15至40U/ml,具体地约20U/ml加入到含有宿主细胞上清液的病毒中。
通过本文所述方法获得的病毒颗粒可用来制备用于治疗个体的组合物,具体地用于预防性治疗的组合物,例如用于接种疫苗。
术语“治疗”涉及改善健康状态,减少或抑制不希望的体重减轻和/或延长和/或增加个体寿命的任何治疗。所述治疗可以消除个体中的疾病,阻止或减缓个体疾病的恶化,抑制或减缓个体疾病的恶化,降低个体症状的频率或严重性,和/或减少在目前患有或曾患有疾病的个体中复发。
术语“预防性治疗”或“防预性治疗”可以互换使用,并且涉及旨在预防个体中发生疾病的任何治疗。
如本发明所用,“预防(preventing)”或“预防(prevention)”疾病,紊乱或病症是指相对于未治疗的对照受试者,治疗的受试者中紊乱或病症的发生减少,或相对于未治疗的对照受试者的紊乱或病症的一种或多种症状延迟发作或降低其严重性。术语“保护”、“防止”、“防预”、“预防性”或“保护性”涉及防止和/或治疗疾病的发生和/或传播。
本发明通过以下实施例进一步得以阐明,但不限于此。
实施例
核酸酶处理和PEG沉淀的组合得到具有低DNA和蛋白质(宿主细胞蛋白质)杂质的高病毒产率。本发明提供了一步纯化的方法,该方法具有高产率、高效力和低DNA水平,符合法规要求。
实验数据
实施例1
甲型流感delNS106-P2A-GFP病毒在接种于组织培养瓶中的Vero细胞中生长。在4.100g,22℃下离心15分钟,收获澄清的病毒。
任选地用Benzonase(20U/ml,在室温下2小时)处理澄清的收获物。在4℃下用8%PEG(w/v)孵育24小时,然后在4.100g,4℃下离心30分钟进行病毒沉淀,可选地含有100mM NaCl。最后,将沉淀的病毒重悬于初始收获体积的1/10的病毒重建缓冲液(VRB;磷酸盐pH 7.5,蔗糖,精氨酸)中,得到10倍浓缩物。
分析
通过TCID50测定法在Vero细胞中测定感染滴度。使用Biorad Bradford测定法进行总蛋白质定量。对于每个矩阵(OptiPro和VRB),平行运行8点标准曲线。使用Picogreen测定法一式三份地进行DNA定量。对于每个矩阵(OptiPro和VRB),平行运行8点标准曲线。
表1
表2
图2显示了使用PEG,PEG/NaCl、Benzonase+PEG、Benzonase+NaCl的回收率的比较。
实施例2
乙型流感delNS106-P2A-GFP病毒在接种于组织培养瓶中的Vero细胞中生长。在4.100g,22℃下离心15分钟,收获澄清病毒。
任选地用Benzonase(20U/ml,在室温下2小时)处理澄清的收获物。在4℃下用8%PEG(w/v)孵育24小时,然后在4.100g,4℃下离心30分钟进行病毒沉淀。每次沉淀(+/-Benzonase处理)一式两份进行。
最后,将沉淀的病毒以初始收获体积的1/10重悬于病毒重建缓冲液(VRB)中,得到10倍浓缩物。
分析
通过TCID50测定法在Vero细胞中测定感染滴度。使用Biorad Bradford测定法进行总蛋白质定量。对于每个矩阵(OptiPro和VRB),平行运行8点标准曲线。使用Picogreen测定法一式三份地进行DNA定量。对于每个矩阵(OptiPro和VRB),平行运行8点标准曲线。
表3
表4
图3显示使用PEG,Benzonase+PEG回收乙型流感delNS-106A-P2A-GFP的比较
实施例3
甲型流感delNS106-P2A-E6E7病毒在接种于组织培养瓶中的Vero细胞中生长。在4.100g,22℃下离心15分钟,收获澄清病毒。
用Benzonase(20U/ml,在室温下2小时)处理澄清的收获物。在4℃下用8%PEG(w/v)孵育24小时,然后在4.100g,4℃下离心30分钟进行病毒沉淀。PEG沉淀一式两份进行。
最后,将沉淀的病毒以初始收获体积的1/10重悬于病毒重建缓冲液(VRB)中,得到10倍浓缩物。
分析
通过TCID50测定法在Vero细胞中测定感染滴度。使用Biorad Bradford测定法一式三份地进行总蛋白质定量。对于每个矩阵(OptiPro和VRB),平行运行8点标准曲线。使用Picogreen测定法进行DNA定量,一式三份进行。对于每个矩阵(OptiPro和VRB),平行运行8点标准曲线。
表5
表6
图4显示使用Benzonase+PEG回收甲型流感delNS106-P2A-E6E7。
- 还没有人留言评论。精彩留言会获得点赞!