增强的hAT家族转座子介导的基因转移及相关组合物、系统和方法与流程
交叉引用
本申请要求2016年12月16日提交的第62/435,522号美国临时申请的权益,该美国临时申请通过引用整体并入本文。
背景技术:
可转座遗传元件,也称为转座子,是可以在单细胞内从一个基因组位置移动到另一个基因组位置的dna区段。转座子根据其转座机制可以被分为两大类:(1)对于被称为反转录转座子的元件,可以通过rna中间体的反转录而发生转座,以及(2)对于dna转座子,可以通过侧翼为末端反向重复序列(tir)的dna的直接转座而发生转座。活性转座子编码转座所需的一种或多种蛋白质。天然活性dna转座子携带转座酶基因。
hat家族中的dna转座子广泛存在于植物和动物中。已经鉴定了许多活性hat转座子系统,并且发现它们是功能性的,包括但不限于hermes转座子、ac转座子、hobo转座子和tol2转座子。hat家族由两个家族组成,这两个家族根据其转座酶的一级序列被分类为ac亚家族和buster亚家族。hat家族的成员属于ii类转座因子。ii类可动因子使用切割和粘贴转座机制。hat元件共有相似的转座酶、短末端反向重复序列和基因组靶标的八碱基对复制序列。
技术实现要素:
本公开内容的一个方面提供了一种突变tcbuster转座酶,其包含与全长seqidno:1至少70%相同的氨基酸序列,并且与seqidno:1相比具有增加在中性ph下的净电荷的一个或多个氨基酸置换。在一些实施方案中,与具有氨基酸序列seqidno:1的野生型tcbuster转座酶相比,所述突变tcbuster转座酶具有增加的转座效率。
本公开内容的另一方面提供了一种突变tcbuster转座酶,其包含与全长seqidno:1至少70%相同的氨基酸序列,并且在dna结合和寡聚化域、插入域、zn-bed域或其组合中具有一个或多个氨基酸置换。在一些实施方案中,与具有氨基酸序列seqidno:1的野生型tcbuster转座酶相比,所述突变tcbuster转座酶具有增加的转座效率。
本公开内容的又一方面提供了一种突变tcbuster转座酶,其包含与全长seqidno:1至少70%相同的氨基酸序列,并且具有来自表1的一个或多个氨基酸置换。
在一些实施方案中,与seqidno:1相比,所述突变tcbuster转座酶包含增加在催化域内或邻近处在中性ph下的净电荷的一个或多个氨基酸置换。在一些实施方案中,所述突变tcbuster转座酶与seqidno:1相比包含增加在中性ph下的净电荷的一个或多个氨基酸置换,并且当根据seqidno:1编号时,所述一个或多个氨基酸位于邻近d223、d289或e589处。在一些实施方案中,所述邻近是约80、75、70、60、50、40、30、20、10或5个氨基酸的距离。在一些实施方案中,所述邻近是约70至80个氨基酸的距离。
在一些实施方案中,所述突变tcbuster转座酶的氨基酸序列与全长seqidno:1至少80%、至少90%、至少95%、至少98%或至少99%相同。
在一些实施方案中,所述一个或多个氨基酸置换包括向赖氨酸或精氨酸的置换。在一些实施方案中,所述一个或多个氨基酸置换包括天冬氨酸或谷氨酸向中性氨基酸、赖氨酸或精氨酸的置换。在一些实施方案中,所述突变tcbuster转座酶包含来自表4的一个或多个氨基酸置换。在一些实施方案中,所述突变tcbuster转座酶包含来自表2的一个或多个氨基酸置换。在一些实施方案中,所述突变tcbuster转座酶包含来自表3的一个或多个氨基酸置换。在一些实施方案中,当根据seqidno:1编号时,所述突变tcbuster转座酶包含氨基酸置换v377t、e469k和d189a。在一些实施方案中,当根据seqidno:1编号时,所述突变tcbuster转座酶包含氨基酸置换k573e和e578l。在一些实施方案中,当根据seqidno:1编号时,所述突变tcbuster转座酶包含氨基酸置换1452k。在一些实施方案中,当根据seqidno:1编号时,所述突变tcbuster转座酶包含氨基酸置换a358k。在一些实施方案中,当根据seqidno:1编号时,所述突变tcbuster转座酶包含氨基酸置换v297k。在一些实施方案中,当根据seqidno:1编号时,所述突变tcbuster转座酶包含氨基酸置换n85s。在一些实施方案中,当根据seqidno:1编号时,所述突变tcbuster转座酶包含氨基酸置换i452f、v377t、e469k和d189a。在一些实施方案中,当根据seqidno:1编号时,所述突变tcbuster转座酶包含氨基酸置换a358k、v377t、e469k和d189a。在一些实施方案中,当根据seqidno:1编号时,所述突变tcbuster转座酶包含氨基酸置换v377t、e469k、d189a、k573e和e578l。
在一些实施方案中,所述转座效率通过测定来测量,该测定包括将所述突变tcbuster转座酶和含有报道货物盒(reportercargocassette)的tcbuster转座子引入细胞群体中,并检测该报道货物盒在所述细胞群体的基因组中的转座。
本公开内容的又一方面提供了一种融合转座酶,其包含tcbuster转座酶序列和dna序列特异性结合域。在一些实施方案中,所述tcbuster转座酶序列与全长seqidno:1具有至少70%的同一性。
在一些实施方案中,所述dna序列特异性结合域包含tale域、锌指域、aavrepdna结合域或其任意组合。在一些实施方案中,所述dna序列特异性结合域包含tale域。
在一些实施方案中,所述tcbuster转座酶序列与全长seqidno:1具有至少80%、至少90%、至少95%、至少98%或至少99%的同一性。在一些实施方案中,所述tcbuster转座酶序列与seqidno:1相比包含增加在中性ph下的净电荷的一个或多个氨基酸置换。在一些实施方案中,所述tcbuster转座酶序列在dna结合和寡聚化域、插入域、zn-bed域或其组合中包含一个或多个氨基酸置换。在一些实施方案中,所述tcbuster转座酶序列包含来自表1的一个或多个氨基酸置换。在一些实施方案中,与具有氨基酸序列seqidno:1的野生型tcbuster转座酶相比,所述tcbuster转座酶序列具有增加的转座效率。在一些实施方案中,与seqidno:1相比,所述tcbuster转座酶序列包含增加在催化域内或邻近处在中性ph下的净电荷的一个或多个氨基酸置换。在一些实施方案中,所述tcbuster转座酶序列与seqidno:1相比包含增加在中性ph下的净电荷的一个或多个氨基酸置换,并且当根据seqidno:1编号时,所述一个或多个氨基酸置换位于邻近d223、d289或e589处。在一些实施方案中,所述邻近是约80、75、70、60、50、40、30、20、10或5个氨基酸的距离。在一些实施方案中,所述邻近是约70至80个氨基酸的距离。在一些实施方案中,所述tcbuster转座酶序列包含来自表2的一个或多个氨基酸置换。在一些实施方案中,所述tcbuster转座酶序列包含来自表3的一个或多个氨基酸置换。在一些实施方案中,当根据seqidno:1编号时,所述tcbuster转座酶序列包含氨基酸置换v377t、e469k和d189a。在一些实施方案中,当根据seqidno:1编号时,所述tcbuster转座酶序列包含氨基酸置换k573e和e578l。在一些实施方案中,当根据seqidno:1编号时,所述tcbuster转座酶序列包含氨基酸置换i452k。在一些实施方案中,当根据seqidno:1编号时,所述tcbuster转座酶序列包含氨基酸置换a358k。在一些实施方案中,当根据seqidno:1编号时,所述tcbuster转座酶序列包含氨基酸置换v297k。在一些实施方案中,当根据seqidno:1编号时,所述tcbuster转座酶序列包含氨基酸置换n85s。在一些实施方案中,当根据seqidno:1编号时,所述tcbuster转座酶序列包含氨基酸置换i452f、v377t、e469k和d189a。在一些实施方案中,当根据seqidno:1编号时,所述tcbuster转座酶序列包含氨基酸置换a358k、v377t、e469k和d189a。在一些实施方案中,当根据seqidno:1编号时,所述tcbuster转座酶序列包含氨基酸置换v377t、e469k、d189a、k573e和e578l。在一些实施方案中,所述tcbuster转座酶序列与全长seqidno:1具有100%的同一性。
在融合转座酶的一些实施方案中,所述tcbuster转座酶序列和所述dna序列特异性结合域被连接体隔开。在一些实施方案中,所述连接体包含至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少15个、至少20个或至少50个氨基酸。在一些实施方案中,所述连接体包含seqidno:9。
本公开内容的又一方面提供了编码如本文所述的突变tcbuster转座酶的多核苷酸。
本公开内容的又一方面提供了编码如本文所述的融合转座酶的多核苷酸。
在一些实施方案中,所述多核苷酸包含编码所述突变tcbuster转座酶或所述融合转座酶的dna。在一些实施方案中,所述多核苷酸包含编码所述突变tcbuster转座酶或所述融合转座酶的信使rna(mrna)。在一些实施方案中,所述mrna是化学修饰的。在一些实施方案中,所述多核苷酸包含编码可被所述突变tcbuster转座酶或所述融合转座酶识别的转座子的核酸序列。在一些实施方案中,所述多核苷酸存在于dna载体中。在一些实施方案中,所述dna载体包括小环质粒。
本公开内容的又一方面提供了产生如本文所述的突变tcbuster转座酶或融合转座酶的细胞。本公开内容的又一方面提供了含有如本文所述的多核苷酸的细胞。
本公开内容的又一方面提供了一种方法,其包括:将如本文所述的突变tcbuster转座酶和可被该突变tcbuster转座酶识别的转座子引入细胞中。
本公开内容的又一方面提供了一种方法,其包括:将如本文所述的融合转座酶和可被该融合转座酶识别的转座子引入细胞中。
在方法的一些实施方案中,所述引入包括使所述细胞与编码所述突变tcbuster转座酶或所述融合转座酶的多核苷酸接触。在一些实施方案中,所述多核苷酸包含编码所述突变tcbuster转座酶或所述融合转座酶的dna。在一些实施方案中,所述多核苷酸包含编码所述突变tcbuster转座酶或所述融合转座酶的信使rna(mrna)。在一些实施方案中,所述mrna是化学修饰的。
在方法的一些实施方案中,所述引入包括使所述细胞与含有所述转座子的dna载体接触。在一些实施方案中,所述dna载体包括小环质粒。在一些实施方案中,所述引入包括使所述细胞与含有所述转座子和编码所述突变tcbuster转座酶或所述融合转座酶的多核苷酸的质粒载体接触。在一些实施方案中,所述引入包括使所述细胞与作为纯化蛋白质的所述突变tcbuster转座酶或所述融合转座酶接触。
在方法的一些实施方案中,所述转座子包含位于两个反向重复序列之间的货物盒。在一些实施方案中,所述两个反向重复序列的左反向重复序列包含与seqidno:3具有至少50%、至少60%、至少80%、至少90%、至少95%、至少98%或至少99%同一性的序列。在一些实施方案中,所述两个反向重复序列的左反向重复序列包含seqidno:3。在一些实施方案中,所述两个反向重复序列的右反向重复序列包含与seqidno:4具有至少50%、至少60%、至少80%、至少90%、至少95%、至少98%或至少99%同一性的序列。在一些实施方案中,所述两个反向重复序列的右反向重复序列包含seqidno:4。在一些实施方案中,所述两个反向重复序列的左反向重复序列包含与seqidno:5具有至少50%、至少60%、至少80%、至少90%、至少95%、至少98%或至少99%同一性的序列。在一些实施方案中,所述两个反向重复序列的左反向重复序列包含seqidno:5。在一些实施方案中,所述两个反向重复序列的右反向重复序列包含与seqidno:6具有至少50%、至少60%、至少80%、至少90%、至少95%、至少98%或至少99%同一性的序列。在一些实施方案中,所述两个反向重复序列的右反向重复序列包含seqidno:6。在一些实施方案中,所述载体盒包含选自cmv、efs、mnd、ef1α、cagc、pgk、ubc、u6、h1和cumate的启动子。在一些实施方案中,所述货物盒包含cmv启动子。在一些实施方案中,所述货物盒以正向方向存在。在一些实施方案中,所述货物盒以反向方向存在。在一些实施方案中,所述货物盒包含转基因。在一些实施方案中,所述转基因编码选自细胞受体、免疫检查点蛋白质、细胞因子及其任意组合的蛋白质。在一些实施方案中,所述转基因编码选自t细胞受体(tcr)、b细胞受体(bcr)、嵌合抗原受体(car)或其任意组合的细胞受体。在一些实施方案中,所述引入包括借助于电穿孔、显微注射、磷酸钙沉淀、阳离子聚合物、树状聚体、脂质体、微粒轰击、fugene、直接声波加载、细胞挤压、光学转染、原生质体融合、impalefection、磁转染、核转染或其任意组合转染所述细胞。在一些实施方案中,所述引入包括对所述细胞进行电穿孔。
在方法的一些实施方案中,所述细胞是从受试者分离的原代细胞。在一些实施方案中,所述受试者是人。在一些实施方案中,所述受试者是患有疾病的患者。在一些实施方案中,所述受试者已被诊断为患有癌症或肿瘤。在一些实施方案中,所述细胞从所述受试者的血液中分离。在一些实施方案中,所述细胞包含原代免疫细胞。在一些实施方案中,所述细胞包含原代白细胞。在一些实施方案中,所述细胞包含原代t细胞。在一些实施方案中,所述原代t细胞包含γ6t细胞、辅助t细胞、记忆t细胞、自然杀伤t细胞、效应t细胞或其任意组合。在一些实施方案中,所述原代免疫细胞包含cd3+细胞。在一些实施方案中,所述细胞包含干细胞。在一些实施方案中,所述干细胞选自:胚胎干细胞、造血干细胞、表皮干细胞、上皮干细胞、支气管肺泡干细胞、乳腺干细胞、间充质干细胞、肠干细胞、内皮干细胞、神经干细胞、嗅觉成体干细胞、神经嵴干细胞、睾丸细胞及其任意组合。在一些实施方案中,所述干细胞包含诱导多能干细胞。
本公开内容的又一方面提供了一种治疗方法,其包括:(a)将转座子和识别该转座子的如本文所述的突变tcbuster转座酶或融合转座酶引入细胞中,从而生成遗传修饰的细胞;(b)将所述遗传修饰的细胞施用于需要所述治疗的患者。在一些实施方案中,所述遗传修饰的细胞包含由所述转座子引入的转基因。在一些实施方案中,所述患者已被诊断为患有癌症或肿瘤。在一些实施方案中,所述施用包括将所述遗传修饰的细胞输注到所述患者的血管中。
本公开内容的又一方面提供了一种用于基因组编辑的系统,其包含:如本文所述的突变tcbuster转座酶或融合转座酶,以及可被所述突变tcbuster转座酶或所述融合转座酶识别的转座子。
本公开内容的又一方面提供了用于基因组编辑的系统,其包含:编码如本文所述的突变tcbuster转座酶或融合转座酶的多核苷酸,以及可被所述突变tcbuster转座酶或所述融合转座酶识别的转座子。
在系统的一些实施方案中,所述多核苷酸包含编码所述突变tcbuster转座酶或所述融合转座酶的dna。在一些实施方案中,所述多核苷酸包含编码所述突变tcbuster转座酶或所述融合转座酶的信使rna(mrna)。在一些实施方案中,所述mrna是化学修饰的。在一些实施方案中,所述转座子存在于dna载体中。在一些实施方案中,所述dna载体包括小环质粒。在一些实施方案中,所述多核苷酸和所述转座子存在于同一质粒中。在一些实施方案中,所述转座子包含位于两个反向重复序列之间的货物盒。在一些实施方案中,所述两个反向重复序列的左反向重复序列包含与seqidno:3具有至少50%、至少60%、至少80%、至少90%、至少95%、至少98%或至少99%同一性的序列。在一些实施方案中,所述两个反向重复序列的左反向重复序列包含seqidno:3。在一些实施方案中,所述两个反向重复序列的右反向重复序列包含与seqidno:4具有至少50%、至少60%、至少80%、至少90%、至少95%、至少98%或至少99%同一性的序列。在一些实施方案中,所述两个反向重复序列的右反向重复序列包含seqidno:4。在一些实施方案中,所述两个反向重复序列的左反向重复序列包含与seqidno:5具有至少50%、至少60%、至少80%、至少90%、至少95%、至少98%或至少99%同一性的序列。在一些实施方案中,所述两个反向重复序列的左反向重复序列包含seqidno:5。在一些实施方案中,所述两个反向重复序列的右反向重复序列包含与seqidno:6具有至少50%、至少60%、至少80%、至少90%、至少95%、至少98%或至少99%同一性的序列。在一些实施方案中,所述两个反向重复序列的右反向重复序列包含seqidno:6。在一些实施方案中,所述货物盒包含选自cmv、efs、mnd、ef1α、cagc、pg、ubc、u6、h1和cumate的启动子。在一些实施方案中,所述货物盒包含cmv启动子。在一些实施方案中,所述货物盒包含转基因。在一些实施方案中,所述转基因编码选自细胞受体、免疫检查点蛋白质、细胞因子及其任意组合的蛋白质。在一些实施方案中,所述转基因编码选自t细胞受体(tcr)、b细胞受体(bcr)、嵌合抗原受体(car)或其任意组合的细胞受体。在一些实施方案中,所述货物盒以正向方向存在。在一些实施方案中,所述货物盒以反向方向存在。
援引并入
本说明书中提及的所有出版物、专利和专利申请均通过引用并入本文,其程度如同具体且单独地指出每个单独的出版物、专利或专利申请通过引用而并入。在通过引用并入的术语与本文定义的术语有冲突的情况下,以本说明书为准。
附图说明
本发明的新颖特征在所附的权利要求书中具体阐述。通过参考以下对利用本发明原理的说明性实施方案加以阐述的详细描述以及附图,将会获得对本发明特征和优点的更好的理解,在这些附图中:
图1显示了如根据用野生型(wt)tcbuster转座酶和示例性tcbuster转座子转染的细胞中mcherry阳性细胞的百分比所测量的,数种示例性tcbuster转座子载体构建体的转座效率。
图2显示了示例性tcbusterir/dr序列1和序列2的核苷酸序列比较。
图3a显示了用示例性tcbuster转座子tn-8(含有puro-mcherry盒;在图1中示出)和wttcbuster转座酶或v596a突变转座酶(含有v596a置换)转染后2周,hek-293t细胞的代表性亮视野和荧光图像。在转染后2天,将经转染的细胞接种于含有1μg/ml嘌呤霉素的6孔板中,在转染后2周将其固定并用结晶紫染色,以供集落定量。图3b显示了转染后2周在6孔板中经转染的细胞集落的代表性图片。图3c是显示转染后2周每种转染条件下的集落定量的图。
图4描绘了tcbuster转座酶与ac亚家族中的许多转座酶的氨基酸序列比对,仅显示了氨基酸保守区域。
图5描绘了tcbuster转座酶与buster亚家族中的许多其它转座酶成员的氨基酸序列比对。在蛋白质序列上方示出某些示例性氨基酸置换,在比对顶部显示的百分比是含有预计被置换为tcbuster序列的氨基酸的其它buster亚家族成员的百分比,而在下方显示的百分比是在该位置含有规范tcbuster氨基酸的其它buster亚家族成员的百分比。
图6显示了用来测试tcbuster转座酶突变体的示例性表达载体pcdna-dest40的载体图谱。
图7是如根据采用示例性转座酶突变体用tcbuster转座子tn-8(图1中示出)转染的hek-293t细胞中mcherry阳性细胞的百分比所测量的,对示例性tcbuster转座酶突变体的转座效率进行定量的图。
图8描绘了一种示例性融合转座酶,其含有通过可选的连接体连接的dna序列特异性结合域和tcbuster转座酶序列。
图9是如根据采用含有标签的示例性转座酶用tcbuster转座子tn-8(图1中示出)转染的hek-293t细胞中mcherry阳性细胞的百分比所测量的,对含有不同标签的示例性tcbuster转座酶的转座效率进行定量的图。
图10a是如根据gfp阳性细胞的百分比所测量的,对示例性tcbuster转座系统在人cd3+t细胞中的转座效率进行定量的图。图10b是在转染后2天和7天通过流式细胞术对转染的t细胞的活力进行定量的图。数据是相对于脉冲对照。
图11显示了注释出某些氨基酸的野生型tcbuster转座酶的氨基酸序列(seqidno:1)。
图12显示了含有氨基酸置换d189a/v377t/e469k的突变tcbuster转座酶的氨基酸序列(seqidno:78)。
图13显示了含有氨基酸置换d189a/v377t/e469k/i452k的突变tcbuster转座酶的氨基酸序列(seqidno:79)。
图14显示了含有氨基酸置换d189a/v377t/e469k/n85s的突变tcbuster转座酶的氨基酸序列(seqidno:80)。
图15显示了含有氨基酸置换d189a/v377t/e469k/a358k的突变tcbuster转座酶的氨基酸序列(seqidno:81)。
图16显示了含有氨基酸置换d189a/v377t/e469k/k573e/e578l的突变tcbuster转座酶的氨基酸序列(seqidno:13)。
具体实施方式
概述
dna转座子可以通过非复制性的“切割和粘贴”机制转位。这需要由催化酶即转座酶识别两个末端反向重复序列,该酶可切割其靶标,从而从其供体模板上释放dna转座子。在切下后,该dna转座子随后可以整合到被相同转座酶切割的接受体dna中。在它们的一些天然构型中,dna转座子的侧翼是两个反向重复序列,并且可含有编码催化转座的转座酶的基因。
对于采用dna转座子的基因组编辑应用,需要设计转座子以开发基于两种不同质粒的二元系统,由此转座酶与含有侧翼为反向重复序列的目的基因的转座子dna在物理上分离。将转座子和转座酶质粒共同递送到靶细胞中使得能够通过常规的切割和粘贴机制进行转座。
tcbuster是dna转座子的hat家族的成员。该家族的其它成员包括sleepingbeauty和piggbac。本文讨论了与使用hat家族转座子组分增强向人造血和免疫系统细胞中的基因转移的协同方法有关的各种装置、系统和方法。本公开内容涉及改进的hat转座酶、转座子载体序列、转座酶递送方法和转座子递送方法。在一个实施方式中,本研究鉴定了用于制备高活性hat转座酶的特定通用位点。在另一个实施方案中,描述了用于制备保留基因组空间的最小尺寸的hat转座子载体反向末端重复序列(itr)的方法。在另一个实施方式中,描述了作为化学修饰的体外转录的mrna来递送hat家族转座酶的改进方法。在另一个实施方式中,描述了作为dna的“微型”环来递送hat家族转座子载体的方法,其中几乎所有原核序列都已通过重组方法除去。在另一个实施方式中,描述了使用与hat转座酶融合的转录激活因子样(tal)域来融合dna序列特异性结合域的方法。这些改进可以单独地或组合地产生意外高水平的向所讨论的细胞类型的基因转移,以及转座子载体向目的序列的递送的改善。
突变tcbuster转座酶
本公开内容的一个方面提供了一种突变tcbuster转座酶。与野生型tcbuster转座酶(seqidno:1)相比,突变tcbuster转座酶可包含一个或多个氨基酸置换。
突变tcbuster转座酶可包含与野生型tcbuster转座酶的全长序列(seqidno:1)具有至少70%序列同一性的氨基酸序列。在一些实施方案中,突变tcbuster转座酶可包含与野生型tcbuster转座酶的全长序列(seqidno:1)具有至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少96%、至少97%、至少98%或至少99%序列同一性的氨基酸序列。在一些情况下,突变tcbuster转座酶可包含与野生型tcbuster转座酶的全长序列(seqidno:1)具有至少98%、至少98.5%、至少99%、至少99.1%、至少99.2%、至少99.3%、至少99.4%、至少99.5%、至少99.6%、至少99.7%、至少99.8%、至少99.9%或至少99.95%序列同一性的氨基酸序列。
突变tcbuster转座酶可包含具有至少一个与野生型tcbuster转座酶的全长序列(seqidno:1)不同的氨基酸的氨基酸序列。在一些实施方案中,突变tcbuster转座酶可包含具有至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个或更多个与野生型tcbuster转座酶的全长序列(seqidno:1)不同的氨基酸的氨基酸序列。在一些情况下,突变tcbuster转座酶可包含具有至少5个、至少10个、至少20个、至少30个、至少40个、至少50个、至少60个、至少70个、至少80个、至少90个、至少100个、至少200个或至少300个与野生型tcbuster转座酶的全长序列(seqidno:1)不同的氨基酸的氨基酸序列。在一些情况下,突变tcbuster转座酶可包含具有至多3个、至多6个、至多12个、至多25个、至多35个、至多45个、至多55个、至多65个、至多75个、至多85个、至多95个、至多150个、至多250个或至多350个与野生型tcbuster转座酶的全长序列(seqidno:1)不同的氨基酸的氨基酸序列。
如图4所示,通常,野生型tcbuster转座酶可被视为从n末端到c末端包含znf-bed域(氨基酸76-98)、dna结合和寡聚化域(氨基酸112-213)、第一催化域(氨基酸213-312)、插入域(氨基酸312-543)和第二催化域(氨基酸583-620),以及至少四个在这些注释的结构域之间的域间区域。除非另有说明,否则本文所用的氨基酸的数字参考均根据seqidno:1。突变tcbuster转座酶可以在这些结构域中的任何一个中包含一个或多个氨基酸置换,或其任意组合。在一些情况下,突变tcbuster转座酶可在znf-bed域、dna结合和寡聚化域、第一催化域、插入域或其组合中包含一个或多个氨基酸置换。突变tcbuster转座酶可在两个催化域中的至少一个中包含一个或多个氨基酸置换。
示例性突变tcbuster转座酶可包含来自表1的一个或多个氨基酸置换。有时,突变tcbuster转座酶可包含来自表1的至少一个氨基酸置换。突变tcbuster转座酶可包含至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少20个、至少30个或更多个来自表1的氨基酸置换。
表1
示例性突变tcbuster转座酶包含来自表2的一个或多个氨基酸置换或置换组合。有时,突变tcbuster转座酶可包含来自表2的至少一个氨基酸置换或置换组合。突变tcbuster转座酶可包含至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少20个、至少30个或更多个来自表2的氨基酸置换或置换组合。
表2
示例性突变tcbuster转座酶包含来自表3的一个或多个氨基酸置换或置换组合。有时,突变tcbuster转座酶可包含来自表3的至少一个氨基酸置换或置换组合。突变tcbuster转座酶可包含至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少20个、至少30个或更多个来自表3的氨基酸置换或置换组合。
表3
高活性突变tcbuster转座酶
本公开内容的另一方面提供了一种高活性突变tcbuster转座酶。如本文所用的,“高活性”突变tcbuster转座酶可指与具有氨基酸序列seqidno:1的野生型tcbuster转座酶相比具有增加的转座效率的任何突变tcbuster转座酶。
在一些实施方案中,与具有氨基酸序列seqidno:1的野生型tcbuster转座酶相比,在某些情况下,高活性突变tcbuster转座酶可具有增加的转座效率。例如,当用来催化具有特定类型的反向重复序列的转座子的转座时,高活性突变tcbuster转座酶可具有比野生型tcbuster转座酶更好的转座效率。对于具有其它类型的反向重复序列的一些其它转座子,与野生型tcbuster转座酶相比,高活性突变tcbuster转座酶可能不具有增加的转座效率。在一些其它非限制性实例中,在某些转染条件下,与具有氨基酸序列seqidno:1的野生型tcbuster转座酶相比,高活性突变tcbuster转座酶可具有增加的转座效率。不受限制,与野生型tcbuster转座酶相比,当温度高于正常细胞培养温度时,高活性突变tcbuster转座酶可具有更好的转座效率;高活性突变tcbuster转座酶在相对酸性或碱性水性介质中可具有更好的转座效率;当实施特定类型的转染技术(例如,电穿孔)时,高活性突变tcbuster转座酶可具有更好的转座效率。
转座效率可以根据宿主细胞群体中发生的成功转座事件的百分比来衡量,该百分比用引入该宿主细胞群体中的转座子和转座酶的量进行归一化。在许多情况下,当比较两种或更多种转座酶的转座效率时,针对宿主细胞在相同或相似转染条件下的转染,将相同的转座子构建体与两种或更多种转座酶中的每一种进行配对。可以通过各种方法检查宿主细胞中的转座事件的量。例如,转座子构建体可以被设计成含有位于反向重复序列之间的报道基因,并且该报道基因呈阳性的转染细胞可以被计数为发生成功转座事件的细胞,这可以得出转座事件的量的估计值。另一个非限制性实例包括对宿主细胞基因组进行测序,以检查转座子的盒货物的插入。在一些实施方案中,当比较两种或更多种不同转座子的转座效率时,可以针对宿主细胞在相同或相似转染条件下的转染,将相同的转座酶与每种不同的转座子进行配对。可以使用类似的方法来测量转座效率。也可以实施本领域技术人员已知的其它方法来比较转座效率。
本文还提供了获得高活性突变tcbuster转座酶的方法。
一种示例性方法可包括系统性地突变tcbuster转座酶的氨基酸,以增加氨基酸序列的净电荷。有时,该方法可包括进行系统性丙氨酸扫描,以使在中性ph下带负电荷的天冬氨酸(d)或谷氨酸(e)突变为丙氨酸残基。方法可包括系统性突变为在中性ph下带正电荷的赖氨酸(k)或精氨酸(r)残基。
不希望受特定理论的束缚,氨基酸序列在中性ph下的净电荷的增加可以增加tcbuster转座酶的转座效率。特别是,当在邻近转座酶的催化域处净电荷增加时,预期转座效率会增加。可以预期,带正电荷的氨基酸可以形成与dna靶标的接触点,并允许催化域作用于dna靶标。还可以预期,这些带正电荷的氨基酸的缺失可以降低转座酶中的切除或整合活性。
图11描绘了wttcbuster转座酶氨基酸序列,突出显示了可以是与dna的接触点的氨基酸。在图11中,大号粗体字母表示催化三联体氨基酸;带有框的字母表示当被置换为带正电荷的氨基酸时增加转座的氨基酸;斜体和小写字母表示当被置换为不同的氨基酸时降低转座的带正电荷的氨基酸;粗体斜体且带下划线的字母表示当被置换为带正电荷的氨基酸时增加转座并且当被置换为带负电荷的氨基酸时降低转座的氨基酸;带下划线的字母表示基于与buster亚家族的蛋白质序列比对,可以是带正电荷的氨基酸的氨基酸。
与seqidno:1相比,突变tcbuster转座酶可包含增加在中性ph下的净电荷的一个或多个氨基酸置换。有时,与seqidno:1相比包含增加在中性ph下的净电荷的一个或多个氨基酸置换的突变tcbuster转座酶可以是高活性的。有时,突变tcbuster转座酶可包含向带正电荷的氨基酸,例如但不限于赖氨酸(k)或精氨酸(r)的一个或多个置换。突变tcbuster转座酶可包含用中性氨基酸或带正电荷的氨基酸对带负电荷的氨基酸,例如但不限于天冬氨酸(d)或谷氨酸(e)的一个或多个置换。
一个非限制性实例包括一种突变tcbuster转座酶,其与seqidno:1相比包含增加在催化域内或邻近处在中性ph下的净电荷的一个或多个氨基酸置换。该催化域可以是第一催化域或第二催化域。该催化域还可以包括转座酶的两个催化域。
本公开内容的示例性方法可以包括对经预测与dna紧密邻近或直接接触的氨基酸进行突变。这些氨基酸可以被置换为经确定在hat家族的其它成员(例如,buster和/或ac亚家族的其它成员)中保守的氨基酸。经预测与dna紧密邻近或直接接触的氨基酸可以通过例如参考晶体结构、预测的结构、突变分析、功能分析、与hat家族其它成员的比对或其它任何合适的方法来鉴定。
不希望受特定理论束缚,tcbuster转座酶,像hat转座酶家族的其它成员一样,具有dde基序,该基序可能是催化转座子移动的活性位点。预期d223、d289和e589组成活性位点,该活性位点是酸性残基的三联体。dde基序可以与二价金属离子配位,并且在催化反应中可能是重要的。在一些实施方案中,与seqidno:1相比,突变tcbuster转座酶可包含增加在中性ph下的净电荷的一个或多个氨基酸置换,并且当根据seqidno:1编号时,所述一个或多个氨基酸位于邻近d223、d289或e589处。
在某些实施方案中,本文提供的突变tcbuster转座酶不包含催化三联体即d223、d289或e589的任何破坏。突变tcbuster转座酶可以不包含在d223、d289或e589处的任何氨基酸置换。突变tcbuster转座酶可以包含在d223、d289或e589处的氨基酸置换,但是这样的置换不会破坏由所述催化三联体所贡献的催化活性。
在一些情况下,术语“邻近”可指转座酶的一级结构中线性距离的量度。例如,野生型tcbuster转座酶的一级结构中d223与d289之间的距离是66个氨基酸。在某些实施方案中,邻近可指约70至80个氨基酸的距离。在许多情况下,邻近可指约80、75、70、60、50、40、30、20、10或5个氨基酸的距离。
在一些情况下,术语“邻近”可指转座酶的二级或三级结构中,即当转座酶折叠成其三维构型时,空间关系的量度。蛋白质二级结构可指蛋白质局部区段的三维形式。常见的二级结构元件包括α螺旋、β折叠、β转角和ω环。在蛋白质折叠成其三维三级结构之前,二级结构元件可以形成为中间体。蛋白质三级结构可指蛋白质的三维形状。蛋白质三级结构可在生理或其它条件下表现出动态构型变化。三级结构将具有单个多肽链“骨架”,其具有一个或多个蛋白质二级结构,即蛋白质结构域。氨基酸侧链可以以多种方式相互作用和键合。特定蛋白质中侧链的相互作用和键合决定其三级结构。在许多实施方式中,邻近可指约
中性ph可以是约7的ph值。有时,中性ph值可以是6.9至7.1、6.8至7.2、6.7至7.3、6.6至7.4、6.5至7.5、6.4至7.6、6.3至7.7、6.2至7.8、6.1-7.9、6.0-8.0、5-8或由此衍生的范围内的ph值。
与seqidno:1相比包含增加在中性ph下的净电荷的一个或多个氨基酸置换的非限制性示例性突变tcbuster转座酶包括包含来自表4的氨基酸置换的至少一种组合的tcbuster转座酶。突变tcbuster转座酶可包含至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少20个、至少30个或更多个来自表4的氨基酸置换。
在一些实施方案中,与seqidno:1相比,突变tcbuster转座酶可包含增加在非中性ph下的净电荷的一个或多个氨基酸置换。在一些情况下,在非中性ph下在催化域内或邻近处净电荷增加。在许多情况下,在非中性ph下在d223、d289或e589邻近处净电荷增加。非中性ph可以是低于7、低于6.5、低于6、低于5.5、低于5、低于4.5、低于4、低于3.5、低于3、低于2.5、低于2、低于1.5或低于1的ph值。非中性ph也可以是高于7、高于7.5、高于8、高于8.5、高于9、高于9.5或高于10的ph值。
表4
在一个示例性实施方案中,方法可包括系统性地突变dna结合和寡聚化域中的氨基酸。不希望受特定理论的束缚,dna结合和寡聚化域中的突变可以增加转座酶对dna靶标的结合亲和力并促进其寡聚化活性,因此可以促进转座效率。更具体地,该方法可以包括系统性地逐个突变在dna结合和寡聚化域(例如,氨基酸112至213)内或邻近处的氨基酸。该方法还可以包括突变在dna结合和寡聚化域内或邻近处的超过一个氨基酸。该方法还可以包括突变在dna结合和寡聚化域内或邻近处的一个或多个氨基酸,以及在dna结合和寡聚化域外的一个或多个氨基酸。
在一些实施方案中,所述方法可包括基于tcbuster与其它hat家族转座酶(ac、hermes、hobo、tag2、tam3、hermes、restless和tol2)或与buster亚家族其它成员(例如,aebuster1、aebuster2、aebuster3、btbuster1、btbuster2、cfbuster1和cfbuster2)的多序列比对进行选择性氨基酸残基的合理替换。不受某些理论的束缚,某些氨基酸在其它hat家族转座酶之间,尤其是在活性转座酶之间的保守性,可能表明它们对转座酶的催化活性的重要性。因此,用在其它hat家族之间保守的氨基酸替换野生型tcbuster序列(seqidno:1)中的非保守氨基酸可产生高活性突变tcbuster转座酶。所述方法可包括获得tcbuster以及其它hat家族转座酶的序列;将所述序列相对于在其它hat家族转座酶之间保守的不同对应物进行比对并鉴定tcbuster转座酶中的氨基酸;进行定点诱变以产生携带突变的突变tcbuster转座酶。
基于与buster亚家族的其它成员或hat家族的其它成员的比对,高活性突变tcbuster转座酶可包含一个或多个氨基酸置换。在许多情况下,所述一个或多个氨基酸置换可以是野生型tcbuster序列(seqidno:1)中的非保守氨基酸被保守氨基酸的置换。突变tcbuster转座酶的非限制性实例包括包含来自表5的至少一个氨基酸置换的tcbuster转座酶。突变tcbuster转座酶可包含至少2个、至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少20个、至少30个或更多个来自表5的氨基酸置换。
另一种示例性方法可以包括将酸性氨基酸系统性地突变为碱性氨基酸并鉴定高活性突变转座酶。
在一些情况下,突变tcbuster转座酶可包含氨基酸置换v377t、e469k和d189a。突变tcbuster转座酶可包含氨基酸置换k573e和e578l。突变tcbuster转座酶可包含氨基酸置换i452k。突变tcbuster转座酶可包含氨基酸置换a358k。突变tcbuster转座酶可包含氨基酸置换v297k。突变tcbuster转座酶可包含氨基酸置换n85s。突变tcbuster转座酶可包含氨基酸置换n85s、v377t、e469k和d189a。突变tcbuster转座酶可包含氨基酸置换i452f、v377t、e469k和d189a。突变tcbuster转座酶可包含氨基酸置换a358k、v377t、e469k和d189a。突变tcbuster转座酶可包含氨基酸置换v377t、e469k、d189a、k573e和e578l。
表5
融合转座酶
本发明的另一方面提供一种融合转座酶。该融合转座酶可包含tcbuster转座酶序列和dna序列特异性结合域。
融合转座酶的tcbuster转座酶序列可包含如本文所述的任何突变tcbuster转座酶的氨基酸序列。融合转座酶的tcbuster转座酶序列还可包含具有氨基酸序列seqidno:1的野生型tcbuster转座酶的氨基酸序列。
如本文所述的dna序列特异性结合域可指适合于与dna分子在含有特定序列基序的序列区域(“靶序列”)处结合的蛋白质结构域。例如,示例性dna序列特异性结合域可以选择性地结合序列基序tata,而另一个示例性dna序列特异性结合域可以选择性地结合不同的序列基序atgcntagat(n表示a、t、g和c中的任何一个)。
本文提供的融合转座酶可引导转座子的序列特异性插入。例如,dna序列特异性结合域可以基于结合域的结合特异性引导融合转座酶与靶序列结合。结合或局限于某个序列区域可以在空间上限制融合转座酶与转座子之间的相互作用,从而将被催化的转座限制在邻近靶序列的序列区域。根据dna结合域的大小、三维构型和序列结合亲和力,以及dna结合域与tcbuster转座酶序列之间的空间关系,以及两个结构域之间的连接的灵活性,实际转座位点至靶序列的距离可以变化。融合转座酶构型的适当设计可以将转座引导至期望的靶基因组区域。
用于转座的靶基因组区域可以是任何特定的基因组区域,这取决于应用目的。例如,有时,对于转座而言希望避免转录起始位点,其可能引起细胞某些重要内源基因的表达水平的不期望的或甚至有害的变化。融合转座酶可含有dna序列特异性结合域,后者可将转座靶向至宿主基因组的安全港。安全港的非限制性实例可包括hprt、aavs位点(例如,aavs1、aavs2、etc)、ccr5或rosa26。安全港位点通常可指转基因插入位点,该位点的使用对细胞基因组完整性或细胞健康和功能没有或几乎没有破坏作用。
dna序列特异性结合域可以衍生自具有序列特异性的任何dna结合蛋白质,或者是其变体。在许多情况下,dna序列特异性结合域可包含与天然存在的序列特异性dna结合蛋白质至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或100%相同的氨基酸序列。dna序列特异性结合域可包含与天然存在的序列特异性dna结合蛋白质至少70%相同的氨基酸序列。天然存在的序列特异性dna结合蛋白质的非限制性实例包括但不限于来自各种来源的转录因子、特异性序列核酸酶和病毒复制蛋白质。天然存在的序列特异性dna结合蛋白质也可以是来自各种来源的具有特异性结合能力的其它任何蛋白质。dna结合蛋白质的选择和预测可以通过各种方法进行,包括但不限于使用可在线获得的计算预测数据库,如dp-bind(http://lcg.rit.albany.edu/dp-bind/)或dnabind(http://dnabind.szialab.org/)。
术语“转录因子”可指通过与特定dna序列结合来控制遗传信息从dna到信使dna的转录速率的蛋白质。可以在本文所述的融合转座酶中使用的转录因子可以基于原核转录因子或真核转录因子,只要其在与靶dna分子结合时赋予序列特异性即可。转录因子预测数据库如dbd(http://www.transcriptionfactor.org)可用于为本公开内容的应用选择合适的转录因子。
如本文所用的dna序列特异性结合域可包含来自天然存在的转录因子的一个或多个dna结合域。转录因子的dna结合域的非限制性实例包括属于诸如碱性螺旋-环-螺旋、碱性-亮氨酸拉链(bzip)、二分应答调节物的c末端效应域、ap2/erf/gcc盒、螺旋-转角-螺旋、同源域蛋白质、λ阻遏蛋白样、srf样(血清应答因子)、配对盒、翼状螺旋、锌指、多域cys2his2(c2h2)锌指、zn2/cys6或zn2/cys8核受体锌指等家族的dna结合域。
dna序列特异性结合域可以是与特定dna序列结合的人工工程化氨基酸序列。这类人工设计的氨基酸序列的非限制性实例包括基于框架产生的序列,如转录激活因子样效应核酸酶(tale)dna结合域、锌指核酸酶、腺相关病毒(aav)rep蛋白和其它任何合适的如本文所述的dna结合蛋白质。
天然tale是由黄单胞菌属(xanthomonas)细菌分泌的蛋白质,有助于植物物种的感染。天然tale可通过与特定dna序列结合并激活宿主基因的表达来帮助感染。通常,tale蛋白由中心重复结构域组成,该中心重复结构域决定dna靶向特异性并且可以从头快速合成。tale具有含有重复残基序列的模块化dna结合域(dbd)。在一些tale中,每个重复区域含有34个氨基酸。本文使用的术语“tale域”可指tale的模块化dbd。每个重复区域的第12和第13位的一对残基可以决定核苷酸特异性,并且被称为重复可变二残基(rvd)。最后一个重复区域,被称为半重复,通常被截短为20个氨基酸。组合这些重复区域允许合成序列特异性合成tale。c末端通常含有将tale引导至细胞核的核定位信号(nls),以及调节转录的功能域,如酸性激活域(ad)。内源性nls可以被生物体特异性定位信号替代。例如,来源于猿猴病毒40大t抗原的nls可以在哺乳动物细胞中使用。rvdhd、ng、ni和nn分别针对c、t、a和g/a。rvd的列表及其在某些情况下对核苷酸的结合偏好可见表6。额外的talervd也可用于定制简并tale-dna相互作用。例如,na对dna的所有四种碱基具有高亲和力。另外,n*-其中*是在第13个残基中具有缺失的rvd-可以适应dna的所有碱基,包括甲基化的胞嘧啶。s*也可以具有与任何dna核苷酸结合的能力。
许多在线工具可用于设计tale以靶向特定dna序列,例如tale-nt(https://tale-nt.cac.cornell.edu/)、mojohand(http://www.talendesign.org/)。可商购获得的试剂盒也可以帮助在蛋白质的n末端与c末端之间产生tale重复区域的定制装配体。这些方法可用来装配自定义dbd,然后将其克隆到含有功能域,例如tcbuster转座酶序列的表达载体中。
表6rvd结合偏好
tale可以在实验室中从头合成,例如,通过将goldengate反应中的消化和连接步骤与ii型限制酶组合。或者,tale可以通过许多不同的方法装配,包括但不限于不依赖于连接的克隆(lic)、基于连接的快速可自动化固相高通量(flash)装配和迭代-加帽装配(ica)。
锌指(zf)是可以与约3个核苷酸的有限组合结合的约30个氨基酸。c2h2zf域可能是最常见的zf类型,并且似乎是真核细胞中最丰富表达的蛋白质之一。zf是小的、功能性的且独立折叠的结构域,在其结构中与锌分子配位。每个zf中的氨基酸可以对特定核苷酸具有亲和力,使得每个指选择性地识别dna的3-4个核苷酸。多个zf可以排列成串联阵列并识别dna上的一组核苷酸。通过使用不同锌指的组合,可以靶向基因组内的独特dna序列。可以产生不同长度的不同zfp,这可以允许从可能的64个三联体亚位点识别几乎任何所需的dna序列。
在本公开内容中使用的锌指可以使用已建立的模块化装配指来形成,该模块化装配指例如是由barbas及其同事开发的一组模块化装配指结构域,以及toolgen的另一组模块化装配指结构域。这两组结构域都覆盖所有3bpgnn、大多数ann、许多cnn和一些tnn三联体(其中n可以是四种核苷酸中的任何一种)。两者具有不同组的指,这允许根据需要搜索和编码不同的zf模块。还可以采用基于选择的组合寡聚化池工程化(open)策略来使模块化装配体的依赖于背景的影响最小化,其涉及指在蛋白质中的位置和相邻指的序列。openzf阵列可从zincfingerconsortiumdatabase公开获得。
aavrepdna结合域是可以与本公开内容的主题一起使用的另一种dna序列特异性结合域。病毒顺式作用反向末端重复序列(itr)和反式作用病毒rep蛋白(rep)被认为是在不存在辅助病毒的情况下介导aav优先整合到宿主基因组的aavs1位点中的因子。aavrep蛋白可以与aavs1位点的特定dna序列结合。因此,位点特异性dna结合域可以与本文所述的tcbuster转座酶结构域融合在一起。
本文提供的融合转座酶可包含tcbuster转座酶序列和标签序列。本文提供的标签序列可指可用作融合蛋白的检测标签的任何蛋白质序列,例如但不限于可以被抗体识别的报道蛋白和亲和标签。报道蛋白包括但不限于荧光蛋白(例如,gfp、rfp、mcherry、yfp)、β-半乳糖苷酶(β-gal)、碱性磷酸酶(ap)、氯霉素乙酰转移酶(cat)、辣根过氧化物酶(hrp)。亲和标签的非限制性实例包括多组氨酸(his标签)、谷胱甘肽s-转移酶(gst)、麦芽糖结合蛋白(mbp)、钙调蛋白结合肽(cbp)、内含肽-几丁质结合域(内含肽-cbd)、基于链霉抗生物素蛋白/生物素的标签、表位标签如flag、ha、c-myc、t7、glu-glu等。
本文提供的融合转座酶可包含不使用任何中间序列(例如,“背靠背”)融合在一起的tcbuster转座酶序列和dna序列特异性结合域或标签序列。在一些情况下,本文提供的融合转座酶可包含通过连接体序列连接的tcbuster转座酶序列和dna序列特异性结合域或标签序列。图8是示例性融合转座酶的示意图,其包含通过连接体连接的dna序列特异性结合域和tcbuster转座酶序列。在示例性融合转座酶中,连接体可主要用作第一和第二多肽之间的间隔区。连接体可以是用来分离单个多肽中的多个结构域的短氨基酸序列。连接体序列可包含在天然多结构域蛋白质中存在的连接体。在一些情况下,连接体序列可包含人工产生的连接体。连接体序列的选择可以基于融合转座酶的应用。连接体序列可包含3、4、5、6、7、8、9、10个或更多个氨基酸。在一些实施方案中,连接体序列可包含至少3个、至少4个、至少5个、至少6个、至少7个、至少8个、至少9个、至少10个、至少15个、至少20个或至少50个氨基酸。在一些实施方案中,连接体序列可包含至多4个、至多5个、至多6个、至多7个、至多8个、至多9个、至多10个、至多11个、至多12个、至多15个、至多20个、至多30个、至多40个、至多50个或至多100个氨基酸。在某些情况下,可能希望使用柔性连接体序列,例如但不限于gly和ser残基的序列段(“gs”连接体),如(ggggs)n(n=2-8)、(gly)8、gsagsaagsgef、(ggggs)4。有时,可能希望使用刚性连接体序列,例如但不限于(eaaak)n(n=2-7)、富含pro的序列,如(xp)n,其中x表示任何氨基酸。
在本文提供的示例性融合转座酶中,tcbuster转座酶序列可以与dna序列特异性结合域或标签序列的n末端融合。或者,tcbuster转座酶序列可以与dna序列特异性结合域或标签序列的c末端融合。在一些实施方案中,根据融合转座酶的应用,第三结构域序列或更多其它序列可以存在于tcbuster转座酶与dna序列特异性结合域或标签序列之间。
tcbuster转座子
本公开内容的另一方面提供了一种tcbuster转座子,其包含位于两个反向重复序列之间的盒货物。tcbuster转座子可以被本文所述的tcbuster转座酶识别,例如,tcbuster转座酶可以识别tcbuster转座子并催化tcbuster转座子向dna序列中的转座。
在本文中可互换使用的术语“反向重复序列”、“末端反向重复序列”、“反向末端重复序列”可指在天然转座子中的转座酶基因或人工工程化转座子中的盒货物侧翼的短序列重复。在相应转座酶的存在下移动转座子通常需要两个反向重复序列。如本文所述的反向重复序列可含有一个或多个直接重复(dr)序列。这些序列通常嵌入元件的末端反向重复序列(tir)中。如本文所用的术语“货物盒”可指反向重复序列之间除含有tcbuster转座酶基因的天然核苷酸序列以外的核苷酸序列。货物盒可以被人工工程化。
本文描述的转座子可包含侧翼为ir/dr序列的货物盒。在一些实施方案中,至少一个重复序列含有至少一个直接重复序列。如图1和图2所示,转座子可以含有侧翼为irdr-l-seq1(seqidno:3)和irdr-r-seq1(seqidno:4)的货物盒。在许多情况下,左反向重复序列可包含与irdr-l-seq1(seqidno:3)至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或100%相同的序列。有时,右反向重复序列可包含与irdr-r-seq1(seqidno:4)至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或100%相同的序列。在其它情况下,右反向重复序列可包含与irdr-l-seq1(seqidno:3)至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或100%相同的序列。有时,左反向重复序列可包含与irdr-r-seq1(seqidno:4)至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或100%相同的序列。如本文所用的,术语“左”和“右”可分别指双链转座子的有义链上的货物盒的5′和3′侧。转座子也可能含有侧翼为irdr-l-seq2(seqidno:5)和irdr-r-seq2(seqidno:6)的货物盒。在许多情况下,左反向重复序列可包含与irdr-l-seq2(seqidno:5)至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或100%相同的序列。有时,右反向重复序列可包含与irdr-r-seq2(seqidno:6)至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或100%相同的序列。在其它情况下,右反向重复序列可包含与irdr-l-seq2(seqidno:5)至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或100%相同的序列。有时,左反转重复序列可包含与irdr-r-seq2(seqidno:6)至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或100%相同的序列。转座子可含有侧翼为两个反向重复序列的货物盒,所述反向重复序列具有与图2中给出的不同的核苷酸序列,或者本领域技术人员已知的各种序列的组合。本文所述转座子的两个反向重复序列中的至少一个可以含有与seqidno:3-6中的任一个至少40%、至少50%、至少60%、至少70%、至少80%、至少90%、至少95%、至少98%、至少99%或100%相同的序列。本文所述转座子的反向重复序列中的至少一个可以含有与seqidno:3或4至少80%相同的序列。本文所述转座子的反向重复序列中的至少一个可以含有与seqidno:5或6至少80%相同的序列。反向重复序列的选择可以根据预期的转座效率、待修饰的细胞类型、待使用的转座酶和许多其它因素而变化。
在许多实施方式中,可使用保留基因组空间的最小尺寸的转座子载体反向末端重复序列。hat家族转座子的itr差异很大,且右手和左手itr具有差异。在许多情况下,仅由100-200个核苷酸组成的较小itr与较长天然itr一样在hat转座子载体中有活性。在介导hat家族转座时,这些序列可以一致地减少。这些较短的itr可以保留hat转座子载体内的基因组空间。
本文提供的转座子的反向重复序列可以是约50至2000个核苷酸、约50至1000个核苷酸、约50至800个核苷酸、约50至600个核苷酸、约50至500个核苷酸、约50至400个核苷酸、约50至350个核苷酸、约50至300个核苷酸、约50至250个核苷酸、约50至200个核苷酸、约50至180个核苷酸、约50至160个核苷酸、约50至140个核苷酸、约50至120个核苷酸、约50至110个核苷酸、约50至100个核苷酸、约50至90个核苷酸、约50至80个核苷酸、约50至70个核苷酸、约50至60个核苷酸、约75至750个核苷酸、约75至450个核苷酸、约75至325个核苷酸、约75至250个核苷酸、约75至150个核苷酸、约75至95个核苷酸、约100至500个核苷酸、约100至400个核苷酸、约100至350个核苷酸、约100至300个核苷酸、约100至250个核苷酸、约100至220个核苷酸、约100至200个核苷酸,或由其衍生的任何范围中的核苷酸。
在一些情况下,货物盒可包含启动子、转基因或其组合。在包含启动子和转基因的货物盒中,转基因的表达可以由启动子引导。启动子可以是本领域技术人员可获得的任何类型的启动子。可在tcbuster转座子中使用的启动子的非限制性实例包括efs、cmv、mnd、ef1α、cagg、pgk、ubc、u6、h1和cumate。将在tcbuster转座中使用的启动子的选择取决于许多因素,例如但不限于启动子的表达效率、待遗传修饰的细胞类型和所需的转基因表达水平。
tcbuster转座子中的转基因可以是任何感兴趣的基因,并且是本领域技术人员可获得的。转基因可以衍生自自然界中的基因或者是其变体,或者可以人工设计。转基因可以与待修饰的细胞属于相同的物种来源,或来自不同物种。转基因可以是原核基因或真核基因。有时,转基因可以是来源于非人动物、植物或人类的基因。转基因可包含内含子。或者,转基因可以去除或不存在内含子。
在一些实施方案中,转基因可以编码蛋白质。示例性蛋白质包括但不限于细胞受体、免疫检查点蛋白质、细胞因子或其任意组合。有时,本文所述的细胞受体可包括但不限于t细胞受体(tcr)、b细胞受体(bcr)、嵌合抗原受体(car)或其任意组合。
如本文所述的货物盒可以不包含编码任何类型的蛋白质产物的转基因,而包含可用于其它目的基因。例如,货物盒可用于在插入位点中产生移码,例如,当其插入宿主基因组中基因的外显子中时。这可导致基因产物的截短或无效突变。有时,货物盒可用于用外源核苷酸序列替换内源基因组序列,从而修饰宿主基因组。
本文所述的转座子可具有正向或反向方向的货物盒。在许多情况下,货物盒具有其自身的方向性。例如,含有转基因的货物盒将具有5′至3′编码序列。含有启动子和基因插入的货物盒将在基因插入的5′位点上具有启动子。如本文所用的,术语“正向方向”可指货物盒在双链转座子的有义链上保持其方向性的情况。如本文所用的,术语“反向方向”可指货物盒在双链转座子的反义链上保持其方向性的情况。
用于基因组编辑的系统和使用方法
本公开内容的另一方面提供了一种用于基因组编辑的系统。系统可包含tcbuster转座酶和tcbuster转座子。系统可用来编辑宿主细胞的基因组、破坏或修饰宿主细胞的内源基因组区域、将外源基因插入宿主基因组中、用外源核苷酸序列替换内源核苷酸序列,或其任意组合。
用于基因组编辑的系统可包含如本文所述的突变tcbuster转座酶或融合转座酶,以及可被该突变tcbuster转座酶或融合转座酶识别的转座子。突变tcbuster转座酶或融合转座酶可以作为纯化的蛋白质提供。蛋白质生产和纯化技术是本领域技术人员已知的。纯化的蛋白质可以保存在与转座子不同的容器中,或者它们可以保存在同一容器中。
在许多情况下,用于基因组编辑的系统可包含编码如本文所述的突变tcbuster转座酶或融合转座酶的多核苷酸,以及可被该突变tcbuster转座酶或融合转座酶识别的转座子。有时,该系统的多核苷酸可包含编码所述突变tcbuster转座酶或融合转座酶的dna。备选地或另外,该系统的多核苷酸可包含编码所述突变tcbuster转座酶或融合转座酶的信使rna(mrna)。mrna可以通过本领域普通技术人员熟知的许多方法产生,例如但不限于体内转录和rna纯化、体外转录和从头合成。在许多情况下,mrna可以被化学修饰。化学修饰的mrna可以比未修饰的或天然的mrna具有降解抗性,或者可以更快地降解。在许多情况下,mrna的化学修饰可以使mrna以更高的效率翻译。mrna的化学修饰可以使用本领域技术人员可获得的公知技术或由商业供应商进行。
对于许多应用,安全性表示hat转座酶表达的持续时间仅长到足以介导安全的转座子递送。而且,与转座子载体水平的高度相一致的hat转座酶表达的脉冲可以实现最大的基因递送。使用可获得的从dna质粒模板体外转录rna分子的技术进行实施。可以使用多种从dna拷贝进行体外(例如,无细胞)转录的方法合成rna分子。其实现方法已有描述并且可商购获得。例如,mmessagemachine体外转录试剂盒可通过lifetechnologies获得。
还有许多公司可以在收取服务费的基础上进行体外转录。我们还发现,用于hat表达的化学修饰的rna特别适用于基因转移。这些化学修饰的rna不会诱导细胞免疫应答,使用专有方法产生的rna也避免了细胞免疫应答。这些rna制品去除rna二聚体(clean-cap)和细胞反应性(假尿苷掺入),在人类t细胞中产生更好的瞬时基因表达,而在我们看来没有毒性(数据未示出)。可以使用许多描述的rna转染方法中的任何方法将rna分子引入细胞中,其通常对大多数细胞无毒性。其实现方法已有描述并且可商购获得。例如,amaxanucleofector、neonelectroporator和maxcyte平台。
如本文所述的转座子可以存在于表达载体中。在许多情况下,该表达载体可以是dna质粒。有时,该表达载体可以是小环载体。如本文所用的术语“小环载体”可指小环状质粒衍生物,其不含大多数(如果不是全部的话)原核载体部分(例如,原核来源的控制序列或非功能序列)。在某些情况下,通过使用如本文所述的“小环”可以减轻通过转染或电穿孔产生的对细胞的毒性。
小环载体可通过可获得的众所周知的分子克隆技术制备。首先,可以产生细菌如大肠杆菌中的“亲本质粒”(具有插入的细菌质粒,如转座子构建体),然后可以诱导位点特异性重组酶。这些步骤之后可以通过插入物两端的两个重组酶-靶序列切除原核载体部分,以及回收所得的小环载体。可以通过转染或脂质转染将纯化的小环转移到接受体细胞中,并通过例如喷射注射将其转移到分化的组织中。含有tcbuster转座子的小环可具有约1.5kb、约2kb、约2.2kb、约2.4kb、约2.6kb、约2.8kb、约3kb、约3.2kb、约3.4kb、约3.6kb、约3.8kb、约4kb、约4.2kb、约4.4kb、约4.6kb、约4.8kb、约5kb、约5.2kb、约5.4kb、约5.6kb、约5.8kb、约6kb、约6.5kb、约7kb、约8kb、约9kb、约10kb、约12kb、约25kb、约50kb的大小,或这些数字中任意两个之间的值。有时,含有本文提供的tcbuster转座子的小环可具有至多2.1kb、至多3.1kb、至多4.1kb、至多4.5kb、至多5.1kb、至多5.5kb、至多6.5kb、至多7.5kb、至多8.5kb、至多9.5kb、至多11kb、至多13kb、至多15kb、至多30kb或至多60kb的大小。
在某些实施方案中,如本文所述的系统可含有编码本文所述的突变tcbuster转座酶或融合转座酶的多核苷酸,和转座子,它们存在于同一表达载体例如质粒中。
本公开内容的又一方面提供了一种遗传工程化方法。遗传工程化方法可以包括向细胞中引入tcbuster转座酶和可被该tcbuster转座酶识别的转座子。遗传工程化方法也可以在无细胞环境中进行。在无细胞环境中的遗传工程化方法可以包括将tcbuster转座酶、可被该转座酶识别的转座子和靶核酸组合到容器如孔或管中。
本文描述的方法可以包括向细胞中引入本文提供的突变tcbuster转座酶和可被该突变tcbuster转座酶识别的转座子。基因组编辑方法可以包括:向细胞中引入本文提供的融合转座酶和可被该融合转座酶识别的转座子。
可以将所述突变tcbuster转座酶或融合转座酶作为蛋白质或通过编码所述突变tcbuster转座酶或融合转座酶的多核苷酸引入细胞中。如上所述,该多核苷酸可包含编码所述突变tcbuster转座酶或融合转座酶的dna或mrna。
在许多情况下,所述tcbuster转座酶或融合转座酶可以作为蛋白质转染到宿主细胞中,并且该蛋白质的浓度可以是至少0.05nm、至少0.1nm、至少0.2nm、至少0.5nm、至少1nm、至少2nm、至少5nm、至少10nm、至少50nm、至少100nm、至少200nm、至少500nm、至少1μm、至少2μm、至少5μm、至少7.5μm、至少10μm、至少15μm、至少20μm、至少25μm、至少50μm、至少100μm、至少200μm、至少500μm或至少1μm。有时,该蛋白质的浓度可以是约1μm至约50μm、约2μm至约25μm、约5μm至约12.5μm或约7.5μm至约10μm。
在许多情况下,所述tcbuster转座酶或融合转座酶可以通过多核苷酸转染到宿主细胞中,并且该多核苷酸的浓度可以是至少约5ng/ml、10ng/ml、20ng/ml、40ng/ml、50ng/ml、60ng/ml、80ng/ml、100ng/ml、120ng/ml、150ng/ml、180ng/ml、200ng/ml、220ng/ml、250ng/ml、280ng/ml、300ng/ml、500ng/ml、750ng/ml、1μg/ml、2μg/ml、3μg/ml、5μg/ml、50μg/ml、100μg/ml、150μg/ml、200μg/ml、250μg/ml、300μg/ml、350μg/ml、400μg/ml、450μg/ml、500μg/ml、550μg/ml、600μg/ml、650μg/ml、700μg/ml、750μg/ml或800μg/ml。有时,该多核苷酸的浓度可以是约5-25μg/ml、25-50μg/ml、50-100μg/ml、100-150μg/ml、150-200μg/ml、200-250μg/ml、250-500μg/ml、5-800μg/ml、200-800μg/ml、250-800μg/ml、400-800μg/ml、500-800μg/ml,或其中可衍生的任何范围。在许多情况下,转座子与转座酶存在于不同的表达载体中,并且该转座子的浓度可以是至少约5ng/ml、10ng/ml、20ng/ml、40ng/ml、50ng/ml、60ng/ml、80ng/ml、100ng/ml、120ng/ml、150ng/ml、180ng/ml、200ng/ml、220ng/ml、250ng/ml、280ng/ml、300ng/ml、500ng/ml、750ng/ml、1μg/ml、2μg/ml、3μg/ml、5μg/ml、50μg/ml、100μg/ml、150μg/ml、200μg/ml、250μg/ml、300μg/ml、350μg/ml、400μg/ml、450μg/ml、500μg/ml、550μg/ml、600μg/ml、650μg/ml、700μg/ml、750μg/ml或800μg/ml。有时,该转座子的浓度可以是约5-25μg/ml、25-50μg/ml、50-100μg/ml、100-150μg/ml、150-200μg/ml、200-250μg/ml、250-500μg/ml、5-800μg/ml、200-800μg/ml、250-800μg/ml、400-800μg/ml、500-800μg/ml,或其中可衍生的任何范围。转座子与编码转座酶的多核苷酸的比例可能是至多10000、至多5000、至多1000、至多500、至多200、至多100、至多50、至多20、至多10、至多5、至多2、至多1、至多0.1、至多0.05、至多0.01、至多0.001、至多0.0001,或其任意两者之间的任何数字。
在一些其它情况下,转座子和编码转座酶的多核苷酸存在于同一表达载体中,并且含有转座子和编码转座酶的多核苷酸的表达载体的浓度可以是至少约5ng/ml、10ng/ml、20ng/ml、40ng/ml、50ng/ml、60ng/ml、80ng/ml、100ng/ml、120ng/ml、150ng/ml、180ng/ml、200ng/ml、220ng/ml、250ng/ml、280ng/ml、300ng/ml、500ng/ml、750ng/ml、1μg/ml、2μg/ml、3μg/ml、5μg/ml、50μg/ml、100μg/ml、150μg/ml、200μg/ml、250μg/ml、300μg/ml、350μg/ml、400μg/ml、450μg/ml、500μg/ml、550μg/ml、600μg/ml、650μg/ml、700μg/ml、750μg/ml或800μg/ml。有时,含有转座子和编码转座酶的多核苷酸的表达载体的浓度可以是约5-25μg/ml、25-50μg/ml、50-100μg/ml、100-150μg/ml、150-200μg/ml、200-250μg/ml、250-500μg/ml、5-800μg/ml、200-800μg/ml、250-800μg/ml、400-800μg/ml、500-800μg/ml,或其中可衍生的任何范围。
在一些情况下,可以改变可通过电穿孔引入细胞中的多核酸的量,以优化转染效率和/或细胞活力。在一些情况下,可以向每个细胞样品中加入少于约100pg的核酸(例如,一个或多个细胞被电穿孔)。在一些情况下,可以向每个细胞样品中加入至少约100pg、至少约200pg、至少约300pg、至少约400pg、至少约500pg、至少约600pg、至少约700pg、至少约800pg、至少约900pg、至少约1微克、至少约1.5μg、至少约2μg、至少约2.5μg、至少约3μg、至少约3.5μg、至少约4μg、至少约4.5μg、至少约5μg、至少约5.5μg、至少约6μg、至少约6.5μg、至少约7μg、至少约7.5μg、至少约8μg、至少约8.5μg、至少约9μg、至少约9.5μg、至少约10μg、至少约11μg、至少约12μg、至少约13μg、至少约14μg、至少约15μg、至少约20μg、至少约25μg、至少约30μg、至少约35μg、至少约40μg、至少约45μg或至少约50μg的核酸(例如,一个或多个细胞被电穿孔)。例如,可以向每个细胞样品中加入1微克dsdna用于电穿孔。在一些情况下,最佳转染效率和/或细胞活力所需的多核酸(例如dsdna)的量可以是细胞类型特异的。
本文公开的主题可应用于多种不同类型的宿主细胞的基因组编辑。在优选的实施方案中,宿主细胞可以来自真核生物体。在一些实施方案中,该细胞可以来自哺乳动物来源。在一些实施方案中,该细胞可以来自人类来源。
通常,所述细胞可以来自永生化细胞系或原代细胞。
在本文中可互换使用的术语“细胞系”和“永生化细胞系”可指来自生物体的细胞群体,其在正常情况下不会无限增殖,但由于突变,可能已经逃避正常的细胞衰老,而可以继续分裂。本文提供的主题可应用于一系列常见的已建立的细胞系,包括但不限于人bc-1细胞、人bjab细胞、人im-9细胞、人jiyoye细胞、人k-562细胞、人lcl细胞、小鼠mpc-11细胞、人raji细胞、人ramos细胞、小鼠ramos细胞、人rpmi8226细胞、人rs4-11细胞、人skw6.4细胞、人树突细胞、小鼠p815细胞、小鼠rbl-2h3细胞、人hl-60细胞、人namalwa细胞、人巨噬细胞、小鼠raw264.7细胞、人kg-1细胞、小鼠m1细胞、人pbmc细胞、小鼠bw5147(t200-a)5.2细胞、人ccrf-cem细胞、小鼠el4细胞、人jurkat细胞、人scid.adh细胞、人u-937细胞或其细胞的任意组合。
如本文所用的,术语“原代细胞”及其语法等同语可指直接取自生物体的细胞,通常是取自多细胞生物体如动物或植物的活组织的细胞。在许多情况下,可以建立原代细胞以供在体外生长。在一些情况下,原代细胞可能刚刚从生物体中取出,并且尚未在转染前建立以供体外生长。在一些实施方案中,原代细胞也可以在体外扩充,即,原代细胞还可以包括由直接取自生物体的细胞增殖产生的子代细胞。在这些情况下,子代细胞不像已建立的细胞系中的细胞那样表现出无限增殖性质。例如,宿主细胞可以是人原代t细胞,而在转染之前,t细胞已暴露于可导致t细胞增殖和细胞群体扩充的刺激因子。
待遗传修饰的细胞可以是来自组织或器官的原代细胞,该组织或器官例如是但不限于脑、肺、肝、心脏、脾、胰腺、小肠、大肠、骨骼肌、平滑肌、皮肤、骨骼、脂肪组织、毛发、甲状腺、气管、胆囊、肾、输尿管、膀胱、主动脉、静脉、食道、膈、胃、直肠、肾上腺、支气管、耳、眼、视网膜、生殖器、下丘脑、喉、鼻、舌、脊髓或输尿管、子宫、卵巢、睾丸及其任意组合。在某些实施方案中,该细胞可包括但不限于血细胞、毛发细胞(trichocyte)、角质形成细胞、促性腺激素细胞、促皮质激素细胞、促甲状腺素细胞、促生长激素细胞、催乳素细胞、嗜铬细胞、滤泡旁细胞、球细胞、黑素细胞、痣细胞、merkel细胞、成牙本质细胞、成牙骨质细胞、角膜细胞、视网膜muller细胞、视网膜色素上皮细胞、神经元、胶质细胞、室管膜细胞、松果体细胞、肺细胞、克拉拉细胞、杯状细胞、g细胞、d细胞、肠嗜铬样细胞、胃主细胞、壁细胞、中心凹细胞(foveolarcell)、k细胞、d细胞、i细胞、帕内特细胞、肠细胞、微褶细胞、肝细胞、肝星状细胞、胆囊细胞(cholecystocyte)、泡心细胞、胰腺星状细胞、胰腺α细胞、胰腺β细胞、胰腺δ细胞、胰腺f细胞、胰腺ε细胞、甲状腺甲状旁腺、嗜酸性细胞、尿路上皮细胞、成骨细胞、骨细胞、成软骨细胞、软骨细胞、成纤维细胞、纤维细胞、成肌细胞、肌细胞、肌卫星细胞、肌腱细胞、心肌细胞、成脂肪细胞、脂肪细胞、cajal间质细胞、成血管细胞、内皮细胞、系膜细胞、肾小球旁细胞、致密斑细胞、基质细胞、间质细胞、远细胞(telocyte)、简单上皮细胞、足细胞、肾近端小管刷状缘细胞、塞托利细胞、莱迪希细胞、颗粒细胞、栓细胞(pegcell)、生殖细胞、精子卵细胞、淋巴细胞、髓样细胞、内皮祖细胞、内皮干细胞、成血管细胞、中胚层成血管细胞(mesoangioblast)、周细胞壁细胞及其任意组合。在许多情况下,待修饰的细胞可以是干细胞,例如但不限于胚胎干细胞、造血干细胞、表皮干细胞、上皮干细胞、支气管肺泡干细胞、乳腺干细胞、间充质干细胞、肠干细胞、内皮干细胞、神经干细胞、嗅觉成体干细胞、神经嵴干细胞、睾丸细胞及其任意组合。有时,该细胞可以是来源于任何类型的组织的诱导多能干细胞。
在一些实施方案中,待遗传修饰的细胞可以是哺乳动物细胞。在一些实施方案中,该细胞可以是免疫细胞。该细胞的非限制性实例可包括b细胞、嗜碱性粒细胞、树突细胞、嗜酸性粒细胞、γδt细胞、粒细胞、辅助性t细胞、朗格汉斯细胞、淋巴样细胞、先天性淋巴样细胞(ilc)、巨噬细胞、肥大细胞、巨核细胞、记忆t细胞、单核细胞、髓样细胞、自然杀伤t细胞、嗜中性粒细胞、前体细胞、浆细胞、祖细胞、调节性t-细胞、t细胞、胸腺细胞,其任何分化或去分化的细胞,或其细胞的任何混合物或组合。在某些情况下,该细胞可以是t细胞。在一些实施方案中,该细胞可以是原代t细胞。在某些情况下,该细胞可以是抗原呈递细胞(apc)。在一些实施方案中,该细胞可以是原代apc。与本公开内容相关的apc可以是树突细胞、巨噬细胞、b细胞、其它非专业apc或其任意组合。
在一些实施方案中,所述细胞可以是ilc(先天性淋巴样细胞),并且该ilc可以是第1组ilc、第2组ilc或第3组ilc。第1组ilc通常可被描述为由t-bet转录因子控制的细胞,其响应于细胞内病原体分泌1型细胞因子,如ifn-γ和tnf-α。第2组ilc通常可被描述为依赖于gata-3和ror-α转录因子的细胞,其响应于细胞外寄生虫感染产生2型细胞因子。第3组ilc通常可被描述为由ror-γt转录因子控制的细胞,并产生il-17和/或il-22。
在一些实施方案中,所述细胞可以是对于给定因子呈阳性或阴性的细胞。在一些实施方案中,细胞可以是cd3+细胞、cd3-细胞、cd5+细胞、cd5-细胞、cd7+细胞、cd7-细胞、cd14+细胞、cd14-细胞、cd8+细胞、cd8-细胞、cd103+细胞、cd103-细胞、cdl1b+细胞、cd11b-细胞、bdca1+细胞、bdca1-细胞、l-选择蛋白+细胞、l-选择蛋白-细胞、cd25+、cd25-细胞、cd2.7+、cd27-细胞、cd28+细胞、cd28-细胞、cd44+细胞、cd44-细胞、cd56+细胞、cd56-细胞、cd57+细胞、cd57-细胞、cd62l+细胞、cd62l-细胞、cd69+细胞、cd69-细胞、cd45ro+细胞、cd45ro-细胞、cd127+细胞、cd127-细胞、cd132+细胞、cd132-细胞、il-7+细胞、1l-7-细胞、il-15+细胞、il-15-细胞、凝集素样受体g1阳性细胞、凝集素样受体g1阴性细胞,或其分化或去分化的细胞。由细胞表达的因子的实例并非限制性的,并且本领域技术人员将会理解,所述细胞可以对本领域已知的任何因子呈阳性或阴性。在一些实施方案中,该细胞可以对两种或更多种因子呈阳性。例如,该细胞可以是cd4+和cd8+。在一些实施方案中,该细胞可以对两种或更多种因子呈阴性。例如,该细胞可以是cd25-、cd44-和cd69-。在一些实施方案中,该细胞可以对一种或多种因子呈阳性,并且对一种或多种因子呈阴性。例如,该细胞可以是cd4+和cd8-。
应当理解,在本文公开的任何方法中使用的细胞可以是本文公开的任何细胞的混合物(例如,两种或更多种不同的细胞)。例如,本公开内容的方法可以包括细胞,并且该细胞是cd4+细胞和cd8+细胞的混合物。在另一个实例中,本公开内容的方法可以包括细胞,并且该细胞是cd4+细胞和幼稚细胞的混合物。
如本文所提供的,可通过许多方法将转座酶和转座子引入细胞中。如本文使用的术语“转染”及其语法等同语通常可指将核酸引入真核细胞中的过程。可与所述主题一起使用的转染方法可以包括但不限于电穿孔、显微注射、磷酸钙沉淀、阳离子聚合物、树状聚体、脂质体、微粒轰击、fugene、直接声波加载、细胞挤压、光学转染、原生质体融合、impalefection、磁转染、核转染或其任意组合。在许多情况下,可通过电穿孔将本文所述的转座酶和转座子转染到宿主细胞中。有时,转染也可以通过电穿孔方法的变化形式如核转染(也称为nucleofectortm技术)进行。如本文所用的术语“电穿孔”及其语法等同语可指对细胞施加电场以增加细胞膜的通透性,从而允许将化学物质、药物或dna引入细胞中的过程。在电穿孔期间,通常以非常短暂时间段例如5毫秒、10毫秒和50毫秒的“脉冲”的形式提供电场。如本领域技术人员所理解的,电穿孔通过使用脉冲旋转电场暂时打开细胞外膜中的孔。用于体外和体内电穿孔的方法和装置也是众所周知的。可以根据被电穿孔的细胞类型和将要被细胞摄取的分子的物理特性(如脉冲强度、脉冲长度、脉冲数)来选择各种电参数。
应用
本文提供的主题,例如组合物(例如,突变tcbuster转座酶、融合转座酶、tcbuster转座子)、系统和方法,可以广泛应用于现代生活各个方面中与基因组编辑有关的应用。
在某些情况下,本文描述的主题的优点可包括但不限于降低的成本、监管考虑因素、较低的免疫原性和较低的复杂性。在一些情况下,本公开内容的显著优点是高转座效率。在许多情况下,本公开内容的另一个优点是本文提供的转座系统可以是“可调节的”,例如,可以将转座设计成靶向选择的基因组区域而不是随机插入。
一个非限制性实例涉及产生用于研究和临床应用的遗传修饰细胞。例如,如上所述,可以使用本文提供的主题创建遗传修饰的t细胞,其可以应用于帮助人们抵抗多种疾病,例如但不限于癌症和传染病。
一个具体实例包括使用本文提供的方法产生遗传修饰的原代白细胞,以及将所述遗传修饰的原代白细胞施用于有需要的患者。遗传修饰的原代白细胞的产生可以包括向白细胞中引入转座子和可以识别该转座子的如本文所述的突变tcbuster转座酶或融合转座酶,从而产生遗传修饰的白细胞。在许多情况下,该转座子可包含转基因。该转基因可以是细胞受体、免疫检查点蛋白质、细胞因子及其任意组合。有时,细胞受体可包括但不限于t细胞受体(tcr)、b细胞受体(bcr)、嵌合抗原受体(car)或其任意组合。在一些其它情况下,该转座子和转座酶被设计用于删除或修饰内源基因,例如细胞因子、免疫检查点蛋白质、癌基因或其任意组合。原代白细胞的遗传修饰可以被设计为促进针对使患者处于患病状态的传染性病原体或癌细胞的免疫。
另一个非限制性实例涉及产生用于农业、食品生产、医药和药剂学的遗传修饰的生物体。可以遗传修饰的物种范围很广,包括但不限于植物和动物。遗传修饰的生物体,如遗传修饰的作物或牲畜,可以在其生理学性质的某些方面进行修饰。食用作物中的实例包括对某些害虫、病害或环境条件的抗性,腐败的减少,或对化学处理的抗性(例如对除草剂的抗性),或改善作物的营养物质概况。非食用作物中的实例包括药剂、生物燃料和其它工业上有用的商品的生产,以及用于生物修复。牲畜中的实例包括对某些寄生虫的抗性、某些营养元素的产生、生长速率的增加和乳产量的增加。
如本文所用的与参考数值及其语法等同语结合使用的术语“约”及其语法等同语可包括该数值加上或减去10%的值的范围。例如,“约10”的量包括9至11的量。与参考数值结合使用的术语“约”还可包括该数值加上或减去10%、9%、8%、7%、6%、5%、4%、3%、2%或1%的值的范围。
实施例
以下实施例进一步说明了所描述的实施方案,而非限制本公开内容的范围。
实施例1.材料与方法
该实施例描述了用于生成和评价示例性突变tcbuster转座酶的数种方法。
用于tcbuster突变体制备的定点诱变
通过hat和buster亚家族的核苷酸序列和氨基酸比对鉴定出推定的高活性tcbuster(tcb)转座酶突变体。q5定点诱变试剂盒(newenglandbiolabs)用于所有定点诱变。pcr诱变后,用genejetpcr纯化试剂盒(thermofisherscientific)纯化pcr产物。使用t4dna连接酶(newenglandbiolabs)对纯化的pcr产物进行20μl连接反应。使用5μl连接反应在dh10beta细胞中进行转化。使用通过sequetech的直接集落测序来确认所需突变的存在。使用zymopure质粒小量制备试剂盒(zymoresearch)制备用于确认突变的dna。
测量hek-293t细胞中的转染效率
在转染前一天,将hek-293t细胞以每孔300,000个细胞接种于6孔板中。按照制造商的说明书(mirusbio),使用transitx2试剂,用500ng带有mcherry-嘌呤霉素盒的转座子和62.5ngtcb转座酶转染细胞。转染后两天,将细胞以3,000个细胞/孔的密度与嘌呤霉素(1ug/ml)一起一式三份重新接种于6孔板中的dmem完全培养基中,或者不使用嘌呤霉素选择进行重新接种。通过嘌呤霉素处理的细胞(在药物选择下存活的每个细胞形成集落)的集落计数或流式细胞术来评估转基因的稳定整合。对于集落计数,在嘌呤霉素选择后两周,除去dmem完全+嘌呤霉素培养基。用1xpbs洗涤细胞,并用1x结晶紫溶液将细胞染色10分钟。将板用pbs洗涤两次并进行集落计数。
对于流式细胞术分析,通过检测在没有药物选择的情况下生长的细胞中的mcherry荧光来评估转基因的稳定整合。在转染后的指定时间点收获转染的细胞,用pbs洗涤1次,并重悬于200μlrdfii缓冲液中以供分析。使用novocyte(aceabiosciences)分析细胞,并使用pe-得克萨斯红通道评估mcherry表达。
hek-293t细胞中tcb转座酶突变体的筛选
在转染前一天,将hek-293t细胞以每孔75,000个细胞接种于24孔板中。根据制造商的说明书(mirusbio),使用transitx2试剂,一式两份用500ng转座子和125ng转座酶转染细胞。通过检测mcherry荧光评估转基因的稳定整合。转染后14天收获细胞,用pbs洗涤1次,并重悬于200μlrdfii缓冲液中。使用novocyte(aceabiosciences)分析细胞,并使用pe-得克萨斯红通道评估mcherry表达。
tcbuster转座子和转座酶在cd3+t细胞中的转染
从leukopaks(stemcelltechnologies)中富集并冷冻保存cd3+t细胞。将cd3+t细胞解冻,并使用cd3/cd28dynabeads(thermofisher)在补充有人血清和il-2、il-15和il-7细胞因子的x-vivo-15培养基中激活2天。在转染之前,移除cd3/cd28珠子,洗涤细胞,并使用neontransfection系统(thermofisher)用tcbuster转座子(携带tcbuster和sleepingbeautyir/dr和gfp货物的小环)和rna形式的tcbuster或sleepingbeauty转座酶进行电穿孔。作为活力对照,对细胞进行“脉冲”电穿孔而不使用dna或rna。经电穿孔的细胞在转染后扩充21天,并通过流式细胞术评估gfp货物的活力稳定整合。通过ssc-a与fsc-a测量活力,并相对于仅脉冲的对照进行归一化,并且在第2、7、14和21天使用fitc通道评估gfp表达。
实施例2.示例性转座子构建体
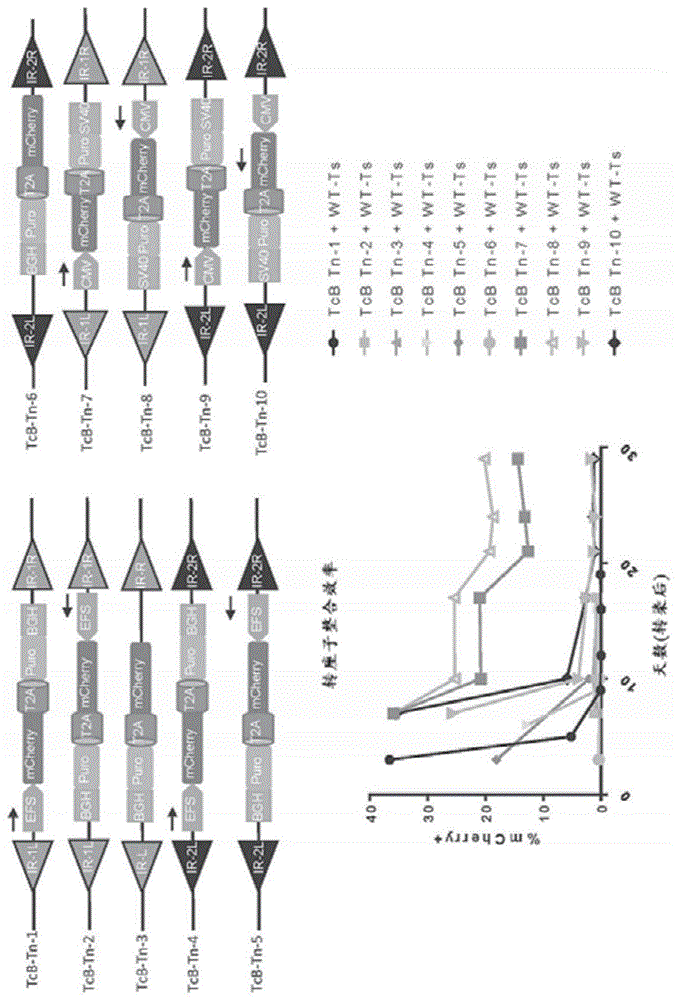
该研究的目的是检查不同示例性tcbuster转座子构建体的转座效率。发明人比较了10种tcbuster(tcb)转座子(tn)配置(图1a),以测试它们在哺乳动物细胞中的转座效率。这10种tcbtn在使用的启动子(efs与cmv)、ir/dr序列和转座子货物的方向上不同。每种转座子含有编码通过2a与抗药性基因嘌呤霉素连接的mcherry的相同盒,使得可以通过荧光和/或采用嘌呤霉素的选择来鉴定经转染的细胞。用10种tcbtn之一和tcb野生型转座酶转染hek-293t细胞(比例为1个转座子:1个转座酶)。通过在转染后检测mcherry荧光10-30天,通过流式细胞术评估转基因的稳定整合(图1b)。
发现在实验条件下,与efs相比,使用cmv启动子大大增强了转基因mcherry的稳定表达。转座似乎仅在使用序列1ir/dr时发生。还发现,与正向方向相比,货物在反向方向上的转录促进了更大的转座活性。
通过流式细胞术,tcbtn-8在所测试的10种tn中显示出最大的转座效率。为了证实tcbtn-8的转座效率,用tcbtn-8与wt转座酶或v596a突变转座酶转染hek-293t细胞。转染后两天,将细胞以3,000个细胞/孔的密度与嘌呤霉素(1μg/ml)一起一式三份重新接种于6孔板中的dmem完全培养基中。在选择两周后,在药物选择下存活的每个细胞形成集落,评估其mcherry表达(图3a),并计数,以确认转基因的稳定整合(图3b至图3c)。通过hek-293t细胞中mcherry和嘌呤霉素抗性集落的表达证实了tcb-tn8的转座效率。
实施例3.示例性转座酶突变体
该研究的目的是生成tcbuster转座酶突变体并检查它们的转座效率。
为此,发明人通过比较野生型tcb转座酶与其它类似转座酶的cdna和氨基酸序列产生了共有序列。为了进行该比较,通过比对13种类似的转座酶而重建sleepingbeauty,通过比对来自8种不同生物体的spin样转座酶来重建spin。spin和tcbuster是丰富的hat转座酶家族的一部分。
hat转座子家族由两个亚家族组成:ac,如hobo、hermes和tol2,以及buster亚家族,如spin和tcbuster。将tcbuster的氨基酸序列与ac和buster亚家族成员的氨基酸序列进行比对,以鉴定在tcbuster中不保守的关键氨基酸,其可能是高活性置换的靶标。tcbuster与ac亚家族成员hermes、hobo、tag2、tam3、herves、restless和tol2的比对使我们能够鉴定tcbuster中可以被置换的高保守区域内的氨基酸(图4)。此外,tcbuster与buster亚家族的序列比对导致可以被置换的更多候选氨基酸(图5)。使用包含表7中列出的位点突变的寡核苷酸产生候选tcb转座酶突变体。然后对突变体进行序列验证,将其克隆到pcdna-dest40表达载体(图6)中,并在转染前进行小量制备。
表7
为了检查tcb转座酶突变体的转座效率,用tcbtn-8(mcherry-嘌呤霉素盒)与wt转座酶或v596a突变转座酶或候选转座酶突变体一式两份转染hek-293t细胞。细胞在dmem完全培养基中生长(没有药物选择),并且在转染后第14天通过流式细胞术评估mcherry表达。鉴定出超过20种转座效率高于野生型转座酶的tcb转座酶突变体(图7)。发现在这些检查的突变体中,与含有相应单置换的突变体相比,含有d189a、v377t和e469k这三个氨基酸置换的组合的一种突变转座酶导致转座活性的显著增加。具有高转座活性的突变体还包括k573e/e578l、i452f、a358k、v297k、n85s、s447e、e247k和q258t等。
在这些检查的突变体中,发现在邻近催化三联体氨基酸(d234、d289和e589)之一处向带正电荷的氨基酸如赖氨酸(k)或精氨酸(r)的大多数置换增加了转座。另外,去除正电荷或添加负电荷减少了转座。这些数据提示,靠近催化域的氨基酸可能有助于促进tcb的转座活性,特别是当这些氨基酸被突变为带正电荷的氨基酸时。
高活性tcbuster突变体d189a/v377t/e469k的氨基酸序列(seqidno:78)示于图12中。将进行对该突变体的进一步突变分析。如图13所示,构建tcbuster突变体d189a/v377t/e469k/i452f(seqidno:79)。如图14所示,构建tcbuster突变体d189a/v377t/e469k/n85s(seqidno:80)。如图15所示,构建tcbuster突变体d189a/v377t/e469k/s358k(seqidno:81)。如图16所示,构建tcbuster突变体d189a/v377t/e469k/k573e/e578l(seqidno:13)。在图12-16的每幅图中,tcbuster的结构域表示如下:znf-bed(小写字母),dna结合/寡聚化域(粗体字母),催化域(带下划线的字母),插入域(斜体字母);核心d189a/v377t/e469k置换以较大号粗体、斜体且带下划线的字母表示;而另外的置换以大号粗体字母表示。如已经描述的那样测试这些构建体中的每一种,并且预期它们与野生型tcbuster相比显示出高活性。
实施例4.含有标签的示例性融合转座酶
该研究的目的是生成并检查融合tcbuster转座酶的转座效率。例如,蛋白质标签gst或pest域与tcbuster转座酶的n末端融合,以生成融合tcbuster转座酶。使用由seqidno:10编码的柔性连接体ggsggsggsggsgts(seqidno:9)将gst域/pest域与tcbuster转座酶分隔开。该柔性连接体的存在可以使融合蛋白中的非特异性相互作用最小化,从而增加其活性。如上所述用tcbtn-8转染示例性融合转座酶,并通过流式细胞术在第14天通过mcherry表达测量转座效率。转座效率不受gfp或pest域的标记的影响(图9),提示融合该转座酶dna结合域以引导tcbuster货物整合至选定的基因组位点如安全港位点,可能是tcbuster的可行选择,允许更安全的整合概况。
实施例5.包含tale域的示例性融合转座酶
该研究的目的是生成包含tale域的融合tcbuster转座酶并检查该融合转座酶的转座活性。将tale序列(seqidno:11)设计为靶向人类基因组的人aavs1(haavs1)位点。因此,tale序列与野生型tcbuster转座酶(seqidno:1)的n末端融合以生成融合转座酶。使用由seqidno:12编码的柔性连接体gly4ser2来分离tale域和tcbuster转座酶序列。示例性融合转座酶具有氨基酸序列seqidno:8。
借助于电穿孔,用如上所述的tcbtn-8将示例性融合转座酶转染到hela细胞中。该tcbtn-8包含报道基因mcherry。转染效率可在转染后2天通过流式细胞术检查,其对mcherry阳性细胞进行计数。此外,进行新一代测序以评估基因组中的mcherry基因插入位点。预期所设计的tale序列可以介导mcherry基因在haavs1位点附近的基因组位点处的靶标插入。
实施例6.原代人t细胞中的转座效率
该研究的目的是开发tcbuster转座子系统,以对原代cd3+t细胞进行工程化。为此,发明人将携带gfp转基因的示例性tcbuster转座子引入小环质粒中。用tcb小环转座子和rna转座酶如wttcbuster转座酶以及如实施例2所述选择的示例性突变体对活化的cd3+t细胞进行电穿孔。在电穿孔后通过流式细胞术监测转基因表达21天。
发现与wttcbuster转座酶和v596a突变转座酶相比,在转染后14天,使用示例性突变体v377t/e469k和v377t/e469k/d189a使tcb转座子的转座改善了近两倍(图10a)。此外,与sb11(平均值=8.4)相比,高活性突变体v377t/e469k和v377t/e469k/d189a的平均转座效率分别为2倍(平均值=20.2)和3倍(平均值=24.1)有效。
接下来,在电穿孔后两天用小环tcb转座子和rna转座酶评估cd3+t细胞的活力。发现当用tcb小环和rna转座酶转染cd3+t细胞时,活力适度降低;然而,细胞到第7天迅速恢复活力(图10b)。这些实验证明了根据本公开内容一些实施方案的tcbuster转座子系统在原代t细胞的细胞工程化中的能力。
实施例7.用于治疗癌症患者的嵌合抗原受体修饰的t细胞的生成
可以将含有上述tcbtn-8构建体的小环质粒设计成在转座子的反向重复序列之间携带嵌合抗原受体(car)基因。可以将该car设计成对b细胞抗原cd19具有特异性,其与cd137(t细胞中的共刺激受体[4-1bb])和cd3-zeta(t细胞抗原受体的信号转导组分)信号域偶联。
自体t细胞从癌症例如白血病患者的外周血中获得。可以通过裂解红细胞并通过percolltm梯度离心消耗单核细胞来分离t细胞。可以使用抗cd3/抗cd28缀合的珠子,如dynabeadm-450cd3/cd28t,通过流式细胞术分离cd3+t细胞。根据gmp指南,在标准条件下培养分离的t细胞。
如上所述,使用包含氨基酸置换v377t、e469k、d189a、k573e和e578l的突变tcbuster转座酶(seqidno:13)和包含car的tcbustertn-8转座酶进行原代t细胞的遗传修饰。在该突变tcbuster转座酶和含car的tn-8转座酶的存在下,对t细胞进行电穿孔。转染后,用免疫刺激试剂(如抗cd3抗体和il-2、il-7和il-15)处理t细胞以供活化和扩充。转染的验证在转染后2周通过新一代测序进行。可以确定经转染的t细胞中的转染效率和转基因负荷,以帮助设计治疗方案。如果测序结果发现有风险的转基因插入位点,也将采取某些措施来消除任何安全性问题。
在确认转基因插入和嵌合抗原受体修饰的t细胞(car-t细胞)体外扩充至临床所需水平后,开始将car-t细胞输注回癌症患者。
输注剂量取决于许多因素,包括但不限于癌症的阶段、患者的治疗史和cbc(全血细胞计数)以及患者在治疗当天的生命体征。输注剂量可以逐步升高或逐步降低,这取决于疾病的进展、患者的排斥反应和许多其它医学因素。同时,在治疗方案期间,进行定量聚合酶链反应(qpcr)分析以检测血液和骨髓中的嵌合抗原受体t细胞。qpcr分析可用来作出关于给药策略和其它治疗计划的医学决策。
表8氨基酸和核苷酸序列
尽管在此已经示出并描述了本发明的优选实施方案,但对于本领域技术人员明显的是,这些实施方案仅以示例的方式提供。本领域技术人员在不脱离本发明的情况下现将想到许多变化、改变和替代。应当理解,本文描述的本发明实施方案的各种替代方案可用于实施本发明。意欲以下述权利要求限定本发明的范围,并由此涵盖这些权利要求范围内的方法和结构及其等同物。
- 还没有人留言评论。精彩留言会获得点赞!