一种生物大分子上游分阶段截留的生产方法、生产模块及在生产中的应用与流程
本发明属于生物制品生产领域,更具体地,涉及到生物大分子的工业化生产,特别是多肽、融合蛋白或免疫球蛋白的上游工艺制备。
背景技术:
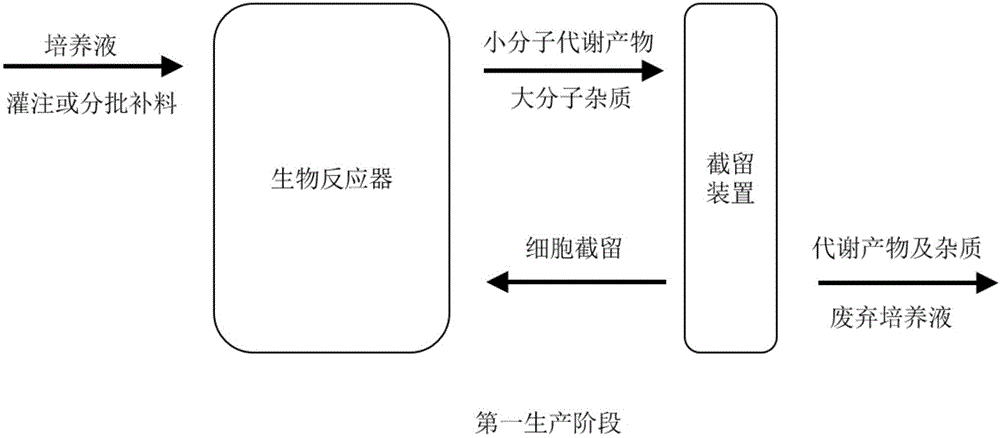
:生物大分子,特别是融合蛋白与免疫球蛋白分子是当今生物制药领域的热点,其生产需要经过细胞培养的上游工艺制备,再从细胞培养液中获得、纯化、精制、浓缩的下游工艺制备过程,以及将抗体分子置于适于人体的制剂溶液的制剂工艺制备三个主要步骤。在上游工艺中用于生产重组蛋白的表达体系主要是建立在哺乳动物细胞培养体系中,一般从工作细胞库的单个储存管的细胞活化开始,经过三角瓶,2升,10升,50升,然后到500升的细胞反应器生产。由于细胞培养过程中所涉及的培养基成分多达70-80种,且在细胞培养过程中还可能在细胞反应其中积累分泌的蛋白酶类、小的细胞碎片及宿主细胞蛋白、dna、rna分子等多种杂质。同时,还包括残缺的抗体分子或者由于氧化还原造成电荷分布不一样的抗体分子等,因此下游工艺中需要使用离心法和深层过滤去除细胞后,再用蛋白a亲和层析法完成抗体的收获,这一步骤的产品收率大于95%,但此时不仅收获了绝大多数带有fc片段的完整抗体分子,还同时将残缺的抗体分子等和产品性质相关的杂质一并收获从而导致在其后的纯化和精制步骤中操作难度很大。因此,在这样的情况下,为了保证产品的高质量,或者不同生产批次的相似性,下游工艺的纯化和精制步骤往往是以牺牲产率作为结果的。现有的生物大分子的大规模工业生产的上游细胞培养阶段常采用灌注培养(perfusionculture)与分批补料培养(fed-batchculture)两种形式,再结合不同的细胞截留工艺,以实现高密度的细胞培养,同时达到细胞培养液中杂质的过滤。atf技术(alternatingtangentialflowfiltration,交替切向流过滤)是一种最先进的截留工艺,这是一种保证对细胞低剪切力、较大的过滤面积且强的抗堵塞能力的过滤系统,可以实现高密度的细胞过滤培养。然而,在实际操作过程中,由于细胞的不断生长,会在细胞大规模培养过程中累积产生除了表达蛋白之外的不同性质的代谢产物或产品相关杂质,如在细胞培养的初期主要在培养基中累积细胞代谢产物,同时在细胞大量扩展初期的培养条件下,会在培养基中产生少量的抗体产物,这部分的抗体产物易于受初期培养温度较高等条件影响,发生脱氨或降解等变化,成为产品相关物质或杂质。这些代谢产物和产品相关杂质随着细胞与期望蛋白的浓度升高,将会直接影响最终蛋白产物的产量和纯度,更将影响蛋白产物的天然构象,可能造成高浓度蛋白的相互聚集,造成企业后期处理重大的成本和时间上投入,乃至不可挽回的损失。因此,现有生物大分子在上游生产工艺中的局限使得企业中难以在短时间内按时间表实现高质量,高速度和高产出转化为产品,故亟待寻求一种生产解决方案,用于克服在上游生产阶段细胞培养过程中的代谢产物和产品相关杂质对生产的影响问题。技术实现要素:本发明提供了一种生物大分子上游生产过程中分阶段截留的生产方法、配合该方法使用的生产模块以及该方法/模块在工业化生产多肽、融合蛋白以及免疫球蛋白分子上的应用,利用该方法,可以有效地实现大规模重组蛋白上游工艺的效率、产量和纯度的提高。本发明的第一方面,提供了一种生物大分子上游分阶段截留的生产方法,包括使用生物反应器结合截留系统的生产方式,所述方法至少包含两个生产阶段,在第一生产阶段,使用包含第一过滤模块的截留系统,所述的第一过滤模块包含有滤孔为0.05μm-1μm的过滤组件;在第二生产阶段,使用包含有第二过滤模块的截留系统,所述的第二过滤模块包含有滤孔的截留分子量相对于产物分子量1/15~2/3过滤组件。在一优选实施例中,所述的第一过滤模块包含有滤孔为0.1μm-0.5μm,优选地为0.2μm-0.3μm的过滤组件。在一优选实施例中,所述的第二过滤模块包含有滤孔的截留分子量相对于产物分子量的2/15~7/15,优选地1/5~1/3的过滤组件。在一优选实施例中,所述产物的分子量为50~300kd;优选地,所述产物的分子量为100~250kd;更优地,所述的产物分子量在150~200kd。所述的第一生产阶段为细胞的初始增殖阶段,或可称为产物合成优化阶段。由于初始环境中培养温度较高(37℃),细胞处于高速增殖阶段,大量的细胞代谢废物、乳酸产物以及少量脱氨或降解的抗体杂质容易累积。所述的第二生产阶段为产物合成与收集阶段,本发明人意外发现,在清除了第一生产阶段中产生的代谢产物和杂质后,更有利于第二生产阶段高质量产物的合成和收集,因此,创造性地引入了分阶段截留体系,以期提高后期产物的质量和产率。在一优选实施例中,第一生产阶段中,所述的截留系统主要截留细胞,去除代谢产物及杂质;第二生产阶段中,所述的截留系统主要截留细胞且富集蛋白产物,去除小分子代谢产物。在一实施例中,在生物大分子上游生产中,第一生产阶段可以在细胞接种到生物反应器后就开始启动。在另一实施例中,在生物大分子上游生产中,细胞培养密度达到6±1.5×106细胞数/毫升时,启动第一生产阶段。在另一实施例中,在生物大分子上游生产中,细胞培养密度达到10±5×106细胞数/毫升时,启动第一生产阶段。在一实施例中,所述的第二生产阶段的细胞培养密度不低于15±5×106细胞数/毫升;优选地,所述的第二生产阶段的细胞密度不低于35±5×106细胞数/毫升。在另一优选例中,所述的“培养密度不低于15±5×106细胞数/毫升”为培养密度10×106~30×106细胞数/毫升。在另一优选例中,所述的“培养密度不低于35±5×106细胞数/毫升”为培养密度30×106~50×106细胞数/毫升。在另一优选例中,所述的“培养密度不低于15±5×106细胞数/毫升”为培养密度10×106~300×106细胞数/毫升,直至培养到细胞活率下降到50%时,收获细胞发酵液,完成第二生产阶段;优选地,培养细胞的活力下降到70%时,收获细胞发酵液;更优地,培养细胞的活力下降到80%时,收获细胞发酵液;最优地,培养细胞的活力下降到90%时,收获细胞发酵液。在另一优选例中,所述的“培养密度不低于35±5×106细胞数/毫升”为培养密度30×106~100×106细胞数/毫升。在一实施例中,所述的第二生产阶段的细胞培养密度呈现相对稳定的趋势,其波动范围不高于10×106细胞数/毫升。在另一实施例中,所述的第二生产阶段的细胞培养密度呈递增趋势,其波动范围高于10×106细胞数/毫升。在另一实施例中,所述的“波动范围高于10×106细胞数/毫升”为波动范围10×106~290×106细胞数/毫升。在另一优选实施例中,所述的“波动范围高于10×106细胞数/毫升”为波动范围10×106~90×106细胞数/毫升。在一实施例中,所述的截留系统包括但不限于交替式切向流系统、切向流过滤系统、旋转过滤系统、深层过滤系统、离心机系统或沉降系统。在一实施例中,所述的生物反应器包括但不限于气升式生物反应器、机械搅拌式生物反应器、鼓泡塔式生物反应器、膜生物反应器。在另一实施例中,所述的生物反应器包括但不限于孵化摇床式、微型生物反应器、台式生物反应器、不锈钢生物反应器、玻璃生物反应器、一次性生物反应器、摇摆式生物反应器或多个并联罐体。在一实施例中,所述的培养细胞包括但不限于哺乳动物细胞、植物细胞、昆虫细胞和微生物细胞等适用于产业化发酵培养的表达体系;优选地,所述的哺乳动物细胞包括但不限于cho细胞、nso细胞、sp2/0细胞、hek细胞、bhk细胞等。在一实施例中,所述的生产工艺包括但不限于灌注培养、浓缩灌注培养、补料批次培养和浓缩补料批次培养。在一实施例中,细胞上游的生产过程,包括以下步骤:s1.活化待扩增的细胞,逐级放大培养至设定规格生物反应器中;s2.将含有第一过滤模块的截留系统配合生物反应器对细胞进行第一生产阶段的培养生产;s3.待细胞密度达到15±5×106细胞数/毫升时,更换为含有第二过滤模块的截留系统,进入第二生产阶段的培养生产。在一优选实施例中,待细胞密度达到35±5×106细胞数/毫升时,更换为含有第二过滤模块的截留系统,进入第二生产阶段的培养生产。在另一优选实施例中,待细胞密度达到55±5×106细胞数/毫升时,更换为含有第二过滤模块的截留系统,进入第二生产阶段的培养生产。s4.实施监测细胞生长活性,在培养细胞的活率下降到50%时,收获细胞发酵液,进入到下游的生产工艺中;优选地,培养细胞的活力下降到70%时,收获细胞发酵液;更优地,培养细胞的活力下降到80%时,收获细胞发酵液;最优地,培养细胞的活力下降到90%时,收获细胞发酵液。由于下游的生产纯化工艺是依赖不同生物分子产物的特性而设计的,在本发明一个优选实施例中,以赫赛汀的生物类似物的生产为例来说明分阶段截留体系生产在产率和产品质量的优点。在本发明的另一个优选实施例中,以阿瓦斯汀的生物类似物的生产为例来说明分阶段截留体系生产在产率和产品质量的优点。本发明的第二方面,提供了一种生物大分子上游分阶段截留的生产模块,所述生产模块可以结合到截留系统中,并配合生物反应器使用,包含有至少两个过滤模块,其中第一过滤模块包含有过滤孔径0.05μm-1μm范围内的过滤组件,用于去除细胞培养液中的代谢产物与产品杂质;所述的第二过滤模块包含有滤孔的截留分子量相对于产物分子量1/15~2/3范围内的过滤组件,用于收获和富集生物大分子产物。在一优选实施例中,所述的第一过滤模块包含有滤孔为0.1μm-0.5μm,优选地0.2μm-0.3μm的过滤组件,所述的第二过滤模块包含有滤孔的截留分子量相对于产物分子量的2/15~7/15,较佳地1/5~1/3的过滤组件。在一实施例中,所述的杂质过滤模块的过滤孔径为20-50kd分子的直径;更优地,所述的杂质过滤模块的过滤孔径为50kd分子的直径。所述的过滤组件从形态上包括但不限于中空纤维式、管式、卷式、平板式等。所述的过滤组件的材料为纤维素酯类或非纤维素酯类,所述的纤维素酯类材料包括但不限于醋酸纤维素、硝酸纤维素、乙基纤维素等;所述的非纤维素酯类包括但不限于聚砜(ps)、聚丙烯(pp)、聚乙烯(pe)、聚氯乙烯(pvc)、聚醚砜(pes)以及聚偏氟乙烯(pvdf)等材料。所述的生物反应器包括但不限于气升式生物反应器、机械搅拌式反应器、鼓泡塔式生物反应器、膜生物反应器等。在另一实施例中,所述的生物反应器包括但不限于孵化摇床式、微型生物反应器、台式生物反应器、不锈钢生物反应器、玻璃生物反应器、一次性生物反应器、摇摆式生物反应器或多个并联罐体。在一实施例中,所述的截留系统包括但不限于交替式切向流系统、切向流过滤系统、旋转过滤系统、深层过滤系统、离心机系统或沉降系统。所述的培养细胞包括但不限于哺乳动物细胞、植物细胞、微生物细胞、昆虫细胞等适用于大规模发酵培养的表达体系;优选地,所述的哺乳动物细胞包括但不限于cho细胞、nso细胞、sp2/0细胞、hek细胞、bhk细胞等。本发明的第三方面,提供了一种生物大分子上游生产分阶段过滤的生产模块/生产方法的应用,所述的生物大分子分阶段过滤生产模块/生产方法可以应用于生物大分子的工业化生产中。所述的生物大分子包括但不限于多肽或重组蛋白。优选地,所述的重组蛋白为免疫球蛋白或基因工程抗体,包括但不限于人鼠嵌合抗体、人源化抗体、全人抗体、fab片断、f(ab’)2、fv、scfv、单域抗体、双/多特异性抗体等。在另一优选例中,所述的重组蛋白为具有生物学活性的功能蛋白和fc段融合而成的新型蛋白。所述应用,适用于微生物培养、培养基、克隆或表达载体的筛选、小规模蛋白供应、工艺开发、优化与特性鉴定、种子扩大、生产等各个环节。附图说明图1、细胞上游第一生产阶段示意图。图2、细胞上游第二生产阶段示意图。具体实施方式针对现有技术中生物大分子上游生产工艺中效率低、产量低和纯度低的问题,本发明人经过深入的研究,意外发现在上游生产过程中采用分阶段的截留工艺,大大优化表达蛋白下游的生产质量,极大地提高高质量蛋白的产率。为了便于理解本发明,对本发明的关键参数进行定义:sec-hplc:分子排阻高效液相色谱法,产品纯度测定的方法之一,按照面积归一化法进行计算,分为单体、聚体(高分子量组)以及片段(低分子量组)。其中,单体的百分比越大,代表产品的纯度越高。cex-hplc:阳离子交换高效液相色谱法,产品电荷纯度测定的方法之一,用于反应产品的均一性问题,根据产品的电荷情况,分为酸性峰组、主峰以及碱性峰,其中,酸性峰或碱性峰的比例越高,代表产品的电荷异质化程度越高,产品均一性越差。rce-sds:还原毛细管凝胶电泳法,采用还原毛细管凝胶电泳,以高压电场为驱动力,产品经过还原后,依分子量的大小在毛细管内移动速度不同而进行分离,其中,重链+轻链的总和的比例越高,代表产品的纯度越高。nrce-sds:非还原毛细管凝胶电泳法,采用非还原毛细管凝胶电泳,以高压电场为驱动力,产品依分子量大小在毛细管内移动速度不同而进行分离,其中,单体的比例越高,代表产品的纯度越高。细胞活力/细胞活率:单位体积内活细胞占总细胞数量的比例。由于抗体在发酵过程中易于受到培养温度、培养时间、搅拌速率、ph等条件影响,发生脱氨、氧化、糖化、n-端焦谷氨酸环化等各种翻译后修饰变化,这些变化均会对抗体的电荷分布造成影响。这些翻译后修饰根据其发生的位置是否关键(比如是否发生在cdr区影响功能,是否发生在fcrn结合位点影响pk等)判定是否为关键质量属性。同时,电荷分布/电荷纯度是一种非常敏感的质量属性,可以作为工艺一致性评价非常好的指标,一直以来,对电荷异质体的控制都是抗体药物生产的重点和难点。本发明的优势在于保持产品的较高电荷纯度(减少可能有影响电荷的其他翻译后形式或降解形式),同时进一步保证产物在多批次大规模生产的电荷分布相似性。同时,细胞扩增阶段产生的物质如铵离子、蛋白酶、其他宿主蛋白、dna等,这些产物可能对细胞生长有影响,可能对产品质量特性有影响(如某些酶引起产品降解),同时大量的杂质代入产品收获液中,会大幅影响下游的纯化得率,也有可能无法完全去除,对产品的产量和质量都造成影响。另外,本发明的系统和方法还可以进一步解决存在于现有的补料培养系统中产品质量和均一性的问题,在大规模抗体生产领域中,由于分批补料模式下产品的杂质控制不稳定,常常将其切换为灌注培养,导致工艺的复杂性增大。本发明,可以解决分批补料模式下不稳定、产品相关杂质含量高的问题,无须进行工艺的切换就可以获得高质量的产物,是大规模抗体生产领域中的一大创新和进步。因此,本发明与现有技术相比,在细胞培养过程中,依次使用适合于杂质以及细胞代谢产物排出的第一过滤组件和适合于产品收集和富集的第二过滤组件,可以保证在产品截留阶段,在相对固定的细胞代次、密度、活力条件下,在较短的时间区域内,大规模和高产出生产抗体产品并收获产品,主要的技术优点包括:1)提高产品均一性,包括解决抗体生产中电荷异质的难题;2)去除细胞扩增阶段产生的代谢物、尤其是高分子量蛋白酶体等,降低这些代谢物在截留阶段对产品造成的影响,提高产品纯度和质量;3)去除细胞扩增前期阶段由于相对高温的培育条件而产生的小量抗体产物,这些早期产物在相对高的温度条件下,易发生降解,并作为产品相关杂质,进入产品。因此本发明有利于进一步降低产品相关的杂质,保证最终产品的高产量和高纯度;4)减少了生产周期,简化了下游生产工艺,为企业节约了成本。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下面实施例中未注明具体条件的实验方法,通常按照常规条件或《分子克隆试验指南》第三版的基本试验方法,或按照制造厂商所建议的条件。实施例1、基于分阶段截留的200l生物反应器的培养抗体本实施例用于生产的抗体是针对市售的治疗性抗体赫赛汀所开发的生物类似药的生产工艺,表达细胞系为中国仓鼠卵巢细胞(cho),单克隆抗体为igg1/kappa类型,其氨基酸序列与原研药赫赛汀相同(inn:trastuzumab,imgt编号:7637);其分子量为145kda。细胞上游第一生产阶段的流程示意图如图1,细胞上游第二生产阶段的流程示意图如图2。细胞复苏取出细胞冻存管直接手持浸入37℃恒温水浴中,并不时摇动使其尽快融化。从37℃水浴中取出冻存管,用75%酒精表面消毒后,在超净台里拧开冻存管,用无菌移液管吸出细胞悬液,放入已装有1ml预孵的cdfortichotmmedium基础培养基的15ml离心管中,摇匀;30~60秒后,补加2ml预孵基础培养基,摇匀;再过30~60秒,补加4ml预孵基础培养基,摇匀;等待30~60秒,将离心管以700rpm离心5min,弃上清;取2ml预孵基础培养基到离心管中,溶解沉淀细胞,再转入已装有8ml基础培养基的细胞培养瓶中,摇匀。扩增培养每隔2日取样计数,并进行一次扩增培养,培养基选用cdoptichotm培养基(生产厂家:thermofisher),扩增后使初始细胞密度重新回到6~10x105cells/ml。直到扩增体积达到10l反应器接种要求,细胞密度2.5~4.5x106cells/ml且存活率≥90%,具体控制参数如表1:表1摇床转速温度二氧化碳浓度120rpm37℃5%待接种至10lwave生物反应器中,执行每日取样,具体的控制参数如表2:表2温度ph溶解氧摇摆速度摇摆角度通气量37℃750%25rpm8°0.2l/分钟待培养3日后,进一步扩大生物反应器容积至50l,具体控制参数如表3:表3温度ph溶解氧转速培养时间37℃750%90rpm3天atf结合200l生物反应器的灌注培养本实施例中使用来自refinetechology的200l-交替式切向流系统,首先将atf装置中的中空纤维柱和底座顶端的隔膜组装好,再与真空泵和控制器连接好,将0.2um与50kd截留分子量的真空纤维膜组装到atf系统中,经过25%乙醇冲洗10min后再用去离子水反复冲洗,去除残留的乙醇,继而置于高温湿热灭菌柜中灭菌45min之后备用。将含有0.2um过滤组件的atf系统接入到200l的生物反应器中,待细胞在50l的生物反应器中培养3日后,接种至200l的生物反应器中,初始的细胞密度为1x106cells/ml具体控制参数如表4:表4培养温度ph溶解氧转速37℃750%90rpm待细胞密度生长至10x106cells/ml时,连通atf系统,并开启atf装置中的控制器和真空泵,根据细胞生长量和细胞生长的速度,来计算每天培养基交换的体积,来调节新鲜培养基进入的速度和培养废液排出的速度。待细胞密度生长至40~50x106cells/ml时,更换0.2μm过滤组件的atf系统为含有50kd截留分子量过滤组件的atf系统,继续启动atf装置中的控制器和真空泵,进入第二生产阶段。在一个优选实施例中,在细胞生长密度达到40~50x106cells/ml之前,提前将生物反应器的培养温度调节到34℃,ph值调节到6.9,保持50%的溶解氧,并将培养转速调节到125rpm(其结果呈现于表6)。在另一个优选实施例中,生物反应器温度和培养条件的调节可以与更换含有50kd截留分子量过滤组件的atf系统同时进行。在培育至细胞生长密度约为100x106cells/ml时收集上清。细胞澄清细胞培养液澄清大都采用离心或者微滤配合深层过滤来完成培养液中细胞和细胞碎片的去除。本实施例中,从200l生物反应器中获得细胞悬浮液经过4℃低温6000g离心15min后,去除细胞,保留细胞发酵液;继而使用目前普遍运用于细胞培养液澄清的深层过滤方式,它采用了疏松多孔的纤维素骨架结构,并填充了硅藻土成分,进样端的表面孔径成漏斗状,这些结构摈弃了传统微滤表面截留结构易造成阻塞、过滤效率低的缺点,又具备了离心机所没有的截留小体积细胞碎片的优势,同时依靠硅藻土的吸附作用,能截留dna和hcp。本实施例使用密理博公司的mx0hc10fs1深层过滤器,将离心液连接于蠕动泵后(蠕动泵选择方面只要能符合流速需求即可),用超纯水冲洗深层过滤膜,冲洗体积为10cv。然后深层过滤缓冲液25mmtris-hcl+100mmnacl,ph7.4±0.2冲洗深层过滤膜,冲洗体积为1cv,冲洗流速为100–300lmh。过滤细胞培养液并立即开始收集滤出液,过滤流速为100–300lmh。上样结束后,用深层过滤缓冲液25mmtris-hcl+100mmnacl,ph7.4±0.2顶洗过滤膜并收集滤出液,冲洗体积为2cv,过程中控制膜前压力不超过2bar。proteina亲和层析proteina亲和层析在抗体纯化中作为捕获步骤,对宿主蛋白、内毒素、dna都具有去除效果。本实施例中,proteina亲和层析填料为mabselectsure(生产厂商:ge)。深层过滤得到的上清液上样,流速为300cm/h,层析柱载量保证小于35mg/ml填料。上样完毕后切换至淋洗液25mmtris-hcl,50mmnaclph7.4以300cm/h流速冲洗层析柱5cv。之后进行洗脱操作,洗脱液为100mm乙酸-乙酸钠(ph3.6±0.2,导电率0.9±0.2ms/cm),流速为300cm/h。uv280进行检测,uv280读数升至0.1au开始收集洗脱峰,再次降至0.5au值时停止收集。进行三个循环的proteina亲和层析。病毒灭活与灭活后的深层过滤本实施例的病毒灭活采用低ph孵育亲和层析后的洗脱峰,以使逆转录病毒和有包膜的病毒失活。用10%乙酸调节亲和层析的洗脱液至ph3.6-3.8,灭活60-120min。病毒灭活后的样品使用密理博公司的mx0hc10fs1深层过滤器进行深层过滤:使用前用超纯水冲洗10cv,缓冲液50mm乙酸-乙酸钠,ph5.2冲洗1cv的深层过滤膜,冲洗完毕之后连接管道进行样品过滤,流速100-300lmh,过滤压力小于2bar,上样完毕后,用缓冲液50mm乙酸-乙酸钠,ph5.2冲洗1cv继续冲洗深层过滤膜2cv,并回收冲洗滤出液。阳离子交换层析为进一步去除产品中的杂质以及dna、内毒素,本实施例在病毒灭活和深层过滤中采取了3个循环的阳离子交换层析,阳离子交换层析选取fractogelemdcoo-(m)(生产厂商:默克)。平衡液(50mm乙酸-乙酸钠,ph5.2)平衡层析柱3cv,将样品上样,流速为120cm/h,层析柱载量保证小于45mg/ml填料。上样完毕后切换至平衡液180cm/h流速冲洗层析柱5cv。之后进行洗脱操作,洗脱液为:50mm乙酸-乙酸钠和300mm氯化钠,ph5.2,平衡液和洗脱液0-100%梯度洗脱10cv,流速为180cm/h,洗脱过程中收集洗脱样品。阴离子交换层析采用阴离子交换层析以有效去除样品中的痕量的杂质如各种病毒,dna,内毒素等。由于单克隆抗体的高等电点,通常阴离子交换层析采用流穿模式即杂质会与填料结合而目标蛋白通过层析柱流出不与其结合。本实施例的阴离子交换层析选用captoq(生产厂家:ge),预平衡液(50mmtris-hcl+1mnacl,ph8.0)平衡层析柱2cv,之后用平衡液(50mmtris-hcl,ph8.0)平衡层析柱3cv,样品上样,流速180cm/h,收集流穿uv280读数升至0.1au开始收集洗脱峰,层析柱载量保证小于40mg/ml填料。上样完毕后切换至平衡液180cm/h流速冲洗层析柱3cv,uv280降到0.1au时停止收集样品。病毒过滤病毒过滤可以用来去除无包膜的病毒,在生产过程中采用1.02m2/批的病毒过滤膜进行过滤。使用的是压力罐,0.5mnaoh处理,注射用水洗净后接上压缩空气进行过滤。本实施例中使用vpmg201nb1(生产厂家:merckmillipore)进行深层过滤,使用前用超纯水冲洗10cv,缓冲液50mm乙酸-乙酸钠,ph5.2冲洗2cv的深层过滤膜,冲洗完毕之后连接管道进行样品过滤,流速100-300lmh,过滤压力为1.9-2.0bar,上样完毕后,用缓冲液50mm乙酸-乙酸钠,ph5.2冲洗1cv继续冲洗深层过滤膜2cv,并回收冲洗滤出液。超滤换液将型号为p2c030c25(生产厂家:merckmillipore)孔径为30kd的超滤膜包清洗干净,并用20mm磷酸钠ph6.0缓冲液冲洗至膜后端ph为6.0。将蠕动泵泵入超滤膜,控制进口端流速为200lmh,跨膜压力为0.35bar,使用20mm磷酸钠ph6.0缓冲液进行换液,收获抗体产物。对照例1、基于单一截留法的200l生物反应器培养基本的实施方式同实施例1,区别在于:待细胞密度生长至10x106cells/ml时,连通atf系统,并开启atf装置中的控制器和真空泵。所使用的atf系统为包含有50kd截留分子量的真空纤维膜组组件,一直培养至细胞生长密度约为100x106cells/ml时完成发酵步骤。后续的纯化步骤同实施例1。在完成proteina亲和层析后,分别对实施例1和对照例1所获得的样品取样进行阳离子高效液相色谱分析,来考查电荷异构体的含量,其中,酸碱峰的分布的结果如表5:表5从表5可以明显看出,分阶段截留法获得的抗体产物具备相对于单一截留法的抗体产物更优秀的电荷纯度,中性峰的含量更高,酸性峰的含量更低。在完成产品纯化后,再对这两种上游生产工艺的终产品进行比较,也可以发现,单一截留法生产的终产物的酸性峰的比例获得了一定的改善,但是改善的程度不佳,反应在生物学活性上,分阶段截留法表现出明显优于单一截留法的生物学活性,同时,分阶段截留法获得合格的终产物的产量高;而单一截留法获得的合格的终产品的产率显著更低,详见表6。表6实施例2、基于分阶段截留的2l生物反应器培养抗体本实施例中,用于生产的抗体是重组抗血管内皮生长因子(vegf)人源化单克隆抗体,在体外哺乳动物细胞中发酵表达而得到,动物细胞为中国仓鼠卵巢细胞(cho),单克隆抗体为igg1/kappa类型,其氨基酸序列与原研药阿瓦斯汀相同(inn:bevacizumab,imgt编号:8017,http://www.imgt.org/mab-db/);其分子量为149kda。细胞复苏与2l生物反应器atf灌注培养细胞复苏的步骤同实施例1。使用常规的细胞培养工艺进行种子细胞培养:当细胞密度达到4.0~6.5x106cells/ml,活率≥90%时满足接种要求,将种子细胞无菌接种到含有cdfortichotmmedium基础培养基的2l生物反应器中培养。接种后细胞密度为1.0x106cells/ml,活率≥90%。初始细胞培养条件为:培养温度37℃,搅拌转速95rpm,ph:7.20±0.05,溶解氧:50%。使用来自refinetechology的atf系统,首先将atf装置中的中空纤维柱和底座顶端的隔膜组装好,再与真空泵和控制器连接好,先安装孔径为0.2μm的中空纤维柱顶端与反应器连接的管道,待细胞在生物反应器中培养至细胞密度4.5~5.5x106cells/ml时,将atf装置中的控制器和真空泵开启,根据细胞生长量和细胞生长的速度,来计算每天培养基交换的体积,来调节新鲜培养基进入的速度和培养废液排出的速度。在每天灌流体积达到预期设定的情况下,若葡萄糖不够,适当的额外补充30%的葡萄糖溶液。当细胞密度达到65±5×106cells/ml时,将培养温度降低为32℃,ph降为7.00±0.05;待细胞密度进一步增加到95±5×106cells/ml时,将处理过的无菌的50kd真空纤维膜替换掉原0.2μm的中空纤维膜,进入第二生产阶段,维持细胞密度在10×106cells/ml的范围内,一直到细胞活力开始下降到90%,终止生物反应器的培养,收集细胞培养液。在一实施例中,收集细胞培养液的时机控制在细胞活力下降到80%时;在另一实施例中,收集细胞培养液的时机控制在细胞活力下降到70%时;在另一实施例中,收集细胞培养液的时机控制在细胞活力下降到50%时。细胞澄清本实施例将深层过滤膜(d0hc(货号md0hc10fs1,厂家:默克)连接于蠕动泵后(蠕动泵选择方面只要能符合流速需求即可),用超纯水冲洗深层过滤膜,冲洗体积为10cv。然后深层过滤缓冲液25mmtris-hcl+100mmnacl,ph7.4±0.2冲洗深层过滤膜,冲洗体积为1cv,冲洗流速为100–300lmh。过滤细胞培养液并立即开始收集滤出液,过滤流速为100–300lmh。上样结束后,用深层过滤缓冲液25mmtris-hcl+100mmnacl,ph7.4±0.2顶洗过滤膜并收集滤出液,冲洗体积为2cv,过程中控制膜前压力不超过2bar。proteina亲和层析proteina亲和层析填料为jwt203(生产厂商:jsr)。深层过滤得到的上清液上样,流速为300cm/h,层析柱载量保证小于35mg/ml填料。上样完毕后切换至淋洗液25mmtris-hcl,50mmnaclph7.4以300cm/h流速冲洗层析柱5cv。之后进行洗脱操作,洗脱液为100mm乙酸-乙酸钠(ph3.6±0.2,导电率0.9±0.2ms/cm),流速为300cm/h。uv280进行检测,uv280读数升至0.5au开始收集洗脱峰,再次降至0.5au值时停止收集。样品于室温调节ph值至3.5-3.7,1-2小时进行低ph病毒灭活工序。阴离子交换层析粗纯后的样品经过精纯层析后制备原液。阴离子交换层析选取captoq填料(生产厂商:gehealthcare)。预平衡液(50mmtris-hcl+1mnacl,ph8.0)平衡层析柱2cv,之后用平衡液(50mmtris-hcl,ph8.0)平衡层析柱3cv,样品上样,流速为240cm/h。收集流穿uv280读数升至0.1au开始收集洗脱峰。层析柱载量保证小于40mg/ml填料。上样完毕后切换至平衡液240cm/h流速冲洗层析柱3cv。uv280降至0.1au停止收集。阳离子交换层析收集样品进入下一步阳离子交换层析,阳离子交换层析选取fractogelemdcoo-(m)(生产厂商:默克)。平衡液(50mm乙酸-乙酸钠,ph5.2)平衡层析柱3cv,将gb222样品上样,流速为180cm/h,层析柱载量保证小于45mg/ml填料。上样完毕后切换至平衡液180cm/h流速冲洗层析柱5cv。之后进行洗脱操作,洗脱液为:50mm乙酸-乙酸钠和300mm氯化钠,ph5.2,平衡液和洗脱液0-100%梯度洗脱10cv,流速为180cm/h,洗脱过程中收集洗脱样品。超滤换液精纯后的样品经过超滤换液,步骤为:将型号为p3c030c05,孔径为30kd(生产厂家:默克)的超滤膜包清洗干净并用20mm磷酸钠ph6.0缓冲液冲洗至膜后端ph为6.0。将阳离子层析样品用蠕动泵泵入超滤膜进行超滤浓缩,控制进口端流速为300lmh,跨膜压力为0.3~0.7bar,初次浓缩至约20mg/ml,之后用20mm磷酸钠ph6.0缓冲液进行10倍等体积换液,结束后进行排空超滤膜回收蛋白,即为原液。对照例2、基于单一截留法的2l-atf系统的抗体的生产同样使用来自refinetechology的atf系统,首先将atf装置中的中空纤维柱和底座顶端的隔膜组装好,再与真空泵和控制器连接好,安装孔径为50kd的中空纤维柱顶端与反应器连接的管道置于25%的乙醇中,按照实施例1的方法进行灭菌消毒。细胞培养基本条件如实施例2,主要区别在于:待细胞密度生长至4.5~7.5x106cells/ml时,连通atf系统,并开启atf装置中的控制器和真空泵。所使用的atf系统为包含有50kd截留分子量的真空纤维膜组组件,一直培养至细胞活性下降到90%时终止反应。后续的纯化步骤同实施例2。单一截留法细胞培养第10天时取细胞培养液进行初步分析,其酸性峰含量为26%左右,而分阶段截留法培养第10天酸性峰只有10%左右;在完成后续的纯化步骤时,分阶段截留法生产工艺获得的终产物的酸性峰含量也低于单一截留法。经过超滤换液后,对sec-hplc的要求是抗体单体的纯度>95%,而在3个单一截留法生产批次中,所检测的抗体单体的数值仅为93%、92.8%与93%,大大低于实施例2中所用的分阶段截留法的收率。因此,除了产率上的优越,分阶段截留工艺生产出来的样品在电荷纯度以及分子大小纯度上都明显优于单一截留法的产物。对样品的参数进一步分析对比的结果如下表7:表7实施例3、在不同细胞生长密度下执行分阶段截留的上游生产进一步研究发现,分阶段截留工艺可适用的细胞密度可以低至15±5×106细胞数/毫升,如在低密度细胞培养的条件下,在细胞密度达到15±5×106细胞数/毫升时就可以进入第二生产阶段,在细胞密度达到35±5×106细胞数/毫升时效果更佳。在上述的细胞密度下,进入第二生产阶段,终产品的产量以及产品电荷纯度上仍表现出明显优于传统单一截留工艺。以实施例2的抗体为例,如表8,在细胞密度15±5×106细胞数/毫升,其波动范围为10×106细胞数/毫升~20×106细胞数/毫升的情况下,或在细胞密度35±5×106细胞数/毫升,其波动范围为30×106细胞数/毫升~40×106细胞数/毫升的情况下为细胞密度的情况下单一截留法与分阶段截留法的对比。表8实施例4、不同分子量的产物的适用性本发明的分阶段截留的生产工艺还适用于不同分子量的蛋白产品的生产,以重组基因工程抗体为例,抗体fab区,平均分子量约50kd;双/多特异性抗体,其分子量可以达到近300kd,都在分阶段截留工艺中可以很好的适用。特别是双/多特异性抗体,结构复杂,常常伴有特别设计的突变,产品相关杂质的出现的可能性很高,因此,利用分阶段截留的上游生产工艺,在第一生产阶段,就将相关杂质通过较大的滤孔排除,更加利于后期的纯化与开发。由于蛋白产物的分子量差别较大,在本发明中,本发明人还摸索了两个生产阶段所使用的过滤组件的滤孔的范围,在第一生产阶段,0.05μm-1μm范围内的过滤组件就可以满足将小分子代谢产物以及大分子产品相关杂质清除,在一优选例中,使用0.1μm-0.5μm的过滤组件,可以更有效地提高清除效率以及产品收率;在第二生产阶段,本发明人以产物的分子量大小作为参照,当截留孔径设置为相对于产物分子量1/15~2/3范围内的过滤组件,可以实现较好的产物富集的效果,当截留孔径设置为相对于产物分子量2/15~7/15范围内时,产率更高,当截留孔径设置为相对于产物分子量1/5~1/3范围内时,富集抗体的产率最高。以上是根据本发明的优选生产形态通过实例对本发明进行了没有限制的描述,但应理解,本发明所述的分阶段截留的上游生产工艺可以结合到不同形态的生物反应器的培养中,或应用于现有的各种截留体系中使用,如切向流过滤系统(tff,tangentialflowfiltration)、旋转过滤系统、深层过滤系统、离心机系统或沉降系统等等。在所附权利要求书定义的范围内,任何变化和/或变型,都在本发明的保护范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1