一种消化液的制作方法
本申请涉及一种消化液,属于测试用样品制备
技术领域:
。
背景技术:
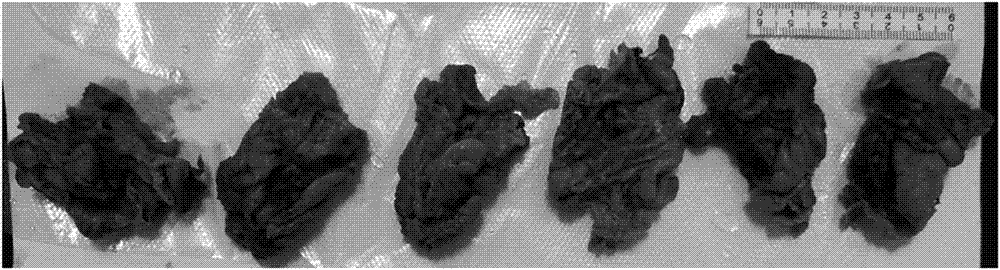
现有肿瘤淋巴结清扫离体组织标本通常是在福尔马林固定液中浸泡,这主要由于甲醛可以长时间并且很好的保存组织形态学结构特征,同时又具有良好的经济效用。此类标本处理方法虽然可以很好的固定组织的形态,但也使含有脂肪组织的标本变硬,在病理科取材特别是淋巴结取材时大大增加了难度。肿瘤淋巴结清扫离体组织标本中,彻底地淋巴结取材对肿瘤诊断分期、制定治疗方案及判断预后至关重要,而常规的固定液和现有的标本固定方法都无法满足在快速固定的同时提高淋巴结的取材速度和检出率,使得病理医生在长期的离体脂肪组织中手摸刀切式寻找淋巴结的方法存在取材不充分、操作时间长等诸多弊端,并最终影响病人的治疗方案、预后和转归。为解决现有肿瘤淋巴结清扫组织标本处理技术中存在的问题,临床实际工作中急需软化或者溶解脂肪的同时充分暴露和固定淋巴结、保持淋巴结组织结构和细胞形态完整的方法。基于此,做出本申请。技术实现要素:针对现有淋巴结检出技术所存在的上述缺陷,本申请提供一种全新的固定脂肪消化液,在消化和液化脂肪的同时,加大脂肪组织和淋巴结软硬度差,方便淋巴结取材。为实现上述目的,本申请采取的技术方案如下:一种消化液,包括以下浓度的各组分:蛋白酶k0.1-2mg/ml,胰蛋白酶1-100mg/ml,edta0.1-2mg/ml。进一步的,作为优选:所述消化液中,各组分的浓度分别为:蛋白酶k0.5mg/ml,胰蛋白酶25mg/ml,edta1mg/ml。具有上述特征的消化液还可以溶解于两种缓冲液中:一种是pbs缓冲液,ph7.4,主要作用是缓冲和维持反应体系的ph值及盐离子浓度。根据需要,还可以加1-10mmcacl2稳定酶活性所需双价阳离子。另一种是ph7.550mmtris-hcl缓冲液,还可加1-10mmcacl2,配制方法是6克的tris-base加水至900ml,用hcl调至ph7.5,还可以加cacl2至终浓度10mm。tris主要作用是缓冲和维持反应体系的ph值及盐离子浓度,cacl2稳定酶活性所需双价阳离子。上述消化液的制备方法如下:称取edta粉末溶于pbs中,在配置时调整溶液ph适宜,搅拌均匀,配置形成高浓度的edta母液;分别称取胰蛋白酶和蛋白酶k,溶解于缓冲溶液中后,将其按比例滴入edta母液,根据需要补充滴加pbs即可。将上述方法应用于肿瘤淋巴结离体标本的固定处理,其优点主要体现为:(1)本申请所提供的消化液,是具有消化和液化脂肪等作用的混合液,用于依次经“软脂固定液”固定、酸和碱处理过肿瘤淋巴结根治标本,能进入脂肪细胞发挥消化脂肪作用,可软化及液化经“软脂固定液”固定处理的标本,而淋巴结因表面致密结缔组织被膜固定保护而不受影响或影响轻微。(2)组织标本先上述消化液处理后,加大了脂肪组织和淋巴结之间的软硬度差,方便淋巴结取材,提高了工作效率和工作质量,也减少了病理科医生的解剖取材时间,为后期病理学科的室外质量控制提供了可能。(4)本申请使用消化液对淋巴结及多种组织标本的消化显著,提高了淋巴结的检出数目,精确淋巴结转移阳性率,商品化后在临床广泛推广应用中的作用尤其突出。附图说明图1为实施例3中固定液处理后的脂肪状态图;图2为实施例3中hcl/pbs处理后的脂肪状态图;图3为实施例3中naoh/pbs处理后的脂肪状态图;图4为实施例3中消化液处理后的脂肪状态图;图5为实施例3中不同留置方式处理后的脂肪状态图;图6为实施例3处理方法对淋巴结结构的影响对照图;图7-14为实施例4中样例1条件下的处理效果对照图;图15-19为实施例4中样例2条件下的处理效果对照图;图20、21为实施例4中样例3条件下的处理效果对照图;图22、23、24为实施例4中样例4条件下的处理效果对照图;图25、26、27为实施例4中样例5条件下的处理效果对照图;图28-35为实施例4中样例6条件下的处理效果对照图;图36-43为实施例4中样例7条件下的处理效果对照图;图44-49为实施例4中样例8条件下的处理效果对照图;图50-54为实施例4中样例9条件下的处理效果对照图。具体实施方式实施例1:不同组成的消化液构成本申请所提供的消化液的核心作用成分是消化酶,主要成分为蛋白酶k、胰蛋白酶和edta,在不同实施环境下,还可以选用pbs或tris-hcl的一种作为缓冲液,还可以加cacl2稳定酶活性,具体成分选择方式可参见表1所示。表1不同组成的消化液序号蛋白酶k胰蛋白酶edtapbstris-hclcacl21√√√---2√√√√--3√√√-√4√√√--√5√√√√√-6√√√√-√7√√√-√√8√√√√√√我们分别对核心构成成分的消化液(即表1中的序号1)以及补充成分进行测试,可以得到上述8种情况,相同组分采用相同浓度对同样的样品做平行试验,结果表明:核心构成成分的主要作用是破坏脂肪细胞膜,增加脂肪细胞膜的通脱性。但补充成分的作用也不容忽视,缓冲液用于缓冲和维持反应体系的ph值及盐离子浓度;cacl2提供稳定酶活性所需双价阳离子。本申请所提供的消化液具消化和液化脂肪等作用的混合液,用于依次经“软脂固定液”固定、酸和碱处理过肿瘤淋巴结根治标本,能进入脂肪细胞发挥消化脂肪作用,可软化及液化经“软脂固定液”固定处理的标本,而淋巴结因表面致密结缔组织被膜固定保护而不受影响或影响轻微。从而达到加大脂肪组织和淋巴结软硬度差,方便淋巴结取材,提高工作效率和工作质量的目的。因此,基于不同的消化目的和处理要求,可以选择上述不同构成的消化液进行消化处理。我们还对消化液中核心构成成分(蛋白酶k、胰蛋白酶和edta)与补充成分的浓度进行了实验,结果表明在消化液中,蛋白酶k0.1-2mg/ml,胰蛋白酶1-100mg/ml,edta0.1-2mg/ml,在这种情况下,三种核心作用成分可以很好的发挥协同与配合作用,达到理想的软脂同时保证淋巴结结构的效果,低于或者超出上述范围则会对软脂不充分或者破坏淋巴结结构;当进行补充成分的添加时,可保持上述三种核心作用成分添加量不变或者在上述范围内适当调整,补充成分的添加不宜过大,否则很容易造成固定液失衡,影响软化与溶解效果,因此,缓冲液pbs、tris-hcl浓度分别控制为1×和50mmcacl2的浓度为1-10mm(优选1mm)。实施例2:同时,在不同实施环境下,将其分别溶于不同的缓冲液中,以下分别以溶于pbs溶液和tris-hcl作为代表,进行消化液的作用说明。(1)pbs缓冲液:ph7.4,主要作用是缓冲和维持反应体系的ph值及盐离子浓度。另外,还可以加1-10mmcacl2,稳定酶活性所需双价阳离子。(2)ph7.550mmtris-hcl缓冲液,该制备过程中,可加入1-10mmcacl2,配制方法是:6克的tris-base加水至900ml,用hcl调至ph7.5,还可以加cacl2至终浓度10mm。tris主要作用是缓冲和维持反应体系的ph值及盐离子浓度,cacl2稳定酶活性所需双价阳离子。实施例3:使用效果对照本例中,取胃癌根治手术切除的新鲜脂肪组织及淋巴结,一式六份,依次经过如下处理:(1)固定液在室温下处理3小时,固定液是由以下浓度比的各组分构成:甲醛100ml/l,卵磷脂50g/l,无水乙醇250ml/l,丙酮250ml/l,去氧胆酸47.5g/l,甲醇250ml/l,pbs溶液1×,美兰0.1g/l;(2)以0.1nhcl/pbs溶液室温处理1小时;(3)0.1nnaoh/pbs溶液室温处理1小时;(4)消化液处理,25mg胰蛋白酶-1%edta/ml+蛋白酶k,37℃水浴4小时,并分别以0.5mg/ml、0.25mg/ml、0.1mg/ml、0.5mg/ml、0.25mg/ml、0.1mg/ml的蛋白酶k对六份样品进行平行试验,对上述处理各阶段的效果进行观察。在步骤(1)处理后的各组织标本仍然较硬,参见图1所示;步骤(2)处理后的各组织标本无明显改变,六份相互之间也没有差别,参见图2所示;步骤(3)处理后的各组织标本无明显改变,六份相互之间也没有差别,参见图3所示;步骤(4)处理后的组织标本,no.1和no.4两个样品的脂肪组织明显变软变薄,脂肪组织与淋巴结的硬度差显著,易于识别取材,其他样品软化程度不明显,参见图4所示。将上述四个步骤处理后的样品分别进行留置处理:置于本申请固定液中的样本仍然效果较好,但由于no.2和no.3的蛋白酶k浓度不足,no.1和no.4的留置效果较no.2和no.3为0.25mg/ml的留置效果好,而采用福尔马林固定液留置的no.5和no.6效果较差,具体参见图5所示。切取上述no.1方法得到的淋巴结组织,结果如图6所示,可以看出:经本方法处理淋巴结组织结构完整,细胞形态正常,免疫组化蛋白表达定位清楚,染色清晰。其中,上述消化液的制备方法如下:称取1gedta粉末溶于pbs中,在配置时适当加入几滴naoh至ph为8,搅拌均匀至溶液为100ml,配置成1%的edta母液。分别称取2.5g胰蛋白酶和50mg蛋白酶k,溶解于90mlpbs溶液中,滴入1mledta母液,滴加pbs至溶液总量100ml。固定液由以下步骤制备:称取pbs粉末和15ml蒸馏水混合均匀,得到7×pbs溶液,然后依次加入无水乙醇,甲醇,丙酮,甲醛,卵磷脂,去氧胆酸,美兰,定容至100ml,搅拌至混合均匀。实施例4:不同处理方法对照实验样例1常规福尔马林固定后脂肪组织(见图7)→弃固定液,pbs冲洗后,0.25n盐酸常温浸泡1小时(见图8,未见明显变化)→弃盐酸,pbs冲洗后2nnaoh常温浸泡1小时(见图9,均未见明显变化)→弃2nnaoh,pbs冲洗后不同消化液37℃恒温浸泡(蛋白酶k10mg/ml;蛋白酶k10mg/ml+胰酶25mg/ml+edta1%;蛋白酶k5mg/ml+胰酶25mg/ml+edta1%;蛋白酶k1mg/ml+胰酶25mg/ml+edta1%,自左向右依次形成样一、样二、样三、样四),每隔一小时进行观察(见图10,1h脂肪组织松软液化;见图11,2h脂肪组织松软液化;见图12,3h后样一脂肪溶解样二样三脂肪进一步软化,样四则仍然处于松软液化状态;见图13,4h后样一脂肪明显溶解,样二、样三、样四则组织部分溶解)→弃消化液,溶脂固定剂浸泡8小时(见图14,全部组织均溶解)。样例2固定、酸碱前处理同样例1→弃2nnaoh,pbs冲洗后以不同方式浸泡(常温固定液;37℃,蛋白酶k1mg/ml;37℃,蛋白酶k0.5mg/ml+胰酶25mg/ml+edta1%;37℃,蛋白酶k0.25mg/ml+胰酶25mg/ml+edta1%;37℃,蛋白酶k0.125mg/ml+胰酶25mg/ml+edta1%,自左向右依次形成样一、样二、样三、样四、样五),每隔一小时进行观察(见图15,1h未见明显变化;见图16,2h后,样二、样三组织稍显疏松,其余组未见明显改变;见图17,3h后样一未见明显改变,样二、三、四与两小时时相比更软化,样五未见明显改变;见图18,4h后样二组织部分溶解,样一、三、四与两小时时相比更软化,样五未见明显改变)→弃消化液,溶脂固定剂浸泡8小时(见图19,左边为样一、样四,右边为样二,样二消化四小时组织液化)。样例3固定、酸碱前处理同样例1→弃2nnaoh,pbs冲洗后1mg/ml蛋白酶k37℃恒温浸泡,ph不同(ph依次为6、7、8、9,自左向右依次形成样一、样二、样三、样四,3h后组织略软,6-9之间ph值无显著影响,见图20)→弃消化液,溶脂固定剂浸泡8小时(见图21,脂肪溶解效果不佳)。样例4固定、酸碱前处理同样例1→0.5mg/ml蛋白酶k+1%edta37℃恒温浸泡,加不同浓度胰蛋白酶(胰蛋白酶浓度依次为12.5mg/ml、12.5mg/ml、1.25mg/ml、1.25mg/ml,自左向右依次形成样一、样二、样三、样四,每小时观察一下:1h后,见图22组织较硬,未见明显变化;2h后,见图23脂肪疏松)→弃消化液,溶脂固定剂浸泡8小时(见图24,脂肪变硬,效果不良)。样例5固定、酸碱前处理同样例1→1mg/ml蛋白酶k+1%edta37℃恒温浸泡,加不同浓度胰蛋白酶(胰蛋白酶浓度依次为25mg/ml、25mg/ml、2.5mg/ml、2.5mg/ml,自左向右依次形成样一、样二、样三、样四,每小时观察一下:1h后,见图25未见明显变化;2h后,见图26脂肪疏松)→弃消化液,溶脂固定剂室温浸泡8小时(见图27,脂肪变硬,效果不良)。样例6新鲜脂肪组织分为四个样(见图28,自左向右依次为样一、样二、样三、样四)→样一、样二以固定液室温浸泡3h,样三、样四以formalin室温浸泡3h(见图29,四个脂肪均变硬)→样一、样三0.25nhcl室温处理,样二、样四不处理(见图30,硬度:样二>样四>样一>样三,脂肪硬韧韧,颗粒明显)→不同浓度naoh处理(见图31,样一、样三与样二、样四相比,无明显差异)→样一、样三采用37℃水浴1mg/ml蛋白酶k+25mg/ml胰蛋白酶-edta处理,样二、样四采用2nnaoh处理(6h后,见图32,样一、样三无明显差别,均变软,样二、样四仍硬)→样二、样四采用37℃水浴1mg/ml蛋白酶k+25mg/ml胰蛋白酶-edta处理,样一、样三不处理(9h后,见图33,样一、样二脂肪软化效果优于样三、样四,样一与样二、样三与样四无差别)→样一、样三采用溶脂固定液处理,样二、样四不处理(10h后,见图34,与9h时无明显差别)→样二、样四采用溶脂固定液处理,样一、样三不处理(8h后,见图35,固定4h效果优于3h,同等时间下溶脂固定液效果优于formalin)。样例7新鲜取材标本分为四个样(见图36,自左向右依次为样一、样二、样三、样四)→溶脂固定液室温浸泡3h(见图37,组织硬)→样一0.25nhcl室温处理,样二2nhcl室温处理,样三、样四不处理(1h后见图38,无明显变化)→样一、样四2nnaoh处理,样二、样三0.25nnaoh处理(见图39,无明显差异)→样一、样二采用37℃水浴1mg/ml蛋白酶k+25mg/ml胰蛋白酶-edta处理,样二、样四不处理(1h后,见图40,样一、样二脂肪软化,样三、样四脂肪无明显变化;4h后,见图41,样一、样二脂肪明显软化,纤维组织出现,样二效果最佳,样三、样四软化)→样一、样二溶脂固定液处理,样三样四不处理(5h后,见图42,样一、样二脂肪几乎全部溶解,样三、样四纤维组织出现,样四效果优于样三)→样三、样四采用溶脂固定液处理,样一、样二不处理(见图43,样一、样二、样三、样四均达到预期效果)。样例8新鲜取材标本分为十个样(见图44,第一行自左向右依次为样一、样二、样三、样四、样五,第二行自左向右依次为样六、样七、样八、样九、样十)→溶脂固定液室温浸泡4h(见图45,脂肪变硬)→0.1nhcl/pbs常温浸泡1h(见图46,无明显变化)→0.1nnaoh/pbs常温浸泡1h(见图47,无明显差异)→样一、样六酶k1mg/ml;样二、样七胰酶-edta25mg/ml;样三、样八胰酶-edta12.5mg/ml,酶k1mg/ml;样四、样九胰酶-edta2.5mg/ml,酶k1mg/ml;样五、样十胰酶-edta25mg/ml,酶k0.5mg/ml(4h后,见图48,均无明显变化)→溶脂固定液常温浸泡8h(见图49,样一、样六与样二、样七相比,酶k效果优于胰蛋白酶-edta;样二、样七与样五、样十比较,酶的联合使用效果佳)。样例9标本溶脂固定液常温浸泡3h(见图50,第一行自左向右依次为样一、样二、样三、样四、样五、样六,脂肪变硬)→pbs冲洗后.1nhcl/pbs室温浸泡1小时(见图51,无明显改变)→弃hcl,pbs冲洗后,0.1nnaoh/pbs室温浸泡1小时(见图52,无明显变化)→弃0.1nnaoh,pbs冲洗后,以下条件37℃恒温浸泡3小时,(均含胰酶25mg/ml,edta1%),不同浓度蛋白酶k处理(样一、样四0.5mg/ml,样二、样五0.25mg/ml,样三、样六0.1mg/ml,4h后,见图53,脂肪组织软化)→样一、样二、样三溶脂固定液常温浸泡8h,样四、样五、样六福尔马林常温浸泡8小时(见图54,样一、样四效果好,样二、样三效果较好,样五、样六效果差)。综上,消化液中各组分浓度较佳构成为:蛋白酶k0.1-2mg/ml(0.5mg/ml最佳),胰蛋白酶1-100mg/ml(最佳25mg/ml),edta0.1-2mg/ml(最佳1mg/ml)。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1