用于检测鸽副伤寒沙门氏菌的核酸、试剂盒及检测方法与流程
本发明属于生物技术领域,具体涉及一种用于检测鸽副伤寒沙门氏菌的核酸以及含有该核酸的试剂盒和检测方法。
背景技术
沙门氏菌是一种重要的食源性病菌,是威胁公众卫生安全的一种重要的致病菌,有2600多个血清型,该细菌能引起各种家禽和哺乳动物的传染病,也可引起人类疾病,是一种重要的人畜共患病病原。其中鼠伤寒沙门氏菌(salmonellatyphimurium)属于沙门氏菌b群。鼠伤寒沙门氏菌(哥本哈根变种)是鸽副伤寒病的病原菌,对幼鸽具有较强的致病性,然而,目前国内关于鸽源沙门氏菌的诊断研究较少,对该菌的检测主要依靠传统的培养方法(参见国标gb/t4789.4-2008),该方法需经选择性增菌培养,并通过生化反应及血清学试验鉴定,操作步骤复杂,不利于及时诊断病因,确定病源,控制病情的蔓延。另外,沙门氏菌血清学检测仍然是通过细菌与特异性抗体的凝集反应鉴别其o抗原和h抗原,根据white-kauffmann-leminor抗原表确定沙门氏菌的血清型。但该方法容易受试验人员主观因素影响,对某些血清型的鉴别容易混淆,甚至无法鉴别,必须通过常规的生化鉴定,这种常规的检测方法需要5至7天的时间,过程繁琐,耗时耗力,无法做到快速诊断和有效控制疫病,并在揭示病原菌之间联系方面存在较大缺陷。另外血清价格昂贵,在生产中难以推广应用。因此,越来越多的研究人员尝试应用新型技术进行沙门氏菌鉴定,从而使鉴定方法更加快捷而有效。
pcr方法检测病原菌时具有快速、灵敏、特异等优点,因此它作为检测病原的一种方法表现出巨大的潜力。在我国,有学者先后以鼠伤寒沙门氏菌fima、fimy、fljb等基因为目的基因,对鼠伤寒沙门氏菌进行特异性pcr检测,但是采用常规细菌分离鉴定pcr方法,操作步骤烦琐,结果准确性低。经对现有技术的文献检索发现,尚未发现与本发明的鸽副伤寒沙门氏菌pcr检测方法、来自鸽源的核酸序列有关报道。如何能快速、准确的检测并确诊病原是鸽副伤寒沙门氏菌病,对预防治理鸽副伤寒病有重要意义。
技术实现要素:
为了解决上述技术问题,本发明提供一种用于检测鸽副伤寒沙门氏菌的核酸,包括有特异性引物对或/和内参引物对,用该特异性引物进行检测鸽副伤寒沙门氏菌,直接从临床样品样品中检测鸽副伤寒沙门氏菌,与细菌分离比较检测步骤少,时间短,成本低,准确性高,更加具有实用性,检测结果特异,结果判定简单。
为实现上述目的,本发明采用以下的技术方案为:
一组用于检测鸽副伤寒沙门氏菌的核酸,包括鸽副伤寒沙门氏菌上游引物和鸽副伤寒沙门氏菌下游引物,所述鸽副伤寒沙门氏菌上游引物的核苷酸序列如seqidno.1所示,所述鸽副伤寒沙门氏菌下游引物的核苷酸序列如seqidno.2所示。
如上所述用于检测鸽副伤寒沙门氏菌的核酸,还包括用于检测沙门氏菌的内参核酸,包括内参上游引物和内参下游引物,所述内参上游引物的核苷酸序列如seqidno.3所示,所述内参下游引物的核苷酸序列如seqidno.4所示。
如上所述的用于检测鸽副伤寒沙门氏菌的核酸,还包括鸽副伤寒沙门氏菌阳性对照,所述鸽副伤寒沙门氏菌阳性对照含如seqidno.5所示的核苷酸序列。
本发明还提供了用于检测鸽副伤寒沙门氏菌pcr检测试剂盒,其包括如上所述的核酸。
其中,2×premix中含有pcr反应缓冲液、mg2+、dntp和taq酶。
本发明还提出了使用上述试剂盒检测鸽副伤寒沙门氏菌的方法,其包括以下步骤:
s1、提取待检样品基因组dna;
s2、对提取的所述基因组dna采用如上所述的试剂盒进行pcr扩增;
s3、琼脂糖凝胶电泳检测扩增产物,判断样品是否含有鸽副伤寒沙门氏菌。
如上所述的方法,优选地,在步骤s3中,所述判断的方法为:
如果电泳结果在463bp位置出现扩增条带,则说明样品中含有沙门氏菌;如果没有出现相应的463bp扩增条带,则样品中不含有沙门氏菌;如果电泳结果在613bp位置和463bp位置均出现扩增条带,则说明样品中含有鸽副伤寒沙门氏菌;如果没有出现相应的613bp扩增条带,则样品中不含有鸽副伤寒沙门氏菌。
扩增时,可采用鸽副伤寒沙门氏菌阳性对照作为模板进行扩增,同时设置灭菌水为阴性对照进行扩增,电泳结果应是鸽副伤寒沙门氏菌阳性对照在613bp位置出现扩增条带,阴性对照没有条带出现;如果阳性对照没有在对应位置出现扩增条带或阴性对照出现非特异性条带,说明所用试剂失效或被污染,应重新配制试剂或更换,重新进行检测,设置阳性对照和阴性对照用于保证检测结果的准确性。
如上所述的方法,优选地,在步骤s2中,所述pcr扩增所采用的检测体系为20μl反应体系包括:2×premix10μl,10μmol/l的上游引物、下游引物各0.5μl,模板溶液1.5μl,最后灭菌去离子水补足至20μl。
如上所述的方法,优选地,在步骤s2中,所述pcr扩增所采用的扩增程序为:先95℃预变性5min,之后开始扩增循环,每个循环的程序为:94℃变性30s,52℃退火30s,72℃延伸40s,循环共30个;循环结束后,72℃延伸7min,降温至16℃,结束。
更进一步的,本发明还提供了如上所述的核酸或如上所述的检测试剂盒在制备用于检测鸽副伤寒沙门氏菌试剂盒中的应用。
所述的试剂用于区别鸽副伤寒沙门氏菌及其他致病性沙门氏菌血清型和其它非沙门氏菌。
其中,优选地,所述的其他致病性沙门氏菌血清型包括鸡伤寒沙门氏菌、鸡白痢沙门氏菌、猪霍乱沙门氏菌和肠炎沙门氏菌血清型;其它非沙门氏菌包括大肠杆菌。
与现有检测技术相比较,本发明的有益效果在于:采用本发明提供的特异性引物用于检测鸽副伤寒沙门氏菌,内参引物对用于验证是否为沙门氏菌,其检测方法相比于其他检测方法具有明显优势。现有常规的细菌分离鉴定费时费力;平板凝集实验虽然简便,但容易出现假阳性。本发明建立的鸽副伤寒沙门氏菌多重pcr检测方法特异性好、灵敏度高、结果准确,该方法操作简单、快速、费用低,在普通的实验室均可以进行,整个检测过程只需半天就可以完成。而且本发明可用于检测某些抗血清不能检测出的菌株,弥补免疫检测的缺陷,更具实用性。
本发明的检测方法还便于在基层实验室中推广使用,完全可以满足在鸽场快速、特异性检测鸽副伤寒沙门氏菌的需求,对于疫情的诊断和控制具有十分重要的作用,从而最大程度地避免了经济损失及对公共健康造成的危害。
附图说明
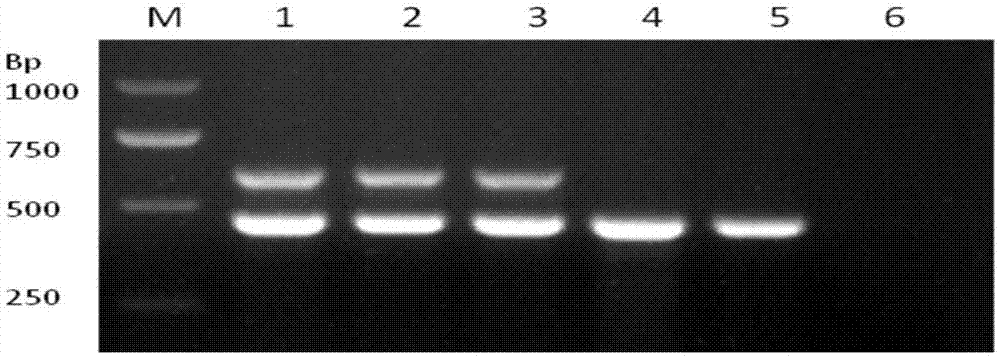
图1为本发明实施例1中鸽副伤寒沙门氏菌特异性pcr检测方法的建立凝胶电泳结果;其中,图1中:泳道1-3为鸽副伤寒沙门氏菌;泳道4-6:鸡白痢沙门氏菌、鸡伤寒沙门氏菌、空白对照。
图2为本发明实施例2中鸽副伤寒沙门氏菌pcr检测方法特异性评价实验凝胶电泳结果;其中,图2中:泳道1-2:鸡白痢沙门氏菌、鸡伤寒沙门氏菌;泳道m:2000bp分子量标准;泳道3-8:鼠伤寒沙门氏菌、鸽副伤寒沙门氏菌1、2、肠炎沙门氏菌、猪霍乱沙门氏菌、大肠杆菌。
图3为本发明实施例3中鸽副伤寒沙门氏菌pcr检测方法灵敏性评价实验凝胶电泳结果;其中,m:2000bp分子量标准;泳道1-8:dna模板浓度分别为:39.5ng、3.95ng、395pg、39.5pg、3.95pg、395fg、39.5fg、3.95fg。
图4为本发明实施例4中鸽副伤寒沙门氏菌疑似菌株的检测凝胶电泳结果。
图5为现有技术中的引物对鸽副伤寒沙门氏菌株的检测凝胶电泳结果。
图6为本发明的引物对鸽副伤寒沙门氏菌株的检测凝胶电泳结果。
具体实施方式
以下实施例用于进一步说明本发明,但不应理解为对本发明的限制。在不背离本发明精神和实质的前提下,对本发明所作的修饰或者替换,均属于本发明的范畴。
若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如sambrook等分子克隆:实验室手册(newyork:coldspringhaborlaboratorypress,1989)中所述的条件,或按照制造厂商所建议的条件。
实施例1鸽副伤寒沙门氏菌特异性pcr检测方法的建立
步骤一,设计特异性扩增鸽副伤寒沙门氏菌的引物对
通过生物信息学分析,从鼠伤寒沙门氏菌基因组dna序列中筛选出保守且特异的flic基因,将之作为检测鸽副伤寒沙门氏菌的靶基因,将基因dna序列输入软件dnastar中设计扩增引物对,设置gc%范围为40%~60%,产物大小范围为400~700bp,从备选引物对中,通过大量实验并对引物进行适应性调整,最后验证选择作为特异性引物对,鸽副伤寒沙门氏菌上游引物fli1和鸽副伤寒沙门氏菌下游引物fli2,引物对序列如下所示,引物可由生工生物工程(上海)股份有限公司合成。其中采用鸽副伤寒沙门氏菌上下游引物扩增的阳性序列如seqidno.5所示。
fli1(seqidno.1):5’-actggtaaagatggct-3’
fli2(seqidno.2):5’-cgctgtagcccaggttggtaat-3’;
为了进一步验证所获得的鸽副伤寒沙门氏菌阳性菌为沙门氏菌,设有内参核酸,用于检验所测测定的菌种确定是沙门氏菌,在沙门氏菌也阳性的前提下,检测为鸽副伤寒沙门氏菌的613bp阳性,才能确定为鸽副伤寒沙门氏菌阳性,其内参的上下游引物分别inve-up和inve-down,其扩增的产物为463bp。
inve-up(seqidno.3):5'-cgatccgaagaccctcaa-3'
inve-down(seqidno.4):5'-cagtaacgcattcaaacct-3'
步骤二,dna模板制备
将鸽副伤寒沙门氏菌(由北京市农林科学院畜牧兽医研究所分离保存),接种至5ml的lb液体培养基中,在37℃增菌16h-18h后,取1ml菌液,放入1.5ml离心管中;12,000r/min离心2min,弃上清液,加入200μl无菌双蒸水重新悬浮菌体;或无菌挑取3-5个鸽副伤寒沙门氏菌菌落加到有50-100μl灭菌ddh2o的ep管内,在沸水浴中煮10min,立即取出,冰上冷却5min,12,000r/min离心2min,取上清液放置-20℃备用或为模板做pcr。
步骤三,特异性pcr检测方法的建立
将大量实验验证,要既能保证扩增出鸽副伤寒沙门氏菌又能扩增出内参沙门氏菌属,最后选定如下pcr检测方法,配制pcr扩增用20μl体系:含2×premix10μl、10μmol/l的鸽副伤寒沙门氏菌上、下游引物和内参上、下游引物各0.5μl、模板1.5μl,以无菌水为模板作为反应的阴性对照,加入灭菌去离子水补足20μl,混匀。然后将反应管离心后,放入pcr反应仪中,按照以下pcr循环参数进行:在95℃预变性5min,94℃变性30s,退火温度52℃,退火时间为30s,然后在72℃延伸40s,30个循环,循环结束后在72℃延伸7min,最后降温至16℃,结束所有操作程序。其中,2×premix可采用宝生物工程(大连)有限公司。
同时,采用含鸽副伤寒沙门氏菌阳性对照的序列作为模板分别进行扩增。
步骤四,结果判定
所述判断具体为:取pcr扩增产物8μl,在2%的琼脂糖凝胶上进行电泳分析,用凝胶成像系统进行观察,如果电泳结果在613bp位置和463bp位置均出现扩增条带,则说明样品中含鸽副伤寒沙门氏菌;如果电泳结果在613bp位置没有出现扩增条带,则样品中不含鸽副伤寒沙门氏菌。如果电泳结果只在463bp位置出现扩增条带,则说明样品中含有沙门氏菌;如果没有出现相应的463bp扩增条带,则样品中不含有沙门氏菌。
同时,鸽副伤寒沙门氏菌阳性对照的电泳结果应是在613bp位置出现扩增条带,阴性对照没有条带出现;如果阳性对照没有在对应位置出现扩增条带或阴性对照出现非特异性条带,说明所用试剂失效或被污染,应重新配制试剂或更换新的试剂或重新合成引物,重新进行检测,设置阳性对照和阴性对照主要是用于保证检测结果的准确性。
图1显示了菌株的检测结果,图1中:泳道1-3为鸽副伤寒沙门氏菌;泳道4-6:鸡白痢沙门氏菌、鸡伤寒沙门氏菌、空白对照。其中表示特异性引物对鸽副伤寒沙门氏菌可以扩增出613bp特异性目的条带,但对其他血清学常见沙门氏菌致病菌的扩增结果只在463bp位置出现扩增条带;空白对照6无任何扩增条带。结果表明本发明设计的引物对扩增鸽副伤寒沙门氏菌具有良好的特异性。
实施例2鸽副伤寒沙门氏菌pcr检测方法特异性评价实验
步骤一,dna模板制备
选取与鸽副伤寒沙门氏菌关系较近的菌株为参考株,参考菌株为鼠伤寒沙门氏菌(s.typhimurium)、鸡伤寒沙门氏菌(s.gallinarum)、鸡白痢沙门氏菌(s.gallinarum)、猪霍乱沙门氏菌(s.choleraesuls)、肠炎沙门氏菌(s.enteritidis)、大肠杆菌(e.coli),这些菌株可购自中国兽医微生物菌种保藏管理中心(cvcc)或中国医学细菌保藏管理中心(cmcc)。按照实施例1步骤二分别提取鼠伤寒沙门氏菌、鸡伤寒沙门氏菌、鸡白痢沙门氏菌、猪霍乱沙门氏菌、肠炎沙门氏菌、大肠杆菌基因组dna模板。
步骤二,鸽副伤寒沙门氏菌pcr检测方法特异性评价试验
按照实施例1步骤三中pcr反应体系,取步骤一中制备各菌株的dna模板1.5μl作为pcr反应模板分别添加到pcr反应体系中,空白对照以1.5μl的无菌双蒸水为模板;然后按照实施例1步骤三中pcr循环参数进行pcr扩增反应。
步骤三,结果判定
取pcr扩增产物8μl,在2%的琼脂糖凝胶上进行电泳分析,用凝胶成像系统进行观察,如果电泳结果在613bp位置和463bp位置出现扩增条带,则说明样品中含鸽副伤寒沙门氏菌;若在613bp位置没有出现扩增条带,则样品中不含鸽副伤寒沙门氏菌;如果电泳结果在463bp位置出现扩增条带,则说明样品中含有其他血清型沙门氏菌;如果没有出现任何扩增条带,则样品中不含有沙门氏菌。电泳凝胶成像结果见图2,其中图2中1-8条带所用的模板分别是鸡白痢沙门氏菌、鸡伤寒沙门氏菌、鼠伤寒沙门氏菌、鸽副伤寒沙门氏菌1、鸽副伤寒沙门氏菌2、肠炎沙门氏菌、猪霍乱沙门氏菌、大肠杆菌,其菌株编号及检测结果如下表1:
表1
表1中,-表示pcr结果为阴性;+表示pcr结果为阳性;*表示由北京市农林科学院畜牧兽医研究所分离保存。
从图2及表1中可以看出,pcr扩增鸽副伤寒沙门氏菌和鼠伤寒沙门氏菌dna,凝胶电泳检测后,在613bp位置和463bp位置均观察到特异扩增条带。而pcr扩增猪霍乱沙门氏菌、鸡伤寒沙门氏菌、鸡白痢沙门氏菌、肠炎沙门氏菌在463bp附近位置观察到一条扩增条带;大肠杆菌凝胶电泳检测后,没有观察到任何扩增条带。以上结果说明引物对具有良好的特异性,建立的pcr检测方法可以特异性的检测鸽副伤寒沙门氏菌。
实施例3鸽副伤寒沙门氏菌pcr检测方法敏感性评价实验
步骤一,dna模板制备
按照实施例1步骤二分别提取鸽副伤寒沙门氏菌dna基因组模板,经od260/280检测,鸽副伤寒沙门氏菌dna溶液的浓度为39.5ng/μl,用无菌水做10倍梯度稀释,共稀释7个梯度。
步骤二,鸽副伤寒沙门氏菌pcr检测方法敏感性评价试验
每个梯度分别取1.5μl加入pcr反应体系,按照实施例1步骤三方法但只添加鸽副伤寒沙门氏菌上、下游引物如seqidno.1和seqidno.2所示的序列,对dna模板进行pcr扩增检测。
步骤三,结果判定
取pcr扩增产物8μl,在2%的琼脂糖凝胶上进行电泳分析,在凝胶成像仪上进行观察。若电泳结果在613bp位置出现扩增条带,则说明可以检测出样品中含的鸽副伤寒沙门氏菌;若在613bp位置没有出现扩增条带,则说明未能检出样品中含的鸽副伤寒沙门氏菌。
图3显示灵敏度评价结果,图中1-8分别为dna模板浓度分别为:39.5ng/μl、3.95ng/μl、395pg/μl、39.5pg/μl、3.95pg/μl、395fg/μl、39.5fg/μl、3.95fg/μl。结果显示,鸽副伤寒沙门氏菌菌液dna浓度为39.5fg/μl时,可以有效地扩增出目的片段,但菌液dna浓度为3.95fg/μl或更低时扩增结果为阴性。结果表明,该pcr方法对鸽副伤寒沙门氏菌的最低检测dna浓度为39.5fg/μl,具有较好的灵敏度。
实施例4鸽副伤寒沙门氏菌临床疑似菌株的检测
利用实施例1建立的鸽副伤寒沙门氏菌特异性pcr检测方法对从河北某鸽场分离的12株疑似菌株疑似鸽副伤寒沙门氏菌菌株进行检测。
结果如图4所示,其中1-12分别为河北某鸽场分离的疑似菌株:经pcr检测发现11株疑似菌株扩增出条带,其中3株呈鸽副伤寒沙门氏菌阳性结果条带,编号1、5、7。同时将这11株疑似菌株进行血清学分型实验,其中3株血清型为4,12或4,12:i:1,与鼠伤寒沙门氏菌哥本哈根变种(即鸽副伤寒沙门氏菌)抗原式(1,4,12:i:1,2)相符合,8株血清型为9,12或1,9,与鸡白痢沙门氏菌抗原式(1,9,12)相符合,之后经microbialcharacterizationsystem鉴定,结果表明这11株疑似菌株鉴定结果与本发明建立的pcr方法检测结果均符合。而对pcr检测方法为阴性的1株其它疑似菌株,进行血清学分型实验,其血清型结果与沙门氏菌抗原式不符,经microbialcharacterizationsystem鉴定证实其不是沙门氏菌。本实施例证明,所建立的鸽副伤寒沙门氏菌的特异性pcr方法具有非常高的可靠性。
对比例
采用现有的引物actggtaaagatggct、和cggtgttgcccaggttggtaat及内参核酸对鸽副伤寒沙门氏菌进行了检测,扩增条件和程序采用实施例1中的条件,扩增结果用电泳检测,结果如图5所示,从扩增结果看,采用现有的引物,目标条带613bp较弱,几乎看不清楚,这样容易导致出现假阴性,而采用本发明的作为改造后的引物如seqidno.1和seqidno.2及内参核酸对对鸽副伤寒沙门氏菌进行了检测,扩增条件和程序采用实施例1中的条件,扩增结果用电泳检测,结果如图6所示,从扩增结果看,目标条带613bp较亮,检测结果不会出现假阴性问题,且本发明的扩增的阳性进行克隆测序的613基因序列目前在genbank上是首次提交。
序列表
<110>北京市农林科学院畜牧兽医研究所
<120>用于检测鸽副伤寒沙门氏菌的核酸、试剂盒及检测方法
<160>5
<170>siposequencelisting1.0
<210>1
<211>16
<212>dna
<213>人工序列(artificialsequence)
<400>1
actggtaaagatggct16
<210>2
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>2
cgctgtagcccaggttggtaat22
<210>3
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>3
cgatccgaagaccctcaa18
<210>4
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>4
cagtaacgcattcaaacct19
<210>5
<211>613
<212>dna
<213>人工序列(artificialsequence)
<400>5
actggtaaagatggctattatgaagtttccgttgataagacgaacggtgaggtgactctt60
gctggcggtgcgacttccccgcttacaggtggactacctgcgacagcaactgaggatgtg120
aaaaatgtacaagttgcaaatgctgatttgacagaggctaaagccgcattgacagcagca180
ggtgttaccggcacagcatctgttgttaagatgtcttatactgataataacggtaaaact240
attgatggtggtttagcagttaaggtaggcgatgattactattctgcaactcaaaataaa300
gatggttccataagtattaatactacgaaatacactgcagatgacggtacatccaaaact360
gcactaaacaaactgggtggcgcagacggcaaaaccgaagttgtttctattggtggtaaa420
acttacgctgcaagtaaagccgaaggtcacaactttaaagcacagcctgatctggcggaa480
gcggctgctacaaccaccgaaaacccgctgcagaaaattgatgctgctttggcacaggtt540
gacacgttacgttctgacctgggtgcggtacagaaccgtttcaactccgctattaccaac600
ctgggctacagcg613
- 还没有人留言评论。精彩留言会获得点赞!