一种以红娘鱼为原料制备γ-氨基丁酸的方法与流程
本发明属于水产品生物加工技术领域,具体涉及一种以红娘鱼为原料制备gaba的方法。
背景技术
红娘鱼(gurnard)是硬骨鱼纲,鲉形目,鲂鮄科,红娘鱼属鱼类的通称。有约20种。体长可达300毫米。它们体色红润,身体苗条,颇有妇女之貌,故称红娘鱼。红娘鱼在我国沿海地区均有分布与产出,资源极为丰富。红娘鱼的鱼肉具有高蛋白、低脂肪、维生素、矿物质含量丰富,口味好、易于消化吸收的优点,因此,其食用价值很高。在加工过程中,蛋白质含量很高的红娘鱼的内脏往往被丢弃,这不仅造成了资源的浪费,还污染了环境。除了蛋白含量高的优点外,红娘鱼肉和内脏中的油脂、色素含量较低,在氨基酸分离纯化方面,省去了脱色、除脂的过程,可谓是天然优质的氨基酸获取原料。如果可以利用红娘鱼的鱼肉和内脏作为微生物的氮源,供其生长、代谢生产γ-氨基丁酸,这不仅实现了红娘鱼资源的高值化开发利用,为人类提供理想的海洋食品及海洋药物,创造出宏观的经济效益,还可以减少鱼类加工废弃内脏对环境造成的压力。
γ-氨基丁酸(γ-aminobutiricacid,gaba)是哺乳动物、甲壳类动物、昆虫和某些寄生蠕虫神经系统中重要的抑制性神经递质。少数植物中含有这种非蛋白质氨基酸。γ-氨基丁酸也称氨酪酸,是一种非蛋白质组成成份的天然氨基酸,广泛存在于自然界中,是目前研究较为深入的一种重要的抑制性神经递质,它参与多种代谢活动,具有降血压、调节心律失常、改善睡眠、抗焦虑、改善脂质代谢、防止动脉硬化等功效,因此受到越来越多的科学工作者的关注。
技术实现要素:
本发明的目的在于提供一种以红娘鱼为原料制备γ-氨基丁酸的方法。
为实现上述目的,本发明采用的技术方案为:
一种以红娘鱼为原料制备γ-氨基丁酸的方法,以红娘鱼肉和/或一种或几种红娘鱼内脏为原料,加入碳源,并调节ph值4.5-7.0,接种可产生谷氨酸脱羧酶的菌株的活化菌悬液,发酵培养至菌株进入稳定期,再加入谷氨酸盐,调节ph值,发酵培养即得到富含gaba的发酵液。
所述富含gaba的发酵液经预处理、分离纯化后得到纯度在90%以上的gaba粉末。
1)进一步的说,以红娘鱼肉和/或一种或几种红娘鱼内脏为原料,磨匀加水获得原料液,所得原料液中加入碳源,并调节ph值4.5-7.0后高温高压灭菌,冷却至室温后,接种可产生谷氨酸脱羧酶的菌株的活化菌悬液,发酵培养。其中,所述“活化微生物菌悬液”其活化方法,参见参考文献《乳酸菌lactococcuslactissyfs1.009生物法制备γ-氨基丁酸的研究》。
所述原料去头、尾、鳍、骨、皮后,用匀浆机研磨成匀浆,匀浆中加水混匀后室温静置获得原料液,待用;其中,匀浆与水按质量体积为1:1-5的比例混合。
所述原料液中加入其质量体积比0.5%-2.0%(w/v)的葡萄糖,调节ph值4.5-7.0,高温高压灭菌后所得到的培养液,培养液冷却至室温后,按0.5%-2.0%量(v/v)接种可产生谷氨酸脱羧酶的菌株的活化菌悬液后,于30℃-40℃下发酵培养12-48小时,使菌株进入稳定期所得到的富含微生物的培养液。
所述富含微生物的培养液中加入其质量体积百分比0.5%-2.0%的谷氨酸盐(如:谷氨酸钠),调节ph值4.0-7.0,于30℃-40℃下发酵培养2-7天所得到的富含gaba的发酵液。
所述步骤3)可产生谷氨酸脱羧酶的菌株的活化菌悬液为鸟肠球菌、短乳杆菌、双歧杆菌、德氏乳杆菌、酵母菌、红曲霉中的一种或几种的混合。优选为鸟肠球菌或短乳杆菌。
本发明所具有的优点
1.本发明利用红娘鱼及其废弃内脏制备gaba,相较于目前发酵生产gaba普遍采用的mrs培养基和gyp培养液,大大节约了生产成本,极大简化了培养基、培养液的配制过程,更适合于工业化生产。gaba为微生物次生代谢产物,只有在菌体完成自身生长之后,才能合成谷氨酸脱羧酶,将谷氨酸盐转化为gaba。利用两阶段发酵策略生产gaba是将微生物的生长与gaba生产区分开来,即第一阶段,在培养基中不添加谷氨酸盐(防止其对微生物生长的毒性作用),给予菌体最适的生长环境,保证菌体的生物量达到最大值;第二阶段,在拥有最大生物量的基础之上,通过添加谷氨酸盐(反应底物)、降低ph值(谷氨酸脱羧酶体系为微生物耐酸性调节机制之一)等外界胁迫,使菌体产谷氨酸脱羧酶的能力得到提升,将更多的谷氨酸盐转化为gaba。
2.我国红娘鱼产量丰富,在其加工过程中,大量的内脏废弃物未被加工利用。本发明实现了红娘鱼及其加工下脚料的高值利用,充分利用了我国丰富的红娘鱼资源,提高了水产业的经济效益,同时也减少了加工废料随意丢弃所带来的环境污染问题。
3.本发明采用的原料红娘鱼肉和内脏中的油脂、色素含量较低,在氨基酸分离纯化方面,省去了发酵液后续脱色、除脂的过程,可谓是天然优质的氨基酸获取原料,简化了gaba的分离步骤,节约了gaba的分离纯化成本。
附图说明
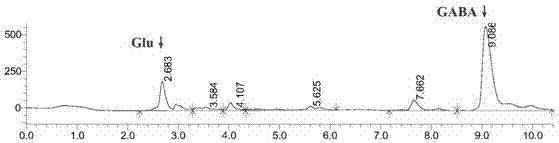
图1为本发明实施例提供的红娘鱼鸟肠球菌发酵液hplc图。
图2为本发明实施例提供的红娘鱼内脏鸟肠球菌发酵液hplc图。
图3为本发明实施例提供的红娘鱼鱼肉短乳杆菌发酵液hplc图。
图4为不同海产品短乳杆菌发酵液。
具体实施例
下面对本发明作进一步说明,并且本发明的保护范围不仅局限于以下实施例。
实施例1
(1)将新鲜红娘鱼原料去头、尾、鳍、骨、皮后,鱼肉和内脏混合用匀浆机研磨成匀浆,加入匀浆质量2倍体积水(w/v),获得原料液;
(2)向原料液中添加2.0%(w/v)葡萄糖,调节ph值6.5,高温高压灭菌后,得到培养液。
(3)所得培养液冷却至室温后,按1.0%量(v/v)接种活化鸟肠球菌菌悬液,而后于37℃下发酵培养21小时,使鸟肠球菌进入稳定期,得到富含鸟肠球菌的培养液(第一阶段,鸟肠球菌在红娘鱼肉、内脏混合培养基中最适生长条件为:葡萄糖添加量2.0%,ph值6.5,培养温度37℃,培养时间21小时)。鸟肠球菌已在申请号为201410244756.0,发明名称为:一种高产γ-氨基丁酸菌株及其应用的专利文献中记载,同时并保存于中国普通微生物菌种保藏中心,编号:cgmcc9184。鸟肠球菌活化方法,参见参考文献《乳酸菌lactococcuslactissyfs1.009生物法制备γ-氨基丁酸的研究》
(4)随后向富含鸟肠球菌的培养液中添加1.5%的谷氨酸钠,调节ph值6.0,于37℃下发酵培养4天,即得到富含gaba的发酵液,gaba浓度为4.98g/l(第二阶段,鸟肠球菌在红娘鱼肉、内脏混合培养基中最适gaba生产条件为:谷氨酸添加量1.5%,ph值6.0,培养温度37℃,培养时间4天)。
(5)hplc法测定发酵液中gaba的含量(参见图1),检测方法见参考文献《γ-氨基丁酸(gaba)的分布及测定方法》。由图1可见发酵液中谷氨酸钠的含量显著降低,gaba的含量明显升高。证明在优化的培养条件和培养策略下,鸟肠球菌可将发酵液中的谷氨酸盐转化为gaba。
(6)相同原料,同一菌种,采用直接发酵法(通过单因素优化实验和响应面分析法优化发酵条件),发酵液中gaba含量最高仅为1.79g/l,两阶段发酵策略使发酵液中gaba的含量提高了2.78倍。
实施例2
(1)新鲜红娘鱼原料取内脏,用匀浆机研磨成匀浆,加入匀浆质量2倍体积水(w/v),获得原料液;
(2)向原料液中添加2.0%(w/v)葡萄糖,调节ph值6.5,高温高压灭菌后,得到培养液。
(3)所得培养液冷却至室温后,按1.0%量(v/v)接种活化鸟肠球菌菌悬液后,于37℃下发酵培养21小时,使鸟肠球菌进入稳定期,得到富含鸟肠球菌的培养液。
(4)随后向富含鸟肠球菌的培养液中添加1.5%的谷氨酸钠,调节ph值6.0,于37℃下发酵培养4天,即得到富含gaba的发酵液,gaba浓度为5.71g/l。
(5)hplc法测定发酵液中gaba的含量(参见图2),检测方法见参考文献《γ-氨基丁酸(gaba)的分布及测定方法》。
(6)相同原料,同一菌种,采用直接发酵法(通过单因素优化实验和响应面分析法优化发酵条件),发酵液中gaba含量最高仅为2.20g/l,两阶段发酵策略使发酵液中gaba的含量提高了2.60倍。
实施例3
(1)将新鲜红娘鱼原料去头、尾、鳍、骨、皮后,鱼肉用匀浆机研磨成匀浆,加入匀浆质量5倍体积水(w/v),获得原料液;
(2)向原料液中添加1.0%(w/v)葡萄糖,调节ph值5.5,高温高压灭菌后,得到培养液。
(3)所得培养液冷却至室温后,按1.0%量(v/v)接种活化短乳杆菌菌悬液后,于37℃下发酵培养18小时,使短乳杆菌进入稳定期,(第一阶段,短乳杆菌在红娘鱼肉培养基中最适生长条件为:葡萄糖添加量1.0%,ph值5.5,培养温度37℃,培养时间18小时)得到富含短乳杆菌的培养液。(发酵菌株短乳杆菌lactobacillusbrevis1-558购买于中国普通微生物菌种保藏中心。)
(4)随后向富含短乳杆菌的培养液中添加1.0%的谷氨酸钠,调节ph值5.5,于37℃下发酵培养4天,即得到富含gaba的发酵液,gaba浓度为3.06g/l。(第二阶段,短乳杆菌在红娘鱼肉培养基中最适gaba生产条件为:谷氨酸添加量1.0%,ph值5.5,培养温度37℃,培养时间4天)
(5)hplc法测定发酵液中gaba的含量(参见图3),检测方法见参考文献《γ-氨基丁酸(gaba)的分布及测定方法》。
对上述实施例3获得的富含gaba的发酵液进一步分离提纯:
1)富含gaba的红娘鱼肉发酵液去菌体:将上述实施例获得发酵液以5000r/min的离心速度,离心10分钟,取上清液体得无菌体发酵液;以及采用其它不同海产品(牡蛎、红娘鱼、扇贝)按照上述实施例3记载的方式进行发酵(参见图4),由各发酵液看出红娘鱼肉发酵液的颜色几乎是无色透明,油脂和色素含量很低,无需经过活性炭、大孔吸附树脂的脱色过程,避免了发酵液中gaba的损失;其它发酵液需要进一步的脱色(如扇贝),无需脱色的牡蛎由于其发酵物中营养成分的不足使得菌株生长并不好,进而gaba产量很低;同时不同海产品发酵液中gaba的含量参见表1。
表1不同水产品短乳杆菌发酵液中gaba含量(g/l)
2)无色透明发酵液中gaba的分离纯化:
将上述本发明实施例3获得无色透明液装入分子量为500-1000的透析袋,反透析48小时(即保留析出液,弃去透析带内的液体),析出液经减压浓缩后(浓缩至原体积的1/10),上预处理过的732树脂(氢型)交换柱,流速取3ml/min,让其充分进行交换吸附。吸附完毕后用去离子水洗涤至ph6.0。先用150ml0.1mol/l氨水洗,再用1mol/l氨水以3ml/min的流速进行洗脱。在洗脱过程中不断用茚三酮丙酮溶液进行显色测试,并用ph试纸检测ph的变化。当茚三酮反应呈蓝色,ph6.0左右时,即可收集流出液,直至茚三酮蓝色反应消失为止,合并收集液(gaba水溶液ph值约为6,且与茚三酮反应呈蓝色,由此可判断:当流出液ph值为6,且与茚三酮反应呈蓝色,其内含有gaba)。收集液减压浓缩(至原体积的1/10),上制备型高效液相色谱,分离条件:c18制备色谱柱,流动相甲醇:水=70:30,收集保留时间10-15分钟馏分。将洗脱馏分浓缩后,将10倍体积的无水乙醇加到浓缩液中,不断搅拌,逐渐出现大量白色结晶后,静置一段时间。抽滤,滤物转至培养皿中,30℃烘干,挥发乙醇,得分离提纯gaba,纯度为91.34%。
实施例4
(1)新鲜红娘鱼原料取内脏,用匀浆机研磨成匀浆,加入匀浆质量2倍体积水(w/v),获得原料液;
(2)向原料液中添加1.0%(w/v)葡萄糖,调节ph值4.5,高温高压灭菌后,得到培养液。
(3)所得培养液冷却至室温后,按1.0%量(v/v)接种活化红曲霉菌菌悬液后,于30℃下发酵培养24小时,使红曲霉菌进入稳定期,(第一阶段,红曲霉菌在红娘鱼内脏培养基中最适生长条件为:葡萄糖添加量1.0%,ph值4.5,培养温度30℃,培养时间24小时)得到富含红曲霉的培养液。红曲霉菌购买于上海生物网,编号为accc30342,活化方法及培养基见文献《红曲霉发酵提高γ-氨基丁酸含量的研究》
(4)随后向富含红曲霉菌的培养液中添加0.7%的谷氨酸钠,调节ph值4.0,于37℃下发酵培养3天,即得到富含gaba的发酵液,gaba浓度为0.93g/l。(第二阶段,红曲霉菌在红娘鱼内脏培养基中最适gaba生产条件为:谷氨酸添加量0.7%,ph值4.0,培养温度37℃,培养时间3天)
(5)hplc法测定发酵液中gaba的含量,检测方法见参考文献《γ-氨基丁酸(gaba)的分布及测定方法》。
(6)相同原料,同一菌种,采用直接发酵法(通过单因素优化实验和响应面分析法优化发酵条件),发酵液中gaba含量最高仅为0.55g/l,两阶段发酵策略使发酵液中gaba的含量提高了1.69倍。
(7)与红曲霉相比,鸟肠球菌和短乳杆菌两阶段策略发酵液中gaba的含量更高,适合gaba的生产。
- 还没有人留言评论。精彩留言会获得点赞!