一种柴达木大肥菇抗缺氧多糖的提取与纯化方法与流程
本发明涉及生物化学技术领域,具体涉及一种柴达木大肥菇多糖的提取和纯化方法。
背景技术
柴达木大肥菇是青藏高原柴达木盆地特殊生态环境条件下的一种分类十分重要的野生大型食用真菌。因其生长在恶劣的环境下使其具有子实体巨大、抗逆性强、地下结实、低温出菇等特点,为大肥蘑菇中的特殊菌种。柴达木大肥菇子实体含粗蛋白24.0%、粗脂肪2.10%、粗纤维17.32%、碳水化合物34.91%、灰分13.65%。按照食用菌多糖溶解性,极性大分子化合物,易溶于水,不溶于乙醇。目前常用提取方法有:热水浸提法、超滤法又称膜分离法、超微粉碎技术、微波辅助提取法、超临界流体萃取法等。在多糖的进一步提纯过程中常用的纯化的方法有分级沉淀法、盐析法、金属络合物法、柱层析法等方法。分级沉淀法是用不同浓度的沉淀剂如甲醇、乙醇、丙酮等来分部沉淀纯化多糖;季铵盐沉淀法中的常用季铵盐为十六烷基三甲基胺溴化物(ctab)及其碱(ctaooh)和十六烷基吡啶;盐析法常用的盐析剂有氯化钠、氯化钾、硫酸铵、醋酸钾等;金属络合沉淀法常用的络合剂有费林溶液、氯化铜、氢氧化钡和醋酸铅等;柱层析法包括纤维素柱层析、阴离子交换树脂柱层析(如deae-纤维素)、凝胶柱层析(sephadexg-200、sepharose、deae-sephadex)、高压液相柱层析,比较常见的是阴离子交换树脂柱层析。然而,由于柴达木大肥菇是生长于青藏高原柴达木盆地的一种特殊菌种,所以国外对其研究几乎没有,而在国内虽然对其有不少研究报道,但却没有公开采用上述方法对柴达木大肥菇多糖的进行提取和纯化的技术方案。
技术实现要素:
本发明要解决的技术问题是提供一种可使柴达木大肥菇纯多糖的纯化程度得到改善和提高的柴达木大肥菇抗缺氧纯化多糖得率的提取与纯化方法。
为解决上述技术问题,本发明采用如下技术方案:一种柴达木大肥菇抗缺氧多糖的提取与纯化方法,其特征在于:
提取和纯化的具体过程按以下步骤进行:
1)子实体、菌丝体超声波提取多糖:将柴达木大肥菇制成的原料放入超声波清洗机中,以超声波功率126w、频率40-50khz的条件进行提取时间40-60min,然后抽滤,获得粗多糖液;粗多糖液按1:10浓缩后放置4℃冰箱备用;
2)脱色:取脱蛋白的多糖溶液用活性炭脱色,以5%的比例于多糖溶液中加入活性炭,在温度为80℃的水浴锅中水浴40-60min,重复两次,直至颜色变成淡黄色;
3)浓缩:用旋转蒸发仪在温度为50℃的条件下蒸发10min,得粗多糖溶液;
4)柱层析纯化——deae-纤维素法:a、deae-52的活化:称量40gdeae-52树脂置于蒸馏水中溶胀12h后,将其于0.5mol/l的盐酸中浸泡2h,并不断搅拌,而后用蒸馏水洗涤至中性,再将树脂于0.5mol/l的氢氧化钠溶液中浸泡2h后,洗涤至中性,备用;
b、层析操作:处理好的deae-52树脂→装柱→平衡过夜→上样→梯度洗脱→苯酚-硫酸法测定各收集管多糖浓度→收集各流出组分;
c、deae-52纤维素上柱:将清洗干净的2.5cm×60cm层析柱垂直固定在层析架上,向层析柱中注入1/5体积的去离子水,打开下出液口,水流畅通,用玻璃棒将处理好的纤维素搅拌均匀,一次性倒入层析柱中,不留气泡,直至离层析柱上端2~3cm处,停止装柱,然后把柱口残留的糊状物用少量水冲下去,用去离子水平衡洗脱1-2h,静置过夜;
吸取经过旋转蒸发浓缩的粗多糖溶液0.1-0.3bv(树脂装柱体积)至纤维素层析柱中,以nacl溶液作为洗脱液,保持恒定流速进行洗脱,按1min每管收集洗脱液;用苯酚-硫酸法逐个检测每管收集的多糖溶液,直至无多糖洗出;
5)透析:a、透析袋预处理:将透析袋剪成10-20cm的小段,先用50%乙醇煮沸1h,再按照50%乙醇、0.01mol/l碳酸氢钠溶液和0.001mol/ledta溶液依次洗涤,最后用蒸馏水洗涤,即可使用,使用后的透析袋洗干净后放在蒸馏水中存于4℃的冰箱中,在冷藏过程中,透析袋完全浸没在蒸馏水中;
b、将经过纯化的各多糖组分溶液放入经过处理的透析袋,在室温下用流动的蒸馏水透析24-48h。
优选地,在步骤1)中,采用的柴达木大肥菇制成的原料为柴达木大肥菇子实体,其在烘箱温度为60℃条件下烘24h,60目粉碎过筛,阴凉、干燥贮存;然后称取子实体粉末,按1:20与蒸馏水混合,在超声波功率126w、频率40khz、提取温度70℃的条件下提取60min,抽滤得到上清液,备用。
或者,在步骤1)中,采用的柴达木大肥菇制成的原料为柴达木大肥菇菌丝体,经液体深层发酵培养的柴达木大肥菇菌丝体,抽滤、烘干,称取干菌粉,按1:20与蒸馏水混合,在超声波功率126w、频率40khz、提取温度70℃的条件下提取60min,抽滤得到上清液,备用。
或者,在步骤1)中,采用的柴达木大肥菇制成的原料为柴达木大肥菇发酵液,首先将液体菌种接种于培养基中并放至摇床中进行培养,温度26℃、转速120rpm,培养完成后,抽滤,得发酵液;然后将发酵液放入超声波清洗机中,在超声波功率126w、频率40khz、提取温度40℃的条件下提取40min至1h,抽滤,得发酵液粗多糖,备用。
进一步地,在步骤4)中,梯度洗脱依次用蒸馏水、0.1mol/l、0.2mol/l、0.3mol/l的nacl溶液进行洗脱。
优选地,在步骤4)中的苯酚为浓度6%的苯酚试剂,其配制过程为:首先配制80%苯酚:称量80ml的苯酚,再加入20ml的蒸馏水;再配制6%苯酚:取质量分数为80%的苯酚3ml,再加37ml的蒸馏水,配成质量浓度为6%的苯酚试剂。
本发明利用超声波法提取粗多糖,利用活性炭对粗多糖脱色、deae-52纤维素柱层析纯化洗脱各单组分,利用透析膜去除小分子物质,最后对各单组分进行旋转蒸发浓缩,获得纯化多糖单组分。超声波提取粗多糖具有效率高、得率高的优势,活性炭脱色不仅可有效脱去色素大分子物质,还可以除去蛋白质等杂质,而deae纤维素阴离子柱层析分离多糖的原理主要是其可吸附离子型物质,比如蛋白质、酸性多糖等,而作为大多数的中性多糖则可顺利流出,从而去粗取精、达到分离的目的。超声波提取子实体粗多糖得率高达128.25mg/g,提取效率较其它方法提高3-4倍;采用活性炭对粗多糖脱色,粗提液颜色由深褐色变成淡黄色,多糖提脱色率为76.5%;deae-52纤维素柱层析可分离出3-4个多糖单组分。采用该方法提取和纯化的柴达木大肥菇(子实体、菌丝体及发酵液)多糖,可使柴达木大肥菇纯多糖的纯化程度得到改善和提高,得到纯度较高的柴达木大肥菇源的多糖成品。
附图说明
图1为超声波功率对多糖得率的影响曲线图;
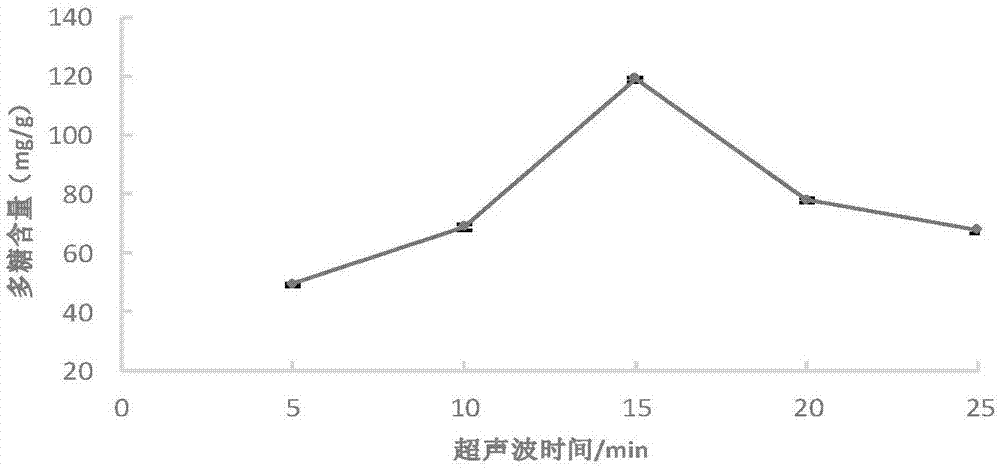
图2为超声波时间对多糖提取得率的影响曲线图;
图3为料液比对多糖提取率的影响曲线图;
图4为发酵液粗多糖纯化的最佳工艺条件验证实验洗脱曲线;
图5为子实体粗多糖纯化的最佳工艺条件验证实验洗脱曲线;
图6为菌丝体粗多糖纯化的最佳工艺条件验证实验洗脱曲线。
具体实施方式
下面结合具体实施例对本发明做进一步说明,但这并不意味着对本发明的任何限制。
一、柴达木大肥菇子实体的多糖提取
1、原材料
野生柴达木大肥菇子实体(购自青海省海西州诺木洪农场),干粉由青海大学动物科学系食品工程实验室自行制备。
deae-52纤维素树脂,购自合北京索莱宝科技有限公司。
2、试剂
表1
3、粗多糖的提取
1)原料预处理:柴达木大肥菇子实体在烘箱温度为60℃条件下烘24h,粉碎过筛(60目),阴凉、干燥贮存。
2)多糖提取:称取一定量子实体粉末,按1:20与蒸馏水混合,在超声波功率126w(45khz)、提取温度70℃提取60min,抽滤得到上清液,备用。
3)脱色:将备用上清液按照一定比例稀释后,置于1000ml烧杯中,装液量为400-500ml,加蒸馏水至600-700ml,加入5%的活性炭,80℃水浴1h,其间不断搅拌,抽滤,重复2遍,直至颜色变成淡黄色。
4)浓缩:取脱色后的多糖抽提液,选用旋转蒸发器,温度30℃、转速60rpm,浓缩至原体积的1/4,测定粗多糖浓度,冷藏备用。
4、多糖的纯化:deae-52树脂预处理→装柱→平衡→上样→洗脱→收集各组分→计算分析得出最佳工艺条件→deae-52纤维树脂重生。
1)deae-52树脂的预处理:以1:20的比例,将称取的100gdeae-52阴离子交换剂干粉浸泡在蒸馏水中溶胀12h,多次搅拌,去除上层的悬浮杂质(待其静置10min后,用脱脂棉吸附表层的悬浮物质或倒去含有肉眼可见杂质的上清液),抽滤,后用0.5mol/l的hcl溶液浸泡2h,用蒸馏水反复洗至中性(注意:抽滤不宜抽干,分成两部分洗,采用多次蒸馏水浸泡,每次10-20min,并用玻璃棒不断搅拌,保证整个体系的ph相同)。再次抽滤,将抽干的树脂浸泡于0.5mol/l的naoh溶液中2h,用蒸馏水洗至中性,方法同前,处理好的树脂浸泡在蒸馏水中,置于4℃冷藏备用。
2)装柱:将层析柱洗净垂直牢固到层析架上,用洗瓶注入1/3体积的蒸馏水,打开止水夹,保持水流畅通,沿玻璃棒缓缓倒入柱填料,使其自然沉降在柱底部,当柱填料沉积到距离层析柱1.5-2cm处时,停止装柱。
3)平衡:层析柱上端进液口连接恒流泵,先用0.5mol/l的nacl溶液平衡1h,再用蒸馏水平衡1-2h(平衡过程中上端口和下端口的流速尽量保持一致,不宜过快,以免柱子压得过实,从而影响试验结果),平衡好后静置12h即可。
4)柱层析纯化分离
上样:deae-52纤维柱上样为预处理得到的子实体多糖粗提液。平衡过后上液面的蒸馏水不宜过多,离纤维柱层2-3cm即可,所需样品量提前计算好,用符合规格的量筒精确量取,并用注射器吸取样品,沿着层析柱内壁缓缓打下去,不能破坏其表面的平整。
洗脱:加样后,用0.5mol/l的nacl溶液洗脱,中间多次用苯酚一硫酸法追踪检测,若有多糖洗脱出时则用部分自动收集器进行收集,洗脱速度为1min/管,管数设为60管,确定最佳上样浓度、最佳上样体积、最佳洗脱流速三个工艺条件,最终洗脱至苯酚-硫酸法检测无糖流出为止。
5)离子交换纤维素的再生:多糖洗脱结束后,用高浓度2mol/l的nacl溶液洗脱柱床,除去其中的杂质和色素。利用多次后,可用预处理方式进行再生。
6)透析:a、透析袋预处理:将透析袋剪成10-20cm的小段,先用50%乙醇煮沸1h,再按照50%乙醇、0.01mol/l碳酸氢钠溶液和0.001mol/l的edta溶液依次洗涤,最后用蒸馏水洗涤,即可使用,使用后的透析袋洗干净后放在蒸馏水中存于4℃的冰箱中,在冷藏过程中,透析袋完全浸没在蒸馏水中;
b、将经过纯化的各多糖组分溶液放入经过处理的透析袋,在室温下用流动的蒸馏水透析24-48h。
二、柴达木大肥菇菌丝体的多糖提取
1、原材料
柴达木大肥菇菌丝体由青海大学动物科学系食品工程实验室制备;
deae-52纤维素树脂,购自于北京索莱宝科技有限公司。
2、试剂,活性炭ar:1000g(济宁恒泰化工有限公司),其它同
实施例1。
3、粗多糖的提取
1)提取:采用超声波辅助水提法,经液体深层发酵培养的柴达木大肥菇菌丝体,抽滤,烘干,称取一定量的干菌粉,以料液比1:20于超声波清洗机中,以70℃、126w(45khz)条件下提取1h,抽滤得上清液,备用。
2)浓缩:取抽滤后的多糖液采用旋转蒸发仪,以1:10的比例浓缩,温度70℃、转速60rpm,测定粗多糖浓度冷冻备用;
4、菌丝体粗多糖的纯化
1)deae-52阴离子树脂的预处理
称取100gdeae-52阴离子树脂干粉按1:5比例于蒸馏水中浸泡48h,反复冲洗,去除上层悬浮杂质(待其静置10min后,用脱脂棉吸附表层的悬浮物质或倒去含有杂质的上清液),抽滤,再先后于0.5mol/l的naoh与hcl溶液中浸泡2h,每次用蒸馏水洗至中性(分成两部分洗,抽滤不宜抽干,采用多次蒸馏水浸泡,每次10-20min,并用玻璃棒不断搅拌,使整个体系ph相同),处理好的树脂浸泡于蒸馏水中,备用。
2)deae-52阴离子树脂的再生
将用过的树脂首先用2mol/l的nacl溶液冲洗柱床,以除去树脂所吸附的成分,再用酸碱处理,处理方法与预处理相同。
3)装柱与平衡:将层析柱垂直固定在铁架台上加入少量蒸馏水,关闭下端出水口,用玻璃棒将处理好的纤维素树脂搅拌至糊状,缓缓倒入层析柱中,同时打开下端出口,使其保持一定流速,待下到一定高度时关闭下端出口,静置,使其自然沉降12h,柱子装好后应无断层、气泡。最后用0.5mol/l的nacl溶液以1ml/min的流速对柱子进行平衡。
4)分离纯化:deae-52纤维素柱层析法
上样:上样前打开下端出水口,至上液面离树脂2-3cm时,关闭下端出水口,将量取好的粗多糖液用加样枪沿柱壁缓缓打入层析柱中,用少量洗脱液冲洗柱壁,同时打开柱子下端出水口,用恒流泵控制洗脱流速。
洗脱:用0.5mol/lnacl溶液进行洗脱,中间用苯酚-硫酸法追踪检测,待有多糖洗脱出时用部分自动收集器进行收集,洗脱速度为2min/管,管数设为100管,确定最佳上样浓度、上样体积、洗脱速度,洗脱至苯酚-硫酸法检测无糖为止。
三、柴达木大肥菇发酵液的多糖提取
1、原板料
柴达木大肥菇发酵液,于青海大学食品工程实验室自行制备备用;
deae纤维素de-52,购自于北京索莱宝科技有限公司。
2、试剂
表2
3、粗多糖的提取
1)原材料预处理
将液体菌种接种于培养基中并放至摇床中进行培养,温度26℃、转速120rpm,培养完成后,抽滤,得发酵液;
2)发酵液粗多糖的提取
将发酵液与无水乙醇按1:4的比例混合放入超声波清洗机中,温度40℃、功率126w(45khz)提取1h,抽滤,得发酵液粗多糖,备用。
3)多糖脱色与浓缩工艺
将备用发酵液粗多糖按一定比例稀释后,置于1000ml烧杯中,装液量为400-500ml,加蒸馏水至600-700ml,加入5%的活性炭,80℃水浴2h,期间不断搅拌,使其脱色更加彻底。取脱色后的多糖液,采用旋转蒸发仪,温度70℃、转速60rpm、浓缩至原体积的1/10,采用苯酚-硫酸法测定多糖浓度,冷冻备用。
4、发酵液粗多糖的纯化
1)deae-52纤维素的预处理
称取100gdeae-52阴离子交换剂干粉按1:10比例浸泡于蒸馏水中24h,反复冲洗,去除上层悬浮杂质(待其静置10min后,用脱脂棉吸附表层的悬浮物质或倒去含有杂质的上清液),抽滤,再用0.5mol/l的hcl溶液浸泡2h,期间多次搅拌,分成两部分,用蒸馏水洗涤至中性,时间10-20min即可,并用玻璃棒不断搅拌,使整个体系ph相同,抽滤时不宜抽干;再用0.5mol/l的naoh溶液浸泡2h,同理洗涤至中性,放入适量蒸馏水中备用。
2)装柱
将层析柱清洗干净垂直固定到层析架上,注入1/3体积的蒸馏水,打开下出液口,水流畅通,无漏水,将树脂搅拌均匀用玻璃棒引流缓缓注入层析柱(引流会减少气泡的产生),使其自然沉降,待其沉积至一定高度时,停止装柱,静置12h。
3)平衡
上样前必须对层析柱进行平衡,层析柱上端进液口连接恒流泵,流速为2min/ml,先用配好的0.5mol/l的nacl溶液平衡1h,再用蒸馏水平衡1-2h。
4)上样
上样的样品为预处理后的发酵液粗提液。上样之前要注意平衡过后上液面的蒸馏水不宜过多,离凝胶层2-3cm即可,将量取好的粗多糖液用注射器缓慢注入层析柱中,用少量洗脱液冲洗柱壁,同时打开下端出水口,用恒流泵控制洗脱流速。
5)洗脱:用0.5mol/l的nacl溶液进行洗脱,中间用苯酚-硫酸法追踪检测,待有多糖洗脱出时用部分自动收集器进行收集,洗脱速度为2min/管,管数设为100管,确定最佳上样浓度、上样体积、洗脱速度,洗脱至苯酚-硫酸法检测无糖为止。
四、结果与分析
1、单因素试验
(1)超声波功率对多糖得率的影响
分别称取柴达木大肥菇子实体粉末,按照20:1的液料比,在72、90、108、126、144w的超声波条件下,提取15min,计算粗多糖含量。结果如图1。
粗多糖的提取得率在随超声波功率先显著增加后略有降低,其原因可能是由于超声波功率的增加,对柴达木子实体细胞壁破坏逐渐加强,利于多糖的溶出,当超声波功率达到一定值后,随着细胞壁的破坏其它可溶物也大量溶出,阻碍了柴达木子实体多糖的扩散,同时较大的超声波功率也会引起少量多糖的降解。超声波功率为126w时,多糖得率最高,确定126w为最佳超声波功率。
(2)超声波时间对多糖得率的影响
分别称取柴达木大肥菇子实体粉末,按照相同液料比20:1,在超声波功率126w条件下超声波提取5、10、15、20、25min,计算粗多糖的提取含量。结果如图2:多糖含量先逐渐升高,在超声15min时达到最高,随后迅速下降。发生这种现象的原因有可能是由于超声较强的剪切作用,长时间作用破坏多糖的分子结构,促使多糖在外力作用下发生水解反应,使得多糖含量降低。确定15min为最佳超声时间。
(3)液料比对多糖得率的影响
分别以采用液料比10:1、20:1、30:1、40:1、50:1,在超声波功率126w条件下提取15min,计算粗多糖的提取含量。
结果如图3:多糖得率先增加,在液料比为40:1时最高,而后迅速下降。由于有效成分会随着溶剂量的增加而逐渐溶出,当溶剂水平超过一定水平时,细胞中水溶性物质的溶出会远远超过多糖,且多糖会在高水平溶剂量条件下被迅速稀释,导致多糖得率快速降低。因此确定最佳液料比为40:1。
2、响应面优及验证实验
以超声波功率、液料比、超声波时间三个因素,多糖提取含量为响应值,进行试验,共计17次,每个试验点三个平行,结果如表3
表3响应面设计试验结果
注:*为中心试验点。
表4响应面试验结果的方差分析
注:**p<0.01,差异极显著;*p<0.05,差异显著。
表4中,方程的相关系数r2=0.9654,说明96%以上的实验数据可变性可以用该模型来描述。响应值的变异系数(cv%0.6324)较小,说明试验稳定性好,试验操作是可信的;失拟项p>0.05不显著,说明本试验无其它显著影响因素。此外,回归方程系数显著性检验可知,模型的一次项a、b(p<0.05)差异显著,c(p>0.05)差异不显著;二次项a2、b2、c2(p<0.01)差异极显著。
结合表4和表5可知,三个因素对响应值影响的显著性顺序为:a>b>c,即超声功率>液料比>提取时间。将不显著的因素保持低水平状态,显著因素保持在最优代码水平上,如此即可得到粗多糖得率的回归方程为:
y=8.39+0.37875a+0.3625b-0.16875c-0.4475ab-0.235ac+0.2075bc-2.1275a2-1.045b2-0.7375c2,根据回归方程可绘制等高线图,考察各因素间的交互作用影响,确定粗多糖提取条件的优化最优工艺为:超声功率126.85w,液料比36.3:1,提取时间为15min,在此条件下,粗多糖得率的最大预测值为128.25mg/g。
表5多糖回归方程系数显著性分析
从整个试验结果分析表明,以超声波功率126.85w,液料比36.3:1,提取时间为15min为最佳提取工艺,为试验方便进行,将工艺条件修正为超声波功率127w、液料比为36:1、提取时间为15min,进行3次验证实验,每次设定三个平行,测得柴达木大肥菇的粗多糖提取平均含量分别为128.54mg/g、128.41mg/g、128.37mg/g,最终平均值为128.44mg/g,与预测值接近。对验证结果进行多重比较分析,由表6可知,三次验证实验的结果比较均达到了差异显著或极显著程度。
表6响应面验证试验的多重比较
注:“*”表示差异显著,“**”表示差异极显著。
采用超声波提取柴达木大肥菇子实体多糖,通过响应面优化提取工艺,确定超声波提取其多糖最佳工艺条件为:超声功率127w、液料比36:1(ml/g)、提取时间15min,经验证,得到提取率为128.44mg/g,与理论预测值接近。
3、粗多糖纯化最佳工艺条件的确定
a、发酵液粗多糖纯化:以液体深层发酵培养获得的柴达木大肥菇发酵液为研究对象,用乙醇沉淀法提取粗多糖进行多糖的分离纯化研究,选择deae-52纤维素离子层析法,以0.5mol/l的nacl溶液为洗脱剂,以上样浓度、洗脱流速及上样体积为条件进行多糖的分离纯化,确定发酵液多糖分离纯化的最佳工艺体系。结果表明在上样浓度为25mg/ml、上样体积为6ml、洗脱流速为3ml/min的条件下进行纯化,可分离得到三个多糖单组分,能有效分离纯化柴达木大肥菇胞外多糖,其纯化效果好,方法简单可行。
如图4所示,发酵液粗多糖经deae-52纤维素柱层析分离纯化后,每组实验均得到三个洗脱峰,结果表明三组平行实验线型趋势显著,各组分基线离起始点都较近,峰之间完全分离,峰值点均较高,即多糖含量高,整体峰型较窄且峰面积较大,均无拖尾现象,说明分离纯化效果好,达到了此次分离纯化的目的,其回收率达到88.9%,因此,确定最佳工艺条件:上样浓度25mg/ml,上样体积6ml,洗脱速度3ml/min。
b、子实体粗多糖纯化:以柴达木大肥菇子实体为研究对象,经过预处理得到子实体多糖粗提液,采用deae-52纤维素离子树脂层析法,以洗脱曲线为评价指标,对多糖粗提液的上样浓度、上样体积、洗脱流速等纯化条件进行优化,确定分离纯化中子实体粗多糖的最佳工艺体系。结果表明:在上样浓度为15mg/ml、上样体积为5ml及洗脱流速为3ml/min的条件下纯化,粗多糖可明显分离得到三个单组分。
如图5所示,三次平行实验所得到的结果与未纯化的结果相比,线型趋势显著,三个洗脱峰峰型均较窄,没有明显的拖尾现象且每个单组分的最高值点均较高,说明多糖含量高,表明纯化效果好,达到了此次分离纯化的目的,工艺简单可靠。因而,最适柴达木野生大肥菇子实体粗多糖分离纯化的最佳工艺条件为:上样浓度15mg/ml,上样体积5ml,洗脱流速3ml/min。
c、菌丝体粗多糖纯化:柴达木大肥菇菌丝体为研究对象进行多糖分离纯化研究,采用deae-52纤维素阴离子树脂层析法,以上样浓度、洗脱速度以及上样体积为纯化条件,以0.5mol/lnacl溶液为洗脱剂,进行多糖的分离纯化,测定多糖浓度,绘制洗脱曲线,确定菌丝体多糖分离纯化的最佳工艺体系。结果表明,以上样浓度15mg/ml、上样体积0.04bv、洗脱速度3ml/min进行纯化,可将粗多糖明显分离为三个单组份。在此条件下,进行三组平行验证实验,显示菌丝多糖的纯化效果良好。
如图6所示,菌丝体粗多糖经deae-52阴离子树脂纯化后,结果显示线型趋势都较显著,三个峰完全分离,单峰峰值点较高,即多糖含量高,整体峰型较窄,较均一,洗脱峰面积较大,各组分基线离起始点都较近,数据无明显拖尾现象,与纯化前相比,纯化效果显著,表明分离纯化效果好,达到了此次分离纯化的目的,其样品回收率为84%,纯化效率较高。所以,综合考虑纯化负荷与效率、样品有效使用率等因素,确定最佳工艺条件:上样浓度为15mg/ml,上样体积为0.04bv,洗脱速度为3ml/min。
以上已将本发明做一详细说明,以上所述,仅为本发明之较佳实施例而已,当不能限定本发明实施范围,即凡依本申请范围所作均等变化与修饰,皆应仍属本发明涵盖范围内。
- 还没有人留言评论。精彩留言会获得点赞!