一种不依赖于基因型的植物基因编辑方法与流程
本发明涉及植物基因工程
技术领域:
,具体而言,涉及一种不依赖于基因型的植物基因编辑方法。
背景技术:
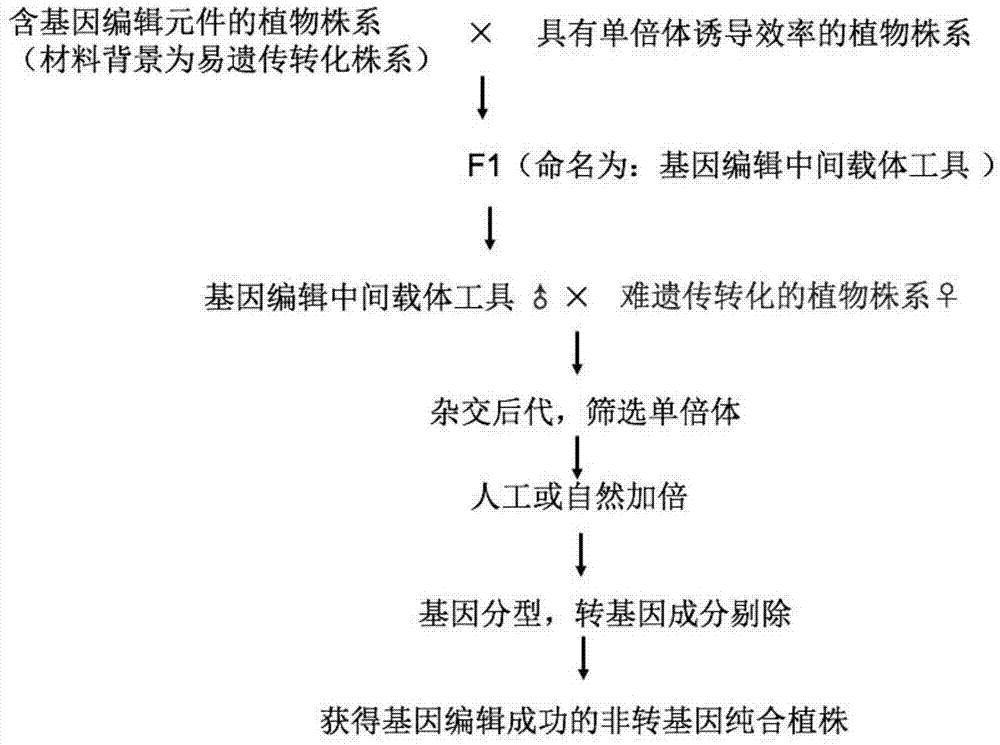
:利用基因编辑技术定点敲除不利基因,从而实现目标性状的精准改良,对于提高作物定向遗传改良效率有很大帮助。2016年,精准的植物基因编辑技术被列为十大科技突破之一,基于crispr-cas9的靶向基因工程可以精准的改善农作物特性,在确保粮食的可持续生产方面表现出了巨大的技术优势和市场潜力。玉米研究方面杜邦先锋公司已成功利用该技术得到了糯玉米、磺酰脲类除草剂抗性、雄性不育和叶舌缺失等基因编辑玉米植株。其他作物方面,已经在马铃薯、牵牛花、芥蓝、水稻、大豆等获得重要进展,展现了巨大的商业价值。尽管基因编辑技术已经较为成熟,但目前玉米、高粱等很多植物基因编辑工作仍有很大的技术瓶颈。存在的主要问题是:基因编辑严重依赖于植物遗传转化技术,而遗传转化技术受基因型限制,且由于经历组织培养过程,通常会产生大量的遗传变异,不利于基因编辑后代材料的快速纯化和应用。常用农杆菌介导的遗传转化方法,同一植物不同基因型对农杆菌敏感度显著不同,以玉米为例,常用于遗传转化的hiii和b104等受体材料,技术优化后转化效率可达到10%左右,但商业化的自交系几乎无法转化成功。高粱、大豆等其他植物也存在类似现象。另一种常用的基因枪介导的方法,同样需要经历繁杂的组织培养再生程序,组培再生也受限于基因型。此外,由于基因枪是物理轰击,轰击细胞损伤较大,细胞内基因碎片化严重,不利于基因编辑后代转基因成分剔除。技术实现要素:为了解决现有基因编辑受限于基因型且需要经过组织培养从而产生大量遗传变异、不利于后代转基因成分的剔除等问题,本发明提供一种不依赖于基因型的植物基因编辑方法。该方法不依赖于基因型且不需要经过复杂的组织培养,可以快速实现对植物基因型的基因编辑,尤其可以解决难转化基因型植物基因的编辑。本发明为解决技术问题所采用的技术方案如下:本发明的一种不依赖于基因型的植物基因编辑方法,以含有基因编辑功能元件的转基因植物株系和具有单倍体诱导效率的植物株系作为基础材料,制备用于基因编辑的具有工具属性的基因编辑中间载体工具,利用该基因编辑中间载体工具,通过杂交同时实现植物单倍体诱导和目标基因编辑,所述基因编辑功能元件包含具有引导基因编辑酶到目标靶点的grna序列。作为优选的实施方式,本发明的一种不依赖于基因型的植物基因编辑方法,主要包括以下步骤:步骤一、构建一种含有基因编辑功能元件的植物表达载体,该植物表达载体进入植物体内后能够实现对目标基因的有效编辑;步骤二、以能够遗传转化的植物材料作为受体材料,利用构建的植物表达载体,进行植物遗传转化,培育转基因植物植株;步骤三、含有基因编辑功能元件的转基因植物株系与具有单倍体诱导效率的植物株系进行杂交,产生f1代植株和后代衍生材料,命名为基因编辑中间载体工具;步骤四、以基因编辑中间载体工具作为父本工具,对目标编辑植物株系进行授粉,获得杂交后代;步骤五、杂交后代材料筛选获得单倍体,种植在温室或田间,单倍体植株加倍,去除杂合体和非整倍体;步骤六、基因型分析,pcr测序鉴定获得基因编辑植株;步骤七、自交授粉后获得非转基因、目的基因发生编辑的植物双单倍体纯合株系。作为优选的实施方式,所述植物表达载体含有除草剂草铵膦抗性和基因编辑功能元件。作为优选的实施方式,基因编辑功能元件的启动子优选但不限制为yao-promoter等在花粉和合子中高表达的启动子,更进一步优选为在精细胞中高表达的启动子。作为优选的实施方式,所述基因编辑功能元件可以选择crispr-cas9、crispr-cpf1、转录激活样效应因子核酸酶(transcriptionactivator-likeeffectornuclease,talen)和锌指核酸酶(zinc-fingernuclease,zfn)等。作为优选的实施方式,步骤二中,所述受体材料为玉米品系、水稻品系、高粱品系或大豆品系。作为更优选的实施方式,所述玉米品系为hiii或b104等,所述高粱品系为吉2731或keller等,所述水稻品系为吉粳88或日本晴等,所述大豆为williams82或沈农9号等。上述植物特征为具有可利用现有的组织培养遗传转化方法容易实现外源基因转入的特点。作为优选的实施方式,步骤二中,所述植物遗传转化方法采用农杆菌介导的植物遗传转化方法。作为优选的实施方式,步骤五中,采用选择小苗进行流式细胞仪检测方法或采用幼胚颜色筛选方法进行单倍体筛选。作为优选的实施方式,步骤五中,采用除草剂涂抹方法,或采用bar检测试纸进行检测,然后进行转基因载体元件pcr测序确认方法,或采用全基因组测序方法实现杂合体的去除。作为优选的实施方式,步骤六中,采用编辑靶点pcr测序方法或采用全基因组测序方法进行基因型分析。本发明还提供了一种基因编辑中间载体工具,该基因编辑中间载体工具同时具有植物单倍体诱导和目标基因编辑功能。本发明提供了上述基因编辑中间载体工具的制备方法,主要包括以下步骤:步骤一、构建一种含有基因编辑功能元件的植物表达载体,该植物表达载体进入植物体内后能够实现对目标基因的有效编辑;步骤二、以能够遗传转化的植物材料作为受体材料,利用构建的植物表达载体,进行植物遗传转化,培育转基因植物植株;步骤三、得到的转基因植物植株中选择具有基因编辑能力的的单株a作为父本,选择具有单倍体诱导能力的株系b作为母本进行杂交,产生的f1代或在后代中进一步筛选具有植物单倍体诱导能力且含有转基因成分的阳性植株即为基因编辑中间载体工具。发明原理:众所周知,双单倍体(dh)育种技术是利用自然发生或人工培育的单倍体植株,经人工或自然加倍获得纯合的二倍体植株。利用dh育种技术选系的优势在于加速选育进程,可实现被选自交系一代纯合,与传统自交选育的需要6-7世代相比,具备明显的技术优势。dh育种技术主要包括三个环节,即单倍体的诱导、单倍体筛选、单倍体加倍。目前常用的单倍体诱导多采用利用诱导系进行杂交授粉,后代筛选单倍体的方法。以玉米为例,世界上上第一个选育成功和目前普遍适用的单倍体诱导系stock6,诱导可产生2.52%的单倍体植株。目前国内外通过杂交改良的方法已经获得多个单倍体诱系,诱导率约为5~15.9%。本发明在开展玉米单倍体诱导基础研究过程中,意外的发现,当赋予单倍体诱导系基因编辑功能后,利用该材料进行单倍体诱导,不但可以完成单倍体诱导,还可以对单倍体直接进行基因编辑。本发明还发现单倍体编辑后,转基因成分并不进入单倍体植株体内,并且基因编辑后的单倍体加倍后可以直接形成一个的目标基因编辑的纯合的新品系。基于该发现,本发明进一步设计了通过制备具有工具属性的基因编辑中间载体开展植物基因编辑的方法,不通过遗传转化即可实现难转化基因型植物的快速基因编辑。该方法不仅限于玉米使用,还适用于所有具有单倍体诱导能力和可以人工授粉的植物,本发明加快了植物基因编辑的研发速度,解决了植物基因编辑中受基因型限制的技术难题。本发明的有益效果为:本发明通过制备含有基因编辑元件且具有单倍体诱导能力的具有工具属性的基因编辑中间载体工具,利用该基因编辑中间载体工具对靶向编辑植株进行授粉,最终实现单倍体诱导、基因编辑和单倍体加倍一次完成的快速基因编辑。与现有技术相比,本发明具有以下优点:1、本发明提供的基因编辑方法不依赖于植物基因型,无需在每次基因编辑时经历复杂的组织培养过程。2、本发明提供的基因编辑方法由于不经历植物组织培养的过程,无组培变异产生,产品安全性更好。3、本发明提供的基因编辑方法产生的后代不含有转基因成分,无需进行转基因成分剔除。4、本发明提供的基因编辑方法不同于传统的基因编辑后再进行单倍体诱导和加倍的研究方法,而是通过构建具有工具属性的基因编辑中间载体工具,经过人工杂交后实现单倍体诱导和基因编辑的同时完成,基因编辑后代材料纯合的速度比传统方法节省2-3代。5、本发明提供的基因编辑方法适合于作物高通量快速基因编辑。6、本发明可应用于任何具有单倍体诱导能力和可以人工授粉的植物,克服了现有技术对受体基因型的限制,对于规模化开展植物基因编辑和育种具有重要意义。附图说明为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。图1为本发明一种不依赖于基因型的植物基因编辑方法的流程示意图。图2为实施例1中基因编辑基础载体pcambia1300-bar-pyao-cas9-mcs的图谱。图3为实施例6提供的8902单倍体诱导后代(8902×f1(xg-18#×stock6))基因编辑突变体29-4突变位置序列比对示例图。图4为实施例6提供的郑单958单倍体诱导后代(郑单958×f1(xg-21#×stock6))29-4基因编辑表型示例图。图5为实施例6提供的8902单倍体诱导后代(8902×f1(xg-18#×stock6))基因编辑突变体5-2突变位置序列比对示例图。图6为实施例6提供的8902单倍体诱导后代(8902×f1(xg-18#×stock6))基因编辑突变体5-2基因编辑表型示例图。图7为单倍体材料bar免疫检测试纸检测结果图。图8为含有基因编辑功能元件的转基因玉米株系的pcr检测结果。具体实施方式本发明的一种不依赖于基因型的植物基因编辑方法,以含有基因编辑功能元件的转基因植物株系和具有单倍体诱导效率的植物株系作为基础材料,制备用于基因编辑的具有工具属性的基因编辑中间载体工具,利用该基因编辑中间载体工具,通过杂交同时实现植物单倍体诱导和目标基因编辑。如图1所示,本发明的一种不依赖于基因型的植物基因编辑方法,主要包括以下步骤:步骤一、构建一种含有基因编辑功能元件的植物表达载体,该植物表达载体含有除草剂草铵膦抗性和基因编辑功能元件,该植物表达载体进入植物体内后能够实现对目标基因的有效编辑。所说的基因编辑功能元件包括但不限于cas9、cpf1等具有基因编辑能力的元件。所说的基因编辑功能元件包含但不限于具有引导基因编辑酶到目标靶点的grna序列。步骤二、以能够遗传转化的植物材料(植物品种/系)作为受体材料,利用构建的植物表达载体,进行植物遗传转化,培育转基因植物植株。所说的能够遗传转化的植物材料即受体材料选择常用的玉米品系,但不限于此,还可以选择水稻品系、高粱品系或大豆品系等可以人工杂交授粉的品系。所说的玉米品系优选hiii或b104等易转化的玉米品系,但不限于这些品系。所说的植物遗传转化方法优选采用农杆菌介导的植物遗传转化方法,但不限于该方法。步骤三、含有基因编辑功能元件的转基因植物株系与具有单倍体诱导效率的植物株系进行杂交,产生f1代植株和后代衍生材料,命名为基因编辑中间载体工具。步骤四、以基因编辑中间载体工具作为父本工具,对目标编辑植物株系进行授粉,获得杂交后代。所说的目标编辑植物株系优选为难遗传转化的植物株系,例如玉米中难以转化基因型玉米自交系或杂交种,但不限于玉米,还可以选择水稻、高粱或大豆等可以人工杂交授粉的植物。步骤五、杂交后代材料筛选获得单倍体,种植在温室或田间,单倍体植株加倍,去除杂合体和非整倍体。优选采用选择小苗进行流式细胞仪检测方法或采用幼胚颜色筛选方法等技术进行单倍体筛选,但不限于此。优选采用除草剂涂抹方法,或采用bar检测试纸进行检测,然后进行转基因载体元件pcr测序确认方法,或采用全基因组测序方法进行杂合体的去除,但不限于此。步骤六、采用编辑靶点pcr测序方法或采用全基因组测序方法进行基因型分析,但不限于此,然后经pcr测序鉴定获得基因编辑植株。步骤七、自交授粉后获得非转基因、目的基因发生编辑的植物双单倍体纯合株系。本发明的一种基因编辑中间载体工具,同时具有植物单倍体诱导和目标基因编辑功能。该基因编辑中间载体工具的制备方法,主要包括以下步骤:步骤一、构建一种含有基因编辑功能元件的植物表达载体,该植物表达载体进入植物体内后能够实现对目标基因的有效编辑。步骤二、以能够遗传转化的植物材料作为受体材料,利用构建的植物表达载体,进行植物遗传转化,培育转基因植物植株。步骤三、得到的转基因植物植株中选择单拷贝且cas9稳定表达的单株a作为父本,选择具有单倍体诱导效率的株系b作为母本进行杂交,产生的f1代或在后代中进一步筛选具有植物单倍体诱导能力且含有转基因成分的阳性植株即为基因编辑中间载体工具。下面将结合实施例对本发明的实施方案进行详细描述,但是本领域技术人员将会理解,下列实施例仅用于说明本发明,而不应视为限制本发明的范围。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。玉米单倍体诱导系stock6、农大高诱5号为目前单倍体育种研究中最为常用的玉米单倍体诱导系。吉诱83号为吉林省农业科学院农业生物技术研究所自选玉米单倍体诱导系。公众可以从科学院农业生物技术研究所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。易转化玉米受体材料hiii来源于玉米自交系a188和玉米自交系b73杂交后代选出的两个自交系pa和pb,以pa为母本,pb为父本产生的杂交种f1。公众可以从吉林省农业科学院农业生物技术研究所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。玉米杂交种郑单958为市售的杂交种,公众可以从市场购买。玉米自交系58为高配合力玉米自交系,公众可以从吉林省农业科学院农业生物技术研究所获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。实施例1基因编辑测试植物表达载体的构建构建一种含有基因编辑功能元件的植物表达载体,该植物表达载体进入植物体内后能够实现对目标基因的有效编辑。该基因编辑功能元件包含具有引导基因编辑酶到目标靶点的grna序列。一、靶标片段pds1-t1的设计为方便观察表型,选用测试性状为白化性状。玉米白化苗性状控制基因pds1(phytoenedesaturase1)基因,maizegdb数据库登陆号为:grmzm2g410515,其序列如序列表中的seqidno:1所示。核苷酸测序结果证实研究选用的易转化受体材料hiii与玉米自交系b73的pds1基因组序列一致,可以根据玉米自交系b73基因组序列设计基因编辑靶点。crispr靶向特异性是由两部分决定的,一部分是rna嵌合体和靶dna之间的碱基配对,另一部分是cas9蛋白和一个短dna序列,这个短的dna序列通常在靶dna的3'末端发现,被称为protospaceradjacentmotif(pam)。pam序列(ccg)。通过利用cripsr-cas9技术在pds1基因外显子附近设计基因编辑靶点。靶点设计采用crispr-p网站进行,采用的策略为单靶点编辑策略,设计的靶标片段为pds1-t1,靶标片段pds1-t1位于目的基因pds1上,其序列为cctgaaaggctatgcatgcc,且双链靶标片段pds1-t1中的一条链具有如下结构:5'-nx-ngg-3',n表示a、g、c和t中的任一种,x=20。利用该靶标片段pds1-t1,预期将在pds1基因外显子上引入indei突变。二、重组质粒pcambia1300-bar-pyao-cas9-pds1-sgrna的构建。如图2所示,人工合成带有白化苗基因敲出靶标片段pds1-t1的grna表达盒,将grna表达盒的双链dna分子插入基因编辑基础载体pcambia1300-bar-pyao-cas9-mcs的多克隆位点区域,获得植物表达载体pcambia1300-bar-pyao-cas9-pds1-sgrna。基因编辑基础载体pcambia1300-bar-pyao-cas9-mcs作为载体骨架由中科院遗传发育所谢旗研究员馈赠。基因编辑调控元件采用的yao-promoter为细胞分裂旺盛组织优先表达的基因,尤其在胚、胚囊、胚乳以及花粉中有很高的表达量。植物表达载体pcambia1300-bar-pyao-cas9-pds1-sgrna的构建工作由上海生物工程有限公司完成。实施例2基因编辑测试植物表达载体玉米遗传转化和转化体创制一、重组质粒pcambia1300-bar-pyao-cas9-pds1-sgrna转化农杆菌及阳性克隆鉴定1.1取200μl农杆菌感受态,加入1-2μl质粒dna,冰浴30min,液氮速冻1min,37℃水;浴5min,加入800μlyep培养基;1.2在28℃条件下,100rpm恢复培养3h,5000g离心1min,弃上清;1.3加入100μlyep培养基;重悬菌体,涂布于含相应抗生素的yep平板上,28℃,培养36-48h;1.4挑取单菌落于5mlyep培养基(含相应抗生素)中,28℃,200rpm培养48h后,提取质粒dna,进行pcr和酶切验证。验证正确的单克隆进行保菌,用于后续的实验。二、农杆菌侵染玉米幼胚及植株再生2.1取适量含目的载体的农杆菌eha105菌体悬浮于yep液体培养基中,28℃,震荡培养,使菌处于对数期;3000rpm离心10min弃上清,菌体用n6液体培养基洗涤,离心收集菌体并用含有100mm乙酰丁香酮的n6液体培养基悬浮菌体,调整od550在0.3左右;2.2剥离授粉后9-12天的hiii幼胚,幼胚直径1.5-2.0mm;经诱导形成胚性愈伤组织,将胚性愈伤组织浸于菌体悬浮液5min,取出并沥干菌液;2.3将胚性愈伤组织转移至共培养基,28℃黑暗培养3天;2.4三天后将胚性愈伤组织转移到静息培养基上,28℃黑暗培养7-10天;2.5静息培养后,将胚性愈伤组织转移到含有双丙氨膦的筛选培养基中,28℃黑暗培养,每两周继代一次,直至上筛选出抗性愈伤组织;2.6将抗性愈伤组织转移至分化培养基,再生植株,获得30个成功转化的转化事件,选择无白化表型的株系进行分子检测,进一步选择含有基因编辑载体的非白化苗杂合植株,移栽温室,杂交授粉后收获种子。选取xg-18#、xg-21#和xg-27#三个转化事件进行下一步研究。2.7设计特异性引物:crispr-cas9-f:cgatccgtgtctcgtacaggcrispr-cas9-r:agatgatcgccaagagcgagpcr反应体系:10×buffer2ul;dntp2ul;r-taq酶2ul;模版1ul;引物f+r0.4ul,水补足20ul。marker:dl2000,胶浓度为1%。pcr检测结果证实成功获得了含有基因编辑功能元件的转基因玉米株系,如图8所示。实施例3基因编辑中间载体工具制备选取xg-18#、xg-21#和xg-27#三个转化事件和具有高单倍体诱导效率的stock6、高诱5号和吉诱83号玉米单倍体诱导系进行温室种植,所有试验遵循正常温室管理方式统一管理。幼苗期取xg-18#、xg-21#和xg-27#叶片进行pcr和试纸条检测,标记除草剂草铵膦阳性和目的基因pcr阳性的植株;开花期时选择阳性标记的材料取花粉给stock6、高诱5号和吉诱83号杂交授粉,授粉后按照温室正常管理标准管理,最终收获材料如表1。该部分材料作为基因编辑中间载体工具,用于下一步研究方法测试。表1基因编辑工具植株收获情况父本/母本stock6高诱5号吉诱83号(自选系)xg-18#2穗3穗2穗xg-21#2穗2穗1穗xg-27#3穗2穗2穗实施例4基因编辑中间载体工具应用温室种植实施例3获得的基因编辑中间载体工具f1(xg-18#×stock6)、f1(xg-21#×stock6)、f1(xg-27#×stock6)、f1(xg-18#×高诱5号)、f1(xg-27#×高诱5号)、f1(xg-18#×吉诱83号)、f1(xg27#×吉诱83号)植株,作为父本与杂交种郑单958和自交系郑58两个测试种进行杂交。所有试验遵循正常温室管理方式统一管理。收获材料如表2。表2基因编辑中间载体工具测试种收获情况父本/母本郑单958郑58f1(xg-18#×stock6)8穗2穗f1(xg-21#×stock6)8穗0穗f1(xg-27#×stock6)10穗2穗f1(xg-18#×高诱5号)9穗2穗f1(xg-27#×高诱5号)6穗0穗f1(xg-18#×吉诱83号)5穗0穗f1(xg27#×吉诱83号)6穗0穗实施例5杂交后代材料田间数据统计种植郑单958×f1(xg-18#×stock6),郑单958×f1(xg-21#×stock6),郑单958×lf1(xg-27#×stock6),郑单958×f1(xg-18#×高诱5号),郑单958×f1(xg-27#×高诱5号),郑单958×f1(xg-18#×吉诱83号),郑单958×f1(xg27#×吉诱83号),郑58×f1(xg-18#×stock6),郑58×f1(xg-27#×stock6),郑58×f1(xg-18#×高诱5号)等材料,苗期管理依据正常田间管理方法进行管理。除草剂叶片涂抹方法确定阴阳性,挂标签标记。田间统计除草剂阴阳性比率,统计出苗数和小苗数量,其中除草剂阴性的小苗为候选单倍体。表3测试杂交种田间数据统计表实施例6单倍型分析、基因型分析和表型鉴定一、单倍体诱导率鉴定采用美国bd公司的facscalibur流式细胞仪(flowcytometric)进行基因组大小检测,并用cellquest(bd公司)软件获取数据,modfit软件(yeritysoftwarehouse公司)分析结果。测定操作程序:取植株新鲜叶片1g,蒸馏水洗净表面尘土,滤纸吸干后放入预冷的培养皿里,加入2ml预冷的解离液,在细胞裂解液中用锋利的刀片切碎整个过程,材料须浸没在解离液里,以便更好的游离细胞核。吸取培养皿内的解离液,用400目的滤膜过滤到1.5ml离心管中,然后置于4℃冰箱中,孵育5min。4℃、1000r/min离心5min后,弃上清后,再加入100ul预冷的解离液,同时加入150ul预冷的pi(propidiumiodide碘化丙啶)染液染料,用对细胞核dna进行荧光标记,置于4℃冰箱暗处染色20min后,用流式细胞仪进行待测样品倍性鉴定。用已知倍性的待测样品的起始材料或同种材料为对照样,通过调节参数将对照样横坐标固定,不改变任何参数,进行待测样检测,根据峰的位置并参考对照样品的峰值位置判断待测样倍性,单倍体峰的所处横坐标位置为二倍体的1/2处,据此判断单倍体。总计115棵小苗中,58棵鉴定为单倍体,其他材料可能为杂合体或非整倍型。二、基因型分析由于采用的单靶点编辑,无法直接从电泳条带大小分析是否发生基因编辑,需要进行pcr产物sanger测序。流式细胞仪鉴定单倍体后,进一步选取白化性状显著的玉米小苗,ctab提取法提取玉米叶片dna。pcr检测引物:pds1-facttctgccagcaatggttg;pds1-rtacgagaattcaggcggacc。pcr反应体系:10×buffer2ul;dntp2ul;r-taq酶2ul;模版1ul;引物f+r0.4ul,水补足20ul。sanger测序工作由吉林省库美生物公司完成,ncbiblast软件比对测序结果表明共计4个单倍体株系发生基因编辑,出现3种突变。1种为单碱基缺失、2种为多碱基缺失。多碱基缺失如图3和图5所示。三、表型观察田间调查研究结果田间观察叶片白化性状与基因表型一致,如图4和图6所示。除草剂试纸条检测发现白花苗表现阴性,如图7所示,除草剂草铵膦与试纸条检测结果一致,表明获得的单倍体植株不携带有外源的植物表达载体组份,为非转基因植株。综合分析流式细胞仪单倍体基因分型和测序比对结果,证实:利用基因编辑中间载体工具可以成功诱导植株产生单倍体,且诱导获得的单倍体中有10-12.5%的比率出现了psd1基因靶标序列不同位点的突变,如表4所示。获得的基因编辑单倍体利用行业内公知的秋水仙素等单倍体加倍技术,很容易实现单倍体的快速加倍,获得的纯合二倍体材料,基因编辑位点是纯合的,且为稳定的自交系/纯系。考虑到本研究中采用的测试性状为白化苗性状,且秋水仙素加倍为公知技术,本发明未开展单倍体加倍研究。依据本发明原理,本发明适用于所有编辑后可育的植物基因位点。上述结果支持本专利实施的可行性。表4测试种单倍型和基因型分析以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。序列表<110>吉林省农业科学院<120>一种不依赖于基因型的植物基因编辑方法<160>1<170>siposequencelisting1.0<210>1<211>2190<212>dna<213>dna(2ambystomalateralexambystomajeffersonianum)<400>1tgtccctttctacggctccaaacaaatgcggaggtctccactcttctctcttcctccatc60ttatcatcgcccacgtacacacccaattcctcgcaactgggctcccccgcctccacgaca120ctgccccccgcctcaagtccgccgcctccattcttcagctctcctatcctccgtctgcct180gtacctattggctgaagcagagctgacccccactttatcaagagttgctcaacaatggac240actggctgcctgtcatctatgaatattactggagctagccagacaagatcttttgcgggg300caacttcctcctcagagatgttttgcgagtagtcactatacaagctttgccgtgaaaaaa360cttgtctcaaggaataaaggaaggagatcacaccgtagacatcctgccttgcaggttgtc420tgcaaggattttccaagacctccactagaaagcacaataaactatttggaagctggacag480ctctcttcattttttagaaacagcgaacgccccagtaagccgttgcaggtcgtggttgct540ggtgcaggattggctggtctatcaacagcgaagtatctggcagatgctggacataaaccc600atattgcttgaggcaagagatgttttgggtggaaaggtagctgcttggaaggatgaagat660ggagattggtacgagactgggcttcatatcttttttggagcttatcccaacatacagaat720ctgtttggcgagcttaggattgaggatcgtttacagtggaaagaacactctatgatattc780gccatgccaaacaagccaggagaattcagccggtttgatttcccagaaactttgccagca840cctataaatgggatatgggccatattgagaaacaatgaaatgcttacctggcccgagaag900gtgaagtttgcaatcggacttctgccagcaatggttggtggtcaaccttatgttgaagct960caagatggcttaaccgtttcagaatggatgaaaaagcagggtgttcctgatcgggtgaac1020gatgaggtttttattgcaatgtccaaggcactcaatttcataaatcctgatgagctatct1080atgcagtgcattttgattgctttgaaccgatttcttcaggagaagcatggttctaaaatg1140gcattcttggatggtaatccgcctgaaaggctatgcatgcctattgttgatcacattcgg1200tctaggggtggagaggtccgcctgaattctcgtattaaaaagatagagctgaatcctgat1260ggaactgtaaaacacttcgcacttagtgatggaactcagataactggagatgcttatgtt1320tgtgcaacaccagtcgatatcttcaagcttcttgtacctcaagagtggagtgaaattact1380tatttcaagaaactggagaagttggtgggagttcctgttatcaatgttcatatatggttt1440gacagaaaactgaacaacacatatgaccaccttcttttcagcaggagttcacttttaagt1500gtctatgcagacatgtcagtaacctgcaaggaatactatgacccaaaccgttcaatgctg1560gagttggtctttgctcctgcagacgaatggattggtcgaagtgacactgaaatcatcgat1620gcaactatggaagagctagccaagttatttcctgatgaaattgctgctgatcagagtaaa1680gcaaagattcttaagtatcatattgtgaagacaccgagatcggtttacaaaactgtccca1740aactgtgagccttgccggcctctccaaaggtcacctatcgaaggtttctatctagctggt1800gattacacaaagcagaaatacctggcttccatggaaggtgcagtcctatccgggaagctt1860tgcgcccagtccattgtgcaggattatagcaggctcacactcaggagccagaaaagccta1920caatcaggagaagttcccgtcccatcttagttgtagttggctttagctatcgtcatcccc1980actgggtgctatcttatctcctatttcaatgggaacccacccaatggtcatgttggagac2040aacacctgttatggtcctttgaccatctcgtggtgactgtagttgatgtcatattcggat2100atatatgtaaaaggatctgcatagcaattgttagacctttgggaaagcaaaagcgataaa2160gagatctcagatagatattgtgttctttca2190当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1