一种生物活性多肽DQDLVLI及其制备方法和应用与流程
本发明涉及蛋白领域,尤其是涉及一种生物活性多肽dqdlvli及其制备方法和应用。
背景技术:
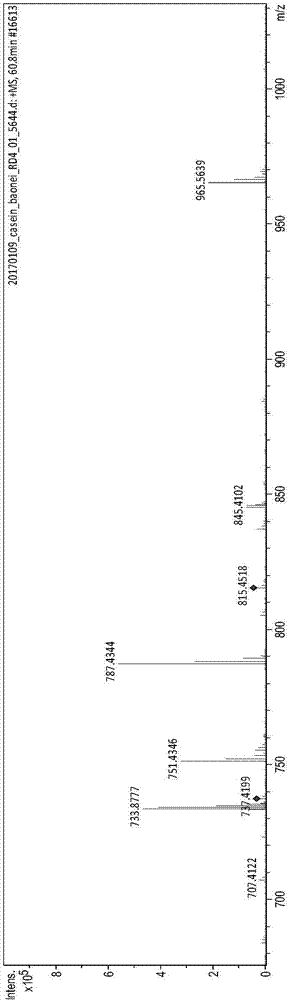
在牛乳经乳酸菌发酵的过程中,牛乳中的一部分蛋白质被乳酸菌代谢利用,并发生了一系列生理生化反应,使蛋白质变为多肽或者游离的氨基酸,被人体消化吸收或通过小肠上皮细胞的吸收转运直接进入人体的血液循环。乳酸菌菌体也存在一些自身合成的蛋白质多肽片段,供细菌生长利用。在这些多肽中,有一部分具有特殊的生理功能,被称为“生物活性肽”。在天然食物来源中寻找安全的生物活性肽尤为重要。近些年来,人们发现一些食物来源的多肽类物质具有良好的生物活性,如玉米短肽、大豆肽、牛乳多肽等。这些多肽可以通过微生物发酵、消化酶解等多种途径得到,并且大多具有生物活性的多肽是由2~20个氨基酸残基组成,分子量小于6000da,含有一定量的疏水氨基酸、芳香族氨基酸。免疫活性肽是继阿片肽发现后首次从乳中获得并证明其生理活性的一类生物活性多肽。1981年jolles等人首次发现,利用胰蛋白酶水解人乳蛋白,可以得到一个氨基酸序列为val-glu-pro-ile-pro-tyr的六肽,体外实验证明该肽能够增强小鼠腹腔巨噬细胞对绵羊红细胞的吞噬作用。migliore-samour等人发现来自酪蛋白的六肽thr-thr-met-pro-leu-trp能够刺激绵羊血红细胞对小鼠腹膜巨噬细胞的吞噬作用以及增强对于肺炎克雷伯菌的抵抗,具有抗炎功能。李素萍等人用合成的乳源肽(pgpipn)饲喂大鼠发现大鼠腹腔巨噬细胞的吞噬作用和红细胞相关的抗炎功能有显著的增强。研究表明,免疫活性肽不仅能够增强机体免疫力,刺激机体淋巴细胞的增殖,增强巨噬细胞的吞噬功能,促进细胞因子的释放、促进巨噬细胞一氧化氮诱生量的增加、提高机体抵御外界病原体感染的能力,降低机体发病率,而且不会引起机体的免疫排斥反应。衰老是一个自然现象,且过程常伴有抗氧化水平、器官组织、免疫因子的变化,其中细胞因子发生着复杂的变化,如促炎细胞因子il-6、il-4、tnf-α等呈现增长的趋势,il-6与tnf-a均被认为在老年性疾病的发生过程中扮演重要角色。随着遗传学和分子生物学的发展,生物衰老机理的研究取得了可喜的进展。研究人员通过利用一些模式生物,如小鼠、果蝇和秀丽线虫等的单一基因突变实验,发现有些基因能够显著增加这些生物体的寿命达6倍之多。抗衰老肽作为一种新兴的抗衰老剂,在生理功能方面具有氨基酸所不能比拟的优势,其能对生物体内的酶产生促进或抑制作用,改善对矿物质及其他营养元素的吸收和利用,清除体内自由基,增强机体自身的抗氧化力,以延缓衰老。因此,生物活性肽的营养保健作用已成为国内外学者课题研究的重点。邱隽等人经实验研究发现,乳源性生物活性小肽能有效延长果蝇寿命,延缓其衰老,并且还具有较好的抗氧化作用,推测可能是其中富含琉基肽类。周之辉等发现牛初乳提取物能显著性提高老年人体内血清中sod活力,减少其脂质过氧化物和增强机体抗氧化力,具有一定的抗衰老功能。目前关于生物活性多肽的研究有很多,比如中国专利cn105254738a公布了一种来源于β-酪蛋白的乳源性生物活性多肽delqdkih,中国专利cn105254739a公布了一种来源于αs1-酪蛋白的乳源性生物活性多肽gtqytd,中国专利cn105254740a公布了一种来源于αs2-酪蛋白的乳源性生物活性多肽nqfyqkf。技术实现要素:本发明的目的在于提供一种生物活性多肽dqdlvli及其制备方法和应用。本发明的目的可以通过以下技术方案来实现:本发明第一方面,提供一种生物活性多肽dqdlvli,其氨基酸序列为asp-gln-asp-leu-val-leu-ile,如seqidno:1所示。较优的,所述生物活性多肽来源于瑞士乳杆菌菌体蛋白。具体来源于>lbh_1022|m.953lbh_1022|g.953orflbh_1022|g.953lbh_1022|m.953type:completelen:565(+)lbh_1022:1-1695(+)蛋白,并且为此蛋白第32~38位的氨基酸残基。>lbh_1022|m.953lbh_1022|g.953orflbh_1022|g.953lbh_1022|m.953type:completelen:565(+)lbh_1022:1-1695(+)蛋白氨基酸序列如seqidno:3所示。>lbh_1022|m.953lbh_1022|g.953orflbh_1022|g.953lbh_1022|m.953type:completelen:565(+)lbh_1022:1-1695(+)蛋白的氨基酸序列以及对应的核苷酸序列为既有技术,编码此蛋白第32~38位氨基酸残基的核苷酸片段能编码成熟的生物活性多肽dqdlvli。较优的,所述生物活性多肽具有抗炎功能和抗衰老功能。本发明第二方面,提供了编码所述生物活性多肽dqdlvli的核苷酸片段,其序列为:5’-atcaagacttggttttaatct-3’,如seqidno:2所示。本发明第三方面,提供了所述生物活性多肽dqdlvli的制备方法,可以通过基因工程的方法人工合成,可以从瑞士乳杆菌菌体通过细胞破碎分离纯化的方法直接获得,可以直接通过化学合成制备。本发明第四方面,提供了所述生物活性多肽dqdlvli在制备具有抗炎功能的食品、保健品、药物或化妆品中的应用。本发明第五方面,提供了所述生物活性多肽dqdlvli在制备具有抗衰老功能的食品、保健品或药物中的应用。本发明第六方面,提供了所述生物活性多肽dqdlvli在制备同时具有抗炎功能和抗衰老功能的食品、保健品或药物中的应用。具体而言,本发明的生物活性多肽dqdlvli可以用于制备减少自由基对皮肤伤害的化妆品、制备具有抗炎和/或抗衰老的药物;并且由于本发明的生物活性多肽dqdlvli通过胃肠道降解后的产物仍旧具有生物活性,因此还可以用于制备酸奶等食品、调节免疫力的保健品,以及口服的用于制备具有抗炎和/或抗衰老的药物。本发明第七方面,提供了一种抗炎产品,包括所述生物活性多肽dqdlvli或所述生物活性多肽dqdlvli的衍生物;所述的抗炎产品包括抗炎食品、抗炎保健品、抗炎药物或抗炎化妆品;所述生物活性多肽dqdlvli的衍生物,是指在生物活性多肽dqdlvli的氨基酸侧链基团上、氨基端或羧基端进行羟基化、羧基化、羰基化、甲基化、乙酰化、磷酸化、酯化或糖基化等修饰,得到的多肽衍生物。本发明第八方面,提供了一种抗衰老产品,包括所述生物活性多肽dqdlvli或所述生物活性多肽dqdlvli的衍生物;所述的抗衰老产品包括抗衰老食品、抗衰老保健品或抗衰老药物;所述生物活性多肽dqdlvli的衍生物,是指在生物活性多肽dqdlvli的氨基酸侧链基团上、氨基端或羧基端进行羟基化、羧基化、羰基化、甲基化、乙酰化、磷酸化、酯化或糖基化等修饰,得到的多肽衍生物。本发明第九方面,提供了一种同时具有抗炎功能和抗衰老功能的产品,包括所述生物活性多肽dqdlvli或所述生物活性多肽dqdlvli的衍生物;具有抗炎功能和抗衰老功能的产品包括食品、保健品或药物;所述生物活性多肽dqdlvli的衍生物,是指在生物活性多肽dqdlvli的氨基酸侧链基团上、氨基端或羧基端进行羟基化、羧基化、羰基化、甲基化、乙酰化、磷酸化、酯化或糖基化等修饰,得到的多肽衍生物。本发明生物活性多肽dqdlvli的有益效果为:本发明的生物活性多肽dqdlvli具有较好的抗炎活性和抗衰老活性;一方面,本发明的生物活性多肽dqdlvli能够促进巨噬细胞分泌细胞因子,促进巨噬细胞一氧化氮诱生量的增加,提高机体抵御外界病原体感染的能力,降低机体发病率;另一方面,能够提高体内抗过氧化酶系的活力,增强机体抵抗外源性刺激的功能,从而降低机体老化、衰老和生病的机率,对开发具有抗炎功能、抗衰老功能的食品、保健品和药物具有十分重要的意义。附图说明图1:质量色谱提取图(m/z=815.4518);图2:质荷比为815.4518的片段的二级质谱图;图3:质荷比为815.4518的多肽az、by断裂情况;图4:il-4标准曲线;图5:生物活性多肽dqdlvli对细胞因子il-4分泌量的影响;图6:各组实验动物小鼠脾脏变化情况;(a)为低剂量灌胃组小鼠脾脏组织图;(b)为高剂量灌胃组小鼠脾脏组织图;(c)为空白组小鼠脾脏组织;(d)为动物模型组小鼠脾脏组织图;图7:各组小鼠血清il-6变化表;图8:各组小鼠血清tnf-α变化表。具体实施方式在进一步描述本发明具体实施方案之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本
技术领域:
技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本
技术领域:
的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本
技术领域:
常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecularcloning:alaboratorymanual,secondedition,coldspringharborlaboratorypress,1989andthirdedition,2001;ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,1987andperiodicupdates;theseriesmethodsinenzymology,academicpress,sandiego;wolffe,chromatinstructureandfunction,thirdedition,academicpress,sandiego,1998;methodsinenzymology,vol.304,chromatin(p.m.wassarmananda.p.wolffe,eds.),academicpress,sandiego,1999;和methodsinmolecularbiology,vol.119,chromatinprotocols(p.b.becker,ed.)humanapress,totowa,1999等。下面结合附图和具体实施例对本发明进行详细说明。实施例1活性肽dqdlvli的人工合成一、生物活性肽的合成1.称取rink树脂3g(取代度0.3mmol/g)于150ml的反应器中,用50ml的二氯甲烷(dcm)浸泡。2.2小时后,用3倍树脂体积的氮-二甲基甲酰胺(dmf)洗涤树脂,然后抽干,如此重复四次,将树脂抽干后待用。3.向反应器中加入一定量的20%哌啶(哌啶/dmf=1:4,v:v),放在脱色摇床上摇晃20min,以此来脱去树脂上的fmoc保护基团。脱完保护后用3倍树脂体积的dmf洗涤四次,然后抽干。4.取少量树脂用茚三酮(九井水合茚三酮)法检测(检a、检b各两滴,100℃反应1min),树脂有颜色,说明脱保护成功。5.称取氨基酸asp适量和1-羟基-苯骈三唑(hobt)适量于50ml的离心管中,加入20ml的dmf将其溶解,然后加入3ml的n,n二异丙基碳二亚胺(dic)振荡摇匀1min,待溶液澄清后加入到反应器中,然后将反应器置于30℃的摇床中反应。6.2小时后,用一定量的醋酸酐封头(醋酸酐:diea:dcm=1:1:2,v:v:v)半小时,然后用3倍树脂体积的dmf洗涤四次,抽干待用。7.向反应器中加入一定量的20%哌啶(哌啶/dmf=1:4,v:v),放在脱色摇床上摇晃20min,以此来脱去树脂上的fmoc保护基团。脱完保护后用dmf洗涤四次,然后抽干。8.取少量树脂用茚三酮(九井水合茚三酮)法检测(检a、检b各两滴,100℃反应1min),树脂有颜色,说明脱保护成功。9.称取后面第二个氨基酸适量和hobt适量于50ml的离心管中,加入25ml的dmf将其溶解,然后加入2.5ml的dic振荡摇匀1min,待溶液澄清后加入到反应器中,然后将反应器置于30℃的摇床中反应。10.1小时后,取少量树脂检测,用茚三酮法检测(检a、检b各两滴,100℃反应1min),若树脂为无色,说明反应完全;若树脂有颜色,说明缩合不完全,继续反应。11.待反应完全后,用dmf洗涤树脂四次,然后抽干,向反应器中加入一定量的20%哌啶(哌啶/dmf=1:4,v:v),放在脱色摇床上摇晃20min,以此来脱去树脂上的fmoc保护基团。脱完保护后用dmf洗涤四次,然后抽干检测保护是否脱去。12.按照步骤9-11依次接上氨基酸gln、asp、leu、val、leu和ile。13.待接上最后一个氨基酸后,脱去保护,用dmf洗涤四次,然后用甲醇将树脂抽干。然后用95切割液(三氟乙酸:1,2乙二硫醇:3,异丙基硅烷:水=95:2:2:1,v:v:v)将多肽从树脂上切割下来(每克树脂加10ml切割液),并用冰乙醚(切割液:乙醚=1:9,v:v)离心沉降四次。至此,人工合成了生物活性肽dqdlvli。二、生物活性肽的确认1)uplc分析uplc条件如下:仪器:watersacquityuplc超高效液相-电喷雾-四级杆-飞行时间质谱仪色谱柱规格:behc18色谱柱流速:0.4ml/min温度:50℃紫外检测波长:210nm进样量:2μl梯度条件:a液:含有0.1%甲酸(v/v)的水,b液:含有0.1%甲酸(v/v)的乙腈2)质谱分析质谱条件如下:离子方式:es+质量范围(m/z):100-1000毛细管电压(capillary)(kv):3.0采样锥(v):35.0离子源温度(℃):115去溶剂温度(℃):350去溶剂气流(l/hr):700.0碰撞能量(ev):4.0扫描时间(sec):0.25内扫描时间(sec):0.02根据以上分析方法,利用超高效液相-电喷雾-四级杆-飞行时间质谱,对生物活性肽dqdlvli进行色谱分析和质谱分析,其质量色谱提取图如图1所示,提取此峰的二级质谱图和az、by断裂情况如图2和3所示,可得此峰的多肽质荷比为815.4518da,保留时间是60.8min。3)结果由图3可知,根据az、by断裂的情况,经过mascot软件分析计算,得到质荷比815.4518da的片段序列为asp-gln-asp-leu-val-leu-ile(dqdlvli),记为seqidno:1。该片段与lbh_1022|m.953lbh_1022|g.953orflbh_1022|g.953lbh_1022|m.953type:completelen:565(+)lbh_1022:1-1695(+)蛋白第32~38位的残基序列相对应,序列见seqidno:3。实施例2生物活性肽的抗炎活性实验一、生物活性多肽dqdlvli的促巨噬细胞分泌细胞因子的实验(elisa法)1.实验试剂及仪器:试剂:实验动物balb/c小鼠(雄性6-8周龄),上海斯莱克实验动物有限公司;小鼠淋巴细胞提取液,上海索莱宝生物科技有限公司;rpmi1640培养基,gibco公司;牛血清白蛋白(bovineserumalbumin,bsa),genebase公司;实施例1获得的生物活性多肽dqdlvli;elisa细胞因子快速试剂盒(il-4),武汉博士德生物工程有限公司。仪器设备:cm-230型摩尔超净水,上海摩勒科学仪器有限公司;lrh-250f生化培养箱,上海恒科技有限公司;gl-22m高速冷冻离心机,上海卢湘仪离心机仪器有限公司;heracell150co2培养箱,heraeus公司;dragonwellscanmk3酶标仪,labsystems公司。2.实验方法:(1)标准曲线的制备制作il-4标准曲线:将浓度为500pg/ml,250pg/ml,125pg/ml,62.5pg/ml,31.3pg/ml,15.6pg/ml,7.8pg/ml的il-4标准品分别依次加入酶标板孔内,再加入生物素标记抗小鼠il-4抗体(elisa细胞因子快速试剂盒),酶标板加上盖,37℃反应90min。甩去酶标板内液体,每孔依次加入亲和素-过氧化物酶复合物(elisa细胞因子快速试剂盒)0.1ml。37℃反应60min。0.01mpbs洗涤3次,每孔加入0.1mlabc工作液,37℃反应30min。0.01mpbs洗涤5次,每孔加入90ultmb显色液,37℃避光反应25min。每孔加入0.1mltmb终止液,用酶标仪在450nm测定吸光值。制作的il-4检测用标准曲线如图4所示。il-4标准曲线是以浓度为横坐标(单位pg/ml),450nm下的吸光值为纵坐标,进行一次回归拟合,获得标准曲线y=0.0038x+0.1224,r2=0.9979。其中x代表il-4浓度,单位为pg/ml,y代表od450下的吸光值。(2)多肽dqdlvli的促巨噬细胞分泌细胞因子检测在无菌条件下取小鼠脾脏淋巴细胞,调整细胞浓度至5×105/ml接种于96孔板,实验组加入生物活性多肽dqdlvli进行培养,调整生物活性多肽dqdlvli的终浓度分别为100,50,10μg/ml,与淋巴细胞共同培养36小时后进行细胞因子il-4的测定。空白组不加生物活性多肽dqdlvli,培养36h作为对照。3.实验结果及分析:实验结果见图5,与空白对照组相比,随着多肽浓度的增加,il-4的分泌量逐渐增加;当多肽添加浓度达到50和100μg/ml时,il-4分泌量显著大于空白组;可见生物活性多肽dqdlvli具有促进淋巴细胞增殖的功能,并且通过对il-4细胞因子分泌的调节,起到对机体体液免疫的调节作用。二、生物活性多肽dqdlvli的促巨噬细胞一氧化氮诱生量的测定(griess法)1.实验试剂及仪器:试剂:实验动物balb/c小鼠(雄性6-8周龄)上海交通大学农业与生物学院动物实验中心;实施例1获得的生物活性多肽dqdlvli;lps,购自sigma公司;中性红染色液,碧云天生物技术研究所生产。仪器设备:lrh-250f生化培养箱上海恒科技有限公司;gl-22m高速冷冻离心机上海卢湘仪离心机仪器有限公司;heracell150co2培养箱heraeus公司;dragonwellscanmk3酶标仪labsystems公司。2.试验方法:加入细胞个数为2×106/ml的细胞悬液100μl/孔,贴壁纯化后加入含肽的rpmi1640完全培养液(10%fbs)200μl/孔,炎症组在24h时加入lps至终浓度10μg/ml,连续培养48h后,收集培养液上清50μl/孔,在培养液上清中依次添加griess试剂1和griess试剂2各50μl/孔,室温反应10分钟后,在540nm波长下测定吸光度值(od540)。3.实验结果及分析:表1生物活性多肽dqdlvli促巨噬细胞一氧化氮诱生量的测定实验分组正常组炎症组细胞空白0.0592±0.005250.3241±0.0381dqdlvli1mg/ml0.1373±0.0622**0.4972±0.0614**dqdlvli0.5mg/ml0.1256±0.0135**0.3913±0.0345**dqdlvli0.1mg/ml0.2675±0.0145**注:*,与阴性对照比较,有显著性差异(p<0.05);**,与阴性对照组比较,有显著性差异(p<0.01)实验结果见表1,由表1可知,在实验组中添加生物活性多肽dqdlvli,浓度分别为1mg/ml和0.5mg/ml,对于正常情况下生长和lps造炎症情况下生长的促进巨噬细胞的一氧化氮诱生量均有促进作用。与细胞空白组相比,具有显著性差异(p<0.05)。当生物活性多肽dqdlvli的添加浓度为0.1mg/ml,在lps造炎症情况下相比,也能促进巨噬细胞一氧化氮诱生量的增加,并具有显著性差异(p<0.05)。但是与正常情况下生长的细胞空白组相比,没有显著性差异。说明生物活性多肽dqdlvli在一定浓度条件下具有促进巨噬细胞一氧化氮诱生量增加的能力。实施例3生物活性肽的抗衰老活性实验一、生物活性多肽dqdlvli对体内脾脏组织结构作用的实验1.实验试剂及仪器:试剂:实验动物icr小鼠(雄性5周龄),上海市实验动物中心;d-gal,国药集团化学试剂有限公司;多聚甲醛,国药集团化学试剂有限公司;氯化钠,国药集团化学试剂有限公司;实施例1获得的生物活性多肽dqdlvli。仪器设备:cm-230型摩尔超净水,上海摩勒科学仪器有限公司;密理博milliporemillexgp0.22μm滤膜,美国密理博公司;gl-22m高速冷冻离心机,上海卢湘仪离心机仪器有限公司。2.实验方法:(1)动物衰老模型造模将icr小鼠适应性饲养一周后,分为4组,每组6只。组1为低剂量灌胃组,小鼠每天以500mg/kg的剂量颈背部皮下注射d-gal,并以1mg/只·天的剂量灌胃生物活性多肽dqdlvli;组2为高剂量灌胃组,小鼠每天以500mg/kg的剂量颈背部皮下注射d-gal,并且3mg/只的·天剂量灌胃生物活性多肽dqdlvli;组3为空白组,小鼠正常生长;组4为动物模型组,小鼠每天以500mg/kg的剂量颈背部皮下注射d-gal,并且灌胃浓度为0.9%的生理盐水;d-gal的注射周期与多肽的灌胃周期均为42天。每3天更换垫料,并保证饲料与蒸馏水的供给。每五天称量一次小鼠的体重,根据小鼠的体重配制d-gal注射液,且d-gal注射液经0.22μm针筒式滤膜过滤,以保证无菌。(2)获取动物脏器实验周期完成后,以摘眼球取血法获取小鼠的血液,获得血液后断颈处死小鼠,而后将小鼠的躯体置于低温冰盒上,并迅速摘取小鼠的大脑、脾脏、肝脏和肾脏,所获得的脏器均放置于预先灭菌的1.5ml离心管中,所有器官样品均保存在-80℃冰箱内备检。处置实验动物过程中的所有操作遵循2006年科学技术部发布的《关于善待实验动物的指导性意见》。所摘取的小鼠脾脏直接浸泡于预先配制好的4%多聚甲醛溶液中,以固定其形态。多聚甲醛粉末较为难溶,可以加入微量的碳酸氢钠将ph值调节至碱性,以助溶。多聚甲醛溶液的配制需要在通风橱内完成。(3)样品检测组织切片的制作:小鼠脾脏样品需在4%多聚甲醛溶液中至少固定24小时。脾脏组织的蜡块制作、切片与he染色均委托上海威奥生物科技有限公司完成。3.实验结果及分析:在本实验中,共有4组小鼠,其中空白组的小鼠正常生长未受到任何外界刺激,其余3组小鼠均接受了d-gal的长期注射。利用光学显微镜,对不同组小鼠的脾脏切片进行观察,从图6中可发现,对比各组小鼠的脾脏切片,相对于空白组小鼠而言,动物模型小鼠的脾脏红髓与白髓界限模糊,且白髓出现萎缩,表明长期的d-gal注射使小鼠的糖代谢途径发生紊乱,导致抗氧化酶活降低、过氧化物堆积,进而可能引发了脾脏的衰老与萎缩。而灌胃多肽组的小鼠的脾脏组织相对于动物模型组小鼠则白髓萎缩程度较轻,且红髓与白髓的界限较为分明。此结果说明,在整个d-gal的注射周期内,实验动物持续不断地受到致衰老因子的刺激,导致脾脏的衰老与萎缩。因此从组织结构变化的情况来看,本实验中所发明的生物活性多肽dqdlvli对动物因受到不良因子的刺激引起的的脾脏衰老与萎缩具有一定的保护作用。二、生物活性多肽dqdlvli对体内器官抗氧化水平作用的实验1.实验试剂及仪器:试剂:实验动物icr小鼠(雄性5周龄),上海市实验动物中心;d-gal,国药集团化学试剂有限公司;多聚甲醛,国药集团化学试剂有限公司;氯化钠,国药集团化学试剂有限公司;实施例1获得的生物活性多肽dqdlvli;bca蛋白试剂盒,南京凯基生物科技有限公司;mda脂质过氧化物试剂盒,南京凯基生物科技有限公司;sod超氧化物歧化酶试剂盒,南京建成生物科技有限公司。仪器设备:cm-230型摩尔超净水,上海摩勒科学仪器有限公司;密理博milliporemillexgp0.22μm滤膜,美国密理博公司;gl-22m高速冷冻离心机,上海卢湘仪离心机仪器有限公司。2.实验方法:(1)动物衰老模型造模将icr小鼠适应性饲养一周后,分为4组,每组6只。组1为低剂量灌胃组,小鼠每天以500mg/kg的剂量颈背部皮下注射d-gal,并以1mg/只·天的剂量灌胃生物活性多肽dqdlvli;组2为高剂量灌胃组,小鼠每天以500mg/kg的剂量颈背部皮下注射d-gal,并且3mg/只的·天剂量灌胃生物活性多肽dqdlvli;组3为空白组,小鼠正常生长;组4为动物模型组,小鼠每天以500mg/kg的剂量颈背部皮下注射d-gal,并且灌胃浓度为0.9%的生理盐水;d-gal的注射周期与多肽的灌胃周期均为42天。每3天更换垫料,并保证饲料与蒸馏水的供给。每五天称量一次小鼠的体重,根据小鼠的体重配制d-gal注射液,且d-gal注射液经0.22μm针筒式滤膜过滤,以保证无菌。(2)获取动物脏器实验周期完成后,以摘眼球取血法获取小鼠的血液,获得血液后断颈处死小鼠,而后将小鼠的躯体置于低温冰盒上,并迅速摘取小鼠的大脑、脾脏、肝脏和肾脏,所获得的脏器均放置于预先灭菌的1.5ml离心管中,所有器官样品均保存在-80℃冰箱内备检。处置实验动物过程中的所有操作遵循2006年科学技术部发布的《关于善待实验动物的指导性意见》。所摘取的小鼠脾脏直接浸泡于预先配制好的4%多聚甲醛溶液中,以固定其形态。多聚甲醛粉末较为难溶,可以加入微量的碳酸氢钠将ph值调节至碱性,以助溶。多聚甲醛溶液的配制需要在通风橱内完成。(3)样品检测所有需检测的脏器,均在低温环境下研磨,并用4℃无菌pbs溶液稀释成10%的组织匀浆液,4℃条件下4000g离心后,吸取取上清液,弃去沉淀,根据试剂盒说明书操作,或置于-80℃冰箱待测。3.实验结果及分析:表2各组实验动物小鼠不同器官内sod含量的变化注:*标示与模型组对照比较,有显著性差异(p<0.05);**标示与模型组对照比较,有显著性差异(p<0.01),下同。从表2中可知,相对于动物模型组小鼠,多肽灌胃组小鼠的肝脏与肾脏中的sod含量均呈现显著性的增加(p<0.01)。意味着多肽灌胃组的小鼠虽然受到长期大剂量的d-gal的刺激,即使d-gal的过量注射也没有完全破坏小鼠体内sod酶系,说明在注射周期内,实验动物在持续不断地受到致衰老因子的刺激情况下,会导致不同器官内sod含量的减少,但同时摄入一定量的多肽dqdlvli对小鼠体内的氧化损伤具有一定保护作用。表3各组实验动物小鼠不同器官内mda含量的变化情况从表3中可知,动物模型组小鼠的肝脏mda含量为26.86±7.04nmol/l,与动物模型组比较,多肽灌胃的两组小鼠肝脏中的mda含量呈现显著性差异(p<0.01)。由于mda可用于估计动物体内脂质过氧化物的堆积情况,故由此可知,动物模型组小鼠在致衰老模型形成过程中,由于过量的d-gal的长期注射,使小鼠的糖代谢途径发生紊乱,产生大量自由基从而造成氧化损伤,其肝脏组织内出现大量脂质过氧化物,mda作为脂质过氧化物,其在动物体内含量的升高,能从侧面反应出小鼠体内抗氧化酶系活力的降低。而多肽灌胃组小鼠肝脏mda含量的显著降低,说明多肽dqdlvli的摄入能有效地保护重要组织器官免受不良因子刺激产生大量的脂质过氧化物。三、生物活性多肽dqdlvli的对血清中免疫细胞因子作用的实验1.实验试剂及仪器:试剂:实验动物icr小鼠(雄性5周龄),上海市实验动物中心;d-gal,国药集团化学试剂有限公司;多聚甲醛,国药集团化学试剂有限公司;氯化钠,国药集团化学试剂有限公司;实施例1获得的生物活性多肽dqdlvli;bca蛋白试剂盒,南京凯基生物科技有限公司;elisa细胞因子快速试剂盒(tnf-α和il-6),武汉博士德生物工程有限公司。仪器设备:cm-230型摩尔超净水,上海摩勒科学仪器有限公司;密理博milliporemillexgp0.22μm滤膜,美国密理博公司;gl-22m高速冷冻离心机,上海卢湘仪离心机仪器有限公司。2.实验方法:(1)动物衰老模型造模将icr小鼠适应性饲养一周后,分为4组,每组6只。组1为低剂量灌胃组,小鼠每天以500mg/kg的剂量颈背部皮下注射d-gal,并以1mg/只·天的剂量灌胃生物活性多肽dqdlvli;组2为高剂量灌胃组,小鼠每天以500mg/kg的剂量颈背部皮下注射d-gal,并且3mg/只的·天剂量灌胃生物活性多肽dqdlvli;组3为空白组,小鼠正常生长;组4为动物模型组,小鼠每天以500mg/kg的剂量颈背部皮下注射d-gal,并且灌胃浓度为0.9%的生理盐水;d-gal的注射周期与多肽的灌胃周期均为42天。每3天更换垫料,并保证饲料与蒸馏水的供给。每五天称量一次小鼠的体重,根据小鼠的体重配制d-gal注射液,且d-gal注射液经0.22μm针筒式滤膜过滤,以保证无菌。(2)获取动物脏器与血清实验周期完成后,以摘眼球取血法获取小鼠的血液,获得血液后断颈处死小鼠,而后将小鼠的躯体置于低温冰盒上,小鼠血液室温静置1小时后,以3000g离心15min,分离血清。血清保存在-80℃冰箱内待检。处置实验动物过程中的所有操作遵循2006年科学技术部发布的《关于善待实验动物的指导性意见》。所摘取的小鼠脾脏直接浸泡于预先配制好的4%多聚甲醛溶液中,以固定其形态。多聚甲醛粉末较为难溶,可以加入微量的碳酸氢钠将ph值调节至碱性,以助溶。多聚甲醛溶液的配制需要在通风橱内完成。(3)样品检测根据试剂盒说明书指示,首先绘制标准曲线,将标准品粉末用标准品稀释液配制成1000pg/ml的溶液,再连续稀释为500pg/ml、250pg/ml、125pg/ml、62.5pg/ml、31.3pg/ml、15.6pg/ml等不同浓度。每个浓度梯度溶液移取100μl于已包被抗体的酶标板中。吸取小鼠血清样品100μl,加入同一块酶标板中(若血清样品不够,可适当稀释后再检测计算时需按比例折算)。盖上酶标板,将其置于37℃环境下孵育90min。反应完毕后,小心甩去酶标板内的液体,并将酶标板置于吸水纸上,小心拍打,除去多余液体。将预热好的生物素抗抗体工作液按每孔100μl依次加入酶标板各孔内,37℃下,反应60min。反应完毕后,利用0.01m的pbs溶液洗涤3次,每次每孔内加入100μl的pbs,浸泡1min后倾去溶液,反复3次。将预热好的abc工作液按每孔0.1ml依次加入,37℃反应30min。反应完毕后,用0.01mpbs洗涤5次,每次浸泡1min左右。按每孔90μl依次加入已在37℃平衡30min的tmb显色液,37℃避光反应8-12min。按每孔0.1ml依次加入tmb终止液,此时蓝色立转黄色,用酶标仪在450nm测定od值。通过细胞因子的标准蛋白做已知浓度系列稀释,测出od值后绘制出标准曲线,根据标准曲线可推算出标本中细胞因子的含量。3.实验结果及分析:表4各组小鼠血清中细胞因子的变化情况从表4、图7、图8中可以发现本实验中的模型组小鼠体内il-6与tnf-α含量分别为168.01±26.38pg/ml,4.34±0.76pg/ml,相较于正常组均呈现显著性的增加(p<0.01),故可以认为由于持续不断地注射致衰老因子,导致动物模型组小鼠在细胞因子层面出现衰老性炎症的症状,而多肽灌胃组的小鼠血清的il-6与tnf-α含量均得到有效控制。根据细胞因子的实验结果,多肽灌胃组小鼠的血清炎性细胞因子il-6、tnf-α的分泌水平均低于动物模型组,从氧化损伤角度来看,小鼠因自由基攻击、过氧化产物堆积而造成的氧化损伤可能得到一定程度的抑制;从炎症的角度来看,小鼠因氧化而引起的炎症得到了有效的抑制;从衰老角度来看,小鼠由长期注射d-gal而引起的衰老所导致的一系列老年性疾病有可能得到控制。上述的对实施例的描述是为便于该
技术领域:
的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。序列表<110>上海交通大学;浙江辉肽生命健康科技有限公司<120>一种生物活性多肽dqdlvli及其制备方法和应用<160>3<170>siposequencelisting1.0<210>1<211>7<212>prt<213>人工序列(artificialsequence)<400>1aspglnaspleuvalleuile15<210>2<211>21<212>dna<213>人工序列(artificialsequence)<400>2atcaagacttggttttaatct21<210>3<211>564<212>prt<213>人工序列(artificialsequence)<400>3metalapheaspglyleupheilehisserleuleuglnaspleuthr151015prothrleuvalglyserargleuserlysiletyrglnpropheasp202530glnaspleuvalleuilephearglysasnarglysasntyrglnphe354045leuileseralaasnalaglntyrproargmettyrleuthrglugln505560thrileasnasnproasplysalaproilephevalmetvalleuarg65707580lystyrleugluglyservalleuglnserilegluglnvalglyleu859095aspargilethrasnphehispheserasnargasngluleuglyasp100105110gluvalgluleuvalleuservalgluvalmetglyarghisserasn115120125valileleutyrasnglnlysaspasnhisileileaspleuleulys130135140argileasnproaspgluasnargalaargileleuleuprolysala145150155160lystyrgluleuproproleulysproglyleuasnglyleuthrleu165170175sergluasplysphelysglnleuserasngluasnaspproasnglu180185190leuserlysglnmetaspglyleuasplysaspaspargasngluleu195200205leuglytyrleugluaspasptyrsertyrserserphelysthrphe210215220pheasnglnphegluasnproargalaphevalleulysthrproasn225230235240asnlysarglysilephecystyrleuprotyrhisleugluleuglu245250255lysgluserserasnproaspleuasnlysglyleuaspgluphetyr260265270glutyrglnalaasnargasptrpvallysglnargalaserglnval275280285gluargvalvallysasngluglnlyslysleuserlyslysilelys290295300lysleulyslysglnleuaspleualagluasnsergluglytyrarg305310315320ilelysglygluileleuasnalaasnleuasnglnvallysprogly325330335metthrthrvalserleuproasntyrtyrgluasnasnalaproile340345350gluilelysleuaspproalaleuserprothrargasnalaglnlys355360365tyrphethrargtyrlyslysleuargaspserilelyshisvalasn370375380gluglnilelysilethrglugluasnleuargtyrpheaspserile385390395400glnthralaileaspasnalaaspproglnaspileaspglnilethr405410415aspgluleuileasnglnglytyrilearglysglnlyslysasnlys420425430argarglyslysilethrgluargasnleuasngluphelysleuser435440445serglylyshisvalleuvalglylysasnasntyrglnasnasptrp450455460leuthrleulyslysalaasnlysserasptyrtrpphehisvallys465470475480asnmetproglyserhisvalileleuargaspaspglnproserasp485490495aspaspilelysglualaalagluilealaalaphepheserlysala500505510lysasnserthrhisvalglnvalasptyrvalglnasplysargval515520525lyslysproasnglyalalysproglyphevaliletyrthrglygln530535540asnserilegluvalthrprolysglulysgluilemetalametlys545550555560valasnlyslys当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1