一种高活性重组人凝血因子IX融合蛋白及其制备方法与流程
本发明属于转基因技术领域,具体涉及一种高活性重组人凝血因子ix融合蛋白及其制备方法。
背景技术:
血友病b是一种x染色体连锁的隐性遗传性出血性疾病,男性新生儿中的发病率约为1/25000,因患者凝血因子ix(fix,factorix)基因突变导致体内fix蛋白合成缺乏所致,患者易发生自发性出血,重症患者常因关节出血、脑出血等导致残疾,影响生活质量和寿命。目前,血友病b患者主要依靠静脉输注补充外源凝血因子ix来进行治疗,这类产品包括血液来源和重组来源的凝血因子ix制品。
人免疫球蛋白igg的fc片段可通过与fcrn结合介导与其融合蛋白的再循环过程,从而延长目标蛋白的半衰期,该方法在药物的生产中已经得到了广泛应用。百健公司的alprolix是首个上市的fix-fc融合蛋白药物,临床研究显示其与野生型的fix相比具有等同的活性,但半衰期显著增加2-3倍,有效缩短了患者的用药间隔(nct01425723)。
凝血因子ix存在一系列功能获得性(gain-of-functionmutation)突变可使凝血活性获得不同程度的增加。例如,2009年在一个意大利家族中发现的突变型fix蛋白,其384位由精氨酸变为亮氨酸(r384l,也被称为fixpadua),该突变导致fix凝血活性增加5-10倍。目前该突变型已被用于基因治疗研究,临床试验取得了良好的效果(pct/ep2009/061935)。另有一篇1999年发表于thejournalofbiologicalchemistry的文章中描述了fix的另一个功能获得性突变(r384a),体外研究显示该突变相比野生型活性增加2-3倍[jinlichang,jianpingjin,petelollar,et.al.changingresidue338inhumanfactorixfromargininetoalaninecausesanincreaseincatalyticactivity[j].thejournalofbiologicalchemistry,1998,273(20):12089–12094];转基因动物乳腺表达的该突变体蛋白的体内外凝血活性可提高2.5-3倍[yanj-b,wangs,huangw-y,etal.transgenicmicecanexpressmutanthumancoagulationfactorixwithhigherlevelofclottingactivity[j].biochemicalgenetics,2006,44(7-8):347-358.]。功能获得性突变体在血友病b基因治疗和重组蛋白药物研发的应用可提高凝血因子ix的活性表达水平,具有重要的应用价值。
目前,重组人凝血因子通常产量较低、半衰期短、价格昂贵。而与重组细胞生产凝血因子ix相比,动物生物反应器的生产成本相对低廉,是廉价大量生产fix的一个潜力方向。发明人利用的牛乳腺生物反应器及progenes公司的猪乳腺生物反应器均可人fix的表达,临床前体内和体外活性试验证实所产生的fix具有高效凝血活性。但在已公开的任何报道中还未有报道利用乳腺生物反应器表达fix融合蛋白的先例,也未知乳腺生物反应器表达fix融合蛋白是否仍具有fix活性并能维持高表达水平。
技术实现要素:
本发明的目的在于提供一种高活性重组人凝血因子ix融合蛋白及其制备方法。
一种高活性重组人凝血因子ix融合蛋白基因,其特征在于,包括启动子,人凝血因子ix蛋白基因,人免疫球蛋白igg1的fc段基因和终止子。
所述的启动子是本领域常规,只要能够在哺乳动物细胞中启动下游基因的表达即可,较佳的是在哺乳动物乳腺组织中启动表达效率高的启动子,较佳的是β-酪蛋白基因启动子,更佳的是山羊β-酪蛋白基因启动子。
所述人凝血因子ix为高凝血活性突变体,其核苷酸序列如seqidno:1所示,位置1960-1961位的核苷酸为gc而非cg。
所述的凝血因子ix为高活性突变体,其氨基酸序列如seqidno:2所示,位置384的氨基酸为a而非r。
所述人免疫球蛋白igg1的fc段核酸序列如seqidno:3所示,氨基酸序列如seqidno:4所示。
所述人凝血因子ix基因与人免疫球蛋白igg1的fc段基因之间包括接头序列。
所述接头是由氨基酸序列(ggggs)n表示的肽,其中n是1-20的整数,所述的接头还包含一段柔性多肽efagaaav的肽。
一种利用转基因动物乳腺生物反应器生产高活性重组人凝血因子ix融合蛋白的方法,将含有所述高活性重组人凝血因子ix融合蛋白基因的载体经原核显微注射整合入受精卵使转基因哺乳动物乳腺表达并分泌所述的外源重组凝血因子ix融合蛋白;所述哺乳动物为小鼠,牛或羊。
一种高活性凝血因子ix的突变蛋白的乳腺特异表达载体的制备方法,包括如下步骤:
(1)将凝血因子ix(r384a)突变的人凝血因子ix基因与人igg1的fc片段cdna通过接头序列连接构建入载体中,得到重组质粒;
(2)将上述重组载体显微注射导入小鼠受精卵,制备hfix-fc转基因小鼠;
(3)pcr法鉴定阳性小鼠,取阳性小鼠交配繁育,获得阳性母鼠乳汁;
(4)检测小鼠乳汁中的hfix-fc融合蛋白表达情况。
所述重组载体为真核表达载体pcdna3.1(-)。
本发明的有益效果:本发明首次在乳腺生物反应器表达系统中实现fix融合蛋白的高效表达,证实乳腺生物反应器可正确表达fix-fc融合蛋白,且相比于非融合蛋白,fix-fc融合蛋白具有更高的比活性。
附图说明
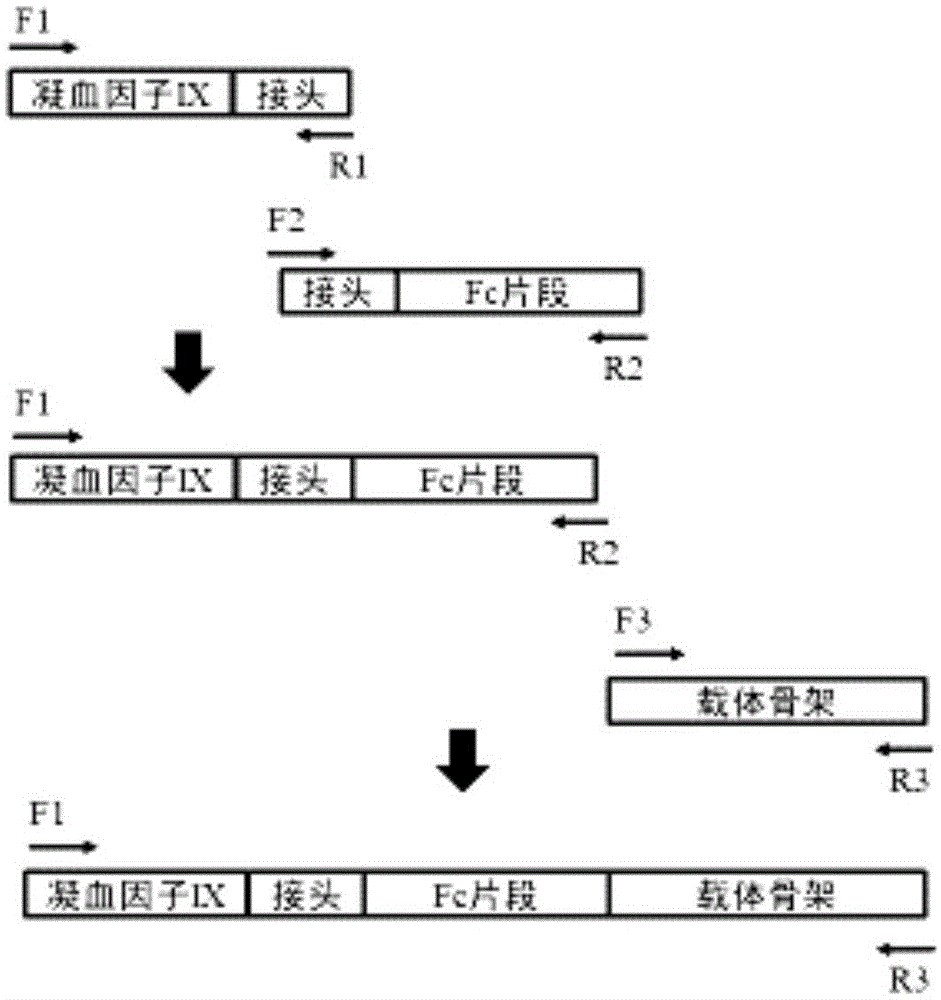
图1为融合pcr构建人凝血因子ix-fc融合表达基因示意图。
图2为本发明载体构建示意图。
图3为hepg2细胞瞬时转染相应质粒hfix-fc融合蛋白elisa检测结果。
图4为转基因小鼠乳汁中hfix-fc融合蛋白elisa检测结果。
图5为转基因小鼠乳汁中hfix-fc融合蛋白活性表达结果。
图6为转基因小鼠乳汁中hfix-fc融合蛋白比活性结果。
具体实施方式
下面结合实例具体阐明本发明,在此之前请理解,除非另外定义,本文使用的所有技术和科学术语具有与本发明所属领域普通技术人员所通常理解的相同的含义。尽管与本文描述的那些类似或等同的方法和材料可用于实施或测试本发明,但下面描述了合适的方法和材料。冲突时,以包括定义在内的本专利说明为准。此外应理解,材料、方法和实例仅是示例说明性的,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
一、片段合成
1)人igg1fccdna片段的扩增
用上游引物fc-f:5’-gagcccaaatcttgtgacaaaact-3’;下游引物fc-r:5’-tttacccggagacagggagaggct-3’,以人外周血细胞cdna为模板,进行pcr扩增。反应体系如下:
总共做4个反应管,反应条件为94℃5min;(94℃45sec,56℃45sec,72℃3min)×30个循环;72℃10min。扩出约0.7kb的higg1fccdna片段,将反应液混合后,取2μl送至上海美吉生物技术公司进行测序,余下产物产物经琼脂糖电泳,切胶并用试剂盒回收0.7kb的higg1fccdna片段。然后将测序所得序列与genebank数据库中的序列af150959.1进行比对,比对发现相差1个碱基,经查证该位点为snp位点,不影响fc片段的功能。
二、载体构建
1)pcdna3.1(-)-f9fc质粒的构建
构建过程如图1所示。分子克隆中所使用的限制性内切酶和连接酶均购自neb公司。
首先用相应引物通过融合pcr的办法扩增fixfc融合片段,在上游引物中引入ppumi酶切位点,下游引物中引入bamhi酶切位点,fix和fc基因之间引入接头序列,我们构建了3个fixfc融合片段,根据接头序列的不同后分别称作f9fc1,f9fc2,f9fc3。
引物信息如下:
反应体系如下:
pcdna3.1(-)-fix载体(具体信息可参考文献yanj-b,wangs,huangw-y,etal.transgenicmicecanexpressmutanthumancoagulationfactorixwithhigherlevelofclottingactivity[j].biochemicalgenetics,2006,44(7-8):347-358.)作为骨架载体,用ppumi酶和bamhi酶切线性化,分别连接上述片段,得到相应pcdna3.1(-)-cmv-hfixfc载体质粒,以下简称为cmv-f9fc1,cmv-f9fc2,cmv-f9fc3。
酶切体系为:质粒10μg,ppumi(10u/μl)3μl,10×cutsmartbuffer10μl,补h2o至100μl,37℃水浴酶切过夜。酶切产物经琼脂糖电泳,用试剂盒回收7.5kb的dna片段,在te中溶解。
连接反应体系为200ng的0.7kbigg1-fccdna片段,100ng7.5kb的载体片段,5μl2×ligationbuffer,加h2o补足体积至10μl。16℃连接过夜,转化入e.colidh5alpha感受态细胞,涂amp抗性平板,挑斑,扩增培养,碱裂解法抽提质粒,酶切鉴定,测序确认。
本发明载体构建过程如图2所示。
三、细胞转染
(1)细胞株:hepg2细胞株购自中科院上海生化细胞所;
(2)细胞培养基:高糖dmem、小牛血清分别购自gibco、民海公司。lipofectamine3000购自invitrogen公司;
(3)细胞培养方法:液氮中取hepg2细胞冻存管,快速置37℃水中冻融。冻融细胞1000rpm5min,倾去上清,可见细胞沉淀,再加约5ml全培养液,轻轻重悬细胞。加入培养瓶中,镜下可见分散均匀的细胞。放置37℃,5%co2及饱和湿度条件下培养。hepg2细胞用含10%小牛血清的dmem培养基培养。两天后用0.25%胰酶/0.01%edta将培养瓶中细胞消化下,转入6孔板中继续培养,每孔加入培养基1.5ml,次日用于转染。
(4)基因转染
1)转染液的制备:
灭菌ep管用于制备转染液a液和b液。
a液:2.5μg相应质粒(分别是egfp对照质粒,cmv-fix对照质粒,cmv-f9fc1,cmv-f9fc2,cmv-f9fc3),及5μlp3000用高糖dmem培养液分别定容稀释到100μl,轻摇混匀。
b液:3.75μllipofectamine3000质脂体转染试剂(invitrogen公司)用dmem培养液定容稀释到100μl,轻摇混匀。
将a液和b液混合,轻轻摇匀,室温静置5min,即得转染液。
2)转染:
hepg2细胞换1ml新鲜培养基,每孔中加入200μl转染液,前后摇几次。使培养液完全覆盖细胞。37℃,5%co2下培养48h。
3)收集培养液,用elisa测定人凝血因子ix的含量。
四、hepg2细胞中人凝血因子ix-fc融合蛋白表达测定
选用elisa方法检测细胞液上清中fix-fc融合蛋白的表达情况。
elisa检测试剂盒选购自美国abcam公司(cambridge,ma)的factorixhumanelisakit(ab108831),检测方法参见产品说明书。检测结果如附图3所示,质粒cmv-f9fc2相比野生型表达量最高,选取该质粒进行后续的研究。
五、hfix-fc融合表达转基因小鼠制备及乳汁的获取
根据hepg2细胞上的结果,我们选定cmv-f9fc2质粒构建后续的转基因小鼠。将cmv-f9fc2质粒用sali线性化,随后用显微注射方式得到转基因小鼠。通过对鼠尾dna的pcr检测,确认阳性小鼠。具体方法如下:
一)受精卵供体鼠
选择动情期间的雌鼠(7周龄)于第一日采用腹腔注射方法对雌鼠分别注射10u孕马血清促性腺激素(pms),于第三日对己注射pms的雌鼠腹腔注射10u人促绒毛膜性激素(hcg),然后与雄鼠以1:1合笼。第四日早晨检查雌鼠阴栓,有阴栓说明己经交配,将有阴栓的雌鼠作为受精卵供体鼠。
二)假孕受体鼠
在供体母鼠注射hcg当日,选择动情期的雌鼠和结扎输精管的雄鼠以1:1或2:1比例合笼。第二日同供体鼠一起检查阴栓,将有阴栓的雌鼠即作为假孕受体鼠。
三)受精卵的采集和显微注射
1)受精卵的采集
实验前,所用的物品高压灭菌,实验房间消毒。
培养液准备:
体外培养:超净台环境下,用移液枪吸取ksom培养液(不含透明质酸)于一次性塑料培养皿中,在不同位置上滴约40μl的数个液滴(培养皿背面相应位置编号),再加入胚胎级石蜡油将ksom液滴全部覆盖,然后将培养皿置于37℃,5%co2的培养箱平衡其湿度和ph值,以便将洗涤后的受精卵放置在此培养皿中进行体外培养。
体外操作:在培养皿中滴加m2培养液、含透明质酸酶m2液滴,将剪取的输卵管放入其中。
颈椎脱臼法处死受精卵供体小鼠,背侧朝上置于一培养皿盖上,75%乙醇消毒待切口处的皮毛,在小鼠背侧近中部脊椎一侧纵向剪开,用眼科剪将皮肤与腹壁分离,再将腹壁同样剪开一小口,用眼科镊将卵巢、输卵管及子宫提出,再用眼科剪将输卵管完整地剪下来,放在盛有透明质酸酶培养液的液滴中,同样取对侧及另外供体雌鼠的输卵管。
体视镜下用眼科镊撕开输卵管壶腹部,用移卵管(transferpipette)依次将受精卵收集转移到m2培养液中。在m2液滴中逐个将受精卵吸起,移入下一个液滴中,如此将每个受精卵清洗数次,这样在选择合适的卵细胞的同时也将尽量去除透明质酸(注意:载物台上有热光源或放置恒温微热板,使细胞处于合适的温度环境中)。
从co2培养箱中取出含有培养液滴和石蜡油的培养皿,用移卵管将洗涤过的受精卵转移到ksom液滴中,若受精卵原核发育仍未达到理想状态,可放入co2培养箱培养一定时间。
此过程供体鼠每侧输卵管可得到超排受精卵20、80枚不等。理想的受精卵细胞形态饱满正常,透明带完整,雄原核和雌原核清晰。
2)受精卵的微注射
将先制备好的固定受精卵的胚胎固定管(holdingpipette)安置在显微注射仪的左侧。将dna溶液从预制好的注射针(microinjectionneedle)尾部加入,在体视镜下检查dna溶液中有无气泡产生(质粒dna稀释成4ng/μl,注射前解冻后离心1-2min)。然后将注射针安置在显微注射仪的右侧,并使注射针内处于正压状态。
在凹孔载玻片中央滴20-30μlm2,覆盖石蜡油,用移卵管移入待注射的受精卵。将载玻片移入显微操作仪的载物台上。
在低倍镜下调节焦距,用持卵管将受精卵置于视野的适当位置,再将持卵管和注射针调节至合适位置(与玻片底部平面呈10°角),通过微调左右臂使持卵管、注射针和受精卵在一条直线并清晰可见。
将注射针的尖端在持卵管上轻轻碰撞,以碰断注射针的少许尖端,以让dna溶液溢出。
在高倍镜下,用持卵管反复吹吸受精卵将其调至合适位置,通过负压将欲注射的受精卵在左侧持卵管的顶端。受精卵的最佳位置是极体位于正上方,其雄原核的位置对应于持卵管的中央且近右侧。
将注射针快速刺入雄原核,勿碰触核仁,适当加压,使dna注入,待核膨大为原来体积的一倍后迅速将注射针拔出,将受精卵转移。如此反复,对其它受精卵逐个进行注射,尽可能在较短时间内完成。
将注射完毕的受精卵可置于37℃,5%co2培养箱中培养一段时间,挑选出形态较好的受精卵用于移植。
3)受精卵的移植
腹腔注射方法,用戊巴比妥钠溶液(10mg/ml)按1mg/10g体重的剂量将假孕母鼠麻醉。将己经麻醉的小鼠背部向上置于培养皿盖上,在最后一根肋骨将凹陷处去毛,75%乙醇消毒。按常规外科手术在小鼠消毒处行以与脊椎平行的纵切口,手术镊伸入腹腔,将脂肪及包裹在膜囊中的卵巢、输卵管和子宫一并提出,并用脂肪镊固定。
将注射后受精卵吸入同一移卵管内,管中吸入气泡作为标志。
在血管稀疏处用眼科镊轻轻撕开卵巢和输卵管之间的囊膜,将镊子伸入囊膜内,轻轻地将卵巢和输卵管分开,夹住输卵管伞部,提到裂口处,找到游离端。将充有受精卵的移卵管从输卵管伞部轻轻插入到漏斗部,用口慢慢地将受精卵吹入输卵管,可见输卵管明显地膨胀及移卵管中气泡移至伞口内。
将移卵管轻轻从输卵管中拔出,将卵巢和输卵管放回腹腔,缝合伤口后放回洁净鼠笼中,注意保暖,待其苏醒后按常规饲养。植入后19、20天,受精卵可发育成小鼠出生。
四)转基因小鼠的鉴定
1)鼠尾组织dna提取
小鼠出生后三周剪取lcm尾组织置于1.5mlep管中。
在ep管中加400μl消化液buffer,10μl(20mg/ml)蛋白酶k,56℃消化过夜。
加等体积酚,振荡,混匀后13000rpm离心12min。
取上清液加等体积酚:氯仿:异戊醇(25:24:1)振荡混匀后13000rpm离心6min。取上清液加等体积氯仿:异戊醇(24:1)振荡混匀后13000rpm离心4min。
取上清液加1/10体积3mol/lnaac及2倍体积无水乙醇混匀室温放置10min后,13000rpm离心10min。
80%乙醇洗2次,真空抽干后溶解于200μlph8.0te中。
1)pcr方法鉴定hfix-fc阳性小鼠,pcr体系见下表。
检测引物信息:
pcr体系:
六、转基因小鼠乳汁中hfix表达的检测
取转基因母鼠配种,待分娩后,采用腹腔注射方法,用戊巴比妥钠溶液(10mg/ml)按1mg/10g体重的剂量将哺乳期(8-10天左右)母鼠麻醉。麻醉后乳腺注射催产素(0.03iu),等待5min后,用拇指食指挤压乳腺,使乳汁从乳头中溢出,用移液枪收集乳液于0.5mlep管内。
选用购自美国abcam公司(cambridge,ma)的factorixhumanelisakit(ab108831)试剂盒及instrumentationlaboratorycompany公司aptt活性检测试剂盒(heemosilsynthasil,0020006800,,usa);凝血酶原测定仪为instrumentationlaboratorycompany,公司产品(acltop720);检测小鼠乳汁中的人凝血因子ix蛋白表达情况,具体操作见kit说明书,测得结果参见附图4-6。
由附图4-6可见,实验共得到阳性母鼠20个,小鼠乳汁中hfix活性最高可达6.2iu/ml,远高于人血浆的1iu/ml。特别的是,hfix的比活性得到显著增加,相比野生型hfix的比活性200-250iu/mg,本发明的比活性可达2300-3500iu/mg,均值为3000iu/mg。
- 还没有人留言评论。精彩留言会获得点赞!