一株产D泛解酸内酯水解酶的赤霉菌及应用、发酵方法与流程
本发明属于微生物领域,具体地说,涉及一株产d泛解酸内酯水解酶的赤霉菌及应用、发酵方法。
背景技术:
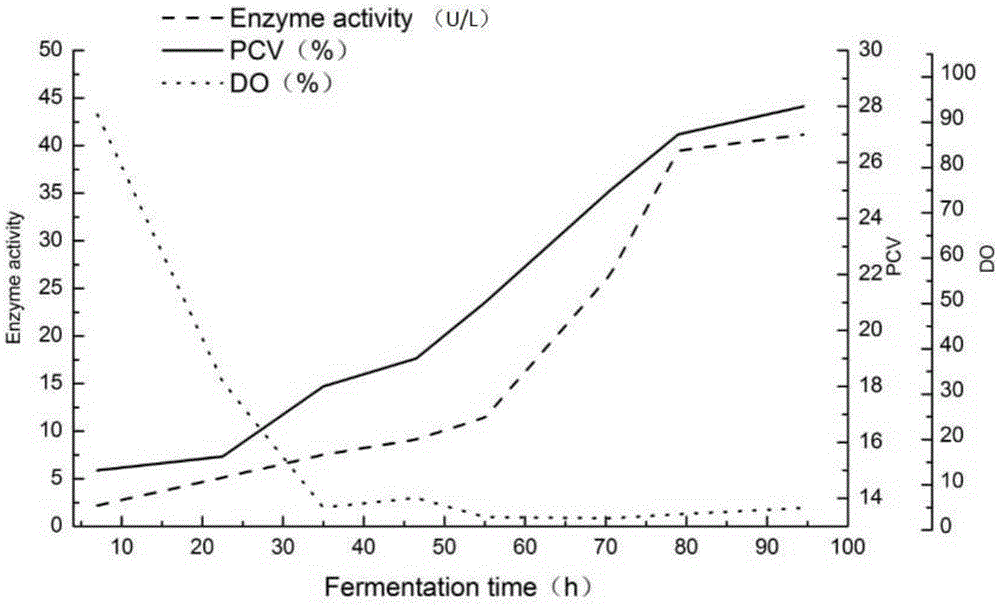
:d-泛酸钙为维生素类药物,广泛应用于医药、食品、饲料工业。d-泛解酸内酯是合成d-泛酸钙及d-泛醇的重要前体物,因此从80年代起人们便对dl-泛解酸内酯进行拆分。现在对dl-泛解酸内酯拆分的方法主要有化学法、生物法。由于化学法存在试剂用量大、环境污染严重等缺点,因此人们对生物法进行了一系列的研究。生物法制备d泛解酸内酯主要有酶法,微生物法,已报道的研究有多种酶及微生物的技术路线。如今比较成熟的且已经应用到商业化的酶法为用微生物选择性水解d-泛解酸内酯,即利用微生物d-立体专一性内酯水解酶选择性水解dl-泛解酸内酯中的d-泛解酸内酯,得到d-泛解酸,d-泛解酸再经过内酯化反应生成d-泛解酸内酯,而l-泛解酸内酯并不被水解,未水解部分经过消旋化可反复使用。该方法不要求水解彻底,反应时间短,得到产品泛解酸内酯的光学纯度高,反应容易控制,底物的浓度可以很高。该方法的路线如下:国内江南大学孙志浩教授与浙江鑫富生化股份有限公司合作,其选育了一株高产量且立体专一性水解泛解酸内酯的微生物菌株串珠镰孢霉fusadum.moniliformesw-902(中国微生物菌种保藏号cgmccno.0536),此菌株已经做为鑫富公司的生产菌株用于工业生产数十年,此菌株经过各种工艺优化后,专利报道的最终发酵生物量为干重6~8g/l,酶活力0.87-0.92u/g干菌体。得到的酶解产物d泛解酸光学纯度达到99%e.e.。此专利法的微生物活力及微生物产量都还有很大的提升空间。由此可知,现有生产d-泛解酸内酯的菌株,其发酵过程中生物量偏低。技术实现要素:1、要解决的问题针对现有生产d-泛解酸内酯的菌株发酵过程中生物量偏低的问题,本发明提供一种赤霉菌(gibberellasp.)rd016,所述赤霉菌(gibberellasp.)rd016保藏号为cgmccno.16374。所述赤霉菌(gibberellasp.)的发酵过程中生物量干重高达35g/l。同时本发明还提供一种赤霉菌(gibberellasp.)rd016在水解dl-泛解酸内酯中的应用、赤霉菌(gibberellasp.)rd016的发酵方法和赤霉菌(gibberellasp.)rd016在制备d-泛解酸内酯中的应用。2、技术方案为了实现上述发明目的,本发明提供以下技术方案:一种赤霉菌(gibberellasp.)rd016,其保藏号为cgmccno.16374。赤霉菌(gibberellasp.)rd016在水解dl-泛解酸内酯中的应用。优选的,将所述赤霉菌(gibberellasp.)rd016与dl-泛解酸内酯反应,生成d-泛解酸,然后d-泛解酸内酯化,得到d-泛解酸内酯。优选的,将所述赤霉菌(gibberellasp.)rd016经过发酵后得到的湿菌体与dl-泛解酸内酯反应,生成d-泛解酸,然后d-泛解酸内酯化,得到d-泛解酸内酯。优选的,所述赤霉菌(gibberellasp.)rd016发酵所用的培养基包括甘油、葡萄糖、玉米浆、大豆蛋白粉、硫酸镁和磷酸氢二钾,每升所述培养基中含有甘油30~46ml,葡萄糖20~36g,玉米浆20~36g,大豆蛋白粉20~36g,硫酸镁2~3.6g,磷酸氢二钾2~3.6g,ph调至7.0-8.0;优选的,每升所述培养基中甘油38~40ml,葡萄糖25~30g,玉米浆25~32g,大豆蛋白粉20~30g硫酸镁3~3.4g,磷酸氢二钾2~2.4g,ph调至7.0~8.0;优选的,每升所述培养基中含有甘油46ml,葡萄糖28g,玉米浆28g,大豆蛋白粉20g,硫酸镁2.4g,磷酸氢二钾2.4g,ph调至7.0-8.0。上述的赤霉菌(gibberellasp.)rd016发酵方法,将所述赤霉菌(gibberellasp.)rd016先接种至发酵罐中的培养基发酵,接种量为0.1%~1%,发酵温度28~35℃,装液量50~70%,发酵过程中通气量为0.5~2vvm,ph为7.0~8.0,发酵时间96h~120h。优选的,所述培养基包括甘油、葡萄糖、玉米浆、大豆蛋白粉、硫酸镁和磷酸氢二钾,每升所述培养基中含有甘油30~46ml,葡萄糖20~36g,玉米浆20~36g,大豆蛋白粉20~36g,硫酸镁2~3.6g,磷酸氢二钾2~3.6g,ph调至7.0-8.0。优选的,每升所述培养基中含有甘油46ml,葡萄糖28g,玉米浆28g,大豆蛋白粉20g,硫酸镁2.4g,磷酸氢二钾2.4g,ph调至7.0-8.0。赤霉菌(gibberellasp.)rd016在制备d-泛解酸内酯中的应用。优选的,将所述赤霉菌(gibberellasp.)rd016经过发酵后得到的湿菌体与dl-泛解酸内酯反应,生成d-泛解酸,然后d-泛解酸内酯化,得到d-泛解酸内酯。3、有益效果相比于现有技术,本发明的有益效果为:(1)本发明的赤霉菌(gibberellasp.)rd016发酵过程中的生物量干重达到35g/l,现有技术中,相关生产菌株的发酵过程中生物量为干重6~8g/l。(2)本发明的赤霉菌(gibberellasp.)rd016水解dl-泛解酸内酯后得到的d-泛解酸内酯的光学纯度达到96%e.e.,酶活达到41.1u/l,换算为菌体酶活为1.17u/g,转化率为45%~48%,现有技术中的生产菌株的酶活力为0.87-0.92u/g。生物保藏说明:本发明提供的赤霉菌(gibberellasp.),菌株名称为rd016,已于2018年10月17日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏中心地址为:北京市朝阳区北辰西路1号院3号中国科学院微生物研究所;保藏编号为cgmccno.16374。附图说明图1、高密度发酵酶活、生物量变化趋势;图2、菌体镜检照;图3、dl-泛解酸内酯的反向hplc图;图4、dl泛解酸的反向hplc图;图5、dl-泛解酸内酯正向手性柱hplc图;图6、dl-泛解酸的正向手性柱hplc图;图7、d泛解酸内酯标准品正向手性柱hplc图;图8、重结晶后的d-泛解酸内酯正向手性柱hplc图;图9a、l泛解酸内酯消旋前正向手性柱hplc图;图9b、l泛解酸内酯消旋后正向手性柱hplc图。具体实施方式下面结合附图对本发明进行详细描述。实施例1菌株分离和鉴定从合肥市大蜀山森林公园土壤里,油脂厂,醋厂,酒厂,污水处理厂等,各采集土壤20g,称取5g加入无菌水500ml,于28℃、150rpm下孵育3h,后离心取上清液涂pda抗生素平板,于28℃培养箱里培养。将平板上的单菌落进行单独培养支菌株,在pda培养基基础上添加5g/l花生油继续筛选潜在d-泛解酸内酯水解酶菌株,根据透明圈和菌丝生长圈比例,选取rd01,rd02,rd03,rd04,rd05,rd06进行发酵实验。pda培养基(1l):葡萄糖20g,kh2po43g,mgso4.7h2o1.5g,vb10.002g,氨苄青霉素50mg,琼脂15g,20%土豆汁。菌株在pda培养基上生长良好,菌丝旺盛。实施例2产d-泛解酸内酯水解酶菌株筛选将rd01,rd02,rd03,rd04,rd05,rd06,fusariumculmorumcgmcc3.4283,fusariumsphaerosporumcgmcc3.4488,cylindrocaronsp.cgmcc3.3591,fusariumoxysporumas3.1785共10支菌株进行发酵,从pda平板上分别接种4块1cm直径的琼脂块至ymg种瓶中,种瓶于28℃、180rpm下培养48h后,以0.1%接种量接种至sf-1培养基中,继续发酵7天后过滤收集菌体。接种量=种子液的体积/sf-1培养基的体积。以上菌株中其中:fusariumculmorumcgmcc3.4283;fusariumsphaerosporumcgmcc3.4488;cylindrocaronsp.cgmcc3.3591,fusariumoxysporumas3.1785为购买菌株,购买自北纳生物菌种保藏中心。取干菌体2g,30ml0.5mtris-cl(ph7.5)溶解10%的dl-泛解酸内酯,28℃震荡反应2h后将菌体过滤,取上清液进行hplc检测。酶活定义:在上述条件下,每分钟水解1umold-泛解酸内酯成d-泛解酸的酶量定义为1个酶活力单位(1u)。d-泛解酸内酯含量、转化率和光学纯度(%e.e.)通过如下液相方法测定。hplc检测条件:使用岛津lc-20a系统,柱子型号:wondasilc18-wr5μm4.6×250mm,流动相为乙腈:水=10:90;流速1ml/min,柱温30℃,检测波长215nm。转化率%=(投入底物dl-泛解酸内酯含量-未水解的dl-泛解酸内酯含量)/投入底物dl-泛解酸内酯含量×100;ymg培养基(1l):葡萄糖4g,酵母提取物4g,麦芽提取物10g,其余为水。sf-1培养基(1l):甘油20ml,葡萄糖20g,玉米浆40g,ph调至7.0,其余为水。发酵的10支菌株通过上述hplc检测转化率和光学纯度e.e.见表1。表1筛选菌株产酶结果序号菌株转化率(%)e.e.值(%)1rd0118672rd0212813rd0320964rd045555rd057756rd0621717fusariumsphaerosporumcgmcc3.448820928fusariumculmorumcgmcc3.428325719cylindrocaronsp.cgmcc3.3591249310fusariumoxysporumas3.17852994其中rd03催化底物dl-泛解酸内酯得到d-泛解酸内酯的e.e.值较高。实施例3产d-泛解酸内酯水解酶菌株诱变将装有rd03的种瓶中制备的菌体打碎,取2~4ml制备的菌液加到直径9cm培养皿内,放入一无菌磁力搅拌子,然后置磁力搅拌器上、15w紫外线下30cm处。在正式照射前,应先开紫外线10min,让紫外灯预热,然后开启皿盖正式在搅拌下照射10~50s。操作均应在红灯下进行,或用黑纸包住,避免白炽光。精确称取ntg(亚硝基胍)2、4、6、8、10mg于小试管中,按10mgntg加丙酮溶液1ml的比例溶解ntg配成ntg试液。分别将不同浓度的ntg试液移到装有菌体悬浮液的小口试剂瓶中,使用前ntg的终浓度分别为0.1、0.2、0.3、0.4、0.5g/l,于32℃下振荡,转速130rpm,震荡30~60min,然后以转速为500rpm离心15分钟,取菌体,分别用磷酸缓冲液洗涤菌体3次,取菌体沉淀.用生理盐水稀释后涂pda平板,将突变后菌株单菌落挑出进行如实施例2中方法进行发酵,在发酵第5天时菌体产酶活力达到最高,在第5天收集菌体。检测转化率和e.e.值。采用实施例2的hplc条件进行检测。通过多轮诱变筛选,获得一株d-泛解酸内酯水解酶产酶菌株:gibberellasp.rd016保藏号为cgmccno.16374,该菌株转化率相对于诱变前提高了10%~20%,产酶时间由7天缩短至5天,降低了生产成本。对rd016进行菌种鉴定,包括形态鉴定、生化鉴定、its序列测序分析。its鉴定过程如下:从pda斜面上挑取4块约1cm直径大小的菌体接种至100mlymg培养基的250ml三角瓶中,28℃、120rpm下振荡培养5天,收集菌体。基因组抽提方法可以参考专利cn201710235246.0。根据真菌的18s和28srdna保守序列设计两个its引物p1(5’-tccgtaggtgaa-cctgcgg-3’)和p2(5’-tcctccgcttattgatatgc-3’)。以基因组dna为模版,设置反应体系如下:10ng基因组dna,1×transtaq-tbuffer,0.2μmol/lp1和p2,0.2mmol/ldntps,2.5utranstaq-tdna聚合酶,补水至50μl。扩增程序为:94℃,5min;55℃,2min;72℃,2min;94℃,1min;55℃,50s;72℃,55s;72℃,5min,共30循环。回收目标产物进行测序。形态学鉴定:通过微生物镜检,通过显微镜观察可知,菌丝体较发达,大量气生菌丝交织成白色绒毛状。符合霉菌的典型特征。生化鉴定:通过发酵培养后进行催化底物dl-泛解酸内酯,发现活性高于大多数霉菌。将其与已知产水解泛解酸内酯水解酶的菌株比较发现,同样的培养条件下,只有发明的菌株rd016转化dl-泛解酸内酯最多。与cgmccno.16374基因匹配度较高且亲缘关系很近的gibberellamoniliformisfm24,但是转化dl-泛解酸内酯的活性却不同,cgmccno.16374与本属其他菌种相比,应该存在某种(或几种)特定的功能基因不同,从而具备高效转化dl-泛解酸内酯的能力。通过以上鉴定结果,确认cgmccno.16374为来自gibberella属的新菌株。its序列为seqidno:1实施例4产d-泛解酸内酯水解酶菌株培养基正交优化将诱变后得到的菌株gibberellasp.rd016分别接种到4块1cm直径的琼脂块至ymg种瓶中,种瓶于28℃、180rpm下培养48h后,以0.1%接种量接种至培养基中发酵,继续发酵5天后过滤收集菌体,hplc检测酶活。接种量=种子液的体积/培养基的体积。培养基配方每升培养基中包括以下成分:甘油30~46ml,葡萄糖20~36g,玉米浆20~36g,大豆蛋白粉20~36g,硫酸镁2~3.6g,磷酸氢二钾2~3.6g,ph调至7.0,其余为水。培养基正交设计表如下:表2:正交优化水平设计根据表2输出结果如下:表3:正交优化结果分析通过表3可以得到优化后的培养基配方,每升优化后的培养基中包括以下成分:甘油46ml,葡萄糖28g,玉米浆28g,大豆蛋白粉20g,硫酸镁2.4g,磷酸氢二钾2.4g,ph调至7.0,其余为水。实施例5产d-泛解酸内酯水解酶菌株高密度发酵将诱变后得到的菌株gibberellasp.rd016分别接种4块1cm直径的琼脂块至ymg种瓶中,种瓶于28℃、180rpm下培养48h后,以0.1%接种量接种至优化后的培养基中,接种前,先将优化后的培养基加入到发酵罐中,发酵罐总体积为10l,装液量为6l。发酵过程中通气量为0.5vvm,温度为28℃。转速设置为前期设置为200rpm,在do降至0%时改为500rpm。以1m硫酸和25%氨水维持整个发酵过程ph为7.0,发酵至96小时酶活与生物量已达到平台期,发酵结束下罐。发酵过程中生物量以pcv(%)计量(图1)。pcv测量方法:量取10ml发酵液,以3000rpm离心10min后,将上清液倒出,测量,测得上清液的体积为v1ml,则pcv(%)=(10-v1)/10×100。发酵96小时结束后,此时将菌体取出烘干至恒重测得生物量为干重35g/l,酶活测定最高为41.1u/l,换算为菌体酶活为1.17u/g。如图1、图2所示,在96小时发酵结束后镜检及发酵罐中菌体状态,菌体在发酵时酶活和生物量在80小时接近最高峰值,随后增加速度降慢。表4本申请与现有生产技术比较:实施例6产d-泛解酸内酯水解酶菌株高密度发酵将诱变后得到的菌株gibberellasp.rd016分别接种4块1cm直径的琼脂块至ymg种瓶中,种瓶于35℃、180rpm下培养48h后,以1.0%接种量接种至优化后的培养基中,接种前,先将优化后的培养基加入到发酵罐中,发酵罐总体积为10l,装液量为7l。发酵过程中通气量为2.0vvm,温度为35℃。转速设置为前期设置为200rpm,在do降至0%时改为500rpm。以1m硫酸和25%氨水维持整个发酵过程ph为8.0,发酵至120小时酶活与生物量已达到平台期,发酵结束下罐。实施例7将比旋度为零的dl-泛解酸内酯,用含50mmolcacl2的水溶液配制成30%浓度为底物;加按实例5方法制备的湿菌体,加酶量为0.5u/g,置摇床30℃,180r/min反应,每30min取样进行高压液相色谱分析及比旋光测定(比旋光度为采用旋光仪测定,参照国标),并用浓氨水调节反应液的ph值为7.0。酶解时间为6~18小时。将反应结束后滤出的菌丝体,加入新的底物继续反应,如此反复,重复利用6次。表5结果表明,酶水解后,得到的酶转化率为47%左右,经内酯化后萃取的产品d-泛解酸内酯的比旋光度为[α]d20=-47°。加酶量为0.5u/g表示相对于底物的加酶量,比如底物dl-泛解酸内酯用量为10g,则加酶量为5u。表5、检测结果转化次数123456转化率48.147.547.647.447.247.2实施例8称取比旋度为零的dl-泛解酸内酯300g,用含50mmolcacl2的水溶液配制成30%浓度为底物,体系为1l,添加按实例5的方法制备的湿菌体,按实施例7的方法酶水解。所得的酶解液1000ml过滤所得的清液,用体积比为1∶(1~3)的乙酸乙酯萃取3次,分离出水相,水相中主要含已转化的d-泛解酸(图4,图6)。水相用hcl调ph为1进行内酯化反应后,再用乙酸乙酯萃取提取,有机相进行蒸发回收溶剂,得到d-泛解酸内酯粗品138.6g,粗品得率46.2%。图4中,在反向条件下d型和l型的泛解酸都在同一位置出峰,该位置的保留时间为2.870。图6中,保留时间22.758的峰为l型的泛解酸,保留时间41.998的峰为d型的泛解酸。粗品测定比旋光为[α]d20=-48°,进行液相检测,液相图见图3和图5。粗品用乙酸乙酯重结晶,得d-泛解酸内酯纯品119.2g(图8),重结晶收率86%,对dl-泛解酸内酯得率39.7%,产品比旋光为[α]d20=-51°,hplc测定d-泛解酸内酯光学纯度为96%e.e.。其中,图7为d泛解酸内酯标准品图。图7中,保留时间9.863的峰为d泛解酸内酯。图3中,保留时间9.086的峰为dl-泛解酸内酯,在反向条件下d型和l型的泛解酸内酯都在同一位置出峰。图5中,保留时间28.716的峰为l泛解酸内酯,保留时间34.127的峰为d泛解酸内酯。图8中,保留时间为9.579的峰为d泛解酸内酯,保留时间为8.119的峰为l泛解酸内酯。收集l-泛解酸内酯及未转化的d-泛解酸内酯,蒸发浓缩回收溶剂后,用naoh溶液130℃加热2小时,进行消旋化反应。回收得到dl-泛解酸内酯168.2g,直接用于下次酶反应。图9a为l泛解酸内酯消旋前正向手性柱hplc图,图9b为l泛解酸内酯消旋后正向手性柱hplc图。按此计算,得到的d-泛解酸内酯纯品对dl-泛解酸内酯消耗量(酶水解的d-泛解酸内酯)的得率为90.4%。从图9a和图9b中,可以看出,消旋前几乎全为l型,消旋后d型和l型约各占一半。反向检测条件:使用岛津lc-20a系统,柱子型号:wondasilc18-wr5μm4.6×250mm,流动相为乙腈:水=10:90;流速1ml/min,柱温30℃,检测波长215nm;图3和图4采用上述液相条件得到。正向手性柱检测条件:使用岛津lc-15c系统,柱子型号:大赛璐chiralpak5μm4.6×250mm,流动相为正已烷:丙酮=40:60;流速1ml/min,柱温30℃,检测波长215nm;图5、图6、图7、图8、图9a和图9b均采用上述液相条件得到。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1