一种邻氟邻亚胺基苯甲酸中间体化合物及其制备方法和应用与流程
本发明涉及一种邻氟邻亚胺基苯甲酸中间体化合物及其制备方法和应用,属于药物中间体合成技术领域。
背景技术:
idelalisib的化学名称为5-氟-3-苯基-2-[(1s)-1-(9h-嘌呤-6-基氨基)丙基]-(3h)-喹唑啉-4-酮,其结构式如下式所示。
有关idelalisib的制备方法报道较多,现有的合成工艺路线中均涉及到一个关键的中间体2-[(1s)-1-氨丙基]-5-氟-3-苯基-4(3h)-喹唑啉酮。
如wo2005/113556a中最早制备上述中间体的路线是从2-氟-6-硝基苯甲酸为初始原料,与酰氯化试剂反应生成酰氯,再与苯胺缩合、得到的中间体与酰氯化试剂反应得到酰氯,得到的酰氯与n-boc-l-2-氨基丁酸亲核取代,再经过硝基还原,环合,水解脱保护,获得了式ii化合物,如下述方程式所示:
又如wo2015095601a中为了改进上述制备方法,通过使用2-氨基-6-氟苯甲酸为初始原料,在吡啶和亚磷酸二苯酯的活化下,与(s)-2-((叔丁氧羰基)氨基)丁酸反应,经过(s)-(1-(5-氟-4-氧代-4h-苯并[d][1,3]噁嗪-2-基)丙基)氨基甲酸叔丁酯中间体,然后与苯胺发生交换反应后获得式ii化合物,如下述方程式所示:
该方法经过的氧代中间体,性能比较稳定,但是在下一步跟苯胺的交换反应,需要较高的温度,且反应时间长,会导致杂质增多,手性构型发生变化等一系列的问题。
又如中国专利申请(公开号:cn104876931a)公开了一种与上述方法接近,使用了一锅法,也制备得到式ⅲ的中间体。吡啶与(亚)磷酸三苯酯结合,是活化羧基的常用方法,但是,由于第一步反应的两种物料均含有羧基,如果不有序的加料,因活化活性的问题,很难形成高手性纯度的且将其中间体分离出来,其一锅法貌似简化了操作,实则增加了反应的复杂程度,增加了产物的分离难度。也就是说,采用现有的制备方法所用的原料大多存在纯化困难,无法满足该中间体高ee%值、高纯度的要求,需要改进。
技术实现要素:
本发明针对以上现有技术中存在的缺陷,提供一种邻氟邻亚胺基苯甲酸中间体化合物及其制备方法和应用,解决的问题是提供一种新的中间体化合物使具有易于活化且反应活性高。
本发明的目的之一是通过以下技术方案得以实现的,一种邻氟邻亚胺基苯甲酸中间体化合物及其制备方法和应用,其特征在于,该化合物的结构式如下式ⅰ化合物:
其中,式ⅰ化合物中r为氨基保护基团。
本发明的邻氟邻亚胺基苯甲酸中间体化合物具有较高的活性,在苯胺等亲核试剂的进攻协助下,能够使其与本发明的化合物中亚胺基相连的苯氧基很容易起到协同进攻并活化羧基,从而进行下步反应,获得idelalisib的关键中间体如下所示(即式ⅲ化合物中手性碳为s构型):
从而实现有效的提高反应效率和简化合成操作的效果。更进一步的讲,本发明的上述中间体化合物是发明人在大量研究分析idelalisib的关键中间体式ii化合物的过程中通过对吡啶与(亚)磷酸三苯酯结合活化羧基机理的深入研究,通过大量的实验验证,发现通过调节合理的加料次序,使得其中的羧基有序的被活化,从而实现有效的分离得到一种新的具有较高活性的中间体邻氟邻亚胺基苯甲酸中间体化合物,该活性中间体又可称为2-((2-((叔丁氧羰基)胺基)-1-苯氧基丁烯基)胺基)-6-氟苯甲酸活性化合物,具有反应活性高,且易于活性,能够有效的应用到合成idelalisib的关键中间体式ii化合物的起始原料,且具有较高的反应稳定性,得到的相应中间产物也具有质量高的效果。
在上述邻氟邻亚胺基苯甲酸中间体化合物中,作为优选,所述式ⅰ化合物中的r为boc基团。目的是为了有效的保护其中的氨基基团,使在后续的反应中氨基不被反应而产物其它副产物,能够有效的保证后续反应的产物收率和纯度质量具有较高的效果;同时,采用boc基团还具有保护效果好,且又有利于后续该保护基团的脱除。这里还可以使r为cbz基团,同样能够有效的对氨基进行保护。
在上述邻氟邻亚胺基苯甲酸中间体化合物中,作为优选,所述式ⅰ化合物中手性碳为r型或s型手性碳,最好使所述式ⅰ化合物中手性碳为s型手性碳的对应化合物,能够得到相应构型的中间体产物。由于采用本发明的中间体化合物具有反应单一和构型确定的优势,因此,可以有效的根据本活性中间体化合物的手性构型等,使具有较好的纯度和构型保持的效果。由于亚胺基团物存在,还可以根据实际可以使形成的亚胺双键可以是z或e。
本发明的目的之二是通过以下技术方案来实现的,一种邻氟邻亚胺基苯甲酸中间体化合物的制备方法,其特征在于,该方法包括以下步骤:
将式ⅱ化合物用有机溶剂溶解后,再加入吡啶和亚磷酸三苯酯搅拌使羧基活化,加入2-氨基-6-氟苯甲酸进行缩合反应,得到相应的式ⅰ化合物;
其中,式ⅰ化合物与式ⅱ化合物中的r相对应,且r为氨基保护基团。
本发明通过为式ⅱ化合物为起始原料,加入吡啶和亚磷酸三苯酯,能够有效的使活化n-boc-2-氨基丁酸的羧基,然后再与2-氨基-6-氟苯甲酸的氨基缩合形成酰胺,能够使该反应有效的避免羧基的无序活化,从而使得本中间体式i化合物的获得变得可行,具有反应稳定性好的效果,也能够有效的避免反应副产物的产生。这里进一步讲,对于式ⅱ化合物中手性碳的手性选择,可以选用d或l构型的原料,当然,为了使能够有效的形成对应手性的中间体式ⅲ化合物,最好使式ⅱ化合物对应的为n-boc-l-2-氨基丁酸,如以n-boc-l-2-氨基丁酸原料为例,本发明的反应机理过程(其中各化合物中对应的r基团以boc为说明)可以通过以下方程式表示:
这里对于反应中各原料的用量根据本领域一般的摩尔当量进行调整即可,能够使反应有效进行均可,均能够得到相应的中间体化合物式i化合物,并没有具体的限定要求,但是,为了提高原料的利用率和反应的效率,最好使按照摩尔当量比例进行。
在上述邻氟邻亚胺基苯甲酸中间体化合物的制备方法中,所述氨基保护基团目的是为了保护氨基不被反应,使能够有效的带入后续的中间体化合物,也为了有效避免其它副产物的产生。作为优选,所述式ⅱ化合物中的r为boc基团。能够使有效的保护氨基不被反应,有效减少副产物的产生和提高中间产物的纯度。
在上述邻氟邻亚胺基苯甲酸中间体化合物的制备方法中,所述有机溶剂可以根据实际需要进行调整,这里有机溶剂的加入目的是为了使反应更温和的进行,对于有机溶剂的选择能够使原料溶解的溶剂均可,进一步的采用不与原料发生反应且能溶解式ⅱ化合物的有机溶剂为最好。作为更进一的步的优选,所述有机溶剂选自非水溶性溶剂,所述缩合反应的温度为50℃-80℃。这里的非水溶性溶剂可以是甲苯、二甲苯、二氯甲烷等等。具有溶剂原料毒性低,易于回收套用的效果,也具有反应条件温和,易于操作的效果。
在上述邻氟邻亚胺基苯甲酸中间体化合物的制备方法中,作为优选,所述缩合反应结束后,还包括后处理,所述后处理具体为:向缩合反应结束后的反应液中加入稀酸进行淬灭反应,再加入非水溶性溶剂进行萃取,收集有机相浓缩后,得到相应的最终产物式i化合物。通过先加酸进行淬灭,能够使反应过程中未完全反应的原料被有效去除,避免其它副产物的产生,有利用更有效的提高纯度的效果,且通过加非水溶性溶剂也能够有效的萃取出产物,使能够更有效的保证收率的效果。
本发明的目的之三是通过以下技术方案得以实现的,一种邻氟邻亚胺基苯甲酸中间体化合物的应用,其特征在于,该化合物的结构式如下式ⅰ化合物:
其中,式ⅰ化合物中r为氨基保护基团;
使式i化合物与苯胺进行反应,环化后再脱除氨基保护基团后生成式ⅲ化合物,所述式ⅲ化合物为:
通过采用本发明的活性较高的邻氟邻亚胺基苯甲酸中间体化合物跟苯胺混合后,能够有效的发生亲核取代反应,借助掉下来的苯氧基协同活化羧基,进一步可以使在酸化条件下环化形成环酰胺,然后强酸条件下脱除氨基保护基团,形成式ii化合物。具有反应活性高,且易于形成最终产物的效果,更进一步的讲,以对应s型的产物中r基团boc基团为例说明,本发明的反应机理可以通过以下方程式表示:
在上述邻氟邻亚胺基苯甲酸中间体化合物的应用,作为优选,所述制备式ⅲ化合物具体方法为:
将式i化合物溶解于有机溶剂中,加入苯胺在50℃~80℃的条件下反应后,将反应液酸化促进环化反应,再加入强酸进行水解脱除氨基保护基,然后调节ph至7以上,得到相应的式ⅲ化合物。使能够更有效的形成相应的产物,具有较好的收率和纯度效果。
在上述邻氟邻亚胺基苯甲酸中间体化合物的应用,作为优选,所述有机溶剂选自甲苯、二甲苯和二氯甲烷中的一种或几种。具有原料易得,易于回收的效果。
在上述邻氟邻亚胺基苯甲酸中间体化合物的应用,作为优选,所述强酸选自盐酸、氢溴酸、硫酸和三氟乙酸中的一种或几种混合。能够有效地脱除氨基保护基,使得到相应的产物,具有较好的收率效果。
综上所述,本发明与现有技术相比,具有以下优点:
1.本发明邻氟邻亚胺基苯甲酸中间体化合物,具有反应活性高,且易于活性,能够有效的应用到合成idelalisib的关键中间体式ii化合物的起始原料,且具有较高的反应稳定性,得到的相应中间产物也具有质量纯度高的效果。
2.本发明方法具有反应路线短,易于操作的优点,且具有产物收率和纯度高的效果。
3.本发明邻氟邻亚胺基苯甲酸中间体化合物用于制备式ii化合物,在亲核试剂苯胺存在下,能够有效的发生亲核取代反应,借助掉下来的苯氧基协同活化羧基,具有反应稳定性高的效果。
附图说明
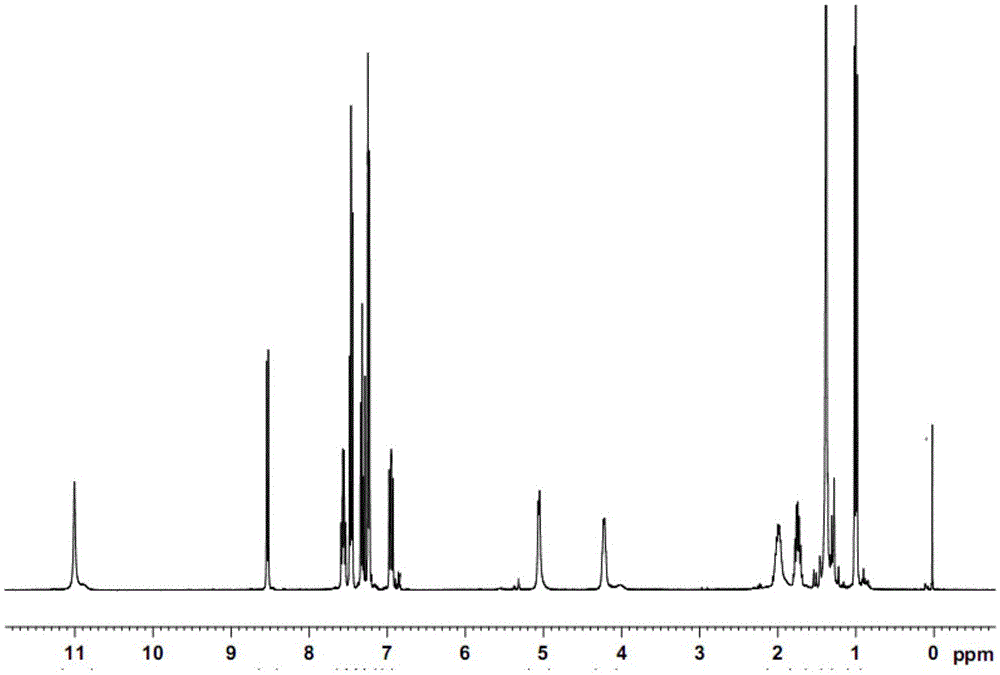
图1是本发明邻氟邻亚胺基苯甲酸中间体化合物的1h-nmr谱图。
具体实施方式
下面通过具体实施例和附图,对本发明的技术方案作进一步具体的说明,但是本发明并不限于这些实施例。
实施例1
本实施例中对应手性为s的式i化合物(s)-2-((2-((叔丁氧羰基)胺基)-1-苯氧基丁烯基)胺基)-6-氟苯甲酸的具体制备如下:
将10g(0.05mol)n-boc-l-2-氨基丁酸溶解于适量100ml甲苯溶剂中,加入4g吡啶与17gp(oph)3并搅拌混合均匀,继续搅拌,使羧酸活化完全,然后加入2-氨基-6-氟苯甲酸8.5g,升温至55℃使进行缩合反应1.5小时后,进行跟踪确认反应完全;反应结束后,加入1m盐酸使进行酸化反应液,静置、分层,收集有机层进行浓缩除去溶剂得到油状物15.2g,即为(s)-2-((2-((叔丁氧羰基)胺基)-1-苯氧基丁烯基)胺基)-6-氟苯甲酸,进一步的可以将该油状物经过快速柱分离纯化得纯品。将得到的(s)-2-((2-((叔丁氧羰基)胺基)-1-苯氧基丁烯基)胺基)-6-氟苯甲酸进行核磁氢谱分析,其分析结果如图1所示。同时,进行31p-nmr图谱显示不含p。且其质谱主要含92.92,339.1等碎片峰,显示该(s)-2-((2-((叔丁氧羰基)胺基)-1-苯氧基丁烯基)胺基)-6-氟苯甲酸比较活泼。
实施例2
将10g(0.05mol)n-boc-l-2-氨基丁酸溶解于适量150ml甲苯溶剂中,加入6g吡啶与16gp(oph)3并搅拌混合均匀,继续搅拌,使羧酸活化完全,然后加入2-氨基-6-氟苯甲酸9.0g,升温至60℃,并控制温度在60℃-65℃使进行缩合反应1.0小时后,进行跟踪确认反应完全;反应结束后,加入1m盐酸使进行酸化反应液,静置、分层,收集有机层进行浓缩除去溶剂得到油状物,即为(s)-2-((2-((叔丁氧羰基)胺基)-1-苯氧基丁烯基)胺基)-6-氟苯甲酸,进一步的可以将该油状物经过快速柱分离纯化得纯品。将得到的(s)-2-((2-((叔丁氧羰基)胺基)-1-苯氧基丁烯基)胺基)-6-氟苯甲酸进行相应的结构分析,结果表明其1h-nmr、31p-nmr图谱显示不含p、以及质谱主要含92.92,339.1等碎片峰同实施例1中的分析结果相一致,这里不再赘述。
实施例3
将10g(0.05mol)n-boc-l-2-氨基丁酸溶解于适量150ml甲苯溶剂中,加入7g吡啶与18gp(oph)3并搅拌混合均匀,继续搅拌,使羧酸活化完全,然后加入2-氨基-6-氟苯甲酸8.5g,升温至75℃,并控制温度在75℃-80℃使进行缩合反应1.0小时后,进行跟踪确认反应完全;反应结束后,加入1m盐酸使进行酸化反应液,静置、分层,收集有机层进行浓缩除去溶剂得到油状物,即为(s)-2-((2-((叔丁氧羰基)胺基)-1-苯氧基丁烯基)胺基)-6-氟苯甲酸,进一步的可以将该油状物经过快速柱分离纯化得纯品。将得到的(s)-2-((2-((叔丁氧羰基)胺基)-1-苯氧基丁烯基)胺基)-6-氟苯甲酸进行结构分析,其1h-nmr、31p-nmr图谱显示不含p、以及质谱主要含92.92,339.1等碎片峰同实施例1中的分析结果相一致,这里不再赘述。
实施例4
本实施例(r)-2-((2-((叔丁氧羰基)胺基)-1-苯氧基丁烯基)胺基)-6-氟苯甲酸
本实施例中式i化合物(r)-2-((2-((叔丁氧羰基)胺基)-1-苯氧基丁烯基)胺基)-6-氟苯甲酸的具体制备方法同实施例1一致,区别仅在于,对原料n-boc-l-2-氨基丁酸根据手性的不同采用n-boc-d-2-氨基丁酸代替,使得到相应的最终产物(r)-2-((2-((叔丁氧羰基)胺基)-1-苯氧基丁烯基)胺基)-6-氟苯甲酸。进行结构分析,其1h-nmr、31p-nmr图谱显示不含p、以及质谱主要含92.92,339.1等碎片峰同实施例1中的分析结果相一致,这里不再赘述。
当然,在采用不同异构体或者消旋体原料可以获得相对应的式i化合物,通过上述通用的制备方法,均顺利的获得了相对应的式ii化合物。这里通过对起始原料构型的选择,对应最终产物的结构即可得到相应的手性碳为r或s手性碳;亚胺双键可以是z型或e型的产物。本实施例中的原料n-boc-l-2-氨基丁酸中的氨基保护基boc可以采用苄氧羰基(cbz)代替,即采用n-cbz-l-2-氨基丁酸代替,同样能够得到相应的中间体产物。
实施例5
本实施例中针对实施例得到的相应(s)-2-((2-((叔丁氧羰基)胺基)-1-苯氧基丁烯基)胺基)-6-氟苯甲酸用于制备(s)-2-(1-胺基丙基)-5-氟-3-苯基喹唑啉-4(3h)-酮(式ⅲ化合物)的具体方法如下:
在洁净的反应瓶中将4.2g(0.01mol)(s)-2-((2-((叔丁氧羰基)胺基)-1-苯氧基丁烯基)胺基)-6-氟苯甲酸溶解于50ml甲苯中,再加入1.0g(0.01mol)苯胺,再加热升温至55℃左右并在搅拌下反应至完全,然后加入1m盐酸促进环化完全,再加入强酸浓盐酸继续反应进行脱除boc保护基,脱除完全后,然后,用氨水调节反应液的ph值至大于7,再静置、分层,分出有机相甲苯层,浓缩除去溶剂,再适量溶剂重结晶后得到类白色固体产物(s)-2-(1-胺基丙基)-5-氟-3-苯基喹唑啉-4(3h)-酮2.4g,摩尔收率为80%,纯度大于97%。
实施例6
本实施例中针对实施例得到的相应(s)-2-(1-胺基丙基)-5-氟-3-苯基喹唑啉-4(3h)-酮(对应手性为s的式ⅲ化合物)的具体方法如下:
在洁净的反应瓶中将4.2g(0.01mol)(s)-2-((2-((叔丁氧羰基)胺基)-1-苯氧基丁烯基)胺基)-6-氟苯甲酸溶解于100ml二氯甲烷中,再加入1.2g(0.012mol)苯胺,再加热升温至60℃左右并在搅拌下反应至完全,然后加入1m盐酸促进环化完全,再加入强酸浓盐酸继续反应进行脱除boc保护基,脱除完全后,然后,用氨水调节反应液的ph值至大于7,再静置、分层,分出有机相甲苯层,浓缩除去溶剂,再适量溶剂重结晶后得到类白色固体产物(s)-2-(1-胺基丙基)-5-氟-3-苯基喹唑啉-4(3h)-酮2.3g,摩尔收率为76%,手性纯度大于98%。
实施例7
本实施例中针对实施例得到的相应(r)-2-(1-胺基丙基)-5-氟-3-苯基喹唑啉-4(3h)-酮(对应手性为r的式ⅲ化合物)的具体方法如下:
在洁净的反应瓶中将4.2g(0.01mol)(r)-2-((2-((叔丁氧羰基)胺基)-1-苯氧基丁烯基)胺基)-6-氟苯甲酸溶解于100ml甲苯中,再加入1.5g(0.015mol)苯胺,再加热升温至80℃左右并在搅拌下反应至完全,然后加入1m盐酸促进环化完全,再加入强酸三氟乙酸继续反应进行脱除boc保护基,脱除完全后,然后,用氨水调节反应液的ph值至大于7,再静置、分层,分出有机相甲苯层,浓缩除去溶剂,再适量溶剂重结晶后得到类白色固体产物(r)-2-(1-胺基丙基)-5-氟-3-苯基喹唑啉-4(3h)-酮2.2g,摩尔收率为74%,手性纯度大于98%。
本发明中所描述的具体实施例仅是对本发明精神作举例说明。本发明所属技术领域的技术人员可以对所描述的具体实施例做各种各样的修改或补充或采用类似的方式替代,但并不会偏离本发明的精神或者超越所附权利要求书所定义的范围。
尽管对本发明已作出了详细的说明并引证了一些具体实施例,但是对本领域熟练技术人员来说,只要不离开本发明的精神和范围可作各种变化或修正是显然的。
- 还没有人留言评论。精彩留言会获得点赞!