倍半萜和类胡萝卜素的共同生成的制作方法
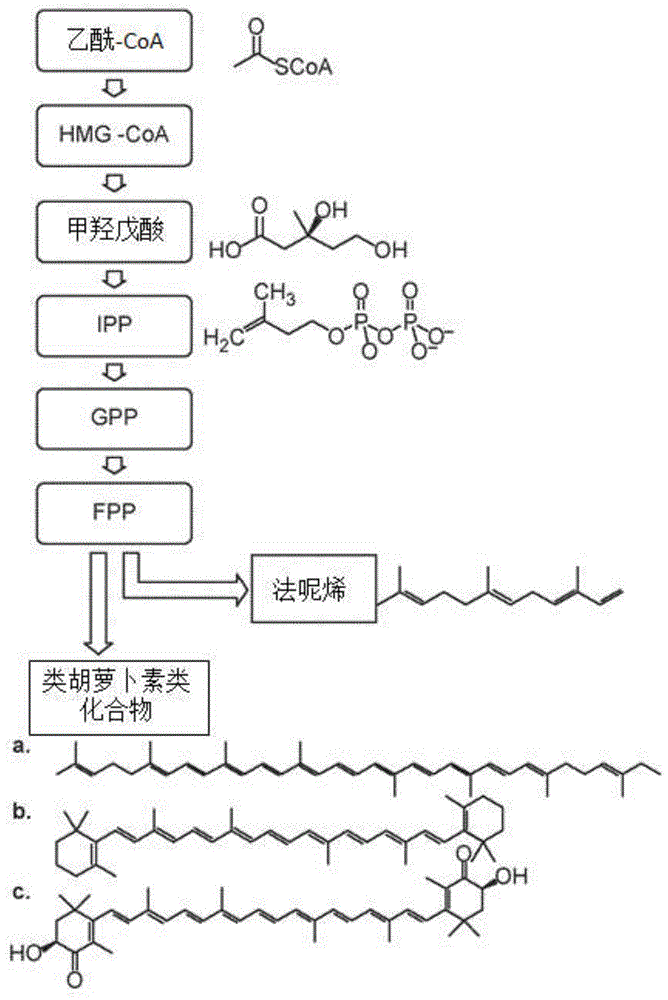
1.发明领域本发明提供了用于在发酵过程中从微生物细胞共同生成两种或两种以上类异戊二烯类化合物的组合物和方法,以及用过的微生物细胞的增值。2.发明背景类异戊二烯类化合物在自然界中普遍存在。其包含由40,000多种个体产品组成的家族,其中许多产品对生物体至关重要。类异戊二烯类化合物用于维持细胞流动性、电子传递和其他代谢功能。大量天然与合成的类异戊二烯类化合物具有许多应用,例如药物类、化妆品类、香料类、颜料类和着色剂类、杀真菌剂类、防腐剂类、营养品类和精细化学中间体类。特别是,类胡萝卜素类化合物分布在鱼类、动物和甲壳类动物中。红色类胡萝卜素虾青素已被用作工业中的色素沉着来源,例如,用于水产养殖业中的鲑鱼肉。ukibeetal.,2009,appl.environ.microbiol.75:7205-7211。虾青素是鲑鱼饲料的最大成本之一,并且是鲑鱼肉呈红色所必需的。传统上,类异戊二烯类化合物是通过从天然来源例如植物、微生物和动物中提取而制得的。然而,由于许多深刻的限制,通过提取方式的产量通常非常低。首先,大多类异戊二烯类化合物在自然界中仅少量积累。其次,所述源生物通常不适于生成商业上可行量的所需类异戊二烯类化合物所必需的大规模培养。在合成生物学领域已取得了进展,并且目前正在以工业规模生成许多类异戊二烯类化合物。然而,考虑到许多商业应用所需的大量类异戊二烯产品,仍需改进能够比现有技术更有效地生成类异戊二烯类化合物的系统和发酵程序。此外,期望从可再生来源有效生成类胡萝卜素类化合物,例如虾青素。本发明的实施方案满足所述这些需求和其他需求。3.发明摘要本发明提供了用于从经遗传修饰以生成类异戊二烯类化合物的宿主细胞共同生成两种或两种以上类异戊二烯类化合物的组合物和方法,以及用过的宿主细胞,特别是用过的微生物宿主细胞的增值。在一方面,本发明提供了经遗传修饰以生成第一类异戊二烯和进一步经遗传修饰以生成第二类异戊二烯的宿主细胞。本发明所述的某些实施方案一般涉及微生物(例如非天然存在的微生物),其至少生成倍半萜,诸如法呢烯和类胡萝卜素,例如虾青素、叶黄素、酮式类胡萝卜素、或其他类胡萝卜素。在某些实施方案,所述宿主细胞能够生成法呢烯和类胡萝卜素,例如虾青素、叶黄素、酮式类胡萝卜素、或其他类胡萝卜素。在某些实施方案,所述宿主细胞能够生成法呢烯和虾青素。在另一方面,本发明提供了能够生成倍半萜(例如法呢烯)和类胡萝卜素(例如虾青素、叶黄素、酮式类胡萝卜素、或其他类胡萝卜素)的宿主细胞。在某些实施方案,所述宿主细胞包含编码本发明所述的甲羟戊酸途径的各种酶中的至少一种的一种或多种核酸。在某些实施方案,所述宿主细胞还包含编码萜烯合酶的核酸,如本发明所述。在某些实施方案,所述萜烯合酶是法呢烯合酶。在某些实施方案,所述宿主细胞还包含编码能够生成类胡萝卜素(例如虾青素、叶黄素、酮式类胡萝卜素、或其他类胡萝卜素)的途径的酶的一种或多种核酸。在某些实施方案,所述类胡萝卜素是虾青素。在某些实施方案,所述这些酶选自由八氢番茄红素合酶/番茄红素环化酶,八氢番茄红素去饱和酶,虾青素合酶,细胞色素-p450羟化酶/酮化酶,细胞色素-p450还原酶,β-胡萝卜素酮化酶,β-胡萝卜素羟化酶,β-胡萝卜素羟化酶,β-胡萝卜素酮化酶,β-胡萝卜素羟化酶,和其组合组成的组。在某些实施方案,所述这些实施方案的各种酶由多种核酸编码。在某些实施方案,单个核酸编码所述这些实施方案的每种酶。在某些实施方案,所述这些实施方案的各种酶由多种异源核酸编码。在某些实施方案,单个异源核酸编码所述这些实施方案的每种酶。在某些实施方案,大量的倍半萜从细胞中释放出来,所述倍半萜可从所述细胞中回收。在某些实施方案,大量的类胡萝卜素保留在所述细胞中(或保持与细胞生物量相关),其中可通过回收所述细胞团来回收所述类胡萝卜素。在某些实施方案,所述倍半萜和所述类胡萝卜素的生成可在同一时间发生或大约同时发生(图4的第一实施方案)。在某些实施方案,可存在遗传开关,使得最初生成生物量和倍半萜,然后在所述遗传开关被激活后在所述生物量中生成类胡萝卜素(图4的第二实施方案)。在某些实施方案,所述倍半萜和生物量可通过在低密度液相中与所述倍半萜进行差速离心来分离,并且使用颗粒状固体材料来分离生物量。在第一个实施方案,所述沉淀的生物量含有类胡萝卜素。在第二个实施方案,可将所述生物量重新悬浮在培养基中并进行遗传开关以激活类胡萝卜素生成。在所述第二实施方案中,在合适的条件下孵育合适的时间后,可再次使生物量沉淀,并且可生成含有类胡萝卜素的所述沉淀的生物量。本实施方案提供了若干优点。生成两种或两种以上类异戊二烯类化合物(例如,在生成倍半萜如法呢烯的相同酵母细胞中的类胡萝卜素类化合物,例如虾青素)的一个优点是可在接种后的单次发酵运行中制备多种类异戊二烯产品。因此,在发酵的初始阶段生长的相同细胞生物量可用于生成两种或两种以上类异戊二烯产品。如果要对两种或两种以上类异戊二烯类化合物进行单独的发酵,则需复制大多数操作单元(例如,接种、种子菌株的生长、生成发酵罐的生长和操作),导致两种或或两种以上类异戊二烯的总生成成本相应增加。此外,如果进行两次单独的发酵,则发酵碳源的成本将显著增加。这是因为生物量的生长是碳源的重要用途,并且在两次发酵中均需生物量生成,导致碳源生成生物量的需求增加了数倍。还存在其他优点。例如,在某些实施方案,宿主细胞中生成的多种类异戊二烯产物主要存在于不同的相中。例如,较大的类异戊二烯(例如,c40类异戊二烯)主要与细胞结合,因为其尺寸不允许其从细胞释放到发酵培养基中,而较小的类异戊二烯(例如,c15类异戊二烯)主要释放到所述发酵培养基中。在不同相中存在两种目标类异戊二烯可容易地使此两种类异戊二烯产物分离。此外,生成倍半萜的宿主细胞在没有生成类胡萝卜素类化合物的情况下具有低价值,是要处理的废产物,或作为动物饲料成分具有最小价值。在酵母细胞中生成类胡萝卜素类化合物,例如虾青素,显著增加了生成所述倍半萜的酵母的价值。含有类胡萝卜素类化合物的酵母具有显著增强的价值。譬如,含有虾青素的酵母可出售到鲑鱼饲料市场,以取代合成虾青素的使用,所述合成虾青素是鲑鱼饲料的最大成本之一,并且是鲑鱼肉呈红色所必需的。4.附图简要说明图1a示出了缩简的甲羟戊酸途径和用于法呢烯和类胡萝卜素生物合成的碳流分裂的概览。示出了3种类胡萝卜素的结构:(a)番茄红素,(b)β-胡萝卜素,和(c)虾青素。图1b示出了所述甲羟戊酸途径和各种碳数的类异戊二烯类化合物的生成。图2示出了在致癌酵母xanthophyllomycesdendrorhus中β-胡萝卜素的生成途径,其也示出了来自由bts1编码的酿酒酵母(saccharomycescerevisiae)的ggps。图3a示出了使用来自x.dendrorhous的基因经工程改造的酿酒酵母(s.cerevisiae)中虾青素生物合成途径。图3b示出了用于生成黄体素和其他类胡萝卜素类化合物的示例性途径。图4示出了共同生成法呢烯和类胡萝卜素类化合物的两个不同实施方案。图5示出了在hplc中从色谱柱于11.5分钟处洗脱得到β-胡萝卜素。图6示出了β-胡萝卜素校准标准品,显示随着浓度的增加而峰面积增加。图6所示为各级校准标准品的原始hplc色谱图的叠加图。如方法章节中所报道的,将峰分离并在450nm处监测。图7示出了校准曲线,其显示峰面积与分析物浓度有很好的相关性(r2>0.99)。图8示出了虾青素洗脱约1.4分钟,并示出了随着浓度增加,峰面积明显增加。此处报道的浓度是在丙酮中连续稀释dmso中约1mg/ml储备液的估计值。然而,此图清楚地表明,虾青素和胡萝卜素可使用当前条件彼此分离。在480nm处监测所述峰,并且即使在450nm处测定(通常用于β-胡萝卜素),我们也未观察到峰响应的任何显著变化。图9示出了使用本报告中提及的条件进行提取和分析的各种菌株样品。a)ggpps祖父母菌株,无下游基因,预计未显示β-胡萝卜素或虾青素的迹象。b)仅含有编码β-胡萝卜素的基因的亲本菌株在提取和分析后清楚地显示其存在。目前尚不清楚13.3分钟处的第二个峰的身份。它可能是β-胡萝卜素的二氢类似物,其是crtyb基因的已知副产物(参考文献:verwaaletal,2007)。c)子代菌株清楚地显示在1.4分钟处存在虾青素以及β-胡萝卜素和其他潜在的类胡萝卜素类化合物。其他较小的峰值的身份是未知的,它们可能是其他下游类胡萝卜素类化合物(比β-胡萝卜素极性更大,可能是氧化形式),或者也可能含有一些降解或转化的虾青素类似物。图10示出了代表性平板,其示出了黄色/橙色菌落。此板中的a、c.菌落看起来是淡黄色。此板中的b.菌落看起来是橙色的。图11示出了代表性平板,其示出了红色的共同生成菌株菌落。图左,带有单个菌落的转化板。图右,重新划线所选克隆。黄色菌落包含编码β-胡萝卜素生物合成途径的核酸。红色菌落是生成虾青素的菌株。图12示出了通过工程化生成类胡萝卜素类化合物(β-胡萝卜素或虾青素)的菌株来生成法呢烯。用类胡萝卜素生物合成途径进行工程化的法呢烯生成菌株生成法呢烯,如图12所示。所述这些菌株也生成类胡萝卜素类化合物(数据未示出)。图13a和13b示出了几种菌株的法呢烯生成量(13a)和生长(光密度:13b)。图14a示出了几种菌株的法呢烯生成量。图14b示出了几种菌株的生长(光密度)。5.具体实施方式5.1定义术语“类异戊二烯”、“类异戊二烯类化合物”、“萜烯”、“萜烯化合物”、“萜烯类化合物”和“萜类化合物”在本发明中可互换使用,是指能够衍生自异戊烯基焦磷酸(ipp)的任何化合物。存在于类异戊二烯类化合物中的c原子数通常可被5整除(例如,c5、c10、c15、c20、c25、c30和c40)。已报道了不规则的类异戊二烯类化合物和多萜类化合物,并且也均包括在“类异戊二烯”的定义中。类异戊二烯类化合物包括但不限于单萜类、二萜类、三萜类、倍半萜类和多萜类。术语“类胡萝卜素”是指由多烯骨架组成的化合物,所述多烯骨架是由五碳异戊二烯单元缩合而成。类胡萝卜素类化合物可以是非环状的或以一个(单环)或两个(双环)环状端基进行封端。术语“类胡萝卜素”可包括胡萝卜素类化合物和叶黄素类化合物。“胡萝卜素”是指烃类胡萝卜素。含有一个或多个氧原子的胡萝卜素衍生物,所述氧原子以羟基-、甲氧基-、氧代-、环氧-、羧基-、或醛基官能团的形式,或存在于糖苷类、糖苷酯类或硫酸酯类中,统称为“叶黄素”。特别适用于本发明的类胡萝卜素类化合物是单环和双环类胡萝卜素类化合物。本发明使用的术语“异戊二烯基二磷酸”可与“异戊二烯基焦磷酸”互换使用,包括具有单个异戊二烯基基团的单异戊二烯基二磷酸(例如ipp和dmapp),以及包含2个或更多个异戊二烯基基团的聚异戊二烯基二磷酸。单异戊二烯基二磷酸包括异戊烯基焦磷酸(ipp)及其异构体二甲基烯丙基焦磷酸(dmapp)。本发明使用的术语“萜烯合酶/萜烯合酶”是指酶促修饰ipp、dmapp或聚异戊二烯基焦磷酸的任何酶,从而生成萜类化合物前体化合物。术语“萜烯合酶/萜烯合酶”包括催化异戊二烯基二磷酸转化为类异戊二烯或类异戊二烯前体的酶。“焦磷酸”一词在本发明中可与“二磷酸”互换使用,是指共价键合的两个磷酸基团。因此,例如,术语“异戊烯二磷酸”和“异戊烯焦磷酸”是可互换的;术语“异戊烯基焦磷酸”和“异戊烯基二磷酸”是可互换的;术语“法呢基二磷酸”和“法呢基焦磷酸”是可互换的,等等。本发明使用的术语“甲羟戊酸途径”或“mev途径”是指将乙酰-coa转化为ipp的生物合成途径。所述甲羟戊酸途径包含催化以下步骤的酶:(a)使两分子乙酰-coa缩合成乙酰乙酰-coa(例如,通过乙酰乙酰-coa硫解酶的作用);(b)使乙酰乙酰-coa与乙酰-coa缩合形成羟甲基戊二酰辅酶a(hmg-coa)(例如,通过hmg-coa合酶(hmgs)的作用);(c)使hmg-coa转化为甲羟戊酸(例如,通过hmg-coa还原酶(hmgr)的作用);(d)使甲羟戊酸磷酸化为甲羟戊酸5-磷酸(例如,通过甲羟戊酸激酶(mk)的作用);(e)使甲羟戊酸5-磷酸转化为甲羟戊酸5-焦磷酸(例如,通过磷酸甲羟戊酸激酶(pmk)的作用);和(f)使甲羟戊酸5-焦磷酸转化为异戊烯基焦磷酸(例如,通过甲羟戊酸焦磷酸脱羧酶(mpd)的作用)。所述甲羟戊酸途径在图1中进行示意性说明。所述甲羟戊酸途径的“上半部分”是指负责将乙酰-coa转化为甲羟戊酸的酶。本发明使用的术语“i-脱氧-d-木酮糖5-二磷酸途径”或“dxp途径”是指通过dxp途径中间体将甘油醛-3-磷酸和丙酮酸转化为ipp和dmapp的途径,其中dxp途径包含催化所述反应的酶。dxp途径的典型酶包括dxs、dxr、cms、cmk、mcs、hds和hdr。dxs是1-脱氧-d-木酮糖-5-磷酸合酶;dxr是1-脱氧-d-木酮糖-5-磷酸还原异构酶(也称为ispc);ispd(cms)是4-二磷酸胞苷-2c-甲基-d-赤藓糖醇合酶;ispe(cmk)是4-二磷酸胞苷-2c-甲基-d-赤藓糖醇合酶;ispf(mcs)是2c-甲基-d-赤藓糖醇2,4-环二磷酸合酶;ispg(hds)是1-羟基-2-甲基-2-(e)-丁烯基4-二磷酸合酶;和isph(hdr)是异戊烯基/二甲基烯丙基二磷酸合酶。本发明使用的术语“异戊二烯基转移酶”可与术语“异戊二烯基二磷酸合酶”和“聚异戊二烯基合酶”(例如,“gpp合酶”、“fpp合酶”、“opp合酶”等)互换使用,是指催化异戊烯基二磷酸与烯丙基引物底物的连续1'-4缩合,使得形成各种链长的异戊二烯基二磷酸的酶。本发明使用的术语“目标化合物”是指从采用一种或多种异源核酸进行遗传修饰的宿主细胞中回收的化合物,所述一种或多种异源核酸编码用于生成目标化合物,但不包括在所述目标化合物的生成过程中偶然生成的代谢物的生物合成途径的酶。在特定实施方案中,从培养物中回收两种或两种以上目标化合物。术语“发酵运行”是指分批、半连续或连续发酵的一个完整循环。优选在发酵罐最初填充起始物料并用适当的生物体接种时开始发酵运行。发酵运行优选在发酵罐生物体不再活跃时或当发酵罐被清空时结束。术语“接种”是指宿主细胞(例如,经遗传修饰的微生物细胞)的配置,所述宿主细胞将生长以形成置于培养基(例如,包含待发酵培养基的发酵罐)中的微生物培养物。术语“单一接种物”是指用于接种的物料,例如,包含宿主细胞(例如,经遗传修饰的微生物细胞)的组合物,所述宿主细胞配置于培养基中,例如在使生物量生长的初始时间点,配置于包含培养基的发酵罐中。术语“共同生成”是指从单一接种物,即从单一宿主细胞生成的细胞,生成两种或两种以上目标化合物。本发明使用的术语共同生成可指在发酵罐中的单次发酵运行中并行或同时生成两种或两种以上化合物。术语共同生成还可指从单一接种物依次顺序生成两种或两种以上目标化合物,其中至少一种目标化合物通过在第一次发酵运行中激活所述目标化合物的生物合成途径的酶的表达,然后激活另一目标化合物的另一生物合成途径的酶的表达而生成。在某些实施方案,可在两个单独的发酵运行中实现依次生成。本发明使用的术语“类胡萝卜素”是指一类具有正式衍生自异戊二烯的共轭多烯碳骨架的烃。这类分子由三萜类和四萜类及其氧化衍生物组成;并且,这些分子通常具有强的光吸收性能,并赋予颜色。术语“类胡萝卜素”可包括胡萝卜素类化合物和叶黄素类化合物。“胡萝卜素”是指烃类胡萝卜素(例如β-胡萝卜素和番茄红素)。相反,术语“叶黄素”是指含有羟基-、甲氧基-、氧代-、环氧-、羧基-、或醛基官能团形式的一个或多个氧原子的c40类胡萝卜素。叶黄素类化合物的实例包括但不限于环氧玉米黄素(antheraxanthin),金盏花黄质(adonixanthin),虾青素(即3,3″-二羟基-β,β-胡萝卜素-4,4″-二酮),角黄素(即β,β-胡萝卜素-4,4″-二酮),β-隐黄质,酮-γ-胡萝卜素,海胆酮,3-羟基海胆酮,3'-羟基海胆酮,玉米黄质,金盏花红素(adonirubin),四羟基-β,β'-胡萝卜素-4,4'-二酮,四羟基-β,β'-胡萝卜素-4-酮,眉藻黄素(caloxanthin),erythroxanthin,念珠藻黄素(nostoxanthin),屈曲黄素(flexixanthin),3-羟基-γ-胡萝卜素,3-羟基-4-酮-γ-胡萝卜素,细菌玉红黄质(bacteriorubixanthin),bacteriorubixanthinal和黄体素。本发明使用的“第一类异戊二烯”和“第二类异戊二烯”是指由宿主细胞生成的目标化合物,所述宿主细胞用编码生物合成途径的异源核酸进行遗传修饰以生成所述第一类异戊二烯和第二类异戊二烯。目标化合物是旨在从宿主所述细胞中回收的化合物。通常,它们并非制备所述宿主化合物的途径中的中间体。本领域技术人员将认识到目标化合物可具有共同的中间体。本发明使用的术语“遗传开关”是指一种或多种遗传元件,其允许控制生成所述第一类异戊二烯化合物的酶和生成所述第二类异戊二烯化合物的酶的表达。在第一种配置中,所述遗传开关可促进生成所述第一类异戊二烯化合物的酶的表达,并抑制生成所述第二类异戊二烯化合物的酶的表达。在第二种配置中,所述遗传开关可抑制生成所述第一类异戊二烯化合物的酶的表达,并促进生成所述第二类异戊二烯化合物的酶的表达。在第三种配置中,所述遗传开关可促进生成所述第一类异戊二烯化合物的酶的表达,并促进生成所述第二类异戊二烯化合物的酶的表达。在第四种配置中,所述遗传开关可抑制生成所述第一类异戊二烯化合物的酶的表达,并抑制生成所述第二类异戊二烯化合物的酶的表达。譬如,所述遗传开关可包括与编码生物合酶的一个或多个基因可操作连接的一个或多个启动子,或与调节表达一种或多种生物合酶的转录调节因子可操作连接的一个或多个启动子。本发明使用的术语“异源/异源性”是指通常在自然界中不存在的。术语“异源核苷酸序列”是指在自然界中通常在给定细胞中不存在的核苷酸序列。因此,异源核苷酸序列可以是:(a)其宿主细胞是外源的(即,相对于所述细胞是“外源的”);(b)天然存在于所述宿主细胞中(即“内源性”),但在所述细胞中以非天然量存在(即,比所述宿主细胞中天然存在的量更多或更少);或(c)天然存在于所述宿主细胞中但位于其天然基因座之外。术语“异源酶”是指在自然界中通常在给定细胞中不存在的酶。所述术语包括以下酶:(a)相对于给定细胞是外源的(即,由天然存在于所述宿主细胞中或天然不存在于所述宿主细胞的给定环境中的核苷酸序列编码);(b)天然存在于所述宿主细胞中(例如,所述酶由相对于所述细胞是内源性的核苷酸序列编码)但在所述宿主细胞中以非天然量(例如,大于或小于天然存在的量)生成。另一方面,本发明使用的关于分子,特别是关于酶和核酸的术语“天然的/原生的(native)”或“内源的”表示在它们起源或在自然界中发现的生物体中表达的分子,其表达水平与可以低于、等于或高于天然微生物中分子的表达水平无关。应理解,天然酶或多核苷酸的表达可在重组微生物中进行修饰。本发明使用的术语“生成量/产生量”通常是指类异戊二烯的量或由本发明提供的经遗传修饰的宿主细胞生成的类异戊二烯的量。在一些实施方案,生成量表示为所述宿主细胞生成的类异戊二烯产量。在其他实施方案,生成量表示为所述宿主细胞在生成所述类异戊二烯时的生产率。本发明使用的术语“生产率”是指由宿主细胞生成类异戊二烯的量,表示为每发酵液的量生成的类异戊二烯的量(以重量计),在所述发酵液中所述宿主细胞按时间(每小时)进行培养(按体积计)。术语“产量/产率”是指由宿主细胞生成类异戊二烯的量,以所述宿主细胞消耗的每碳源量生成的类异戊二烯的量表示,以重量计。本发明使用的术语“变体”是指通过氨基酸插入、缺失、突变和置换而不同于具体列举的“参考”多肽(例如,野生型序列)的多肽,但保留与所述参考多肽基本相似的活性。在一些实施方案,所述变体通过重组dna技术(例如诱变)产生。在一些实施方案,变体多肽与其参考多肽的不同之处在于一个碱基残基置换另一个碱基残基(即arg置换lys),一个疏水残基置换另一个疏水残基(即leu置换ile),或一个芳香族残基置换另一个芳香族残基(即phe置换tyr)等。在一些实施方案,变体包括类似物,其中得到导致所述参考序列的基本结构类似的保守置换。此类保守置换的实例,包括但不限于,天冬氨酸置换谷氨酸,反之亦然;谷氨酰胺置换天冬酰胺,反之亦然;丝氨酸置换苏氨酸,反之亦然;赖氨酸置换精氨酸,反之亦然;或者任何异亮氨酸、缬氨酸或亮氨酸彼此置换。如本发明所用,在两个或两个以上核酸或蛋白序列的背景下的术语“序列同一性”或“百分比同一性”是指两个或两个以上序列或子序列,其是相同的或具有特定百分比的相同氨基酸残基或核苷酸。譬如,当在比较窗口或指定区域上进行比较和比对以获得最大对应性时,如使用序列比较算法或通过手动比对和目视检查进行测定的,所述序列在指定区域上可具有与参考序列至少60%,至少65%,至少70%,至少75%,至少80%,至少85%,至少90%,至少91%,至少92%,至少93%,至少94%,至少95%,至少96%,至少97%,至少98%,至少99%,或更高同一性的百分比同一性。譬如,通过计算所述序列中相同核苷酸(或氨基酸残基)的数量除以总核苷酸(或氨基酸残基)的长度减去任何空位的长度的比值来确定同一性的百分比。为了方便起见,可使用本领域已知的计算机程序和数学算法来确定两个序列之间的同一性程度。计算百分比序列同一性的此类算法通常考虑了比较区域上的序列空位和错配。比较和比对序列的程序,如clustalw(序列比对)(thompsonetal.,(1994)nucleicacidsres.,22:4673-4680),align(myersetal.,(1988)cabios,4:11-17),fasta(pearsonetal.,(1988)pnas,85:2444-2448;pearson(1990),methodsenzymol.,183:63-98)和空位的blast(altschuletal.,(1997)nucleicacidsres.,25:3389-3402)均可用于此目的。所述blast或blast2.0(altschuletal.,j.mol.biol.215:403-10,1990)可从包括国家生物信息中心(ncbi)和互联网在内的,用于连接序列分析程序blastp、blastn、blastx、tblastn和tblastx的多个来源获取。更多信息可在ncbi网站获悉。在一些实施方案,序列比对和百分比同一性计算可使用blast程序采用其标准默认参数来确定。对于核苷酸序列比对和序列同一性计算,blastn程序可以其默认参数(空位开放罚分(gapopeningpenalty)=5,空位延伸罚分(gapextensionpenalty)=2,核匹配(nucleicmatch)=1,核不匹配(nucleicmismatch)=-3,期望值(expectationvalue)=10.0,字大小(wordsize)=11)进行使用。对于多肽序列比对和序列同一性计算,blastp程序可以其默认参数(比对矩阵(alignmentmatrix)=blosum62;空位成本(gapcosts):存在(existence)=11,延伸(extension)=1;成分调整(compositionaladjustments)=条件成分得分(conditionalcompositionalscore),矩阵调整(matrixadjustment);期望值(expectationvalue)=10.0;字大小(wordsize)=6;查询范围中的最大匹配数(maxmatchesinaqueryrange)=0)进行使用。或者,使用以下程序和参数:克隆管理组件(clonemanagersuite)版本5(sci-ed软件)的比对加强版(alignplus)软件;dna比较:总体比较(globalcomparison),标准线性评分矩阵(standardlinearscoringmatrix),不匹配罚分=2,开放空位罚分=4,延伸空位罚分=1。氨基酸比较:总体比较(globalcomparison),blosum62评分矩阵。5.2发明详述本发明提供了用于在培养基中共同生成两种或两种以上类异戊二烯类化合物的方法和宿主细胞。所述宿主细胞在第一生物合成途径中包含一种或多种酶以生成第一类异戊二烯。所述宿主细胞还包含编码第二生物合成途径中的一种或多种酶的一种或多种异源核酸,以生成第二类异戊二烯。在此方法中,回收所述第一类异戊二烯,并回收所述第二类异戊二烯。类胡萝卜素是在自然界中广泛分布的红色、黄色和橙色色素。c40类胡萝卜素类化合物属于四萜类(即,它们具有40个碳原子,由四个含有10个碳原子的萜烯单元构成)。类胡萝卜素类化合物有两大类:胡萝卜素类和叶黄素类。胡萝卜素类仅由碳原子和氢原子组成。叶黄素类具有一个或多个氧原子。烃类胡萝卜素被分类为胡萝卜素类,而含有氧原子的类胡萝卜素则被称为叶黄素类。虾青素是被称为叶黄素或酮式类胡萝卜素(即具有酮基团的类胡萝卜素)的氧化类胡萝卜素。法呢烯(或其他倍半萜类)和所有类胡萝卜素类化合物,包括虾青素,均是类异戊二烯类化合物,其可通过甲羟戊酸途径在酵母中生成。在图1a中示意性地示出了碳通量朝向法呢烯或朝向类胡萝卜素类化合物(包括虾青素)的分裂。图1a中使用的缩写包括hmg-coa(3-羟基-3-甲基戊二酰辅酶a),ipp(异戊烯基二磷酸),gpp(香叶基二磷酸)和fpp(法呢基二磷酸)。图1a中的箭头表示酶促转化,并可由单一酶或多于一种酶进行催化。图1a包括甲羟戊酸途径的缩简形式,完整的甲羟戊酸途径和其他萜烯类化合物的生成如图1b所示。所述甲羟戊酸途径的酶(从乙酰-coa到ipp)在第5.5节中进一步描述。虽然图1a和图1b示出了生成类异戊二烯前体如ipp的甲羟戊酸途径,但dxp途径也可用于生成类异戊二烯前体。酵母(酿酒酵母(saccharomycescerevisiae))中甲羟戊酸途径的过表达已在科学文献中进行描述(例如,notmanetal.,j.am.chem.soc.,128,2006,13982-13983;heetal.,mol.membr.biol.3-4,2012,107-113)。在某些实施方案,如前所述,所述甲羟戊酸途径的一种或多种酶过表达。已描述了在工程化酿酒酵母(s.cerevisiae)中生成β-胡萝卜素。kimetal.,foodsci.biotechnol.19,2010,263-266。β-胡萝卜素生物合成途径如图2所示。如图2中所示的示例性β-胡萝卜素生物合成途径所示,在由甲羟戊酸途径形成ipp后,可通过ipp异构酶将其转化为二甲基烯丙基焦磷酸(dmapp)。ipp和dmapp均由香叶基焦磷酸合酶(gpps)缩合以生成香叶基焦磷酸(gpp)。gpp和ipp可通过法呢基焦磷酸合酶(fpps)组合以生成法呢基焦磷酸(fpp)。fpp和ipp可通过香叶基焦磷酸合酶(ggpp合酶)组合以生成ggpp。编码ggpp合酶的示例性核酸包括bts1基因(酿酒酵母)和crte基因(红发夫酵母(x.dendrohous))。ggpp和ggpp可通过八氢番茄红素合酶(由crtb编码)组合以生成八氢番茄红素。在图2所示的示例性β-胡萝卜素生物合成途径中,示出了由此酶促反应步骤的由crtyb编码的双功能酶(八氢番茄红素合酶/番茄红素环化酶)。通过可由crti基因编码的八氢番茄红素去饱和酶的酶促作用,可将八氢番茄红素转化为链孢红素(neurosporene)。通过番茄红素环化酶(由crty基因编码)或双功能酶(由crtyb基因编码)的酶促作用,可将链孢红素转化为7,8-二氢-β-胡萝卜素。链孢红素也可通过八氢番茄红素去饱和酶(由crti基因编码)的酶促作用转化为番茄红素。番茄红素可通过番茄红素环化酶(由crtb基因编码)的酶促作用转化为β-胡萝卜素。在图2中所示的示例性β-胡萝卜素生物合成途径中,示出了由此酶促反应步骤的由crtyb基因编码的双功能酶(八氢番茄红素合酶/番茄红素环化酶)。应注意,图2中所示的八氢番茄红素不赋予任何颜色,因此不被认为是类胡萝卜素,而链孢红素(neurosporene)、番茄红素、β-胡萝卜素和7,8-二氢-β-胡萝卜素均认为是类胡萝卜素类化合物。由β-胡萝卜素开始的虾青素的生成示出在图3a中。图3a说明了由β-胡萝卜素开始的虾青素的示例性生物合成途径。黑色、白色和灰色粗箭头分别表示由crtw、crtz和crts编码的酶催化的反应。参见ukibeetal.,appliedandenviron.microbiol.nov.2009,p.7025-7211。β-胡萝卜素分四步转化为虾青素,其中分别通过crtw编码的β-胡萝卜素酮化酶和crtz编码的β-胡萝卜素羟化酶将此两个酮基和羟基基团添加至每个环上。如图3a所示,单个红发夫酵母(x.dendrorhous)基因crtyb编码双功能酶八氢番茄红素合酶/番茄红素环化酶。参见verdoesetal.,1999,mol.gen.genet.262:453-461。crts编码虾青素合酶,催化β-胡萝卜素的酮化和羟基化。据信,认为crts可编码细胞色素p450蛋白。ojimaetal.(2006)mol.genet.genomics275:148-158。据信,引入编码细胞色素p450还原酶的crtr,对于宿主细胞如酿酒酵母(s.cerevisiae)中crts和虾青素生成的功能性表达是重要的。参见ukibeetal.,appliedandenviron.microbiol.nov.2009,p.7025-7211。图3b示出了用于生成类胡萝卜素类化合物的另一示例性生物合成途径。特别地,图3b示出了由番茄红素生成黄体素。番茄红素可通过番茄红素环化酶(ec5.5.1.18)转化为δ-胡萝卜素。δ-胡萝卜素可通过δ-胡萝卜素β-环化酶(ec5.5.1.19)转化为α-胡萝卜素。α-胡萝卜素可通过β-环羟化酶(ec1.14.99.-)转化为玉米黄质(zeinoxanthin)。玉米黄质(zeinoxanthin)可通过胡萝卜素ε-单加氧酶(ec1.14.99.45)转化为黄体素。所述这些酶的实例是来自柑橘类水果的cithyb,citcyp97a,citcyp97b和citcyp97c(maetal.2016,bmcplantbiology16:148)。在某些实施方案,编码黄体素生物合成途径中的酶的任何合适的核酸可用于生成经遗传修饰的宿主细胞或用于共同生成黄体素与另一种类异戊二烯的方法。在某些实施方案,编码β-胡萝卜素/虾青素生物合成途径中的酶的任何合适的核酸可用于生成经遗传修饰的宿主细胞或用于共同生成一种或多种类胡萝卜素类化合物与另一种类异戊二烯的方法。编码可用于本发明实施方案的此类酶的示例性核酸示出在下表1中。用于生成β-胡萝卜素/虾青素途径的其他核酸在下述第5.6节中进一步描述。表1:适用于图2和图3a中所示的酶促反应的核酸和编码酶的列表。如上所述,先前报道了在经遗传修饰的微生物中生成类胡萝卜素类化合物。例如,通过使产油酵母,解脂耶氏酵母(yarrowialipolytica)工程化,已生成了虾青素(us7,851,199)。本发明的实施方案与先前研究的不同之处在于,在本实施方案中,一个宿主细胞(例如,酵母细胞)可在接种后的单次发酵运行期间或在接种后的两次发酵运行期间共同生成两种不同的类异戊二烯类化合物(其分子量基本上不同)。例如,两种产品,法呢烯和类胡萝卜素或类胡萝卜素类化合物的混合物(例如,如us7,851,199中所定义),例如虾青素,可同时共同生成(图4的实施方案1),或者可依次生成(图4的实施方案2),在第一时间段内生成法呢烯,然后在所述宿主细胞的第二阶段孵育期间分离宿主细胞并生成所述工程化类胡萝卜素。先前已描述了通过发酵共同生成1,4-丁二醇和γ-丁内酯(us9,222,113),以及共同生成萜烯和各种命名产品(us2015/0211024),但未见已知的共同生成类异戊二烯类化合物(例如倍半萜类和类胡萝卜素类)的实例。5.3宿主细胞本发明提供了能够共同生成两种或两种以上类异戊二烯类化合物的宿主细胞。在某些实施方案,所述宿主细胞用编码第一生物合成途径中的一种或多种酶的一种或多种异源核酸进行遗传修饰以生成第一类异戊二烯,以及用编码第二生物合成途径中的一种或多种酶的一种或多种异源核酸进行遗传修饰以生成第二类异戊二烯,所述第二类异戊二烯分子量不同于所述第一类异戊二烯的分子量。在某些实施方案,所述宿主细胞用编码第三生物合成途径中的一种或多种酶的一种或多种异源核酸进行遗传修饰,以生成第三类异戊二烯。在某些实施方案,所述宿主细胞用编码第四生物合成途径中的一种或多种酶的一种或多种异源核酸进行遗传修饰,以生成第四类异戊二烯。在某些实施方案,所述宿主细胞进行类似地修饰以生成第五、第六、第七、第八、第九或第十类异戊二烯或更多的类异戊二烯。在某些实施方案,所述第一类异戊二烯并非由未经遗传修饰的亲本宿主细胞生成的内源性化合物。在某些实施方案,所述第二类异戊二烯并非由未经遗传修饰的亲本宿主细胞生成的内源性化合物。在某些实施方案,当所述宿主细胞进行类似地修饰以生成第三、第四、第五、第六、第七、第八、第九或第十类异戊二烯或更多的类异戊二烯时,这些另外的类异戊二烯类化合物并非由所述亲本宿主细胞内源生成的。在某些实施方案,所述宿主细胞不经遗传修饰以生成除了衍生自ipp的化合物之外的用于回收的目标化合物。在所述这些实施方案中,所述宿主细胞进行修饰以仅生成类异戊二烯类目标化合物。这些化合物从所述宿主细胞培养物中回收或旨在从所述宿主细胞培养物中回收。所述宿主细胞不进行修饰以生成其他化合物进行回收。在某些实施方案,第一类异戊二烯是c5、c10、c15或c20类异戊二烯,和第二类异戊二烯是c30、c35、c40或更高碳数的类异戊二烯。在某些实施方案,所述第一类异戊二烯是c15类异戊二烯,和所述第二类异戊二烯是c40类异戊二烯。在某些实施方案,所述第一类异戊二烯是倍半萜,和所述第二类异戊二烯是四萜。在特定实施方案,所述第一类异戊二烯是法呢烯,和所述第二类异戊二烯是类胡萝卜素。在某些实施方案,所述第一类异戊二烯是β-法呢烯,和所述第二类异戊二烯是c40类胡萝卜素。在某些实施方案,所述第二类异戊二烯是类胡萝卜素或类胡萝卜素类化合物的混合物。在某些实施方案,所述第二类异戊二烯是虾青素、叶黄素或酮式类胡萝卜素。在某些实施方案,所述第二类异戊二烯是虾青素、角黄素、玉米黄质、β-胡萝卜素、番茄红素、黄体素或其任何组合。在某些实施方案,可选择第一类异戊二烯和第二类异戊二烯的任何组合,或选择本发明所述的任何另外的类异戊二烯类化合物,作为由经遗传修饰的宿主细胞生成的目标化合物。虽然不打算受任何特定操作理论的束缚,但在类异戊二烯共同生成过程中,发现一种或多种第二类异戊二烯(例如,类胡萝卜素类化合物)与第一类异戊二烯(例如,法呢烯)共同产生,与经遗传修饰以仅生成所述第一类异戊二烯的亲本宿主细胞相比,可降低生物量产量(例如,细胞密度)和所述第一类异戊二烯生成量。此类结果用宿主细胞观察到,所述宿主细胞经遗传修饰以提供朝向类胡萝卜素生成的相对高的碳通量。不希望受理论束缚,据信相对高的类胡萝卜素或中间体向类胡萝卜素(例如ggpp)的生成量可能对宿主细胞有毒或可能减缓细胞生长。本发明人进一步发现,通过共同生成作为目标化合物的类胡萝卜素与第一类异戊二烯对生物量积累的负面影响,可通过相对于所述第一类异戊二烯生成的碳通量,调节生成类胡萝卜素类化合物的碳通量来克服。因此,在某些实施方案,本发明提供了经遗传修饰的宿主细胞,使得第二类异戊二烯的共同生成在共同生成期间基本上不影响第一类异戊二烯的生成量或生物量产量。在所述这些实施方案中,可首先通过引入编码萜烯合酶的异源核酸对宿主细胞进行遗传修饰,以生成所需目标量的第一类异戊二烯。在构建能够以目标量生成所述第一类异戊二烯的亲本宿主细胞后,所述亲本宿主细胞可通过引入编码萜烯合酶的异源核酸进行进一步遗传修饰,以在共同生成期间,生成基本上不影响所述第一类异戊二烯生成量生成或生物量产量的水平的第二类异戊二烯。如实施例章节中所述,当与用于第一类异戊二烯(例如,倍半萜)的碳通量相比,用于生成第二类异戊二烯(例如,一种或多种类胡萝卜素)的碳通量减少时,所述第二类异戊二烯的共同生成基本上不影响所述第一类异戊二烯生成量或生物量产量。在一些实施方案,所述两种类异戊二烯的相对比率可以在约0.001重量%至约2重量%之间调节。因此,在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够共同生成第二类异戊二烯和第一类异戊二烯,比率在约0.001重量%和约2重量%之间。在某些实施方案,共同生成类异戊二烯类化合物的方法包括以约0.001重量%和约1重量%之间的比率生成第二类异戊二烯和第一类异戊二烯。在某些实施方案,共同生成类异戊二烯类化合物的方法包括以约0.1重量%和约1重量%之间的比率生成第二类异戊二烯和第一类异戊二烯。在特定实施方案,所述比率基于重量%。在特定实施方案,所述比率基于每体积培养基的化合物的质量。在特定实施方案,所述比率基于每干细胞重量质量的化合物的质量。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以约2.5g/l至约200g/l的量共同生成所述第一类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以约1mg/l至约4000mg/l的量共同生成所述第二类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以约30g/l至约170g/l,约50g/l至约160g/l,或这些范围之间的任何数值的量共同生成所述第一类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以约1mg/l至约3000mg/l,约1mg/l至约2000mg/l,约1mg/l至约1000mg/l,约1mg/l至约800mg/l,约1mg/l至约500mg/l,约1mg/l至约400mg/l,约1mg/l至约300mg/l,或这些范围之间的任何数值的量共同生成所述第二类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以约2.5g/l至约200g/l的量共同生成所述第一类异戊二烯,以及以约1mg/l至约4000mg/l的量共同生成所述第二类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以约2.5g/l至约200g/l的量共同生成所述第一类异戊二烯,以及以约1mg/l至约500mg/l的量共同生成所述第二类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以约100g/l至约120g/l的量共同生成所述第一类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以约20mg/l至约1250mg/l的量共同生成所述第二类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以约100g/l至约120g/l的量共同生成所述第一类异戊二烯,以及以约20mg/l至约1250mg/l的量共同生成所述第二类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以约75mg/l的量共同生成所述第二类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以约100g/l至约120g/l的量共同生成所述第一类异戊二烯,以及以约75mg/l的量共同生成所述第二类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够共同生成本发明所述的任何组合量的所述第一类异戊二烯和所述第二类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以每千克干细胞质量约100g至5kg的量共同生成所述第一类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以每千克干细胞质量约1mg至约100g的量共同生成所述第二类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以每千克干细胞质量约100g至5kg的量共同生成所述第一类异戊二烯,以及以每千克干细胞质量约1mg至约50g的量共同生成所述第二类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以每千克干细胞质量约100g至5kg的量共同生成所述第一类异戊二烯,以及以每千克干细胞质量约1mg至约40g的量共同生成所述第二类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以每千克干细胞质量约100g至5kg的量共同生成所述第一类异戊二烯,以及以每千克干细胞质量约1mg至约30g的量共同生成所述第二类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以每千克干细胞质量约100g至5kg的量共同生成所述第一类异戊二烯,以及以每千克干细胞质量约1mg至约20g的量共同生成所述第二类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够以每千克干细胞质量约100g至5kg的量共同生成所述第一类异戊二烯,以及以每千克干细胞质量约3g的量共同生成所述第二类异戊二烯。在某些实施方案,对所述宿主细胞进行遗传修饰,使得其能够共同生成本发明所述的任何组合量的所述第一类异戊二烯和所述第二类异戊二烯。所述第一类异戊二烯可以是本领域技术人员已知的任何类异戊二烯。在特定实施方案,所述第一类异戊二烯是c15类异戊二烯。在某些实施方案,所述第一类异戊二烯选自由法呢烯、法呢醇、法呢基二磷酸、橙花叔醇、甜没药烯(bisabolene)、甜没药醇(bisabolol)、甜椒醇(capsidiol)和广藿香醇(patchoulol)组成的组。在特定实施方案,所述第一类异戊二烯是法呢烯。在某些实施方案,所述第一类异戊二烯是倍半萜,和第二类异戊二烯是一种或多种类胡萝卜素类化合物。在某些实施方案,所述第一类异戊二烯是倍半萜,和所述第二类异戊二烯是一种或多种c40类胡萝卜素类化合物。在某些实施方案,所述第一类异戊二烯是倍半萜,和所述第二类异戊二烯是虾青素、角黄素、玉米黄质、β-胡萝卜素、番茄红素和黄体素中的一种或多种。在某些实施方案,所述第一类异戊二烯是法呢烯,和所述第二类异戊二烯是虾青素、角黄素、玉米黄质、β-胡萝卜素、番茄红素和黄体素中的一种或多种。在某些实施方案,所述第二类异戊二烯相对于所述第一类异戊二烯的比率是基于单一类胡萝卜素的重量。在某些实施方案,所述第二类异戊二烯相对于所述第一类异戊二烯的比率是基于宿主细胞生成的类胡萝卜素类化合物组合的重量。在所述这些实施方案中,所述第一类异戊二烯和所述第二类异戊二烯的重量比是基于生成所述第一类异戊二烯和所述第二类异戊二烯的干细胞重量来测定。在某些实施方案,所述第一类异戊二烯主要从宿主细胞释放到培养基中。在特定实施方案,所述第一类异戊二烯具有能够使其从细胞中释放的尺寸或组成。其可提前预测或根据经验确定。在特定实施方案,当宿主细胞与培养基分离时,在所述培养基中存在至少70%、75%、80%、85%、90%、或95%的所述第一类异戊二烯。在某些实施方案,所述第二类异戊二烯主要与宿主细胞相关。在某些实施方案,所述第二类异戊二烯主要保留在所述宿主细胞内。在特定实施方案,所述第二类异戊二烯具有减少或防止其从细胞中释放的尺寸或组成。其可提前预测或根据经验确定。在特定实施方案,当宿主细胞与培养基分离时,在所述细胞团中存在至少70%、75%、80%、85%、90%、或95%的所述第二类异戊二烯。在某些实施方案,在与所述第二类异戊二烯共同生产期间,所述宿主细胞能够生成所述第一类异戊二烯,其量为由亲本细胞生成的所述第一类异戊二烯的量的至少约85%、90%、95%、96%、97%、98%、或99%,所述亲本细胞经遗传修饰以生成所述第一类异戊二烯但不生成所述第二类异戊二烯。在某些实施方案,在共同生成所述第一类异戊二烯和所述第二类异戊二烯期间,所述宿主细胞的细胞密度(或生物量产量)是亲本细胞的细胞密度的至少约85%、90%、95%、96%、98%、或99%,所述亲本细胞经遗传修饰以生成所述第一类异戊二烯但不生成所述第二类异戊二烯。在某些实施方案,所述宿主细胞进行遗传修饰,以生成两种类异戊二烯类化合物作为目标化合物,和所述宿主细胞不进行遗传修饰以生成不衍生自ipp的目标化合物。在某些实施方案,所述宿主细胞进行遗传修饰,以生成倍半萜和一种或多种c40类胡萝卜素类化合物,和所述宿主细胞不进行遗传修饰以生成不衍生自ipp的另一目标分子。在某些实施方案,所述宿主细胞进行遗传修饰,以生成c10、c15或c20类异戊二烯作为所述第一类异戊二烯和一种或多种c40类胡萝卜素类化合物作为第二类异戊二烯,和所述宿主细胞不进行遗传修饰以生成不衍生自ipp的另一目标分子。对衍生自ipp的类异戊二烯类化合物以外的目标分子进行遗传修饰,可将碳通量从ipp转移,因此,减少用于生成作为目标化合物的类异戊二烯类化合物的所述碳通量。在某些实施方案,所述宿主细胞进一步经遗传修饰以包含:(a)编码第一聚异戊二烯合酶的异源核酸和编码用于生成第一类异戊二烯的第一萜烯合酶的异源核酸;和(b)编码第二聚异戊二烯合酶的核酸和编码用于生成第二类异戊二烯的第二萜烯合酶的异源核酸。在某些实施方案,所述宿主细胞进一步经遗传修饰以包含:(a)编码fpp合酶和倍半萜合酶以生成倍半萜作为所述第一类异戊二烯的异源核酸;和(b)编码ggpp合酶和类胡萝卜素合酶以生成类胡萝卜素的异源核酸。在某些实施方案,对所述经遗传修饰的宿主细胞进行遗传修饰,以过表达甲羟戊酸途径的一种或多种酶。在某些实施方案,对所述经遗传修饰的宿主细胞进行遗传修饰,以过表达甲羟戊酸途径的所有酶。在某些实施方案,所述经遗传修饰的宿主细胞还包含编码用于生成聚异戊二烯基二磷酸的聚异戊二烯合酶的异源核酸。在某些实施方案,所述经遗传修饰的宿主细胞还包含编码fpp合酶的异源核酸。在某些实施方案,所述经遗传修饰的宿主细胞还包含编码ggpp合酶的异源核酸。在某些实施方案,所述经遗传修饰的宿主细胞还包含编码fpp合酶的异源核酸,并包含编码ggpp合酶的内源核酸,但不包含编码ggpp合酶的异源核酸。可将本发明所述的异源核酸的任何组合引入宿主细胞中,这取决于与第一类异戊二烯共同生成所需的类胡萝卜素。在某些实施方案,所述第二类异戊二烯是番茄红素,和所述宿主细胞包含编码八氢番茄红素合酶的异源核酸;和编码八氢番茄红素去饱和酶的异源核酸。在某些实施方案,所述第二类异戊二烯是β-胡萝卜素,和所述宿主细胞包含:(i)编码八氢番茄红素合酶的异源核酸;和(ii)编码番茄红素环化酶的异源核酸,或(iii)编码具有八氢番茄红素合酶活性和番茄红素环化酶活性的双功能酶的异源核酸;和编码八氢番茄红素去饱和酶的异源核酸。在某些实施方案,所述第二类异戊二烯是角黄素(cantaxanthin),和所述宿主细胞包含:(i)编码八氢番茄红素合酶的异源核酸;和(ii)编码番茄红素环化酶的异源核酸,或(iii)编码具有八氢番茄红素合酶活性和番茄红素环化酶活性的双功能酶的异源核酸;编码八氢番茄红素去饱和酶的异源核酸;和编码β-胡萝卜素酮化酶的异源核酸。在某些实施方案,所述第二类异戊二烯是玉米黄质,和所述宿主细胞包含:(i)编码八氢番茄红素合酶的异源核酸;和(ii)编码番茄红素环化酶的异源核酸,或(iii)编码具有八氢番茄红素合酶活性和番茄红素环化酶活性的双功能酶的异源核酸;和编码八氢番茄红素去饱和酶的异源核酸;和编码β-胡萝卜素羟化酶的异源核酸。在某些实施方案,所述第二类异戊二烯是虾青素,和所述宿主细胞包含:(i)编码八氢番茄红素合酶的异源核酸;和(ii)编码番茄红素环化酶的异源核酸,或(iii)编码具有八氢番茄红素合酶活性和番茄红素环化酶活性的双功能酶的异源核酸;编码八氢番茄红素去饱和酶的异源核酸;(i)编码β-胡萝卜素酮化酶的异源核酸;和(ii)编码β-胡萝卜素羟化酶的异源核酸,或(iii)编码细胞色素p450羟化酶和酮化酶的异源核酸,所述细胞色素p450羟化酶和酮化酶能够将β-胡萝卜素转化为海胆酮,然后转化为β-隐黄质,随后转化为虾青素;和(iv)编码细胞色素p450还原酶的异源核酸,所述细胞色素p450还原酶与所述细胞色素p450羟化酶和酮化酶相互作用。在某些实施方案,所述第二类异戊二烯是黄体素,和所述宿主细胞包含:编码番茄红素环化酶的异源核酸;编码δ-胡萝卜素β-环化酶的异源核酸;编码β-环羟化酶的异源核酸;和编码胡萝卜素ε-单加氧酶的异源核酸。5.4细胞株所述宿主细胞可以是技术人员认为有用的任何细胞。可用于本发明提供的组合物和方法的宿主细胞包括古细菌细胞、原核细胞或真核细胞。合适的原核宿主包括但不限于多种革兰氏阳性、革兰氏阴性或革兰氏变种细菌中的任一种。实例包括但不限于属于以下属的细胞:土壤杆菌属(agrobacterium),脂环酸芽孢杆菌(alicyclobacillus),鱼腥藻属(anabaena),蓝细菌属(anacystis),节杆菌属(arthrobacter),固氮菌属(azobacter),芽孢杆菌属(bacillus),短杆菌属(brevibacterium),红硫细菌属(chromatium),梭菌属(clostridium),棒状杆菌属(corynebacterium),肠杆菌属(enterobacter),欧文氏菌属(erwinia),埃希氏杆菌属(escherichia),乳杆菌属(lactobacillus),乳球菌属(lactococcus),中慢生根瘤菌属(mesorhizobium),甲基杆菌属(methylobacterium),细杆菌属(microbacterium),席藻属(phormidium),假单胞菌属(pseudomonas),红细菌属(rhodobacter),红假单胞菌属(rhodopseudomonas),红螺菌属(rhodospirillum),红球菌属(rhodococcus),沙门氏菌属(salmonella),栅藻属(scenedesmun),沙雷氏菌属(serratia),志贺氏菌属(shigella),葡萄球菌属(staphlococcus),链霉菌属(strepromyces),synnecoccus和发酵单胞菌属(zymomonas)。原核菌株的实例包括但不限于:枯草芽孢杆菌(bacillussubtilis),解淀粉芽孢杆菌(bacillusamyloliquefacines),产氨短杆菌(brevibacteriumammoniagenes),嗜氨短杆菌(brevibacteriumimmariophilum),拜氏梭菌(clostridiumbeigerinckii),阪崎肠杆菌(enterobactersakazakii),大肠杆菌(escherichiacoli),乳酸乳球菌(lactococcuslactis),百脉根根瘤菌(mesorhizobiumloti),绿脓假单胞菌(pseudomonasaeruginosa),迈氏假单胞菌(pseudomonasmevalonii),普迪卡假单胞菌(pseudomonaspudica),荚膜红细菌(rhodobactercapsulatus),类球红细菌(rhodobactersphaeroides),深红红螺菌(rhodospirillumrubrum),肠道沙门氏菌(salmonellaenterica),伤寒沙门氏菌(salmonellatyphi),鼠伤寒沙门氏菌(salmonellatyphimurium),痢疾志贺氏杆菌(shigelladysenteriae),福氏志贺菌(shigellaflexneri),宋内志贺菌(shigellasonne)和金黄色葡萄球菌(staphylococcusaureus)。在特定实施方案,所述宿主细胞是大肠杆菌(escherichiacoli)细胞。合适的古细菌宿主包括但不限于属于以下属的细胞:气火菌属(aeropyrum),古菌状菌属(archaeglobus),盐杆菌属(halobacterium),产甲烷球菌属(methanococcus),甲烷细菌属(methanobacterium),火球菌属(pyrococcus),硫化叶菌属(sulfolobus),和热原体属(thermoplasma)。古细菌菌株的实例包括但不限于:闪烁古生球菌(archaeoglobusfulgidus),盐杆菌属(halobacteriumsp.),詹氏甲烷球菌(methanococcusjannaschii),嗜热自养甲烷杆菌(methanobacteriumthermoautotrophicum),嗜酸热原体(thermoplasmaacidophilum),火山热原体(thermoplasmavolcanium),嗜热古菌(pyrococcushorikoshii),abyssi火球菌(pyrococcusabyssi),和敏捷气热菌(aeropyrumpernix)。合适的真核宿主包括但不限于真菌细胞、藻类细胞、昆虫细胞和植物细胞。在一些实施方案,可用于本发明方法的酵母包括已经与微生物保藏中心(例如,ifo、atcc等)一起保藏并属于以下属的酵母:芽孢酵母属(aciculoconidium),神食酵母属(ambrosiozyma),节束酵母属(arthroascus),arxiozyma,阿舒囊霉属(ashbya),babjevia,本森顿酵母属(bensingtonia),botryoascus,botryozyma,酒香酵母属(brettanomyces),布勒掷孢酵母属(bullera),布勒担孢酵母属(bulleromyces),念珠菌属(candida),固囊酵母属(citeromyces),棒孢酵母属(clavispora),隐球菌属(cryptococcus),cystofilobasidium,德巴利氏酵母属(debaryomyces),dekkara,dipodascopsis,双足囊菌属(dipodascus),eeniella,endomycopsella,eremascus,假囊酵母属(eremothecium),担孢酵母属(erythrobasidium),fellomyces,filobasidium,耐碱酵母属(galactomyces),地丝菌属(geotrichum),季氏酵母属(guilliermondella),孢汉逊酵母属(hanseniaspora),汉逊酵母属(hansenula),hasegawaea,胶珊瑚属(holtermannia),hormoascus,生丝毕赤酵母属(hyphopichia),伊萨酵母属(issatchenkia),克勒克酵母属(kloeckera),孢克勒克酵母属(kloeckeraspora),克鲁维酵母属(kluyveromyces),kondoa,kuraishia,克氏担孢酵母属(kurtzmanomyces),白冬孢酵母属(leucosporidium),油脂酵母属(lipomyces),娄德酵母属(lodderomyces),马拉色氏霉菌属(malassezia),梅奇酵母属(metschnikowia),木拉克酵母属(mrakia),myxozyma,拿逊酵母属(nadsonia),nakazawaea,针孢酵母属(nematospora),ogataea,卵孢酵母属(oosporidium),管囊酵母属(pachysolen),phachytichospora,巴西仙草(phaffia),毕赤酵母属(pichia),红冬孢酵母属(rhodosporidium),红酵母属(rhodotorula),酵母属(saccharomyces),类酵母属(saccharomycodes),覆膜孢酵母属(saccharomycopsis),saitoella,sakaguchia,saturnospora,裂芽酵母孢子菌属(schizoblastosporion),裂殖酵母属(schizosaccharomyces),许旺酵母属(schwanniomyces),锁掷酵母属(sporidiobolus),掷孢酵母属(sporobolomyces),原孢酵母属(sporopachydermia),冠孢酵母属(stephanoascus),梗孢酵母属(sterigmatomyces),sterigmatosporidium,symbiotaphrina,合轴酵母属(sympodiomyces),sympodiomycopsis,有孢圆酵母属(torulaspora),trichosporiella,毛孢子菌属(trichosporon),三角酵母属(trigonopsis),tsuchiyaea,udeniomyces,waltomyces,威克酵母属(wickerhamia),wickerhamiella,拟威尔酵母属(williopsis),yamadazyma,耶氏酵母属(yarrowia),接合囊酵母属(zygoascus),接合酵母属(zygosaccharomyces),接合拟威尔酵母属(zygowilliopsis),和zygozyma等等。在一些实施方案,所述宿主微生物是酿酒酵母(saccharomycescerevisiae),巴斯德毕赤酵母(pichiapastoris),粟酒裂殖酵母(schizosaccharomycespombe),布鲁赛尔德克酵母(dekkerabruxellensis),乳酸克鲁维酵母(kruyveromyceslactis,先前称为乳酸酵母(saccharomyceslactis)),马克斯克鲁维酵母(kluveromycesmarxianus),arxulaadeninivorans或多形汉逊酵母(hansenulapolymorpha)(现称为毕赤酵母(pichiaangusta))。在一些实施方案,所述宿主微生物是念珠菌属的菌株,例如解脂假丝酵母(candidalipolytica),吉利蒙假丝酵母(candidaguilliermondii),克鲁斯假丝酵母(candidakrusei),假热带假丝酵母(candidapseudotropicalis)或产朊假丝酵母(candidautilis)的菌株。在特定实施方案,所述宿主细胞是酿酒酵母(saccharomycescerevisiae)。在一些实施方案,所述宿主是酿酒酵母(saccharomycescerevisiae)的菌株,所述酿酒酵母是选自由贝克氏(baker’s)酵母、cbs7959、cbs7960、cbs7961、cbs7962、cbs7963、cbs7964、iz-1904、ta、bg-1、cr-1、sa-1、m-26、y-904、pe-2、pe-5、vr-1、br-1、br-2、me-2、vr-2、ma-3、ma-4、cat-1、cb-1、nr-1、bt-1、cen.pk、cen.pk2和al-1组成的组。在一些实施方案,所述宿主细胞是酿酒酵母(saccharomycescerevisiae)的菌株,所述酿酒酵母是选自由pe-2、cat-1、vr-1、bg-1、cr-1、和sa-1组成的组。在特定实施方案,所述酿酒酵母(saccharomycescerevisiae)的菌株是pe-2。在另一特定实施方案,所述酿酒酵母(saccharomycescerevisiae)的菌株是cat-1。在另一特定实施方案,所述酿酒酵母(saccharomycescerevisiae)的菌株是bg-1。在一些实施方案,所述宿主细胞是适于工业发酵的微生物。在特定实施方案,所述微生物被调节为在高溶剂浓度、高温、扩大的底物利用、营养限制、由糖和盐引起的渗透应力、酸度、亚硫酸盐和细菌污染、或其组合下存活,所述这些是公认的工业发酵环境的应力条件。5.5甲羟戊酸途径在一些实施方案,本发明提供的细胞包含甲羟戊酸(mev)途径的一种或多种酶。在一些实施方案,所述mev途径的一种或多种酶包含使乙酰-coa与丙二酰-coa缩合以形成乙酰乙酰-coa的酶。在一些实施方案,所述mev途径的一种或多种酶包含使两分子乙酰-coa缩合以形成乙酰乙酰-coa的酶。在一些实施方案,所述mev途径的一种或多种酶包含使乙酰乙酰-coa与乙酰-coa缩合以形成hmg-coa的酶。在一些实施方案,所述mev途径的一种或多种酶包含将hmg-coa转化为甲羟戊酸的酶。在一些实施方案,所述mev途径的一种或多种酶包含使甲羟戊酸磷酸化为甲羟戊酸5-磷酸的酶。在一些实施方案,所述mev途径的一种或多种酶包含将甲羟戊酸5-磷酸转化为甲羟戊酸5-焦磷酸的酶。在一些实施方案,所述mev途径的一种或多种酶包含将甲羟戊酸5-焦磷酸转化为异戊烯基焦磷酸的酶。在一些实施方案,所述mev途径的一种或多种酶选自由乙酰辅酶a硫解酶,乙酰乙酰辅酶a合成酶,hmg-coa合酶,hmg-coa还原酶,甲羟戊酸激酶,磷酸甲羟戊酸激酶和甲羟戊酸焦磷酸脱羧酶组成的组。在一些实施方案,关于能够催化形成乙酰乙酰-coa的mev途径的酶,所述经遗传修饰的宿主细胞包含使两分子乙酰-coa缩合以形成乙酰乙酰-coa的酶,例如乙酰-coa硫解酶;或者使乙酰-coa与丙二酰-coa缩合以形成乙酰乙酰-coa的酶,例如乙酰乙酰-coa合酶。在一些实施方案,所述经遗传修饰的宿主细胞包含使两分子乙酰-coa缩合以形成乙酰乙酰-coa的酶,例如乙酰-coa硫解酶;和使乙酰-coa与丙二酰-coa缩合以形成乙酰乙酰-coa的酶,例如乙酰乙酰-coa合酶。在一些实施方案,所述宿主细胞包含mev途径的一种以上酶。在一些实施方案,所述宿主细胞包含mev途径的两种酶。在一些实施方案,所述宿主细胞包含可将hmg-coa转化为甲羟戊酸的酶和可将甲羟戊酸转化为甲羟戊酸5-磷酸的酶。在一些实施方案,所述宿主细胞包含mev途径的三种酶。在一些实施方案,所述宿主细胞包含mev途径的四种酶。在一些实施方案,所述宿主细胞包含mev途径的五种酶。在一些实施方案,所述宿主细胞包含mev途径的六种酶。在一些实施方案,所述宿主细胞包含mev途径的七种酶。在一些实施方案,所述宿主细胞包含mev途径的所有酶。在一些实施方案,所述细胞还包含可将异戊烯基焦磷酸(ipp)转化为二甲基烯丙基焦磷酸(dmapp)的酶。在一些实施方案,所述细胞还包含可使ipp和/或dmapp分子缩合以形成聚异戊二烯基化合物的酶。在一些实施方案,所述细胞还包含可修饰ipp或聚异戊二烯基以形成类异戊二烯化合物的酶。5.5.1.将乙酰-coa转化为乙酰乙酰-coa在一些实施方案,所述经遗传修饰的宿主细胞包含能够使两分子乙酰辅酶a缩合以形成乙酰乙酰-coa的酶,例如乙酰-coa硫解酶。编码此种酶的核苷酸序列的示例性实例包括但不限于:(nc_000913region:2324131.2325315;大肠杆菌(escherichiacoli)),(d49362;脱氮副球菌(paracoccusdenitrificans)),和(l20428;酿酒酵母(saccharomycescerevisiae))。乙酰辅酶a硫解酶催化两分子乙酰辅酶a的可逆缩合以生成乙酰乙酰辅酶a,但此种反应在热力学上是不利的;乙酰乙酰-coa硫解作用优于乙酰乙酰-coa合成。乙酰乙酰辅酶a合酶(aacs)(或者称为乙酰辅酶a:丙二酰辅酶a酰基转移酶;ec2.3.1.194)使乙酰辅酶a与丙二酰辅酶a缩合以形成乙酰乙酰辅酶a。与乙酰辅酶a硫解酶相反,由于丙二酰辅酶a的相关脱羧,aacs催化的乙酰乙酰辅酶a合成基本上是能量有利的反应。此外,aacs对乙酰乙酰-coa未表现出硫解活性,因此所述反应是不可逆的。因此,在其他实施方案,本发明提供的经遗传修饰的宿主细胞利用乙酰乙酰-coa合酶由乙酰-coa和丙二酰-coa形成乙酰乙酰-coa。在一些实施方案,aacs来自链霉菌属(streptomycessp.)菌株cl190(okamuraetal.,procnatlacadsciusa107(25):11265-70(2010))。链霉菌属(streptomycessp.)菌株cl190的代表性aacs核苷酸序列包括登录号ab540131.1,以及美国专利公开号2014/0273144中的seqidno:19。链霉菌属(streptomycessp.)菌株cl190的代表性aacs蛋白质序列包括登录号d7urv0、baj10048,以及美国专利公开号2014/0273144中的seqidno:20。可用于本发明提供的组合物和方法的其他乙酰乙酰-coa合酶包括但不限于,链霉菌属(streptomycessp.)(ab183750;ko-3988bad86806);环圈链霉菌(s.anulatus)菌株9663(fn178498;cax48662);链霉菌属(streptomycessp.)ko-3988(ab212624;bae78983);游动放线菌属(actinoplanessp.)a40644(ab113568;bad07381);链霉菌属(streptomycessp.)c(nz_acew010000640;zp_05511702);达松维尔拟诺卡氏菌(nocardiopsisdassonvillei)dsm43111(nz_abui01000023;zp_04335288);溃疡分枝杆菌(mycobacteriumulcerans)agy99(nc_008611;yp_907152);海鱼分枝杆菌(mycobacteriummarinum)m(nc_010612;yp_001851502);链霉菌属(streptomycessp.)mg1(nz_ds570501;zp_05002626);链霉菌属(streptomycessp.)aa4(nz_acev01000037;zp_05478992);玫瑰孢链霉菌(s.roseosporus)nrrl15998(nz_abyb01000295;zp_04696763);链霉菌属(streptomycessp.)acte(nz_adfd01000030;zp_06275834);产绿色链霉菌(s.viridochromogenes)dsm40736(nz_acez01000031;zp_05529691);弗兰克氏菌属(frankiasp.)cci3(nc_007777;yp_480101);巴西诺卡菌(nocardiabrasiliensis)(nc_018681;yp_006812440.1);和austwickiachelonae(nz_bagz01000005;zp_10950493.1)。其他合适的乙酰乙酰-coa合酶包括美国专利申请公开号2010/0285549和2011/0281315中记载的那些,其内容通过引用其整体并入本发明。还可用于本发明提供的组合物和方法的乙酰乙酰-coa合酶包括那些被称为本发明所述的任何乙酰乙酰-coa合酶的“衍生物”的分子。此种“衍生物”具有以下特征:(1)其与本发明所述的任何乙酰乙酰-coa合酶具有基本同源性;和(2)能够催化乙酰-coa与丙二酰-coa的不可逆缩合反应以生成乙酰乙酰-coa。如果所述衍生物的氨基酸序列为至少80%,更优选至少90%,最优选至少95%与乙酰乙酰-coa合酶相同,则称乙酰乙酰-coa合酶的衍生物与乙酰乙酰-coa合酶具有“基本同源性”。5.5.2.将乙酰乙酰-coa转化为hmg-coa在一些实施方案,所述宿主细胞包含能够使乙酰乙酰-coa与另一分子的乙酰-coa缩合以形成3-羟基-3-甲基戊二酰-coa(hmg-coa)的酶,例如hmg-coa合酶。编码此种酶的核苷酸序列的示例性实例包括但不限于:(nc_001145.互补19061.20536;酿酒酵母(saccharomycescerevisiae)),(x96617;酿酒酵母(saccharomycescerevisiae)),(x83882;拟南芥(arabidopsisthaliana)),(ab037907;griseola北里孢菌(kitasatosporagriseola)),(bt007302;智人(homosapiens)),和(nc_002758,基因座标记sav2546,geneid1122571;金黄色葡萄球菌(staphylococcusaureus))。5.5.3.将hmg-coa转化为甲羟戊酸在一些实施方案,所述宿主细胞包含可将hmg-coa转化为甲羟戊酸的酶,例如hmg-coa还原酶。在一些实施方案,hmg-coa还原酶是使用nadph的羟甲基戊二酰-coa还原酶-coa还原酶。编码使用nadph的hmg-coa还原酶的核苷酸序列的示例性实例包括但不限于:(nm_206548;黑腹果蝇(drosophilamelanogaster)),(nc_002758,基因座标记sav2545,geneid1122570;金黄色葡萄球菌(staphylococcusaureus)),(ab015627;链霉菌属(streptomycessp.)ko3988),(ax128213,提供编码截短的hmg-coa还原酶的序列;酿酒酵母(saccharomycescerevisiae)),和(nc_001145:互补(115734.118898;酿酒酵母(saccharomycescerevisiae))。在一些实施方案,hmg-coa还原酶是使用nadh的羟甲基戊二酰-coa还原酶-coa还原酶。hmg-coa还原酶(ec1.1.1.34;ec1.1.1.88)催化(s)-hmg-coa还原脱酰为(r)-甲羟戊酸,并且可分为两类,i类hmgr和ii类hmgr。i类包括来自真核生物和大多数古细菌的酶,ii类包括某些原核生物和古细菌的hmg-coa还原酶。除了序列的差异外,两类酶在其辅因子特异性方面也不同。与仅利用nadph的i类酶不同,ii类hmg-coa还原酶在区分nadph和nadh的能力方面不同。参见例如,hedletal.,journalofbacteriology186(7):1927-1932(2004)。选择的ii类hmg-coa还原酶的辅因子特异性提供如下。表2.选择的ii类hmg-coa还原酶的辅因子特异性用于本发明提供的组合物和方法的有用的hmg-coa还原酶包括能够利用nadh作为辅因子的hmg-coa还原酶,例如来自迈氏假单胞菌(p.mevalonii)、闪烁古生球菌(a.fulgidus)或金黄色葡萄球菌(s.aureus)的hmg-coa还原酶。在特定实施方案,所述hmg-coa还原酶仅能够利用nadh作为辅因子,例如来自迈氏假单胞菌(p.mevalonii)、波美罗伊硅杆菌(s.pomeroyi)或食酸代尔夫特菌(d.acidovorans)的hmg-coa还原酶。在一些实施方案,使用nadh的hmg-coa还原酶来自迈氏假单胞菌(pseudomonasmevalonii)。先前已描述了编码hmg-coa还原酶(ec1.1.1.88)的迈氏假单胞菌(pseudomonasmevalonii)的野生型mvaa基因的序列。参见beachandrodwell,j.bacteriol.171:2994-3001(1989)。迈氏假单胞菌(pseudomonasmevalonii)的代表性mvaa核苷酸序列包括登录号m24015,以及美国专利公开号2014/0273144中的seqidno:21。迈氏假单胞菌(pseudomonasmevalonii)的代表性hmg-coa还原酶蛋白质序列包括登录号aaa25837、p13702、mvaa_psemv,以及美国专利公开号2014/0273144中的seqidno:22。在一些实施方案,使用nadh的hmg-coa还原酶来自波美罗伊硅杆菌(silicibacterpomeroyi)。波美罗伊硅杆菌(silicibacterpomeroyi)的代表性hmg-coa还原酶核苷酸序列包括登录号nc_006569.1,以及美国专利公开号2014/0273144中的seqidno:23。波美罗伊硅杆菌(silicibacterpomeroyi)的代表性hmg-coa还原酶蛋白质序列包括登录号yp_164994,以及美国专利公开号2014/0273144中的seqidno:24。在一些实施方案,使用nadh的hmg-coa还原酶来自食酸代尔夫特菌(delftiaacidovorans)。食酸代尔夫特菌(delftiaacidovorans)的代表性hmg-coa还原酶核苷酸序列包括nc_010002region:互补(319980.321269),以及美国专利公开号2014/0273144中的seqidno:25。食酸代尔夫特菌(delftiaacidovorans)的代表性hmg-coa还原酶蛋白质序列包括登录号yp_001561318,以及美国专利公开号2014/0273144中的seqidno:26。在一些实施方案,使用nadh的hmg-coa还原酶来自马铃薯(solanumtuberosum)(craneetal.,j.plantphysiol.159:1301-1307(2002))。还可用于本发明提供的组合物和方法的使用nadh的hmg-coa还原酶包括那些被称为本发明所述的任何使用nadh的hmg-coa还原酶的“衍生物”的分子,例如来自迈氏假单胞菌(p.mevalonii),波美罗伊硅杆菌(s.pomeroyi)和食酸代尔夫特菌(d.acidovorans)的使用nadh的hmg-coa还原酶。此种“衍生物”具有以下特征:(1)其与本发明所述的任何使用nadh的hmg-coa还原酶具有基本同源性;和(2)能够催化(s)-hmg-coa还原脱酰为(r)-甲羟戊酸,同时优先使用nadh作为辅因子。如果所述衍生物的氨基酸序列为至少80%,更优选至少90%,最优选至少95%与使用nadh的hmg-coa还原酶相同,则称使用nadh的hmg-coa还原酶的衍生物与使用nadh的hmg-coa还原酶具有“基本同源性”。本发明使用的短语“使用nadh”是指使用nadh的hmg-coa还原酶对nadh作为辅因子相对于nadph具有选择性,例如,通过证明对nadh的比活性高于对nadph的比活性。在一些实施方案,对作为辅因子的nadh的选择性表示为kcat(nadh)/kcat(nadph)比值。在一些实施方案,所述使用nadh的hmg-coa还原酶具有至少5、10、15、20、25、或大于25的kcat(nadh)/kcat(nadph)比值。在一些实施方案,所述使用nadh的hmg-coa还原酶仅使用nadh。例如,使用nadh的hmg-coa还原酶,其使用nadh仅显示一定活性,其中nadh作为体外唯一辅因子提供,并且当nadph作为唯一辅因子提供时不显示可检测的活性。可利用本领域已知的任何确定辅因子特异性的方法来鉴定优先选择nadh作为辅因子的hmg-coa还原酶,包括以下文献所描述的那些:kimetal.,proteinscience9:1226-1234(2000);和wildingetal.,j.bacteriol.182(18):5147-52(2000),各文献内容通过引用其整体并入本发明。在一些实施方案,所述使用nadh的hmg-coa还原酶被工程改造为对nadh的选择性超过napdh,例如,通过结合辅因子的口袋的定点诱变。用于工程改造nadh选择性的方法记载在watanabeetal.,microbiology153:3044-3054(2007)中,以及确定hmg-coa还原酶的辅因子特异性的方法记载在kimetal.,proteinsci.9:1226-1234(2000)中,各文献内容通过引用其整体并入本发明。在一些实施方案,所述使用nadh的hmg-coa还原酶衍生自天然包含甲羟戊酸降解途径的宿主物种,例如,使作为其唯一碳源的甲羟戊酸分解代谢的宿主物种。在所述这些实施方案,所述使用nadh的hmg-coa还原酶(其通常催化内化的(r)-甲羟戊酸在其天然宿主细胞内氧化酰化为(s)-hmg-coa),用于催化逆反应,即,在包含甲羟戊酸生物合成途径的经遗传修饰的宿主细胞中,将(s)-hmg-coa还原脱酰为(r)-甲羟戊酸。能够在作为其唯一碳源的甲羟戊酸上生长的原核生物已记载在以下文献中:andersonetal.,j.bacteriol,171(12):6468-6472(1989);beachetal.,j.bacteriol.171:2994-3001(1989);benschetal.,j.biol.chem.245:3755-3762;fimongnarietal.,biochemistry4:2086-2090(1965);siddiqietal.,biochem.biophys.res.commun.8:110-113(1962);siddiqietal.,j.bacteriol.93:207-214(1967);和takatsujietal.,biochem.biophys.res.commun.110:187-193(1983),各文献的内容通过引用其整体并入本发明。在本发明提供的组合物和方法的一些实施方案中,所述宿主细胞包含使用nadh的hmgr和使用nadph的hmg-coa还原酶。5.5.4.将甲羟戊酸转化为甲羟戊酸-5-磷酸在一些实施方案,所述宿主细胞包含可将甲羟戊酸转化为甲羟戊酸5-磷酸的酶,例如甲羟戊酸激酶。编码此种酶的核苷酸序列的示例性实例包括但不限于:(l77688;拟南芥(arabidopsisthaliana)),和(x55875;酿酒酵母(saccharomycescerevisiae))。5.5.5.将甲羟戊酸-5-磷酸转化为甲羟戊酸-5-焦磷酸在一些实施方案,所述宿主细胞包含可将甲羟戊酸5-磷酸转化为甲羟戊酸5-焦磷酸的酶,例如磷酸甲羟戊酸激酶。编码此种酶的核苷酸序列的示例性实例包括但不限于:(af429385;巴西橡胶树(heveabrasiliensis)),(nm_006556;智人(homosapiens)),和(nc_001145.互补712315.713670;酿酒酵母(saccharomycescerevisiae))。5.5.6.将甲羟戊酸-5-焦磷酸转化为ipp在一些实施方案,所述宿主细胞包含可将甲羟戊酸5-焦磷酸转化为异戊烯基二磷酸(ipp)的酶,例如甲羟戊酸焦磷酸脱羧酶。编码此种酶的核苷酸序列的示例性实例包括但不限于:(x97557;酿酒酵母(saccharomycescerevisiae)),(af290095;屎肠球菌(enterococcusfaecium)),和(u49260;智人(homosapiens))。5.5.7.将ipp转化为dmapp在一些实施方案,所述宿主细胞还包含能够将通过mev途径生成的ipp转化为二甲基烯丙基焦磷酸(dmapp)的酶,例如ipp异构酶。编码此种酶的核苷酸序列的示例性实例包括但不限于:(nc_000913,3031087.3031635;大肠杆菌(escherichiacoli)),和(af082326;雨生红球藻(haematococcuspluvialis))。5.5.8.聚异戊二烯合酶在一些实施方案,所述宿主细胞还包含聚异戊二烯合酶,其可使ipp和/或dmapp分子缩合以形成含有多于五个碳的聚异戊二烯基化合物。在一些实施方案,所述宿主细胞包含能够将一分子ipp与一分子dmapp缩合以形成一分子香叶基焦磷酸(“gpp”)的酶,例如gpp合酶。编码此种酶的核苷酸序列的示例性实例包括但不限于:(af513111;巨冷杉(abiesgrandis)),(af513112;巨冷杉(abiesgrandis)),(af513113;巨冷杉(abiesgrandis)),(ay534686;金鱼草(antirrhinummajus)),(ay534687;金鱼草(antirrhinummajus)),(y17376;拟南芥(arabidopsisthaliana)),(ae016877,基因座ap11092;蜡样芽孢杆菌(bacilluscereus);atcc14579),(aj243739;甜橙(citrussinensis)),(ay534745;仙女扇(clarkiabreweri)),(ay953508;齿小蠹(ipspini)),(dq286930;番茄(lycopersiconesculentum)),(af182828;胡椒薄荷(menthaxpiperita)),(af182827;胡椒薄荷(menthaxpiperita)),(mpi249453;胡椒薄荷(menthaxpiperita)),(pze431697,基因座cad24425;产玉米素副球菌(paracoccuszeaxanthinifaciens)),(ay866498;胡黄连(picrorhizakurrooa)),(ay351862;葡萄(vitisvinifera)),和(af203881,基因座aaf12843;运动发酵单胞菌(zymomonasmobilis))。在一些实施方案,所述宿主细胞包含能够使两分子ipp与一分子dmapp缩合,或将一分子ipp添加至一分子gpp中以形成一分子法呢基焦磷酸(“fpp”)的酶,例如,fpp合酶。编码此种酶的核苷酸序列的示例性实例包括但不限于:(atu80605;拟南芥(arabidopsisthaliana)),(athfps2r;拟南芥(arabidopsisthaliana)),(aau36376;黄花蒿(artemisiaannua)),(af461050;普通牛(bostaurus)),(d00694;大肠杆菌(escherichiacoli)k-12),(ae009951,基因座aal95523;具核梭杆菌具核亚种(fusobacteriumnucleatumsubsp.nucleatum)atcc25586),(gffppsgen;藤仓赤霉菌(gibberellafujikuroi)),(cp000009,基因座aaw60034;氧化葡糖杆菌(gluconobacteroxydans)621h),(af019892;向日葵(helianthusannuus)),(humfaps;智人(homosapiens)),(klpfpsqcr;乳酸克鲁维酵母(kluyveromyceslactis)),(lau15777;白羽扇豆(lupinusalbus)),(lau20771;白羽扇豆(lupinusalbus)),(af309508;小家鼠(musmusculus)),(ncfppsgen;粗糙脉孢菌(neurosporacrassa)),(pafps1;银胶菊(partheniumargentatum)),(pafps2;银胶菊(partheniumargentatum)),(ratfaps;褐家鼠(rattusnorvegicus)),(yscfpp;酿酒酵母(saccharomycescerevisiae)),(d89104;粟酒裂殖酵母(schizosaccharomycespombe)),(cp000003,基因座aat87386;酿脓链球菌(streptococcuspyogenes)),(cp000017,基因座aaz51849;酿脓链球菌(streptococcuspyogenes)),(nc_008022,基因座yp_598856;酿脓链球菌(streptococcuspyogenes)mgas10270),(nc_008023,基因座yp_600845;酿脓链球菌(streptococcuspyogenes)mgas2096),(nc_008024,基因座yp_602832;酿脓链球菌(streptococcuspyogenes)mgas10750),(mzefps;玉米(zeamays)),(ae000657,基因座aac06913;超嗜热菌(aquifexaeolicus)vf5),(nm_202836;拟南芥(arabidopsisthaliana)),(d84432,基因座baa12575;枯草芽孢杆菌(bacillussubtilis)),(u12678,基因座aac28894;慢生型大豆根瘤菌(bradyrhizobiumjaponicum)usda110),(bacfdps;嗜热脂肪土芽孢杆菌(geobacillusstearothermophilus)),(nc_002940,基因座np_873754;杜克雷嗜血杆菌(haemophilusducreyi)35000hp),(l42023,基因座aac23087;流感嗜血杆菌(haemophilusinfluenzae)rdkw20),(j05262;智人(homosapiens)),(yp_395294;沙克乳杆菌亚种.沙克(lactobacillussakeisubsp.sakei)23k),(nc_005823,基因座yp_000273;钩端螺旋体血清变型(leptospirainterrogansserovar)copenhagenistr.fiocruzl1-130),(ab003187;藤黄微球菌(micrococcusluteus)),(nc_002946,基因座yp_208768;淋病奈瑟氏菌(neisseriagonorrhoeae)fa1090),(u00090,基因座aab91752;根瘤菌属(rhizobiumsp.)ngr234),(j05091;酿酒酵母(saccharomycescerevisae)),(cp000031,基因座aav93568;波美罗伊硅杆菌(silicibacterpomeroyi)dss-3),(ae008481,基因座aak99890;肺炎链球菌(streptococcuspneumoniae)r6),和(nc_004556,基因座np779706;特曼库拉木质部难养菌(xylellafastidiosatemecula1))。在一些实施方案,所述宿主细胞还包含可使ipp和dmapp或ipp和fpp组合以形成香叶基香叶基焦磷酸(“ggpp”)的酶,也称为ggpp合酶(ec2.5.1.29)。编码此种酶的核苷酸序列的示例性实例包括但不限于:(athgerpyrs;拟南芥(arabidopsisthaliana)),(bt005328;拟南芥(arabidopsisthaliana)),(nm_119845;拟南芥(arabidopsisthaliana)),(nz_aajm01000380,基因座zp_00743052;以色列苏云金芽孢杆菌血清型(bacillusthuringiensisserovarisraelensis),atcc35646sq1563),(crggpps;长春花(catharanthusroseus)),(nz_aabf02000074,基因座zp_00144509;具核梭杆菌文氏亚种(fusobacteriumnucleatumsubsp.vincentii),atcc49256),(gfggppsgn;藤仓赤霉菌(gibberellafujikuroi)),(ay371321;银杏(ginkgobiloba)),(ab055496;巴西橡胶树(heveabrasiliensis)),(ab017971;智人(homosapiens)),(mci276129;卷枝毛霉拉斯坦变种(mucorcircinelloidesf.lusitanicus)),(ab016044;小家鼠(musmusculus)),(aabx01000298,基因座ncu01427;粗糙脉孢菌(neurosporacrassa)),(ncu20940;粗糙脉孢菌(neurosporacrassa)),(nz_aakl01000008,基因座zp_00943566;青枯雷尔氏菌(ralstoniasolanacearum)uw551),(ab118238;褐家鼠(rattusnorvegicus)),(scu31632;酿酒酵母(saccharomycescerevisiae)),(ab016095;细长聚球藻(synechococcuselongates)),(saggps;白芥子(sinapisalba)),(ssogds;嗜酸热硫化叶菌(sulfolobusacidocaldarius)),(nc_007759,基因座yp_461832;嗜酸互营菌属(syntrophusaciditrophicus)sb),(nc_006840,基因座yp_204095;费希尔氏弧菌(vibriofischeri)es114),(nm_112315;拟南芥(arabidopsisthaliana)),(erwcrte;成团泛菌(pantoeaagglomerans)),(d90087,基因座baa14124;菠萝泛菌(pantoeaananatis)),(x52291,基因座caa36538;荚膜红细菌(rhodobactercapsulatus)),(af195122,基因座aaf24294;类球红细菌(rhodobactersphaeroides)),(nc_004350,基因座np_721015;变形链球菌(streptococcusmutans)ua159),(np_015256;酿酒酵母(saccharomycescerevisiae));(afc92798;三孢布拉霉菌(blakesleatrispora)),(baa14124;菠萝泛菌(pantoeaananatis)),(aam21639;岩蔷薇(cistuscreticus));(aay33921;红发夫酵母(xanthophyllomycesdendrorhous)),(xp_019067954;番茄(solanumlycopersicum))。5.5.9.萜烯合酶在一些实施方案,所述宿主细胞还包含可修饰聚异戊二烯以形成半萜、单萜、倍半萜、二萜、三萜、四萜、多萜、类固醇化合物、类胡萝卜素、或经修饰的类异戊二烯化合物的酶。在一些实施方案,所述宿主细胞还包含蒈烯合酶。合适的核苷酸序列的示例性实例包括但不限于:(af461460,region(区域)43.1926;挪威云杉(piceaabies))和(af527416,region:78.1871;狭叶鼠尾草(salviastenophylla))。在一些实施方案,所述宿主细胞还包含香叶醇合酶。合适的核苷酸序列的示例性实例包括但不限于:(aj457070;细毛樟(cinnamomumtenuipilum)),(ay362553;罗勒(ocimumbasilicum)),(dq234300;白苏子(perillafrutescens)菌株1864),(dq234299;柠檬桉紫苏(perillacitriodora)菌株1861),(dq234298;柠檬桉紫苏(perillacitriodora)菌株4935),和(dq088667;柠檬桉紫苏(perillacitriodora))。在一些实施方案,所述宿主细胞还包含芳樟醇合酶。合适的核苷酸序列的示例性实例包括但不限于:(af497485;拟南芥(arabidopsisthaliana)),(ac002294,基因座aab71482;拟南芥(arabidopsisthaliana)),(ay059757;拟南芥(arabidopsisthaliana)),(nm_104793;拟南芥(arabidopsisthaliana)),(af154124;黄花蒿(artemisiaannua)),(af067603;仙女扇(clarkiabreweri)),(af067602;山字草属植物黄果厚壳桂(clarkiaconcinna)),(af067601;仙女扇(clarkiabreweri)),(u58314;仙女扇(clarkiabreweri)),(ay840091;番茄(lycopersiconesculentum)),(dq263741;狭叶薰衣草(lavandulaangustifolia)),(ay083653;薄荷柠檬酸(menthacitrate)),(ay693647;罗勒(ocimumbasilicum)),(xm_463918;稻(oryzasativa)),(ap004078,基因座bad07605;稻(oryzasativa)),(xm_463918,基因座xp_463918;稻(oryzasativa)),(ay917193;柠檬桉紫苏(perillacitriodora)),(af271259;白苏子(perillafrutescens)),(ay473623;挪威云杉(piceaabies)),(dq195274;北美云杉(piceasitchensis)),和(af444798;紫苏变种皱叶品种编号79(perillafrutescensvar.crispacultivarno.79))。在一些实施方案,所述宿主细胞还包含柠檬烯合酶。所述合适的核苷酸序列的示例性实例包括但不限于:(+)-柠檬烯合酶(af514287,region:47.1867;柠檬(citruslimon))和(ay055214,region:48.1889;藿香(agastacherugosa))以及(-)-柠檬烯合酶(dq195275,region:1.1905;北美云杉(piceasitchensis)),(af006193,region:73.1986;巨冷杉(abiesgrandis)),和(mhc4slsp,region:29.1828;留兰香(menthaspicata))。在一些实施方案,所述宿主细胞还包含月桂烯合酶。所述合适的核苷酸序列的示例性实例包括但不限于:(u87908;巨冷杉(abiesgrandis)),(ay195609;金鱼草(antirrhinummajus)),(ay195608;金鱼草(antirrhinummajus)),(nm_127982;拟南芥(arabidopsisthaliana)tps10),(nm_113485;拟南芥(arabidopsisthaliana)attps-cin),(nm_113483;拟南芥(arabidopsisthaliana)attps-cin),(af271259;白苏子(perillafrutescens)),(ay473626;挪威云杉(piceaabies)),(af369919;挪威云杉(piceaabies)),和(aj304839;冬青栎(quercusilex))。在一些实施方案,所述宿主细胞还包含罗勒烯合酶。合适的核苷酸序列的示例性实例包括但不限于:(ay195607;金鱼草(antirrhinummajus)),(ay195609;金鱼草(antirrhinummajus)),(ay195608;金鱼草(antirrhinummajus)),(ak221024;拟南芥(arabidopsisthaliana)),(nm_113485;拟南芥(arabidopsisthaliana)attps-cin),(nm_113483;拟南芥(arabidopsisthaliana)attps-cin),(nm_117775;拟南芥(arabidopsisthaliana)attps03),(nm_001036574;拟南芥(arabidopsisthaliana)attps03),(nm_127982;拟南芥(arabidopsisthaliana)tps10),(ab110642;温州蜜柑(citrusunshiu)citmtsl4),和(ay575970;日本百脉根(lotuscorniculatusvar.japonicus))。在一些实施方案,所述宿主细胞还包含α-蒎烯合酶。合适的核苷酸序列的示例性实例包括但不限于:(+)α-蒎烯合酶(af543530,region:1.1887;火炬松(pinustaeda)),(-)α-蒎烯合酶(af543527,region:32.1921;火炬松(pinustaeda)),和(+)/(-)α-蒎烯合酶(agu87909,region:6111892;巨冷杉(abiesgrandis))。在一些实施方案,所述宿主细胞还包含β-蒎烯合酶。合适的核苷酸序列的示例性实例包括但不限于:(-)β-蒎烯合酶(af276072,region:1.1749;黄花蒿(artemisiaannua))和(af514288,region:26.1834;柠檬(citruslimon))。在一些实施方案,所述宿主细胞还包含桧烯合酶。合适的核苷酸序列的示例性示例包括但不限于源自鼠尾草(salviaofficinalis)的af051901,region:26.1798。在一些实施方案,所述宿主细胞还包含γ-萜品烯合酶。合适的核苷酸序列的示例性实例包括:(源自柠檬(citruslimon)的af514286,region:30.1832)和(源自温州蜜柑(citrusunshiu)的ab110640,region1.1803)。在一些实施方案,所述宿主细胞还包含萜品油烯合酶。合适的核苷酸序列的示例性实例包括但不限于:(源自罗勒(oscimumbasilicum)的ay693650)和(源自花旗松(pseudotsugamenziesii)的ay906866,region:10.1887)。在一些实施方案,所述宿主细胞还包含紫穗槐二烯(amorphadiene)合酶。合适的核苷酸序列的示例性实例是美国专利公开号2004/0005678中的seqidno.37。在一些实施方案,所述宿主细胞还包含α-法呢烯合酶。合适的核苷酸序列的示例性实例包括但不限于源自西洋梨品种茹梨(pyruscommuniscultivard'anjou)(梨;基因名称afs1)的dq309034和源自苹果(malusdomestica)(苹果;基因afs1)的ay182241,参见pechouusetal.,planta219(1):84-94(2004)。在一些实施方案,所述宿主细胞还包含β-法呢烯合酶。合适的核苷酸序列的示例性实例包括但不限于源自胡椒薄荷(menthaxpiperita)的登录号af024615(薄荷;基因tspa11),和源自黄花蒿(artemisiaannua)的登录号ay835398,参见picaudetal.,phytochemistry66(9):961-967(2005)。在一些实施方案,所述宿主细胞还包含法呢醇合酶。合适的核苷酸序列的示例性实例包括但不限于源自玉米(zeamays)的登录号为af529266和源自酿酒酵母(saccharomycescerevisiae)(基因pho8)的登录号为ydr481c,参见song,l.,appliedbiochemistryandbiotechnology128:149-158(2006)。在一些实施方案,所述宿主细胞还包含橙花叔醇合酶。合适的核苷酸序列的示例性实例包括但不限于源自玉米(zeamays)(玉米,基因tps1)的af529266。在一些实施方案,所述宿主细胞还包含广藿香醇合酶。合适的核苷酸序列的示例性实例包括但不限于源自广藿香(pogostemoncablin)的ay508730region:1.1659。在一些实施方案,所述宿主细胞还包含诺卡酮(nootkatone)合酶。合适的核苷酸序列的示例性实例包括但不限于源自甜橙(citrussinensis)的af441124region:1.1647和源自白苏子(perillafrutescens)的ay917195region:1.1653。在一些实施方案,所述宿主细胞还包含松香二烯(abietadiene)合酶。合适的核苷酸序列的示例性实例包括但不限于:(u50768;巨冷杉(abiesgrandis))和(ay473621;挪威云杉(piceaabies))。在某些实施方案,所述宿主细胞生成c5、c10、c15或c20类异戊二烯作为第一类异戊二烯,和生成c30、c35、c40或更高碳数的类异戊二烯作为第二类异戊二烯。在某些实施方案。在一些实施方案,所述宿主细胞生成c5类异戊二烯。所述这些化合物衍生自一种异戊二烯单元,也称为半萜。半萜的示例性实例有异戊二烯。在其他实施方案,所述类异戊二烯是c10类异戊二烯。所述这些化合物衍生自两个异戊二烯单元,也被称为单萜。单萜的示例性实例有柠檬烯、香茅醇(citranellol)、香叶醇、薄荷醇、紫苏醇、芳樟醇、侧柏酮(thujone)和月桂烯。在其他实施方案,所述类异戊二烯是c15类异戊二烯。所述这些化合物衍生自三个异戊二烯单元,也被称为倍半萜。倍半萜的示例性实例有蜚蠊酮b、银杏苦内酯b、紫穗槐二烯、青蒿素、青蒿酸、瓦伦烯、诺卡酮、表-雪松醇、表-马兜铃烯、法呢醇、棉酚、sanonin、蜚蠊酮、毛喉素和广藿香醇(也被称为广藿香醇)。在其他实施方案,所述类异戊二烯是c20类异戊二烯。所述这些化合物衍生自四个异戊二烯单元,也被称为二萜。二萜的示例性实例有蓖麻烯、五加素、紫杉醇、prostratin、伪蕨素和紫杉二烯。在一些实施方案,所述类异戊二烯选自由以下组成的组:松香二烯(abietadiene)、紫穗槐二烯、蒈烯、α-法呢烯、β-法呢烯、法呢醇、香叶醇、香叶基香叶醇、异戊二烯、里哪醇、柠檬烯、月桂烯、橙花叔醇、罗勒烯、广藿香醇、β-蒎烯、桧烯、γ-萜品烯、萜品油烯和瓦伦烯。在其他实施例,所述类异戊二烯是c20+类异戊二烯。所述这些化合物衍生自四个以上的异戊二烯单元,包括:三萜类(由6个异戊二烯单元衍生的c30类异戊二烯类化合物),如arbrusidee、鸦胆丁、睾酮、黄体酮、可的松、洋地黄毒苷和角鲨烯;四萜类(衍生自8个类异戊二烯的c40类异戊二烯类化合物),如β-胡萝卜素;和多萜类(衍生自多于8个异戊二烯单元的c40+类异戊二烯化合物),如聚异戊二烯。类异戊二烯类化合物还包括但不限于类胡萝卜素类(如番茄红素、α-胡萝卜素和β-胡萝卜素、α-隐黄质和β-隐黄质(cryptoxanthin)、胭脂素、玉米黄质、虾青素和黄体素),类固醇类化合物,和由其他化学基团如混合萜类生物碱和辅酶q-10修饰的类异戊二烯类化合物组成的化合物类。5.6类胡萝卜素途径示例性类胡萝卜素生物合成途径示出在图2、3a和3b中。在某些实施方案,除了在生物合成途径中编码酶以生成第一类异戊二烯的一种或多种异源核酸外,所述宿主细胞还可包含编码类胡萝卜素生物合成途径的一种或多种酶的一种或多种异源核酸,以生成一种或多种类胡萝卜素类化合物。在某些实施方案,所述类胡萝卜素生物合成途径生成一种或多种c40类胡萝卜素类化合物。在一些实施方案,所述宿主细胞包含编码八氢番茄红素合酶的异源核酸,所述八氢番茄红素合酶可催化香叶基香叶基焦磷酸转化为八氢番茄红素。编码八氢番茄红素合酶的合适多肽序列或多核苷酸的示例性实例包括但不限于:crtb(紫色闪囊菌(lamprocystispurpurea);基因库蛋白质登录号(genbankproteinacc.):wp_020503292)(ec2.5.1.99或ec2.5.1.32)。在一些实施方案,所述宿主细胞包含编码番茄红素环化酶的异源核酸,所述番茄红素环化酶可催化番茄红素转化为β-胡萝卜素和/或催化链孢红素(neurosporene)转化为7,8-二氢-β-胡萝卜素。编码番茄红素环化酶的合适多肽序列或多核苷酸的示例性实例包括但不限于:crty(菠萝泛菌(pantoeaananatis);基因库蛋白质登录号(genbankproteinacc.):baa14126)(ec5.5.1.19)。在一些实施方案,所述宿主细胞包含编码双功能酶的异源核酸,所述双功能酶可催化香叶基香叶基焦磷酸转化为八氢番茄红素(八氢番茄红素合酶)和催化番茄红素转化为β-胡萝卜素(番茄红素环化酶)和/或催化链孢红素(neurosporene)转化为7,8-二氢-β-胡萝卜素。编码此种双功能酶的合适多肽序列或多核苷酸的示例性实例包括:crty/b(红发夫酵母(xanthophyllomycesdendrohous);verwaaletal.app.environ.733(13):4342-50(2007);crty/b(布拉克须霉(phycomycesblakesleeanus);基因库蛋白质登录号(genbankproteinacc.):xp_018294563),crty/b(粗糙脉孢菌(neurosporacrassa);基因库蛋白质登录号(genbankproteinacc.):xp_965725),和crty/b(三孢布拉霉菌(blakesleatrispora);基因库蛋白质登录号(genbankproteinacc.):aao46893)。在一些实施方案,所述宿主细胞包含编码八氢番茄红素去饱和酶的异源核酸,所述八氢番茄红素去饱和酶可催化八氢番茄红素转化为链孢红素(neurosporene)和/或催化链孢红素(neurosporene)转化为番茄红素。编码八氢番茄红素去饱和酶的合适多肽序列或多核苷酸的示例性实例包括但不限于:crti(红发夫酵母(xanthophyllomycesdendrohous);verwaaletal.app.environ.microbiol.73(130:4342-50,2007),crti(红发夫酵母(xanthophyllomycesdendrohous);基因库蛋白质登录号(genbankproteinacc.):caa75240),crti(古蒂分枝杆菌(mycobacteriumgoodie);基因库蛋白质登录号(genbankproteinacc.):wp_049747535),crti(粗糙脉孢菌(neurosporacrassa);基因库蛋白质登录号(genbankproteinacc.):xp_964713),crti(类芽孢杆菌属(paenibacillus_sp);基因库蛋白质登录号(genbankproteinacc.):wp_042140268),和crti(慢生根瘤菌属(bradyrhizobium_sp);基因库蛋白质登录号(genbankproteinacc.):wp_011924720)(ec1.3.99.31或ec1.3.5.5或ec1.3.5.6或ec1.3.99.28或ec1.3.99.30)。在一些实施方案,所述宿主细胞包含编码β-胡萝卜素酮化酶的异源核酸,所述β-胡萝卜素酮化酶可催化β-胡萝卜素转化为海胆酮,所述海胆酮转化为角黄素,所述β-隐黄质转化为3-羟基海胆酮/3'-羟基海胆酮,所述3-羟基海胆酮/3'-羟基海胆酮转化为芬尼黄质(phenicoxanthin),玉米黄质转化为金盏花黄质(adonixanthin),和/或金盏花黄质转化为虾青素。合适的多肽序列或多核苷酸的示例性实例包括但不限于:crtw(副球菌属(paracoccus_sp.);基因库蛋白质登录号(genbankproteinacc.):baa09591),crtw(短波单胞菌属(brevundimonassp);基因库蛋白质登录号(genbankproteinacc.):bad99406),crtw(湖泊红球藻(haematococcuslacustris);基因库蛋白质登录号(genbankproteinacc.):adn43075),crtw(莱茵衣藻(chlamydomonasreinhardtii);xp_001698699),crtw(鞘氨醇单胞菌属(sphingomonassp.)1pnm-20;基因库蛋白质登录号(genbankproteinacc.):wp_095996876);crtw(副球菌属(paracoccussp.)菌株n81106(土壤农杆菌(agrobacteriumaurantiacum))基因库id(genbankid):bae47465.1;uniprotcrtw_parsn;ukibeetal.,appl.environ.microbiol.75(22):7205-7211(2009));hpbkt(雨生红球藻(haematococcuspluvialis);genbankidd45881.1;baa08300.1)(ec1.14.11.b16或ec1.3.5.b4)。在一些实施方案,所述宿主细胞包含编码β-胡萝卜素羟化酶的异源核酸,所述β-胡萝卜素羟化酶可催化β-胡萝卜素转化为β-隐黄质,β-隐黄质转化为玉米黄质,海胆酮转化为3-羟基海胆酮/3'-羟基海胆酮,3-羟基海胆酮/3'-羟基海胆酮转化为金盏花黄质(adonixanthin),角黄素转化为芬尼黄质(phenicoxanthin),和/或芬尼黄质(phenicoxanthin)转化为虾青素。合适的多肽序列或多核苷酸的示例性实例包括但不限于:crtz(伤口埃希菌(escherichiavulneris);基因库蛋白质登录号(genbankproteinacc.):wp_042387980),crtz(菠萝泛菌(pantoeaananatis);基因库蛋白质登录号(genbankproteinacc.):wp_013027996),crtz(副球菌属(paracoccus_sp.);基因库蛋白质登录号(genbankproteinacc.):q44262),crtz(湖泊红球藻(haematococcuslacustris);基因库蛋白质登录号(genbankproteinacc.):akq20654);crtz(副球菌属(paracoccussp.)菌株n81106(土壤农杆菌(agrobacteriumaurantiacum))genbankidbae47466.1;crtz_parsn);crtz(菠萝泛菌(pantoeaananatis);genbankidadd79330.1;unitprod4gfl0_panam;ukibeetal.(2009);hpcrtz(雨生红球藻(haematococcuspluvialis);genbankkp866868.1;akq20654.1)(ec1.14.13.129)。在某些实施方案,所述宿主细胞包含编码细胞色素p450羟化酶的异源核酸,所述细胞色素p450羟化酶可催化β-胡萝卜素转化为海胆酮,海胆酮转化为3-羟基海胆酮/3'-羟基海胆酮,3-羟基海胆酮/3'-羟基海胆酮转化为芬尼黄质(phenicoxanthin),和/或芬尼黄质(phenicoxanthin)转化为虾青素。合适的多肽序列或多核苷酸的示例性实例包括但不限于:crts(红发夫酵母(xanthophyllomycesdendrohous);aay20974;uniprotq3hr17_pharh)。在某些实施方案,所述宿主细胞包含编码细胞色素-p450还原酶的异源核酸,所述细胞色素-p450还原酶可与宿主细胞中的细胞色素p450羟化酶(crts)相互作用,催化虾青素途径中的β-胡萝卜素转化为虾青素,如图3a所示。合适的多肽序列或多核苷酸的示例性实例包括但不限于:crtr(红发夫酵母(xanthophyllomycesdendrohous);aci43097);和(红发夫酵母(xanthophyllomycesdendrohous);genbankidaip94032.1;uniprota0a0c4mwf8_pharh)(ec1.6.2.4)。宿主细胞可包含编码本发明所述的类胡萝卜素途径的酶的异源核酸中的任一种或组合,以生成目标类胡萝卜素化合物。5.7增加乙酰辅酶a水平的修饰在某些实施方案,根据u.s.2004/0273144a1,生成来自乙酰-coa的化合物的任何上述细胞包含对其乙酰-coa途径的修饰。在某些实施方案,所述细胞包含磷酸转酮酶(pk;ec4.1.2.9)和将乙酰磷酸转化为乙酸的内源酶的功能性破坏。在某些实施方案,所述细胞包含磷酸转乙酰酶(pta;ec2.3.1.8);以及将乙酰磷酸转化为乙酸的内源酶的功能性破坏。在一些实施方案,将乙酰磷酸转化为乙酸的酶是甘油-1-磷酸酶(ec3.1.3.21)。在一些实施方案,所述甘油-1-磷酸酶选自由gpp1/rhr2、gpp2hor2、及其同源物和变体组成的组。在一些实施方案,所述宿主细胞包含gpp1/rhr2的功能性破坏。在一些实施方案,所述宿主细胞包含gpp2/hor2的功能性破坏。在一些实施方案,所述宿主细胞包含gpp1/rhr2和gpp2/hor2的功能性破坏。在一些实施方案,所述宿主细胞还包含酰化乙醛脱氢酶(ada;ec1.2.1.10)。在一些实施方案,宿主细胞还包含天然丙酮酸脱氢酶(pdh)旁路的一种或多种酶的功能性破坏。在一些实施方案,pdh旁路的一种或多种酶选自乙酰辅酶a合成酶1(acs1)、乙酰辅酶a合成酶2(acs2)和醛脱氢酶6(ald6)。5.8生成类异戊二烯类化合物的方法在某些实施方案,本发明提供了制备两种或两种以上类异戊二烯类化合物作为目标化合物的方法。所述方法包含:(a)在具有碳源的培养基中培养宿主细胞,所述宿主细胞用编码第一生物合成途径中的一种或多种酶的一种或多种异源核酸进行遗传修饰以生成第一类异戊二烯,和用编码第二生物合成途径中的一种或多种酶的一种或多种异源核酸进行遗传修饰以生成第二类异戊二烯,所述第二类异戊二烯分子量不同于所述第一类异戊二烯分子量;和(b)回收所述第一类异戊二烯,和(c)回收所述第二类异戊二烯。在某些实施方案,所述宿主细胞不进行遗传修饰以生成不衍生自ipp的目标化合物。在某些实施方案,通过在合适的培养条件下,在包含碳源的培养基中,培养所述经遗传修饰的宿主细胞一段时间来进行发酵,所述时间足以生成所述宿主细胞的所需生物量和/或类异戊二烯类化合物的所需量。在某些实施方案,所述发酵过程在两个阶段–构建阶段和生成阶段中进行。所述构建阶段进行一段时间,足以生成可在生成阶段期间支持目标类异戊二烯类化合物生成的细胞生物量。所述构建阶段进行一段时间,足以使接种时存在的细胞群经历多次倍增,直至达到所需的细胞密度。在一些实施方案,所述构建阶段进行一段时间,足以使宿主细胞群在其中进行所述构建阶段的发酵容器或发酵罐中达到约0.01和400之间的细胞密度(od600)。在一些实施方案,进行所述构建阶段直至达到至少0.01的od600。在一些实施方案,进行所述构建阶段直至达到至少0.1的od600。在一些实施方案,进行所述构建阶段直至达到至少1.0的od600。在一些实施方案,进行所述构建阶段直至达到至少10的od600。在一些实施方案,进行所述构建阶段直至达到至少100的od600。在一些实施方案,进行所述构建阶段直至达到0.01和100之间的od600。在一些实施方案,进行所述构建阶段直至达到0.1和10之间的od600。在一些实施方案,进行所述构建阶段直至达到1和100之间的od600。在其他实施方案,所述构建阶段进行至少12、24、36、48、60、72、84、96小时或96小时以上的时间。在一些实施方案,所述生成阶段进行一段时间,足以生成所需目标类异戊二烯类化合物的量。在一些实施方案,所述生成阶段进行至少12、24、36、48、60、72、84、96小时或96小时以上的时间。在一些实施方案,所述生成阶段进行3和20天之间的时间。在一些实施方案,所述生成阶段进行1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20天或20天以上的时间。在特定实施方案,生成目标类异戊二烯类化合物的方法包含在足以使所述经遗传修饰的宿主细胞生长和维持的需氧条件下进行所述经遗传修饰的宿主细胞的发酵;然后提供足以诱导目标类异戊二烯类化合物生成的微需氧发酵条件,并在整个发酵过程中维持微需氧条件。在某些实施方案,在整个发酵运行过程中使用所述微需氧条件。在某些实施方案,在整个发酵运行过程中使用需氧条件。在某些实施方案,所述宿主细胞生成升高水平的目标类异戊二烯类化合物可由诱导化合物诱导。在不存在所述诱导化合物的情况下,可容易地操作此种宿主细胞。然后加入所述诱导化合物以诱导宿主细胞生成升高水平的类异戊二烯。在其他实施方案,所述宿主细胞生成升高水平的类异戊二烯是通过改变培养条件(例如生长温度、培养基成分等)诱导。在某些实施方案,在所述生成阶段期间添加诱导剂以激活启动子或减轻与生物合成途径相关的转录调节因子的抑制以促进目标类异戊二烯类化合物的生成。在某些实施方案,在所述构建阶段期间添加诱导剂以抑制启动子或激活与生物合成途径相关的转录调节因子以抑制目标类异戊二烯类化合物的生成,并且在所述生成阶段期间除去诱导剂以激活启动子,减轻转录调节因子的抑制,从而促进目标类异戊二烯类化合物的生成。本发明使用的术语“遗传开关”是指使用启动子或其他遗传元件来控制类异戊二烯生成的生物合成途径的激活或去激活的用途。用于控制目标类异戊二烯生成的有用诱导剂或遗传开关的示例性实例记载在例如pct申请公开号wo2015/020649,wo2016/210343,和wo2016210350中,其各自通过引用其整体并入本发明。在另一实施方案,生成目标类异戊二烯类化合物的方法包含在分开的构建和生成培养基中培养宿主细胞。譬如,所述方法可包含在构建阶段培养所述经遗传修饰的宿主细胞,其中在非生成条件(例如,非诱导条件)下培养所述细胞以生成接种物,然后在适于诱导目标类异戊二烯生成(例如,诱导条件)的条件下将所述接种物转移至第二发酵培养基中,和在所述第二发酵阶段保持稳态条件以生成含有目标类异戊二烯类化合物的细胞培养物。如图4所示,所述两种或两种以上目标类异戊二烯类化合物可同时或依次生成。图4的实施方案1示出了在单次发酵运行中同时或同一时间共同生成目标类异戊二烯类化合物(例如,法呢烯和类胡萝卜素类化合物)。对于目标类异戊二烯类化合物的同时共同生成,在一些实施方案,所述目标类异戊二烯类化合物的生物合成途径是组成型活性的。在其他实施方案,为了同时共同生成目标类异戊二烯类化合物,所述目标类异戊二烯类化合物的生物合成途径受相同的遗传开关或诱导物控制。譬如,用于生成法呢烯和类胡萝卜素类化合物的生物合成途径可受pgal启动子控制,所述pgal启动子受gal调节子调节。被麦芽糖进一步抑制或诱导的gal调节子的实例记载在pct申请公开号wo2015/020649,wo2016/210343和wo2016210350中。在某些实施方案,可首先诱导生成第一类异戊二烯,然后在单次发酵运行中诱导生成第二类异戊二烯。图4的实施方案2示出了在接种后的两次发酵运行中依次生成类异戊二烯类化合物。在此实施方案中,所述第一类异戊二烯可在第一发酵运行过程中生成,和所述第二类异戊二烯可在第二发酵运行过程中生成。在一些实施方案,所述第一类异戊二烯可在第一发酵运行过程中生成,和所述第一类异戊二烯和所述第二类异戊二烯均可在第二发酵运行过程中生成。在某些实施方案,所述培养和回收包含:(a)培养包含宿主细胞的单一接种物以构建所述宿主细胞群;(b)在所述宿主细胞群中生成所述第一类异戊二烯的条件下,培养所述宿主细胞群,其中所述条件不激活所述第二类异戊二烯生成;(c)从所述宿主细胞群中分离和回收所述第一类异戊二烯;(d)在分离所述第一类异戊二烯后,在激活所述第二类异戊二烯生成的条件下,培养所述宿主细胞群或宿主细胞亚群;和回收所述第二类异戊二烯。在某些实施方案,所述第一类异戊二烯主要从所述宿主细胞释放到培养基中,和所述第二类异戊二烯主要保留在细胞级分中(例如,保留在细胞内)。在某些实施方案,所述第二类异戊二烯与所述宿主细胞一起回收。在一些实施方案,与不包含一种或多种修饰的亲本细胞相比,或者与仅包含所述经遗传修饰的宿主细胞的一种或多种修饰的子集但在遗传上是相同的亲本细胞相比,所述经遗传修饰的宿主细胞生成增加量的类异戊二烯。在一些实施方案,例如,以产量、生成量、生产率,以克每升细胞培养物、毫克每克干细胞重量,基于每单位体积细胞培养物,基于每单位干细胞重量,基于每单位时间的每单位体积细胞培养物,或基于每单位时间的每单位干细胞重量测定,所述增加的量为至少1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%或大于100%。在一些实施方案,所述宿主细胞生成升高水平的第一类异戊二烯,其大于约10克/升发酵培养基。在一些此类实施方案中,所述类异戊二烯的生成量为每升细胞培养物约10至约50克,大于约15克,大于约20克,大于约25克,或大于约30克。在一些实施方案,所述宿主细胞生成升高水平的第一类异戊二烯,其大于约50毫克/克干细胞重量。在一些此类实施方案中,所述类异戊二烯的生成量为每克干细胞重量约50至约1500毫克,大于约100毫克,大于约150毫克,大于约200毫克,大于约250毫克,大于约500毫克,大于约750毫克,或大于约1000毫克。在一些实施方案,所述宿主细胞生成升高水平的类异戊二烯,其相较由亲本细胞生成的类异戊二烯的水平高至少约10%,至少约15%,至少约20%,至少约25%,至少约30%,至少约35%,至少约40%,至少约45%,至少约50%,至少约60%,至少约70%,至少约80%,至少约90%,至少约2倍,至少约2.5倍,至少约5倍,至少约10倍,至少约20倍,至少约30倍,至少约40倍,至少约50倍,至少约75倍,至少约100倍,至少约200倍,至少约300倍,至少约400倍,至少约500倍,或至少约1,000倍或更多,基于每单位体积的细胞培养物。在一些实施方案,所述宿主细胞生成升高水平的类异戊二烯,其相较由亲本细胞生成的类异戊二烯的水平高至少约10%,至少约15%,至少约20%,至少约25%,至少约30%,至少约35%,至少约40%,至少约45%,至少约50%,至少约60%,至少约70%,至少约80%,至少约90%,至少约2倍,至少约2.5倍,至少约5倍,至少约10倍,至少约20倍,至少约30倍,至少约40倍,至少约50倍,至少约75倍,至少约100倍,至少约200倍,至少约300倍,至少约400倍,至少约500倍,或至少约1,000倍或更多,基于每单位干细胞重量。在一些实施方案,所述宿主细胞生成升高水平的类异戊二烯,其相较由亲本细胞生成的类异戊二烯的水平高至少约10%,至少约15%,至少约20%,至少约25%,至少约30%,至少约35%,至少约40%,至少约45%,至少约50%,至少约60%,至少约70%,至少约80%,至少约90%,至少约2倍,至少约2.5倍,至少约5倍,至少约10倍,至少约20倍,至少约30倍,至少约40倍,至少约50倍,至少约75倍,至少约100倍,至少约200倍,至少约300倍,至少约400倍,至少约500倍,或至少约1,000倍或更多,基于每单位时间的每单位体积的细胞培养物。在一些实施方案,所述宿主细胞生成升高水平的类异戊二烯,其相较由亲本细胞生成的类异戊二烯的水平高至少约10%,至少约15%,至少约20%,至少约25%,至少约30%,至少约35%,至少约40%,至少约45%,至少约50%,至少约60%,至少约70%,至少约80%,至少约90%,至少约2倍,至少约2.5倍,至少约5倍,至少约10倍,至少约20倍,至少约30倍,至少约40倍,至少约50倍,至少约75倍,至少约100倍,至少约200倍,至少约300倍,至少约400倍,至少约500倍,或至少约1,000倍或更多,基于每单位时间的每单位干细胞重量。在一些实施方案,与不生成所述第二类异戊二烯的亲本细胞相比,所述经遗传修饰的宿主细胞生成相当量的所述第一类异戊二烯。在一些实施方案,与亲本细胞的生成量相比,所述相当量为至少90%、95%、100%或大于100%,以产量、生成量、生产率,以克每升细胞培养物、毫克每克干细胞重量,基于每单位体积细胞培养物,基于每单位干细胞重量,基于每单位时间的每单位体积细胞培养物,或基于每单位时间的每单位干细胞重量测定。在一些实施方案,与不生成所述第一类异戊二烯的亲本细胞相比,所述经遗传修饰的宿主细胞生成相当量的所述第二类异戊二烯。在一些实施方案,与亲本细胞的生成量相比,所述相当量为至少90%、95%、100%或大于100%,以产量、生成量、生产率,以克每升细胞培养物、毫克每克干细胞重量,基于每单位体积细胞培养物,基于每单位干细胞重量,基于每单位时间的每单位体积细胞培养物,或基于每单位时间的每单位干细胞重量测定。5.9培养基和培养条件用于生物培养物的维持和生长的物料和方法是微生物学或发酵科学领域的技术人员所熟知的(参见例如baileyetal.,biochemicalengineeringfundamentals,secondedition,mcgrawhill,newyork,1986)。必须考虑适当的培养基、ph值、温度以及需氧、微需氧或厌氧条件的要求,这取决于宿主细胞、发酵和过程方法的特定要求。生成本发明提供的类异戊二烯类化合物的方法可在合适的培养基(添加或不添加泛酸盐)、在合适的容器(包括但不限于细胞培养板、烧瓶或发酵罐)中进行。此外,所述方法可以本领域已知的任何发酵规模进行,以支持微生物产品的工业生成。可使用任何合适的发酵罐,包括搅拌釜发酵罐、气升式发酵罐、泡沫发酵罐或其任何组合。在利用酿酒酵母作为宿主细胞的特定实施方案中,菌株可在发酵罐中生长,详细描述参见kosaric,etal,inullmann'sencyclopediaofindustrialchemistry,sixthedition,volume12,pages398-473,wiley-vchverlaggmbh&co.kdaa,weinheim,germany。在一些实施方案,所述培养基是任何培养基,其中能够生成类异戊二烯的经遗传修饰的微生物可以存活,即保持生长和活力。在一些实施方案,所述培养基是包含可同化的碳、氮和磷酸盐源的水性介质。此类介质还可包括适当的盐类、矿物质类、金属类和其他营养物类。在一些实施方案,将所述碳源和每种必需细胞营养物增量地或连续地添加到发酵培养基中,并将每种所需营养物保持在基本上通过使细胞生长,譬如,根据基于将碳源转化成生物量的细胞的代谢或呼吸功能的预定细胞生长曲线,有效同化所需的最低水平。用于培养微生物的合适的条件和合适的培养基在本领域是众所周知的。在一些实施方案,合适的培养基补充有一种或多种附加试剂,例如诱导物(例如,当编码基因产物的一个或多个核苷酸序列处于诱导型启动子控制下时),阻遏物(例如,当编码基因产物的一个或多个核苷酸序列处于阻抑型启动子控制下时),或选择剂(例如,选择包含遗传修饰的微生物的抗生素)。在一些实施方案,所述碳源是单糖(简单糖类)、二糖、多糖、不可发酵的碳源、或其一种或多种组合。合适的单糖的非限制性实例包括葡萄糖、半乳糖、甘露糖、果糖、木糖、核糖、和其组合。合适的二糖的非限制性实例包括蔗糖、乳糖、麦芽糖、海藻糖、纤维二糖、和其组合。合适的多糖的非限制性实例包括淀粉、糖原、纤维素、几丁质、和其组合。合适的不可发酵碳源的非限制性实例包括乙酸盐和甘油。培养基中的碳源(例如葡萄糖)的浓度应促进细胞生长,但不能高到抑制所用微生物的生长。通常,向培养物中添加一定水平的碳源(例如葡萄糖)以达到所需的生长水平和生物量水平,但达不到检测水平(检测限为约<0.1g/l)。在其他实施方案,培养基中的碳源(例如葡萄糖)的浓度大于约1g/l,优选大于约2g/l,更优选大于约5g/l。此外,培养基中的碳源(例如葡萄糖)的浓度通常小于约100g/l,优选小于约50g/l,更优选小于约20g/l。应注意的是,提及培养物组分浓度可以指初始和/或正在进行的组分浓度。在一些情况下,可能需要在培养期间使所述培养基耗尽碳源。可在合适的培养基中使用的可同化氮源包括但不限于简单氮源、有机氮源和复合氮源。此类氮源包括无水氨、铵盐、以及动物、植物和/或微生物来源的物质。合适的氮源包括但不限于蛋白水解产物类、微生物生物量水解产物类、蛋白胨、酵母提取物、硫酸铵、尿素和氨基酸类。通常,培养基中氮源的浓度大于约0.1g/l,优选大于约0.25g/l,更优选大于约1.0g/l。然而,超过一定浓度,向培养基中添加氮源对于微生物的生长是不利的。因此,培养基中氮源的浓度小于约20g/l,优选小于约10g/l,更优选小于约5g/l。此外,在某些情况下,可能需要在培养期间使培养基耗尽氮源。有效的培养基可含有其他化合物,如无机盐类、维生素类、痕量金属类或生长促进剂类。此类其他化合物也可存在于有效培养基中的碳源、氮源或矿物源中,或者可特定地加至培养基中。培养基还可含有合适的磷酸盐源。此类磷酸盐源包括无机和有机磷酸盐源。优选的磷酸盐源包括但不限于磷酸盐类如磷酸一钠或磷酸二钠和磷酸钾、磷酸铵及其混合物。通常,培养基中磷酸盐的浓度大于约1.0g/l,优选大于约2.0g/l,更优选大于约5.0g/l。然而,超过一定浓度,向培养基中添加磷酸盐对于微生物的生长是不利的。因此,培养基中磷酸盐的浓度通常小于约20g/l,优选小于约15g/l,更优选小于约10g/l。合适的培养基还可包括镁源,优选以生理学上可接受的盐形式,如七水合硫酸镁,尽管也可使用贡献相似量的镁的浓度的其他镁源。通常,培养基中镁的浓度大于约0.5g/l,优选大于约1.0g/l,更优选大于约2.0g/l。然而,超过一定浓度,向培养基中添加镁对于微生物的生长是不利的。因此,培养基中镁的浓度通常小于约10g/l,优选小于约5g/l,更优选小于约3g/l。此外,在某些情况下,可能需要在培养期间使培养基耗尽镁源。在一些实施方案,所述培养基还可包含生物学上可接受的螯合剂,例如柠檬酸三钠的二水合物。在此种情况下,培养基中螯合剂的浓度大于约0.2g/l,优选大于约0.5g/l,更优选大于约1g/l。然而,超过一定浓度,向培养基中添加螯合剂对于微生物的生长是不利的。因此,培养基中螯合剂的浓度通常小于约10g/l,优选小于约5g/l,更优选小于约2g/l。所述培养基最初还可包含生物学上可接受的酸或碱以维持培养基的所需ph值。生物学上可接受的酸包括但不限于盐酸、硫酸、硝酸、磷酸及其混合物。生物学上可接受的碱包括但不限于氢氧化铵、氢氧化钠、氢氧化钾及其混合物。在一些实施方案,所使用的碱是氢氧化铵。在一些实施方案,所述培养基还可包含生物学上可接受的钙源,包括但不限于氯化钙。通常,培养基中钙源(例如氯化钙二水合物)的浓度在约5mg/l至约2000mg/l的范围内,优选在约20mg/l至约1000mg/l的范围内,更优选在约50mg/l至约500mg/l的范围内。在一些实施方案,所述培养基还可包含氯化钠。通常,培养基中氯化钠的浓度在约0.1g/l至约5g/l的范围内,优选在约1g/l至约4g/l的范围内,更优选在约2g/l至约4g/l的范围内。在一些实施方案,所述培养基还可包含痕量金属。此类痕量金属可作为储备溶液加至培养基中,为了方便起见,可与其余培养基分开制备。通常,添加至培养基中的此种痕量金属溶液的量大于约1ml/l,优选大于约5ml/l,更优选大于约10ml/l。然而,超过一定浓度,向培养基中添加痕量金属对于微生物的生长是不利的。因此,添加至培养基中的此种痕量金属溶液的量通常小于约100ml/l,优选小于约50ml/l,更优选小于约30ml/l。应注意的是,除了在储备溶液中添加痕量金属之外,各个组分可单独添加,范围内的每个组分独立于上述范围的痕量金属溶液所规定的组分的量。所述培养基可包括其他维生素,如泛酸、生物素、钙、泛酸盐、肌醇、吡哆醇-hcl和硫胺素-hcl。可将此类维生素作为储备溶液加至培养基中,为了方便起见,其可与其余培养基分开制备。然而,向培养基中添加维生素超过一定浓度对于微生物的生长是不利的。本发明所述的发酵方法可以常规培养模式进行,所述培养模式包括但不限于分批、补料分批、细胞再循环、连续和半连续。在一些实施方案,所述发酵以补料分批模式进行。在此种情况下,在发酵的生成阶段期间培养基中的一些组分被耗尽。在一些实施方案,所述培养物可在开始时例如在生成阶段,补充相对高浓度的此种组分,使得生长和/或类异戊二烯生成在需要添加之前支持一段时间。所述这些组分的优选范围在整个培养过程中通过进行添加来维持,因为组分水平通过培养耗尽。所述培养基中组分的水平可通过例如定期取样培养基并测定浓度来进行监测。或者,一旦开发了标准培养程序,可在整个培养的特定时间以对应于已知水平的时间间隔进行添加。如本领域技术人员将认识到的,随着培养基的细胞密度增加,培养期间营养物的消耗速率增加。此外,为了避免将外来微生物引入培养基中,如本领域已知的那样,使用无菌添加方法进行添加。此外,在培养过程中可加入少量的消泡剂。培养基的温度可以是适于经遗传修饰的细胞生长和/或类异戊二烯生成的任何温度。譬如,在用接种物接种培养基之前,可使培养基保持在约20℃至约45℃的温度范围内,优选保持在约25℃至约40℃的温度范围内,更优选保持在约28℃至约32℃的温度范围内。培养基的ph值可通过向培养基中加入酸或碱来控制。在使用氨来控制ph值的情况下,其在培养基中也可方便地作为氮源。优选地,将ph值保持在约3.0至约8.0,更优选保持在约3.5至约7.0,最优选保持在约4.0至约6.5。在一些实施方案,在培养期间监测培养基的碳源浓度,例如葡萄糖浓度。培养基的葡萄糖浓度可使用已知技术来监测,譬如,使用葡萄糖氧化酶试验或高压液相色谱法,其可用于监测上层清液中的葡萄糖浓度,例如培养基的无细胞组分。如前所述,所述碳源浓度应保持在发生细胞生长抑制的水平以下。尽管此浓度可能会因生物体而异,但对于作为碳源的葡萄糖,在葡萄糖浓度大于约60g/l时可能发生细胞生长抑制,并且可通过试验容易地确定。因此,当使用葡萄糖作为碳源时,优选将葡萄糖送入发酵罐并维持在检测限以下。或者,培养基中的葡萄糖浓度维持在约1g/l至约100g/l的范围内,优选在约2g/l至约50g/l的范围内,更优选在约5g/l至约20g/l的范围内。尽管通过添加例如基本上纯的葡萄糖溶液可将碳源浓度保持在所需水平内,但通过添加等份的原始培养基来维持培养基的碳源浓度是可接受的,并且可以是优选的。原始培养基的等分试样的使用可能是合乎需要的,因为培养基中其他营养物(例如,氮源和磷源)的浓度可同时保持。同样,痕量金属浓度可通过加入等份的痕量金属溶液而保持在培养基中。5.10回收类异戊二烯类化合物一旦类异戊二烯由宿主细胞生成,可使用本领域已知的任何合适的分离和纯化方法将其回收或分离用于随后的应用。在一些实施方案,包含类异戊二烯的有机相可通过离心从发酵液中分离。在其他实施方案,包含类异戊二烯的有机相可自发地从发酵液中分离。在其他实施方案,通过向发酵反应中加入破乳剂和/或成核剂,将包含类异戊二烯的有机相从发酵液中分离出来。破乳剂的示例性实例包括絮凝剂和凝结剂。成核剂的示例性实例包括类异戊二烯本身的液滴和有机溶剂如十二烷、肉豆蔻酸异丙酯和油酸甲酯。在所述这些细胞中生成的类异戊二烯可存在于培养上层清液中和/或与宿主细胞结合。在所述类异戊二烯与宿主细胞结合的实施方案中,所述类异戊二烯的回收可包括透化或裂解细胞的方法。另外或同时,培养基中的类异戊二烯可使用包括但不限于色谱法、提取法、溶剂提取法、膜分离法、电渗析法、反渗透法、蒸馏法、化学衍生法和结晶法的回收方法进行回收。在一些实施方案,所述类异戊二烯可与可能存在于有机相中的其他产物进行分离。在一些实施方案,使用吸附法、蒸馏法、气-液萃取法(汽提)、液-液萃取法(溶剂萃取)、超滤法和标准色谱技术来实现分离。在一些实施方案,在这些细胞中生成的所述第一类异戊二烯可存在于培养上清液中,和在这些细胞中生成的所述第二类异戊二烯可与宿主细胞结合。在这些实施方案中,由于两种类异戊二烯产物处于不同的相,因此可更容易分离和回收此两种类异戊二烯产物。用于分离和回收所述第二类异戊二烯(例如类胡萝卜素类化合物)的方法,在以下实施例章节中进行描述。制备经遗传修饰的细胞的方法本发明还提供了用于生成宿主细胞的方法,所述宿主细胞经遗传工程改造以包含一种或多种上述修饰,例如,编码生物合成途径酶的一种或多种异源核酸,所述酶诸如用于共同生成类异戊二烯类化合物。异源酶在宿主细胞中的表达可在允许在宿主细胞中表达的调节元件的控制下,通过在宿主细胞中引入包含编码酶的核苷酸序列的核酸来实现。在一些实施方案,所述核酸是染色体外质粒。在其他实施方案,所述核酸是染色体整合载体,其可将核苷酸序列整合到宿主细胞的染色体中。可通过本领域技术人员已知的任何方法将编码这些蛋白质的核酸引入宿主细胞而无任何限制(参见例如,hinnenetal.(1978)proc.natl.acad.sci.usa75:1292-3;creggetal.(1985)mol.cell.biol.5:3376-3385;goeddeletal.eds,1990,methodsinenzymology,vol.185,academicpress,inc.,ca;krieger,1990,genetransferandexpression--alaboratorymanual,stocktonpress,ny;sambrooketal.,1989,molecularcloning--alaboratorymanual,coldspringharborlaboratory,ny;和ausubeletal.,eds.,currentedition,currentprotocolsinmolecularbiology,greenepublishingassociatesandwileyinterscience,ny)。示例性技术包括但不限于原生质球、电穿孔、peg1000介导的转化、以及乙酸锂或氯化锂介导的转化。可通过修饰编码所述酶的基因的转录来改变宿主细胞中酶的拷贝数。其可通过例如以下方式来实现:修改编码酶的核苷酸序列的拷贝数(例如,通过使用包含核苷酸序列的更高或更低拷贝数的表达载体,或通过将另外的核苷酸序列拷贝引入宿主细胞的基因组中,或通过删除或破坏宿主细胞基因组中的核苷酸序列),通过改变操纵子的多顺反子mrna上的编码序列的顺序或将操纵子分解成各自具有其自身控制元件的单个基因,或通过增加与核苷酸序列可操作连接的启动子或操纵子的强度。或者或另外,可通过改变编码酶的mrna的翻译水平来改变宿主细胞中酶的拷贝数。其可通过例如以下方式来实现:修饰mrna的稳定性,修饰核糖体结合位点的序列,修饰核糖体结合位点和酶编码序列的起始密码子之间的距离或序列,修饰位于酶编码区起始密码子“上游”或邻近5'侧的整个顺反子间区,使用发夹和特化序列稳定mrna转录物的3'末端,修饰酶的密码子使用,改变用于酶的生物合成的稀有密码子trna的表达,和/或增加酶的稳定性例如通过其编码序列的突变。宿主细胞中酶的活性可以多种方式改变,包括但不限于,表达在宿主细胞中表现出增加或降低的溶解度的酶的修饰形式,表达所述酶的改变形式,其缺乏通过其抑制酶活性的结构域,表达所述酶的修饰形式,其对于底物具有更高或更低kcat或更低或更高km,或表达所述酶的改变形式,其或多或少受到所述途径中另一分子的反馈或前馈调节的影响。在一些实施方案,用于遗传修饰宿主细胞的核酸包含一种或多种选择标记,其可用于选择经转化的宿主细胞和对所述宿主细胞施加选择压力以维持外源dna。在一些实施方案,所述选择标记是抗生素抗性标记。抗生素抗性标记的示例性实例包括但不限于bla、nat1、pat、aur1-c、pdr4、smr1、cat、小鼠dhfr、hph、dsda、kanr、和shble基因产物。来自大肠杆菌(e.coli)的bla基因产物赋予对β-内酰胺抗生素(例如,窄谱头孢菌素类、头孢霉素类和碳青霉烯类(厄他培南)、头孢孟多和头孢哌酮)的抗性以及除了替莫西林(temocillin)之外的所有抗革兰氏阴性细菌青霉素类的抗性;来自诺尔斯氏链霉菌(s.noursei)的nat1基因产物赋予对诺尔丝菌素的抗性;来自产绿色链霉菌(s.viridochromogenes)tu94的pat基因产物赋予对双膦的抗性;来自酿酒酵母(saccharomycescerevisiae)的aur1-c基因产物赋予对auerobasidina(aba)的抗性;pdr4基因产物赋予对浅蓝菌素的抗性;smr1基因产物赋予对甲嘧磺隆的抗性;来自tn9转座子的cat基因产物赋予对氯霉素的抗性;小鼠dhfr基因产物赋予对甲氨蝶呤的抗性;肺炎克雷伯氏菌(klebsiellapneumonia)的hph基因产物赋予对潮霉素b的抗性;大肠杆菌的dsda基因产物使得细胞在d-丝氨酸作为唯一氮源的平板上生长;tn903转座子的kanr基因赋予对g418的抗性;和来自印度斯坦链异壁菌(streptoalloteichushindustanus)的shble基因产物赋予对zeocin(博来霉素)的抗性。在一些实施方案,在分离本发明公开的经遗传修饰的宿主细胞后,删除所述抗生素抗性标记。在一些实施方案,所述选择标记拯救经遗传修饰的微生物中的营养缺陷型(例如营养的营养缺陷型)。在此类实施方案中,亲本微生物包含在氨基酸或核苷酸生物合成途径中起作用的一种或多种基因产物中的功能性破坏,并且当非功能性使得亲本细胞不能在培养基中生长而不补充一种或多种营养素时。此类基因产物包括但不限于酵母中的his3、leu2、lys1、lys2、met15、trp1、ade2和ura3基因产物。然后可通过用编码所述破坏的基因产物的功能性拷贝的表达载体或染色体整合构建体转化亲本细胞来拯救营养缺陷型表型,并且可基于亲本细胞的营养缺陷表型的丧失来选择生成的经遗传修饰的宿主细胞。利用ura3、trp1和lys2基因作为选择标记具有显著优势,因为正选择和负选择均是可能的。通过ura3、trp1和lys2突变的营养缺陷互补进行正选择,而负选择是基于特异性抑制剂,即5-氟-乳清酸(foa)、5-氟邻氨基苯甲酸和氨基己二酸(aaa),分别防止原养型菌株生长,但分别使得ura3、trp1和lys2突变体生长。在其他实施方案,所述选择标记拯救可通过已知选择方法鉴定的其他非致死缺陷或表型。本发明描述了可用于本发明方法、组合物和生物体的特定基因和蛋白质;然而,人们将认识到对此类基因的绝对同一性是不必要的。譬如,可进行包含编码多肽或酶的序列的特定基因或多核苷酸的变化并筛选活性。通常,此类变化包括保守突变和沉默突变。可使用本领域已知的方法筛选此种经修饰或突变的多核苷酸和多肽以表达功能性酶。由于遗传密码的固有简并性,编码基本上相同或功能等同的多肽的其他多核苷酸也可用于克隆和表达编码此类酶的多核苷酸。如本领域技术人员所理解的,修饰编码序列以增强其在特定宿主中的表达可能是有利的。所述遗传密码是64个可能密码子的冗余,但大多生物体通常使用所述这些密码子的子集。在物种中最常使用的密码子称为最佳密码子,而那些不常使用的密码子被归类为罕见或低使用密码子。在有时被称为“密码子优化”或“控制物种密码子偏误”的过程中,可置换密码子以反映宿主的优选密码子使用。可制备含有由特定原核或真核宿主(murrayetal.,1989,nuclacidsres.17:477-508)优选的密码子的优化编码序列,譬如,以提高翻译速率或生成具有所需特性的重组rna转录物,与由非优化序列生成的转录物相比,所述重组rna转录物具有所需的性质,例如更长的半衰期。翻译终止密码子也可进行修饰以反映宿主的偏好。譬如,酿酒酵母和哺乳动物的典型终止密码子分别是uaa和uga。单子叶植物类的典型终止密码子是uga,而昆虫和大肠杆菌通常使用uaa作为终止密码子(dalphinetal.,1996,nuclacidsres.24:216-8)。本领域技术人员将认识到,由于遗传密码的简并性质,可使用其核苷酸序列不同的多种dna分子来编码本发明的给定酶。编码上述生物合成酶的天然dna序列在本发明中仅用于说明本发明的实施方案,并且本发明包括编码本发明方法中所用酶的多肽和蛋白质的氨基酸序列的任何序列的dna分子。以类似的方式,多肽通常可在其氨基酸序列中耐受一个或多个氨基酸置换、缺失和插入,而不丧失或显著丧失所需活性。本发明包括具有与本发明所述特定蛋白质不同的氨基酸序列的此类多肽,只要所述经修饰的多肽或变体多肽具有参考多肽的酶促合成代谢或分解代谢活性即可。此外,由本发明所示的dna序列编码的氨基酸序列仅说明了本发明的实施方案。此外,本发明涵盖可用于本发明提供的组合物和方法的酶的同源物。在一些实施方案,当氨基酸序列具有至少约30%、40%、50%、60%、65%、70%、75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、或99%同一性时,此两种蛋白质(或蛋白质的区域)基本上是同源的。为了确定两个氨基酸序列或两个核酸序列的百分比同一性,对序列进行比对以达到最佳比较目的(例如,可在第一和第二氨基酸或核酸序列中的一个或两个中引入空位用于最佳比对,并且可忽略非同源序列用于比较目的)。在其中一个实施方案,为比较目的而比对的参考序列的长度为所述参考序列长度的至少30%,通常至少40%,更通常至少50%,甚至更通常至少60%,甚至更通常至少70%、80%、90%、100%。然后比较相应氨基酸位置或核苷酸位置的氨基酸残基或核苷酸。当第一序列中的位置被与第二序列中相应位置相同的氨基酸残基或核苷酸占据时,那么所述分子在此位置是相同的(如本发明所用,氨基酸或核酸“同一性”等同于氨基酸或核酸“同源性”)。此两个序列之间的同一性百分比是序列共有的相同位置的数量的函数,考虑到空位的数量和每个空位的长度,需引入此这两个序列的最佳比对。当“同源/同源性”用于提及蛋白质或肽时,将认识到不相同的残基位置通常因保守氨基酸置换而不同。“保守氨基酸置换”是其中氨基酸残基被具有相似化学性质(例如,电荷或疏水性)的侧链(r基团)的另一氨基酸残基置换的情况。通常,保守氨基酸置换不会实质上改变蛋白的功能特性。在两个或两个以上氨基酸序列由于保守置换而彼此不同的情况下,可以向上调整百分比序列同一性或同源性程度以校正所述置换的保守性质。进行此类调整的手段是本领域技术人员所熟知的(参见如pearsonw.r.,1994,methodsinmol.biol25:365-89)。以下六组各自含有彼此保守置换的氨基酸:1)丝氨酸(s),苏氨酸(t);2)天冬氨酸(d),谷氨酸(e);3)天冬酰胺(n),谷氨酰胺(q);4)精氨酸(r),赖氨酸(k);5)异亮氨酸(i),亮氨酸(l),丙氨酸(a),缬氨酸(v);和6)苯丙氨酸(f),酪氨酸(y),色氨酸(w)。通常使用序列分析软件测定多肽的序列同源性,其也称为序列同一性百分比。用于将分子序列与含有来自不同生物体的大量序列的数据库进行比较的典型算法是计算机程序blast。当搜索含有来自大量不同生物体的序列的数据库时,通常比较氨基酸序列。此外,编码前述酶(或本发明提及的任何其他酶(或任何控制或调节其表达的调节元件))的任何基因可通过遗传/蛋白质工程技术(例如定向进化或理性诱变,其均是本领域普通技术人员已知的)进行优化。此种作用使本领域普通技术人员能够优化所述酶在酵母中的表达和活性。此外,编码所述这些酶的基因可从其他真菌和细菌物种中鉴定,并可表达用于此途径的调节。多种生物体可作为所述这些酶的来源,包括但不限于,酵母菌属(saccharomycesspp.),包括酿酒酵母(s.cerevisiae)和葡萄汁酵母(s.uvarum),克鲁维酵母菌属(kluyveromycesspp.)包括耐热克鲁维酵母(k.thermotolerans)、乳酸克鲁维酵母(k.lactis)和马克斯克鲁维酵母(k.marxianus),毕赤酵母属(pichiaspp.),汉逊酵母属(hansenulaspp.)包括多型汉逊酵母(h.polymorpha),假丝酵母属(candidaspp.),丝孢酵母属(trichosporonspp.),yamadazymaspp.包括y.spp.stipitis、pretoriensis有孢圆酵母(torulasporapretoriensis)、东方伊萨酵母(issatchenkiaorientalis),裂殖酵母属(schizosaccharomycesspp.)包括粟酒裂殖酵母(s.pombe),隐球酵母属(cryptococcusspp.),曲霉菌属(aspergillusspp.),脉孢菌属(neurosporaspp.),或黑粉菌属(ustilagospp.)。来自厌氧真菌的基因来源包括但不限于,瘤胃壶菌属(piromycesspp.),根囊鞭菌属(orpinomycesspp.),或新美鞭菌属(neocallimastixspp.)。有用的原核生物酶的来源包括但不限于,大肠杆菌(escherichiacoli),运动发酵单胞菌(zymomonasmobilis),金黄色酿脓葡萄球菌(staphylococcusaureus),芽孢杆菌属(bacillusspp.),梭菌属(clostridiumspp.),棒状杆菌属(corynebacteriumspp.),假单胞菌属(pseudomonasspp.),乳球菌属(lactococcusspp.),肠杆菌属(enterobacterspp.),沙门氏菌属(salmonellaspp.)或红发夫酵母(x.dendrorhous)。本领域技术人员已知的技术可适于鉴定其他同源基因和同源酶。通常,类似基因和/或类似酶可通过功能分析来鉴定,并具有功能相似性。本领域技术人员已知的技术可适用于鉴定类似基因和类似酶。譬如,为了鉴定同源或类似的pk、pta、rhr2、hor2或类胡萝卜素基因(carotenogicgene)、蛋白质或酶,技术可包括但不限于,使用基于目的基因/酶的公开序列的引物通过pcr克隆基因,或通过使用设计用于扩增目的基因中的保守区域的简并引物的简并pcr。此外,本领域技术人员可使用技术来鉴定具有功能同源性或相似性的同源或相似基因、蛋白或酶。技术包括通过用于所述活性的体外酶测定法(例如,如本发明所述或在kiritani,k.,branched-chainaminoacidsmethodsenzymology,1970中所述)对酶的催化活性检测细胞或细胞培养物,然后通过纯化技术来分离具有所述活性的酶,通过诸如埃德曼降解法(edmandegradation)等技术来确定所述酶的蛋白序列,设计针对可能的核酸序列的pcr引物,通过pcr来扩增所述dna序列,和克隆所述核酸序列。为了鉴定同源或相似基因和/或同源或相似酶、相似基因和/或相似酶或蛋白,其技术还包括将候选基因或酶的有关数据与数据库如brenda、kegg或metacyc进行比较。所述候选基因或酶可根据本发明所述技术在上述数据库中鉴定。6.实施例6.1亲本法呢烯生成菌株“不可转换的/不可开关控制的”法呢烯生成菌株衍生自野生型酿酒酵母(saccharomycescerevisiae)菌株(cen.pk2),并且还包含在gal启动子控制下,来自酿酒酵母的以下染色体整合的甲羟戊酸途径基因:乙酰辅酶a硫解酶,hmg-coa合酶,hmg-coa还原酶,甲羟戊酸激酶,磷酸甲羟戊酸激酶和甲羟戊酸焦磷酸脱羧酶;和来自黄花蒿(artemisiaannua)的法呢烯合酶突变体的六个拷贝。所述不可转换的法呢烯生成菌株在gal4oc启动子下,缺失gal80基因和gal4的另外拷贝,其中酿酒酵母(saccharomycescerevisiae)的gal4基因的编码序列受其天然启动子(pgal4oc;参见例如griggs&johnston(1991)pnas88(19):8597-8601)的“有效组成型”形式的调节控制。然后使“不可转换的”菌株中的法呢烯生成转变为“可转换”,即在麦芽糖存在下可抑制。通过在麦芽糖响应性启动子如pmal32的控制下染色体整合gal80的拷贝,所述麦芽糖可转换菌株建立在所述不可转换菌株之上。可转换的法呢烯生成可转换菌株的其他描述记载在美国专利申请公开号us2016/0177341和pct申请公开号wo2016/210350中,其均通过引用并入本发明。在某些菌株中,根据meadowsetal.(2016),美国专利号8,603,800,美国专利号9,410,214,进一步对所述可转换的法呢烯菌株进行遗传工程改造,各文献均通过引用并入本发明。6.2基于uv的法呢烯定量和细胞密度测定法呢烯滴度/效价是通过meadowsetal.(2016)中记载的方法进行测定。将600μl的2-丁氧基乙醇加至150μl的全细胞培养液中,每次加入200μl,分3次加入,在每次加入之间在96孔板振荡器上以1,000r.p.m.振摇90秒。然后将样品孵育40分钟。将8μl的2-丁氧基乙醇提取物与200μl的异丙醇在96孔uv板(costar3635)中混合,然后在读板器上读取222nm处的吸光度。根据标准稀释系列的吸光度计算法呢烯滴度。同先前在meadowsetal.(2016)和sandovaletal.(2015)metabol.eng.25,215-226(2014)中记载的方法来测定od600。6.3由法呢烯生成菌株生成β-胡萝卜素为了测试除了法呢烯之外是否可共同生成类胡萝卜素作为增值分子,在pgal启动子下将五个途径基因引入法呢烯生成菌株中。所述引入的基因包括:ggpps、xd.crtyb、xd.crti、hp.crtz、和hp.bkt(或ggpps、xd.crtyb、xd.crti、pa.crtz和ps.crtw),将其引入上述可转换的法呢烯生成菌株中。测试了不同基因剂量(例如,途径基因的不同拷贝)的27种组合。在所有27个转化平板中,观察到黄色或橙色菌落(图10),表明β-胡萝卜素的累积,但未观察到红色,即虾青素的颜色。值得注意的是,在接种后6天才开始出现颜色,这可能是由于麦芽糖开关控制下的类胡萝卜素生物合成途径基因的低表达。通过菌落pcr的遗传分析显示虾青素生物合成基因未被整合。随后挑选代表性β-胡萝卜素生成菌落,用虾青素生物合成基因转化。6.4由法呢烯生成菌株生成虾青素将虾青素生成菌株构建在法呢烯生成菌株之上,所述法呢烯生成菌株包含与ggpps可操作地连接的pgal3,编码crt1的核酸的一个拷贝,和编码crtyb的核酸的四个拷贝。通过添加hp.crtz和hp.bkt基因或pa.crtz和ps.crtw来完成虾青素途径。两组酶均导致红色菌落,表明虾青素的生成(图11)。本实验表明,在法呢烯存在下,虾青素可保留在细胞内。在生成和回收法呢烯之后,细胞内含有虾青素的用过废微生物细胞可作为动物饲料(例如,养殖鲑鱼)来增值。6.5由酵母菌株同时生成虾青素和法呢烯图12示出了由经工程化以生成类胡萝卜素类化合物(β-胡萝卜素或虾青素)的菌株来生成法呢烯。菌株a(也称为菌株y021)是6.1节中所述的基于法呢烯生成的菌株,菌株b是用于引入类胡萝卜素途径基因的菌株a的变体。菌株c衍生自菌株b,所述菌株b包含如图12中所示的其他基因。图12中示出的其他菌株均衍生自菌株c。在生成的“关闭状态”下,所有菌株生长(通过关闭状态细胞密度od600测定)并生成法呢烯(通过基于uv的测定法所示的关闭状态法呢烯滴度测定)。参见6.2节。在关闭状态下,所有用于生成类胡萝卜素类化合物的菌株也生成类胡萝卜素类化合物(数据未示出)。在开启状态期间(当所述类异戊二烯生成被激活时),含有类胡萝卜素基因的培养物同在关闭状态(当所述类异戊二烯生成未被激活时)下一样均不会生长。参见图12。所述菌株还生成比菌株a或其亲本菌株b少得多的法呢烯。此结果说明可首先生成法呢烯,然后可开启类胡萝卜素的生成。在图12中,如下所示测定细胞密度(od600)。将8μl细胞培养物样品与92μltritonod稀释剂(20g/ltritonx-114,200ml/lpeg200,200ml/l100%乙醇,其余为水)在透明96孔板中混合,将溶液以1,000rpm搅拌6分钟,并通过在m5分光光度计(moleculardevices,sunnyvale,ca)上测定600nm处的吸光度来确定od600。在图12中,采用本发明所述的基于uv的测定法,使用全培养液来测定法呢烯滴度。参见6.2节。其他合适的方法,如气相色谱法,可用于测定法呢烯滴度。通常,对于预培养条件,将培养的菌株在无菌96孔板(1.1ml工作体积;axygen)中培养生长,所述96孔板含有360μl鸟种培养基(birdseedmedia,bsm,最初由vanhoeketal.(2000)描述)。对于预培养条件,除非另有说明,碳源通常是1.4%蔗糖和0.7%麦芽糖的混合物。将单菌落挑取到每个孔中,并在33.5℃、80%湿度和1000rpm(inforsmultitron;atrbiotec)下孵育约72小时。对于法呢烯生成实验,将上述饱和培养物以1/25稀释到含有145μlbsm的无菌1.1ml平板中。通常,除非另有说明,所述碳源是4%蔗糖,或2.3%蔗糖和1.7%麦芽糖的混合物。培养72小时后,通过向每个孔中加入600μl异丙醇(ipa)进行法呢烯提取。孵育30分钟后,将8μl转移至含有192μlipa的透明底部测定板中。通过spectramax读板器上222nm处的uv吸光度来测定法呢烯浓度。6.6通过hplc验证β-胡萝卜素和虾青素的生成6.6.1.提取方法开发:尝试各种提取方法从细胞中提取β-胡萝卜素和虾青素。此想法是使细胞沉淀并从沉淀中提取化合物,因为类胡萝卜素类化合物似乎不会从所述细胞中分泌出来,正如由上清液的颜色所判断的那样。最初,将沉淀溶解在dmso中,并使用各种非极性溶剂提取化合物,将其进一步稀释到甲醇-thf溶液中,然后上样至hplc。试验的溶剂组合如下:a)100%庚烷;b)1:1甲醇-thf混合物;c)1:1庚烷-thf混合物;d)1:1甲醇-丙酮混合物;和d)100%戊烷。还将提取物与“无提取”条件进行比较,其中将dmso提取物直接稀释到甲醇-thf溶液中并通过hplc进行分析。样品制备方案:在典型的样品制备中,将120μl全细胞培养液以13000rpm离心60秒。弃去澄清的上清液,然后将所得亮黄色/橙色沉淀重新溶解在约400μldmso中并涡旋15秒以混合所述内容物。将所得混合物以相同速度离心30秒,然后将100μl的此dmso提取物加至200μl1:1甲醇-thf溶液中,并通过hplc-uv进行分析。结果与讨论:使用相同的样品进行所有提取。样品大小和溶剂体积始终保持不变。通过比较不同提取物的相对峰面积来选择最佳提取条件。应注意的是,未进行其他校正以解释溶剂密度的差异。我们注意到使用纯庚烷或戊烷的提取导致β-胡萝卜素的最大峰面积,这与“无提取”条件相当。选择仅dmso条件以避免提取过程中的额外步骤。此外,据报道,dmso破坏细胞膜,所述细胞膜可能已在细胞中有效提取/解离类胡萝卜素类化合物起作用。然而,单一提取步骤不完全,因为它不会导致所得细胞沉淀的完全脱色(通过目视检查)。在70℃下处理dmso提取物约10分钟也未导致完全提取(类胡萝卜素类化合物在高达80℃下稳定)3。在后续实验中,可至少重复三次提取,以验证仍留在所述沉淀中的物料量。6.6.2.标准品制备即使在50mg/l水平下,β-胡萝卜素也很难溶解在溶剂如乙酸乙酯、甲醇或异丙醇中。尽管使用高度非极性溶剂(如庚烷、己烷或戊烷)来溶解化合物是理想的,但所述溶剂与hplc流动相的不混溶性使其成为一个困难的选择。在本实施例中,使用二氯甲烷制备β-胡萝卜素的储备溶液,然后在丙酮中进一步稀释所述储备液以得到校准标准品所需的β-胡萝卜素溶液的终浓度。立即将溶液转移至琥珀色瓶中,用氮气排气(以除去顶部空间中的任何空气)并盖上封盖。然后将校准物等分到gc小瓶中(每个~300μl)并储存在-80℃冰箱中。取出每个等分试样,在室温下解冻并在需要时进行分析。一次使用后,将小瓶丢弃。6.6.3.hplc方法开发:使用c18或c8反相hplc柱以及甲醇、乙腈和水的流动相溶剂组合来洗脱β-胡萝卜素标准品的初始尝试不起作用4。大多文献建议采用反相色谱柱,使用非极性氯化溶剂或流动相中的醚来洗脱β-胡萝卜素5,6。由于与使用乙醚相比,使用氯仿或二氯甲烷会增加健康风险,因此本发明选择四氢呋喃作为流动相中的共溶剂。色谱柱和洗脱参数如下:表3:hplc色谱柱和洗脱参数色谱柱zorbax-sb-c18规格100mmx3.5ux4.6mmi.d.流动相a100%乙腈流动相b甲醇与25%thf(v/v)梯度(ramp)60%a:40%b流速1ml/min–匀速时间16min进样体积3μl检测器波长450nm,480nm和210nm图9示出了使用本报告中提及的条件进行提取和分析的各种菌株样品:a)预期没有下游基因的ggpps祖父母菌株,未显示β-胡萝卜素或虾青素的迹象;b)仅含有编码β-胡萝卜素的基因的亲本菌株在提取和分析后清楚地显示其存在。目前尚不清楚13.3分钟处的第二个峰的身份。我们怀疑这是β-胡萝卜素的二氢类似物,其是crtyb基因的已知副产物(参考:verwaaletal,2007),c)子代菌株清楚地显示在1.4分钟处存在虾青素以及β-胡萝卜素和其他潜在的类胡萝卜素类化合物。在子代菌株中发现β-胡萝卜素并不奇怪。其他较小的峰值的身份是未知的,它们可能是其他下游类胡萝卜素类化合物(比β-胡萝卜素极性更大,可能是氧化形式)或者也可能含有一些降解或转化的虾青素类似物。6.7最终的类胡萝卜素提取方法和分析结果:表4示出了构建在同基因菌株之上的各种菌株,所述同基因菌株包含来自酿酒酵母的经染色体整合的甲羟戊酸途径基因。表4中示出了掺入不同菌株中的其他基因(例如,法呢烯合酶,ggpp合酶,β-胡萝卜素或虾青素生物合成途径基因)。使细胞在烧瓶中生长48小时,然后在提取前切换至1.8%葡萄糖、0.2%半乳糖中进行48小时。从中提取类胡萝卜素类化合物的菌株如表4中所述。表4:从中提取类胡萝卜素类化合物的菌株。所述这些菌株是从生成法呢烯的菌株生成的,所述生成法呢烯的菌株源自y337(westfalletal,2012),其中去除了紫穗槐二烯合酶并用法呢烯合酶替代。菌株说明祖父母菌株1(5xfs+ggpps)祖父母菌株2(15xfs+ggpps)亲本菌株1(5xfs+ggpps)+(2crti:1crtyb)+空质粒亲本菌株2(15xfs+ggpps)+(2crti:1crtyb)+空质粒子代菌株1(5xfs+ggpps)+(2crti:1crtyb)+(ps.crtw_3+ps.crtz_3)子代菌株2(15xfs+ggpps)+(2crti:1crtyb)+(ps.crtw_3+ps.crtz_3)用于样品提取的6个步骤如下:1.将400μlwcb加至2.2ml微量离心管中。2.将样品在台式微量离心机中以13,000rpm旋转45秒后剩余沉淀。3.用移液管除去无色上清液。4.将1000μldmso加至沉淀中,涡旋30秒,进行两次。5.在台式微量离心机上以13,000rpm旋转45秒。6.检查沉淀是否还有颜色-将150μl上清液加至含有插入物的琥珀色gc小瓶中的150μl1:1meoh:thf混合物中,准备用于hplc。来自祖父母菌株1、亲本菌株1和子代菌株1的hplc痕迹清楚地显示在不含β-胡萝卜素基因的情况下不存在类胡萝卜素类化合物,此两个清晰的峰(11.6分钟处的β-胡萝卜素,和13.3分钟处被认为是羟基β-胡萝卜素的峰),虾青素(1.42分钟)和许多其他类胡萝卜素类化合物,以及一些β-胡萝卜素,存在于最红色的菌落中(图9)。图9表明子代菌株1生成虾青素。6.8实施例:类胡萝卜素类化合物和倍半萜的共同生成及其对倍半萜生成和细胞密度的影响本实施例说明了可进一步遗传工程改造高通量法呢烯菌株以共同生成类胡萝卜素类化合物,而基本上不减少法呢烯的生成量和细胞生物量产量。6.8.1.dna组装和转化使用如前所述的dna组装方法来生成多组分dna构建体(dekoketal.(2014)acssynth.biol.21;3(2):97-106.doi:10.1021/sb4001992;serberetal.,美国专利号8,221,982)。根据horwitzetal.cellsyst.jul29;1(1):88-96(2015)和dicarloetal.nucleicacidsres.,41(2013),pp.4336-4343)中记载的方法,将供体dna盒的线性片段转化到宿主细胞中以整合到所述宿主细胞基因组中。转化到宿主中以进行基因组整合是使用优化的酿酒酵母liac方法进行(gietzandwoods,methodsenzymol.2002;350:87-96)。使用菌落pcr确认每个无标记的整合。6.8.2.培养基和菌株培养法呢烯和类胡萝卜素类化合物的共同生成是在96孔微量滴定板中以1,000rpm振摇、相对湿度为80%的条件下进行。用于接种微量滴定板的培养物在28℃下用2%葡萄糖、1%麦芽糖、2g/l赖氨酸和50μg/mlg418维持在合成的完全培养基琼脂平板上。将菌落挑选到无菌96孔微量滴定板(1.1ml工作体积;axygen)的孔中,所述板含有360ml限定的液体生长鸟种培养基(birdseedmedia,bsm),所述培养基含有2%总碳(1.4%蔗糖,0.7%麦芽糖)和1g/l赖氨酸。将此预培养板在28℃、80%湿度和1000rpm(inforsmultitron;atrbiotec)下孵育72小时。将初始生物量构建物以1/25稀释至两个无菌1.1ml平板中,所述平板含有(i)360ml限定的液体生长鸟种培养基(birdseedmedia),其含有4%蔗糖作为碳源,并且此板用于测定生物量产量和类胡萝卜素种类,和(ii)150μl限定的生长培养基,其含4%蔗糖作为碳源。将所述第一个板孵育4天,然后使用uv-uplc测定法测定生物量产量和类胡萝卜素类化合物生成量。在将所述第二个板孵育3天并用异丙醇提取全孔,并使用基于uv的测定法测定之后,来测定法呢烯。参见6.2节。6.8.3.结果:角黄素和其他类胡萝卜素中间体的生成在本实验中,生成法呢烯的菌株y011用作所述基于法呢烯生成的菌株。菌株y011是另一种可转换的生成法呢烯的菌株,其包含实施例6.1中所述的遗传元件,并且是6.5节中所述菌株y021的变体。最初使用设计为会聚的分裂表达盒的构建体,将布拉克须霉(phycomycesblakesleeanus)八氢番茄红素合酶/番茄红素环化酶,粗糙脉孢菌(neurosporacrassa)八氢番茄红素合酶/番茄红素环化酶,红发夫酵母(xanthophyllomycesdendrorhous,phaffiarhodozyma)八氢番茄红素去饱和酶,和副球菌属(paracoccussp.)β-胡萝卜素酮化酶的酿酒酵母密码子优化的序列整合到宿主细胞基因组中。此外,在将第二分裂构建体整合到宿主细胞基因组中后,天然酿酒酵母bts1(香叶基香叶基焦磷酸合酶)、erg8(磷酸甲羟戊酸激酶)和mvd1(甲羟戊酸焦磷酸脱羧酶)也均过表达。如上所述将此两种构建体整合到y011的基因组中,并使用强的天然强pgal1/10双向启动子来驱动每种构建体的基因表达。如上所述构建菌株(参见物料和方法),并在含有50μg/mlg418的琼脂平板上选择转化体。通过菌落pcr验证正确的整合。菌株y924和y925是两个具有正确整合的克隆。我们在含4%蔗糖的限定的birdseed培养基中培养细胞3天(法呢烯)使其生长或在仅含4%蔗糖的培养基中培养4天(类胡萝卜素和生物量)后,评估法呢烯和类胡萝卜素的生成。我们的数据表明,类胡萝卜素共同生成菌株y924和y925(衍生自y011)可生成大量的每种角黄素、番茄红素、八氢番茄红素和β-胡萝卜素。然而,所述生物量产量显著低于亲本(仅生成法呢烯)的生物量产量。因此,所述这些菌株在96孔板中生成的法呢烯少于由亲本生成的法呢烯。图13中示出了法呢烯生成量和生物量产量均显著降低。在生成法呢烯的菌株中共同生成高水平类胡萝卜素的负面影响促使我们进入下一个假设,即以较低水平编码基因的类胡萝卜素途径的表达将指导我们生成更健康的菌株。6.9实施例:在不降低倍半萜和生物量产量的情况下共同生成类胡萝卜素类化合物和倍半萜本实施例说明了类胡萝卜素途径可进行修饰,使得与遗传工程化以仅生成法呢烯的亲本宿主细胞相比,可与类胡萝卜素共同生成初级类异戊二烯产物法呢烯,而不牺牲法呢烯的量或生物量产量。在本实施例中,图2中所示的类胡萝卜素“上部”途径使用不同强度的启动子进行表达,每个启动子与编码类胡萝卜素生物合成途径的酶的核酸可操作地连接。在实施例6.7中,编码基因的所有类胡萝卜素途径,包括编码bts1的第二拷贝(天然ggps基因)的类胡萝卜素途径,使用我们最强的双向启动子pgal1/10进行表达(表5)。为了检验这样的假设,即以较低水平编码基因的类胡萝卜素途径的表达将使本发明生成更健康的共同生成菌株,我们挑选了天然启动子(pgal3)和半合成启动子(pgal2_v10),它们均具有与pgal1不同的启动子强度(表5)。半合成pgal2_v10启动子的启动子强度约等于内源性pgal7启动子的启动子强度。表5.通过使用半乳糖作为糖源在野生型cen.pk2菌株中表达gfp进行测定的相对启动子强度启动子相对于pgal1的启动子强度pgal11pgal2_v100.36pgal30.11在本实验中,我们仅表达导致生成β-胡萝卜素的“上部”类胡萝卜素途径(参见图2),并且我们没有过表达bts1的第二拷贝。在上述生成法呢烯的菌株(y011)中,我们将基于红发夫酵母(xanthophyllomycesdendrorhous,phaffiarhodozyma)的八氢番茄红素合酶/番茄红素环化酶(crtyb)和八氢番茄红素去饱和酶(crti)的酿酒酵母密码子优化的序列整合到基因组中。将构建体设计为会聚的表达盒。我们测试了不同的启动子组合来表达所述“上部”类胡萝卜素途径。如上所述在96孔微量滴定板中培养细胞3天使其生长后,我们评估了法呢烯、生物量和类胡萝卜素的生成量。我们的数据表明,这些新的共同生成菌株y854(pgal3>crtyb;pgal2_v10>crti)、y855(pgal3>crtyb;pgal3>crti)分别在微量滴定板中共同生成至少1.0mg/l的β-胡萝卜素和1.93mg/l的β-胡萝卜素,对法呢烯和生物量生成量没有影响。参见图14a和14b。此外,所述这些菌株生成约1.1至1.4mg/l的八氢番茄红素,表明进一步的途径优化可潜在地导致共同生成更高的β-胡萝卜素水平,而不影响法呢烯生成量。6.10实施例:倍半萜和类胡萝卜素类化合物的共同生成/依次生成及其生成比率本实施例说明了倍半萜和类胡萝卜素的比率,所述倍半萜和类胡萝卜素可共同生成或依次/顺序生成而不会显著影响初级类异戊二烯、倍半萜的生成量或生物量产量。6.10.1.dna组装和转化使用如前所述的dna组装方法来生成多组分dna构建体(dekoketal.(2014)acssynth.biol.21;3(2):97-106.doi:10.1021/sb4001992;serberetal.,美国专利号8,221,982)。根据horwitzetal.(2015)和dicarloetal.(2013)中记载的方法,将供体dna盒的线性片段转化到宿主细胞中以整合到宿主细胞基因组中。转化到宿主中以进行基因组整合是使用优化的酿酒酵母liac方法进行(gietzandwoods,2002)。使用菌落pcr确认每个无标记的整合。对于使用雌二醇响应性启动子y440构建的菌株,使用先前描述的最强雌二醇响应性启动子来表达编码三孢布拉霉菌(blakesleatrispora)ggpps,红发夫酵母(xanthophyllomycesdendrorhous)crti和雨生红球藻(haematococcuspluvialis)β-胡萝卜素酮化酶和β-胡萝卜素羟化酶的基因(mcissacetal.(2014)nucleicacidsres.42:e48),而使用红发夫酵母(xanthophyllomycesdendrorhous)crtyb采用半合成启动子(pgal2_v10)进行表达。6.10.2.雌二醇培养基和菌株培养法呢烯和类胡萝卜素类化合物的共同生成是在96孔微量滴定板中以1,000rpm振摇、相对湿度为80%的条件下进行。用于接种于微量滴定板的培养物在28℃下用2%葡萄糖、1%麦芽糖、2g/l赖氨酸和50μg/mlg418维持在合成的完全培养基琼脂平板上。将菌落挑选到无菌96孔微量滴定板(1.1ml工作体积;axygen)中,所述板含有360ml限定的液体生长鸟种培养基(birdseedmedia,bsm),所述培养基含有2%总碳(1.4%蔗糖,0.7%麦芽糖)和1g/l赖氨酸。将此预培养板在28℃、80%湿度和1000rpm(inforsmultitron;atrbiotec)下孵育72小时。将初始生物量构建物以1/25稀释至两个无菌1.1ml平板中,所述平板含有(i)平板1:360ml限定的液体生长鸟种培养基(birdseedmedia),其含有4%蔗糖作为碳源,并且此板在含有或不含15nm雌二醇的情况下,用于测定生物量浓度(每升培养物的干细胞重量g)和类胡萝卜素种类(以下称为“共同生成”),和(ii)平板2:在含有或不含15nm雌二醇的情况下,使用含有4%蔗糖作为碳源并含有油表面活性剂乳化的150μl限定的生长培养基,来测定法呢烯的生成量。在第二轮接种中,将来自平板1的生物量(不添加雌二醇)旋转下来,并将25%的生物量接种到:(a)总体积为360ml限定的液体生长鸟种培养基(birdseedmedia),所述培养基含有4%蔗糖和50mm雌二醇,或(b)150μl限定的生长培养基,含有4%蔗糖和50mm雌二醇并含有油表面活性剂(以下称为“顺序/依次”)。所述接种的平板用于在连续过程中测定生物量产量和类胡萝卜素种类,或分别用于测定法呢烯生成量。在孵育24-72小时后测定生物量、法呢烯和类胡萝卜素生成量。6.10.3.类胡萝卜素/叶黄素提取方案:培养后,将细胞以最大速度离心5分钟使其沉淀。通过移液管移除上清液。将dmso(二甲亚砜)加至所述沉淀中-加入最终培养物体积的2倍。将容器密封并在室温下、在振荡器上以1500rpm振荡孵育30分钟。然后将等体积的正庚烷加至dmso-细胞混合物中。将其密封并再次在室温下、以1500rpm振荡孵育30分钟。然后将约1/6的磷酸盐缓冲盐水(ph7.0)的培养体积加至dmso-庚烷-细胞混合物中,以增加dmso层的极性。再振荡5分钟。然后将混合物以5,000xg离心5分钟,以沉淀各层并沉淀任何细胞碎片。将等份的顶部庚烷层转移至新容器中,并可加载至分析仪器上用于分析。6.10.4.类胡萝卜素/叶黄素测定方案:6.10.4.1用于检测和定量类胡萝卜素类化合物和叶黄素类化合物的uhplc-dad方法:提取的样品和校准曲线均在具有二极管阵列检测器(dad)的thermoscientificvanquish系列uhplc上运行。将体积为20μl样品上样至色谱柱上(agilenteclipseplusc82.1umx100mm1.8),使用8.5分钟梯度方法,从60%溶剂b至90%溶剂b进行分析(溶剂a:50%meoh/水5mm乙酸铵,0.1%hoac;溶剂b:10%/80%/10%meoh/ipa/水5mm乙酸铵0.1%hoac)。所用方法的流速为0.5ml/min,柱温为45摄氏度。用于检测的波长为260nm(八氢番茄红素)471nm(番茄红素),454nm(β-胡萝卜素,角黄素和虾青素)。6.10.4.2通过质谱(ms)测定全细胞提取物中的叶黄素类化合物:将提取的样品连同预混合的校准曲线标准品提交至themis数据库以生成工作列表,然后使用大气压化学电离(apci)源和自动模式在agilent6545qtof中运行。将体积为5μl样品体积上样至色谱柱上(50x2.1mmi.d.poroshell120sb-c8,part#689775-906),使用3分钟梯度方法,从40%流动相b至100%流动相b进行分析(流动相a:50%meoh/水5mm乙酸铵,0.1%hoac;流动相b:10%/80%/10%meoh/ipa/水5mm乙酸铵0.1%hoac)。所用方法的流速为0.4ml/min,柱温为60摄氏度。创建优选的分析物列表以产生用于生成的进一步鉴定分析物的ms/ms碎片模式。然后使用qual和quantmasshunter来分析和计算数据以鉴定产物并生成滴度测定。6.10.5.共同生成结果此结果描述了第6.9.2节中所述的共同生成实验设计的结果。亲本菌株(y021)是高通量法呢烯生成菌株,在雌二醇(15nm)不存在和存在的情况下均可生成法呢烯,但在此两种生长条件下均不生成任何类胡萝卜素类化合物或叶黄素类化合物。如上所述,菌株y440(如第6.10.1节中所述)经遗传修饰以生成法呢烯和类胡萝卜素类化合物。当编码类胡萝卜素类化合物生物合成的基因以低水平诱导时(通过添加15nm雌二醇),则生成β-胡萝卜素以及法呢烯。亲本菌株y021中法呢烯生成量与菌株y440中法呢烯生成量的差异可忽略不计(例如,小于5重量%)。亲本菌株y021中生物量浓度(每升培养物的干细胞重量g)与菌株y440中生物量浓度的差异也可忽略不计(例如,小于5%)。所述这些结果证明产物(即法呢烯)生成并分泌到培养基和细胞相关的类胡萝卜素(β-胡萝卜素)中,而不会显著影响法呢烯生成量或生物量产量。在本实验中,每个平板生成的β-胡萝卜素重量与法呢烯重量的比率测定为约0.01%。6.10.6.依次生成结果此结果部分描述了第6.10.2节中所述的顺序/依次生成实验设计。在第一生成培养物(pc)中,当不诱导编码类胡萝卜素生成的基因时,则生成法呢烯但不生成β-胡萝卜素。将25%的此种培养物转移至第二次发酵中,其中编码类胡萝卜素和叶黄素生物合成酶的基因在50nm雌二醇的存在下进行高水平诱导,类胡萝卜素(β-胡萝卜素)和叶黄素类化合物(角黄素和黄体素/玉米黄质)可被检测到。此举证明了在所述第一生成培养物中生成法呢烯,和在所述第二生成培养物中生成类胡萝卜素类化合物(和偶然的法呢烯生成)的依次生成。在本实验中,由β-胡萝卜素重量得到的β-胡萝卜素重量与法呢烯重量的比率为约0.03%。6.11实施例:在发酵罐培养物中共同生成法呢烯和类胡萝卜素类化合物使用meadowsetal.(2016)中记载的方案,在0.5l发酵罐中培养菌株y440,除了糖饲料是巴西甘蔗糖浆。在接种y440后,向0.5l发酵罐的培养基中加入15nm雌二醇,并随后加入培养基,使所述发酵罐中雌二醇的浓度保持在15nm。培养超过48小时后,培养物含有4.8g法呢烯/kg全细胞培养液和7mg类胡萝卜素类化合物(番茄红素+β-胡萝卜素)。这相当于生成类胡萝卜素类化合物与生成法呢烯的重量比为约0.14%。以下参考文献通过引用其整体并入本发明:1.westfall,p.j.,etal.,productionofamorphadieneinyeast,anditsconversiontodihydroartemisinicacid,precursortotheantimalarialagentartemisinin.procnatlacadsciusa,2012.109(3):p.e111-8.2.meadows,a.l.,etal.,rewritingyeastcentralcarbonmetabolismforindustrialisoprenoidproduction.nature,2016.537(7622):p.694-697.3.verwaal,r.,etal.,high-levelproductionofbeta-caroteneinsaccharomycescerevisiaebysuccessivetransformationwithcarotenogenicgenesfromxanthophyllomycesdendrorhous.applenvironmicrobiol,2007.73(13):p.4342-50.4.ukibe,k.,etal.,metabolicengineeringofsaccharomycescerevisiaeforastaxanthinproductionandoxidativestresstolerance.applenvironmicrobiol,2009.75(22):p.7205-11.5.mcisaac,r.s.,etal.,syntheticbiologytoolsforprogramminggeneexpressionwithoutnutritionalperturbationsinsaccharomycescerevisiae.nucleicacidsres,2014.42(6):p.e48.6.bendjilali,n.,etal.,time-courseanalysisofgeneexpressionduringthesaccharomycescerevisiaehypoxicresponse.g3:genes|genomes|genetics,2017.7(1):p.221-231.7.notmanetal.molecularbasisfordimethylsulfoxide(dmso)actiononlipidmembranesj.am.chem.soc.,128,2006,13982-13983.8.heetal.iontransportthroughdimethylsulfoxide(dmso)inducedtransientwaterporesincellmembranes.mol.membr.biol.3-4,2012,107-113.9.kim,j.k.,kim,j.i.,lee,n.k.,hahm,y.t.,baik,m.y.,kim,b.y.extractionofβ-caroteneproducedfromyeastrhodosporidiumsp.anditsheatstabilityfoodsci.biotechnol.19,2010,263-266.10.solmaiamriveravelez.guideforcarotenoididentificationinbiologicalsamplesj.nat.prod.doi:10.1021/acs.jnatprod.5b0075611.o’connor,k.c.,vella,g.j.non-aqueousreversephasepurificationofcarotenesonasmallparticlepreparativepacking.12.mcissac,r.s.etal(2014)nucleicacidsres.42:e48.doi:10.1093/nar/gkt1402来自本发明或附图所述的任何实施方案的一个或多个特征可与本发明在附图中描述的任何其他实施方案的一个或多个特征进行组合,而不偏离本发明的范围。本说明书所引用的所有出版物、专利和专利申请均通过引用并入本发明,如同每个单独的出版物或专利申请被具体和单独地提及通过引用并入。尽管为了清楚理解的目的,已通过举例说明和实施例详细描述了前述实施方案,但根据本发明的教导,对于本领域普通技术人员显而易见的是,在不脱离所附权利要求精神或范围的情况下,可对其做出某些改变和修改/修饰。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1