用双相互作用发夹探针进行的靶标介导的原位信号放大的制作方法
相关申请的交叉引用
本申请要求于2017年5月23日递交的美国临时申请第62/510,045号的优先权。以引用的方式将该申请的内容全文并入本文。
发明领域
本发明总体上涉及使用杂交探针原位检测核酸序列以及产生放大的杂交信号。
发明背景
荧光原位杂交(fish)是一种众所周知的技术,其用于例如检测单个固定的透性化细胞中的rna。检测具有低拷贝数rna靶标的细胞的fish方法(即,在细胞水平上检测)通常包括信号放大,以产生可检测的荧光。这样的方法在moter等人(2000)j.microbiol.meth.41:85-112中有综述。例如,地高辛(dig)标记的探针可以通过使dig标记与偶联至碱性磷酸酶的抗dig抗体反应,然后在形成颜色的反应中使碱性磷酸酶与底物反应来检测。已显示某些fish方法能够检测单个rna分子(sm-fish)。sm-fish要求产生足够高的局部荧光信号,该信号足够强并且足够高于背景,以能够实现作为可检测的荧光点来检测单个rna分子。两种成功用于sm-fish的方法利用多组用于靶序列的多个核酸杂交探针,其或者是小数目(五个或六个)的长的、多标记的探针(femino等人(1998)science280:585-590)或者是大数目(例如48个)的短探针,这些探针均被同一荧光团单标记,且沿靶序列平铺(raj等人(2008)naturemethods5:877-879)。后一种探针的组可以stellarisfish探针组商购自lgcbiosearchtechnologies。另一种众所周知的用于充分提高灵敏度以实现sm-fish的技术是通过杂交链反应(hcr)进行信号放大,该技术是由美国加利福尼亚州pasadena的加利福尼亚理工学院的nilesa.pierce博士及其同事开发的一种荧光信号放大方法。用于提高原位杂交反应的信号强度的另一种技术是通过滚环扩增(rca)进行的信号放大(lizardi等人(1998)naturegenetics19:225-232;
在通过hcr进行的信号放大中,包含(或标记有)称为“启始子序列”的延伸部分的线性(或无规卷曲)杂交探针导致两个荧光标记的发夹寡核苷酸(单体)通过杂交聚合,产生多荧光团标记的双链聚合物,其通过杂交栓系在与杂交探针互补的靶序列上。dna和rna均已用于构建杂交探针和hcr发夹寡核苷酸。对hcr的更详细解释在下面结合图1的描述出现。
用于单个靶序列的基本hcr方法的变化形式包括使用一组携带同一启始子序列并沿着靶序列杂交的多个探针;具有两个起始子序列的探针,一端为第一个hcr发夹寡核苷酸的起始子,另一端为另一个发夹寡核苷酸的起始子;或这两者(choi等人(2014)acsnano8:4284-4294,在4288页的右栏)。choi等人使用了这两者:每个rna靶序列一组五个双起始子dna探针。另一种变化形式是多个靶序列的多路检测,其对每个靶序列使用一组探针和一对不同且颜色不同的hcr单体。choi等人(例如)描述了五个靶标的多路检测,其对每个靶序列使用一组五个双起始子探针和一对携带光谱上不同的alexafluor荧光团的独特的hcr单体。
choi等人(2014)报道了在固定的透性化细胞(斑马鱼胚胎)中利用hcr扩增进行rna检测的实例。第一种方法利用rna探针(长度为81个核苷酸,包括50个核苷酸(50-nt)靶标互补或“识别”序列、5-nt间隔子和26-nt起始子序列)和rnahcr发夹寡核苷酸单体(长度为52个核苷酸,每种包含10-nt的立足点序列、16-bp的茎和10-nt的环)。第二种“下一代”方法利用dna探针(长度为91个核苷酸,包括50-nt靶互补序列、5-nt间隔子和36-nt起始子序列(包括12-nt立足点互补序列);或长度为132个核苷酸,在靶标互补序列的每一端带有间隔子和起始子),以及dnahcr发夹寡核苷酸单体(长度为72个核苷酸,包含12-nt的立足点序列、24碱基对(24-bp)茎和12-nt环)。为了与全标本包埋斑马鱼胚胎杂交,将胚胎固定在1ml的4%多聚甲醛中,用pbs洗涤,并用一系列甲醇洗涤液透性化。对于rna探针,在含有50%甲酰胺的缓冲液中在55℃下进行杂交过夜。对于rna发夹单体,在含有40%甲酰胺的缓冲液中在45℃下进行hcr扩增过夜。对于dna探针,在含有50%甲酰胺的缓冲液中进行杂交过夜。对于dna发夹单体,在不含甲酰胺(仅氯化钠柠檬酸盐(ssc)、吐温20和硫酸葡聚糖)的缓冲液中在室温下进行杂交过夜。
shah等人(2016)也报道了根据choi等人(2014)使用hcr扩增在固定和透性化的培养细胞、斑马鱼胚胎和小鼠脑切片中进行rna检测。为了与胚胎杂交,他们使用了一组三十九个单起始子dnasm-fish探针(探针之间≥5-nt的缺口),这些探针包含30-nt的靶标互补序列、5-nt间隔子和36-nt的起始子序列;对于培养的细胞和脑切片,他们使用了一组21至32个dnasm-fish探针,这些探针包含20-nt的靶标互补序列、4-nt间隔子和36-nt起始子序列。调节hcr扩增条件以将hcr聚合限制为每个聚合物链约20至40个发夹。对于培养的细胞,在包含硫酸葡聚糖和ssc的缓冲液中用120nm的每种发夹单体在室温下进行hcr扩增45分钟。对于胚胎,在包含硫酸葡聚糖、ssc和吐温20的缓冲液中用60nm的每种发夹单体在室温下进行hcr扩增一小时。对于脑切片,在包含硫酸葡聚糖和ssc的缓冲液中用120nm的每种发夹单体在室温下进行hcr扩增5至6小时。
hcr的当前局限性包括错误信号(也称为背景信号)的产生。洗涤后和起始hcr时保持非特异性结合的经标记的杂交探针也产生可检测的信号,这些信号构成背景信号或假阳性。有几篇参考文献已指出了这类信号的存在,尽管它们确定背景信号的方法彼此不同。choi等人(2014)指出,这些非特异性背景信号的程度取决于含起始子的杂交探针的长度和数目。在他们的表s2中,choi等人(2014年)报告了其hcr检测实验之一的信号和背景水平。平均信号水平为2010单位,并且背景水平(称为非特异性检测)为28单位。
chen等人(2016)也观察到了背景信号,他们在其补充表3中从在高放大倍数成像中计数的斑点数目的角度报告了信号和背景水平。他们对小鼠脑的从dlg4基因表达mrna的一个区域成像。在脑的特定区域,使用与dlg4mrna互补的探针获得的斑点数目为9,795。当替代地使用错义探针(其序列与mrna中的序列相同,因此不能与rna结合)时,在同一区域检测到1,540个斑点。类似地,针对不存在的rna的探针在该区域产生了1,209个斑点。后两个数字代表背景信号的水平,而第一个数字代表特异性信号。
shah等人(2016年)也观察到由被hcr起始子标记的非特异性结合的探针的扩增所产生的显著背景信号。他们通过用三组探针同时对pgk1mrna进行成像来分析背景水平:一组探针用起始子标记,该起始子从一组用alexa647标记的hcr发夹起始信号;第二组探针用第二种起始子标记,该第二种起始子从用alexa594标记的第二组hcr起始信号;和第三组探针,其直接用cy3b标记。他们的结果表明,36%的alexa647和27%的alexa594hcr和20%的cy3b斑点来自非特异性结合的探针(假阳性信号)(shah等人2016的图s3b)。此外,该文件的实例1描述了使用被动标记的探针进行的hcr所获得的假阳性信号的其他实例。
hcr的另一个局限性在于它不能用于区分彼此相差单个核苷酸的靶标。
通过rca进行信号放大通常是通过首先以模板依赖的方式从单链线性dna寡核苷酸形成环状模板来完成的,该寡核苷酸以将其5’和3’末端彼此相邻放置的方式与靶标结合用于随后的连接反应(lizardi等人(1998)naturegenetics19:225-232和larsson等人(2010)naturemethods5:395-7)。然后将由此产生的环状dna分子用作通过dna引物和dna聚合酶进行的滚环扩增(rca)的模板。环状模板的复制产生模板序列的互补序列的许多多联拷贝,其随后被荧光探针检测到。对rca的更详细的解释在下面结合图2的描述出现。
本发明的一个目的是降低背景并由此增加hcr信号放大检测方法的灵敏度。
本发明的另一个目的是一种rca信号放大检测方法,其产生栓系在杂交探针上的多联扩增子,其中降低了背景信号并提高了灵敏度。
本发明的另一个目的是一种hcr检测方法,该方法可用于区分彼此相差仅一个核苷酸的靶标。
技术实现要素:
其中将hcr起始子标记到靶标特异性区域的探针是已知的。尽管此类探针允许原位杂交的放大检测,但它们易于产生非特异性信号,并且不能用于区分和检测同一细胞中的两个等位基因。本发明包括探针对,其中hcr起始子被隔离在发夹内,并且直到探针在预期位置结合到其正确靶标才能起始扩增。此外,根据本发明的探针对允许产生和检测来自单个靶分子的放大信号,所述单个靶分子彼此相差一个核苷酸多态性。可以同时检测野生型和突变型序列。本发明包括相互作用的发夹杂交探针对,用于通过hcr在固定和透性化的细胞中起始信号放大。
本发明还包括rca方法,其利用探针栓系的引物和环状模板进行信号放大,其中所述引物被包括在探针对中,使得其被隔离在发夹内并且直到探针在预期位置结合到其正确靶标才能起始扩增。本发明包括相互作用的发夹杂交探针对,用于通过rca在固定和透性化的细胞中起始信号放大。
本发明包括一对或多对这样的探针加上一对或多对hcr寡核苷酸单体或用于rca的其他寡核苷酸的寡核苷酸组。本发明还包括含有固定和透性化的细胞和至少一对相互作用的发夹杂交探针的反应混合物,含有固定和透性化的细胞、已相互作用以产生至少一个hcr起始子序列的杂交探针对和至少一对hcr单体的反应混合物。本发明进一步包括用于通过本发明的方法进行单分子荧光杂交(sm-fish)测定的测定试剂盒,其中试剂盒包含至少如上所述的寡核苷酸组加上至少一种用于杂交和扩增反应的缓冲液。相互作用的发夹探针对和hcr单体包含天然或修饰的核苷酸,优选包含天然核苷酸,更优选由dna核苷酸组成。
根据本发明的方法是用于dna或rna靶标的fish方法,特别包括用于单分子检测或能够进行单分子检测的方法(单分子fish(sm-fish))。rna类别的实例包括但不限于信使rna、核糖体rna、小核rna、微rna、环状rna、非编码rna、pre-rna以及剪接的或可变剪接的rna。在用于检测单个细胞中rna或dna的fish方法中,细胞在固定、透性化和洗涤后用杂交探针探测。用于在细胞培养物和组织中固定和透性化细胞的fish技术是众所周知的,洗涤也是如此。根据本发明的方法不限于用于固定和透性化细胞的任何特定技术,或任何特定的洗涤步骤。
在根据本发明的rna或dnafish检测方法中,用至少一对相互作用的发夹杂交探针探测固定和透性化的细胞,该发夹杂交探针当在靶标链中的rna或dna靶序列上相邻杂交时相互作用,以产生单链hcr起始子序列。这种探测包括将至少一个探针对与固定和透性化的细胞一起孵育以使探针对与其靶序列杂交,以及孵育杂交的探针以通过它们的相互作用产生起始子序列。探针杂交和探针相互作用均可在单次孵育中进行。在洗涤以除去过量的未杂交的探针后,起始子与一对hcr发夹单体之一反应,通过hcr导致信号放大。或者,通过rca实现信号放大。
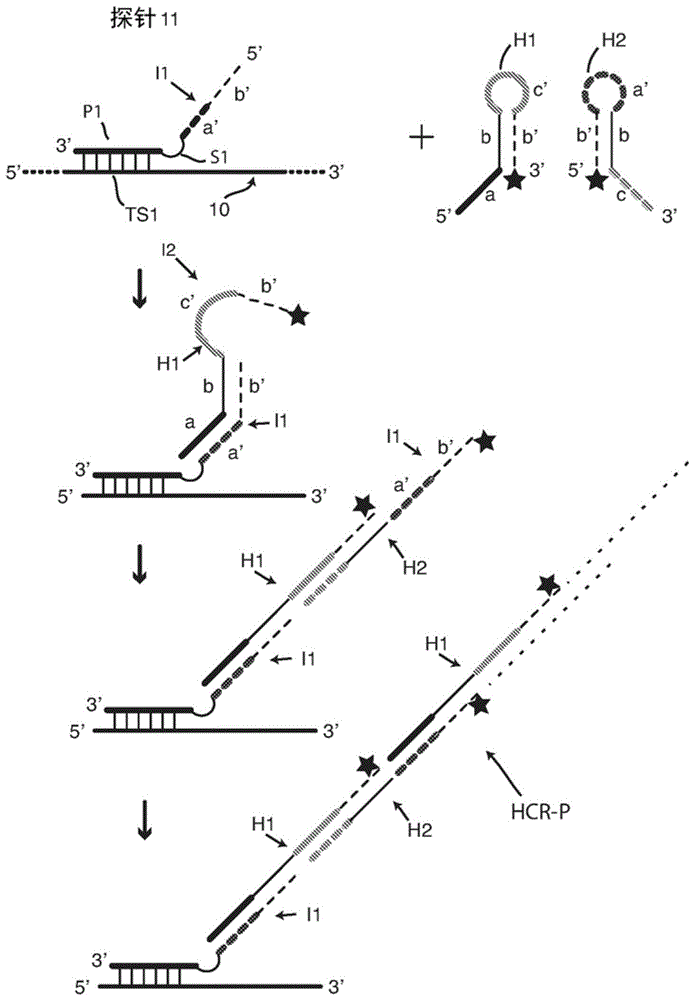
每对相互作用的发夹探针包括第一含发夹的探针,该探针具有以下顺序的片段(核酸序列元件),无论是5’→3’还是3’→5’:第一发夹茎臂序列、与所选的核酸(rna或dna)靶序列的第一子序列互补的环序列和与包括单链延伸的第一茎臂互补的第二发夹茎臂。我们将此探针不同地称为“供臂发夹探针”或“供臂信标”,其有时缩写为“db”。我们将其第二茎臂称为“供体臂”。每对相互作用的发夹探针还包括第二含发夹的探针,其具有以下顺序的序列元件,无论是5’→3’还是3’→5’:与靶序列的第二子序列互补并与第一子序列相邻的末端靶标互补序列、与第一含发夹的探针的供体臂互补的第一发夹茎臂序列、发夹环序列和与第一发夹茎臂的至少一部分互补的第二发夹茎臂序列。我们将此探针称为“臂受体发夹”探针或“臂受体探针”。其第二茎臂具有单链延伸,其包括末端靶标互补序列,并且在一些实施方案中还包括立足点序列。关于方向,当探针对在靶序列上杂交时,供臂发夹探针的第二发夹茎臂(供体臂)及其在臂受体探针中的互补序列是向内朝向的,即彼此相邻的。参考图4中的第二幅,这意味着,由于供体臂e’、f’位于供臂发夹探针49的5’端,其相互作用的臂受体探针50在3’端具有其发夹e、f、g’、f’;并且,由于供体臂d’、b’在供臂发夹探针48的3’端,其相互作用的臂受体探针47在5’端具有其发夹d、b、a’、b’。
第一含发夹的探针,即供臂探针,其功能类似于众所周知的分子信标探针,其具有茎环结构,并且当环序列与其互补靶序列杂交时打开(tyagi和kramer(1996)naturebiotechnology14:303-308;tyagi等人(1998)naturebiotechnology16:49-53)。供臂信标的环与靶序列的杂交将其茎臂分开,使第二茎臂序列及其延伸成为单链,从而能够与第二含发夹的探针即臂受体探针相互作用。相互作用将臂受体探针的茎臂分开,使其环序列和第二臂序列成为单链,并能够根据需要充当hcr扩增的起始子或rca的起始子(引发序列)。
如上所述,第二含发夹的探针即臂受体探针的第一臂序列可以包括第一臂序列的单链延伸,其不仅包含靶标互补序列而且还包含茎和靶标互补序列之间的立足点序列。在这样的实施方案(参见图4)中,立足点序列与第一探针的供体臂的茎形成部分充分互补,其使得在使供体臂成为单链之后,其茎部分与立足点序列杂交。随后发生链置换,打开第二探针的茎。在其他实施方案(参见图5)中,没有立足点序列,但是相互作用仍然打开了臂受体探针的茎。下文和实施例中描述了这两种类型的实施方案。
仅当两种探针在靶序列上相邻地结合或杂交时,它们才相互作用以产生单链hcr起始子序列或rca引物序列。如果第二探针的环序列是等位基因区分的(也就是说,如果存在单个核苷酸错配,则它不杂交并打开探针,并且其靶序列包括等位基因之间不同的核苷酸),则会仅由与探针完全互补的等位基因靶序列导致hcr或rca扩增。
本发明的一个重要方面是,扩增的起始子在游离或非特异性结合的探针中被“隔离”或“掩盖”,但是当探针与其特异性靶标结合时被“显露”或“暴露”。
在根据本发明的检测方法中,由如上所述的一对相互作用的发夹探针产生的hcr起始子序列通过hcr起始信号放大反应。在hcr中,被至少一个拷贝(优选单个拷贝)的同一荧光团标记的一对发夹寡核苷酸单体一旦通过与hcr起始子反应而被起始,就会通过杂交和链置换而彼此相互作用,以产生起始子序列的双链延伸。该延伸被称为hcr聚合物。它被多个荧光团标记,因此与直接荧光团标记的探针相比,产生放大的荧光信号。将其通过杂交直接栓系于臂受体发夹探针,并通过探针与靶序列的杂交间接栓系于该探针的靶序列。hcr的示意图示于图2中。对于有关hcr的说明,参见choi等人(2014)acsnano8:4284-4294。
在根据本发明的检测方法中,单对相互作用的发夹探针可产生单拷贝的hcr起始子,或另外(一对或更多对)对的相互作用的发夹探针可用于产生多拷贝的hcr起始子。当使用多个探针对来检测单个靶序列时,最简单的构建是仅改变靶标结合序列,从而允许使用单个hcr单体对。
在某些实施方案中,两个探针对可以共享一个供臂探针。即使只有三个探针,也有两个探针对,一对包括供臂探针和第一臂受体探针,第二对包括供臂探针和第二臂受体探针。在这样的实施方案中,一个臂受体探针在供臂探针的结合位点的5’与靶序列杂交,并且第二臂受体在供臂探针的结合位点的3’与靶序列杂交。当供臂探针与靶序列杂交,使其茎臂成为单链时,两个游离臂与两个臂受体探针均相互作用,从而释放两个hcr起始子。然后,两个游离的hcr起始子通过一对hcr单体起始hcr扩增,从而从共同的供臂探针中生长不是一个而是两个hcr聚合物。这导致来自单个拷贝的靶序列的更强的荧光信号。
根据本发明的方法还包括针对两个等位基因变体的sm-fish测定(定性和定量测定),该两个等位基因变体的差异仅一个核苷酸,例如野生型序列和含有单核苷酸多态性或变异(snp或snv)的突变序列。这样的方法利用两个相互作用的发夹探针对,其中每对含有供臂信标探针和臂受体发夹探针。每个供臂信标探针的环序列与靶序列的不同等位基因变体互补。例如,供臂信标探针之一的环序列可与野生型靶序列杂交但不与具有snp的突变序列杂交,而第二供臂信标探针的环序列可与突变序列杂交但不与野生型序列杂交。因此,对于给定的rna靶链,仅一个供臂信标探针将与给定的靶序列结合。尽管仅一个供臂信标探针与给定的靶标结合,但两个臂受体探针均与同一个靶标结合,并且它们在结合的供臂信标的任一侧都结合(图3和4)。具有3’起始子序列的臂受体发夹探针与3’的靶序列结合,3’是供臂信标探针的环结合的位置。具有5’起始子序列的臂受体发夹探针与5’的靶序列结合,5’是第二供臂信标探针的环结合的位置。两个臂受体发夹探针的立足点和茎和环序列不同,因此,每个相互作用的探针对都产生不同的单链起始子序列,该序列用标记有不同颜色荧光团标记的不同单体对起始hcr,从而产生可检测到的不同hcr多聚产物。在图3至5中描绘了四种探针以及它们如何与靶标和彼此相互作用。
由于两种等位基因变体都可能存在于杂合细胞中的不同rna链上,因此将在这种细胞中观察到来自这两种hcr变体的信号。另一方面,纯合细胞将仅显示一种信号。最终,在癌细胞(其中一个等位基因相对于另一个等位基因被放大并被更大程度表达)中,相应的hcr的信号强度将大于来自对应于次要等位基因的hcr的信号强度。
因为除非通过相邻的杂交的探针对的相互作用产生,否则反应混合物中不存在单链hcr起始子序列,所以可以将至少一个探针对和至少一个hcr单体对一起添加至固定的和透性化的细胞。然而,在某些优选的方法中,首先添加至少一个探针对,并在添加hcr单体之前通过洗涤除去未结合的探针。本发明的sm-fish方法包括检测hcr聚合物。在hcr聚合之后,通过洗涤除去未使用的hcr单体和未结合的探针对。通过显微镜技术或流式细胞仪检测荧光。
在某些情况下,不是像用平铺的(tiled)stellaris探针组完成的那样用平铺的探针靶向整个mrna靶标长度来进行sm-fish,可能有必要或有利地使用靶序列的一小部分(40-50nt)。例如,在存档的福尔马林固定的、石蜡包埋(ffpe)样品中,靶标mrna可能被降解,并且仅以小片段的形式存在。在其他情况下,靶标可能是小的外显子,其长度不足以允许平铺许多sm-fish探针。在其他情况下,靶标可能包括需要检测的微小差异。在这些情况下,使用单独一对相互作用的发夹探针或共享共同的供臂探针的两对探针将是足够且有利的。
与目前的hcr方法所实现的相比,通过本发明实现的无背景信号放大允许更可靠地检测靶核酸。背景信号的降低还允许检测不太丰富的靶标,在细胞和组织的自然自发荧光之上检测靶标,以及通过组合颜色编码检测同一细胞中的多个靶标。在基于组合颜色编码的多路检测中,通过使用产生颜色组合的探针混合物来检测每个靶标。然而,由于每个靶标信号被分成多个通道,因此这要求探针对每个通道都产生强信号。本发明的探针产生强信号,以满足基于组合颜色编码的多路检测的需要。
附图的简要说明
图1是用被动标记的杂交探针检测核酸靶序列和用hcr单体进行hcr信号放大的示意图。
图2是用被动标记的杂交探针检测核酸靶序列和用环状模板和标记的检测探针进行rca信号放大的示意图。
图3a是一对相互作用的发夹探针以及它们彼此之间以及与它们的靶序列相互作用以产生hcr起始子序列的示意图。
图3b是一对hcr单体的示意图,其聚合是由图3a所示的相互作用的发夹探针对起始的。
图4是两对相互作用的发夹探针以及它们彼此之间以及与它们的靶序列相互作用以产生hcr起始子序列的示意图。臂受体探针含有立足点序列,而供臂探针含有与立足点互补的序列。
图5是图4的探针对(其被修饰为不具有立足点或立足点互补序列)并且它们彼此之间以及与它们的靶序列相互作用以产生hcr起始子序列的示意图。
图6是共享共同的供臂探针的两对相互作用的发夹探针以及它们相互作用以产生两个hcr起始子序列的示意图。
图7是用一对相互作用的发夹杂交探针检测核酸靶序列以及用环状模板和标记的检测探针进行rca信号放大的示意图。
图8是一组显微图像,其显示了用被动标记的杂交探针进行检测和hcr信号放大,以及用相互作用的探针对进行检测和hcr信号放大所得到的靶标特异性信号和背景信号。
图9a和9b是比较使用被动标记的探针和相互作用的发夹探针对在hcr中产生的靶标特异性信号和背景信号的图。分析是通过流式细胞仪进行的。
图10a和b包括显微图像,其显示了使用两对相互作用的发夹探针和两对hcr单体同时检测mrna分子中的单个核苷酸差异。它还显示了描绘区分的定量水平的图。
图11是一组显微图像,其显示了使用具有不同设计的供臂探针的相互作用的探针对同时检测mrna分子中的单个核苷酸差异。
图12是一组显微图像,其显示了通过使用相互作用的发夹探针获得的信号,其中臂受体探针仅具有磷酸二酯键,并且臂受体探针包括由点击(click)化学产生的非磷酸二酯键。
图13是通过相互作用的发夹探针对和hcr信号放大在hela细胞中检测小引导rna所获得的信号的显微图像。
图14是比较来自使用三种类型的探针进行流式细胞术检测的靶标特异性信号和背景信号的一组图:使用大量短探针(均用同一荧光团单一标记)的直接(无扩增)检测;使用大量被动标记的探针的hcr;和使用一半数目的相互作用的发夹探针对的hcr。
图15是一组显微图像,其说明了egfrmrna中杂合点突变的检测。
详细说明
定义:
“rna”。如在本专利申请的说明书和权利要求书中所使用的,当提及靶序列时,“rna”包括所有变体,例如,信使rna、核糖体rna、编码或非编码rna、线性或环状rna、转运rna、微rna、剪接的或可变剪接的rna以及pre-rna。如在本专利申请的说明书和权利要求书中所使用的,当提及相互作用的发夹探针时,“rna”包括具有天然核糖核苷酸和磷酸二酯键的寡核糖核苷酸,还包括含有一个或多个非天然核苷酸(例如,pna核苷酸、lna核苷酸或2’-o-甲基核糖核苷酸)的寡核糖核苷酸。
“dna”。如在本专利申请的说明书和权利要求书中所使用的,当提及相互作用的发夹探针时,“dna”包括具有天然脱氧核糖核苷酸和磷酸二酯键的寡脱氧核糖核苷酸,还包括含有一个或多个非天然核苷酸(例如,pna核苷酸、lna核苷酸或2’-o-甲基核糖核苷酸)和非天然主链的寡脱氧核糖核苷酸。
“核酸”。如在本专利申请的说明书和权利要求书中所使用的,当提及靶分子或靶序列时,“核酸”是指rna或dna,在任何情况下均包括具有天然核苷酸和磷酸二酯键的寡核苷酸;或者当提及相互作用的发夹探针时,包括具有天然核苷酸和磷酸二酯键的rna和dna寡核苷酸,还包括含有一个或多个非天然核苷酸(例如pna核苷酸、lna核苷酸或2’-o-甲基核糖核苷酸)的rna和dna寡核苷酸。
“相邻地”。如在本专利申请的说明书和权利要求书中所使用的,为了描述成对的相互作用的发夹探针的杂交,“相邻”是指彼此足够接近以允许相互作用的发夹探针之间相互作用的位点。优选的选择是“紧邻”,其中两个相互作用的探针的结合位点之间没有间隙。
“靶分子”、“靶链”、“靶序列”和“靶序列区”或“子序列”。如在本专利申请的说明书和权利要求书中所使用的,靶分子或靶链是包含一个或多个靶序列的核酸链,其是rna或dna。“靶序列”是通过一种或多种常规的被动标记的探针或通过本发明的一对或多对相互作用的发夹探针所探测的rna或dna靶链中的序列,其中信号放大导致单一颜色的信号。如果一组两个或多个常规的被动标记的探针或一组两对或更多对相互作用的发夹探针靶向相同的靶序列,则该组中的每个常规的被动标记的探针或该组中的每对相互作用的发夹探针均靶向靶序列的单独的靶序列区域(或子序列)。在用于同时检测一个或多个靶分子(或靶链)中的两个或多个靶序列的多路方法中,每个靶序列通过一个或多个常规的被动标记的探针或一对或多对本发明的相互作用的发夹探针进行探测,其中信号放大对每个靶序列产生不同颜色的信号。
“被动标记的”。如在本专利申请的说明书和权利要求书中所用的,为了描述与来自现有技术(choi等人(2014))的探针相对应的杂交探针,“被动标记的”是指起始子序列,无论是hcr起始子序列或rca起始子序列被附加到靶序列互补序列的至少一个末端。这样的探针中的起始子没有被隔离在阻止其起起始子作用的结构中。相反,被动标记的杂交探针的起始子序列可以起始信号放大,无论探针是结合至其特异性靶序列还是结合至非特异性位点。
解释附图
在图中,彼此互补的序列用相同的字母表示,并且一个用撇号(’)表示以区分互补序列。因此,在图中,序列a和a’彼此互补,序列b和b’,i5和i5’,等等也是一样。
荧光原位杂交(fish)
根据本发明的方法是fish方法。fish(荧光原位杂交)是众所周知的用于检测细胞中核酸靶标的方法。首先将细胞固定(通常用甲醛或多聚甲醛)并且透性化(通常用乙醇或洗涤剂),以允许引入核酸杂交探针。本发明不限于特定的用于将细胞固定和透性化的方法;可以使用与原位探针杂交以及hcr或rca扩增兼容的任何固定和透性化方法。例如,choi等人(2014)教导了用4%多聚甲醛固定胚胎并用甲醇透性化(choi等人(2014)s1.1的补充信息)。shah等人(2016)development143:2862-2868教导了用4%多聚甲醛固定小鼠脑切片并通过称为“pact清除”的技术进行透性化,该技术包括在8%sds去污剂在1x磷酸盐缓冲盐水(pbs)中孵育(shah等人(2016),补充材料和方法)。chen等人(2016)naturemethods13:679-684和补充材料教导了用10%福尔马林固定培养的细胞,并通过在70%乙醇中储存使固定的细胞透性化(chen等人(2016),补充方法)。在实施例中所报告的我们的工作中,我们使用1xpbs中的4%甲醛固定10分钟,并用70%乙醇透性化30分钟。
在最简单的fish方法中,然后添加与所选的靶序列互补的荧光团标记的线性(或无规卷曲)的杂交探针,例如dna探针,并洗去未杂交的探针(即未杂交的探针的拷贝)。然后检测荧光。最简单的fish方法仅足以检测大量的靶分子。为了检测稀少的靶分子,特别是为了在单分子水平检测稀少的靶分子,fish方法必须包括增加从单个靶分子发出的荧光的方法。一种通用的方法是信号放大。本发明涉及包括两种信号放大方法之一的fish方法:杂交链反应(hcr)和滚环扩增(rca)。根据本发明的方法利用fish以高水平的灵敏度检测rna和dna靶标,某些优选的实施方案能够实现单分子灵敏度,有时称为单分子fish(sm-fish)。下面的讨论主要集中在rna靶标的检测上。dna检测所需的特殊调整将单独描述。
杂交链反应(hcr)
本发明的某些方法涉及并采用fish,其包括被称为hcr即杂交链反应的信号放大方法,用于检测固定和透性化的细胞中的单个核酸分子(单分子fish,缩写为sm-fish)。对于特定的核酸靶序列,例如rna靶序列,使用常规hcr信号放大的检测采用一种杂交探针,或更经常地,使用一组若干种杂交探针。通常,探针组中的杂交探针或多个杂交探针没有被荧光团标记。每个杂交探针上均连接有3’尾部、5’尾部或3’尾部和5’尾部二者,它们均不与靶序列杂交。相反,每个尾部都包含末端hcr“起始子”序列。我们将当与它们的靶序列结合时具有游离(未隔离的)起始子序列的杂交探针称为“被动标记的探针”。用hcr检测rna靶序列或dna靶序列也采用了一对荧光团标记的发夹寡核苷酸,有时称为hcr单体,其中之一与杂交探针的起始子序列相互作用以开始hcr扩增。现有的hcr检测方法的基本原理如图1所示,其描绘了显示单个探针与单个核酸靶序列杂交的方法,其中杂交探针包括单个hcr起始子序列。按照fish方法的惯例,无论是在培养物中还是在组织切片中,细胞都是固定和透性化的。与核酸靶序列例如rna靶序列互补的杂交探针被添加到固定和透性化的细胞中,并被孵育以使探针与靶序列杂交。在添加hcr单体之前,洗涤样品以除去未结合的探针拷贝。从下面的描述中将会意识到,这种去除是至关重要的,因为无论是特异性(正确)杂交的还是非特异性结合的,探针的拷贝都能够起始hcr扩增。然后通过添加荧光团标记的hcr单体并孵育来进行hcr。然后通过洗涤除去未使用的hcr单体,然后通过显微镜或流式细胞术检测荧光。
图1描绘了由单个被动标记的杂交探针11起始的hcr所产生的信号放大,该探针11包括与核酸靶分子10中的靶序列ts1互补的探针序列p1。杂交探针11还包括充当5’尾的起始子i1,其含有片段a’和b’。起始子i1通过间隔子s1连接至探针序列p1。图1还示出了一对hcr发夹寡核苷酸(hcr单体),即荧光团标记的发夹寡核苷酸h1和h2。单体h1包含单链5’末端序列a(被称为“立足点”序列)和包含茎b-b’(包含杂交的臂序列b和b’)和单链环序列c’的茎环发夹。立足点序列a是茎臂b的单链延伸。h1的四个序列依次为5’-a-b-c’-b’-3’。显示发夹单体h1仅含有单个3’末端荧光团o。单体h2包含单链末端立足点序列c,和包含茎b’-b(包含杂交的臂序列b’和b)和单链环序列a’的茎环发夹。四个序列依次为3’-c-b-a’-b’-5’。hcr单体h2还含有单个5’末端荧光团o。h1和h2上的荧光团o相同。单体也可以被多个荧光团o的拷贝标记。
图1是由起始子序列i1起始的hcr扩增的示意性流程图。将第一探针11添加到含有已被固定和透性化的细胞的样品中并与之孵育。如图1顶部所示,探针序列(靶标序列互补序列)p1与靶标序列ts1杂交,但是间隔子序列s1和起始子序列i1不杂交。因此,包含序列a’、b’的起始子序列i1通过探针序列pi结合(或栓系)至靶序列ts1,但保持单链。在通过洗涤除去探针11的未结合拷贝之后,如图1的右上方所示,将一对hcr单体h1和h2添加到含有靶分子10和杂交探针11的经洗涤的样品中。
在杂交条件下将hcr单体h1和h2与含有杂交的探针11的样品一起孵育导致hcr信号放大,如下所述。参考图1中的第二示意图,起始子序列i1的序列a’与h1立足点序列a杂交,形成通过链置换而延伸的杂交体,由此起始子序列b’与h1序列b杂交,从而开始hcr聚合。这种杂交和链置换反应在杂交条件下是不可逆的,它将单体h1的茎b-b’分开,结果是h1序列c’、b’变成如图所示的单链3’末端区域,并且可用于作为单体h2的起始子序列i2。因此,现在为单链的h1序列c’与h2立足点序列c杂交,形成通过链置换而延伸的杂交体,从而继续hcr聚合,如图1的第三示意图所示。该第二杂交和链置换反应在杂交条件下也是不可逆的,将h2的茎b’-b分开,结果是在生长的聚合物链的末端,h2序列a’、b’变成与原始起始子序列i1相同的单链5’末端区域,如图1中的第三示意图所示。然后,如图1所示,h2的单链序列a’、b’可以添加另一种h1单体。这导致生长的双链hcr聚合物hcr-p,如图1的底部示意图所示,其在一条链中具有一系列单体h1,并且在互补链中具有从起始子序列i1延伸的一系列h2单体。通过洗涤除去未结合的h1和h2单体,并通过显微镜或流式细胞术检测荧光。被动标记的探针(例如探针11)易于产生错误信号,因为hcr对特异性结合的和非特异性结合的探针均能很好地工作。
如果起始子序列i2作为3’标签包含在探针11(3’-b’-c’-p1)中,则它也可以起始相同的hcr单体h1和h2的hcr聚合。起始子序列12的序列c’如上所述地与h2立足点序列c杂交,以上述方式起始聚合反应,以产生第二种hcr聚合物,其从h2而不是h1开始并从探针序列p1的3’末端延伸。此外,可以通过改变探针11的靶序列互补序列来制备一组探针,以与靶序列ts1中的其他序列杂交。
采用滚环扩增(rca)的sm-fish
本发明还包括用于或能够进行sm-fish检测的试剂和方法,其包括通过滚环扩增(rca)进行的信号放大。首先,我们描述了图2中所描绘的rca可以与被动标记的杂交探针一起使用的方式的概念,该图给出了杂交、rca扩增和用检测探针进行检测的示意性流程图,该检测探针在此显示为荧光团(o)标记的检测探针lp。图2左侧的第一示意图显示了与含有靶序列ts2的靶链20杂交的探针21。杂交探针21包含靶序列特异性部分p2、间隔物s5和rca起始子i5,其是当探针序列p2与靶序列ts2结合时保持为单链的dna序列。起始子序列i5是具有游离3’末端的引发序列。探针21与固定和透性化的细胞中的靶标杂交,并且如上文针对hcr方法所述地通过洗涤除去过量的未结合的探针。
此后,利用环状dna模板ct对样品进行rca,该环状dna模板ct含有与探针的起始子序列i5互补的序列i5’,并且还含有检测探针结合序列pbs。将模板ct和dna聚合酶添加到经洗涤的样品中,然后在rca条件下孵育。起始子(引物)序列i5与模板ct的序列i5’杂交,如图2的第二示意图所示。然后连续复制模板ct多次,即通过dna聚合酶进行聚合,如图2的第三示意图所示。由于模板ct是环状且无尽的,因此产生很长的单链dna扩增产物ap,其含有许多串联重复的环状模板ct的拷贝,如图所示。可以将环状模板预先添加到反应中,或者可以使用线性版的ct原位产生,首先将其结合到i5,然后通过添加连接酶将其变成环状。扩增产物ap通过杂交探针21保持栓系在靶序列ts2上。洗去未结合的模板ct,添加检测探针lp,并在杂交条件下与样品一起孵育。如图2的最终示意图所示,具有片段pbs环状模板ct的序列的标记的探针lp与扩增产物ap中的环状模板ct的每个拷贝杂交。标记的探针lp包括至少一个荧光团o。在图2所描绘的实施方案中,探针lp是标记有单个荧光团的线性(无规卷曲)探针。标记的探针lp的许多拷贝结合在一起,使靶序列ts2发出强烈的荧光。通过洗涤除去过量的未结合的标记的探针lp,并通过显微镜或流式细胞术检测荧光。可以使用分子信标探针代替单个标记的探针lp,以消除通过洗涤除去后者的需要。与hcr一样,用于启动rca的被动标记的探针(例如探针21)容易产生错误信号,因为rca对特异性结合的和非特异性结合的探针均能很好地工作。
采用hcr的本发明的方法和试剂
本发明的检测方法是sm-fish方法,其包括如上所述的使细胞固定和透性化、使探针与细胞中的核酸靶序列例如mrna序列杂交以及如上所述地使一对hcr发夹寡核苷酸(hcr单体)聚合。本发明的方法与先前已知的采用hcr扩增的fish方法的不同之处尤其在于用于起始hcr聚合的杂交探针的设计和构建。本发明的方法不是使用由能够起始hcr的起始子序列被动标记的杂交探针(无论该探针是与靶序列杂交还是与非特异性位点结合),而是使用仅当与预期的核酸靶序列(例如mrna靶分子中所选的靶序列)杂交时才起始hcr信号放大的本发明的探针。本发明的杂交探针包含一对相互作用的茎环寡核苷酸,我们称之为一对相互作用的发夹寡核苷酸探针,优选由dna组成,其在已通过荧光原位杂交(fish)方法固定和透性化的样品中在核酸靶链的靶序列上相邻地杂交,所述靶序列可以是dna链或rna链(例如mrna链)。
a.本发明的一对相互作用的发夹探针及其相互作用
图3a中示出了根据本发明的一对相互作用的发夹探针及其相互作用的示意性流程图的实施方案。探针对包括第一“供臂发夹探针”31,我们有时称之为“供臂信标”。探针31是具有茎e-e’和单链环序列p3的茎环寡核苷酸,其与靶核酸分子30的靶序列ts3互补。茎的杂交臂之一,“供体臂”,包括末端单链延伸f’。探针对还包括第二“臂受体发夹探针”32。探针32是具有茎f’-f和单链环序列g’的茎环寡核苷酸。茎的臂之一包括单链延伸,其包含末端靶标互补序列p4,并且在所示的实施方案中,还包含立足点序列e。
根据本发明的sm-fish方法包括检测细胞样品中靶序列的步骤,该细胞样品包括或被怀疑包括该靶序列的靶分子:
a)固定和透性化样品中的细胞;
b)洗涤经固定和透性化的细胞;
c)将含有经洗涤的细胞的样品与至少一对根据本发明的相互作用的发夹探针一起孵育;
d)优选但非强制性地,洗涤经孵育的细胞以除去未杂交的探针;
e)在步骤c)或步骤d)(如果包括的话)之后,添加聚合试剂并孵育以产生扩增产物,所述聚合试剂对于hcr信号放大包含至少一对荧光团标记的hcr单体,或者对于rca信号放大包含至少一种环状dna模板和dna聚合酶;
f)洗掉过量(未使用)的hcr发夹寡核苷酸单体或过量(未使用)的rca环状模板;
g)对于rca信号放大,针对每个靶序列添加并孵育荧光团标记的检测探针,然后通过洗涤除去过量的检测探针;和
h)通过显微镜或流式细胞术检测所述细胞中的荧光。
图3a中描绘的相互作用的探针对如下起作用。当将含有固定和透性化的细胞的样品与探针对31、32一起孵育时,如图3a中的第二示意图所示,这对探针首先通过它们的靶标互补序列(在这里是环序列p3和延伸序列p4)与靶序列ts3杂交。根据本发明的相互作用的探针对的探针(在这里是探针31、32)“相邻地”杂交,即彼此足够接近以使其相互作用,如图3a中间示意图所示。“相邻地”是指根据本发明的相互作用的探针对的靶标互补序列(或“探针序列”,在这里是探针序列p3和p4)在它们之间没有任何间隙或它们之间只有很小的间隙地杂交,该间隙仍然允许它们预期的相互作用,优选不超过4-5个核苷酸的缺口。环序列p3的杂交导致探针31的茎e-e’打开,从而供体臂e’、f’变成单链。延伸p4的杂交不引起探针32的茎f’-f打开。在结合至靶标后,如图23a中间的示意图所示,杂交且开放的探针31与杂交探针32相互作用。在图3a所示的实施方案中,探针31的臂序列e’与杂交探针32的立足点序列e杂交,形成杂交物e’-e。通过链置换,杂交物e’-e延伸,从而打开探针32的茎f’-f,并将包含环g’和臂f’的序列转变成3’末端单链序列g’、f’,它们共同形成hcr起始子序列i3。
图3b示出了一对hcr发夹寡核苷酸(hcr单体),即,荧光团标记的发夹寡核苷酸h3和h4。单体h3包含单链3’末端序列g(被称为“立足点”序列)以及包含茎f-f’(包含杂交的臂序列f和f’)和单链环序列h’的茎环发夹。立足点序列g是茎臂f的单链延伸。h3的四个序列依次为3’-g-f-h’-f-5’。单体h4包含单链末端立足点序列h以及包含茎f’-f(包含杂交的臂序列f’和f)和单链环序列g’的茎环发夹。四个序列依次为5’-h-f-g’-f’-3’。hcr单体h3和h4被相同的荧光团i标记。(该荧光团显示为未填充的星形,以反映以下事实:如果单体对h1、h2和单体对h3、h4用于相同的反应,如以下结合图4所讨论的,则单体对h1、h2上的荧光团与单体对h3、h4上的荧光团具有不同的颜色)。
在通过上述方法产生起始子序列i3之后,进行hcr信号放大。在探针31和32相互作用以产生hcr起始子i3之后,洗掉未结合的探针。然后添加hcr单体h3和h4,并在杂交条件下与样品一起孵育。释放的起始子序列i3的序列g’(图3a)与hcr单体h3的立足点序列g杂交,形成通过链置换而延伸的杂交体,由此i3起始子序列f’与h3序列f杂交,从而开始hcr聚合。这种杂交和链置换反应在杂交条件下是不可逆的,它将单体h3的茎f-f’分开,结果是h3序列h’、f’变成如图所示的单链3’末端区域,其可以用作单体h4的起始子序列i4。因此,现在是单链的h3序列h’与h4立足点序列h杂交,形成通过链置换而延伸的杂交体,以上文结合图1所讨论的方式继续hcr聚合。该第二杂交和链置换反应在杂交条件下也是不可逆的,其将h4的茎f’-f分开,结果是在增长的聚合物链的末端,h4序列g’、f’变成与原始起始子序列i3相同的单链3’末端区域,导致除单体单元h3和h4之外与如图1所示类似的hcr聚合物的生产。通过洗涤除去未结合的h3和h4单体,并通过显微镜或流式细胞术检测荧光。
相互作用的发夹探针31-32仅在该对在靶序列ts3上相邻地杂交时才产生hcr起始子序列g’、f’(i3)。当在溶液中游离或非特异性结合时,探针31不开放并且供体臂e’、f’不以单链形式存在,并且因此不能与探针32相互作用,这保留其茎环结构。因此,起始子序列g’、f’(i3)被隔离,即不能以起始hcr聚合所需的单链形式获得。第一探针31在结构和功能上类似于未标记的分子信标探针,两者都是众所周知的。参见,例如,tyagi等人(1998)naturebiotechnology16:49-53;和bonnet等人(1999)proc.natl.acad.sci.(usa)96:6171-6176。探针31对于预期的(正确的)靶序列ts3是非常特异性的。它可以设计成错配耐受的,即,即使靶序列ts3含有相对于环p3的一个或两个错配的核苷酸,也可以杂交并打开;或者可以将其设计为等位基因区分的,即,如果环p3与完全互补的靶序列ts3杂交,则其杂交并打开,但如果靶序列ts3含有相对于环p3的单个错配核苷酸,或者如果是非特异性结合的,则其不打开。因此,利用本发明的方法,有可能仅从靶序列(例如含有单核苷酸多态性(snp)的靶序列)中多个紧密相关的等位基因中的一个起始hcr信号放大。除非与开放探针31相邻地杂交,否则探针32将不开放并产生单链起始子序列i3。因此,即使探针32不是分子信标类型并且因此更易于通过线性序列p4非特异性地结合,例如与靶链30或细胞基质中其他地方的错配序列杂交,探针32也不会打开,这归因于以下事实:它必须与开放的探针31相邻地杂交才能打开并产生单链序列i3。因此,只有第一探针正确地杂交,并且只有第二探针与其相邻地杂交(这意味着正确地杂交),才会产生单链hcr起始子序列。溶液中的或非特异性结合的探针32的拷贝不会起始hcr单体h3、h4的hcr扩增,并且因此不会导致背景的产生。因此,根据本发明的方法具有低背景,甚至在探针杂交和hcr扩增之间没有洗涤步骤的实施方案中也是如此。然而,由于茎杂交体是动态的并且经受“呼吸”,所以有可能溶液中极少的探针31的拷贝会短暂地打开并接触探针32的拷贝,从而导致hcr扩增。为了防止这种可能性,本发明方法的优选实施方案包括在添加单体h3、h4之前的洗涤步骤,以防止产生甚至低水平的背景信号。
在上面的设计中,供臂信标31中的探针序列被发夹的两个臂结合,如上所述,这赋予了探针更高的特异性。另一方面,臂受体探针32上的探针序列是末端序列。如果使用者也想赋予该探针更高的特异性,可以向探针序列p4的5’添加形成发夹的臂序列。例如参考图3中的探针32,序列e’将被附加到探针的5’端。采用该附加,游离探针32将包含两个发夹f’、g、f和e、p4、e’。与靶标结合后,后一发夹将松开并使立足点序列成为单链。起始子随后的链置换和暴露将如上所述地发生。该修饰将进一步确保游离探针不彼此相互作用。
在以下实例中,我们说明了对给定的靶序列使用产生hcr起始子序列的单个相互作用的探针对成功地进行sm-fish检测。可以通过改变两个探针的靶序列互补序列来制备一组探针对,以使不同的探针对在靶序列上的不同位置杂交,产生相同的起始子,并与同一对hcr单体起始hcr聚合反应,以产生更强的荧光信号。
b.用于两个紧密相关的等位基因的根据本发明的两个相互作用的探针对
本发明的某些实施方案包括检测或者检测并定量两个紧密相关的等位基因或靶序列变体之一或两者(如果存在的话)的方法。等位基因之间的差异可以包括一个或多个核苷酸的取代、缺失或插入。差异还可以包括剪接变体。优选地,靶序列中的差异包含在供臂探针的结合区域内,尽管也可以检测到跨越供臂探针和臂受体探针的结合区域的更长的差异。检测和定量可以提供单分子灵敏度和分辨率。两个紧密相关的等位基因中的一个或两个(如果存在)的检测利用两对相互作用的发夹探针和两对不同标记的hcr单体,每个等位基因对应一个探针对和一个单体对,如图4所示。图4给出了两个平行的流程图,每个探针对一个。
图4示出了两个不同的核酸靶分子,它们是密切相关的等位基因变体。靶分子41含有第一靶序列变体,出于解释的目的,我们将其称为野生型靶序列变体wtts。靶分子46含有第二靶序列变体,出于解释的目的,我们将其称为突变型靶序列变体mtts。靶序列变体是密切相关的等位基因,它们的差异在于单个核苷酸取代。靶序列变体wtts具有以空心圆(○)43表示的野生型核苷酸,而靶序列mtts具有以实心圆(λ)45表示的取代的突变核苷酸。靶序列变体wtts和mtts以及靶链41和46在其他方面是相同的。起始样品可以含有链41和46中的一个或两者。
在图4的顶部示意图中示出了两对相互作用的探针,它们在溶液中游离存在:一对包括提供臂发夹探针48和臂受体探针47,以及一对包括供臂发夹探针49和臂受体探针50。为了说明的目的,左侧的相互作用的探针对48和47以虚线绘制,而右侧的相互作用的探针对49和50以实线绘制。首先考虑后一对,探针49和50分别具有图3a中探针31和32的结构,并且它们在两个图中被相同地标记。当在靶序列mtts上相邻地杂交(图4中右侧的中间示意图)时,它们的相互作用释放起始子序列i3(图4中右侧的底部示意图)。如上文与图3a和3b相关地描述的,起始子i3起始hcr单体h3和h4的hcr聚合(图3b)。hcr单体h3和h4被相同的荧光团i单一地标记。探针49的环p3与靶序列变体mtts完全互补。它包括核苷酸44(实心圆λ),其与靶链46的靶序列mtts中的核苷酸45(实心圆λ)互补,但与链41中靶序列wtts中的核苷酸43(空心圆○)错配。我们有时将核苷酸42和44中的每一个称为“询问核苷酸”。供臂探针49是等位基因区分的:当与靶序列mtts杂交时,它打开,但如果与靶序列wtts接触或者如果它非特异性结合,则它不杂交并打开。
转向探针对48和47,供臂发夹探针48是等位基因区分的茎环寡核苷酸。其靶序列互补环p5与靶序列变体wtts完全互补。它包括核苷酸42(空心圆○),其与靶链41的靶序列wtts中的核苷酸43(空心圆○)互补,但与靶序列46中的核苷酸45(实心圆λ)错配。探针48还包括茎d-d’。茎臂d’(供体臂)包括末端的单链延伸b’。探针47是“臂受体发夹”探针,即,具有茎b’-b和单链环序列a’的茎环寡核苷酸。茎的一个臂,这里是3’臂b,包括单链延伸,其包含靶标互补序列(或区域)p6,并且在所示的实施方案中,还包含立足点序列d。当在靶序列wtts上相邻地杂交(图4左侧的中间示意图)时,探针47、48的相互作用释放起始子序列i1(图4左侧的底部示意图)。起始子i1起始hcr单体h1和h2的hcr聚合,如以上结合图1所述。hcr单体h1和h2被相同的荧光团o单一地标记,该荧光团的颜色与用于标记hcr单体h3和h4的荧光团i的颜色不同。供臂探针48是等位基因区分的:当与靶序列wtts杂交时,它打开,但如果与靶序列mtts接触或者如果它非特异性结合,则它不杂交且不打开。
重要的是要注意,每个供体信标探针的供体臂比其互补臂长。例如,探针49的5’臂比其3’臂长,这是因为5’臂除了茎元件即序列e’之外还含有序列元件f’。如果探针49成功结合至靶序列mtts,如图4中右侧的中间示意图所示,则序列元件e’(立足点互补序列)是游离的(未在茎中杂交)并且准备与探针50中的序列元件e(立足点)结合,如图4中右侧的中间示意图所示,然后置换探针50中的序列元件f’,产生包含序列g’和f’的单链起始子i3(图4右侧的底部示意图)。如果探针48成功结合至靶wtts,则序列元件d’(立足点互补序列)是游离的,并且准备与探针47中的序列元件d(立足点)结合,如图4的左侧的中间示意图所示,然后置换探针47中的序列元件b’,产生包含序列a’和b’的单链起始子序列i1。
为了能够在一次测定中检测靶序列变体wtts和mtts中的一个或两者,将两个相互作用的探针对中的所有四个探针在杂交反应中与含有固定和透性化的细胞的样品同时孵育,但是如图4的中间示意图所示,四种探针中只有三种结合到给定的靶序列变体(在此为wtts或mtts)。右侧的受体探针50和左侧的受体探针47总是与两个等位基因靶序列变体结合,但是仅一个供体信标在它们之间结合。当靶序列变体是野生型(空心圆○表示的可变核苷酸)时,探针48结合,而当靶序列变体是突变型(实心圆λ表示的可变核苷酸)时,探针49结合。如果样品中同时存在这两种靶序列变体,则探针47、49和50结合至靶序列变体mtts的拷贝,且探针47、48和50结合至靶序列变体wtts的拷贝。臂受体探针47和50与这两个靶序列变体(如果在样品中存在的话)与单个核苷酸差异区域的左侧和右侧(供臂发夹探针48结合以及供臂发夹探针49结合)相邻地结合。
在孵育以允许探针49、50或探针48、47或两者(取决于哪些靶序列或序列存在于样品中)之间的杂交和相互作用之后,通过洗涤除去未杂交的探针,并添加hcr单体h3、h4、h1和h2,导致一种或两种hcr聚合物的产生。聚合后,通过洗涤除去未结合的(过量)hcr单体。单链起始子序列i1(如果存在野生型靶序列wtts,则其产生)的可用性导致hcr发夹寡核苷酸h1和h2的聚合(图1)。该扩增产生一种颜色的荧光信号(例如tmr)。另一方面,单链起始子序列i3(如果存在突变靶序列mtts,则其产生)的可用性导致hcr发夹寡核苷酸h3和h4的聚合(图3)。该扩增产生不同的、光谱上不同颜色的信号(例如cy5)。hcr扩增后,通过显微镜或流式细胞仪检测来自两种荧光团的荧光。在通过显微镜检测中,放大的荧光信号被检测为不同颜色的斑点,由此一个或两个等位基因的存在通过不同颜色的斑点的存在来指示,并且具有每种等位基因的靶链的相对丰度通过两种颜色的斑点的比率来指示。哪种供体信标被设计用于野生型靶序列变体是任意的,并且核苷酸42和44可以颠倒。
供臂探针49与靶序列mtts的结合不导致相邻地杂交的臂受体探针47的茎打开,因为两种探针中的相关序列是不同的而不是互补的(探针47中的序列d和探针49中的序列e’不是互补的,探针47中的序列b和探针49中的f’不是互补的)。探针48不能引起来自探针50的任何响应,原因与探针49不能引起来自探针47的任何响应相同。
图5示意性地显示了图4的探针的杂交和相互作用,该探针被修饰以从臂受体探针47和50消除立足点序列,并从供臂探针48和49消除立足点互补序列。靶序列与图4所示相同。臂受体探针60(图5)包括单链延伸p4而不是单链延伸e和p4(图4)。已从探针50中消除了立足点序列e,以产生探针60。对于臂受体探针57也是如此,其中单链延伸是p6而不是单链延伸d和p6(图4)。已消除了立足点序列d。供臂探针59包括供体臂f’来代替供体臂49的供体臂e’、f’(图4)。已从探针49中消除了立足点互补序列e’,以产生探针59。对于供臂探针58也是如此,其中供体臂是b’而不是d’、b’(图4)。已从探针48中消除了立足点互补序列d’,以产生探针58。
可以看出,在探针48(图4)中,茎形成核苷酸是序列d和d’中的核苷酸,二者均从探针58中消除(图5)。在图5所示的实施方案中,探针58的5’茎臂(称为bsub)源自序列b的一部分,使得茎仍然可以在探针58中形成。对于供臂探针59也是如此,其中序列e和e’已被消除。探针59的3’茎(称为fsub)源自序列f的一部分,使得茎仍可以在探针59中形成。
图5中使用相互作用的探针对产生hcr起始子序列的方法与上文图4中对于相互作用的探针对所述的方法相同,且产生的起始子序列也相同。当供臂探针59与靶序列mtts杂交时,如图5右侧中间的示意图所示,其释放的供体臂(序列f’)与探针60中的茎臂f的长度相同;没有立足点序列。然而,我们已经发现,探针59与探针60相互作用,释放起始子i3,如图5右侧下部的示意图所示。类似地,当供臂探针58与靶序列wtts杂交时,如图5左侧中部的示意图所示,其释放的供体臂(序列b’)与探针57中的茎臂b的长度相同;没有立足点序列。尽管如此,探针58与探针57相互作用,释放起始子i1,如图5左侧下部的示意图所示。然而,供臂发夹探针的供体臂中的立足点互补序列具有双重功能,当探针在溶液中游离时维持发夹构型,并在与靶标结合后与臂受体探针相互作用,这样的事实允许非常短或者如图5所示的0-nt立足点互补片段的探针设计。实施例中描述了没有任何立足点序列的相互作用的发夹探针对的设计。没有任何立足点序列的相互作用的发夹探针很好地起作用的事实是令人惊讶的,并且是本发明的一个方面。
c.显露两个被掩盖的起始子序列并从单独一对hcr单体产生hcr信号的供臂信标探针
为了用相互作用的发夹探针体系增加信号,对每个靶序列利用暴露两个hcr起始子序列而不是一个序列的一组探针是有利的。这两个起始子序列将从相同的hcr单体对起始扩增,从而产生相同颜色的信号。这种体系的一个实例在图6中给出。该体系包括两个相互作用的探针对(62、61和62、50),其包括三个探针61、62和50(图6,顶部)。这两个探针对共享相同的供臂探针62。这三个探针含有与靶分子46的靶序列mtts杂交的靶标互补序列p6、p3和p4。应当理解,在该实施方案中,靶序列可以是突变序列,但不是必须的。这三种探针在靶序列上相邻地杂交,如图6中间的示意图所示。它们被设计为从单体h3和h4起始hcr扩增(图3b)。当探针在溶液中游离时,供臂信标62通过存在于靶序列互补环p3的任一侧上的序列元件e和e’的结合而形成分子内茎。该探针还含有序列元件f’的两个拷贝,作为茎元件e和e’的单链延伸。当探针62中的e和e’彼此结合时,f’序列的两个拷贝不彼此结合或相互作用且保持单链。与附图中描绘的其他供臂信标探针不同,供臂信标62可以将其两个臂贡献给位于其两侧各侧的受体发夹探针。如先前针对图4所述,臂受体探针50含有(3’至5’)序列元件f’、g’、f,其后是靶标互补序列p4。臂受体发夹61含有(3’至5’)靶互补序列p6、序列元件e’、f、h’和f’。三种探针的杂交导致供臂信标62中发夹茎e-e’的破坏,同时产生将探针62的开放茎臂e与臂受体发夹61中的立足点序列e’结合以及将探针62的开放茎臂e’与臂受体发夹50中的立足点e结合的可能性(图6,中间)。这些结合导致两个臂受体探针中的链置换。臂受体探针50中的链置换使得hcr起始子序列i3(环g’和臂f’)为单链。臂受体探针61中的链置换使得hcr起始子序列i4(环h’和臂f’)为单链(图6,底部)。释放的起始子序列i3可以从hcr单体h3开始起始单体h3和h4的hcr扩增,且释放的起始子序列i4可以从hcr单体h4开始起始单体h3和h4的hcr扩增。两种扩增反应均导致基本上相同的聚合产物并产生相同的颜色信号。这与图4中描述的探针体系相反,在图4中,三种探针的相邻结合产生两种可供选择的颜色之一的放大信号。
用于起始rca的一对相互作用的发夹探针
为了克服被动标记的杂交探针(图2)在rca中产生错误信号的趋势,可以按照与上文针对hcr所述方法相似的方式部署本发明的相互作用的发夹探针对。在图7中描绘了根据本发明的rca方法,其给出了rca实施方案的示意性流程图。为了易于理解,与探针31、32(图3)的元件共有的相互作用的发夹探针71、72的元件被赋予与图3中相同的标号。图7中的其他元件与图2中的元件共有并被赋予与图2中相同的标号。
在图7中的第一示意图示出了含有靶序列ts3的靶分子30和相互作用的发夹探针对71、72。臂受体探针72与臂受体探针32(图3)相同,只是用包含环j’和茎臂i’(这得到发夹茎i-i’)的rca起始子(引物)i5(图2)代替了包含环g’和茎臂f’的hcr起始子i3。供臂探针71与供臂探针31(图3)相同,只是供体臂的单链延伸f’被单链延伸i’代替。探针杂交和相互作用如上文结合图3所述进行。然而,探针对71、72的相互作用释放了包含环序列j’和臂序列i’的单链rca起始子序列i5。起始子i5是功能与上文结合图2所描述的相同的起始子。i5是环状模板ct的引发序列。通过dna聚合酶复制ct以产生聚合物ap,荧光团(o)标记的检测探针lp的杂交,以及荧光检测如图2所述进行。简而言之,尽管在图3所示的体系中,相互作用的发夹探针32含有在释放时通过杂交起始聚合反应的起始子序列i3,在图7所示的体系中,相互作用的发夹探针72含有起始子序列i5,其在释放时是通过rca起始聚合的引发序列。
我们注意到,探针71和72中均存在序列i’。探针71中的序列i’永远不能用作引物,因为它的3’端不是游离的(它与序列e’连接)。仅当两个相互作用的发夹探针与它们在靶序列上预期的相邻位点杂交时相互作用之后,探针72中的序列i’才可用于与环状模板ct结合。只有靶标结合探针的相互作用才能启动rca,因为添加dna聚合酶时剩余的游离的或非特异性结合的探针72的拷贝会在它们自身上延伸其3’端(参见探针72结构),这进一步降低了产生错误信号的可能性。因此,尽管我们优选的方法包括在添加扩增试剂之前去除未结合的相互作用的探针的洗涤步骤,但是可以省去这样的洗涤步骤。如上文结合图2所述地检测rca产物ap。为了进一步放大信号,对于单个靶序列可以使用多对相互作用的发夹探针,全部产生相同的起始子序列,其中每对将从相同的环状模板产生rca信号。此外,为了执行不同靶标的多路检测和rca信号放大,可以对每个靶标使用不同的相互作用的发夹探针对,对于不同的环化靶标和标记有不同颜色的不同检测探针,不同的对产生不同的起始子序列。
相互作用的发夹探针的设计和构建
本发明的发夹探针中各种元件的长度和序列的某些方面是相对灵活的,而其他方面是相对受限的。
供臂探针的环序列被设计为与预期的靶序列(其在一些实施方案中包括多个等位基因差异,而在其他实施方案中排除除一个差异之外的所有差异)互补,但与样品中可能存在的其他非靶序列不互补。环被设计为足够长,以确保所需的唯一性。当在溶液中游离或非特异性结合时,供体臂必须包括足以维持其发夹构型的多个核苷酸。此外,无论是错配耐受性的还是等位基因特异性的,当环结合至其预期的靶序列时,其茎必须打开(解离),但如果其非特异性结合,则其不打开。这是本领域技术人员熟知的分子信标探针构造。当供臂探针的发夹是等位基因区分的时,其环的长度受到拒绝等位基因差异(特别是单个核苷酸差异(snv))的需求的限制,因此其通常在10至25核苷酸长之间。在下文的实施例中,对于hcr,环长度/茎长度组合为15/6、12/6、11/6、9/6(不令人满意)和20/11个核苷酸。实施例6描述了对于rca的25/5组合。供臂探针的供体臂必须与臂受体探针的一个茎臂相互作用,以形成比供臂探针的茎更强的杂交体,使得供体臂相对不可逆地相互作用。供体臂包括几个核苷酸的单链延伸,以实现该要求。在下文的实施例中,供体臂延伸的长度为12、17和18个核苷酸。
对于包括hcr信号放大的实施方案,臂受体探针的环和茎的长度和序列由hcr单体的选择决定,因为当通过探针的相互作用而释放时,环和一个茎臂包含hcr起始子序列。类似地,对于包括rca信号放大的实施方式,臂受体探针的环和茎的长度和序列由环状模板的选择决定。臂受体探针在溶液中游离时必须保持其发夹构型,并且当探针杂交时(无论是正确地与其靶序列杂交还是非特异性地杂交),它都不能打开。与供臂探针相比,其环通常较短,而其茎通常较长。在下文的实施例中,对于hcr,臂受体探针的环长度/茎长度组合为8/18个核苷酸。实施例6描述了对于rca的6/20组合。除茎形成核苷酸外,臂受体探针的发夹的一个臂还具有单链延伸,其包括靶标互补序列,并且在某些实施方案中,还包括与供臂探针的供体臂的茎形成序列互补的立足点序列。靶标互补片段的长度可以变化很大,例如15至50个核苷酸。在下文的实施例中,臂受体探针的靶标互补片段对于hcr为19、20、22或24个核苷酸。实施例6描述了对于rca的22个核苷酸的长度。
立足点序列的长度(及其在供臂探针中的互补序列)对等位基因区分的特异性有重要影响:立足点序列越短,探针的区分力就越大。具有3到11个核苷酸长的立足点序列的臂受体探针的功能与一般靶标检测探针一样好。然而,在等位基因区分的实施方案中,用较小的立足点序列实现了更好的等位基因区分,其中,正如我们已经发现的,最好的等位基因区分是由0个核苷酸的立足点序列表现出来的。在下文的实施例中,对于hcr起始,单链延伸的长度以核苷酸计为0-nt立足点加19、20或22个靶标互补核苷酸;5-nt立足点/加上22个靶标互补核苷酸;和14-nt立足点加24个靶标互补核苷酸。对于rca起始所描述的是单链延伸包括22个靶标互补核苷酸和另外的5-nt长的立足点序列的臂受体探针。
当有立足点序列时,供臂探针的茎部分与臂受体探针的立足点序列互补。在实施例3所述的第一探针对中,臂受体探针中的立足点序列为5-nt长,当供臂探针的茎为6-nt长。为了适应该差异,单链延伸从18个核苷酸(与臂受体探针的18-nt长茎臂完全互补)减少到17个核苷酸,其中供臂探针的茎的末端核苷酸贡献第18个核苷酸。因此,根据需要,5’臂的茎形成序列与立足点序列互补,但是长了一个核苷酸,并且单链延伸与其在臂受体探针中的互补序列互补但比它的互补序列短了一个核苷酸。当没有立足点序列时,信标探针的供体臂(包含茎形成核苷酸和单链延伸)与臂受体探针的茎长度相同。
一对相互作用的发夹探针中的每个探针的一部分对靶序列是特异性的,且每个探针的另一部分是通用的,并且可以与许多不同靶序列的不同探针对一起使用。参考图3,例如,在臂受体探针32中,发夹茎环和立足点序列(f’-g’-f-e)是通用部分。仅靶标互补序列p4是靶标特异性的。类似地,在供臂探针31中,仅环p3是靶标特异性的。在上述实施方案中,探针的通用部分是连续单链核酸分子例如dna分子的部分。本发明的一个方面是,相互作用的发夹探针的通用部分和靶标特异性部分可以通过非磷酸二酯键彼此连接,且探针在以靶标依赖性方式从hcr或rca中产生的放大信号中仍具有良好的功能。例如,探针的通用部分可以通过点击化学连接到靶标特异性部分(baskinjm,等人(2007)proc.natl.acad.sci.usa104(43):16793-16797)。连接两个组分的其他方法对于本领域技术人员将是显而易见的。以这种方式将通用部分连接到靶标特异性部分能够节省探针合成中的大量成本,因为不必重复合成相对较长的通用部分,并且对每个不同的靶序列只需要合成相对较短的靶标特异性部分。
为了用本发明的探针检测dna靶标,需要对杂交程序进行特殊调整。由于细胞dna是双链的,因此不容易被用于杂交的探针接近。为了使此类dna靶序列可接近,在变性剂的存在下对固定和透性化的细胞进行热处理(vargas等人(2005)proc.natl.acad.sci.usa102:17008-17013)。例如,在80℃下在2xssc和70%甲酰胺的存在下将细胞孵育10分钟使基因组dna充分变性,以允许随后在正常条件下与寡核苷酸探针(包括本发明的相互作用的探针对)杂交。此外,为了使从dna靶标转录并存在于细胞中的任何rna种类都不会遮盖来自dna靶标的荧光信号,可以在添加相互作用的发夹探针之前通过用核糖核酸酶a预先处理来除去细胞rna。通常,在给定的细胞核中,非重复的核dna靶序列仅以两个拷贝存在(每个染色体上一个)。因此,每组相互作用的发夹探针仅产生两个斑点,并且它们位于细胞核内。检测dna靶标的另一个考虑因素是,由于dna/dna杂交体比相互作用的dna发夹探针对和rna靶序列之间形成的rna/dna杂交体稳定性稍差,因此如果靶序列是dna,则探针对的靶标互补片段通常相对较长。
对实施例的解释
实施例1比较了靶序列特异性信号的水平和背景信号的水平,这些信号是在用根据本发明的单对相互作用的dna发夹探针起始在固定和透性化的细胞中检测rna靶序列和hcr扩增时所获得的或者是在用图1所示类型的单个被动标记的dna杂交探针起始hcr时所获得的。发夹探针对的结构在图3中总体上示为探针31和32,只是不存在如图5所示的探针59和69中的立足点序列。我们进行了若干次分析。在第一个分析中,我们对转染以表达gfp(包括用于杂交探针的gfp靶序列)的细胞进行了显微成像,我们还对经历相同的探针和hcr扩增的未转染的细胞进行了成像。图8中示出了代表性的图像。cy5通道中出现的荧光斑点来自cy5标记的hcr聚合物。使用先前描述的算法(raj等人(2008)naturemethods5:877-879)对细胞边界内的斑点进行计数。图8中左边四个图是用gfp模板转染的hela细胞,右边的四个图是未用该模板转染的hela细胞。最左边两个图中的每个图中的一个细胞在gfp通道中显示出荧光,表明这两个细胞已被模板质粒转染(转染发生在一些细胞中,而其他细胞中不发生)。当在cy5通道中观察同一组细胞时(从左边数第二列图),hcr信号可见。在下面的图中,这对应于使用一对相互作用的发夹探针进行的检测和信号放大,cy5信号仅在转染的细胞中可见。在上面的图中(其对应于使用被动标记的探针进行的检测和信号放大),转染的细胞表现出强的信号,就像前面的情况一样。但是,与前面的情况不同的是,在不显示任何gfp荧光(未转染)的细胞中可见一些斑点。这些信号可能代表背景或假阳性信号。为了完全确保只考虑未转染的细胞来进行背景分析,我们还对未用gfp模板转染的hela细胞进行了成像。当在荧光素通道中观察这些细胞时,在所有细胞中仅观察到微弱的自发荧光(从左边数第三列图)。然而,当在cy5通道中观察这些细胞时(最右边的图),任何斑点都将来自非特异性来源。右下方的图中的图像以较高的对比度显示,以显示整个视野中的一个点。尽管下面的图仅在可见的八个细胞的一个中显示一个斑点,在上面的图中在总共仅五个细胞中可见约13个斑点。这些观察结果表明,尽管不同探针体系中靶标特异性信号的幅度大致相同,但是当由被动标记探针启动hcr时,背景信号的幅度要比由一对相互作用的发夹探针启动hcr时的背景信号的幅度高。
我们还通过计算图像分析(raj等人(2008))分析了四种类别(转染的细胞/被动标记的探针;转染的细胞/相互作用的发夹探针对;未转染的细胞/被动标记的探针;以及未转染的细胞/相互作用的发夹探针对)中每种类别的细胞的平均斑点数。我们发现,使用这两种探针,表达gfp的hela细胞平均产生100个以上的斑点(无法更精确地确定平均斑点数,因为在许多细胞中,斑点如此之多,以至于彼此融合,因此该算法无法将它们彼此区分开)。另一方面,在不表达gfp的对照细胞中,被动标记的探针每细胞产生1.46个斑点,而相互作用的发夹探针对每细胞产生0.62个斑点。就像图8中的代表性图像中一样,该分析还表明,虽然使用两种探针获得的特异性信号大致相同,但由被动标记的探针产生的背景信号要高于由相互作用的发夹探针产生的背景信号。
为了使两个探针体系所产生的背景和特异性信号更加清晰,我们通过流式细胞术分析了来自对细胞悬浮液进行的平行杂交和扩增反应的细胞。图9中示出了该分析。在图9a的两个图中所给出的散点图中,每个点分别代表cy5通道和gfp通道中单个细胞的荧光的x-y坐标。中间的大斑点簇(在104单位的gfp荧光和103单位的cy5荧光的交点处)代表未被gfp质粒转染因此未显示出明显水平的gfp或cy5荧光的hela细胞。位于对角线上的斑点代表转染的细胞,其在两个通道中均显示荧光。代表两个分布的假想线的斜率大致相同,表明两个探针体系的灵敏度相似。我们还分析了未转染的细胞中的cy5荧光。因为这些细胞没有表现出明显水平的gfp荧光,所以仅显示了cy5荧光,并且数据以连续线直方图的形式呈现(图9b)。除了使用了两种探针的hela细胞外,我们还制备了第三类未暴露于任何探针的hela细胞。这些直方图和相关的平均cy5荧光水平表明,尽管采用相互作用的发夹探针的荧光的背景水平与未暴露于任何探针的细胞大致相同,但采用被动标记的探针的荧光的背景水平明显更高。
基于图像和基于流式细胞仪的分析均表明,相互作用的发夹探针对产生的背景信号比被动标记的探针少。另一方面,在两种探针中,特异性信号的水平大致相同。使用被动标记探针的背景信号水平相对较高,与上文讨论的其他实验室的观察结果一致。
图9b提供了用未暴露于任何探针(平均764单位)、一个被动标记的探针(平均1085)或一对相互作用的发夹探针(平均839)的hela细胞获得的背景信号的定量比较。有探针的和没有探针的细胞的荧光之间的差异表明每种探针所产生的背景信号的增加。在被动标记的探针的情况下,差异为301单位(1085-764),而在相互作用的发夹探针的情况下,其为75单位(839-764)。在该比较中,使用了单个被动标记的探针或一对相互作用的发夹探针对。然而,随着通过将探针平铺在靶标上来增加与靶标结合的探针的数目以增加信号强度,在被动标记的探针的情况下,背景信号显著增加,而在相互作用的发夹探针的情况下,背景信号增加不多。
实施例2的a部分描述了使用图5中示意性描述的体系类型以及上文针对该体系所描述的,针对差别仅在于单个核苷酸改变的两个靶序列变体中的任一个所进行的实验。在该组四个探针中,两个供臂发夹探针竞争样品中存在的任一个单个靶序列变体。相互作用的探针对的设计如下:第一个供臂发夹探针(rdb6.6c)与g靶序列变体(如果存在)结合,然后与其臂受体探针(ra6.3)相互作用,这导致由cy5标记的发夹寡核苷酸h3和h4的hcr扩增产生信号,产生cy5信号;或第二供臂发夹探针(ldb6.1t)与a靶序列变体(如果存在)结合,然后与其臂受体探针(la6.1)相互作用,这导致由tmr标记的hcr发夹寡核苷酸h1和h2产生信号,产生tmr信号。在图10a中给出了来自两个样品的荧光图像。左侧的两个图显示了在cy5通道(顶部)和tmr通道(底部)中观察到的表达g变体的细胞的相同区域。类似地,右侧的两个图显示了在cy5通道(顶部)和tmr通道(底部)中观察到的表达a变体的细胞的相同区域。在分析了许多此类图像后,发现即使使用相同的探针混合物来探测两个靶序列变体中的每一个,平均而言,g变异体也产生大量cy5斑点(86.7%)和很少的tmr斑点(13.3%),而a变体产生大量的tmr斑点(93.8%)和很少的cy5斑点(6.2%)。(该数据也显示在图10b的第五行中。)我们还通过使第一供臂发夹探针与a靶序列变体互补和使第二供臂发夹探针与g靶序列变体互补来反转颜色。占优势的斑点的颜色确实反转,表明右侧和左侧臂受体发夹探针及其相关的hcr对以等效且可互换的方式起作用。
在实施例2的b部分中,我们将a部分的实验扩展到了含有四个靶序列变体之一(即,a、t、c或g)的样品。针对每个靶序列变体,我们使用了两种不同的具有与靶序列变体之一完全互补的环的供臂发夹探针的所有六种不同的组合。检测测定和探针/hcr单体体系如a部分所述。用四种标序列变体中的每一种测试了六种探针混合物中的每一种。在设计该系列实验时,对于每种靶序列变体,三种探针组合都不应该产生明显的信号,因为两种区分性的供臂发夹探针都不能与靶序列变异体完全互补;但是三种探针组合应该产生明显的信号,因为一个供臂发夹探针与靶序列变体完全互补。与存在的靶序列完全互补的供臂探针应起始针对其设计的hcr单体对的hcr聚合(cy5标记的h3和h4或tmr标记的h1和h2)并产生适当颜色的荧光信号,而混合物中的另一个供臂探针应当仅很少地通过另一个hcr单体对起始hcr聚合,并且仅产生其颜色的最小信号。实施例2b的结果表明确实如此发生。首先,其中供臂发夹探针均不与靶序列变体互补的测定未产生明显的荧光信号,通过显微镜分析平均为18个斑点。对这些测定未给出条形图。另一方面,其中一个供臂发夹探针与靶序列变体互补的测定确实产生了明显的信号,平均每个细胞有91个斑点。图10b以水平百分比条形图的形式给出了针对后者的结果。每个条代表两种颜色中检测到的斑点的100%,且每个条的深灰色部分是红色(cy5)斑点的百分比。由完全互补的供臂发夹探针的hcr起始所产生的颜色中的平均斑点比例为92%,只有8%的斑点是由错配(单个核苷酸变化)的供臂发夹探针的hcr起始所产生的颜色。我们还用其中没有表达gfp的细胞测试了六种探针组合。他们平均每个细胞产生1.5个斑点。这些结果表明,不管差异位点处的核苷酸的性质如何,探针体系都以很高的保真度进行区分。
实施例3描述了关于优化一对相互作用的发夹探针的结构以最大化其在采用hcr信号放大的检测测定中区分两个紧密相关的等位基因(即,完全互补的靶序列和差异在于单个核苷酸置换的序列)的能力的实验。影响其等位基因区分能力的相互作用的发夹探针的关键特征是(a)供臂发夹探针的环的长度和(b)其是否含有(见图4)或不含有(见图5)用于起始链置换的与臂受体发夹探针中的单链立足点序列互补的立足点互补序列。为了证明这些特征变化的影响,我们设计了四个彼此之间在这两个标准方面不同的相互作用的探针对,然后用表达以下之一的细胞来测试每一对:野生型gfpmrna,其是一种(g)靶序列变体,每一对中的供臂探针与之完全互补;或突变gfpmrna,其是一种(a)靶序列变体,每一对中的供臂探针与其错配单个核苷酸。图11中显示了探针杂交和hcr信号放大后的代表性显微图像,其中左侧的图来自用完全互补的(g)靶序列变体进行的分析,而右侧的图来自用错配的(a)靶序列变体进行的分析。前两行的图比较了在臂受体探针中具有15个核苷酸长的环的、具有(顶部的行)和不具有(第二行)立足点序列的供臂探针发夹探针的使用。这些结果表明,具有15-nt长的环的供臂探针对于完全互补的靶标产生强的信号(斑点),而对于错配的靶标产生较弱的信号。如图像的第二行所示,当消除了立足点互补序列(及其在臂受体探针中的单链互补立足点)时,来自错配的靶序列的信号进一步减弱,但来自完全互补的靶序列的信号仍然很强。图11中底部三行的图比较了没有立足点互补序列但茎长度为6个核苷酸且环长度为15、12或9个核苷酸的供臂探针的结果。在该实施例的测定中,当环长度从15个核苷酸减少到12个核苷酸时,来自错配的靶序列变体的信号几乎完全消失,而来自完全互补的靶序列变体的信号保持几乎一样强。然而,当环长度进一步减少到9个核苷酸时,来自两种靶序列变体的信号均降低到背景水平。底部两个图的对比度高于其他图,以显示图像中几乎没有斑点。探针结构的这些变化以及随之发生的所得信号的变化说明了如何能够优化特定分析条件下特定对的相互作用的发夹探针的区分能力。
实施例4证明了利用通用序列构建根据本发明的相互作用的发夹探针对的探针的能力。我们选择了在实施例1中使用的具有图5中的探针60的片段的臂受体探针ra6.3。我们使用通用片段f-g’-f’-3’作为通用寡核苷酸,并且我们使用靶标互补序列p4-5’作为靶标特异性寡核苷酸。我们通过点击化学将通用寡核苷酸连接到靶标特异性寡核苷酸,以形成臂受体探针ra6.3-点击,其含有点击连接。我们将探针ra6.3-点击的性能与实施例1的杂交和hcr信号放大方法中“正常”(所有磷酸二酯核苷酸间连接)的性能进行了比较。图12中所示的代表性图像证明了两种类型的臂受体发夹探针产生等同的结果。因此,尽管磷酸二酯主链不连续(由于“点击”连接),但当组装的发夹探针及其相互作用的发夹探针均与靶序列结合时,它们能够相互作用,经历所需的构象变化以产生可接近的hcr起始子,并起始hcr扩增以产生hcr放大信号。
实施例5证明了除了mrna之外,还可以使用相互作用的发夹探针来检测其他类型的rna。在实施例5中报道的实验中,我们靶向小引导rna。小引导rna用于引导基因编辑工具cas-9(用于簇状规则间隔的短回文重复序列辅助核酸内切酶9)到基因组内的其目标位置(cong等人(2013)science,339:819-823)。小引导rna具有两个功能元件:与cas-9蛋白结合的部分和与基因组内的靶序列互补的引导部分。靶序列互补元件将所得的cas-9复合物引导至其互补基因组位点,cas-9在此处切割dna,这导致靶基因的丧失。实施例5描述了一对相互作用的发夹探针,其靶向被工程化以表达rna引导序列的hela细胞中的cas-9引导序列,并且当相邻地杂交时,起始hcr信号放大。因为工程化的引导rna在u6启动子的控制下,所以预期其位于工程化细胞的细胞核中(lee等人(2008)rna14:1823-1833)。这不同于mrna,后者位于细胞的细胞质中。
图13示出了hela细胞的图像,其中对应于引导rna的斑点在细胞核中可见。未用该引导rna转染的细胞未产生明显量的斑点。重要的是,正如从其亲本质粒所利用的启动子所预期的那样,观察到该rna位于细胞核内,这表明无论靶核酸序列(此处为rna序列)在细胞中的位置如何,相互作用的发夹探针都能够识别靶标并报告其存在。
实施例6描述了根据本发明的利用滚环扩增(rca)而不是hcr进行信号放大的方法。首先参考图2,可以看到rca起始子i5(在被动标记的杂交探针21上有标签)将通过rca引发环状模板ct的复制以产生扩增产物ap,并且荧光团标记的检测探针lp将检测扩增产物。
实施例6描述了一对相互作用的发夹探针rdbrca和rarca,它们在固定和透性化的细胞中的核酸靶序列上相邻地杂交。一旦杂交后,它们就相互作用以产生起始子序列,在这种情况下其为rca起始子i5。环状模板和dna聚合酶的添加导致rca信号放大和检测,如结合图2所述的。这种相互作用的发夹探针的结构的示意图在图7中被描绘为探针71和72。图7中示出了这种方法的流程图。
实施例7使用三种类型的探测比较了由被刺激的人原代血单个核细胞(pbmc)表达的干扰素γ(ifnγ)mrna的流式细胞术检测的靶序列特异性信号水平和背景信号水平:大量短探针,均用同一荧光团单个地标记;使用大量被动标记探针的hcr;和使用一半数目的相互作用的发夹探针对的hcr。pbmc在其静息状态下不表达ifnγmrna,但是当被佛波醇12-肉豆蔻酸酯13-乙酸酯(pma)和离子霉素刺激时,它们的约15%通过合成ifnγmrna而响应(bushkin等人(2015)journalofimmunology194:836-841)。由于大多数细胞不表达任何ifnγmrna,因此该体系可以评估来自同一细胞群的信号和背景水平。应当认识到,在细胞内rna的基于流式细胞术的分析中获得低水平的背景尤为重要,因为在流式细胞术中仅记录来自每个细胞的整合荧光,并且与显微镜不同的是,不能使用斑点检测作为区分特异性信号和背景信号的辅助工具。
在实施例7的测试中,在三种不同类型的探针的杂交以及对于两种探针类型的hcr信号放大之后,通过流式细胞术分析固定和透性化的pbmc以及被刺激的pbmc。pbmc和被刺激的pbmc的第一个测试包括48个短(长度为20-24个核苷酸)无规卷曲dna探针的杂交,每个探针与ifnγmrna靶序列完全互补,并在其3’端被单个cy5荧光团标记(直接标记)。第二个测试包括采用cy5标记的hcr发夹寡核苷酸h3和h4的hcr扩增(实施例1)进行48个探针的杂交,这些探针具有与第一个测试中相同的靶标互补序列,每个序列具有长度为31个核苷酸的hcr起始子序列作为3’延伸。第三个测试包括采用cy5标记的hcr发夹单体h3和h4的hcr扩增进行23对相互作用的发夹探针的杂交,每对探针具有与第一个测试中相同的靶标互补序列作为连续探针。
图14中给出了流式细胞术分析的结果,其中右侧图代表被刺激的细胞,而左侧图代表静息的细胞。这些散点中的每个斑点代表单个细胞,其中横坐标代表细胞的cy5荧光强度,纵坐标代表同一细胞的侧向散射(后一个参数与细胞的大小有关)。左侧图中的细胞以单个簇的形式出现,这允许测量背景信号,因为未被刺激的细胞没有任何ifnγmrna(bushkin等,2015)。这些簇的峰值荧光强度由每个图上的竖线表示,其中峰值荧光强度在顶部指示。另一方面,被刺激的细胞分成两个簇,左边的一个代表无响应的细胞,右边的一个代表产生ifnγmrna的细胞,因此荧光更强(右图)。每个图中这些簇的峰值荧光类似地由竖线表示。未被刺激细胞的峰值荧光(左图)和被刺激但无反应的细胞的峰值荧光(右图)大致相同。
图14所示的结果显示,尽管与直接标记的探针的组相比,使用被动标记的探针的hcr所得的mrna特异性信号的强度增加了约10倍(373,000对37,000),但背景水平也增加到了相似的程度(9600对920),产生相同的信噪比。然而,显著的是,与直接标记的探针的组相比,采用相互作用的发夹探针的hcr不仅产生更高的mrna特异性信号(66,000对9700),而且背景水平更低(650对920)。三种探针体系的信噪比分别为直接标记的探针,40;采用被动标记的探针的hcr,39;和采用相互作用的发夹探针的hcr,102。应当理解,尽管由采用相互作用的发夹探针的hcr产生的mrna特异性信号的绝对幅度显著低于采用被动标记的探针的hcr(66,000对373,000),但与被动标记的探针相比,仅使用了一半数目的相互作用的发夹探针对(23对48)。
图14与图9b的比较显示,随着用于起始hcr的被动标记探针的数目从一增加到48,背景信号的水平增加到很高的程度,而相反,相互作用的发夹探针所产生的背景信号在探针对的数目从一对增加到23时没有显著增加。
实施例8证明了采用本发明的相互作用的发夹探针的hcr检测点突变的能力。为了该证明,我们选择了癌细胞系中表皮生长因子受体(egfr)mrna中的突变l858r。一些egfr突变使癌症容易受到与egfr结合的药物的影响,而该基因中的其他egfr突变使癌症不受这些药物的影响(sharma等人(2007)naturereviewcancer11:169-181)。我们选择体细胞突变l858r将egfrmrna的2573位的单个野生型胸苷(t)残基突变改变为鸟苷(g)残基(实施例8中所示的cdna序列),并表明酪氨酸激酶抑制剂(tki)如厄洛替尼和吉非替尼将有效抵抗癌症。对于通过显微镜检测的fish,我们选择了两种细胞系:h1975,其源自非小细胞肺癌,并且已知在其egfr基因的两个拷贝之一(杂合子)中带有这种突变;以及hela细胞系,其不含该突变,因此相对于该突变为野生型(kawahara等人clinicalcancerresearch(2010)16:3163-3170)。突变纯合子细胞系不可用于该突变。
为了探测和起始hcr信号放大,我们将图4中所描绘并且在上文结合该图和实施例2所描述的四探针体系的两种相互作用的探针对添加到固定和透性化的细胞中。无论其是野生型还是突变型,两个发夹受体探针均被设计为与靶标结合,而两个供臂发夹探针中只有一个被设计为与每个靶标结合。在该实验中,参考图4,与突变靶序列互补的右侧供臂发夹探针49被设计成与右侧受体发夹探针50相互作用以起始被cy5标记的hcr单体h3和h4的合成;并且与野生型靶序列互补的左侧供臂发夹探针48被设计成与左侧受体发夹探针47相互作用以起始被tmr标记的hcr单体h1和h2的合成。
为了证明相互作用的发夹探针对所产生的斑点通常源自egfrmrna,我们同时将一组48个短的无规卷曲dna探针(与两对相互作用的发夹探针)杂交,每种探针与野生型和突变型靶序列完全互补,并在其3’端用单个德克萨斯红荧光团标记(直接标记)。这些探针将与这两种靶标结合,并将在德克萨斯红通道中产生信号。它们被用作“示踪剂”或“标记物”探针,以确认hcr信号来自预期的靶标。预期实际上细胞中的所有mrna分子都将在德克萨斯红通道中被检测到(raj等人(2008)naturemethods5:877-879)。预期从egfrmrna发出的特异性hcr信号与这些德克萨斯红信号共定位,而不预期非特异性hcr信号与德克萨斯红信号共定位。
实施例8报道了两个实验。在第一个实验中,我们使用了一步杂交反应,其中杂交反应混合物(50μl)含有一组直接标记的短探针、5ng每种供臂发夹探针和5ng每种受体发夹探针。对于第二个实验,我们做了两个更改:我们分两步进行探针杂交,两步之间通过洗涤隔开。用于第一个杂交的反应混合物含有受体探针,但不含有供臂探针,而用于第二个杂交的反应混合物中含有供臂发夹探针,但不含有受体探针。对于第二个实验,每种供臂发夹探针的量从5ng增加到20ng。我们注意到,发夹序列、反应混合物浓度以及上述实验的过程并未得到优化,尽管其对于该证明是足够的。此外,我们尚未确定两个等位基因的相对表达水平,这可能很不平衡(milani等人(2017)allelicimbalanceingeneexpressionasaguidetocis-actingregulatorysinglenucleotidepolymorphismsincancercells,nucleicacidsresearch35:e34)。
图15中给出了分别来自h1975和hela细胞系的一个细胞的图像和图像分析。在该图中,图的水平行显示了从指示的四个不同通道获得的同一细胞的图像。顶部的行(h1975细胞)比底部的行(hela细胞)显示更多的cy5斑点,表明在杂合子样品中成功检测到l858r突变。表2列出了在这些实验中计数的斑点数,即:德克萨斯红斑点;与德克萨斯红斑点共定位的tmr斑点和不与德克萨斯红斑点共定位的tmr斑点;以及与德克萨斯红斑点共定位的cy5斑点和不与德克萨斯红斑点共定位(“单独”)的cy5斑点。顶部的两行是在第一个实验中在图15中成像的单个细胞。中间两行是从第一个实验得到的60个细胞的平均值。底部的两行是从第二个实验中得到的50个细胞的平均值。标准偏差约为报告值的30%。
在使用相互作用的发夹探针进行一步杂交的第一个实验中,我们发现h1975细胞平均表达42.5个egfrmrna分子,而hela细胞平均产生18.3个该mrna分子。在h1975细胞中,相互作用的发夹探针能够检测到34%的靶标,而在hela细胞中,它们能够检测到20%的靶标。在杂合子细胞系h1975中,探针产生的信号表明,检测到的mrna分子中的66%(100*((9.4/(9.4+4.9))是突变型,其余为野生型,而在野生型细胞系hela中,发现92%的分子(100*(3.3/(3.4+0.2))是野生型,其余为突变体。该分析依靠德克萨斯红信号作为引导,指出了探针对突变的出色特异性。第一个实验的结果还显示,tmr和cy5通道中的许多斑点与德克萨斯红斑点并不共定位。由于这些斑点来自潜在非特异性的来源,并降低了测定的灵敏度,因此我们试图通过进行两步杂交来减少其数目。
比较最后两行与中间两行中的“单独的”tmr和“单独的”cy5斑点,表明从单步探针杂交变为两步探针杂交显著地减少非共定位斑点的平均数目,而特异性斑点(与德克萨斯红共定位的斑点)大致相同或略有增加。因此,杂合子与野生型之间的区分变得比一步杂交更准确和可靠。可以在不知道与作为示踪剂的直接标记的短探针的组共定位的情况下进行这种区分。
这两个实验的结果表明,与野生型靶标相比,以更高的效率检测到了突变l858rmrna靶标。在h1975的一步杂交(60个细胞)中:检测到44%的mutmrna(9.4/21.2),并检测到23%的wtmrna(4.9/21.2),而在h1075的两步杂交(50个细胞)中:检测到47%的mutmrna(12.9/27.3),并检测到13%的wtmrna(3.6/27.3)。这些计算中的分子代表与德克萨斯红共定位的tmr和cy5通道中的斑点数,而分母代表总的德克萨斯红mrna分子的一半(表2)。在野生型细胞系hela中也发现野生型mrna较低的检测效率。在这种情况下,在hela的一步杂交(60个细胞)中:检测到19%的wtmrna(3.4/18.3),并且(错误地)只有1%响应于突变探针(0.2/18.3)。类似地,在hela的两步杂交(50个细胞)中:检测到17%的wtmrna(3.4/20.1),并且(错误地)只有2%响应于突变探针(0.5/20.1)。这些计算中的分母是总的德克萨斯红标记的mrna分子。
虽然这些差异可能是归因于等位基因失衡的两个等位基因表达失衡所导致的(milani等人2017),但另一个原因可能是两个等位基因的mrna对探针的不同可接近性。解决该问题以便优化测定的一种简单方法是对每个等位基因分别归一化斑点数。第二种方法是“微调”两种探针的浓度,即,增加左侧供体信标探针(wt)的浓度和降低右侧供体信标探针(mut)的浓度,使得两种mrna的总体检测效率大致相等。又一种方法是修饰左侧供臂探针或左侧受体探针或两者的结构,以增加起始子产生的效率。
实施例
实施例1.证明通过使用相互作用的发夹探针所实现的比使用被动标记的探针所实现的更高的信噪比。
为了证明相互作用的发夹探针对从期望的mrna靶序列特异性地产生放大的信号的能力,我们在hela细胞中表达了编码绿色荧光蛋白(gfp)的异源mrna。这些细胞中通常不存在gfp。该mrna充当了我们探针的靶标。该体系允许我们评估来自表达gfpmrna的细胞的靶标特异性信号,并评估来自不表达gfpmrna的hela细胞的背景信号。
本实施例中使用的寡核苷酸的序列:
gfp靶序列
hcr发夹寡核苷酸h3
5’-cy5-acagacgactcccacattctccaggtgggagtcgtctgtaacatgaagta-3’(seqidno.2)
hcr发夹寡核苷酸h4
5’-ctggagaatgtgggagtcgtctgttacttcatgttacagacgactcccac-cy5-3’(seqidno.3)
被动标记的探针
5’-gtcggggtagcggctgaagaaaaatacttcatgttacagacgactcccac-3’(seqidno.4)
供臂发夹探针(rdb6.6)
5’-gttacagacgactcccaccactgcacgccgtggga-3’(seqidno.5)
臂受体发夹探针(ra6.3)
5’-gtcggggtagcggctgaaggtgggagtcgtctgtaactacttcatgttacagacgactcccac-3’(seqidno.6)
在前述序列中,形成茎的互补片段用下划线标出。
对于这些组实验,我们要么使用类似于choi等人(2014)的探针的针对gfpmrna的被动标记的杂交探针,要么使用根据本发明的一对相互作用的发夹杂交探针,即含有靶标互补序列的第一相互作用的发夹探针rdb6.6,和第二相互作用的发夹探针ra6.3。被动标记的探针被设计为使得其靶标互补片段(或探针序列)与第二相互作用的发夹探针ra6.3(臂受体探针)中的靶标互补序列(或探针序列)相同。在该被动标记的探针中,5’端的靶标互补序列(或探针序列或探测序列)之后(朝其3’端)是5个核苷酸的间隔子(aaaaa),然后是hcr起始子序列i3,其包含序列g’,f’-3’,其是hcr发夹h3和h4的起始子。所有寡核苷酸均得自integrateddnatechnologies(idt)(coraville,ia,u.s.a.)。获得具有5’末端氨基标记的hcr发夹h3,并获得具有3’末端氨基标记的hcr发夹h4。将具有氨基标记的寡核苷酸与cy5琥珀酰亚氨基酯缀合,然后如先前所述通过hplc纯化(tyagi和kramer(1996))。使用变性聚丙烯酰胺凝胶电泳将这些标记的hcr发夹单体和探针在含有8m尿素的10%聚丙烯酰胺凝胶上进一步纯化,重悬于水中,并使用nanodrop分光光度计进行定量。为了确保探针和发夹单体在使用前正确地折叠,将探针稀释至5ng/μl,并将hcr发夹单体在2xssc稀释至25nm(约100μl溶液),在沸水中加热2分钟,然后使其在室温下冷却10分钟。
使用标准方案(vargas等人(2005))将该mrna的dna模板(质粒ptred2egfp,clontech)转染到hela细胞中。转染的细胞(接受质粒)由于gfp的表达而发荧光。此后,将细胞从塑料皿分离并转移至玻璃盖玻片,在其上再培养一天。将这些细胞用1x磷酸盐缓冲盐水(pbs)中的4%甲醛固定,用70%乙醇透性化,用2x柠檬酸钠盐水(ssc)缓冲液(ambion,austin,tx)(探针洗涤缓冲液)中的10%甲酰胺平衡。
然后将被动标记的探针或相互作用的探针对添加到固定和透性化的细胞中,并将所得混合物在37℃的潮湿箱中孵育过夜,以使探针与靶序列杂交并允许探针与探针相互作用。杂交反应混合物(50μl)含有5ng每种探针和10%硫酸葡聚糖(sigma)、1mg/ml大肠杆菌trna(sigma)、2mm氧钒核糖核苷复合物(newenglandbiolabs,ipswich,ma)、0.02%无核糖核酸酶的牛血清白蛋白(ambion)、10%甲酰胺和2xssc。在探针对杂交和相互作用之后,将盖玻片用1ml的探针洗涤缓冲液洗涤两次,以除去未杂交的探针。每次洗涤在室温下进行10分钟。最后,将细胞用50mmna2hpo4、1mnacl、0.05%(v/v)吐温-20,ph7.4(hcr缓冲液)平衡。
在除去过量的探针后,在潮湿箱中于37℃下以50μl反应进行hcr4小时。hcr反应混合物含有25nm的hcr发夹寡核苷酸h3和h4中的每一种,其如先前由koss等人(2015)(naturecommunications6:7294)所述地溶解在hcr缓冲液中。hcr发夹单体用cy5标记。在hcr扩增之后,以与上文去除探针相同的方式,通过在hcr缓冲液中洗涤来去除过量(未使用)的hcr发夹寡核苷酸。对于这两个孵育步骤(杂交和hcr),将石蜡膜片放在玻璃板上,将反应缓冲液的液滴放在石蜡膜片上,然后将盖玻片放在液滴上,附着有细胞的一侧朝下。如先前所述(raj等人(2008))封固盖玻片并成像。
在旨在通过流式细胞术分析信号的平行实验中,在转染后将细胞在塑料皿上培养一天,然后分离。将分离的细胞悬浮于pbs中,固定并透性化。加入探针对并孵育以进行杂交和相互作用,然后洗涤以除去未结合的探针,进行hcr扩增,并再次使用hcr缓冲液洗涤。然而,由于细胞处于悬浮状态,而不是附着在盖玻片上,因此对于每个孵育/洗涤周期,均使用甩平管转子在离心机中对其进行短暂旋转,然后通过抽吸除去上清液,并用新鲜溶液代替。在最后一次洗涤后,将这些细胞悬浮在探针洗涤缓冲液中,并在bectondickinsonaccuri6cflowcytometer上在荧光素通道(对于gfp)和cy5通道(对于hcr产品)中分析。
在dapi、dic、荧光素(或gfp)和cy5通道中用nikoneclipseti显微镜用60倍物镜对盖玻片成像。前两个通道能够识别细胞及其边界,荧光素通道能够识别转染的细胞,而cy5通道用于记录探针信号。对于cy5通道,获得了11个光学切面。hcr放大信号显示为离散的斑点。使用先前描述的算法(raj等人(2008))对细胞边界内的斑点进行计数。图8中示出了代表性的图像。图8中左侧四个图针对用gfp模板转染的hela细胞,右侧四个图针对未用该模板转染的hela细胞。我们还通过流式细胞术分析了来自对细胞悬浮液进行的平行杂交反应的细胞。该分析在图9中示出。在图9a的两个上部图中给出的散点图中,每个点代表在cy5和gfp通道中单个细胞分别对于使用被动标记的探针的反应(左侧图)和对于采用相互作用的探针对的反应(右侧图)的荧光的x-y坐标。我们还分析了未转染的细胞中的cy5荧光。由于这些细胞没有表现出明显水平的gfp荧光,仅显示了cy5荧光,且数据以连续线直方图的形式呈现(图9b)。
实施例2.使用相互作用的发夹探针以单分子灵敏度原位检测mrna的等位基因变体。
为了证明相互作用的发夹探针可用于检测靶序列的单个核苷酸差异,我们如下生成了gfp编码序列的四种单核苷酸变体:使用定点突变程序(change-it,affymetrix)在特定位点使野生型d2egfp序列(clontech)突变,使得任何改变均不会对其荧光产生负面影响。我们用腺苷、胞嘧啶或胸苷取代了通常存在于d2egfp编码序列207位的鸟苷。改变的(用下划线标出的)核苷酸的序列背景是
本实施例中寡核苷酸的序列:
gfp靶序列变体
右侧供臂发夹探针变体
c变体rdb6.6c
t变体rdb6.6t
a变体rdb6.6a
g变体rdb6.6g
右侧臂受体发夹探针ra6.3
5’-gtcggggtagcggctgaaggtgggagtcgtctgtaactacttcatgttacagacgactcccac-3’(seqidno.6)
hcr发夹寡核苷酸h3
5’-cy5-acagacgactcccacattctccaggtgggagtcgtctgtaacatgaagta-3’(seqidno2)
hcr发夹寡核苷酸h4
5’-ctggagaatgtgggagtcgtctgttacttcatgttacagacgactcccac-cy5-3’(seqidno.3)
左侧供臂发夹探针变体
t变体ldb6.1t
c变体ldb6.1c
a变体ldb6.1a
g变体ldb6.1g
左侧臂受体发夹探针la6.1
5’-cctcgtaaatcctcatcaatcatccagtaaaccgccgatgattgatgaggatttacgagggtaggtcagggtggtcacga-3’(seqidno.17)
hcr发夹寡核苷酸h1
5’-ggcggtttactggatgattgatgaggatttacgaggagctcagtccatcctcgtaaatcctcatcaatcatc-tmr-3’(seqidno.18)
hcr发夹寡核苷酸h2
5’-tmr-cctcgtaaatcctcatcaatcatccagtaaaccgccgatgattgatgaggatttacgaggatggactgagct-3’(seqidno.19)
在野生型gfp靶序列和供臂探针中,可变核苷酸为黑体。用下划线标出的序列片段指示发夹茎的臂。
a.用两种相互作用的探针对探测两个靶变体中的一个
我们首先用一组两个相互作用的发夹探针对(由以下组成的四个探针:ra6.3;la6.1;rdb6.6c,其环序列与g靶序列变体互补;和ldb6.1t,其环与a靶序列变体互补)分别探测了表达gfpmrna的g变体的细胞(野生型)和表达a变体的细胞。利用该探针组,如果供臂探针rdb6.6c结合使得其茎打开,则其供体臂然后可以与臂受体探针ra6.3相互作用,释放其hcr起始子序列,其然后可以起始cy5-标记的发夹寡核苷酸h3和h4的hcr扩增,产生cy5信号。然而,如果取而代之的是供臂探针ldb6.1t结合使得其茎打开,则其供体臂然后可以与臂受体探针la6.1相互作用,释放其hcr起始子序列,其然后可以起始tmr-标记的hcr发夹寡核苷酸h1和h2的hcr扩增,产生四甲基罗丹明(tmr)信号。
制备了细胞和探针,并如实施例1中那样进行每种样品(g变体或a变体)的杂交-相互作用孵育,在每种情况下均使用所有四种探针。在如实施例1所述通过洗涤除去过量的探针后,如实施例1所述对每种样品进行hcr扩增,在此期间,存在两组hcr发夹,即cy5标记的h3和h4以及tmr标记的h1和h2。在除去过量(未使用)的hcr发夹寡核苷酸后,在dapi、dic、tmr和cy5通道中在zeissaxiovert显微镜中以100x物镜对盖玻片成像。在图10a中对这两个样品示出了从tmr和cy5通道获得的代表性图像。在上文的“对实施例的解释”部分中对结果进行了描述。我们用反转的供臂发夹的询问核苷酸(即,探针rdb6.6c被探针rdb6.6t替换(与a靶序列变体互补),而探针ldb6.1t被探针ldb6.1c替换(与g靶序列变体互补))重复了前述实验,看占优势的斑点的颜色是否会反转,结果确实如此。
b.用两个相互作用的探针对探测其他靶变体
我们对gfpmrna靶序列的所有四个变体重复实施例2a。我们使用六种不同的探针混合物测试了每种靶序列变体的样品,这些混合物的不同之处在于它们的两种供臂发夹探针的六种组合。所有测定均包括受体探针la6.1和ra6.3,以及hcr发夹寡核苷酸h1、h2、h3和h4。表1中显示了六种组合中的每一种的两个供臂探针。
表1
在表1的系统代号中,对于两个相互作用的探针对中的两个供臂发夹探针中的每一个,大写字母指示与靶序列可变核苷酸相对的环核苷酸以及由其打开所产生的信号的颜色,即绿色(tmr)或红色(cy5)。
用四个靶序列中的每一个测试了表1中的六种探针混合物中的每一种。对于每种探针混合物,两个靶标序列变体与两个供臂探针中的一个互补,并且两个靶标序列变体与任何供臂探针都不互补,即,它们是非同源靶序列变体。例如,被指定为ggtr的探针体系包括具有与靶序列变体c互补的环的供臂探针(我们称之为左供臂探针);和具有与靶序列变体a互补的环序列的供臂探针(我们称之为右供臂探针),因此这两个靶序列变体是同源变体,而靶序列变体g和t是非同源变体。包括非同源靶序列变体的测定未产生明显的来自左供臂发夹探针的杂交和打开的tmr荧光团或来自右供臂发夹探针的杂交和打开的cy5荧光团的荧光信号。图10b中给出了包括同源靶序列变体的测定结果。在图10b中的水平百分比条中(每个条代表100%),具有浅灰色背景的阴影区表示绿色斑点(tmr)的百分比,而连续的深灰色部分表示红色斑点(cy5)的百分比。
实施例3.相互作用的发夹探针的等位基因区分能力的优化
我们在检测测定中使用表达两种靶序列变体之一的细胞测试了四对相互作用的发夹探针:gfpmrna(g)(seqidno.1),其与供臂发夹探针的环完全互补;或gfpmrna(a)(seqidno.8),其与供臂发夹探针的环错配单个核苷酸。本实施例中使用的寡核苷酸的序列如下:
gfp靶序列变体
(g变体)5’-ucgugaccacccugaccuacggcgugcagugcuucagccgcuaccccgac-3’(seqidno.1)
(a变体)5’-ucgugaccacccugaccuacggcguacagugcuucagccgcuaccccgac-3’(seqidno.8)
第一探针对
供臂发夹探针rdb6.3
5’-gttacagacgactcccacagtccagcactgcacgccgtggactg-3’(seqidno.20)
臂受体发夹探针ra6.2
5’-atgtggtcggggtagcggctgaggactgtgggagtcgtctgtaactacttcatgttacagacgactcccac-3’(seqidno.21)
第二探针对
供臂发夹探针rdb6.1
5’-gttacagacgactcccacagcactgcacgccgtgtggga-3’(seqidno.22)
臂受体发夹探针ra6.0
5’-atgtggtcggggtagcggctgagtgggagtcgtctgtaactacttcatgttacagacgactcccac-3’(seqidno.23)
第三探针对
供臂发夹探针rdb6.5
5’-gttacagacgactcccacagcactgcacgcgtggga-3’(seqidno.24)
臂受体发夹探针ra6.0
5’-atgtggtcggggtagcggctgagtgggagtcgtctgtaactacttcatgttacagacgactcccac-3’(seqidno.23)
第四探针对
供臂发夹探针rdb6.7
5’-gttacagacgactcccacactgcacgcgtggga-3’(seqidno.25)
臂受体发夹探针ra6.0
5’-atgtggtcggggtagcggctgagtgggagtcgtctgtaactacttcatgttacagacgactcccac-3’(seqidno.23)
hcr发夹寡核苷酸h3
5’-cy5-acagacgactcccacattctccaggtgggagtcgtctgtaacatgaagta-3’(seqidno.2)
hcr发夹寡核苷酸h4
5’-ctggagaatgtgggagtcgtctgttacttcatgttacagacgactcccac-cy5-3’(seqidno.3)
在上述序列中,发夹臂序列用下划线标出。
在第一对探针中,供臂发夹探针rdb6.3含有长度为15-nt的环序列,且其含有长度为5-nt的立足点互补序列。其相互作用探针,臂受体发夹探针ra6.2含有长度为5-nt的立足点序列。参照探针ra6.2的序列,5’端的22个核苷酸与靶序列互补,接下来的5个核苷酸(ggact)是立足点序列。在第二探针对中,供臂发夹探针rdb6.1含有长度为15-nt的环序列,但不含有立足点互补序列;并且臂受体发夹探针ra6.0不含有立足点序列。在第三探针对中,供臂发夹探针rdb6.5含有长度为12-nt的环序列,但不含有立足点互补序列;并且臂受体探针ra6.0不含有立足点序列。最后,在第四探针对中,供臂发夹探针rdb6.7含有长度为9-nt的环序列,但不含有立足点互补序列;并且臂受体探针ra6.0不含有立足点序列。
除了上述靶序列变体之一和相互作用的发夹探针对之一之外,每种hcr检测方法还使用单独一对hcr发夹寡核苷酸h3和h4。如实施例2所述进行反应。结果示于图11中,其中每个图是探针杂交和hcr信号放大后的细胞的显微图像。mrna靶序列变体显示在每一列图的上方,并且在图的左边显示了每一行图中的供臂发夹探针的特征。
实施例4.经由非磷酸二酯键将通用发夹连接至靶标特异性探针。
为了研究从通用发夹和对特定靶标特异的靶标互补序列制备臂受体探针的可能性,我们使用点击化学方法合成了一种版本的臂受体探针ra6.3,并将其性能与仅含有磷酸二酯键的“正常”臂受体探针ra6.3进行比较。在这两种组分中,获得具有5’氨基的通用受体发夹寡核苷酸,并且获得具有3’氨基的受体靶标互补序列寡核苷酸。本实施例中使用的寡核苷酸的序列如下:
臂受体探针通用发夹
5’-氨基-gtgggagtcgtctgtaactacttcatgttacagacgactcccac-3’(seqidno.26)
臂受体探针特异性靶标互补序列
5’-gtcggggtagcggctgaag-氨基-3’(seqidno.27)
臂受体探针ra6.3
5’-gtcggggtagcggctgaaggtgggagtcgtctgtaactacttcatgttacagacgactcccac-3’(seqidno.6)
gfp靶序列
5’-ucgugaccacccugaccuacggcgugcagugcuucagccgcuaccccgac-3’(seqidno.1)
供臂发夹探针rdb6.6
5’-gttacagacgactcccaccactgcacgccgtggga-3’(seqidno.5)
hcr发夹寡核苷酸h3
5’-cy5-acagacgactcccacattctccaggtgggagtcgtctgtaacatgaagta-3’(seqidno.2)
hcr发夹寡核苷酸h4
5’-ctggagaatgtgggagtcgtctgttacttcatgttacagacgactcccac-cy5-3’(seqidno.3)
在前述序列中,茎臂序列用下划线标出。
通过使用4-叠氮基丁酸-n-氢琥珀酰亚胺酯(sigma-aldrich)将靶标互补序列寡核苷酸的3’氨基修饰为叠氮官能团。单独地,使用二苯并环辛炔-n-羟基琥珀酰亚胺酯(sigma-aldrich)将通用受体发夹的5’-末端的氨基缀合至二苯并环辛炔(dbco)。两种修饰的寡核苷酸均通过高压液相色谱法纯化。通过将两种寡核苷酸以等摩尔比混合并将它们在由50mmkcl、2.5mmmgcl2和10mmtris-hcl组成的缓冲液(ph8.0)中孵育过夜,使它们相互连接。我们将全长缀合寡核苷酸探针称为ra6.3-点击。将其使用变性聚丙烯酰胺凝胶电泳(其使用含有8m尿素的12%聚丙烯酰胺凝胶)纯化,重悬于水中,并使用nanodrop分光光度计进行定量。如前所述,通过加热和冷却将ra6.3-点击折叠成其发夹构象。然后将经适当折叠的臂受体探针ra6.3-点击与供臂发夹探针rdb6.6和hcr单体h3、h4结合用于使用hcr信号放大和显微镜检测的杂交检测,以如实施例1所述对表达野生型gfpmrna靶序列变体g(seqidno.1)的细胞进行成像。平行地,我们在同一测定方法中利用“正常”臂受体探针ra6.3对表达同一gfpmrna的细胞进行成像。图12中示出了代表性图像。
实施例5.小引导rna的检测。
我们在hela细胞中表达了抗cox-2基因的引导rna靶序列。将该序列插入到质粒pgl3-u6-sgrna-pgk-嘌呤霉素(addgene)中,并将工程化的质粒转染到hela细胞中。转染后,如实施例1所述将细胞固定和透性化。
为了检测cox-2引导rna,我们设计了一对相互作用的发夹探针,其以实施例1的方法起始hcr扩增。如实施例1所述制备和纯化这些探针。本实施例中使用的寡核苷酸的序列如下:
cox-2引导rna靶序列
5’-ccgguguacgucuuuagagggucgguuuuagagcuagaaauagcaaguuaaaauaaggcuaguccguuaucaacuug-3’(seqidno.28)
用于cox-2引导rna靶序列的供臂发夹探针
5’-gttacagacgactcccacagacgaatacagcgcgaccctctaaagacgttgtattcgtct-3’(seqidno.29)
用于cox-2引导rna靶序列的臂受体探针
5’-ttaacttgctatttctagctctaacgctgtattcgtctgtgggagtcgtctgtaactacttcatgttacagacgactcccac-3’(seqidno.30)
hcr发夹寡核苷酸h3
5’-cy5-acagacgactcccacattctccaggtgggagtcgtctgtaacatgaagta-3’(seqidno.2)
hcr发夹寡核苷酸h4
5’-ctggagaatgtgggagtcgtctgttacttcatgttacagacgactcccac-cy5-3’(seqidno.3)
在前述序列中,茎臂序列用下划线标出。
如实施例1所述进行发夹探针对的杂交和相互作用、hcr扩增和成像。结果显示在图12中,其示出了hela细胞的图像,其中对应于引导rna的斑点在细胞核中可见。未被该引导rna转染的细胞未产生明显数目的斑点(未示出)。
实施例6.将相互作用的发夹探针与滚环扩增组合使用。
本实施例描述了使用一对相互作用的发夹探针通过滚环扩增(rca)起始信号放大以通过sm-fish检测核酸靶序列的试剂和方法。本实施例中的靶标是vargas等人(2011)cell147:1054-1065先前描述的工程化gfp基因中的阵列3序列。稳定表达gfp-阵列3构建体的中国仓鼠细胞系在玻璃盖玻片上培养,然后以与前述实施例中针对hela细胞所述相同的方式进行固定和透性化。
所使用的寡核苷酸的序列如下:
阵列3靶序列
5’-ucgacgcggagaccacgcucggcuugucuuucgcgcgcaaugcgacgcacgcggauaguuagcugcggcgacgaggcacc-3’(seqidno.31)
用于环状模板的寡核苷酸
5’-tttaagcgtcttaactattagcgtccagtgaatgcgagtccgtctaagagagtagtacagcagccgtcaagagtgtctagttctgtcata-3’(seqidno.32)
用于环状模板的夹板寡核苷酸
5’-taagacgcttaaatatgacagaacta-3’(seqidno.33)
供臂发夹寡核苷酸,rdbrca
5’-gcttaaatatgacagaactaagtccgaaagacaagccgagcgtggtctccggact-3’(seqidno.34)
臂受体发夹寡核苷酸,rarca
5’-ccgcgtgcgtcgcattgcgcgcggacttagttctgtcatatttaagctaagacgcttaaatatgacagaacta-3’(seqidno.35)
用于rca产物的检测探针
5’-tgcgagtccgtctaagagag-tmr-3’(seqidno.36)
为了产生用于rca的环状模板,使用t7多核苷酸激酶(newenglandbiolabs,ipswich,ma,usa)将线性寡核苷酸(seqidno.32)在其5’端磷酸化,并退火成夹板寡核苷酸(seqidno.33),然后按照制造商的说明使用t4dna连接酶(newenglandbiolabs)连接。然后通过在85%的甲酰胺中于100℃下变性10分钟而使环化的模板dna从夹板寡核苷酸解离,然后通过在含有8m尿素的10%聚丙烯酰胺凝胶上进行电泳而纯化。如实施例1所述纯化和制备该对相互作用的发夹探针。
将相互作用的发夹探针对(供臂发夹探针rdbrca和臂受体探针rarca)与固定和透性化的细胞中的靶序列杂交(每50μl杂交反应5ng的每种探针),并允许其相互作用。以实施例1所述的方式除去过量(未结合)的探针。然后添加环化的模板寡核苷酸(5ng在50μl杂交反应混合物中)并在37℃下杂交1小时。通过用探针洗涤缓冲液洗涤两轮,除去未结合(过量)的环化的模板。然后用由以下物质组成的聚合酶缓冲液平衡样品:50mmtris-hcl(ph7.5)、10mmmgcl2、10mm(nh4)2so4、4mmdtt、250ng/μlbsa、0.05%吐温20和0.25mm的四种核苷酸三磷酸中的每一种。37℃下在0.125u/μlphi29dna聚合酶(newenglandbiolabs)的存在下,在50μl相同的缓冲液中进行rca信号放大1小时。然后将盖玻片转移至含有用于rca产物的tmr标记的检测探针(seqidno.36)的溶液(5ng在50μl探针洗涤缓冲液中)中,并在37℃下在溶液中孵育30分钟。通过用探针洗涤缓冲液洗涤两次,除去过量(未结合)的检测探针的拷贝,并安装盖玻片以进行显微镜观察,这如实施例1所述地进行。在该程序中,重要的是使用具有高持续性和高链置换能力的dna聚合酶。在这方面,dna聚合酶噬菌体
对于上述方法的步骤,可以有多种变化。例如,不是使用预先形成的环状模板,而是可以使用环状模板的线性版本。在那种情况下,由相互作用的发夹探针的相互作用所产生的单链rca起始子序列将用作夹板,并且环化将通过原位连接步骤来实现。这将减少寡核苷酸制备所需的工作量。此外,不是如上所述地使用线性检测探针进行rca产物检测(这需要洗涤步骤而去除过量的检测探针),而是可以使用同相(homogeneous)检测探针,优选分子信标探针。如果需要的话,这将省去最后的洗涤步骤。
实施例7.使用hcr与相互作用的发夹探针和mrna的流式细胞术检测。
与基于显微镜的分析相比,在细胞内rna的基于流式细胞术的分析中实现低背景水平更为关键,因为在流式细胞术中仅记录来自每个细胞的整合荧光,并且与显微镜不同的是,不能使用斑点检测作为区分特异性信号和背景信号的辅助工具。为了证明在流式细胞术中使用相互作用的发夹探针进行的hcr检测比使用被动标记的探针进行的hcr检测和使用直接标记的探针进行的检测产生更高的信噪比,我们使用所有三种探针类型在原代血单核细胞(pbmc)中检测ifnγmrna。pbmc在其静息状态下不表达ifnγmrna,但是当它们被佛波醇12-肉豆蔻酸酯13-乙酸酯(pma)和离子霉素刺激时,它们的约15%通过合成ifnγmrna而响应(bushkin等人(2015)journalofimmunology194:836-841)。由于大多数细胞不表达任何ifngmrna,因此该体系可以评估来自同一细胞群的信号和背景水平。
探针序列和合成
ifnγmrna的序列,以相应的cdna序列给出,如下所示:
探针序列如下:
四十八个直接标记的短探针
上文的ifnγcdna序列中带下划线和灰色阴影的序列的反向互补。
被动标记的hcr探针
相同的序列组也用于被动标记的hcr探针的靶标互补区域。然而,在其3’端附加有以下序列aaaaatacttcatgttacagacgactcccac(seqidno.38),其用作hcr的起始子。
二十三个右供臂发夹探针
它们的一般序列为:gttacagacgactcccacnnn…nnngtggga(seqidno.39),其中nnn…nnn表示上文的ifnγcdna序列中23个带下划线的序列之一的反向互补,其中nnn…nnn左侧的序列,即,gttacagacgactccca(seq.idno.40)是每种探针的右臂(对应于图3a中的区域f’和e’),并且其中nnn…nnn右侧的序列,即,gtggga(seqidno.41)与该序列的一部分互补(对应于图3a中的区域e)。
二十三个右受体发夹探针
它们的序列是上文的ifnγcdna序列中除第一个序列之外的阴影序列的反向互补,每个序列的3’端均附有实施例4所述的通用臂受体探针发夹(seqidno.26)。
cy5荧光团缀合至每个直接标记的短探针的3’端。每种右供臂发夹探针均通过全自动dna合成(idtdnainc.)来制备。另一方面,每种右受体探针通过点击化学将探针的靶标特异性部分与通用右受体发夹连接而制备。为此,我们从每个均等摩尔浓度的23种寡核苷酸(具有上文的ifnγcdna序列中阴影序列的反向互补,不包括第一个和最后一个)的池开始,然后如实施例4所述将它们在其3’端与通用臂受体探针发夹(seqidno.26)连接。在通过点击化学合成后,如实施例4所述通过聚丙烯酰胺凝胶电泳纯化右受体探针。将右供臂发夹探针和右受体探针(均以池的形式)加热到95℃2分钟,并使其在2xssc中(在单独的试管中)在室温下冷却10分钟,以确保它们已正确形成了它们各自的发夹。
从血液中纯化pbmc。一部分未被刺激(“静息”),并且一部分被pma和离子霉素刺激。如bushkin等人(2015)journalofimmunology194:836-841中所述,将未刺激的细胞和刺激的细胞均用甲醛固定,并用乙醇透性化且用直接标记的短探针的组进行探测。在平行的一组杂交反应中,我们还使用被动标记的hcr探针的组和相互作用的发夹探针的组对细胞进行了探测。对于每50μl杂交反应,我们使用25ng的直接标记的短探针,或250ng的被动标记的探针,或250ng的右供体信标探针组与250ng的右受体探针组。如先前所讨论的,每个探针组由等摩尔浓度的多种探针组成。在37℃下过夜杂交后,将细胞在探针洗涤缓冲液中洗涤两次。在此步骤之后分析与直接标记的短探针的反应,而与被动标记的hcr探针和与相互作用的发夹探针的反应用hcr缓冲液洗涤,并如实施例1所述在37℃下使用用cy5标记的hcr发夹h3和h4进行hcr扩增2小时。在hcr之后,将细胞用hcr缓冲液洗涤两次,并用探针洗涤缓冲液洗涤一次并进行分析。如实施例1所述进行流式细胞术分析。
流式细胞术分析的结果示于图14中。右列中的图代表被刺激的细胞,而左列中的图代表静息的细胞。最上面一排的图来自用直接标记的短探针的组进行的探测。中间一排的图来自被动标记的hcr探针的组进行的探测。最下面一排的图来自相互作用的发夹hcr探针的组。这些散点中的每个斑点代表单个细胞,其中横坐标代表细胞的cy5荧光,纵坐标代表同一细胞的侧向散射(后一个参数与细胞的大小有关)。
左侧图中的细胞以单个簇的形式出现,其峰值荧光强度由每个图上的竖线表示。峰值强度的值对于直接标记的短探针的组为920荧光单位;对于被动标记的hcr探针为9600单位;且对于相互作用的发夹hcr探针为650。另一方面,右侧图中的被刺激的细胞分成两个簇。左侧的簇代表无响应的细胞,而右侧的簇代表产生ifnγgmrna的细胞,因此荧光更强。每个图中右侧簇的峰值荧光用竖线表示。那些峰强度的值对于直接标记的短探针的组为37,000任意荧光单位(a.u.);对于被动标记的hcr探针的组为373,000单位;且对于相互作用的发夹hcr探针的组为66,000单位。
实施例8.检测癌细胞系中表皮生长因子受体(egfr)mrna中的突变l858r。
细胞系h1975和hela细胞系得自atcc(manasas,va)并根据供应商的说明进行培养。细胞系h1075在efgr基因(杂合子)的两个拷贝之一中带有体细胞突变l858r,而hela细胞系不含有该突变。该突变将egfrmrna的2573位的胸苷(t)残基变为鸟苷(g)残基。
探针序列和合成
egfrmrna的序列,以相应的cdna序列给出,如下所示:
经受l858r突变的胸苷残基为黑体并在括号中。
四十八个直接标记的短探针
上文的egfrcdna序列中带下划线的序列的反向互补。二十四个是包括经历突变的核苷酸(t)的阴影序列的5’,而24个是该序列的3’。
右供臂发夹探针egfr3.1(突变)
形成茎的序列用下划线标出。形成单链环并与突变靶标互补的核苷酸为黑体。单个核苷酸突变的核苷酸在括号中。
左供臂发夹探针egfr3.0(野生型)
形成茎的序列用下划线标出。形成单链环并与野生型靶标互补的核苷酸为黑体。经历突变的核苷酸在括号中。
右受体发夹探针egfr3.0
形成茎的序列用下划线标出。与突变和野生型靶标互补的核苷酸为黑体。
左受体发夹探针egfr3.0
形成茎的序列用下划线标出。与突变和野生型靶标互补的核苷酸为黑体。
相互作用的发夹探针得自idtdnainc.,然后如实施例4所述通过聚丙烯酰胺凝胶电泳纯化。将右供臂发夹探针和右受体探针加热到95℃2分钟,然后使其在2xssc(在单独的试管中)中于室温下冷却10分钟,以确保它们已正确地形成了它们各自的发夹。从biosearchlgc获得带有3’氨基的直接标记的短探针,然后将其偶联到德克萨斯红染料上。如raj等人(2008)所述对标记的探针进行纯化。
如实施例1所述,将细胞在盖玻片上培养、固定和透性化。
在第一个实验中,探针杂交反应混合物(50μl)含有25ng合并的直接标记的短探针、5ng右供臂发夹探针egfr3.1(突变)、左供臂发夹探针egfr3.1(野生型)、右受体发夹探针egfr3.0和左受体发夹探针egfr3.0中的每一种。除了这些探针之外,杂交混合物还含有10%硫酸葡聚糖(sigma)、1mg/ml大肠杆菌trna(sigma)、2mm氧钒核糖核苷复合物(newenglandbiolabs,ipswich,ma)、0.02%不含核糖核酸酶的牛血清白蛋白(ambion)、10%甲酰胺和2xssc。将该杂交反应混合物放置在拉伸的石蜡膜上,并在其上盖上盖玻片,使细胞朝下,然后在潮湿箱中于50℃孵育过夜。将盖玻片用探针洗涤缓冲液洗涤两次,并用hcr缓冲液洗涤一次。
在第二个实验中,以两个步骤进行探针杂交,并增加了供臂发夹探针的浓度。在第一步中,杂交反应混合物包括左和右受体探针,但不包括供臂发夹探针。在与上文指定的相同条件下进行该杂交但进行6小时后,通过连续两次用探针洗涤缓冲液洗涤盖玻片来去除过量的受体探针。此后,用包括20ng右和左供臂发夹探针中的每一种但不包括受体探针的反应混合物进行第二次杂交。第二次杂交过夜进行。在这两次杂交反应中均包括德克萨斯红标记的探针。通过洗涤除去过量的供臂探针。
接下来,在两个实验中,均如实施例1所述在hcr缓冲液中进行hcr扩增。hcr反应混合物包括两组hcr发夹寡核苷酸:cy5标记的h3和h4,以及tmr标记的h1和h2。在除去过量(未使用)的hcr发夹寡核苷酸后,使用primephotometricscmos相机在dic、dapi、tmr、德克萨斯红和cy5通道中在zeissaxiovert显微镜下以镜口率为1.4的63倍物镜对盖玻片进行成像。在tmr、德克萨斯红和cy5通道中,获得了彼此分开0.2μm的16个光学部分。通过定制的matlab图像处理程序分析了这些z堆栈,该程序识别每个通道中的3-d斑点,然后识别在每对通道之间共定位的斑点(vargas等人,2011)。很少发现在所有三个斑点中共定位的斑点。
图15中给出了第一个实验中对来自细胞系h1975(上一行)和hela细胞系(下一行)中每一种一个细胞的图像和图像分析。如图所示,每一行中的水平图显示了从四个不同的通道(tmr、德克萨斯红、cy5和dic)获得的同一细胞的图像。除了右侧的dic图(其对应于z堆栈的中央层)之外,图像是从z堆栈获得的最大强度投影。dic图显示出每类斑点的位置,其通过图的底部给出的附标来标识。
表2列出了两次实验中单个细胞图像中斑点计数的结果。以不同类别的斑点来显示斑点的数目:德克萨斯红斑点的总数目、未与德克萨斯红斑点共定位(“单独”)的tmr斑点的数目、未与德克萨斯红斑点共定位的cy5斑点的数目、与德克萨斯红斑点共定位的tmr斑点的数目以及与德克萨斯红斑点共定位的cy5斑点的数目。顶部的两行是在第一个实验(一步探针杂交)中单个细胞的计数,即图15中所示的细胞。接下来的两行是从第一个实验得到的60个细胞计数的平均值。底部的两行是从第二个实验(两步探针杂交)中得到的50个细胞计数的平均值。标准偏差约为报告值的30%。
序列表
<110>新泽西鲁特格斯州立大学(rutgers,thestateuniversityofnewjersey)
s·泰尔吉(tyagi,sanjay)
s·马拉斯(marras,salvatore)
<120>用双相互作用发夹探针进行的靶标介导的原位信号放大
<130>096747-00368
<150>62/510,045
<151>2017-05-23
<160>47
<170>patentinversion3.5
<210>1
<211>50
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>gfp靶序列
<400>1
ucgugaccacccugaccuacggcgugcagugcuucagccgcuaccccgac50
<210>2
<211>50
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>hcr发卡寡核苷酸h3
<400>2
acagacgactcccacattctccaggtgggagtcgtctgtaacatgaagta50
<210>3
<211>50
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>hcr发卡寡核苷酸h4
<400>3
ctggagaatgtgggagtcgtctgttacttcatgttacagacgactcccac50
<210>4
<211>50
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>被动标记的探针
<400>4
gtcggggtagcggctgaagaaaaatacttcatgttacagacgactcccac50
<210>5
<211>35
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>供臂发卡探针(rdb6.6)
<400>5
gttacagacgactcccaccactgcacgccgtggga35
<210>6
<211>63
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>臂受体发卡探针(ra6.3)
<400>6
gtcggggtagcggctgaaggtgggagtcgtctgtaactacttcatgttacagacgactcc60
cac63
<210>7
<211>50
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>gfp靶序列变体-c变体
<400>7
ucgugaccacccugaccuacggcguccagugcuucagccgcuaccccgac50
<210>8
<211>50
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>gfp靶序列变体-a变体
<400>8
ucgugaccacccugaccuacggcguacagugcuucagccgcuaccccgac50
<210>9
<211>50
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>gfp靶序列变体-t变体
<400>9
ucgugaccacccugaccuacggcgutcagugcuucagccgcuaccccgac50
<210>10
<211>35
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>t变体rdb6.6t
<400>10
gttacagacgactcccaccactgtacgccgtggga35
<210>11
<211>35
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>a变体rdb6.6a
<400>11
gttacagacgactcccaccactgaacgccgtggga35
<210>12
<211>35
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>g变体rdb6.6g
<400>12
gttacagacgactcccaccactggacgccgtggga35
<210>13
<211>41
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>t变体ldb6.1t
<400>13
acgaggcactgtacgcccctcgtaaatcctcatcaatcatc41
<210>14
<211>41
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>c变体ldb6.1c
<400>14
acgaggcactgcacgcccctcgtaaatcctcatcaatcatc41
<210>15
<211>41
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>a变体ldb6.1a
<400>15
acgaggcactgaacgcccctcgtaaatcctcatcaatcatc41
<210>16
<211>41
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>g变体ldb6.1g
<400>16
acgaggcactggacgcccctcgtaaatcctcatcaatcatc41
<210>17
<211>80
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>左臂受体发卡探针la6.1
<400>17
cctcgtaaatcctcatcaatcatccagtaaaccgccgatgattgatgaggatttacgagg60
gtaggtcagggtggtcacga80
<210>18
<211>72
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>hcr发卡寡核苷酸h1
<400>18
ggcggtttactggatgattgatgaggatttacgaggagctcagtccatcctcgtaaatcc60
tcatcaatcatc72
<210>19
<211>72
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>hcr发卡寡核苷酸h2
<400>19
cctcgtaaatcctcatcaatcatccagtaaaccgccgatgattgatgaggatttacgagg60
atggactgagct72
<210>20
<211>44
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>供臂发卡探针rdb6.3
<400>20
gttacagacgactcccacagtccagcactgcacgccgtggactg44
<210>21
<211>71
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>臂受体发卡探针ra6.2
<400>21
atgtggtcggggtagcggctgaggactgtgggagtcgtctgtaactacttcatgttacag60
acgactcccac71
<210>22
<211>39
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>供臂发卡探针rdb6.1
<400>22
gttacagacgactcccacagcactgcacgccgtgtggga39
<210>23
<211>66
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>臂受体发卡探针ra6.0
<400>23
atgtggtcggggtagcggctgagtgggagtcgtctgtaactacttcatgttacagacgac60
tcccac66
<210>24
<211>36
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>供臂发卡探针rdb6.5
<400>24
gttacagacgactcccacagcactgcacgcgtggga36
<210>25
<211>33
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>供臂发卡探针rdb6.7
<400>25
gttacagacgactcccacactgcacgcgtggga33
<210>26
<211>44
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>臂受体探针通用发卡
<400>26
gtgggagtcgtctgtaactacttcatgttacagacgactcccac44
<210>27
<211>19
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>臂受体探针特异性靶标互补序列
<400>27
gtcggggtagcggctgaag19
<210>28
<211>77
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>cox-2引导rna靶序列
<400>28
ccgguguacgucuuuagagggucgguuuuagagcuagaaauagcaaguuaaaauaaggcu60
aguccguuaucaacuug77
<210>29
<211>60
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>用于cox-2引导rna靶序列的供臂发卡探针
<400>29
gttacagacgactcccacagacgaatacagcgcgaccctctaaagacgttgtattcgtct60
<210>30
<211>82
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>用于cox-2引导rna靶序列的臂受体探针
<400>30
ttaacttgctatttctagctctaacgctgtattcgtctgtgggagtcgtctgtaactact60
tcatgttacagacgactcccac82
<210>31
<211>80
<212>rna
<213>人工序列(artificialsequence)
<220>
<223>阵列3靶序列
<400>31
ucgacgcggagaccacgcucggcuugucuuucgcgcgcaaugcgacgcacgcggauaguu60
agcugcggcgacgaggcacc80
<210>32
<211>90
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>用于环状模板的寡核苷酸
<400>32
tttaagcgtcttaactattagcgtccagtgaatgcgagtccgtctaagagagtagtacag60
cagccgtcaagagtgtctagttctgtcata90
<210>33
<211>26
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>用于环状模板的夹板寡核苷酸
<400>33
taagacgcttaaatatgacagaacta26
<210>34
<211>55
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>供臂发卡寡核苷酸,rdbrca
<400>34
gcttaaatatgacagaactaagtccgaaagacaagccgagcgtggtctccggact55
<210>35
<211>73
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>臂受体发卡寡核苷酸,rarca
<400>35
ccgcgtgcgtcgcattgcgcgcggacttagttctgtcatatttaagctaagacgcttaaa60
tatgacagaacta73
<210>36
<211>20
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>针对rca产物的检测探针
<400>36
tgcgagtccgtctaagagag20
<210>37
<211>1218
<212>dna
<213>智人(homosapiens)
<400>37
gtgcagcacattgttctgatcatctgaagatcagctattagaagagaaagatcagttaag60
tcctttggacctgatcagcttgatacaagaactactgatttcaacttctttggcttaatt120
ctctcggaaacgatgaaatatacaagttatatcttggcttttcagctctgcatcgttttg180
ggttctcttggctgttactgccaggacccatatgtaaaagaagcagaaaaccttaagaaa240
tattttaatgcaggtcattcagatgtagcggataatggaactcttttcttaggcattttg300
aagaattggaaagaggagagtgacagaaaaataatgcagagccaaattgtctccttttac360
ttcaaactttttaaaaactttaaagatgaccagagcatccaaaagagtgtggagaccatc420
aaggaagacatgaatgtcaagtttttcaatagcaacaaaaagaaacgagatgacttcgaa480
aagctgactaattattcggtaactgacttgaatgtccaacgcaaagcaatacatgaactc540
atccaagtgatggctgaactgtcgccagcagctaaaacagggaagcgaaaaaggagtcag600
atgctgtttcgaggtcgaagagcatcccagtaatggttgtcctgcctgcaatatttgaat660
tttaaatctaaatctatttattaatatttaacattatttatatggggaatatatttttag720
actcatcaatcaaataagtatttataatagcaacttttgtgtaatgaaaatgaatatcta780
ttaatatatgtattatttataattcctatatcctgtgactgtctcacttaatcctttgtt840
ttctgactaattaggcaaggctatgtgattacaaggctttatctcaggggccaactaggc900
agccaacctaagcaagatcccatgggttgtgtgtttatttcacttgatgatacaatgaac960
acttataagtgaagtgatactatccagttactgccggtttgaaaatatgcctgcaatctg1020
agccagtgctttaatggcatgtcagacagaacttgaatgtgtcaggtgaccctgatgaaa1080
acatagcatctcaggagatttcatgcctggtgcttccaaatattgttgacaactgtgact1140
gtacccaaatggaaagtaactcatttgttaaaattatcaatatctaatatatatgaataa1200
agtgtaagttcacaacta1218
<210>38
<211>31
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>附加序列
<400>38
aaaaatacttcatgttacagacgactcccac31
<210>39
<211>30
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>右供臂探针
<220>
<221>misc_feature
<222>(19)..(24)
<223>n是a,c,g或t
<400>39
gttacagacgactcccacnnnnnngtggga30
<210>40
<211>17
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>右臂
<400>40
gttacagacgactccca17
<210>41
<211>6
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>互补序列
<400>41
gtggga6
<210>42
<211>3633
<212>dna
<213>智人(homosapiens)
<400>42
atgcgaccctccgggacggccggggcagcgctcctggcgctgctggctgcgctctgcccg60
gcgagtcgggctctggaggaaaagaaagtttgccaaggcacgagtaacaagctcacgcag120
ttgggcacttttgaagatcattttctcagcctccagaggatgttcaataactgtgaggtg180
gtccttgggaatttggaaattacctatgtgcagaggaattatgatctttccttcttaaag240
accatccaggaggtggctggttatgtcctcattgccctcaacacagtggagcgaattcct300
ttggaaaacctgcagatcatcagaggaaatatgtactacgaaaattcctatgccttagca360
gtcttatctaactatgatgcaaataaaaccggactgaaggagctgcccatgagaaattta420
caggaaatcctgcatggcgccgtgcggttcagcaacaaccctgccctgtgcaacgtggag480
agcatccagtggcgggacatagtcagcagtgactttctcagcaacatgtcgatggacttc540
cagaaccacctgggcagctgccaaaagtgtgatccaagctgtcccaatgggagctgctgg600
ggtgcaggagaggagaactgccagaaactgaccaaaatcatctgtgcccagcagtgctcc660
gggcgctgccgtggcaagtcccccagtgactgctgccacaaccagtgtgctgcaggctgc720
acaggcccccgggagagcgactgcctggtctgccgcaaattccgagacgaagccacgtgc780
aaggacacctgccccccactcatgctctacaaccccaccacgtaccagatggatgtgaac840
cccgagggcaaatacagctttggtgccacctgcgtgaagaagtgtccccgtaattatgtg900
gtgacagatcacggctcgtgcgtccgagcctgtggggccgacagctatgagatggaggaa960
gacggcgtccgcaagtgtaagaagtgcgaagggccttgccgcaaagtgtgtaacggaata1020
ggtattggtgaatttaaagactcactctccataaatgctacgaatattaaacacttcaaa1080
aactgcacctccatcagtggcgatctccacatcctgccggtggcatttaggggtgactcc1140
ttcacacatactcctcctctggatccacaggaactggatattctgaaaaccgtaaaggaa1200
atcacagggtttttgctgattcaggcttggcctgaaaacaggacggacctccatgccttt1260
gagaacctagaaatcatacgcggcaggaccaagcaacatggtcagttttctcttgcagtc1320
gtcagcctgaacataacatccttgggattacgctccctcaaggagataagtgatggagat1380
gtgataatttcaggaaacaaaaatttgtgctatgcaaatacaataaactggaaaaaactg1440
tttgggacctccggtcagaaaaccaaaattataagcaacagaggtgaaaacagctgcaag1500
gccacaggccaggtctgccatgccttgtgctcccccgagggctgctggggcccggagccc1560
agggactgcgtctcttgccggaatgtcagccgaggcagggaatgcgtggacaagtgcaac1620
cttctggagggtgagccaagggagtttgtggagaactctgagtgcatacagtgccaccca1680
gagtgcctgcctcaggccatgaacatcacctgcacaggacggggaccagacaactgtatc1740
cagtgtgcccactacattgacggcccccactgcgtcaagacctgcccggcaggagtcatg1800
ggagaaaacaacaccctggtctggaagtacgcagacgccggccatgtgtgccacctgtgc1860
catccaaactgcacctacggatgcactgggccaggtcttgaaggctgtccaacgaatggg1920
cctaagatcccgtccatcgccactgggatggtgggggccctcctcttgctgctggtggtg1980
gccctggggatcggcctcttcatgcgaaggcgccacatcgttcggaagcgcacgctgcgg2040
aggctgctgcaggagagggagcttgtggagcctcttacacccagtggagaagctcccaac2100
caagctctcttgaggatcttgaaggaaactgaattcaaaaagatcaaagtgctgggctcc2160
ggtgcgttcggcacggtgtataagggactctggatcccagaaggtgagaaagttaaaatt2220
cccgtcgctatcaaggaattaagagaagcaacatctccgaaagccaacaaggaaatcctc2280
gatgaagcctacgtgatggccagcgtggacaacccccacgtgtgccgcctgctgggcatc2340
tgcctcacctccaccgtgcagctcatcacgcagctcatgcccttcggctgcctcctggac2400
tatgtccgggaacacaaagacaatattggctcccagtacctgctcaactggtgtgtgcag2460
atcgcaaagggcatgaactacttggaggaccgtcgcttggtgcaccgcgacctggcagcc2520
aggaacgtactggtgaaaacaccgcagcatgtcaagatcacagattttgggctggccaaa2580
ctgctgggtgcggaagagaaagaataccatgcagaaggaggcaaagtgcctatcaagtgg2640
atggcattggaatcaattttacacagaatctatacccaccagagtgatgtctggagctac2700
ggggtgactgtttgggagttgatgacctttggatccaagccatatgacggaatccctgcc2760
agcgagatctcctccatcctggagaaaggagaacgcctccctcagccacccatatgtacc2820
atcgatgtctacatgatcatggtcaagtgctggatgatagacgcagatagtcgcccaaag2880
ttccgtgagttgatcatcgaattctccaaaatggcccgagacccccagcgctaccttgtc2940
attcagggggatgaaagaatgcatttgccaagtcctacagactccaacttctaccgtgcc3000
ctgatggatgaagaagacatggacgacgtggtggatgccgacgagtacctcatcccacag3060
cagggcttcttcagcagcccctccacgtcacggactcccctcctgagctctctgagtgca3120
accagcaacaattccaccgtggcttgcattgatagaaatgggctgcaaagctgtcccatc3180
aaggaagacagcttcttgcagcgatacagctcagaccccacaggcgccttgactgaggac3240
agcatagacgacaccttcctcccagtgcctgaatacataaaccagtccgttcccaaaagg3300
cccgctggctctgtgcagaatcctgtctatcacaatcagcctctgaaccccgcgcccagc3360
agagacccacactaccaggacccccacagcactgcagtgggcaaccccgagtatctcaac3420
actgtccagcccacctgtgtcaacagcacattcgacagccctgcccactgggcccagaaa3480
ggcagccaccaaattagcctggacaaccctgactaccagcaggacttctttcccaaggaa3540
gccaagccaaatggcatctttaagggctccacagctgaaaatgcagaatacctaagggtc3600
gcgccacaaagcagtgaatttattggagcatga3633
<210>43
<211>46
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>右供臂发卡探针egfr3.1(突变型)
<400>43
gttacagacgactcccacagtccgtttggcccgcccaaaatggact46
<210>44
<211>52
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>左供臂发卡探针egfr3.0(野生型)
<400>44
taggtgtttggccagcccaaaatacctacctcgtaaatcctcatcaatcatc52
<210>45
<211>88
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>右受体发卡探针egfr3.0
<400>45
ctccttctgcatggtattctttctcttccgcacccagcaggactgtgggagtcgtctgta60
actacttcatgttacagacgactcccac88
<210>46
<211>90
<212>dna
<213>人工序列(artificialsequence)
<220>
<223>左受体发卡探针egfr3.0
<400>46
cctcgtaaatcctcatcaatcatccagtaaaccgccgatgattgatgaggatttaggagg60
taggtctgtgatcttgacatgctgcggtgt90
<210>47
<211>20
<212>dna
<213>智人(homosapiens)
<400>47
cctacggcgtgcagtgcttc20
- 还没有人留言评论。精彩留言会获得点赞!