杂环衍生物化合物的制备方法、包含所述化合物的组合物及所述化合物的水合物与流程
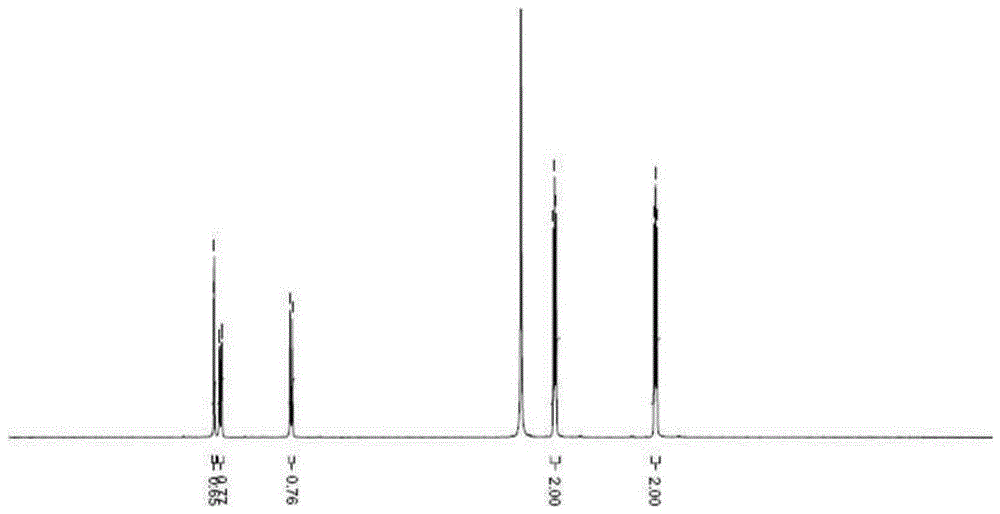
本发明涉及下述化学式ⅰ的杂环衍生物化合物的新制备方法;用于所述制备方法的新中间体化合物;用于治疗或预防高尿酸血症、痛风疾病、肾炎、慢性肾功能衰竭、肾结石、尿毒症、尿路结石或尿酸相关疾病的组合物,所述组合物以超过2mg至10mg以下的施用剂量包含化学式ⅰ的化合物,每天口服施用一次;以及新的化学式ⅰ的化合物的盐酸盐1.5水合物。
背景技术:
:目前,高尿酸血症及痛风的治疗剂或预防剂使用苯溴马隆(benzbromarone),其是具有阻碍人尿酸盐阴离子转运体1(hurat1)活性的作用的尿酸促排剂,此外还使用丙磺舒(probenecid)及磺吡酮(sulfinpyrazone)等药剂,但是对urat1的活性不够充足。尤其,苯溴马隆在副作用的方面存在几个缺点。苯溴马隆对细胞色素p450(cyp450)蛋白质中的2c9蛋白质显示出强的抑制作用,因此具有引起药物-药物间相互作用的可能性,并且也有关于通过谷胱甘肽(gsh)加合物生成实验来生成反应性代谢产物(reactivemetabolite)的报道(参考文献[dermotf.mcginnityetal.,drugmetabolismanddisposition,33,p1700-1707(2005)])。另外,与据报道具有肝毒性的药物苯碘达隆(benziodarone)、苯扎隆(benzarone)及胺碘酮(amiodarone)的药物结构相同,苯溴马隆也是具有苯并呋喃系骨架的药物,因此具有降低肝功能的副作用和诱发肝毒性而引起死亡的事例的问题。因此,打算服用该药物的患者在施用前必须要检查肝功能,而且治疗时建议在服用药物时也要在一定期间(6个月)内确认是否诱发肝毒性,因此在医学领域中需要改善上述问题的药物(参考文献[hautekeetem.l.,etal.,liver,15,p25-29(1995)];文献[makotoarai,etal.,journalofgastroenterologyandhepatology17,p625-626(2002)];文献[埼玉医科大学杂志,30,187-194(2003)];文献[priskakaufmann,etal.,hepatology,41,p925-935(2005)])。国际公开专利wo2009/145456(c&c新药研究所)公开了下述[化学式ⅰ]的杂环衍生物化合物,作为所述化合物的具体实例公开了(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮(化合物4)。[化学式ⅰ]国际公开专利wo2009/145456公开了所述杂环衍生物化合物相比常规的人尿酸盐阴离子转运体1(hurat1)活性抑制剂显示强烈的对hurat1的抑制活性,因此可有效用作尿酸重摄入(reuptake)抑制剂,尤其是选择性抑制剂,对细胞色素p450(cyp450)无药物-药物间相互作用,显示有机阴离子转运体之间的选择性,由于具有更高的溶解度及代谢稳定性而显示有效的药物代谢动力学,因此在治疗或预防下列疾病中显示优于现有的药物的效果:高尿酸血症、急性痛风性关节炎、慢性痛风性关节炎、痛风结节、痛风肾病、肾炎、慢性肾衰竭、肾结石、尿毒症、尿路结石及被报道伴随血中尿酸增加的并发症,如高脂血症、缺血性心脏病、心肌梗塞、动脉硬化、脑梗死、脑血管疾病、糖尿病、高血压等。上述文献中记载了将所述杂环衍生物化合物以3.75mg/kg、7.5mg/kg、15mg/kg口服施用于卷尾(cebus)猴的实验。理论上将这些剂量换算成适用于人的剂量数值时约为15~60mg,在这种高剂量下副作用的危险性非常大。另外,就所述杂环衍生物化合物的盐酸盐而言,由于吸湿性,通过湿法制粒方法以口服施用制剂进行剂型化时存在局限性。另外,作为所述杂环衍生物化合物的合成方法,上述文献公开了如下的化学式ⅰ的杂环衍生物化合物的制备方法,其包括以下步骤:(1)卤化下述化学式vii的化合物,以获得下述化学式x的化合物,然后使获得的化学式x的化合物与下述化学式ix的化合物进行反应,以获得下述化学式viii的化合物,或使下述化学式vii的化合物与下述化学式ix的化合物进行光延(mitsunobu)反应,以获得下述化学式viii的化合物;(2)环化所获得的化学式viii的化合物,以获得化学式iv的化合物;以及(3)进行所获得的化学式iv的化合物与化学式iii的化合物的肽偶联反应。但是,在所述制备方法中作为中间体获得的所述[化学式iv]的噁嗪衍生物中,具有下述结构的3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪为液体且不稳定,因此在分解时生成具有致癌性或诱发突变可能性的杂质,需要额外对这些杂质进行提纯的过程,因此不适于大量生产。另外,所述制备方法中作为所述[化学式ⅲ]的化合物的具有下述结构的3,5-二溴-4-甲氧基-苯甲酰氯的起始物质3,5-二溴-4-甲氧基苯甲酸的价格昂贵,并且在[化学式ⅲ]的化合物与[化学式iv]的噁嗪衍生物合成的过程中存在诱发基因突变的可能性,因此需要能够使其最小化的工艺。另外,美国公开专利us2007-0010670a1(日本烟草公司(japantabaccoinc.))公开了对高尿酸血症、痛风等的治疗有效的具有下述结构式的噁嗪衍生物化合物及其合成方法。技术实现要素:要解决的技术问题为了解决如下问题和缺点,即在化学式ⅰ的杂环衍生物化合物的现有的制备方法中作为中间体获得的噁嗪衍生物在分解时生成具有致癌性或诱发突变的可能性的杂质的问题,所述噁嗪衍生物与3,5-二溴-4-甲氧基-苯甲酰氯合成时生成诱发基因突变的毒性中间体的问题,以及需要额外的提纯工艺以去除各个步骤的杂质,因此制备方法需要经过多个步骤而不适于大量生产的缺点,本发明的目的在于提供化学式ⅰ的杂环衍生物化合物的新制备方法,其特征在于,使用所述噁嗪衍生物的稳定形态的新噁嗪衍生物氢溴酸盐(二氢溴酸盐,2hbr)和新苯甲酸中间体,所述新苯甲酸中间体不生成诱发毒性的物质并可进行原位(insitu)反应而减少制备步骤,因此适于大量生产。另外,本发明的目的在于提供用于所述制备方法的新中间体化合物。另外,本发明的目的在于提供用于治疗或预防高尿酸血症、痛风疾病、肾炎、慢性肾功能衰竭、肾结石、尿毒症、尿路结石或尿酸相关疾病的组合物,其以化学式ⅰ的化合物的游离碱为基准,以超过2mg至10mg以下的施用剂量包含所述化学式ⅰ的化合物、其药学上可接受的盐或其水合物作为有效成分,每天口服施用一次。另外,本发明的目的在于提供新的化学式ⅰ的化合物的盐酸盐1.5水合物。技术方案本发明提供化学式ⅰ的化合物、其药学上可接受的盐或其水合物的制备方法,包括将下述化学式ⅲ的化合物与下述化学式ⅳ的化合物进行偶联反应的步骤。所述式中,r为氢或叔丁氧羰基(boc)。本发明的一个具体实施方案中,所述化学式ⅲ的化合物可以通过将下述化学式ⅱ的化合物与二碳酸二叔丁酯及吡啶进行反应的步骤获得。本发明的一个具体实施方案中,所述化学式ⅰ的化合物的制备方法可以包括以下步骤:(1)将化学式ⅲ的化合物与化学式ⅳ的化合物进行反应,获得化学式ⅴ的化合物;(2)在酸的存在下,将化学式ⅴ的化合物与醇进行反应,获得化学式ⅰ的化合物的盐;以及(3)将化学式ⅰ的化合物的盐第一次与碱进行反应,第二次与酸进行反应。本发明的一个具体实施方案中,所述步骤(1)及步骤(2)可以以原位(insitu)反应进行。本发明的一个具体实施方案中,由所述化学式ⅱ的化合物获得化学式ⅲ的化合物的步骤、所述步骤(1)及步骤(2)可以以原位(insitu)反应进行。本发明的一个具体实施方案中,所述化学式ⅳ的化合物可以通过将3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪与乙酸中的溴酸进行反应的步骤获得。另外,本发明提供下述化学式ⅲ的中间体化合物。所述式中,r为氢或boc。另外,本发明提供下述化学式ⅳ的中间体化合物。另外,本发明提供用于治疗或预防高尿酸血症、痛风疾病、肾炎、慢性肾功能衰竭、肾结石、尿毒症、尿路结石或尿酸相关疾病的药学组合物,其以化学式ⅰ的化合物的游离碱为基准,以超过2mg至10mg以下的施用剂量包含所述化学式ⅰ的化合物、其药学上可接受的盐或其水合物作为有效成分,每天口服施用一次。另外,本发明提供所述化学式ⅰ的化合物、其药学上可接受的盐或其水合物在治疗或预防高尿酸血症、痛风疾病、肾炎、慢性肾功能衰竭、肾结石、尿毒症、尿路结石或尿酸相关疾病中的用途,其中以化学式ⅰ的化合物的游离碱为基准,将所述化学式ⅰ的化合物、其药学上可接受的盐或其水合物以超过2mg至10mg以下的施用剂量每天口服施用一次。另外,本发明提供治疗或预防治疗对象的高尿酸血症、痛风疾病、肾炎、慢性肾功能衰竭、肾结石、尿毒症、尿路结石或尿酸相关疾病的方法,包括:以所述化学式ⅰ的化合物的游离碱为基准,将所述化学式ⅰ的化合物、其药学上可接受的盐或其水合物以超过2mg至10mg以下的施用剂量向治疗对象每天口服施用一次。本发明的一个具体实施方案中,所述化学式ⅰ的化合物的施用剂量以游离碱为基准可以是3~8mg。本发明的一个具体实施方案中,所述化学式ⅰ的化合物可以为化学式ⅰ的化合物的盐酸盐或其1.5水合物形态。另外,本发明提供化学式ⅰ的化合物的盐酸盐1.5水合物。本发明的一个具体实施方案中,所述化学式ⅰ的化合物的盐酸盐1.5水合物在粉末x射线衍射(xrd)分析中在以下2θ位置显示特征峰:11.48±0.5°、24.11±0.5°、24.76±0.5°、27.99±0.5°、31.43±0.5°、34.20±0.5°。本发明的一个具体实施方案中,所述化学式ⅰ的化合物的盐酸盐1.5水合物在粉末x射线衍射(xrd)分析中进一步在以下2θ位置显示特征峰:6.89±0.5°、17.61±0.5°、21.42±0.5°、23.27±0.5°。另外,本发明提供化学式ⅰ的化合物的盐酸盐1.5水合物的制备方法,包括将所述化学式ⅰ的化合物与乙酸、盐酸水溶液及丙酮进行反应生成晶体的步骤。另外,本发明提供剂型化为口服施用制剂的药学组合物,其包含化学式ⅰ的化合物的盐酸盐1.5水合物。本发明的一个具体实施方案中,所述药学组合物可以为片剂形态。有益效果本发明的化学式ⅰ的杂环衍生物化合物的制备方法中使用噁嗪衍生物的稳定的氢溴酸盐(2hbr)形态来代替噁嗪衍生物,从而解决生成具有致癌性或诱发突变的可能性的杂质的问题,并且使用新苯甲酸中间体来代替3,5-二溴-4-甲氧基-苯甲酰氯,从而解决生成诱发基因突变的毒性中间体的问题,因此无需用于去除各个步骤的杂质的额外的提纯工艺,具有通过原位(insitu)反应适于大量生产的优点。另外,将本发明的化学式ⅰ的化合物以超过2mg至10mg以下的施用剂量每天口服施用一次的剂量用法在治疗或预防高尿酸血症、痛风疾病、肾炎、慢性肾功能衰竭、肾结石、尿毒症、尿路结石或尿酸相关疾病中显示出显著优异的效果,并使产生副作用的可能性最小化。另外,就现有的化学式ⅰ的化合物的盐酸盐而言,由于吸湿性,通过湿法制粒方法以口服施用制剂进行剂型化时存在问题,但是本发明的化学式ⅰ的化合物的盐酸盐1.5水合物解决了这种问题,显示出适于口服施用剂型(尤其,片剂)的稳定性。附图说明图1示出实施例1中制备的本发明的3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪氢溴酸盐(2hbr)的nmr数据。图2示出实施例1中制备的本发明的3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪氢溴酸盐(2hbr)的热重(tg)/差热分析(dta)结果。图3示出实施例2中制备的本发明的化学式ⅰ的化合物的nmr数据。图4示出实施例3中制备的本发明的化学式ⅰ的化合物的盐酸盐1.5水合物的粉末x射线衍射(xrd)分析结果。图5示出3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪硫酸盐的nmr数据。图6示出3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪硫酸盐的tg/dta结果。图7示出3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪游离碱形态的nmr数据。图8示出3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪游离碱形态的tg/dta结果。图9示出化学式ⅰ的化合物的盐酸盐非溶剂化物(a)及本发明的化学式ⅰ的化合物的盐酸盐1.5水合物(b)的粉末x射线衍射(xrd)分析的结果。图10示出化学式ⅰ的化合物的盐酸盐非溶剂化物(a)及本发明的化学式ⅰ的化合物的盐酸盐1.5水合物(b)的tg/dta结果。图11示出化学式ⅰ的化合物的盐酸盐非溶剂化物(a)及本发明的化学式ⅰ的化合物的盐酸盐1.5水合物(b)的等温吸湿曲线(watersorptionisotherm)。图12是示出将本发明的化学式ⅰ的化合物的盐酸盐1.5水合物和相同化合物的盐酸盐非溶剂化物的溶解度进行比较的图。图13是示出将本发明的化学式ⅰ的化合物以低剂量(0.25mg、0.5mg、1mg)施用时和以2mg施用时血中尿酸值降低至小于5.0mg/dl的患者的比例(%)(右侧柱)以及血中尿酸值降低至小于6.0mg/dl的患者的比例(%)(左侧柱)的图。图14是示出在本发明的化学式ⅰ的化合物的剂量范围内(3mg、5mg、7mg,10mg)施用时血中尿酸值降低至小于5.0mg/dl的患者的比例(%)(右侧柱)以及血中尿酸值降低至小于6.0mg/dl的患者的比例(%)(左侧柱)的图。具体实施方式以下,更具体地说明本发明。化学式ⅰ的化合物、其盐或水合物的制备方法本发明涉及化学式ⅰ的化合物、其药学上可接受的盐或其水合物的制备方法,包括将下述化学式ⅲ的化合物与下述化学式ⅳ的化合物进行偶联反应的步骤。[反应式1]所述式中,r为氢或boc。具体而言,在化学式ⅲ的化合物中加入碱,并与化学式ⅳ的化合物3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪氢溴酸盐(2hbr)进行偶联反应。对获得的中间体化合物进行后处理,可以获得化学式ⅰ的化合物(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮或其药学上可接受的盐。本发明的一个具体实施方案中,所述化学式ⅲ的化合物可以通过将下述化学式ⅱ的化合物与二碳酸二叔丁酯及吡啶进行反应的步骤获得。[反应式2]具体而言,可以在反应器中加入溶剂,并加入化学式ⅱ的3,5-二溴-4-羟基苯甲酸,然后加入二碳酸二叔丁酯,并加入吡啶进行反应,从而获得化学式ⅲ的化合物。作为低价的起始物质使用的化学式ⅱ的化合物3,5-二溴-4-羟基苯甲酸可以参考公知的方法进行制备,或者可以商购自试剂公司。溶剂通常可以使用对反应不会产生不利影响的常规溶剂,优选的溶剂的实例可以列举二乙醚、四氢呋喃、二氧六环、1,2-二甲氧基乙烷、二甘醇二甲醚(diglyme)等醚类溶剂,苯、甲苯、己烷、二甲苯等烃类溶剂,二氯甲烷、氯仿、四氯化碳、1,2-二氯乙烷等卤代烃类溶剂,甲醇、乙醇、异丙醇、叔丁醇等醇类溶剂,乙酸乙酯、乙酸甲酯、乙酸丁酯等酯类溶剂,丙酮、n,n-二甲基甲酰胺,n,n-二甲基乙酰胺、二甲基亚砜、乙腈等极性溶剂,也可以使用其中两种溶剂的混合溶剂,本反应中优选使用四氢呋喃。具体而言,可以在反应器中加入四氢呋喃(thf),并加入化学式ⅱ的化合物3,5-二溴-4-羟基苯甲酸,然后加入二碳酸二叔丁酯,在氮气气氛下加入吡啶进行反应,获得化学式ⅲ的化合物。此时,反应可以在25~30℃的温度下搅拌约1~3小时来进行。所生成的化学式ⅲ的化合物是新苯甲酸中间体化合物。因此,本发明中还包括下述化学式ⅲ的化合物。所述式中,r为氢或boc。本发明的化学式ⅰ的化合物的制备方法可以包括以下步骤:(1)将化学式ⅲ的化合物与化学式ⅳ的化合物进行反应,获得化学式ⅴ的化合物;(2)在酸的存在下,将化学式ⅴ的化合物与醇进行反应,获得化学式ⅰ的化合物的盐;以及(3)将化学式ⅰ的化合物的盐第一次与碱进行反应,第二次与酸进行反应。[反应式3]所述式中,r为氢或boc。本发明的一个具体实施方案中,所述步骤(1)之前可以进一步包括将化学式ⅱ的化合物与二碳酸二叔丁酯及吡啶进行反应的步骤。此时的所述化学式ⅰ的化合物的制备方法可以由以下反应式表示。[反应式4]所述式中,r为氢或boc。本发明的一个具体实施方案中,所述步骤(1)及步骤(2)可以以原位(insitu)反应进行。本发明的一个具体实施方案中,由所述化学式ⅱ的化合物获得化学式ⅲ的化合物的步骤、所述步骤(1)及步骤(2)可以以原位(insitu)反应进行。“原位(insitu)反应”是指在一个反应器中进行连续的化学反应,也称为“一锅(one-pot)反应”。原位反应可以立即进行下一个反应而无需中间体化合物的分离步骤及提纯步骤,因此非常经济且适于大量生产。下面,更具体地说明所述制备方法。(1)将化学式ⅲ的化合物与化学式ⅳ的化合物进行反应,获得化学式ⅴ的化合物的步骤在化学式ⅲ的化合物中加入碱,并与化学式ⅳ的化合物3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪氢溴酸盐(2hbr)进行反应。反应中使用的碱可以列举三乙胺、吡啶、4-甲基氨基吡啶、4-甲基吗啉、哌嗪、n-甲基哌嗪等有机碱类,或氢氧化锂、氢氧化钠、氢氧化钾、氢氧化钙等碱金属氢氧化物类,或氢化钠、氢化钾等碱金属氢化物,或碳酸钠、碳酸钾、碳酸铯等碱金属碳酸盐类,或碳酸氢钠、碳酸氢钾等碱金属碳酸氢盐,以及磷酸钾,本反应中优选使用三乙胺。具体而言,在反应液中加入三乙胺,并在反应液中加入化学式ⅳ的3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪氢溴酸盐(2hbr),在25~30℃的温度下搅拌反应液约5~7小时。去除形成的盐并收集滤液,然后在25~30℃的温度下将滤液进行浓缩,获得化学式ⅴ的化合物叔丁基-(2,6-二溴-4-(1,2,3,4-四氢-1,7-萘啶-1-羰基)苯基)碳酸酯。(2)在酸的存在下,将化学式ⅴ的化合物与醇进行反应,获得化学式ⅰ的化合物的盐的步骤在装有化学式ⅴ的化合物叔丁基-(2,6-二溴-4-(1,2,3,4-四氢-1,7-萘啶-1-羰基)苯基)碳酸酯的反应器中加入醇,在酸的存在下进行反应,获得(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮的盐。反应中使用的酸可以列举盐酸、硫酸、硝酸、磷酸、氢溴酸、氢碘酸等无机酸,酒石酸、甲酸、柠檬酸、乙酸、三氯乙酸或三氟乙酸、葡萄糖酸、苯甲酸、乳酸、富马酸、马来酸等有机羧酸,甲磺酸、苯磺酸、对甲苯磺酸或萘磺酸等磺酸等,本反应中优选使用盐酸。反应中使用的醇可以列举甲醇、乙醇、异丙醇、叔丁醇等,本反应中优选使用异丙醇。更具体而言,在装有化学式ⅴ的化合物叔丁基-(2,6-二溴-4-(1,2,3,4-四氢-1,7-萘啶-1-羰基)苯基)碳酸酯的温度为25~30℃的反应器中加入异丙醇,并在45℃以下的温度下缓慢地加入浓盐酸,然后将反应液冷却至25~30℃,并搅拌约1~2小时。在25~30℃下,在反应液中加入异丙醇,再搅拌约1小时,然后将反应液冷却至20~25℃。将生成的晶体进行过滤并干燥,获得(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮盐酸盐。(3)将化学式ⅰ的化合物的盐第一次与碱进行反应,第二次与酸进行反应,获得化学式ⅰ的化合物的步骤在干净的反应器中加入水,并在反应器中加入(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮的盐,然后依次与碱及酸进行反应,将生成的晶体进行过滤,获得化学式ⅰ的化合物(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮。反应中使用的碱可以列举三乙胺、吡啶、4-甲基氨基吡啶、4-甲基吗啉、哌嗪、n-甲基哌嗪等有机碱类,或氢氧化锂、氢氧化钠、氢氧化钾、氢氧化钙等碱金属氢氧化物类,或氢化钠、氢化钾等碱金属氢化物,或碳酸钠、碳酸钾、碳酸铯等碱金属碳酸盐类,或碳酸氢钠、碳酸氢钾等碱金属碳酸氢盐,以及磷酸钾,本反应中优选使用氢氧化钠。反应中使用的酸可以列举盐酸、硫酸、硝酸、磷酸、氢溴酸、氢碘酸等无机酸,酒石酸、甲酸、柠檬酸、乙酸、三氯乙酸或三氟乙酸、葡萄糖酸、苯甲酸、乳酸、富马酸、马来酸等有机羧酸,甲磺酸、苯磺酸、对甲苯磺酸或萘磺酸等磺酸等,本反应中优选使用盐酸。更具体而言,在干净的反应器中加入水,并在25~30℃下在反应器中加入所述步骤(2)中获得的(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮盐酸盐,然后在25~30℃下将反应液搅拌约15分钟。在25~30℃下缓慢地加入氢氧化钠水溶液直到ph达到10.0,然后将反应液进行过滤并收集滤液。在反应器中加入乙酸乙酯并搅拌以分离水层,在20~25℃下加入盐酸水溶液直到ph达到6.4~6.7。将生成的晶体进行过滤,获得化学式ⅰ的化合物(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮。在后述的实施例中更具体地说明以上说明的化学式ⅰ的化合物的制备方法。化学式ⅳ的化合物的制备方法本发明的一个具体实施方案中,所述化学式ⅳ的化合物可以通过包括将3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪与乙酸中的溴酸进行反应的步骤的制备方法来制备。本发明的另一个具体实施方案中,所述化学式ⅳ的化合物可以通过下述步骤制备。[反应式5]具体而言,所述制备方法如下。(1)在4-羟基-硝基吡啶中加入三氯氧磷,获得4-氯-3-硝基吡啶。(2)在4-氯-3-硝基吡啶中加入羟乙酸甲酯及碳酸钾,获得2-((3-硝基吡啶-4-基)氧基)乙酸甲酯。(3)在2-((3-硝基吡啶-4-基)氧基)乙酸甲酯中加入氯化铵(nh4cl)及铁(fe),获得2h-吡啶并[4,3-b][1,4]噁嗪-3(4h)-酮。(4)在2h-吡啶并[4,3-b][1,4]噁嗪-3(4h)-酮中加入氢化铝锂(lialh4,lah),获得3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪。(5)在3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪中加入乙酸中的溴酸,最终获得化学式ⅳ的化合物3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪氢溴酸盐(2hbr)。因此,本发明中还包括下述化学式ⅳ的新中间体化合物。在后述的实施例中更具体地说明以上说明的化学式ⅳ的中间体化合物的制备方法。化学式ⅰ的化合物的用途另外,本发明涉及用于治疗或预防高尿酸血症、痛风疾病、肾炎、慢性肾功能衰竭、肾结石、尿毒症、尿路结石或尿酸相关疾病的药学组合物,其以化学式ⅰ的化合物的游离碱为基准,以超过2mg至10mg以下的施用剂量包含所述化学式ⅰ的化合物、其药学上可接受的盐或其水合物作为有效成分,每天口服施用一次。另外,本发明涉及所述化学式ⅰ的化合物、其药学上可接受的盐或其水合物在治疗或预防高尿酸血症、痛风疾病、肾炎、慢性肾功能衰竭、肾结石、尿毒症、尿路结石或尿酸相关疾病中的用途,其中以化学式ⅰ的化合物的游离碱为基准,将所述化学式ⅰ的化合物、其药学上可接受的盐或其水合物以超过2mg至10mg以下的施用剂量每天口服施用一次。另外,本发明涉及治疗或预防治疗对象的高尿酸血症、痛风疾病、肾炎、慢性肾功能衰竭、肾结石、尿毒症、尿路结石或尿酸相关疾病的方法,包括:以所述化学式ⅰ的化合物的游离碱为基准,将所述化学式ⅰ的化合物、其药学上可接受的盐或其水合物以超过2mg至10mg以下的施用剂量向治疗对象每天口服施用一次。本发明的一个具体实施方案中,所述药学组合物、用途及方法中作为有效成分包含的化学式ⅰ的化合物可以为其药学上可接受的盐或水合物的形态。这种药学上可接受的盐包括由酸形成的酸加成盐,所述酸形成含有药学上可接受的阴离子的无毒性酸加成盐,所述酸例如有盐酸、硫酸、硝酸、磷酸、氢溴酸、氢碘酸等无机酸,酒石酸、甲酸、柠檬酸、乙酸、三氯乙酸或三氟乙酸、葡萄糖酸、苯甲酸、乳酸、富马酸、马来酸等有机羧酸,甲磺酸、苯磺酸、对甲苯磺酸或萘磺酸等磺酸等,并且也包括与钠、钾等碱金属的盐。除此之外,还可以包括与芳香族脒衍生物或内酰胺衍生物所属
技术领域:
中公知并使用的其它酸或碱的盐。另外,所述水合物形态可以包括半水合物、一水合物、1.5水合物、二水合物、三水合物等。具体而言,所述药学上可接受的盐可以是盐酸盐,所述水合物可以是1.5水合物形态。血液中的尿酸增加的高尿酸血症(hyperuricemia)是指肾脏中尿酸排泄率减少或尿酸合成增加时尿酸值高于正常值(男性为7~8mg/dl,女性为6mg/dl)的状态,痛风(gout)疾病是指由于尿酸的过度生成或尿酸的排泄降低导致血中尿酸值显著高于正常值(男性为7~8mg/dl,女性为6mg/dl)的患者中尿酸晶体沉积在关节、韧带等软组织,并且针状的尿酸晶体(uricacidcrystal)刺向关节周围的肌肉时,人体的免疫器官攻击尿酸晶体,此时在关节周围引起严重的疼痛和肿胀的阵发性及炎症性关节炎。尿酸晶体的沉积主要发生在大脚趾的跖趾关节(metatarsophalangealjoint),极少的情况下也会发生在脊椎(lumbarspine)(参考文献[vervaeckm.,etal.,clinicalneurologyandneurosurgery,93,p233-236(1991)])。痛风是危险的因素,这是因为除了引发关节炎之外,痛风引发糖尿病、高血压、心脏病、肥胖、肾结石、尿路结石等各种代谢性疾病的并发症的可能性高,发病主要出现在40~50岁的男性患者中,女性患者则在绝经后增加。另外,在肥胖的人群和剧烈运动的人群中发生的频率高。高尿酸血症的长期忽视与痛风疾病发病率密切相关。根据报道,体内尿酸值为9mg/dl以上时,痛风的发生率为4.9%,尿酸值为7.0~8.9mg/dl时,痛风的发生率为0.5%,尿酸值为7.0mg/dl以下时,痛风的发生率为0.1%,在尿酸值高至9mg/dl以上的患者中五年内痛风的累积发生率为约22%(参考文献[campione.w.etal.,am.j.med.,82,p421-426(1987)])。为了治疗重症痛风患者,将血中尿酸值(serumualevel)降低至小于6.0mg/dl,更优选降低至小于5.0mg/dl在临床上具有显著意义。将本发明的化学式ⅰ的化合物、其药学上可接受的盐或其水合物以化学式ⅰ的化合物的游离碱为基准以超过2mg至10mg以下的施用剂量每天口服施用一次的用法在将患者的血中尿酸值减少至小于5.0mg/dl方面具有显著效果。具体而言,如后述的实验例4中所确认,根据本发明的用法施用3mg、5mg、7mg及10mg时,血中尿酸值降低至小于5.0mg/dl的患者数的百分比分别为约23%、64%、80%、73%,观察到在约23~80%的范围(参考图14)。另一方面,将相同的化合物以0.25mg、0.5mg、1mg的剂量施用时,完全没有观察到血中尿酸值降低至小于5.0mg/dl的患者,只有在2mg的剂量下仅为约8%(参考图13)。从上述实验结果可知,超过本发明的用法的剂量范围的下限2mg时,产生显著的效果。另外,将本发明的化学式ⅰ的化合物以超过2mg至10mg以下的施用剂量每天口服施用一次的用法显示出强大的抑制人尿酸盐阴离子转运体1(hurat1)的活性,对如下疾病的治疗或预防有效:高尿酸血症,如急性痛风性关节炎、慢性痛风性关节炎、痛风结节、痛风肾病等痛风疾病,肾炎,慢性肾功能衰竭,肾结石,尿毒症,尿路结石及尿酸相关疾病,如高脂血症、缺血性心脏病、心肌梗塞、脑梗死、脑血管疾病、糖尿病、高血压等。本发明的一个具体实施方案中,所述化学式ⅰ的化合物的施用剂量是每天口服施用一次,在超过2mg至10mg以下的范围内根据患者的疾病、状态、年龄、体重及施用形态而不同,具体可以以3~8mg的施用剂量每天口服施用一次,更具体可以以3~6mg的施用剂量每天口服施用一次。所述剂量范围是以作为活性成分的化学式ⅰ的化合物的游离碱形态为基准,可以以化学式ⅰ的化合物的盐酸盐或其1.5水合物形态施用。具体而言,以化学式ⅰ的化合物的盐酸盐1.5水合物形态施用时,施用剂量可以为超过2.3mg至11.5mg以下。施用剂量为2mg以下时,对治疗所述疾病不能显示出充足的效果,施用剂量为10mg时已显示出最大效果,施用剂量为10mg以上时,虽然具有减少尿酸浓度的效果,但是在治疗过程中引发关节痛(arthralgia)、关节肿胀(jointswelling)等,使得接受治疗的患者感到痛苦,而且有可能发生其它副作用。这种副作用有肌酐(creatinine)的数值增加等,肌酐数值的增加尤其可对肾脏引发致命疾病。如后述的实验例5中所确认,超过本发明的用法的最大剂量10mg时,可以推断关节痛、关节肿胀等不良事例发生率及尿中肌酐的浓度增加的风险高。本发明的用途的对象是动物,优选是哺乳动物,最优选是人。化学式ⅰ的化合物的盐酸盐1.5水合物另外,本发明涉及化学式ⅰ的化合物的盐酸盐1.5水合物。另外,本发明提供化学式ⅰ的化合物的盐酸盐1.5水合物的制备方法,包括将所述化学式ⅰ的化合物与乙酸、盐酸水溶液及丙酮进行反应生成晶体的步骤。具体而言,可以在25℃下在反应器中加入化学式ⅰ的化合物(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮,在相同温度下立即加入乙酸,然后在反应器中加入水,并在25℃下在反应器中加入盐酸水溶液,然后在反应液中加入丙酮生成晶体,然后将生成的晶体进行过滤并真空干燥,获得(3,5-二溴-4-羟基-苯基)-(2,3-二氢-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮盐酸盐1.5水合物。在后述的实施例中更具体地说明以上说明的化学式ⅰ的化合物的盐酸盐1.5水合物的制备方法。本发明的一个具体实施方案中,所述化学式ⅰ的化合物的盐酸盐1.5水合物在粉末x射线衍射(xrd)分析中在以下2θ位置显示特征峰:11.48±0.5°、24.11±0.5°、24.76±0.5°、27.99±0.5°、31.43±0.5°、34.20±0.5°。本发明的一个具体实施方案中,所述化学式ⅰ的化合物的盐酸盐1.5水合物在粉末x射线衍射(xrd)分析中进一步在以下2θ位置显示特征峰:6.89±0.5°、17.61±0.5°、21.42±0.5°、23.27±0.5°。本发明的一个具体实施方案中,所述化学式ⅰ的化合物的盐酸盐1.5水合物在粉末x射线衍射(xrd)分析中在以下2θ位置显示特征峰:6.89±0.5°、10.84±0.5°、11.48±0.5°、13.73±0.5°、15.85±0.5°、17.61±0.5°、18.51±0.5°、19.98±0.5°、21.42±0.5°、22.99±0.5°、23.27±0.5°、24.11±0.5°、24.76±0.5°、27.37±0.5°、27.99±0.5°、31.43±0.5°、34.20±0.5°。另外,本发明涉及剂型化为口服施用制剂的药学组合物,其包含所述化学式ⅰ的化合物的盐酸盐1.5水合物。本发明的药学组合物可以通过将药学上可接受的载体、受体、粘合剂、稳定剂及/或稀释剂和作为活性成分的有效量的化学式ⅰ的化合物的盐酸盐1.5水合物进行混合来制备。对于本发明的药学组合物,根据本发明所属
技术领域:
中具有通常知识者可以容易实施的方法,利用药学上可接受的载体及/或赋形剂进行制剂化,从而可以制成单位剂量形态或加入到多剂量容器中来制备。药学上可接受的载体可以是固体或液体,可以是选自赋形剂、抗氧化剂、缓冲液、抑菌剂、分散剂、吸附剂、表面活性剂、粘合剂、防腐剂、崩解剂、甜味剂、香味剂、助流剂、释放调节剂、湿润剂、稳定剂、悬浮剂及润滑剂中的一种以上。另外,药学上可接受的载体可以选自生理盐水、无菌水、林格氏液、缓冲生理盐水、葡萄糖溶液、麦芽糊精溶液、甘油、乙醇及它们的混合物。本发明的药学组合物可以制成适于口服施用的药学制剂的形态。所述药学制剂可以以粉剂、颗粒剂、片剂、胶囊、糖浆或悬浊液的形态口服施用,具体可以为片剂形态。另外,一个具体实施方案中,所述药学制剂可以以将活性药剂进行包衣或保护其不在胃中分解的方式进行剂型化。以下,通过实施例更详细地说明本发明。但是,这些实施例仅用于示例性地说明一个以上的具体实施方案,本发明的范围并不限定于此。实施例1化学式ⅳ的化合物3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪氢溴酸盐(2hbr)的合成(1)4-氯-3-硝基吡啶的制备将50g(0.356mmol)的4-羟基-硝基吡啶在50ml(1t)的dmf(二甲基甲酰胺)和450ml(9t)的乙酸乙酯中进行搅拌,加入42.5ml的三氯氧磷(pocl3,1.3eq),升温并在70~80℃下加热回流2小时。反应结束后,将反应液冷却至40℃,加入200ml的水终止反应。将分离的有机层分别用200ml的饱和碳酸氢钠(nahco3)、200ml的盐水(brine)洗涤,并将收集的有机层用硫酸镁(mgso4)进行干燥并过滤后减压浓缩,获得60g的淡黄色的浓缩晶体4-氯-3-硝基吡啶。(2)2-((3-硝基吡啶-4-基)氧基)乙酸甲酯的制备将所述步骤(1)中获得的60g(0.356mmol)的4-氯-3-硝基吡啶溶解于300ml(5t)的dmf中,加入36ml(1.3eq)的羟乙酸甲酯和74g(1.5eq)的碳酸钾(k2co3)粉末,升温并在70~80℃下反应1~2小时。反应结束后,冷却至室温,加入150ml的10%hcl溶解并中和,用500ml的乙酸乙酯进行提取。将获得的有机层用150ml的盐水(brine)洗涤,然后将获得的有机层进行减压浓缩并真空干燥,获得62g(82%)的浅褐色固体的2-((3-硝基吡啶-4-基)氧基)乙酸甲酯。(3)2h-吡啶并[4,3-b][1,4]噁嗪-3(4h)-酮的制备将所述步骤(2)中获得的62g(0.291mmol)的2-((3-硝基吡啶-4-基)氧基)乙酸甲酯溶解于480ml的乙腈(acn)和120ml的水(h2o)中,加入16g(1.0eq)的氯化铵(nh4cl)和33g(2.0eq)的铁(fe,iron)粉末,升温并在70~80℃下反应2小时。反应结束后,冷却至室温,加入30ml的浓盐酸(conc-hcl)并搅拌30分钟。将反应液进行过滤以去除不溶物。加入获得的反应液并浓缩直到获得固体,加入到甲醇中进行搅拌并过滤,获得2h-吡啶并[4,3-b][1,4]噁嗪-3(4h)-酮盐酸盐。溶解于水中后用10%氢氧化钠(naoh)中和(ph6~7),将生成的固体进行过滤并干燥,获得2h-吡啶并[4,3-b][1,4]噁嗪-3(4h)-酮。1h-nmr(300mhz,meod-d):δ=8.06(m,2h),6.97(s,1h),4.72(s,2h)。(4)3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪的制备将所述步骤(3)中获得的38g(0.251mmol)的2h-吡啶并[4,3-b][1,4]噁嗪-3(4h)-酮在570ml的四氢呋喃(thf)(15t)中进行搅拌,将反应液的温度冷却至0℃,然后分数次加入15g(1.5eq)的氢化铝锂(lialh4,lah),将反应液升温至室温并搅拌2小时。反应结束后,冷却至0℃,缓慢地滴加40ml的h2o并搅拌10分钟,然后滴加80ml的5%-naoh溶液并搅拌30分钟至室温。将反应液进行过滤以去除al(oh)3不溶物。用10%-hcl中和滤液(ph7),然后用乙酸乙酯进行提取,将用盐水(brine)洗涤的有机层用硫酸钠(na2so4)进行干燥并过滤。将滤液进行减压浓缩,获得3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪(30g,90%)。(5)3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪氢溴酸盐(2hbr)的制备将100g(0.666mol)的2h-吡啶并[4,3-b][1,4]噁嗪-3(4h)-酮在570ml的thf(15t)中进行搅拌,将反应液的温度冷却至0℃,然后分数次加入38g(0.999mol,1.5eq)的氢化铝锂(lialh4,lah),将反应液升温至室温并搅拌2小时。反应结束后,冷却至0℃并进行淬火,并进行过滤以及浓缩后用二氯甲烷(methylenechloride,mc)搅拌并过滤。此时使用的mc是1000ml(10v/w)的2h-吡啶并[4,3-b][1,4]噁嗪-3(4h)-酮。在20~30℃下,在3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪/mc溶液中滴加1.8当量(以2h-吡啶并[4,3-b][1,4]噁嗪-3(4h)-酮为基准,1.199mmol)的294g(210ml)的乙酸中的33%溴酸(d,1.40g/ml)20~30分钟。将生成的晶体溶液在室温下搅拌1小时,冷却至5~10℃,然后再搅拌30分钟。将晶体液进行过滤,用300~500ml的mc洗涤,然后在室温下真空干燥5小时,以95%的收率获得下述化学式ⅳ的化合物3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪氢溴酸盐(2hbr)。图1中示出所述化合物的nmr数据,图2中示出所述化合物的热重(tg)/差热分析(dta)结果。实施例2化学式ⅰ的化合物(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮的合成在25~30℃下,在反应器中加入1l的四氢呋喃(thf),加入139g(0.470mol)的3,5-二溴-4-羟基苯甲酸,然后在反应器中加入278g(1.27mol)的二碳酸二叔丁酯。在氮气气氛下加入125g(1.58mol)的吡啶,并在25~30℃下将反应液搅拌2小时,获得含有3,5-二溴-4-叔丁氧基羰氧基-苯甲酸及3,5-二溴-4-((叔丁氧基羰基)氧基)苯甲酸(叔丁基羰基)酐的反应液。在25~30℃的温度下,在所述反应液中加入170g(1.68mol)的三乙胺,并在反应液中加入100g的所述实施例1中制备的3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪氢溴酸盐(2hbr),在25~30℃的温度下将反应液搅拌6小时。去除形成的盐并收集滤液,然后在25~30℃的温度下将滤液进行浓缩,获得叔丁基-(2,6-二溴-4-(1,2,3,4-四氢-1,7-萘啶-1-羰基)苯基)碳酸酯。在装有叔丁基-(2,6-二溴-4-(1,2,3,4-四氢-1,7-萘啶-1-羰基)苯基)碳酸酯的温度为25~30℃的反应器中加入500ml的异丙醇,并在45℃以下的温度下缓慢地加入500ml的浓盐酸,然后将反应液冷却至25~30℃,并搅拌1~2小时。在25~30℃下,在反应液中加入3l的异丙醇,再搅拌1小时,然后将反应液冷却至20~25℃。将生成的晶体进行过滤并干燥,获得(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮盐酸盐。在干净的反应器中加入水,并在25~30℃下在反应器中加入所述获得的(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮盐酸盐,然后在25~30℃下将反应液搅拌15分钟。在25~30℃下缓慢地加入100ml的4n氢氧化钠水溶液直到ph达到10.0,然后将反应液进行过滤并收集滤液。在反应器中加入乙酸乙酯并搅拌以分离水层,在20~25℃下加入10%盐酸水溶液直到ph达到6.4~6.7。将生成的晶体进行过滤,获得化学式ⅰ的化合物(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮(收率为60%,纯度为98.0%以上)。图3中示出所述化合物的nmr数据。实施例3(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮的盐酸盐1.5水合物的合成在25℃下,在反应器中加入83g的所述实施例2中制备的(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮,并在相同温度下立即加入584ml的乙酸,然后在反应器中加入83ml的水,在25℃下在反应器中加入111ml的2m盐酸水溶液,然后在反应液中加入688ml的丙酮生成晶体,然后将生成的晶体进行过滤并真空干燥12小时,获得(3,5-二溴-4-羟基-苯基)-(2,3-二氢-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮盐酸盐1.5水合物(收率为90%,纯度为99.9%)。图4中示出对获得的(3,5-二溴-4-羟基-苯基)-(2,3-二氢-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮盐酸盐1.5水合物进行粉末x射线衍射(xrd)分析的结果。如图4所示,(3,5-二溴-4-羟基-苯基)-(2,3-二氢-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮盐酸盐1.5水合物在以下2θ位置显示特征峰:6.89±0.5°、10.84±0.5°、11.48±0.5°、13.73±0.5°、15.85±0.5°、17.61±0.5°、18.51±0.5°、19.98±0.5°、21.42±0.5°、22.99±0.5°、23.27±0.5°、24.11±0.5°、24.76±0.5°、27.37±0.5°、27.99±0.5°、31.43±0.5°、34.20±0.5°。实验例13,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪氢溴酸盐(2hbr)的稳定性对实施例1中制备的本发明的3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪氢溴酸盐(2hbr)和通过相同的方法制备获得的其它盐的稳定性进行比较实验。所获得的3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪磷酸盐是凝胶形态(geltype)而不是固体形态,3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪盐酸盐也是半固体形态而具有不稳定的形态。以固体形态获得的物质是3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪氢溴酸盐(2hbr)和3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪硫酸盐。如下表1所示,在硫酸盐形态的情况下,不仅所获得的物质的纯度低于3,4-二氢-2h-吡啶并[4,3-b][1,4]噁嗪游离碱形态,而且在稳定性实验中也发生固体再次融化成液体的现象。另一方面,确认了在氢溴酸盐形态的情况下,不仅纯度比游离碱形态的纯度得以改善,而且4周的稳定性实验结果与初期纯度相比没有显著变化。[表1]稳定性比较实验结果另外,对所述氢溴酸盐形态、硫酸盐形态及游离碱形态测量nmr,并进行热重(thermogravimetric,tg)分析及差热分析(differentialthermalanalysis,dta)。图1中示出氢溴酸盐(2hbr)的nmr数据,图2中示出热重(tg)/差热分析(dta)结果。另外,图5中示出硫酸盐的nmr数据,图6中示出tg/dta结果。另外,图7中示出游离碱的nmr数据,图8中示出tg/dta结果。实验例2(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮的盐酸盐1.5水合物的稳定性对实施例3中制备的本发明的(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮的盐酸盐1.5水合物及相同化合物的盐酸盐非溶剂化物(non-solvate)进行粉末x射线衍射(xrd)分析和tg/dta分析,并测量等温吸湿曲线(watersorptionisotherm),其结果示于图9至图11中。具体而言,图9中示出所述非溶剂化物(a)及1.5水合物(b)的粉末x射线衍射(xrd)分析的结果。图10中示出所述非溶剂化物(a)及1.5水合物(b)的tg/dta结果。图11中示出所述非溶剂化物(a)及1.5水合物(b)的等温吸湿曲线。另外,对所述1.5水合物和非溶剂化物的制备时的物理稳定性(physicalstabilitytoprocessingfactors)进行了比较实验,其结果示于下表2中。[表2]制备时的物理稳定性比较*:使用研钵将样品研磨约2分钟。**:添加30%v/w的溶剂后使用研钵(mortar)将样品制粒约2分钟。将制粒的样品保存在密封的小瓶中约1小时,然后在50℃下将样品干燥约3小时。***:使用7mm的平面形(plat-faced)冲头,在2吨压力下对样品加压5秒钟。****:使用粉末x射线衍射仪评价结晶度。如上表2所示,将研磨及片剂化时的结晶度变化进行比较的结果,1.5水合物比非溶剂化物稳定得多,并且在制粒时对固体形态进行比较的结果,非溶剂化物的一部分转变为1.5水合物的形态,但是1.5水合物没有显示任何变化,可知1.5水合物与非溶剂化物相比显示出更优异的物理稳定性。实验例3(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮的盐酸盐1.5水合物的溶解度将实施例3中制备的本发明的(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮的盐酸盐1.5水合物及相同化合物的盐酸盐非溶剂化物的溶解度进行比较。介质使用50ml的fessif(ph5.0),桨叶速度设为50rpm,在37℃的操作条件下进行试验。使用10mg的化合物和100mg的乳糖的物理混合物作为样品测量溶解度。其结果示于图12中。可知240分钟时的盐酸盐1.5水合物的溶解度为约125μg/ml,但是非溶剂化物的溶解度降低至约112.5μg/ml。实验例4(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮的不同剂量的效果比较实验将共60名的痛风患者为对象,提供实施例3中制备的本发明的(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮的盐酸盐1.5水合物形态,以活性成分(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮(化学式ⅰ)为基准,口服施用0.25mg(n=12)、0.5mg(n=12)、1mg(n=12)、2mg(n=12)及安慰剂(n=12)14天,以安慰剂(placebo)作为对照,评价对血中尿酸值(serumualevel)等的有效性和安全性。在施用后的第15天测量血中尿酸值,确定血中尿酸值降低至小于6.0mg/dl及小于5.0mg/dl的患者数的百分比,并示于图13中。如图13所示,以0.25mg、0.5mg、1mg的剂量施用时,完全没有观察到血中尿酸值降低至小于5.0mg/dl的患者,只有在2mg的剂量下仅观察到约8%。从上述结果可知,施用剂量为2mg以下时对高尿酸血症、痛风等疾病的治疗没有效果。另外,将共68名的痛风患者为对象,提供本发明的(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮的盐酸盐1.5水合物形态,以活性成分(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮(化学式ⅰ)为基准,口服施用3mg(n=13)、5mg(n=14)、7mg(n=15)、10mg(n=15)及安慰剂(n=11)14天,以安慰剂作为对照,评价对血中尿酸值等的有效性和安全性。在施用后的第15天测量血中尿酸值,确定血中尿酸值降低至小于6.0mg/dl及小于5.0mg/dl的患者数的百分比,并示于图14中。如图14所示,以3mg、5mg、7mg、10mg的剂量施用时,血中尿酸值降低至小于5.0mg/dl的患者数的百分比分别为约23%、64%、80%、73%,观察到在约23~80%的范围。血中尿酸值降低至小于6.0mg/dl的患者也出现在所有实验剂量中。从上述实验结果可知,超过本发明的用法的剂量范围的下限2mg时,产生显著的效果。实验例5(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮的不同剂量的副作用分析将共76名的痛风患者为对象,提供实施例3中制备的本发明的(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮的盐酸盐1.5水合物形态,以活性成分(3,5-二溴-4-羟基苯基)(2,3-二氢-4h-吡啶并[4,3-b][1,4]噁嗪-4-基)-甲酮(化学式ⅰ)为基准,口服施用3mg(n=14)、5mg(n=15)、7mg(n=17)、10mg(n=17)及安慰剂(n=13)14天,并调查药物不良反应结果。其结果,如下表3所示,所述用法没有关节痛、关节肿胀等不良事例发生率或这种不良事例发生率极低。[表3]药物不良反应种类安慰剂(n=13)3mg(n=14)5mg(n=15)7mg(n=17)10mg(n=17)关节痛00002名(11.76%)[3例]关节肿胀00001名(5.88%)[1例]另外,将相同的患者为对象测量了尿中肌酐(creatinine)的浓度。与基线(baseline)相比发生肌酐增加0.3mg/dl以上或增加1.5倍以上的事例数示于下表4中。[表4]与基线(baseline)相比发生肌酐增加0.3mg/dl以上或增加1.5倍以上的事例数如上表4所示,在安慰剂施用组及5mg剂量施用组中,相同地仅观察到1个事例,但是在施用最大剂量10mg的组中也观察到3个事例。根据上述结果可推断,超过最大剂量10mg时,尿中肌酐的浓度增加的风险高。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1