多转入基因重组腺病毒的制作方法
与相关申请的交叉引用本申请要求2017年4月12日提交的美国临时专利申请系列号62/484,841的利益和优先权,所述临时申请在此整体通过引用并入本文。本发明的领域是分子生物学和病毒学,具体来说是表达两个或更多个治疗性转入基因的重组病毒。
背景技术:
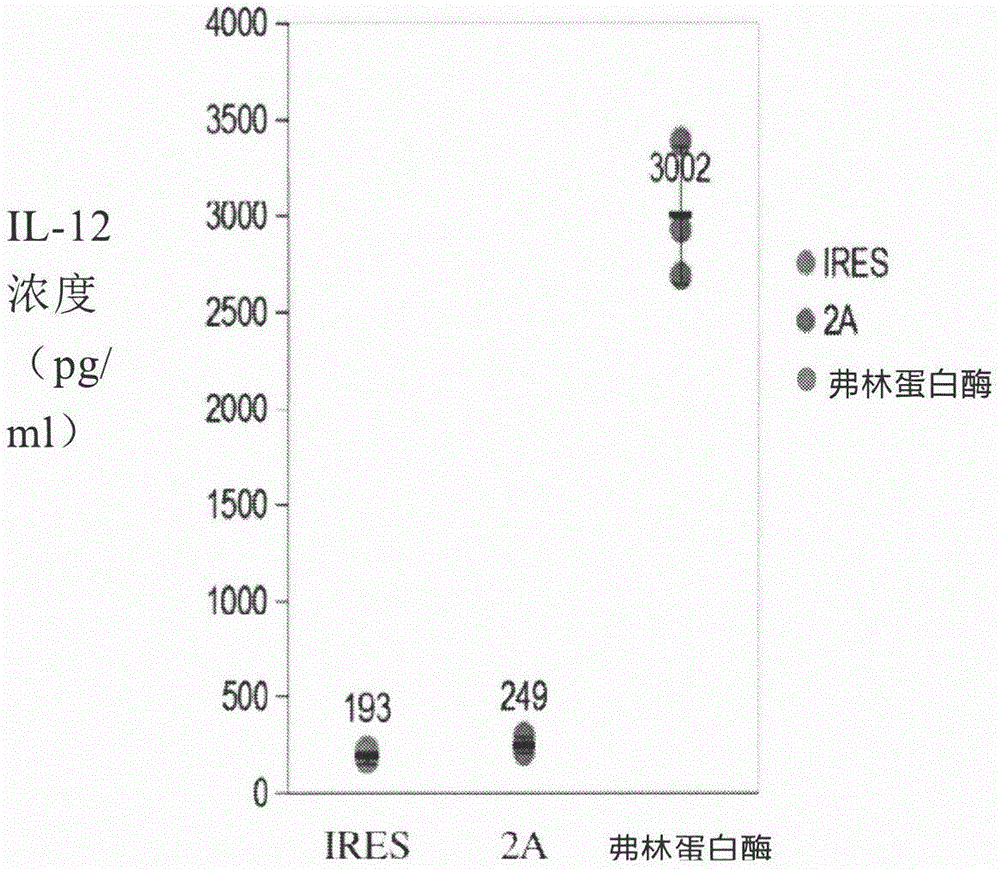
:尽管对引起癌症的基础分子机制已有广泛了解,但大多数晚期癌症仍然不能使用当前的化疗和放疗方案治愈。溶瘤病毒作为有潜力显著增强当前用于各种不同恶性肿瘤的标准治疗的平台技术而出现(kumar,s.等,(2008)currentopinioninmoleculartherapeutics10(4):371-379;kim,d.(2001)expertopiniononbiologicaltherapy1(3):525-538;kimd.(2000)oncogene19(56):6660-6669)。这些病毒已显示出作为溶瘤剂的希望,其不仅通过感染-繁殖-裂解的链式反应直接破坏恶性细胞,而且间接地诱导抗肿瘤免疫。这些免疫刺激性质通过每当病毒复制时复制并表达的治疗性转入基因的插入而被增强。以前开发的溶瘤病毒包括被称为tav-255的溶瘤5血清型腺病毒(ad5),其在正常细胞中转录弱化,但在癌细胞中活跃转录(参见pct公开号wo2010101921)。据信,所述tav-255载体实现这种肿瘤选择性的机制是通过转录因子pea3和e2f的三个转录因子(tf)结合位点的定向缺失,这些转录因子是通过结合到特定dna序列来调控病毒进入宿主细胞后最早转录的基因e1a的腺病毒表达的蛋白质。尽管迄今为止已做出种种努力,但对用于在人类患者中治疗癌症和过度增殖性障碍的改进的重组病毒例如重组溶瘤病毒,仍存在着需求。技术实现要素:本发明部分是基于下述发现,即对于表达两个治疗性转入基因的某些重组腺病毒例如重组溶瘤腺病毒来说,当所述两个治疗性转入基因被表达为具有居间的可切割位点例如可蛋白水解切割位点的单一多肽链时,每个治疗性转入基因的表达可以被大大提高。所述可切割位点随后可以用一种或多种切割试剂例如内源或外源切割试剂进行翻译后切割,以产生由每个治疗性转入基因编码的成熟蛋白产物。这种方法具有确保每个治疗性转入基因的化学计量表达和同时递送的额外优点。一方面,本发明提供了一种重组腺病毒,其包含编码第一治疗性转入基因的第一核苷酸序列、编码第二治疗性转入基因的第二核苷酸序列和配置在所述第一核苷酸序列与第二核苷酸序列之间编码可切割位点的第三核苷酸序列。在某些实施方式中,所述重组腺病毒包含以5’至3’方向包含所述第一核苷酸序列、第三核苷酸序列和第二核苷酸序列的重组多核苷酸序列。在某些实施方式中,所述重组腺病毒包含以5’至3’方向连续包含所述第一核苷酸序列、第三核苷酸序列和第二核苷酸序列的重组多核苷酸序列,例如不存在配置在所述第一核苷酸序列与第三核苷酸序列之间和/或所述第三核苷酸序列与第二核苷酸序列之间的居间核苷酸序列(例如含有另一个转入基因的序列或调控序列)。在某些实施方式中,所述第一核苷酸序列、第三核苷酸序列和第二核苷酸序列被可操作地连接到单一启动子(任选地位于所述第一核苷酸序列的第一核苷酸的5’)并被表达为单一多肽链。所述可切割位点可以是可蛋白水解切割位点,例如被存在于真核细胞的内质网或高尔基体中的蛋白酶切割的可蛋白水解切割位点。在某些实施方式中,所述可蛋白水解切割位点是弗林蛋白酶可切割位点,例如包含序列rx1x2r(seqidno:6)的弗林蛋白酶可切割位点,其中x1是任何氨基酸,并且x2是lys或arg,例如包含序列rakr(seqidno:7)的弗林蛋白酶可切割位点。在某些实施方式中,所述重组腺病毒是5型腺病毒(ad5)或2型腺病毒(ad2)。在某些实施方式中,所述第一、第二和第三核苷酸序列被插入到位于e1b-19k的起始位点与e1b-19k的终止位点之间的e1b-19k插入位点中。在某些实施方式中,所述e1b-19k插入位点位于e1b-19k的起始位点与e1b-55k的起始位点之间。在某些实施方式中,所述e1b-19k插入位点包含在e1b-19k的起始位点附近约100至约305、约100至约300、约100至约250、约100至约200、约100至约150、约150至约305、约150至约300、约150至约250或约150至约200个核苷酸的缺失。在某些实施方式中,所述e1b-19k插入位点包含在e1b-19k的起始位点附近约200个核苷酸、例如202或203个核苷酸的缺失。在某些实施方式中,所述e1b-19k插入位点包含对应于ad5基因组(seqidno:1)的第1714-1917或1714-1916位核苷酸的缺失。在某些实施方式中,所述第一、第二和第三核苷酸序列被插入到对应于ad5基因组(seqidno:1)的第1714和1917位的核苷酸之间或对应于ad5基因组(seqidno:1)的第1714和1916位的核苷酸之间。在某些实施方式中,第一、第二和第三核苷酸序列被插入到ctgacctc(seqidno:2)和tcaccagg(seqidno:3)之间,例如所述重组腺病毒以5’至3’方向包含ctgacctc(seqidno:2)、第一核苷酸序列、第三核苷酸序列、第二核苷酸序列和tcaccagg(seqidno:3)。在某些实施方式中,所述重组腺病毒包含具有功能性pea3结合位点的缺失的e1a启动子。例如,所述病毒可以包含对应于e1a的起始位点上游约-300至约-250位的核苷酸的缺失,例如对应于e1a的起始位点上游-305至-255或-304至-255位的核苷酸的缺失。在某些实施方式中,所述缺失包含对应于ad5基因组(seqidno:1)的第195-244位的核苷酸的缺失,和/或所述e1a启动子包含序列ggtgttttgg(seqidno:4)。在某些实施方式中,所述重组腺病毒包含具有功能性tata盒的缺失,例如整个tata盒的缺失的e1a启动子。例如,在某些实施方式中,所述病毒包含对应于5型腺病毒e1a启动子的-27至-24、-31至-24、-44至+54或-146至+54位的核苷酸的缺失,所述核苷酸分别对应于ad5基因组(seqidno:1)的第472至475、468至475、455至552和353至552位核苷酸。在某些实施方式中,所述病毒包含产生包含序列ctaggactg(seqidno:5)、agtgcccg(seqidno:16)或tattcccg(seqidno:17)的病毒的多核苷酸缺失,所述序列由原本在所述缺失的多核苷酸序列侧翼的两个多核苷酸序列的联结产生。在某些实施方式中,所述重组腺病毒包含对应于5型腺病毒e1a启动子的-29至-26、-33至-26、-44至+52或-148至+52位的核苷酸的缺失。在某些实施方式中,所述病毒包含对应于ad5基因组(seqidno:1)的第353至552位的核苷酸的缺失。在某些实施方式中,所述病毒包含产生包含序列ctaggactg(seqidno:5)的病毒的多核苷酸缺失,所述序列由原本在所述缺失的多核苷酸序列侧翼的两个多核苷酸序列的联结产生。在某些实施方式中,所述重组腺病毒包含具有功能性caat盒的缺失,例如整个caat盒的缺失的e1a启动子。例如,在某些实施方式中,所述病毒包含对应于5型腺病毒e1a启动子的-76至-68位的核苷酸的缺失,所述核苷酸对应于ad5基因组(seqidno:1)的第423至431位核苷酸。在某些实施方式中,所述病毒包含产生包含序列ttccgtggcg(seqidno:18)的病毒的多核苷酸缺失,所述序列由原本在所述缺失的多核苷酸序列侧翼的两个多核苷酸序列的联结产生。在某些实施方式中,所述重组腺病毒包含e3缺失。在某些实施方式中,所述e3缺失包含约500至约3185、约500至约3000、约500至约2500、约500至约2000、约500至约1500、约500至约1000、约1000至约3185、约1000至约3000、约1000至约2500、约1000至约2000、约1000至约1500、约1500至约3185、约1500至约3000、约1500至约2000、约2000至约3185、约2000至约3000、约2000至约2500、约2500至约3185、约2500至约3000或约3000至约3185个核苷酸的缺失。在某些实施方式中,所述e3缺失位点位于pviii的终止位点与fiber的起始位点之间。在某些实施方式中,所述e3缺失位点位于e3-10.5k的终止位点与e3-14.7k的终止位点之间。在某些实施方式中,所述e3缺失包含在e3-10.5k的终止位点附近约500至约1551、约500至约1500、约500至约1000、约1000至约1551、约1000至约1500或约1500至约1551个核苷酸的缺失。在某些实施方式中,所述e3缺失包含在e3-10.5k的终止位点附近约1050个核苷酸的缺失,例如所述e3缺失包含在e3-10.5k的终止位点附近1063或1064个核苷酸的缺失。在某些实施方式中,所述e3缺失包含对应于ad5d1309e3缺失的缺失。在某些实施方式中,所述e3缺失包含对应于ad5基因组(seqidno:1)的第29773-30836位核苷酸的缺失。在某些实施方式中,所述e3缺失位于e3-gp19k的终止位点与e3-14.7k的终止位点之间。在某些实施方式中,所述e3缺失包含在e3-gp19k的终止位点附近约500至约1824、约500至约1500、约500至约1000、约1000至约1824、约1000至约1500或约1500至约1824个核苷酸的缺失。在某些实施方式中,所述e3缺失包含在e3-gp19k的终止位点附近约1600个核苷酸的缺失,例如所述e3缺失包含在e3-gp19k的终止位点附近1622个核苷酸的缺失。在某些实施方式中,所述e3缺失包含对应于ad5基因组(seqidno:1)的第29218-30839位核苷酸的缺失。在某些实施方式中,所述重组腺病毒还包含e4缺失。在某些实施方式中,所述e4缺失位于e4-orf6/7的起始位点与右侧末端反向重复序列(itr)之间。在某些实施方式中,所述e4缺失位于e4-orf6/7的起始位点与e4-orf1的起始位点之间。在某些实施方式中,所述e4缺失包含约500至约2500、约500至约2000、约500至约1500、约500至约1000、约1000至约2500、约1000至约2000、约1000至约1500、约1500至约2500、约1500至约2000或约2000至约2500个核苷酸的缺失。在某些实施方式中,所述e4缺失包含在e4-orf6/7的起始位点附近约250至约1500、约250至约1250、约250至约1000、约250至约750、约250至约500、500至约1500、约500至约1250、约500至约1000、约500至约750、750至约1500、约750至约1250、约750至约1000、约1000至约1500或约1000至约1250个核苷酸的缺失。在某些实施方式中,所述e4缺失包含在e4-orf6/7的起始位点附近约1450个核苷酸的缺失,例如,所述e4缺失包含在e4-orf6/7的起始位点附近1449个核苷酸的缺失。在某些实施方式中,所述e4缺失包含对应于ad5基因组(seqidno:1)的第34078-35526位核苷酸的缺失。在某些实施方式中,所述第一和/或第二治疗性转入基因编码选自乙酰胆碱、抗ctla-4抗体重链或轻链、抗pd-1抗体重链或轻链、抗pd-l1抗体重链或轻链、boris/ctcfl、cd19、cd20、cd40l、cd70、cd80、cd86、cd137、cd137l、cd154、dkk1/wnt、fgf、gitrl、gm-csf、icam、il-1、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10阱、il-15、il-15il-15受体融合蛋白、il-17、il-23、il-23a/p19、il-12b/p40、il-24、il-27、il-27a/p28、il-27b/ebi3、il-35、干扰素-γ、mage、ny-eso-1、ox40l、p53、分泌的鞭毛蛋白、tgf-β、tgf-β阱、胸苷激酶和tnf-α的多肽。在某些实施方式中,所述第一和/或第二治疗性转入基因编码选自乙酰胆碱、抗ctla-4抗体重链或轻链、抗pd-1抗体重链或轻链、抗pd-l1抗体重链或轻链、boris/ctcfl、cd19、cd20、cd40l、cd70、cd80、cd86、cd137、cd137l、cd154、dkk1/wnt、fgf、gitrl、gm-csf、icam、il-1、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10阱、il-12、il-12a/p35、il-12b/p40、il-15、il-15il-15受体融合蛋白、il-23a/p19、干扰素-γ、mage、ny-eso-1、ox40l、p53、分泌的鞭毛蛋白、tgf-β、tgf-β阱、胸苷激酶和tnf-α的多肽。在某些实施方式中,所述第一和第二治疗性转入基因分别编码异二聚体蛋白例如异二聚体细胞因子的第一和第二亚基。例如,在某些实施方式中,在任何上述重组腺病毒中,所述第一和/或第二治疗性转入基因选自il-12a/p35和il-12b/p40,例如所述第一治疗性转入基因编码il-12b/p40并且所述第二治疗性转入基因编码il-12a/p35。在某些实施方式中,所述重组腺病毒包含编码由seqidno:8的第17-1000位核苷酸、seqidno:8的第1013-1606位核苷酸和/或seqidno:8的第17-1606位核苷酸编码的氨基酸序列的核苷酸序列。在某些实施方式中,所述重组腺病毒包含seqidno:8的核苷酸序列,或者包含与seqidno:8具有80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的序列。在某些实施方式中,在任何上述重组腺病毒中,所述第一和/或第二治疗性转入基因选自il-23a/p19和il-12b/p40,例如所述第一治疗性转入基因编码il-12b/p40并且所述第二治疗性转入基因编码il-23a/p19。在某些实施方式中,所述重组腺病毒包含编码由seqidno:9的第17-1000位核苷酸、seqidno:9的第1013-1582位核苷酸和/或seqidno:9的第17-1582位核苷酸编码的氨基酸序列的核苷酸序列。在某些实施方式中,所述重组腺病毒包含seqidno:9的核苷酸序列,或者包含与seqidno:9具有80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的序列。在某些实施方式中,任何上述重组病毒可以在过度增殖性细胞中选择性复制。在某些实施方式中,任何上述重组病毒可以在过度增殖性细胞中选择性表达两个或更多个治疗性转入基因。所述过度增殖性细胞可以是癌细胞例如肺癌细胞、结肠癌细胞和胰腺癌细胞。在某些实施方式中,任何上述重组病毒可以是溶瘤病毒。在某些实施方式中,在任何上述重组腺病毒中,所述第一和/或第二治疗性转入基因不被可操作连接到外源启动子序列。在某些实施方式中,所述第一和第二治疗性转入基因的尺寸在合并时为约500至约5000、约500至约4000、约500至约3000、约500至约2000、约500至约1000、约1000至约5000、约1000至约4000、约1000至约3000、约1000至约2000、约2000至约5000、约2000至约4000、约2000至约3000、约3000至约5000、约3000至约4000或约4000至5000个核苷酸。在某些实施方式中,所述第一和第二治疗性转入基因的尺寸在合并时为约500至约7000、约500至约6000、约500至约5000、约500至约4000、约500至约3000、约500至约2000、约500至约1000、约1000至约7000、约1000至约6000、约1000至约5000、约1000至约4000、约1000至约3000、约1000至约2000、约2000至约7000、约2000至约6000、约2000至约5000、约2000至约4000、约2000至约3000、约3000至约7000、约3000至约6000、约3000至约5000、约3000至约4000、约4000至约7000、约4000至约6000、约4000至约5000、约5000至约7000、约5000至约6000或约6000至约7000个核苷酸。在某些实施方式中,所述第一和第二治疗性转入基因的尺寸在合并时至少为约500至约5000、约500至约4000、约500至约3000、约500至约2000、约500至约1000、约1000至约5000、约1000至约4000、约1000至约3000、约1000至约2000、约2000至约5000、约2000至约4000、约2000至约3000、约3000至约5000、约3000至约4000或约4000至5000个核苷酸。在某些实施方式中,所述第一和第二治疗性转入基因的尺寸在合并时至少为约500至约7000、约500至约6000、约500至约5000、约500至约4000、约500至约3000、约500至约2000、约500至约1000、约1000至约7000、约1000至约6000、约1000至约5000、约1000至约4000、约1000至约3000、约1000至约2000、约2000至约7000、约2000至约6000、约2000至约5000、约2000至约4000、约2000至约3000、约3000至约7000、约3000至约6000、约3000至约5000、约3000至约4000、约4000至约7000、约4000至约6000、约4000至约5000、约5000至约7000、约5000至约6000或约6000至约7000个核苷酸。在某些实施方式中,所述第一和第二治疗性转入基因的尺寸在合并时为至少约500、约1000、约2000、约3000、约4000或约5000个核苷酸。在某些实施方式中,所述第一和第二治疗性转入基因的尺寸在合并时为至少约500、约1000、约2000、约3000、约4000、约5000、约6000或约7000个核苷酸。在某些实施方式中,所述第一和第二治疗性转入基因的尺寸在合并时为约1600个核苷酸、约1650个核苷酸或约3100个核苷酸。另一方面,本发明提供了一种药物组合物,其包含每种上述重组腺病毒和至少一种可药用载体或稀释剂。另一方面,本发明提供了一种在对象中治疗癌症的方法。所述方法包括向所述对象给药有效量的本文中描述的重组腺病毒,以在所述对象中治疗所述癌症疾病。在某些实施方式中,所述癌症选自肛门癌、基底细胞癌、膀胱癌、骨癌、脑癌、乳腺癌、上皮癌、胆管癌、宫颈癌、结肠癌、结肠直肠癌、子宫内膜癌、胃食管癌、胃肠(gi)癌、胃肠间质瘤、肝细胞癌、妇科癌症、头颈癌、血液癌、肾癌、白血病、肝癌、肺癌、淋巴瘤、黑素瘤、梅克尔细胞癌、间皮瘤、神经内分泌癌症、非小细胞肺癌、卵巢癌、胰腺癌、儿科癌症、前列腺癌、肾细胞癌、肉瘤、皮肤癌、小细胞肺癌、皮肤的鳞状细胞癌、胃癌、睾丸癌和甲状腺癌。另一方面,本发明提供了一种在对象中抑制肿瘤细胞增殖的方法。所述方法包括向所述对象给有效量的本文中描述的重组腺病毒,以抑制所述肿瘤细胞的增殖。另一方面,本发明提供了一种在对象中抑制肿瘤生长的方法。所述方法包括向所述对象给有效量的本文中描述的重组腺病毒,以抑制所述肿瘤细胞的增殖。在每一种上述方法中,所述重组腺病毒可以例如与选自手术、辐射、化疗、免疫疗法、激素疗法和病毒疗法的一种或多种疗法相组合给药。在每一种上述方法中,所述重组腺病毒的有效量可以是例如102-1015噬斑形成单位(pfus)。在任何上述方法的某些实施方式中,所述对象可以是人类例如人类幼儿。另一方面,本发明提供了一种在靶细胞中表达两个或更多个治疗性转入基因的方法。所述方法包括向所述细胞递送例如将所述细胞暴露于有效量的本文中描述的重组腺病毒,以表达所述靶转入基因。在某些实施方式中,所述两个治疗性转入基因在表达时产生单一多肽链,其可以被翻译后切割成两条多肽链。本发明的这些以及其他的方面和优点将通过下面的附图、详细描述和权利要求书来说明。附图说明参考下面的附图可以更完全地理解本发明。图1是描绘了通过elisa确定的用编码具有不同连接物的il-12的质粒瞬时转染的hek-293细胞的il-12表达的图。点表示一式三份测量的浓度,深色条表示平均值,误差条表示标准偏差。图2是来自于tav-hil-12-furin腺病毒(标注为“furin”)、tav-hil-12-separate腺病毒(标注为“separate”)和对照d1309腺病毒的dna的pcr产物的凝胶,证实了预期尺寸的产物。图3描绘了在用所指示的病毒感染后的指示时间点时ads-12细胞的结晶紫染色。结晶紫将活细胞染成紫色。图4是描绘了通过elisa确定的用tav-δ19k和tav-mil12-ires感染的ads-12细胞的il-12表达的条形图。误差条表示标准偏差。图5是描绘了tav-δ19k和tav-mil-12-ires在ads-12细胞中的病毒复制的条形图。误差条表示标准偏差。图6是描绘了通过elisa确定的用tav-δ19k、tav-hil-12-ires、tav-hil-12-furin感染或不用病毒感染的a549细胞的il-12表达的条形图。图7描绘了在用所指示的病毒感染后的指示时间点时a549细胞的结晶紫染色。结晶紫将活细胞染成紫色。图8是描绘了tav-δ19k、tav-hil-12-ires和tav-hil-12-furin在a549细胞中的病毒复制的条形图。图9是描绘了来自于病毒tav-mil-12-furin的il-12表达的线形图。将a549细胞以所指示的moi感染,并通过elisa在所指示的时间点测量调制培养基中的il-12浓度。ct指示未感染的对照细胞。图10是描绘了来自于病毒tav-mil-23-furin的il-23和来自于病毒tav-mil-27-furin的il-27的表达的条形图。将a549细胞以moi值为5进行感染,并在感染后4天通过elisa测量每种病毒在调制培养基中的相应细胞因子的浓度。详细描述本发明部分是基于下述发现,即对于表达两个治疗性转入基因的某些重组腺病毒例如重组溶瘤腺病毒来说,当所述两个治疗性转入基因被表达为具有居间的可切割位点例如可蛋白水解切割位点的单一多肽链时,每个治疗性转入基因的表达可以被大大提高。所述可切割位点随后可以用一种或多种切割试剂例如内源或外源切割试剂进行翻译后切割,以产生由每个治疗性转入基因编码的成熟蛋白产物。这种方法具有确保每个治疗性转入基因的化学计量表达和同时递送的额外优点。因此,一方面,本发明提供了一种重组腺病毒,其包含编码第一治疗性转入基因的第一核苷酸序列、编码第二治疗性转入基因的第二核苷酸序列和配置在所述第一核苷酸序列与第二核苷酸序列之间编码可切割位点的第三核苷酸序列。在某些实施方式中,所述重组腺病毒包含以5’至3’方向包含所述第一核苷酸序列、第三核苷酸序列和第二核苷酸序列的重组多核苷酸序列。在某些实施方式中,所述重组腺病毒包含以5’至3’方向连续包含所述第一核苷酸序列、第三核苷酸序列和第二核苷酸序列的重组多核苷酸序列,例如不存在配置在所述第一核苷酸序列与第三核苷酸序列之间和/或所述第三核苷酸序列与第二核苷酸序列之间的居间核苷酸序列(例如含有另一个转入基因的序列或调控序列)。在某些实施方式中,所述第一核苷酸序列、第三核苷酸序列和第二核苷酸序列被可操作地连接到单一启动子(任选地位于所述第一核苷酸序列的第一核苷酸的5’)并被表达为单一多肽链。在某些实施方式中,所述重组腺病毒是溶瘤病毒,例如表现出肿瘤选择性复制和/或病毒介导的裂解的病毒。在某些实施方式中,所述溶瘤病毒允许治疗性转入基因的选择性表达,例如,所述病毒允许所述治疗性转入基因在赘生性细胞中表达,但在正常细胞中减弱表达。在某些实施方式中,所述治疗性转入基因在非过度增殖性细胞中的表达为在过度增殖性细胞中的表达的约90%、约80%、约70%、约60%、约50%、约40%、约30%、约20%、约10%或约5%。在某些实施方式中,所述病毒在非过度增殖性细胞中不表现出所述治疗性转入基因的可检测的表达。治疗性转入基因表达可以通过本领域中已知的任何适合方法来确定,例如western印迹或elisa。所述过度增殖性细胞可以是癌细胞例如上皮癌、肉瘤、白血病、淋巴瘤、前列腺癌、肺癌、胃肠道癌、结肠直肠癌、胰腺癌、乳腺癌、卵巢癌、宫颈癌、胃癌、甲状腺癌、间皮瘤、肝癌、肾癌、皮肤癌、头颈癌或脑癌细胞。i.病毒术语“病毒”在本文中用于指称不具有蛋白质合成或能量产生机制的任何专性细胞内寄生物。病毒基因组可以是rna或dna。在本发明的实践中有用的病毒包括重组修饰的包膜或无包膜dna和rna病毒,优选地选自杆状病毒科、细小病毒科、小核糖核酸病毒科、疱疹病毒科、痘病毒科或腺病毒科。重组修饰的病毒在本文中被称为“重组病毒”。重组病毒可以例如通过重组dna技术被修饰成复制缺陷型、条件复制型或复制型,和/或通过重组dna技术被修饰成包含外源转入基因的表达。利用每种亲本载体性质的有利要素的嵌合病毒载体(参见例如feng等,(1997)naturebiotechnology15:866-870),在本发明的实践中也可能是有用的。尽管使用来自于待治疗物种的病毒通常是有利的,但在某些情况下使用源自于具有有利致病特点的不同物种的载体也可能是有利的。例如,用于人类基因疗法的马疱疹病毒载体被描述在pct公开号wo98/27216中。所述载体被描述为可用于人类治疗,因为所述马病毒对人类无致病性。同样地,绵羊腺病毒载体可用于人类基因疗法,因为它们据称避免了针对人类腺病毒载体的抗体。这些载体被描述在pct公开号wo97/06826中。优选地,所述重组病毒是腺病毒。腺病毒是中等尺寸(90-100nm)、无包膜的(裸露的)二十面体病毒,由核衣壳和双链线性dna基因组构成。腺病毒在哺乳动物的核中使用宿主的复制机器复制。术语“腺病毒”是指腺病毒属包括但不限于人、牛、绵羊、马、犬、猪、鼠和猿猴腺病毒亚属中的任何病毒。具体来说,人类腺病毒包括a-f亚属及其各个血清型,所述各个血清型和a-f亚属包括但不限于人类腺病毒1、2、3、4、4a、5、6、7、8、9、10、11(ad11a和ad11p)、12、13、14、15、16、17、18、19、19a、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、34a、35、35p、36、37、38、39、40、41、42、43、44、45、46、47、48和91型。优选的是源自于人类腺病毒2和5型的重组病毒。除非另有陈述,否则所有5型腺病毒的核苷酸编号是相对于ncbi参考序列ac_000008.1,其在本文中被描绘在seqidno:1中。腺病毒的复制周期具有两个阶段:早期阶段,在此期间4个转录单位e1、e2、e3和e4被表达,以及晚期阶段,其在病毒dna合成开始后发生,此时主要从主要晚期启动子(mlp)表达晚期转录本。所述晚期信使编码病毒的大多数结构蛋白。e1、e2和e4的基因产物负责转录激活、细胞转化、病毒dna复制以及其他病毒功能,并且对于病毒生长来说是必需的。术语“可操作连接”是指多核苷酸元件以功能性关系的连接。当一个核酸序列与另一个核酸序列形成功能性关系时,核酸序列是“可操作连接”的。例如,启动子或增强子如果影响基因的转录,则它被可操作连接到所述基因。可操作连接的核苷酸序列通常是毗邻的。然而,由于增强子通常在与启动子相隔几千碱基时起作用并且内含子序列可能具有可变的长度,因此某些多核苷酸元件可能是可操作连接的但不直接位于侧翼,并且可以甚至从不同的等位基因或染色体反式起作用。在某些实施方式中,所述重组腺病毒具有对调控序列或启动子的一个或多个修饰。对调控序列或启动子的修饰包括与所述调控序列或启动子的野生型序列相比一个或多个核苷酸的缺失、替换或添加。在某些实施方式中,所述调控序列或启动子的修饰包括转录因子结合位点序列的修饰,以例如通过缺失其一部分或通过在所述结合位点中插入单一点突变来降低其对转录因子的亲和性。在某些实施方式中,所述修饰的调控序列增强在赘生性细胞中的表达和/或减弱在正常细胞中的表达。在某些实施方式中,所述修饰的调控序列被可操作连接到编码蛋白质的序列。在某些实施方式中,腺病毒e1a和e1b基因(编码区)中的至少一个被可操作连接到修饰的调控序列。在某些实施方式中,所述e1a基因被可操作连接到修饰的调控序列。所述e1a调控序列含有用于转录因子pea3的5个结合位点,被称为pea3i、pea3ii、pea3iii、pea3iv和pea3v,其中pea3i是最接近于e1a起始位点的pea3结合位点,并且pea3v是最远离的。所述e1a调控序列还含有用于转录因子e2f的结合位点,因此被称为e2fi和e2fii,其中e2fi是最接近于e1a起始位点的e2f结合位点,e2fii是最远离的。从e1a起始位点起,所述结合位点如下排列:pea3i,e2fi,pea3ii,e2fii,pea3iii,pea3iv和pea3v。在某些实施方式中,这七个结合位点中的至少一者或七个功能性结合位点中的至少一者被缺失。当在本文中使用时,“功能性结合位点”是指能够结合到相应的结合配偶体例如转录因子的结合位点,例如具有相应野生型结合位点序列的至少100%、至少90%、至少80%、至少70%、至少60%、至少50%或至少40%的结合活性的结合位点。当在本文中使用时,“非功能性结合位点”是指例如具有相应野生型结合位点序列的低于30%、低于20%、低于10%或0%的结合活性的结合位点。在某些实施方式中,所述重组腺病毒包含具有功能性pea3结合位点的缺失例如整个pea3结合位点的缺失的e1a启动子。当在本文中使用时,“功能性pea3结合位点”是指能够结合到它的相应转录因子(例如pea3)的pea3结合位点,例如具有相应的野生型pea3结合位点序列的至少100%、至少90%、至少80%、至少70%、至少60%、至少50%或至少40%的pea3结合活性的的pea3结合位点。当在本文中使用时,“非功能性pea3结合位点”是指例如具有相应野生型pea3结合位点序列的低于30%、低于20%、低于10%或0%的pea3结合活性的pea3结合位点。用于确定pea3结合位点是否结合到pea3的测定法在本领域中是已知的。示例性的结合测定法包括电泳迁移率变动测定法、染色质免疫沉淀测定法和dna酶足迹测定法。在某些实施方式中,至少一个pea3结合位点或功能性pea3结合位点被缺失。所述缺失的pea3结合位点可以是pea3i、pea3ii、pea3iii、pea3iv和/或pea3v。在某些实施方式中,所述缺失的pea3结合位点是pea3ii、pea3iii、pea3iv和/或pea3v。在某些实施方式中,所述缺失的pea3结合位点是pea3iv和/或pea3v。在某些实施方式中,所述缺失的pea3结合位点是pea3ii和/或pea3iii。在某些实施方式中,所述缺失的pea3结合位点是pea3ii和pea3iii两者。在某些实施方式中,所述pea3i结合位点或功能性pea3i结合位点被保留。在某些实施方式中,至少一个e2f结合位点或功能性e2f结合位点被缺失。在某些实施方式中,至少一个e2f结合位点或功能性e2f结合位点被保留。在某些实施方式中,所述保留的e2f结合位点是e2fi和/或e2fii。在某些实施方式中,所述保留的e2f结合位点是e2fii。在某些实施方式中,全部缺失基本上由pea3ii、pea3iii、pea3iv和/或pea3v中的一者或多者构成。在某些实施方式中,所述重组腺病毒包含至少一个e2f结合位点或其功能性部分的缺失。在某些实施方式中,所述重组腺病毒包含至少一个e2f结合位点或其功能性部分的缺失,并且不包含pea3结合位点的缺失。在某些实施方式中,所述病毒具有位于e1a起始位点上游-304至-255位,例如对应于ad5基因组(seqidno:1)的第195-244位的50个碱基对区域的缺失,其在后文中被称为tav-255缺失。在某些实施方式中,所述tav-255缺失产生包含序列ggtgttttgg(seqidno:4)的e1a启动子。在某些实施方式中,所述重组腺病毒包含具有功能性tata盒的缺失例如整个tata盒的缺失的e1a启动子。当在本文中使用时,“功能性tata盒”是指能够结合到tata盒结合蛋白(tbp)的tata盒,例如具有相应野生型tata盒序列的至少100%、至少90%、至少80%、至少70%、至少60%、至少50%或至少40%的tbp结合活性的tata盒。当在本文中使用时,“非功能性tata盒”是指例如具有相应野生型tata盒序列的低于30%、低于20%、低于10%或0%的tbp结合活性的tata盒。用于确定tbp是否结合到tata盒的测定法在本领域中是已知的。示例性的结合测定法包括电泳迁移率变动测定法、染色质免疫沉淀测定法和dna酶足迹测定法。例如,在某些实施方式中,所述重组腺病毒包含对应于5型腺病毒e1a启动子的-27至-24、-31至-24、-44至+54或-146至+54位的核苷酸的缺失,所述核苷酸分别对应于ad5基因组(seqidno:1)的第472至475、468至475、455至552和353至552位核苷酸。在某些实施方式中,所述病毒包含对应于5型腺病毒e1a启动子的-29至-26、-33至-26、-44至+52或-148至+52位的核苷酸的缺失。在某些实施方式中,所述病毒包含对应于ad5基因组(seqidno:1)的第353至552位的核苷酸的缺失。在某些实施方式中,所述病毒包含产生包含序列ctaggactg(seqidno:5)、agtgcccg(seqidno:16)或tattcccg(seqidno:17)的病毒的多核苷酸缺失,所述序列由原本在所述缺失的多核苷酸序列侧翼的两个多核苷酸序列的联结产生。在某些实施方式中,所述病毒包含产生包含序列ctaggactg(seqidno:5)的病毒的多核苷酸缺失。在某些实施方式中,所述重组腺病毒包含具有功能性caat盒的缺失例如整个caat盒的缺失的e1a启动子。当在本文中使用时,“功能性caat盒”是指能够结合到c/ebp或nf-y蛋白的caat盒,例如具有相应野生型caat盒序列的至少100%、至少90%、至少80%、至少70%、至少60%、至少50%或至少40%的c/ebp或nf-y结合活性的caat盒。当在本文中使用时,“非功能性caat盒”是指例如具有相应野生型caat盒序列的低于30%、低于20%、低于10%或0%的c/ebp或nf-y结合活性的caat盒。用于确定c/ebp或nf-y蛋白是否结合到caat盒的测定法在本领域中是已知的。示例性的结合测定法包括电泳迁移率变动测定法、染色质免疫沉淀测定法和dna酶足迹测定法。例如,在某些实施方式中,重组腺病毒包含对应于5型腺病毒e1a启动子的-76至-68位的核苷酸的缺失,所述核苷酸对应于ad5基因组(seqidno:1)的第423至431位的核苷酸。在某些实施方式中,所述病毒包含产生包含序列ttccgtggcg(seqidno:18)的病毒的多核苷酸缺失,所述序列由原本在所述缺失的多核苷酸序列侧翼的两个多核苷酸序列的联结产生。腺病毒e1b-19k基因主要起到抗凋亡基因的作用,并且是细胞抗凋亡基因bcl-2的同源物。由于宿主细胞在子代病毒粒子成熟之前死亡将限制病毒复制,因此将e1b-19k表达为所述e1盒的一部分以防止过早细胞死亡,从而允许感染继续并产生成熟病毒粒子。因此,在某些实施方式中,提供了包括e1b-19k插入位点的重组腺病毒,例如所述重组腺病毒具有插入到e1b-19k插入位点中的编码转入基因的核苷酸序列。在某些实施方式中,所述插入位点位于e1b-19k的起始位点(即编码e1b-19k的起始密码子的核苷酸序列,例如对应于seqidno:1的第1714-1716位核苷酸)和e1b-55k的起始位点(即编码e1b-55k的起始密码子的核苷酸序列,例如对应于seqidno:1的第2019-2021位核苷酸)之间。在某些实施方式中,所述e1b-19k插入位点位于e1b-19k的起始位点(即编码e1b-19k的起始密码子的核苷酸序列,例如对应于seqidno:1的第1714-1716位核苷酸)和e1b-19k的终止位点(即编码e1b-19k的终止密码子的核苷酸序列,例如对应于seqidno:1的2242-2244位核苷酸)之间。在整个本说明书和权利要求书中,两个位点之间的插入,例如(i)第一基因(例如e1b-19k)的起始位点与第二基因(例如e1b-55k)的起始位点之间,(ii)第一基因的起始位点与第二基因的终止位点之间,(iii)第一基因的终止位点与第二基因的起始位点之间,或(iv)第一基因的终止位点与第二基因的终止位点之间的插入,被理解为意味着在所述插入周围构成给定起始位点或终止位点的核苷酸的全部或一部分可能存在或不存在于所述最终病毒中。同样地,两个核苷酸之间的插入被理解为意味着在所述插入周围的核苷酸可能存在或不存在于所述最终病毒中。在某些实施方式中,所述e1b-19k插入位点包含在e1b-19k的起始位点附近约100至约305、约100至约300、约100至约250、约100至约200、约100至约150、约150至约305、约150至约300、约150至约250或约150至约200个核苷酸的缺失。在某些实施方式中,所述e1b-19k插入位点包含在e1b-19k的起始位点附近约200个核苷酸、例如202或203个核苷酸的缺失。在某些实施方式中,所述e1b-19k插入位点包含对应于ad5基因组(seqidno:1)的第1714-1917或1714-1916位核苷酸的缺失。在某些实施方式中,所述第一核苷酸序列、第三核苷酸序列和第二核苷酸序列被插入到对应于ad5基因组(seqidno:1)的第1714和1917位的核苷酸之间或对应于ad5基因组(seqidno:1)的第1714和1916位的核苷酸之间。在某些实施方式中,所述第一核苷酸序列、第三核苷酸序列和第二核苷酸序列被插入到ctgacctc(seqidno:2)和tcaccagg(seqidno:3)之间,例如所述重组腺病毒以5’至3’方向包含ctgacctc(seqidno:2)、第一核苷酸序列、第三核苷酸序列、第二核苷酸序列和tcaccagg(seqidno:3)。ctgacctc(seqidno:2)和tcaccagg(seqidno:3)为ad5基因组(seqidno:1)内的e1b-19k插入位点定义了独特的边界序列。在整个本说明书和权利要求书中,位点附近的缺失例如基因的起始位点附近的缺失或基因的终止位点附近的缺失,被理解为意味着所述缺失可能包括构成给定起始位点或终止位点的核苷酸的全部、一部分的缺失或不包括所述核苷酸的缺失。在某些实施方式中,所述重组腺病毒包含e3缺失。在某些实施方式中,所述e3缺失包含约500至约3185、约500至约3000、约500至约2500、约500至约2000、约500至约1500、约500至约1000、约1000至约3185、约1000至约3000、约1000至约2500、约1000至约2000、约1000至约1500、约1500至约3185、约1500至约3000、约1500至约2000、约2000至约3185、约2000至约3000、约2000至约2500、约2500至约3185、约2500至约3000或约3000至约3185个核苷酸的缺失。在某些实施方式中,所述e3缺失位点位于pviii的终止位点(即编码pviii的终止密码子的核苷酸序列,例如对应于seqidno:1的第27855-27857位核苷酸)与fiber的起始位点(即编码fiber的起始密码子的核苷酸序,例如对应于seqidno:1的第31042-31044位核苷酸)之间。在某些实施方式中,所述e3缺失位点位于e3-10.5k的终止位点(即编码e3-10.5k的终止密码子的核苷酸序列,例如对应于seqidno:1的第29770-29772位核苷酸)与e3-14.7k的终止位点(即编码e3-14.7k的终止密码子的核苷酸序列,例如对应于seqidno:1的第30837-30839位核苷酸)之间。在某些实施方式中,所述e3缺失包含在e3-10.5k的终止位点附近约500至约1551、约500至约1500、约500至约1000、约1000至约1551、约1000至约1500或约1500至约1551个核苷酸的缺失。在某些实施方式中,所述e3缺失包含在e3-10.5k的终止位点附近约1050个核苷酸的缺失,例如所述e3缺失包含在e3-10.5k的终止位点附近1063或1064个核苷酸的缺失。在某些实施方式中,所述e3缺失包含对应于ad5d1309e3缺失的缺失。在某些实施方式中,所述e3缺失包含对应于ad5基因组(seqidno:1)的第29773-30836位核苷酸的缺失。在某些实施方式中,所述e3缺失位于e3-gp19k的终止位点(即编码e3-gp19k的终止密码子的核苷酸序列,例如对应于seqidno:1的第29215-29217位核苷酸)与e3-14.7k的终止位点(即编码e3-14.7k的终止密码子的核苷酸序列,例如对应于seqidno:1的第30837-30839位核苷酸)之间。在某些实施方式中,所述e3缺失包含在e3-gp19k的终止位点附近约500至约1824、约500至约1500、约500至约1000、约1000至约1824、约1000至约1500或约1500至约1824个核苷酸的缺失。在某些实施方式中,所述e3缺失包含在e3-gp19k的终止位点附近约1600个核苷酸的缺失,例如所述e3缺失包含在e3-gp19k的终止位点附近1622个核苷酸的缺失。在某些实施方式中,所述e3缺失包含对应于ad5基因组(seqidno:1)的第29218-30839位核苷酸的缺失。在某些实施方式中,提供了包括e3插入位点的重组腺病毒,例如所述重组腺病毒具有插入到e3插入位点中的编码治疗性转入基因的核苷酸序列。在某些实施方式中,所述重组腺病毒包含e3缺失。在某些实施方式中,所述e3缺失包含约500至约3185、约500至约3000、约500至约2500、约500至约2000、约500至约1500、约500至约1000、约1000至约3185、约1000至约3000、约1000至约2500、约1000至约2000、约1000至约1500、约1500至约3185、约1500至约3000、约1500至约2000、约2000至约3185、约2000至约3000、约2000至约2500、约2500至约3185、约2500至约3000或约3000至约3185个核苷酸的缺失。在某些实施方式中,所述e3缺失位于pviii的终止位点(即编码pviii的终止密码子的核苷酸序列,例如对应于seqidno:1的第27855-27857位核苷酸)与fiber的起始位点(即编码fiber的起始密码子的核苷酸序,例如对应于seqidno:1的第31042-31044位核苷酸)之间。在某些实施方式中,所述e3缺失位于e3-10.5k的终止位点(即编码e3-10.5k的终止密码子的核苷酸序列,例如对应于seqidno:1的第29770-29772位核苷酸)与e3-14.7k的终止位点(即编码e3-14.7k的终止密码子的核苷酸序列,例如对应于seqidno:1的第30837-30839位核苷酸)之间。在某些实施方式中,所述e3缺失包含在e3-10.5k的终止位点附近约500至约1551、约500至约1500、约500至约1000、约1000至约1551、约1000至约1500或约1500至约1551个核苷酸的缺失。在某些实施方式中,所述e3缺失包含在e3-10.5k的终止位点附近约1050个核苷酸的缺失,例如所述e3缺失包含在e3-10.5k的终止位点附近1063或1064个核苷酸的缺失。在某些实施方式中,所述e3缺失包含对应于ad5d1309e3缺失的缺失。在某些实施方式中,所述e3缺失包含对应于ad5基因组(seqidno:1)的第29773-30836位核苷酸的缺失。在某些实施方式中,所述第一核苷酸序列、第三核苷酸序列和第二核苷酸序列被插入到对应于ad5基因组(seqidno:1)的第29773和30836位的核苷酸之间。在某些实施方式中,所述第一核苷酸序列、第三核苷酸序列和第二核苷酸序列被插入到cagtatga(seqidno:19)和taataaaaaa(seqidno:20)之间,例如所述重组腺病毒以5’至3’方向包含cagtatga(seqidno:19)、第一核苷酸序列、第三核苷酸序列、第二核苷酸序列和taataaaaaa(seqidno:20)。cagtatga(seqidno:19)和taataaaaaa(seqidno:20)为ad5基因组(seqidno:1)内的e3插入位点定义了独特的边界序列。在某些实施方式中,所述e3插入位点位于e3-gp19k的终止位点(即编码e3-gp19k的终止密码子的核苷酸序列,例如对应于seqidno:1的第29215-29217位核苷酸)与e3-14.7k的终止位点(即编码e3-14.7k的终止密码子的核苷酸序列,例如对应于seqidno:1的第30837-30839位核苷酸)之间。在某些实施方式中,所述e3插入位点包含在e3-gp19k的终止位点附近约500至约1824、约500至约1500、约500至约1000、约1000至约1824、约1000至约1500或约1500至约1824个核苷酸的缺失。在某些实施方式中,所述e3插入位点包含在e3-gp19k的终止位点附近约1600个核苷酸的缺失,例如所述e3插入位点包含在e3-gp19k的终止位点附近1622个核苷酸的缺失。在某些实施方式中,所述e3插入位点包含对应于ad5基因组(seqidno:1)的第29218-30839位核苷酸的缺失。在某些实施方式中,所述第一核苷酸序列、第三核苷酸序列和第二核苷酸序列被插入到对应于ad5基因组(seqidno:1)的第29218和30839位的核苷酸之间。在某些实施方式中,所述第一核苷酸序列、第三核苷酸序列和第二核苷酸序列被插入到tgccttaa(seqidno:21)和taaaaaaaaat(seqidno:22)之间,例如所述重组腺病毒以5’至3’方向包含tgccttaa(seqidno:21)、第一核苷酸序列、第三核苷酸序列、第二核苷酸序列和taaaaaaaaat(seqidno:22)。tgccttaa(seqidno:21)和taaaaaaaaat(seqidno:22)为ad5基因组(seqidno:1)内的e3插入位点定义了独特的边界序列。在某些实施方式中,重组腺病毒包含e4缺失。在某些实施方式中,所述e4缺失位于e4-orf6/7的起始位点(即编码e4-orf6/7的起始密码子的核苷酸序列,例如对应于seqidno:1的第34075-34077位核苷酸)与右侧末端反向重复序列(itr;例如对应于seqidno:1的第35836-35938位核苷酸)之间。在某些实施方式中,所述e4缺失位于e4-orf6/7的起始位点与e4-orf1的起始位点(即编码e4-orf1的起始密码子的核苷酸序列,例如对应于seqidno:1的第35524-35526位核苷酸)之间。在某些实施方式中,所述e4缺失包含e4-orf6/7的起始位点与e4-orf1的起始位点之间的核苷酸序列的缺失。在某些实施方式中,所述e4缺失包含约500至约2500、约500至约2000、约500至约1500、约500至约1000、约1000至约2500、约1000至约2000、约1000至约1500、约1500至约2500、约1500至约2000或约2000至约2500个核苷酸的缺失。在某些实施方式中,所述e4缺失包含在e4-orf6/7的起始位点附近约250至约1500、约250至约1250、约250至约1000、约250至约750、约250至约500、500至约1500、约500至约1250、约500至约1000、约500至约750、750至约1500、约750至约1250、约750至约1000、约1000至约1500或约1000至约1250个核苷酸的缺失。在某些实施方式中,所述e4缺失包含在e4-orf6/7的起始位点附近约1450个核苷酸的缺失,例如,所述e4缺失包含在e4-orf6/7的起始位点附近1449个核苷酸的缺失。在某些实施方式中,所述e4缺失包含对应于ad5基因组(seqidno:1)的第34078-35526位核苷酸的缺失。ii.病毒生产方法用于生产本发明的重组病毒的方法在本领域中是已知的。通常,所公开的病毒在适合的宿主细胞系中使用常规技术来生产,所述常规技术包括将转染或感染的宿主细胞在适合的条件下培养,以便允许感染性病毒粒子的生产。编码病毒基因的核酸可以被并入到质粒中,并通过常规的转染或转化技术引入到宿主细胞中。用于生产本公开的病毒的示例性的适合宿主细胞包括人类细胞系例如hela、hela-s3、hek293、911、a549、her96或per-c6细胞。具体的生产和纯化条件将随着所使用的病毒和生产系统而变。对于腺病毒来说,用于产生病毒粒子的传统方法是穿梭质粒(通常含有一小部分腺病毒基因组子集并任选地含有潜在的转入基因表达盒)和腺病毒辅助质粒(含有完整腺病毒基因组的大部分)的共转染,随后进行后续体内重组。用于产生腺病毒的可选技术包括利用细菌人工染色体(bac)系统、在reca+细菌菌株中利用含有互补的腺病毒序列的两个质粒的体内细菌重组和酵母人工染色体(yac)系统。在生产后,从所述培养物回收感染性病毒粒子并任选地纯化。典型的纯化步骤可以包括噬斑纯化、离心例如氯化铯梯度离心、澄清、酶处理例如全能核酸酶或蛋白酶处理、层析步骤例如离子交换层析或过滤步骤。iii.治疗性转入基因所公开的重组腺病毒可以包含为治疗性转入基因编码的核苷酸序列。在某些实施方式中,所公开的重组腺病毒可以包含分别编码第一和第二治疗性转入基因的第一核苷酸序列和第二核苷酸序列。治疗性转入基因可以编码治疗性核酸例如反义rna或核酶rna。所述治疗性转入基因可以编码治疗性肽或多肽,例如凋亡剂、抗体、ctl响应性肽、细胞因子、细胞裂解剂、细胞毒性剂、酶、在肿瘤细胞的表面上表达以引发免疫应答的异源抗原、免疫刺激剂或免疫调节剂、干扰素、裂解肽、癌蛋白、催化引起细胞死亡的过程的多肽、补足体细胞中的遗传缺陷的多肽、肿瘤抑制蛋白、疫苗抗原或其任何组合。在某些实施方式中,所述第一和/或第二治疗性转入基因编码选自乙酰胆碱、抗ctla-4抗体重链或轻链、抗pd-1抗体重链或轻链、抗pd-l1抗体重链或轻链、boris/ctcfl、cd19、cd20、cd40l、cd70、cd80、cd86、cd137、cd137l、cd154、dkk1/wnt、fgf、gitrl、gm-csf、icam、il-1、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10阱、il-15、il-15il-15受体融合蛋白、il-17、il-23、il-23a/p19、il-12b/p40、il-24、il-27、il-27a/p28、il-27b/ebi3、il-35、干扰素-γ、mage、ny-eso-1、ox40l、p53、分泌的鞭毛蛋白、tgf-β、tgf-β阱、胸苷激酶和tnf-α的多肽。在某些实施方式中,所述第一和/或第二治疗性转入基因编码选自乙酰胆碱、抗ctla-4抗体重链或轻链、抗pd-1抗体重链或轻链、抗pd-l1抗体重链或轻链、boris/ctcfl、cd19、cd20、cd40l、cd70、cd80、cd86、cd137、cd137l、cd154、dkk1/wnt、fgf、gitrl、gm-csf、icam、il-1、il-2、il-3、il-4、il-5、il-6、il-7、il-8、il-9、il-10阱、il-12、il-12a/p35、il-12b/p40、il-15、il-15il-15受体融合蛋白、il-23a/p19、干扰素-γ、mage、ny-eso-1、ox40l、p53、分泌的鞭毛蛋白、tgf-β、tgf-β阱、胸苷激酶和tnf-α的多肽。在某些实施方式中,所述第一和第二治疗性转入基因分别编码异二聚体蛋白例如异二聚体细胞因子的第一和第二亚基。例如,在某些实施方式中,所述第一和/或第二治疗性转入基因选自il-12a/p35和il-12b/p40,它们构成异二聚体细胞因子il-12。例如,所述第一治疗性转入基因可以编码il-12b/p40,并且所述第二治疗性转入基因可以编码il-12a/p35。在某些实施方式中,所述重组腺病毒包含编码由seqidno:8的第17-1000位核苷酸、seqidno:8的第1013-1606位核苷酸和/或seqidno:8的第17-1606位核苷酸编码的氨基酸序列的核苷酸序列。在某些实施方式中,所述重组腺病毒包含seqidno:8的核苷酸序列,或者包含与seqidno:8具有80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的序列。此外,在某些实施方式中,所述第一和/或第二治疗性转入基因选自il-23a/p19和il-12b/p40,它们构成异二聚体细胞因子il-23。例如,所述第一治疗性转入基因可以编码il-12b/p40,并且所述第二治疗性转入基因可以编码il-23a/p19。在某些实施方式中,所述重组腺病毒包含编码由seqidno:9的第17-1000位核苷酸、seqidno:9的第1013-1582位核苷酸和/或seqidno:9的第17-1582位核苷酸编码的氨基酸序列的核苷酸序列。在某些实施方式中,所述重组腺病毒包含seqidno:9的核苷酸序列,或者包含与seqidno:9具有80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%或99%序列同一性的序列。此外,在某些实施方式中,所述第一和/或第二治疗性转入基因选自il-27a/p28和il-27b/ebi3,它们构成异二聚体细胞因子il-23。序列同一性可以以本领域技术范围之内的各种不同方式来确定,例如使用可公开获得的计算机软件如blast、blast-2、align或megalign(dnastar)软件。使用被程序blastp、blastn、blastx、tblastn和tblastx利用的算法的blast(基本局部比对搜索工具(basiclocalalignmentsearchtool))分析(karlin等,(1990)proc.natl.acad.sci.usa87:2264-2268;altschul,(1993)j.mol.evol.36,290-300;altschul等,(1997)nucleicacidsres.25:3389-3402,通过引用并入),被定制用于序列相似性搜索。对于搜索序列数据库中的基本问题的讨论,参见altschul等,(1994)naturegenetics6:119-129,其全部通过引用并入。本领域技术人员可以为测量比对,包括为了在待比较的序列的全长上获得最大对齐所需的任何算法,确定适合的参数。用于直方图、描述、比对、期望值(即用于针对数据库序列报告匹配的统计学显著性阈值)、截止值、矩阵和筛选器的搜索参数在缺省设置处。被blastp、blastx、tblastn和tblastx使用的缺省评分矩阵是blosum62矩阵(henikoff等,(1992)proc.natl.acad.sci.usa89:10915-10919,全部通过引用并入)。四个blastn参数可以如下调整:q=10(空隙生成罚分);r=10(空隙扩展罚分);wink=1(在沿着查询的每个wink.sup.th位置处产生词命中率);和gapw=16(设置在其中产生带有空隙的比对的窗口宽度)。等效的blastp参数设置可以是q=9;r=2;wink=1;和gapw=32。搜索也可以使用ncbi(nationalcenterforbiotechnologyinformation)blast高级选项参数来进行(例如:-g,开启空隙的成本[integer]:default=5(对于核苷酸来说)/11(对于蛋白质来说);-e,扩展空隙的成本[integer]:default=2(对于核苷酸来说)/1(对于蛋白质来说);-q,核苷酸错配的罚分[integer]:default=-3;-r,核苷酸匹配的奖励[integer]:default=1;-e,期望值[real]:default=10;-w,词长[integer]:default=11(对于核苷酸来说)/28(对于megablast来说)/3(对于蛋白质来说);-y,以比特为单位的blast延长的衰减(x):default=20(对于blastn来说)/7(对于其他来说);-x,带有空隙的比对(以比特为单位)的x衰减值:default=15(对于所有程序来说),不适用于blastn;和-z,带有空隙的比对(以比特为单位)的最终x衰减值:50(对于blastn来说),25(对于其他来说)。也可以使用用于成对蛋白质比对的clustalw(缺省参数可以包括例如blosum62矩阵和空隙开启罚分=10和空隙扩展罚分=0.1)。可以在gcg软件包10.0版中获得的序列之间的bestfit比较使用dna参数gap=50(空隙生成罚分)和len=3(空隙扩展罚分),并且在蛋白质比较中的等效设置是gap=8和len=2。在某些实施方式中,所述第一和第二治疗性转入基因的尺寸在合并时为约500至约5000、约500至约4000、约500至约3000、约500至约2000、约500至约1000、约1000至约5000、约1000至约4000、约1000至约3000、约1000至约2000、约2000至约5000、约2000至约4000、约2000至约3000、约3000至约5000、约3000至约4000或约4000至5000个核苷酸。在某些实施方式中,所述第一和第二治疗性转入基因的尺寸在合并时为约500至约7000、约500至约6000、约500至约5000、约500至约4000、约500至约3000、约500至约2000、约500至约1000、约1000至约7000、约1000至约6000、约1000至约5000、约1000至约4000、约1000至约3000、约1000至约2000、约2000至约7000、约2000至约6000、约2000至约5000、约2000至约4000、约2000至约3000、约3000至约7000、约3000至约6000、约3000至约5000、约3000至约4000、约4000至约7000、约4000至约6000、约4000至约5000、约5000至约7000、约5000至约6000或约6000至约7000个核苷酸。在某些实施方式中,所述第一和第二治疗性转入基因的尺寸在合并时至少为约500至约5000、约500至约4000、约500至约3000、约500至约2000、约500至约1000、约1000至约5000、约1000至约4000、约1000至约3000、约1000至约2000、约2000至约5000、约2000至约4000、约2000至约3000、约3000至约5000、约3000至约4000或约4000至5000个核苷酸。在某些实施方式中,所述第一和第二治疗性转入基因的尺寸在合并时至少为约500至约7000、约500至约6000、约500至约5000、约500至约4000、约500至约3000、约500至约2000、约500至约1000、约1000至约7000、约1000至约6000、约1000至约5000、约1000至约4000、约1000至约3000、约1000至约2000、约2000至约7000、约2000至约6000、约2000至约5000、约2000至约4000、约2000至约3000、约3000至约7000、约3000至约6000、约3000至约5000、约3000至约4000、约4000至约7000、约4000至约6000、约4000至约5000、约5000至约7000、约5000至约6000或约6000至约7000个核苷酸。在某些实施方式中,所述第一和第二治疗性转入基因的尺寸在合并时为至少约500、约1000、约2000、约3000、约4000或约5000个核苷酸。在某些实施方式中,所述第一和第二治疗性转入基因的尺寸在合并时为至少约500、约1000、约2000、约3000、约4000、约5000、约6000或约7000个核苷酸。在某些实施方式中,所述第一和第二治疗性转入基因的尺寸在合并时为约1600个核苷酸、约1650个核苷酸或约3100个核苷酸。在某些实施方式中,所述第一和第二治疗性转入被连接物隔开。所述连接物可以包含可切割位点例如可蛋白水解或不可蛋白水解切割位点或核糖体跳跃序列例如t2a序列。在某些实施方式中,所述第一和第二治疗性转入基因被可蛋白水解切割位点隔开。在某些实施方式中,所述可蛋白水解切割位点被存在于特定组织、细胞器或细胞内区室中的蛋白酶切割。在某些实施方式中,所述连接物包含可蛋白水解切割位点和两个半胱氨酸残基,其在蛋白水解切割后产生二硫键连接。在某些实施方式中,所述可蛋白水解切割位点被选自基质金属蛋白酶(mmp)、弗林蛋白酶、pc1、pc2、pc3、组织蛋白酶b、蛋白酶3和半胱天冬酶3的蛋白酶切割。在某些实施方式中,所述可切割位点是被存在于真核细胞的内质网或高尔基体中的蛋白酶切割的可蛋白水解切割位点。在某些实施方式中,所述可蛋白水解切割位点是弗林蛋白酶可切割位点。弗林蛋白酶是一种广泛表达并集中于高尔基体中的蛋白酶,在高尔基体中它识别共有序列rx1x2r(seqidno:6),其中x1是任何氨基酸并且x2是lys或arg,并在最后一个arg之后切割。弗林蛋白酶在切割通过高尔基体转运的蛋白质的前肽中发挥生物学作用。因此,在某些实施方式中,所述可蛋白水解切割位点是包含序列rx1x2r(seqidno:6)的弗林蛋白酶可切割位点,其中x1是任何氨基酸并且x2是lys或arg,例如包含序列rakr(seqidno:7)的弗林蛋白酶可切割位点。iii.药物组合物对于治疗使用来说,优选地将本文公开的重组腺病毒与可药用载体组合。当在本文中使用时,“可药用载体”意味着适合与人类和动物的组织相接触使用而没有过量毒性、刺激性、过敏反应或其他问题或并发症,与合理的利益/风险比相称的缓冲剂、载体和赋形剂。所述载体在与配方的其他成分相容并且对接受者无害的意义上是“可接受的”。可药用载体包括与药物给药相容的缓冲剂、溶剂、分散介质、包衣、等渗和吸收延迟剂等。这些介质和药剂用于制药活性物质的用途,在本领域中是已知的。含有重组腺病毒的药物组合物可以以剂量单元形式存在,并且可以通过任何适合的方法制备。药物组合物应该被配制成与它计划的给药途径相容。给药途径的实例是静脉内(iv)、真皮内、吸入、透皮、局部、透粘膜和直肠给药。有用的配方可以通过制药领域中已知的方法来制备。例如参见《remington制药学》(remington′spharmaceuticalsciences),第18版(mackpublishingcompany,1990)。适合于肠胃外给药的配方组分包括无菌稀释剂例如注射用水、盐水溶液、不挥发油、聚乙二醇、甘油、丙二醇或其他合成溶剂,抗细菌剂例如苯甲醇或对羟基苯甲酸甲酯,抗氧化剂例如抗坏血酸或亚硫酸氢钠,螯合剂例如edta,缓冲剂例如乙酸盐、柠檬酸盐或磷酸盐,以及用于调节渗涨度的药剂例如氯化钠或右旋糖。对于静脉内给药来说,适合的载体包括生理盐水、抑菌水、cremophoreltm(basf,parsippany,nj)或磷酸盐缓冲盐水(pbs)。所述载体应该在制造和储存的条件下稳定,并且应该被防腐以对抗微生物。所述载体可以是溶剂或分散介质,其含有例如水、乙醇、多元醇(例如甘油、丙二醇和液体聚乙二醇)及其适合的混合物。药物配方优选是无菌的。灭菌可以通过任何适合的方法来实现,例如通过无菌过滤膜过滤。在所述组合物被冷冻干燥的情况下,过滤除菌可以在冷冻干燥和重构之前或之后进行。当在本文中使用时,术语“有效量”是指足以实现有益或所需结果的活性组分的量(例如重组腺病毒的量)。有效量可以在一次或多次给药、施用或剂量中给药,并且不打算限于特定配方或给药途径。在某些实施方式中,活性成分的治疗有效量在0.1mg/kg至100mg/kg的范围内,例如1mg/kg至100mg/kg、1mg/kg至10mg/kg。在某些实施方式中,所述重组腺病毒的治疗有效量在102至1015噬斑形成单位(pfus)的范围内,例如102至1010、102至105、105至1015、105至1010或1010至1015噬斑形成单位。给药的量取决于多种变量,例如待治疗的疾病或指征的类型和程度、患者的总体健康、所述活性成分的体内效能、药物配方和给药途径。初始剂量可以提高到超过上限水平,以便快速获得所需的血液水平或组织水平。或者,初始剂量可以低于最适值,并且可以在治疗过程中逐步提高每日剂量。人类剂量可以例如在被设计从0.5mg/kg运行到20mg/kg的常规i期剂量递增研究中进行优化。给药频率可以随着多种因素而变,例如给药途径、剂量、重组腺病毒的血清半衰期和待治疗的疾病。示例性的给药频率是每日一次、每周一次和每两周一次。iv.治疗性用途本文中公开的重组腺病毒可用于治疗各种不同的医学指征,例如癌症。当在本文中使用时,“治疗”意味着在对象中,例如在人类中治疗疾病。这包括:(a)抑制所述疾病,即制止它的发展;和(b)减轻所述疾病,即引起所述疾病状态的减退。当在本文中使用时,术语“对象”和“患者”是指将要通过本文描述的方法和组合物治疗的生物体。这些生物体优选地包括但不限于哺乳动物(例如鼠类、猿猴、马科动物、牛科动物、猪科动物、犬科动物、猫科动物等),更优选地包括人类。癌症的实例包括实体肿瘤、软组织肿瘤、造血系肿瘤和转移病变。造血系肿瘤的实例包括白血病、急性白血病、急性成淋巴细胞白血病(all)、b-细胞、t-细胞或faball、急性髓性白血病(aml)、慢性髓细胞性白血病(cml)、慢性淋巴细胞性白血病(cll)例如转化的cll、弥漫性大b-细胞淋巴瘤(dlbcl)、滤泡性淋巴瘤、毛细胞白血病、骨髓增生异常综合征(mds)、淋巴瘤、霍奇金病、恶性淋巴瘤、非霍奇金淋巴瘤、伯基特淋巴瘤、多发性骨髓瘤或莱特尔综合征(莱特尔转化)。实体肿瘤的实例包括各种不同器官系统的恶性肿瘤例如肉瘤、腺癌和上皮癌,例如影响头颈部(包括咽)、甲状腺、肺(小细胞或非小细胞肺癌(nsclc))、乳腺、淋巴、胃肠(例如口腔、食道、胃、肝、胰腺、小肠、结肠和直肠、肛管)、生殖器和泌尿生殖道(例如肾、尿道上皮、膀胱、卵巢、子宫、宫颈、子宫内膜、前列腺、睾丸)、cns(例如神经或神经胶质细胞例如成神经细胞瘤或神经胶质瘤)或皮肤(例如黑素瘤)的恶性肿瘤。在某些实施方式中,所述癌症选自肛门癌、基底细胞癌、膀胱癌、骨癌、脑癌、乳腺癌、上皮癌、胆管癌、宫颈癌、结肠癌、结肠直肠癌、子宫内膜癌、胃食管癌、胃肠(gi)癌、胃肠间质瘤、肝细胞癌、妇科癌症、头颈癌、血液癌、肾癌、白血病、肝癌、肺癌、淋巴瘤、黑素瘤、梅克尔细胞癌、间皮瘤、神经内分泌癌症、非小细胞肺癌、卵巢癌、胰腺癌、儿科癌症、前列腺癌、肾细胞癌、肉瘤、皮肤癌、小细胞肺癌、皮肤的鳞状细胞癌、胃癌、睾丸癌和甲状腺癌。在某些实施方式中,所述癌症选自鼻咽癌、基底细胞癌、滑膜癌、肝细胞癌、肾癌、结缔组织的癌症、黑素瘤、肺癌、肠癌、结肠癌、直肠癌、结肠直肠癌、脑癌、喉癌、口腔癌、肝癌、骨癌、胰腺癌、绒膜癌、胃泌素瘤、神经内分泌癌、嗜铬细胞瘤、泌乳素瘤、t-细胞白血病/淋巴瘤、神经瘤、vonhippel-lindau病、zollinger-ellison综合征、肾上腺癌、肛门癌、胆管癌、膀胱癌、输尿管癌、脑癌、少突神经胶质瘤、成神经细胞瘤、脑膜瘤、脊髓肿瘤、骨癌、骨软骨瘤、软骨肉瘤、尤文氏肉瘤、原发位点未知的癌症、类癌、胃肠道的类癌、纤维肉瘤、乳腺癌、佩吉特病、宫颈癌、结肠直肠癌、直肠癌、食管癌、胆囊癌、头癌、眼癌、颈癌、肾癌、维尔姆斯瘤、肝癌、卡波斯肉瘤、前列腺癌、肺癌、睾丸癌、霍奇金病、非霍奇金淋巴瘤、口腔癌、皮肤癌、间皮瘤、多发性骨髓瘤、卵巢癌、内分泌胰腺癌、胰高血糖素瘤、胰腺癌、甲状旁腺癌、阴茎癌、垂体癌、软组织肉瘤、成视网膜细胞瘤、小肠癌、胃癌、胸腺癌、甲状腺癌、滋养层癌、葡萄胎、子宫癌、子宫内膜癌、阴道癌、外阴癌、听神经瘤、蕈样肉芽肿、胰岛素瘤、类癌综合征、生长抑素瘤、牙龈癌、心脏癌、唇癌、脑膜癌、口癌、神经癌、腭癌、腮腺癌、腹膜癌、咽癌、胸膜癌、唾液腺癌、舌癌和扁桃腺癌。在某些实施方式中,重组腺病毒与一种或多种疗法例如手术、放疗、化疗、免疫疗法、激素疗法或病毒疗法相组合给药到所述对象。在某些实施方式中,重组腺病毒与酪氨酸激酶抑制剂例如埃罗替尼相组合给药。在某些实施方式中,重组腺病毒与检查点抑制剂例如抗ctla-4抗体、抗pd-1抗体或抗pd-l1抗体相组合给药。示例性的抗pd-1抗体包括例如纳武单抗(bristol-myerssquibbco.)、pembrolizumab(mercksharp&dohmecorp.)、pdr001(novartispharmaceuticals)和pidilizumab(ct-011,curetech)。示例性的抗pd-l1抗体包括例如阿特珠单抗(genentech)、duvalumab(astrazeneca)、medi4736、avelumab和bms936559(bristolmyerssquibbco.)。当在本文中使用时,术语“相组合”给药被理解为意味着在对象被所述障碍困扰的过程中将两种(或更多种)不同治疗递送到所述对象,使得在某个时间点所述治疗对所述对象的效果重叠。在某些实施方式中,一种治疗的递送在第二种治疗的递送开始时仍在进行,使得在给药方面存在交叠。这在本文中有时被称为“同时”或“并行递送”。在其他实施方式中,一种治疗的递送在另一种治疗的递送开始之前结束。在任一种情况的某些实施方式中,治疗由于组合给药而更加有效。例如,所述第二种治疗更加有效,例如使用更少的第二种治疗观察到等同的效果,或者与第二种治疗在不存在第一种治疗的情况下给药的情形中看到的相比,所述第二种治疗以更大的程度减轻症状,或者在使用所述第一种治疗时观察到类似的情况。在某些实施方式中,递送使得症状或与所述障碍相关的其他参数的降低超过在递送一种治疗而不存在另一种治疗的情况下所观察到的。所述两种治疗的效果可以是部分累加、完全累加或高于累加的。所述递送可以使得当第二种治疗被递送时所递送的第一种治疗的效果仍然可被检测到。在某些实施方式中,所述重组病毒的有效量通过在所述对象中测量针对抗原的免疫应答来确定,和/或治疗所述对象的方法还包括在所述对象中测量针对抗原的免疫应答。癌症可能以免疫抑制为特征,并且在所述对象中测量针对抗原的免疫应答可以指示所述对象中免疫抑制的水平。因此,在所述对象中测量针对抗原的免疫应答可以指示装置治疗的效能和/或所述重组病毒的有效量。所述对象中针对所述抗原的免疫应答可以通过本领域中已知的任何方法来测量。在某些实施方式中,针对所述抗原的免疫应答是通过在所述对象的皮肤上的注射位点处注射所述抗原,并在所述注射位点处测量硬结的尺寸或炎症的量来测量的。在某些实施方式中,针对所述抗原的免疫应答是通过所述对象的细胞在暴露到所述抗原后,测量细胞释放的细胞因子(例如干扰素γ、il-4和/或il-5)来测量的。在整个本说明书中,当病毒、组合物和系统被描述为具有、包括或包含特定组分的情况下,或者当过程和方法被描述为具有、包括或包含特定步骤的情况下,可以预期的是,除此之外还存在基本上由所叙述的组分构成或由所叙述的组分构成的本发明的组合物、装置和系统,并且存在基本上由所叙述的过程步骤构成或由所叙述的过程步骤构成的符合本发明的过程和方法。在本申请中,在要素或组分被称为是包含在所叙述的要素或组分的名单中和/或选自所述名单的情况下,应该理解所述要素或组分可以是所叙述的要素或组分中的任一者,或者所述要素或组分可以选自所叙述的要素或组分中的两者或更多者。此外,应该理解,本文中描述的病毒、组合物、系统、方法或过程的要素和/或特点可以以各种不同的方式组合而不背离本发明的精神和范围,不论在本文中是明确说明还是暗示的。例如,在指称特定病毒的情况下,该病毒可用于本发明的组合物的各种不同实施方式和/或本发明的方法中,除非从上下文另有理解。换句话说,在本申请中,实施方式以能够书写并绘制出清楚且简明的申请的方式进行描述和描绘,但计划并且应该认识到实施方式可以进行各种不同的组合或拆分,而不背离本文的教授和发明。例如,应该认识到本文描述和描绘的所有特点可以适用于本文描述和描绘的本发明的所有方面。应该理解,表述“......中的至少一者”包括在该表述后的每一个所叙述的物体和所叙述的物体中的两者或更多者的各种组合,除非从上下文和使用中另有理解。与三个或更多个叙述物体相结合的表述“和/或”应该被理解为具有相同的意义,除非从上下文另有理解。术语“包括”、“具有”或“含有”、包括其语法等同语的使用,通常应该被理解为开放式和非限制性的,例如不排除另外的未叙述的要素或步骤,除非从上下文另有具体陈述或理解。在本说明书中的各个不同位置处,病毒、组合物、系统、过程和方法或其特点被成组或在范围内公开。它具体来说意指所述描述包括这些组和范围的成员的每一个单个的子组合。作为其他实例,在1至20的范围内的整数具体来说打算单个地公开1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19和20。当在数量值之前使用术语“约”时,本发明还包括所述特定数量值本身,除非另有具体陈述。当在本文中使用时,术语“约”是指距标称值±10%的变动,除非另有指示或推断。应该理解,步骤的顺序或执行某些行动的顺序是不重要的,只要本发明仍然可行即可。此外,两个或更多个步骤或行动可以同时进行。本文中的任何和所有实例或示例性语言如“例如”或“包括”的使用,仅仅旨在更好地说明本发明,并且除非声明,否则不对本发明的范围构成限制。本说明书中的所有语言都不应该被解释为指示任何未提出权利要求的要素对于本发明的实践来说是必不可少的。实施例下面的实施例仅仅是说明性的,并且不打算以任何方式限制本发明的范围或内容。实施例1:异二聚体il-12的表达白介素12(il-12)是一种促进细胞介导的免疫的细胞因子。il-12含有两条分开的蛋白质链il-12a/p35和il-12b/p40,它们组合形成被称为il-12p70的有活性的异二聚体。本实施例描述了包括il-12亚基il-12a/p35和il-12b/p40两者的人类il-12异二聚体的表达。对带有一部分5型腺病毒基因组的质粒pad1进行修饰,以在e1b-19k区的起始位点处带有sali位点并在所述sali位点的3′方向200碱基对处带有xhoi位点,以便于治疗性转入基因的插入。所述得到的质粒在后文中被称为pad1-δ19k。所述修饰的e1b-19k区的核苷酸序列如下,其中来自于融合的sali和xhoi位点的残留碱基被下划线:将编码人类il-12a/p35的核苷酸序列、然后是脑心肌炎病毒(emcv)ires、然后是编码人类il-12b/p40的核苷酸序列克隆到pad1-δ19k的修饰的e1b-19k区中。所述得到的质粒在后文中被称为pad1-hil-12-ires。所述插入到e1b-19k区中的编码人类il-12a/p35的核苷酸序列、然后是emcvires、然后是编码人类il-12b/p40的核苷酸序列如下所述,其中il-12a/p35和il-12b/p40编码区被大写,所述ires是小写字母,并且包括sali和xhoi限制性位点的侧翼e1b-19k序列被下划线:此外,将编码人类il-12b/p40的核苷酸序列、然后是编码弗林蛋白酶可切割位点(rakr)的核苷酸序列、然后是编码人类il-12a/p35的核苷酸序列克隆到pad1-δ19k的修饰的e1b-19k区中。所述得到的质粒在后文中被称为pad1-hil-12-furin。所述插入到e1b-19k区中的编码人类il-12b/p40的核苷酸序列、然后是编码弗林蛋白酶可切割位点(rakr)的核苷酸序列、然后是编码人类il-12a/p35的核苷酸序列如下所述,其中il-12b/p40和il-12a/p35编码区被大写,所述弗林蛋白酶可切割位点编码区是小写字母,并且包括sali和xhoi限制性位点的侧翼e1b-19k序列被下划线:此外,将编码人类il-12b/p40的核苷酸序列、然后是编码2a肽的核苷酸序列、然后是编码人类il-12a/p35的核苷酸序列克隆到pad1-a19k的修饰的e1b-19k区中。所述得到的质粒在后文中被称为pad1-hil-12-2a。所述插入到e1b-19k区中的编码人类il-12b/p40的核苷酸序列、然后是编码2a肽的核苷酸序列、然后是编码人类il-12a/p35的核苷酸序列如下所述,其中il-12b/p40和il-12a/p35编码区被大写,所述2a编码区是小写字母,并且包括sali和xhoi限制性位点的侧翼e1b-19k序列被下划线:所试验的质粒的详细情况示出在表1中。表1质粒e1b-19kpad1-δ19k缺失pad1-hil-12-ires缺失并用il-12a/p35-ires-il-12b/p40代替pad1-hil-12-furin缺失并用il-12b/p40-furin-il-12a/p35代替pad1-hil-12-2a缺失并用il-12b/p40-2a-il-12a/p35代替将质粒瞬时转染到hek-293细胞中。在转染后4天收集调制培养基,并在特异性检测il-12a/p35和il-12b/p40亚基的异二聚体的elisa(biolegend431704)中测量il-12浓度。如图1中所示,所述带有弗林蛋白酶可切割位点的质粒(pad1-hil-12-furin)与利用ires(pad1-hil-12-ires)或2a肽(pad1-hil-12-2a)的质粒相比引发明显更高的异二聚体il-12表达。实施例2:表达il-12的腺病毒本实施例描述了表达人类il-12亚基il-12a/p35和il-12b/p40的重组5型(ad5)腺病毒。构建了带有位于e1a起始位点上游-304至-255位置处的核苷酸区的缺失的腺病毒5型病毒,所述缺失使e1a表达成为癌症选择性的(如以前在美国专利号9,073,980中所描述)。所述得到的病毒在后文中被称为tav。将tav进一步修饰以在e1b-19k区的起始位点处带有sali位点并在所述sali位点的3′方向200碱基对处带有xhoi位点,以便于治疗性转入基因的插入。所述得到的病毒在后文中被称为tav-δ19k。所述修饰的e1b-19k区的核苷酸序列如下,其中来自于融合的sali和xhoi位点的残留碱基被下划线:tav-δ19k在e3区中带有d1309破坏。为了产生带有原本使病毒基因组过大而不能被包装在病毒衣壳中的治疗性转入基因的病毒,将tav-δ19k进一步修饰以缺失e3区的完整ridα、ridβ和14.7k基因。所述得到的病毒在后文中被称为tav-δ19k-δe3。所述修饰的e3区的核苷酸序列如下,其中连字符指示缺失的点:将编码人类il-12b/p40的核苷酸序列、然后是编码弗林蛋白酶可切割位点(rakr)的核苷酸序列、然后是编码人类il-12a/p35的核苷酸序列克隆到tav-δ19k-δe3的修饰的e1b-19k区中。所述得到的质粒在后文中被称为tav-hil-12-furin。所述插入到e1b-19k区中的编码人类il-12b/p40的核苷酸序列、然后是编码弗林蛋白酶可切割位点的核苷酸序列、然后是编码人类il-12a/p35的核苷酸序列如下所述,其中il-12b/p40和il-12a/p35编码区被大写,所述弗林蛋白酶可切割位点编码区是小写字母,并且包括sali和xhoi限制性位点的侧翼e1b-19k序列被下划线:此外,将编码人类il-12b/p40的核苷酸序列克隆到的tav-δ19k-δe3的修饰的e1b-19k区中,并将编码人类il-12a/p35的核苷酸序列克隆到tav-δ19k-δe3的修饰的e3区中。所述得到的病毒在后文中被称为tav-hil-12-separate。所述插入到e1b-19k区中的编码人类il-12b/p40的核苷酸序列如下,其中包括sali和xhoi限制性位点的侧翼e1b-19k序列被下划线:所述插入到e3区中的编码人类il-12a/p35的核苷酸序列如下,其中侧翼腺病毒序列被下划线:所试验的质粒的详细情况示出在表2中。表2将来自于那些病毒以及对照病毒(d1309)的裂解物的病毒基因组dna,使用在e1a启动子侧翼的引物、在e1b-19k区侧翼的引物和在e3ridα、ridβ和14.7k区侧翼的引物进行pcr扩增,以确认所需元件的存在。正如在图2中看到的,所述病毒具有所需的特点,即预期尺寸的pcr产物。两种病毒中的il-12编码区被测序确认。实施例3:表达il-23的腺病毒本实施例描述了表达人类il-23亚基il-23a/p19和il-12b/p40的重组5型腺病毒(ad5)。如实施例2中所述产生tav-δ19k-δe3病毒。将编码人类il-12b/p40的核苷酸序列、然后是编码弗林蛋白酶可切割位点(rakr)的核苷酸序列、然后是编码人类il-23a/p19的核苷酸序列克隆到tav-δ19k-δe3的修饰的e1b-19k区中。所述得到的病毒在后文中被称为tav-hil-23-furin。所述插入到e1b-19k区中的编码人类il-12b/p40的核苷酸序列、然后是编码弗林蛋白酶可切割位点的核苷酸序列、然后是编码人类il-23a/p19的核苷酸序列如下所述,其中所述il-12b/p40和il-23a/p19编码区被大写,所述弗林蛋白酶可切割位点编码区是小写字母,并且包括sali和xhoi限制性位点的侧翼e1b-19k序列被下划线:实施例4:表达il-12的腺病毒本实施例描述了使用ires表达小鼠il-12亚基il-12a和il-12b的重组5型腺病毒(ad5)。如实施例2中所述产生tav、tav-δ19k和tav-δ19k-δe3病毒。将编码小鼠il-12a的核苷酸序列、然后是emcvires、然后是编码小鼠il-12b的核苷酸序列克隆到tav-δ19k-δe3的修饰的e1b-19k区中。所述得到的病毒在后文中被称为tav-mil-12-ires。所述插入到e1b-19k区中的编码小鼠il-12a的核苷酸序列、然后是emcvires、然后是编码小鼠il-12b的核苷酸序列如下所述,其中所述小鼠il-12b和il-12a编码区被大写,所述ires是小写字母,并且侧翼限制性位点和腺病毒序列被下划线:试验了tav-mil-12-ires的细胞毒性活性。将ads-12(小鼠肺癌)细胞用tav-mil12-ires、tav-δ19k病毒以10的感染复数(moi)感染或不用病毒感染,并用结晶紫染色,其将活细胞染成紫色。如图3中所示,tav-mil12-ires保留了细胞毒性活性,尽管与对照tav-δ19k病毒相比水平更低。试验了来自于tav-mil-12-ires的il-12表达。将ads-12细胞用tav-δ19k或tav-mil-12-ires以5的moi感染。在感染后5天收集调制培养基,并使用特异性针对il-12异二聚体的elisa测量il-12浓度。如图4中所示,用tav-δ19k感染的细胞没有可检测的表达,而用tav-mil-12-ires感染的细胞表达67ng/ml的il-12异二聚体。试验了tav-mil-12-ires的病毒复制。将ads-12细胞用tav-mil12-ires或tav-δ19k以5的moi感染。在感染后5天收获培养基和细胞裂解物并滴定。病毒复制通过测量每个被感染的ads-12细胞的噬斑形成单位(pfu)的数目来测定。如图5中所示,与tav-δ19k相比,tav-mil-12-在ads-12细胞中以较低水平复制。实施例5:表达il-12的腺病毒本实施例描述了使用ires表达人类il-12亚基il-12a和il-12b的重组腺病毒和使用弗林蛋白酶可切割位点表达人类il-12亚基il-12a和il-12b的重组腺病毒。如实施例2中所述产生tav、tav-δ19k、tav-δ19k-δe3和tav-hil-12-furin病毒。此外,将编码人类il-12a/p35的核苷酸序列、然后是emcvires、然后是编码人类il-12b/p40的核苷酸序列克隆到tav-δ19k-δe3的修饰的e1b-19k区中。所述得到的腺病毒在后文中被称为tav-hil-12-ires。所述插入到e1b-19k区中的编码人类il-12a/p35的核苷酸序列、然后是emcvires、然后是编码人类il-12b/p40的核苷酸序列如下所述,其中所述il-12a/p35和il-12b/p40编码区被大写,所述ires是小写字母,并且包括sali和xhoi限制性位点的侧翼e1b-19k序列被下划线:试验了从tav-hil-12-furin和tav-hil-12-ires的il-12表达。将a549细胞用tav-δ19k、tav-hil-12-ires、tav-hil-12-furin以5的moi感染或不用病毒感染。在感染后4天收集调制培养基,并通过elisa(biolegend431704)测量il-12浓度。如图6中所示,从tav-hil-12-furin的表达(170ng/ml)高于从tav-hil-12-ires的表达(23ng/ml)。试验了tav-hil-12-furin的细胞毒性活性。将a549细胞用tav-δ19k、tav-hil12-furin以5的moi感染或不用病毒感染,并用结晶紫染色,其将活细胞染成紫色。如图7中所示,tav-hil12-furin保留了与对照tav-δ19k病毒相近水平的细胞毒性活性。试验了tav-hil-12-furin和tav-hil-12-ires的病毒复制。将a549细胞用tav-hil-12-furin、tav-hil-12-ires或tav-δ19k以5的moi感染。在感染后6天收获培养基和细胞裂解物并滴定。病毒复制通过测量每个被感染的a549细胞的噬斑形成单位(pfu)的数目来测定。如图8中所示,与tav-hil-12-ires相比,tav-hil-12-furin更加高效地复制。实施例6:表达il-12、il-23和il-27的腺病毒本实施例描述了使用弗林蛋白酶可切割位点表达小鼠il-12、il-23和il-27的两个亚基的的重组腺病毒。如实施例2中所述产生tav、tav-δ19k和tav-δ19k-δe3病毒。将编码小鼠il-12b的核苷酸序列、然后是编码弗林蛋白酶可切割位点(rakr)的核苷酸序列、然后是编码小鼠il-12a的核苷酸序列克隆到tav-δ19k-δe3的修饰的e1b-19k区中。所述得到的病毒在后文中被称为tav-mil-12-furin。所述插入到e1b-19k区中的编码小鼠il-12b的核苷酸序列、然后是编码弗林蛋白酶可切割位点的核苷酸序列、然后是编码小鼠il-12a的核苷酸序列如下所述,其中所述il-12b和il-12a编码区被大写,所述弗林蛋白酶可切割位点编码区是小写字母,并且包括sali和xhoi限制性位点的侧翼e1b-19k序列被下划线:另外,将编码小鼠il-12b的核苷酸序列、然后是编码弗林蛋白酶可切割位点(rakr)的核苷酸序列、然后是编码小鼠il-23a的核苷酸序列克隆到tav-δ19k-δe3的修饰的e1b-19k区中。所述得到的病毒在后文中被称为tav-mil-23-furin。所述插入到e1b-19k区中的编码小鼠il-12b的核苷酸序列、然后是编码弗林蛋白酶可切割位点的核苷酸序列、然后是编码小鼠il-23a的核苷酸序列如下所述,其中所述il-12b和il-23a编码区被大写,所述弗林蛋白酶可切割位点编码区是小写字母,并且包括sali和xhoi限制性位点的侧翼e1b-19k序列被下划线:另外,将编码小鼠il-27b的核苷酸序列、然后是编码弗林蛋白酶可切割位点(rakr)的核苷酸序列、然后是编码小鼠il-27a的核苷酸序列克隆到tav-δ19k-δe3的修饰的e1b-19k区中。所述得到的病毒在后文中被称为tav-mil-27-furin。所述插入到e1b-19k区中的编码小鼠il-27b的核苷酸序列、然后是编码弗林蛋白酶可切割位点的核苷酸序列、然后是编码小鼠il-27a的核苷酸序列如下所述,其中所述il-27b和il-27a编码区被大写,所述弗林蛋白酶可切割位点编码区是小写字母,并且包括sali和xhoi限制性位点的侧翼e1b-19k序列被下划线:试验了从tav-mil-12-furin的il-12表达。将a549细胞用tav-mil-12-furin以1、5或10的moi感染或者不用病毒感染。在感染后的各个不同时间收集调制培养基,并通过elisa测量il-12浓度。如图9中所示,il-12以剂量依赖性和时间依赖性方式表达。试验了从tav-mil-23-furin和tav-mil-27-furin的il-23和il-27表达。将a549细胞用tav-mil-23-furin、tav-mil-27-furin以moi5感染或不用病毒感染。在感染后4天收集调制培养基,并通过elisa测量il-23和il-27浓度。正如在图10中所示,两种病毒表达相应的异二聚体细胞因子。通过引用并入本文中提到的每个专利文献和科学论文的整个公开内容为所有目的通过引用并入本文。等同性本发明可以以其他特定形式体现而不背离其精神或本质特征。因此,前述实施方式应该在所有情况下被认为是说明性的而不是限制本文描述的发明。因此,本发明的范围由随附的权利要求书而不是上面的描述指明,并且打算将进入权利要求书的意义和等同性范围之内的所有变化涵盖在其中。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1