具有交换结合区取向的双重可变区抗体样结合蛋白的制作方法
发明领域
本发明涉及包含形成4个抗原结合位点的4条多肽链的抗体样结合蛋白,其中形成抗体样结合蛋白的每对多肽具有带有交换取向的双重可变结构域。本发明还涉及用于制备这类抗原样结合蛋白的方法。
发明背景
天然存在的IgG抗体是二价和单特异性的。对两种不同的抗原具有结合特异性的双特异性抗体可采用重组技术产生,并预期具有广泛的临床应用。众所周知,完整的IgG抗体分子是Y形分子,包含4条多肽链:2条重链和2条轻链。每条轻链由2个结构域组成,称为可变或VL结构域(或区)的N端结构域和称为恒定(或CL)结构域(恒定κ(Cκ)或恒定λ(Cλ)结构域)的C端结构域。每条重链由4或5个结构域组成,这取决于抗体的类别。N端结构域称为可变(或VH)结构域(或区),其后面是第一恒定(或CH1)结构域、铰链区,然后是第二和第三恒定(或CH2和CH3)结构域。在装配的抗体中,VL和VH结构域缔合在一起形成抗原结合位点。此外,CL和CH1结构域缔合在一起以保持一条重链与一条轻链缔合。两个重链-轻链异二聚体通过CH2和CH3结构域的相互作用和两条重链上铰链区之间的相互作用缔合在一起。
已知抗体的蛋白水解消化可导致抗体片段(Fab和Fab2)的产生。完整抗体的这类片段可显示抗原结合活性。抗体片段还可重组产生。可获得Fv片段,其由彼此缔合的重链和轻链的可变结构域组成。这些Fv片段对于抗原结合是一价的。较小的片段,例如单独的可变结构域(结构域抗体或dAB;Ward等,1989,Nature 341(6242):544-46)和单独的互补决定区或CDR(Williams等,1989,Proc.Natl.Acad.Sci.U.S.A.86(14):5537-41)也显示保持亲本抗体的结合特性,但是大多数天然存在的抗体一般需要VH和VL两者以保持完整的结合效能。
单链可变片段(scFv)构建体包含单一多肽链中所包含的抗体VH和VL结构域,其中结构域被足够长(大于12个氨基酸残基)的柔性接头分隔,所述接头迫使分子内相互作用,允许两个结构域自我装配成功能性表位结合位点(Bird等,1988,Science 242(4877):423-26)。这些小的蛋白质(MW约25,000Da)一般在单个多肽中保持对其抗原的特异性和亲和力,并可为较大的抗原特异性分子提供合适的结构单元(building block)。
在诊断和治疗中使用抗体片段而非完整抗体的优势在于其较小的尺寸。它们可能比完整抗体较低免疫原性,并且更能够渗透组织。与使用这类片段有关的缺点是,它们只有一个抗原结合位点,导致亲合力降低。另外,由于其尺寸小,它们非常快地从血清中清除,因此显示短的半寿期。
一直感兴趣的是产生双特异性抗体(BsAb),其将两种抗体的抗原结合位点组合在单一分子内,因此,总能够同时结合两种不同的抗原。除诊断目的的应用以外,这类分子还例如通过将有效的效应器系统重定向至患病区(其中癌细胞通常发展抑制由单克隆抗体引发的正常免疫应答的机制,如抗体依赖性细胞毒性(ADCC)或补体依赖性细胞毒性(CDC))或通过提高抗体的中和或刺激活性,为新的治疗应用做好准备。这种潜力在早期就被认可,产生了多种用于获得这类双特异性抗体的方法。将针对不同靶抗原的两个完整抗体的结合特异性连接起来用于治疗目的的最初尝试利用了化学融合的异型缀合(heteroconjugate)分子(Staerz等,1985,Nature 314(6012):628-31)。
双特异性抗体最初通过融合两种杂交瘤来制备,每种杂交瘤能够产生不同免疫球蛋白(Milstein等,1983,Nature 305(5934):537-40),但在细胞培养中产生的种类的复杂性(多达10个不同的种类)使得纯化困难并昂贵(George等,1997,The Antibodies 4:99-141(Capra等主编,Harwood Academic Publishers))。采用这种形式,在相同细胞(例如,作为两种杂交瘤的四源杂交瘤(quadroma)融合,或在工程改造的CHO细胞)中同时产生小鼠IgG2a和大鼠IgG2b抗体。由于每种抗体的轻链优先与其同源类型的重链缔合,因此装配出3种主要类型的抗体:两种亲代抗体和包含各自的一个重链/轻链对(通过其Fc部分缔合)的两种抗体的异二聚体。所需的异二聚体可从这种混合物中纯化,因为其与蛋白A的结合性质不同于亲代抗体的结合性质:大鼠IgG2b不与蛋白A结合,而小鼠IgG2a则结合。因此,小鼠-大鼠异二聚体与蛋白A结合,但在比小鼠IgG2a同二聚体高的pH下洗脱,这使得双特异性异二聚体的选择性纯化成为可能(Lindhofer等,1995,J.Immunol.155(1):219-25)。所得双特异性异二聚体完全是非人的,因此是高度免疫原性的,这可能具有有害的副作用(例如“HAMA”或“HARA”反应),和/或抵消治疗性。存在对可易于以高收率从哺乳动物细胞培养中产生的具有优良性质的工程改造的双特异性的需要。
尽管使用由上述细胞融合产生的异型缀合物或双特异性抗体所得到的有前景的结果,但若干因素使之对于大规模治疗应用不切实际。所述因素包括:异型缀合抗体在体内的快速清除、产生任何类型的分子所需要的实验室密集技术、对自同型缀合物或单特异性抗体中大量纯化出异型缀合物的需要以及通常获得的低收率。
已利用遗传工程以渐增的频率来设计、修饰和产生具有所需要的成套结合性质和效应子功能的抗体或抗体衍生物。已开发出用于有效生产以下BsAb的各种重组方法:其作为抗体片段(Carter等,1995,J.Hematother.4(5):463-70;Pluckthun等,1997,Immunotechnology 3(2):83-105;Todorovska等,2001,J.Immunol.Methods 248(1-2):47-66)和全长IgG形式(Carter,2001,J.Immunol.Methods 248(1-2):7-15)两者。
组合两种不同的scFv导致具有最小分子量的BsAb形式,称为sc-BsAb或Ta-scFv(Mack等,1995,Proc.Natl.Acad.Sci.U.S.A.92(15):7021-25;Mallender等,1994,J.Biol.Chem.269(1):199-206)。已通过将两种scFv遗传融合成二聚化官能团(例如亮氨酸拉链),构建了BsAb(Kostelny等,1992,J.Immunol.148(5):1547-53;de Kruif等,1996,J.Biol.Chem.271(13):7630-34)。
双抗体(Diabodies)是小的二价和双特异性抗体片段。所述片段包含在相同多肽链上与VL连接的VH,其使用了太短以致于不允许相同链上的两个结构域配对的接头(小于12个氨基酸残基)。结构域被迫与另一条链的互补结构域进行分子间配对并产生两个抗原结合位点。这些二聚抗体片段,或“双抗体”是二价和双特异性的(Holliger等,1993,Proc.Natl.Acad.Sci.U.S.A.90(14):6444-48)。双抗体的大小与Fab片段类似。通过介于3和12个氨基酸残基之间的接头连接的VH和VL结构域的多肽链主要形成二聚体(双抗体),而用介于0和2个氨基酸残基之间的接头,则三聚体(三抗体)和四聚体(四抗体)占优势。除接头长度以外,寡聚的确切形式还似乎取决于组成以及可变结构域的取向(Hudson等,1999,J.Immunol.Methods231(1-2):177-89)。双抗体分子最终结构的可预测性极差。
尽管基于sc-BsAb和双抗体的构建体显示有吸引力的临床潜力,但表明这种非共价缔合的分子在生理条件下并不足够稳定。scFv片段的总体稳定性取决于VL和VH结构域的内在稳定性以及结构域界面的稳定性。scFv片段VH-VL界面的稳定性不足常常提示为不可逆scFv失活的主要原因,因为界面的短暂开放(其为肽接头所允许)使促成聚集的疏水块(hydrophobic patches)暴露,因此不稳定和生产收率差(等,2001,J.Mol.Biol.305(5):989-1010)。
自VH和VL结构域制备双特异性二价抗原结合蛋白的一种备选方法描述于美国专利号5,989,830。通过表达编码两个多肽链的双顺反子载体获得这类双头和双重Fv构型(double head and dual Fv)。在双重Fv构型中,两种不同抗体的可变结构域以串联方向在两个单独的链(一条重链和一条轻链)上表达,其中一条多肽链具有被肽接头分隔的两个串联的VH(VH1-接头-VH2),另一条多肽链由通过肽接头串联连接的互补VL结构域(VL1-接头-VL2)组成。在交换的双头构型中,两种不同抗体的可变结构域以串联方向在两个单独的多肽链(一条重链和一条轻链)上表达,其中一条多肽链具有被肽接头分隔的两个串联的VH(VH1-接头-VH2),另一个多肽链由通过肽接头以相反方向串联连接的互补VL结构域(VL2-接头-VL1)组成。构建体的分子建模表明接头大小长到足以跨越(15-20个氨基酸残基)。
提高抗体的化合价(valency)是有价值的,因为它提高因亲合作用所致的该抗体的功能亲和力。化合价提高的多价蛋白质复合物(Polyvalent protein complex,PPC)描述于美国专利申请公布号US 2005/0003403 A1。PPC包含通常彼此侧向排列的2条多肽链。每条多肽链通常包含3或4个“v区”,其包含当与相对多肽链上的相应v区匹配时能够形成抗原结合位点的氨基酸序列。每条多肽链可使用至多约6个“v区”。每条多肽链的v区彼此线性连接,并可通过散置的连接区连接。当以PPC的形式排列时,每条多肽链上的v区形成各自的抗原结合位点。复合物可含有一种或几种结合特异性。
Carter等人(Ridgway等,1996,Protein Eng.9(7):617-21;Carter,2011,J.Immunol.Methods 248(1-2):7-15)提出了使用Fc的CH3结构域中的一组“knob-into-hole”突变以产生Fc异二聚体的策略。这些突变导致结构保守的疏水核内CH3结构域界面间残基堆积互补性(residue packing complementarity)改变,使得与同二聚体相比,有利于异二聚体的形成,这从哺乳动物细胞培养中实现良好的异二聚体表达。虽然该策略导致较高的异二聚体收率,同二聚体不被完全抑制(Merchant等,1998,Nat.Biotechnol.16(7):677-81。
Gunasekaran等人研究了通过改变CH3结构域界面上的电荷互补性,在驱使Fc异二聚体形成的同时保持疏水核完整的可行性(Gunasekaran等,2010,J.Biol.Chem.285(25):19637-46)。利用静电操纵机制的优势,这些构建体显示,通过两对外围定位的带电荷残基的突变有效促使具有最低同二聚体污染的Fc异二聚体形成。与knob-into-hole设计形成对比,由于静电排斥机制所致同二聚体被均匀地抑制,但并未完全避免。
Davis等人描述了在不引入额外链间二硫键的情况下,通过使人IgG和IgA CH3结构域的β链区段交错,将Fc同二聚体转化成异二聚体的抗体工程方法(Davis等,2010,Protein Eng.Des.Sel.23(4):195-202)。通过哺乳动物细胞表达SEEDbody(Sb)融合蛋白以高收率产生Sb异二聚体,其容易纯化以清除少量副产物。
美国专利申请公布号US 2010/331527 A1描述了基于CH3结构域的异二聚化的双特异性抗体,在一条重链中引入了CH3结构域内的突变H95R和Y96F。这些氨基酸取代来源于IgG3亚型的CH3结构域,并将与IgG1骨架异二聚化。易于与每条重链配对的通用轻链是基于通过CH3结构域异二聚化的所有形式的先决条件。因此产生总共3种类型的抗体:50%具有单纯的IgG1骨架,1/3具有单纯的H95R和Y96F突变骨架,1/3具有两种不同的重链(双特异性)。所需异二聚体可从该混合物中纯化,因为其与蛋白A的结合性质不同于亲代抗体的结合性质:IgG3来源的CH3结构域不与蛋白A结合,而IgG1却结合。因此,异二聚体与蛋白A结合,但以比单纯的IgG1同二聚体高的pH洗脱,这使得双特异性异二聚体的选择性纯化成为可能。
美国专利号7,612,181描述了双重可变结构域IgG(DVD-IgG)双特异性抗体,其以描述于美国专利号5,989,830的双重Fv形式为基础。类似的双特异性形式还描述于美国专利申请公布号US 2010/0226923 A1。将恒定结构域加入双重Fv的相应链中(CH1-Fc加入重链,κ或λ恒定结构域加入轻链)导致功能性双特异性抗体,而对额外修饰无任何需要(即恒定结构域的明显加入以提高稳定性)。以DVD-Ig/TBTI形式表达的某些抗体显示对第二(或最深处的)抗原结合位置(Fv2)的位置效应。根据被Fv2位置识别的抗原的序列和性质,这种抗体结构域显示对其抗原的亲和力降低(即与亲代抗体相比失去结合速率(on-rate))。这种观察结果的一种可能解释是VL1和VL2间的接头突出到Fv2的CDR区,使得Fv2对较大抗原有些不可及。
描述于美国专利号5,989,830的双特异性抗体片段的第二种构型是交换双头(cross-over double head,CODH),其具有在两条链上表达的可变结构域的下列取向:
VL1-接头-VL2,对于轻链,和
VH2-接头-VH1,对于重链
'830专利公开了双特异性交换双头抗体片段(构建体GOSA.E)保持比双重Fv高的结合活性(参见'830专利第20页,第20-50行),并且还公开了这种形式较少受可变结构域之间使用的接头影响(参见'830专利第20-21页)。
发明概述
本发明提供包含形成4个抗原结合位点的4条多肽链的抗体样结合蛋白,其中2条多肽链具有由下式表示的结构:
VL1-L1-VL2-L2-CL [I]
和2条多肽链具有由下式表示的结构:
VH2-L3-VH1-L4-CH1-Fc [II]
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;
Fc为免疫球蛋白铰链区和CH2、CH3免疫球蛋白重链恒定结构域;
L1、L2、L3和L4为氨基酸接头;
且其中式I的多肽和式II的多肽形成交换轻链-重链对。
本发明还提供包含形成两个抗原结合位点的2条多肽链的抗体样结合蛋白,其中第一多肽链具有由下式表示的结构:
VL1-L1-VL2-L2-CL [I]
和第二多肽链具有由下式表示的结构:
VH2-L3-VH1-L4-CH1 [II]
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;
L1、L2、L3和L4为氨基酸接头;
且其中第一和第二多肽形成交换轻链-重链对。
本发明还提供制备包含形成4个抗原结合位点的4条多肽链的抗体样结合蛋白的方法,该方法包括鉴定结合第一靶抗原的第一抗体可变结构域和结合第二靶抗原的第二抗体可变结构域,所述可变结构域各含有VL和VH;指定轻链或重链作为模板链;指定第一抗体可变结构域或第二抗体可变结构域的VL作为VL1;按照下式[I]和式[II]指定VL2、VH1和VH2:
VL1-L1-VL2-L2-CL [I]
VH2-L3-VH1-L4-CH1-Fc [II]
确定L1、L2、L3和L4的最大和最小长度;产生式I和式II的多肽结构;选出当组合形成抗体样结合蛋白时,结合第一靶抗原和第二靶抗原的式I和式II的多肽结构;
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;
Fc为免疫球蛋白铰链区和CH2、CH3免疫球蛋白重链恒定结构域;和
L1、L2、L3和L4为氨基酸接头;
且其中式I的多肽和式II的多肽形成交换轻链-重链对。
本发明还提供制备包含形成4个抗原结合位点的4条多肽链的抗体样结合蛋白的方法,该方法包括鉴定结合第一靶抗原的第一抗体可变结构域和结合第二靶抗原的第二抗体可变结构域,所述可变结构域各含有VL和VH;指定轻链或重链作为模板链;指定第一抗体可变结构域或第二抗体可变结构域的VL作为VL1;按照下式[I]和式[II]指定VL2、VH1和VH2:
VL1-L1-VL2-L2-CL [I]
VH2-L3-VH1-L4-CH1 [II]
确定L1、L2、L3和L4的最大和最小长度;产生式I和式II的多肽结构;选出当组合形成抗体样结合蛋白时,结合第一靶抗原和第二靶抗原的式I和式II的多肽结构;
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;和
L1、L2、L3和L4为氨基酸接头;
且其中式I的多肽和式II的多肽形成交换轻链-重链对。
本发明的具体实施方案从某些实施方案和权利要求书的以下更详细的说明来看将是显然的。
具体地,本发明涉及如下各项:
1.一种包含形成4个抗原结合位点的4条多肽链的抗体样结合蛋白,其中2条多肽链具有由下式表示的结构:
VL1-L1-VL2-L2-CL [I]
并且2条多肽链具有由下式表示的结构:
VH2-L3-VH1-L4-CH1-Fc [II]
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;
Fc为免疫球蛋白铰链区和CH2、CH3免疫球蛋白重链恒定结构域;和L1、L2、L3和L4为氨基酸接头;
且其中式I的多肽和式II的多肽形成交换轻链-重链对。
2.项1的抗体样结合蛋白,其中:
L1的长度为3-12个氨基酸残基;
L2的长度为3-14个氨基酸残基;
L3的长度为1-8个氨基酸残基;和
L4的长度为1-3个氨基酸残基。
3.项1或2的抗体样结合蛋白,其中:
L1的长度为5-10个氨基酸残基;
L2的长度为5-8个氨基酸残基;
L3的长度为1-5个氨基酸残基;和
L4的长度为1-2个氨基酸残基。
4.项1-3中任一项的抗体样结合蛋白,其中:
L1的长度为7个氨基酸残基;
L2的长度为5个氨基酸残基;
L3的长度为1个氨基酸残基;和
L4的长度为2个氨基酸残基。
5.项1的抗体样结合蛋白,其中:
L1的长度为1-3个氨基酸残基;
L2的长度为1-4个氨基酸残基;
L3的长度为2-15个氨基酸残基;和
L4的长度为2-15个氨基酸残基。
6.项1或5的抗体样结合蛋白,其中:
L1的长度为1-2个氨基酸残基;
L2的长度为1-2个氨基酸残基;
L3的长度为4-12个氨基酸残基;和
L4的长度为2-12个氨基酸残基。
7.项1、5或6中任一项的抗体样结合蛋白,其中:
L1的长度为1个氨基酸残基;
L2的长度为2个氨基酸残基;
L3的长度为7个氨基酸残基;和
L4的长度为5个氨基酸残基。
8.项1的抗体样结合蛋白,其中L1的长度为0个氨基酸残基,L3的长度为2个或更多个氨基酸残基。
9.项1的抗体样结合蛋白,其中L3的长度为0个氨基酸残基,L1的长度为1个或多个氨基酸残基。
10.项1的抗体样结合蛋白,其中L4的长度为0个氨基酸残基,L2的长度为3个或更多个氨基酸残基。
11.项1-10中任一项的抗体样结合蛋白,其中所述结合蛋白能够与一种或多种抗原靶特异性结合。
12.项1-11中任一项的抗体样结合蛋白,其中所述一种或多种抗原靶选自B7.1、B7.2、BAFF、BlyS、C3、C5、CCL11(嗜伊红粒细胞趋化因子)、CCL15(MIP-1d)、CCL17(TARC)、CCL19(MIP-3b)、CCL2(MCP-1)、CCL20(MIP-3a)、CCL21(MIP-2)、SLC、CCL24(MPIF-2/嗜伊红粒细胞趋化因子-2)、CCL25(TECK)、CCL26(嗜伊红粒细胞趋化因子-3)、CCL3(MIP-1a)、CCL4(MIP-1b)、CCL5(RANTES)、CCL7(MCP-3)、CCL8(mcp-2)、CD3、CD19、CD20、CD24、CD40、CD40L、CD80、CD86、CDH1(E-钙黏着蛋白)、几丁质酶、CSF1(M-CSF)、CSF2(GM-CSF)、CSF3(GCSF)、CTLA4、CX3CL1(SCYD1)、CXCL12(SDF1)、CXCL13、EGFR、FCER1A、FCER2、HER2、IGF1R、IL-1、IL-12、IL13、IL15、IL17、IL18、IL1A、IL1B、IL1F10、IL1β、IL2、IL4、IL6、IL7、IL8、IL9、IL12/23、IL22、IL23、IL25、IL27、IL35、ITGB4(b 4整联蛋白)、LEP(瘦蛋白)、MHC II类、TLR2、TLR4、TLR5、TNF、TNFα、TNFSF4(OX40配体)、TNFSF5(CD40配体)、Toll样受体、TREM1、TSLP、TWEAK、XCR1(GPR5/CCXCR1)、DNGR-1(CLEC91)和HMGB1。
13.项1-12中任一项的抗体样结合蛋白,其中所述结合蛋白是双特异性的并且能够结合两种不同的抗原靶。
14.项1-13中任一项的抗体样结合蛋白,其中所述两种不同的抗原靶选自IL4和IL13、IGF1R和HER2、IGF1R和EGFR、EGFR和HER2、BK和IL13、PDL-1和CTLA-4、CTLA4和MHC II类、IL-12和IL-18、IL-1α和IL-1β、TNFα和IL12/23、TNFα和IL-12p40、TNFα和IL1β、TNFα和IL-23及IL17和IL23。
15.项1-14中任一项的抗体样结合蛋白,其中所述结合蛋白能够抑制所述抗原靶中的一种或多种的功能。
16.项1-15中任一项的抗体样结合蛋白,其中选自L1、L2、L3和L4的接头的至少一个含有至少一个半胱氨酸残基。
17.一种包含形成两个抗原结合位点的2条多肽链的抗体样结合蛋白,其中第一多肽链具有由下式表示的结构:
VL1-L1-VL2-L2-CL [I]
并且第二多肽链具有由下式表示的结构:
VH2-L3-VH1-L4-CH1 [II]
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;和
L1、L2、L3和L4为氨基酸接头;
且其中第一和第二多肽形成交换轻链-重链对。
18.项17的抗体样结合蛋白,其中:
L1的长度为3-12个氨基酸残基;
L2的长度为3-14个氨基酸残基;
L3的长度为1-8个氨基酸残基;和
L4的长度为1-3个氨基酸残基。
19.项17或18的抗体样结合蛋白,其中:
L1的长度为5-10个氨基酸残基;
L2的长度为5-8个氨基酸残基;
L3的长度为1-5个氨基酸残基;和
L4的长度为1-2个氨基酸残基。
20.项17-19中任一项的抗体样结合蛋白,其中:
L1的长度为7个氨基酸残基;
L2的长度为5个氨基酸残基;
L3的长度为1个氨基酸残基;和
L4的长度为2个氨基酸残基。
21.项17的抗体样结合蛋白,其中:
L1的长度为1-3个氨基酸残基;
L2的长度为1-4个氨基酸残基;
L3的长度为2-15个氨基酸残基;和
L4的长度为2-15个氨基酸残基。
22.项17或21的抗体样结合蛋白,其中:
L1的长度为1-2个氨基酸残基;
L2的长度为1-2个氨基酸残基;
L3的长度为4-12个氨基酸残基;和
L4的长度为2-12个氨基酸残基。
23.项17、21或22中任一项的抗体样结合蛋白,其中:
L1的长度为1个氨基酸残基;
L2的长度为2个氨基酸残基;
L3的长度为7个氨基酸残基;和
L4的长度为5个氨基酸残基。
24.项17的抗体样结合蛋白,其中L1的长度为0个氨基酸残基,L3的长度为2个或更多个氨基酸残基。
25.项17的抗体样结合蛋白,其中L3的长度为0个氨基酸残基,L1的长度为1个或多个氨基酸残基。
26.项17的抗体样结合蛋白,其中L4的长度为0个氨基酸残基,L2的长度为3个或更多个氨基酸残基。
27.项17-26中任一项的抗体样结合蛋白,其中所述结合蛋白能够与一种或多种抗原靶特异性结合。
28.项17-27中任一项的抗体样结合蛋白,其中所述一种或多种抗原靶选自B7.1、B7.2、BAFF、BlyS、C3、C5、CCL11(嗜伊红粒细胞趋化因子)、CCL15(MIP-1d)、CCL17(TARC)、CCL19(MIP-3b)、CCL2(MCP-1)、CCL20(MIP-3a)、CCL21(MIP-2)、SLC、CCL24(MPIF-2/嗜伊红粒细胞趋化因子-2)、CCL25(TECK)、CCL26(嗜伊红粒细胞趋化因子-3)、CCL3(MIP-1a)、CCL4(MIP-1b)、CCL5(RANTES)、CCL7(MCP-3)、CCL8(mcp-2)、CD3、CD19、CD20、CD24、CD40、CD40L、CD80、CD86、CDH1(E-钙黏着蛋白)、几丁质酶、CSF1(M-CSF)、CSF2(GM-CSF)、CSF3(GCSF)、CTLA4、CX3CL1(SCYD1)、CXCL12(SDF1)、CXCL13、EGFR、FCER1A、FCER2、HER2、IGF1R、IL-1、IL-12、IL13、IL15、IL17、IL18、IL1A、IL1B、IL1F10、IL1β、IL2、IL4、IL6、IL7、IL8、IL9、IL12/23、IL22、IL23、IL25、IL27、IL35、ITGB4(b 4整联蛋白)、LEP(瘦蛋白)、MHC II类、TLR2、TLR4、TLR5、TNF、TNFα、TNFSF4(OX40配体)、TNFSF5(CD40配体)、Toll样受体、TREM1、TSLP、TWEAK、XCR1(GPR5/CCXCR1)、DNGR-1(CLEC91)和HMGB1。
29.项17-28中任一项的抗体样结合蛋白,其中所述结合蛋白是双特异性的并且能够结合两种不同的抗原靶。
30.项17-29中任一项的抗体样结合蛋白,其中所述两种不同的抗原靶选自IL4和IL13、IGF1R和HER2、IGF1R和EGFR、EGFR和HER2、BK和IL13、PDL-1和CTLA-4、CTLA4和MHC II类、IL-12和IL-18、IL-1α和IL-1β、TNFα和IL12/23、TNFα和IL-12p40、TNFα和IL1β、TNFα和IL-23及IL17和IL23。
31.项17-30中任一项的抗体样结合蛋白,其中所述结合蛋白能够抑制抗原靶中的一种或多种的功能。
32.项17-31中任一项的抗体样结合蛋白,其中选自L1、L2、L3和L4的接头中的至少一个含有至少一个半胱氨酸残基。
33.一种分离的核酸分子,其包含编码项1-32中任一项的抗体样结合蛋白的核苷酸序列。
34.一种表达载体,其包含项33的核酸分子。
35.一种分离的宿主细胞,其包含项33的核酸分子或项34的表达载体。
36.项35的宿主细胞,其中所述宿主细胞是哺乳动物细胞或昆虫细胞。
37.一种药物组合物,其包含药学上可接受的载体和治疗有效量的项1-32中任一项的抗体样结合蛋白。
38.一种用于制备项1-16中任一项的抗体样结合蛋白的方法,所述方法包括在细胞中表达编码多肽的一种或多种核酸分子,所述多肽具有由下式[I]和式[II]表示的结构:
VL1-L1-VL2-L2-CL [I]
VH2-L3-VH1-L4-CH1-Fc [II]
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;
Fc为免疫球蛋白铰链区和CH2、CH3免疫球蛋白重链恒定结构域;和
L1、L2、L3和L4为氨基酸接头;
且其中式I的多肽和式II的多肽形成交换轻链-重链对。
39.一种用于制备项17-32中任一项的抗体样结合蛋白的方法,所述方法包括在细胞中表达编码多肽的一种或多种核酸分子,所述多肽具有由下式[I]和式[II]表示的结构:
VL1-L1-VL2-L2-CL [I]
VH2-L3-VH1-L4-CH1 [II]
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;和
L1、L2、L3和L4为氨基酸接头;
且其中式I的多肽和式II的多肽形成交换轻链-重链对。
40.一种制备包含形成4个抗原结合位点的4条多肽链的抗体样结合蛋白的方法,所述方法包括:
(a)鉴定结合第一靶抗原的第一抗体可变结构域和结合第二靶抗原的第二抗体可变结构域,所述可变结构域各含有VL和VH;
(b)指定轻链或重链作为模板链;
(c)指定第一抗体可变结构域或第二抗体可变结构域的VL作为VL1;
(d)按照下式[I]和式[II]指定VL2、VH1和VH2:
VL1-L1-VL2-L2-CL [I]
VH2-L3-VH1-L4-CH1-Fc [II]
(e)确定L1、L2、L3和L4的最大和最小长度;
(f)产生式I和式II的多肽结构;
(g)选出当组合形成抗体样结合蛋白时,结合第一靶抗原和第二靶抗原的式I和式II的多肽结构;
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;
Fc为免疫球蛋白铰链区和CH2、CH3免疫球蛋白重链恒定结构域;和
L1、L2、L3和L4为氨基酸接头;
且其中式I的多肽和式II的多肽形成交换轻链-重链对。
41.项40的方法,其中所述第一抗体可变结构域和第二抗体可变结构域相同。
42.一种制备包含形成4个抗原结合位点的4条多肽链的抗体样结合蛋白的方法,所述方法包括:
(a)鉴定结合第一靶抗原的第一抗体可变结构域和结合第二靶抗原的第二抗体可变结构域,所述可变结构域各含有VL和VH;
(b)指定轻链或重链作为模板链;
(c)指定第一抗体可变结构域或第二抗体可变结构域的VL作为VL1;
(d)按照下式[I]和式[II]指定VL2、VH1和VH2:
VL1-L1-VL2-L2-CL [I]
VH2-L3-VH1-L4-CH1 [II]
(e)确定L1、L2、L3和L4的最大和最小长度;
(f)产生式I和式II的多肽结构;
(g)选出当组合形成抗体样结合蛋白时,结合第一靶抗原和第二靶抗原的式I和式II的多肽结构;
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;和
L1、L2、L3和L4为氨基酸接头;
且其中式I的多肽和式II的多肽形成交换轻链-重链对。
43.项42的方法,其中所述第一抗体可变结构域和第二抗体可变结构域相同。
附图简述
图1.双重V区构型内的抗原结合结构域Fv1和Fv2及在TBTI形式中其各自的肽接头LL和LH的排列的示意图。
图2.交换双重可变(CODV)构型内抗原结合结构域Fv1(抗IL4)和Fv2(抗IL13)及其各自的肽接头的排列的示意图(2D)。
图3.Fv抗IL4和Fab抗IL13的示意图,显示通过抗IL4的Fv和抗IL13的Fv的蛋白质-蛋白质对接获得的一种可能的空间排列。
图4.在BIACORE测定法中通过将两种抗原贯序或同时注入DVD-Ig蛋白包被的芯片上对CODV蛋白的四价双特异性结合能力进行评价。通过共注入两种抗原可获得通过贯序注入所观察到的最大信号,这就表明了全部结合位点饱和。
图5.CODV构型内的抗原结合结构域及其各自的肽接头LL(L1和L2)和LH(L3和L4)的排列的示意图(2D)。在图A中,轻链保持呈“线性或模板”排列,而重链呈“交换”构型。在图B中,重链保持呈“线性或模板”排列,而轻链呈“交换”构型。
图6.根据是轻链还是重链用作“模板”的CODV-Ig设计的示意图。
图7.掺入抗IL4和抗IL13序列的TBTI/DVD-Ig或CODV-Ig分子的比较。
图8.在细胞毒性测定法中使用NALM-6细胞对CODV-Fab和B-Fab形式的比较。
发明详述
本发明提供包含形成4个抗原结合位点的4条多肽链的抗体样结合蛋白,其中形成抗体样结合蛋白的每对多肽具有带有交换取向的双重可变结构域。本发明还提供用于制备这类抗原样结合蛋白的方法。
计算机建模预测,美国专利号5,989,830的交换双头(CODH)设计可产生这样的复合物,其中两个结合位点以相对取向面对,没有对美国专利号7,612,181的双重Fv构型所提出的约束。具体地说,计算机建模表明可变结构域间氨基酸接头的长度对于CODH设计不是关键的,但在双重Fv设计中对于允许充分接近两个抗原结合位点是重要的。如同DVD-Ig/TBTI形式一样,制备了这样的抗体样结合蛋白构建体,其中恒定结构域与CODH构型连接形成包含形成4个抗原结合位点的4条多肽链的抗体样结合蛋白,其中形成抗体样结合蛋白的每对多肽具有带有交换取向的双重可变结构域(即CODH-Ig)。预期与CODH分子相比,CODH-Ig分子具有显著改进的稳定性(因为DVD-Ig/TBTI具有相对于双重Fv分子的改进的稳定性)。
为了验证上述假设,使用描述于美国专利申请公布号US 2010/0226923 A1的抗IL4和抗IL13抗体序列制备CODH-Ig分子。就分隔各自的多肽链上的可变结构域的氨基酸接头的长度而言,CODH-Ig分子不同于US 2010/0226923的CODH分子。CODH-Ig分子在瞬时转染后在细胞中表达,然后通过蛋白A色谱法纯化。虽然其分子排阻色谱(SEC)概况显示5-10%的聚集水平,但CODH-Ig分子无一是功能性的,因此CODH-Ig分子无一能够结合其所有的靶抗原。没有抗原结合活性可能是因为因不合适的接头长度损害正确的互补位形成所致而扰乱重链和轻链Fv区的二聚化。因此,开发了确定合适的氨基酸接头的方案,所述接头用于插入到抗体样结合蛋白的多肽重链和轻链两者上的两个可变结构域和第二可变结构域和恒定结构域之间。该方案分别基于FvIL4和FvIL13区的同源和实验模型的蛋白质-蛋白质对接、模式Fc1结构域的纳入以及FvIL4和FvIL13区之间及Fv和恒定Fc1区之间的合适接头的构建。
采用标准重组DNA方法构建编码形成本发明抗体样结合蛋白的多肽的多核苷酸,将这些多核苷酸掺入重组表达载体中,并将这类载体导入宿主细胞中。参见例如Sambrook等,2001,Molecular Cloning:A Laboratory Manual(Cold Spring Harbor Laboratory Press,第3版)。酶促反应和纯化技术可按照生产商的说明书、按本领域通常实现的或按本文描述的进行。除非提供特定的定义,与本文所述分析化学、合成有机化学及医学和制药化学的实验室程序和技术联用的术语是本领域众所周知和常用的术语。类似地,常规技术可用于化学合成、化学分析、药物制备、制剂化、递送和患者治疗。
1.通用定义
如本公开内容所使用,下列术语除非另有说明,否则应理解为具有下列含义。除非文中另有要求,否则单数术语应包括复数,复数术语应包括单数。
本文所用术语“多核苷酸”是指长为至少10个核苷酸的单链或双链核酸聚合物。在某些实施方案中,包含多核苷酸的核苷酸可以是核糖核苷酸或脱氧核糖核苷酸或任一核苷酸类型的修饰形式。所述修饰包括碱基修饰例如溴尿苷、核糖修饰例如阿拉伯糖苷和2',3'-双脱氧核糖及核苷酸间键修饰例如硫代磷酸酯、二硫代磷酸酯、硒代磷酸酯(phosphoroselenoate)、二硒代磷酸酯、phosphoroanilothioate、phoshoraniladate和氨基磷酸酯(phosphoroamidate)。术语“多核苷酸”明确包括DNA的单链和双链形式。
“分离的多核苷酸”为基因组、cDNA或合成来源的多核苷酸或其一些组合,由于其来源,分离的多核苷酸:(1)不与分离的多核苷酸天然存在于其中的多核苷酸的全部或部分缔合,(2)与其天然不与之连接的多核苷酸连接,或(3)不作为较大序列的部分天然存在。
“分离的多肽”是这样的多肽:(1)不含正常与之同时存在的至少一些其它多肽,(2)基本不含来自相同来源(例如来自相同物种)的其它多肽,(3)通过来自不同物种的细胞表达,(4)已与其与之天然缔合的多核苷酸、脂质、碳水化合物或其它物质的至少约50%分离,(5)不与“分离的多肽”天然与之缔合的多肽的部分缔合(通过共价或非共价相互作用),(6)与其与之天然不缔合的多肽有效缔合(通过共价或非共价相互作用),或(7)天然不存在。所述分离的多肽可由基因组DNA、cDNA、mRNA或合成来源的其它RNA或其任何组合编码。优选分离的多肽基本不含在其自然环境中存在的可能干扰其应用(治疗、诊断、预防、研究或其它)的多肽或其它污染物。
本文所用术语“人抗体”包括基本相当于人种系免疫球蛋白序列的可变区和恒定区的抗体。在一些实施方案中,人抗体在非人哺乳动物中产生,包括但不限于啮齿动物(例如小鼠和大鼠)和兔类动物(例如兔)。在其它实施方案中,人抗体在杂交瘤细胞中产生。在另外其它的实施方案中,人抗体经重组产生。
天然存在的抗体通常包含四聚体。每个这样的四聚体通常由两个相同的多肽链对组成,每对具有一条全长“轻”链(通常分子量为约25kDa)和一条全长“重”链(通常分子量的约50-70kDa)。本文所用术语“重链”和“轻链”是指任何具有足以赋予针对靶抗原的特异性的可变结构域序列的免疫球蛋白多肽。各轻链和重链的氨基端部分通常包括约100-110个或更多个氨基酸的可变结构域,其通常负责抗原识别。各链的羧基端部分通常限定负责效应子功能的恒定结构域。因此,在天然存在的抗体中,全长重链免疫球蛋白多肽包括可变结构域(VH)和3个恒定结构域(CH1、CH2和CH3),其中VH结构域位于多肽的氨基端,CH3结构域位于羧基端,而全长轻链免疫球蛋白多肽包括可变结构域(VL)和恒定结构域(CL),其中VL结构域位于多肽的氨基端,CL结构域位于羧基端。
人轻链通常分类为κ和λ轻链,人重链通常分类为μ、δ、γ、α或ε,分别限定抗体的同种型为IgM、IgD、IgG、IgA和IgE。IgG具有若干亚类,包括但不限于IgG1、IgG2、IgG3和IgG4。IgM具有亚类,包括但不限于IgM1和IgM2。IgA同样被细分为亚类,包括但不限于IgA1和IgA2。在全长轻链和重链内,可变和恒定结构域通常通过约12个或更多个氨基酸的“J”区连接,其中重链还包含约10多个氨基酸的“D”区。参见例如Fundamental Immunology(Paul,W.主编,Raven Press,第2版,1989),所述文献通过引用以其整体予以结合用于所有目的。各轻链/重链对的可变区通常形成抗原结合位点。天然存在的抗体的可变结构域通常显示由3个超变区(亦称互补决定区或CDR)连接的相对保守的框架区(FR)的相同通用结构。每对的两条链的CDR通常通过框架区对齐,这可以使得能够结合特定的表位。从氨基端到羧基端,轻链和重链两者的可变结构域通常包含结构域FR1、CDR1、FR2、CDR2、FR3、CDR3和FR4。
本文所用术语“天然Fc”是指这样的分子,其包含因抗体消化得到的或通过其它方法产生的非抗原结合片段的序列,不论呈单体还是多聚体形式,并可含有铰链区。天然Fc的原始免疫球蛋白来源优选为人源的,并可以是任何的免疫球蛋白,虽然优选IgG1和IgG2。天然Fc分子由单体多肽组成,所述单体多肽可通过共价(即二硫键)和非共价缔合连接成为二聚或多聚体形式。天然Fc分子单体亚单元间的分子间二硫键的数量范围为1-4,这取决于类别(例如IgG、IgA和IgE)或亚类(例如IgG1、IgG2、IgG3、IgA1和IgGA2)。天然Fc的一个实例是自木瓜蛋白酶消化IgG所得的二硫键键合的二聚体。本文所用术语“天然Fc”是单体、二聚和多聚体形式的通称。
本文所用术语“Fc变体”是指这样的分子或序列,其自天然Fc修饰但仍包含针对补救受体(salvage receptor)FcRn(新生儿Fc受体)的结合位点。示例性的Fc变体及其与补救受体的相互作用是本领域已知的。因此,术语“Fc变体”可包含来自非人天然Fc经人源化的分子或序列。而且,天然Fc包含可被除去的区域,因为它们提供非本发明的抗体样结合蛋白所需的结构特征或生物活性。因此,术语“Fc变体”包含缺乏一个或多个天然Fc位点或残基的分子或序列,或其中一个或多个Fc位点或残基被修饰,其影响或参与:(1)二硫键形成,(2)与选定宿主细胞的不相容性,(3)在选定宿主细胞中表达时的N端异质性,(4)糖基化,(5)与补体的相互作用,(6)与非补救受体的Fc受体结合,或(7)抗体依赖性细胞毒性(ADCC)。
本文所用术语“Fc结构域”包括天然Fc和上文定义的Fc变体和序列。如同Fc变体和天然Fc分子一样,术语“Fc结构域”包括呈单体或多聚体形式的分子,不论是自完整抗体消化还是通过其它方法产生。
本文所用术语“抗体样结合蛋白”是指与至少一个靶抗原特异性结合的非天然存在的(或重组的)分子,并且其包含形成4个抗原结合位点的4条多肽链,其中2条多肽链具有由下式表示的结构:
VL1-L1-VL2-L2-CL [I]
和2条多肽链具有由下式表示的结构:
VH2-L3-VH1-L4-CH1-Fc [II]
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;
Fc为免疫球蛋白铰链区和CH2、CH3免疫球蛋白重链恒定结构域;
L1、L2、L3和L4为氨基酸接头;
且其中式I的多肽和式II的多肽形成交换轻链-重链对。本文所用术语“抗体样结合蛋白”还指与至少一个靶抗原特异性结合的非天然存在的(或重组的)分子,且其包含形成两个抗原结合位点的2条多肽链,其中第一多肽链具有由下式表示的结构:
VL1-L1-VL2-L2-CL [I]
和第二多肽链具有由下式表示的结构:
VH2-L3-VH1-L4-CH1 [II]
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;
L1、L2、L3和L4为氨基酸接头;
且其中第一和第二多肽形成交换轻链-重链对。“重组的”分子是通过重组方法制备、表达、产生或分离的分子。
本发明的一个实施方案提供对介于1和4个之间的靶抗原具有生物学和免疫学特异性的抗体样结合蛋白。本发明的另一个实施方案提供包含编码形成所述抗体样结合蛋白的多肽链的核苷酸序列的核酸分子。本发明的另一个实施方案提供表达载体,其包含含有编码形成所述抗体样结合蛋白的多肽链的核苷酸序列的核酸分子。本发明的又一个实施方案提供表达所述抗体样结合蛋白(即包含编码形成所述抗体样结合蛋白的多肽链的核酸分子或载体)的宿主细胞。
本文所用术语“可交换性”是指CODV形式内的且保持折叠和最终结合亲和力的可变结构域的可互换性。“完全可交换性”是指交换CODV-Ig(即,使顺序反转)或CODV-Fab中的VH1和VH2结构域两者的顺序并因此交换VL1和VL2结构域的顺序,同时保持抗体样结合蛋白的完整功能性的能力,这通过结合亲和力的保留来证实。而且,应注意的是,特定CODV-Ig或CODV-Fab内的标识VH和VL仅是指最终形式的特定蛋白质链上的结构域位置。例如,VH1和VH2可来源于亲本抗体中的VL1和VL2结构域,并被置于抗体样结合蛋白中的VH1和VH2位置处。同样地,VL1和VL2可来源于亲本抗体中的VH1和VH2结构域,并被置于抗体样结合蛋白中的VH1和VH2位置处。因此,VH和VL标识是指现在的位置,而非亲本抗体中的原始位置。VH和VL结构域因此是“可交换的”。
“分离的”抗体样结合蛋白是已从其天然环境的组分中鉴定和分离和/或回收的抗体样结合蛋白。其天然环境的污染物组分是可能干扰抗体样结合蛋白的诊断或治疗用途的物质,可包括酶、激素和其它蛋白质性或非蛋白质性溶质。在优选的实施方案中,抗体样结合蛋白可被纯化至:(1)通过Lowry方法测定,按抗体重量计大于95%并且最优选按重量计大于99%;(2)通过使用转杯式测序仪,足以获得N端或内部氨基酸序列的至少15个残基的程度;或(3)使用考马斯蓝或优选银染色在还原或非还原条件下通过SDS-PAGE的同质性。分离的抗体样结合蛋白包括重组细胞内的原位抗体样结合蛋白,因为抗体样结合蛋白的自然环境的至少一个组分将不存在。
本文所用术语“基本纯的”或“基本纯化的”是指是存在的主要种类的任何化合物或种类(即以摩尔浓度基础计,比组成物中的任何其它各个种类丰富)。在一些实施方案中,基本纯化的部分是其中所述种类包含存在的所有大分子种类的至少约50%(以摩尔浓度基础计)的组合物。在其它实施方案中,基本纯的组合物包含存在于组合物中的所有大分子种类的大于约80%、85%、90%、95%或99%。在另外其它的实施方案中,该种类被纯化至基本同质性(通过常规检测方法无法在组合物中检出污染种类),其中组合物基本由单一大分子种类组成。
本文所用术语“抗原”或“靶抗原”是指这样的分子或分子的部分,其能够被抗体样结合蛋白结合,且另外能够用于动物以产生与该抗原的表位结合的抗体。靶抗原可具有一个或多个表位。就被抗体样结合蛋白识别的各个靶抗原而言,抗体样结合蛋白能够与识别靶抗原的完整抗体竞争。“二价”抗体样结合蛋白,而非“多特异性”或“多功能”抗体样结合蛋白,被认为包含具有相同抗原特异性的抗原结合位点。
双特异性或双功能抗体通常是具有两个不同的重链/轻链对和两个不同的结合位点或表位的人工杂合抗体。双特异性抗体可通过各种方法产生,包括但不限于杂交瘤的融合或F(ab')片段的连接。
F(ab)片段通常包括一条轻链及一条重链的VH和CH1结构域,其中F(ab)片段的VH-CH1重链部分无法与另一重链多肽形成二硫键。本文所用F(ab)片段还可包括一条轻链(含有被氨基酸接头分隔开的2个可变结构域)和一条重链(含有被氨基酸接头分隔开的2个可变结构域和CH1结构域)。
F(ab')片段通常包括一条轻链和含有更多恒定区(在CH1与CH2结构域间)的一条重链的一部分,使得可在两条重链间形成链间二硫键以形成F(ab')2分子。
关于本发明的抗体样结合蛋白的短语“生物学性质”、“生物学特性”和术语“活性”在本文中可互换使用,包括但不限于表位亲和力和特异性、拮抗抗原靶(或靶向多肽)的活性的能力、抗体样结合蛋白的体内稳定性和抗体样结合蛋白的免疫原性性质。抗体样结合蛋白的其它可鉴定的生物学性质或特性包括例如交叉反应性(即一般为与抗原靶的非人同源物或与其它抗原靶或组织的交叉反应性)和保持蛋白质在哺乳动物细胞中的高表达水平的能力。可采用本领域公认的技术来观察或测量上述性质或特性,所述技术包括但不限于ELISA、竞争性ELISA、表面等离振子共振分析、体外和体内中和测定法和用来自不同来源(包括人、灵长类动物或可能需要的任何其它来源)的组织切片的免疫组织化学。
本文所用术语“免疫功能性免疫球蛋白片段”是指至少含有多肽片段来源于其中的免疫球蛋白重链或轻链的CDR的多肽片段。免疫功能性免疫球蛋白片段能够与靶抗原结合。
本文所用“中和”抗体样结合蛋白是指能够阻断或实质性降低与之结合的靶抗原的效应子功能的分子。本文所用“实质性降低”意指靶抗原的效应子功能降低至少约60%、优选至少约70%、更优选至少约75%、甚至更优选至少约80%、还更优选至少约85%、最优选至少约90%。
术语“表位”包括任何决定簇,优选能够与免疫球蛋白或T细胞受体特异性结合的多肽决定簇。在某些实施方案中,表位决定簇包括例如氨基酸、糖侧链、磷酰基或磺酰基等分子的化学活性表面群聚,并且在某些实施方案中,可具有特定的三维结构特性和/或特定的电荷特性。表位是被抗体或抗体样结合蛋白结合的抗原的区域。在某些实施方案中,当抗体样结合蛋白优先识别其在蛋白质和/或大分子的复杂混合物中的靶抗原时,被称为与抗原特异性结合。在优选的实施方案中,当平衡解离常数≤10-8M、更优选当平衡解离常数≤10-9M、最优选当解离常数≤10-10M时,抗体样结合蛋白被称为与抗原特异性结合。
可通过例如表面等离振子共振,测定抗体样结合蛋白的解离常数(KD)。一般而言,表面等离振子共振分析采用BIAcore系统(Pharmacia Biosensor;Piscataway,NJ),通过表面等离振子共振(SPR),测量配体(生物传感器基质上的靶抗原)和分析物(溶液中的抗体样结合蛋白)之间的实时结合相互作用。表面等离振子分析也可通过使分析物固定(抗体样结合蛋白固定在生物传感器基质上)和提供配体(靶抗原)来进行。本文所用术语“KD”是指特定抗体样结合蛋白和靶抗原间的相互作用的解离常数。
本文所用术语“特异性结合”是指抗体样蛋白或其抗原结合片段以至少约1x10-6M、1x10-7M、1x10-8M、1x10-9M、1x10-10M、1x10-11M、1x10-12M或更大的Kd与含有表位的抗原结合和/或以其对非特异性抗原的亲和力至少2倍的亲和力与表位结合的能力。
本文所用术语“接头”是指插入免疫球蛋白结构域中为轻链和重链的结构域提供足够的可动性以折叠成交换双重可变区免疫球蛋白的一个或多个氨基酸残基。在序列水平上,接头分别在可变结构域之间或可变和恒定结构域之间的转换处插入。可以鉴定结构域间的转换,因为已完全了解免疫球蛋白结构域的近似大小。结构域转换的确切位置可通过定位不形成二级结构单元例如β-折叠或α-螺旋的肽段来确定,,其通过实验数据证实或可通过建模技术或二级结构预测来假设。本文所述接头称为L1,其位于N端VL1和VL2结构域间轻链上;L2,其同样位于VL2和C端CL结构域间的轻链上。重链接头称为L3,其位于N端VH2和VH1结构域之间;和L4,其位于VH1和CH1-Fc结构域之间。接头L1、L2、L3和L4为独立的,但是它们在某些情况下具有相同的序列和/或长度。
本文所用术语“载体”是指用于将编码信息转移至宿主细胞中的任何分子(例如核酸、质粒或病毒)。术语“载体”包括能够将其已连接的另一个核酸转运的核酸分子。载体的一个类型是“质粒”,是指另外的DNA区段可插入其中的环状双链DNA分子。载体的另一个类型是病毒载体,其中另外的DNA区段可插入病毒基因组。某些载体能够在其所导入的宿主细胞中自主复制(例如具有细菌复制起点的细菌载体和附加型哺乳动物载体)。其它载体(例如非附加型哺乳动物载体)可在导入宿主细胞中时整合到宿主细胞的基因组中,从而与宿主基因组一起复制。另外,某些载体能够指导其与之有效连接的基因表达。这类载体在本文称为“重组表达载体”(或简称“表达载体”)。一般而言,在重组DNA技术中应用的表达载体常常为质粒的形式。术语“质粒”和“载体”在本文可互换使用,因质粒是最常使用的载体形式。然而,本发明意欲包括表达载体的其它形式,例如病毒载体(例如复制缺陷型逆转录病毒、腺病毒和腺伴随病毒),其起等同功能的作用。
本文使用术语“有效连接”是指侧翼序列的排列,其中所述侧翼序列经配置或装配,使得进行其常规功能。因此,与编码序列有效连接的侧翼序列可以能够实现编码序列的复制、转录和/或翻译。例如,当启动子能够指导编码序列转录时,所述编码序列与启动子有效连接。侧翼序列不必与编码序列邻接,只要它正确地发挥功能即可。因此,例如,可在启动子序列和编码序列间存在插入的不翻译但转录的序列,启动子序列可仍被视为与编码序列“有效连接”。
本文所用短语“重组宿主细胞”(或“宿主细胞”)是指重组表达载体已导入其中的细胞。重组宿主细胞或宿主细胞不仅意指特定的受试细胞,而且还指这类细胞的子代。由于因其突变或环境影响所致某些修饰可发生在后代中,因此尽管这样的后代实际上可能与母细胞不同,但这样的细胞仍包括在本文所用术语“宿主细胞”的范围内。可使用各种宿主细胞表达系统表达本发明的抗体样结合蛋白,包括细菌、酵母、杆状病毒和哺乳动物表达系统(以及噬菌体展示表达系统)。合适细菌表达载体的实例为pUC19。为了重组表达抗体样结合蛋白,将宿主细胞用一个或多个携带编码抗体样结合蛋白的多肽链的DNA片段的重组表达载体转化或转染,使得多肽链在宿主细胞中表达,并优选分泌到其中培养宿主细胞的培养基中,可从所述培养基中回收抗体样结合蛋白。
本文所用术语“转化”是指细胞遗传特性的改变,当细胞被修饰以含有新的DNA时,细胞被转化。例如,当它自其天然状态被遗传修饰时,细胞被转化。在转化后,转化的DNA可通过自然整合至细胞染色体中而与细胞重组,或可作为附加型元件瞬时保持而不复制,或可作为质粒独立复制。当DNA随细胞分裂而复制时,细胞被视为已稳定转化。本文所用术语“转染”是指异质或外源DNA被细胞摄取,当外源DNA被导入细胞膜内时,细胞被“转染”。多种转染技术是本领域众所周知的。可采用这类技术将一个或多个外源DNA分子导入合适的宿主细胞中。
本文所用和应用于客体的术语“天然存在的”是指该客体可存在于大自然中并且未被人为操作的事实。例如,存在于可从天然来源分离的生物(包括病毒)中且未被人为有意修饰的多核苷酸或多肽是天然存在的。类似地,本文所用“非天然存在的”是指自然中不存在或已人为进行结构修饰或合成的客体。
如本文所用,20个常用氨基酸及其缩写按照常规用法。20个常用氨基酸的立体异构体(例如d-氨基酸);非天然氨基酸例如α-氨基酸、α-二取代的氨基酸、N-烷基氨基酸、乳酸和其它不常用的氨基酸也可是本发明的抗体样结合蛋白多肽链的合适组分。不常用氨基酸的实例包括:4-羟脯氨酸、γ-羧基谷氨酸、ε-N,N,N-三甲基赖氨酸、ε-N-乙酰基赖氨酸、O-磷酸丝氨酸、N-乙酰丝氨酸、N-甲酰甲硫氨酸、3-甲基组氨酸、5-羟赖氨酸、σ-N-甲基精氨酸和其它类似氨基酸和亚氨基酸(例如4-羟脯氨酸)。在本文所用多肽表示法中,按照标准用法和惯例,左侧方向为氨基端方向,右侧方向为羧基端方向。
可根据共有的侧链性质,将天然存在的残基分类:
(1)疏水:Met、Ala、Val、Leu、Ile、Phe、Trp、Tyr、Pro;
(2)极性亲水:Arg、Asn、Asp、Gln、Glu、His、Lys、Ser、Thr;
(3)脂肪族:Ala、Gly、Ile、Leu、Val、Pro;
(4)脂肪族疏水:Ala、Ile、Leu、Val、Pro;
(5)中性亲水:Cys、Ser、Thr、Asn、Gln;
(6)酸性:Asp、Glu;
(7)碱性:His、Lys、Arg;
(8)影响链取向的残基:Gly、Pro;
(9)芳香族:His、Trp、Tyr、Phe;和
(10)芳香族疏水:Phe、Trp、Tyr。
保守氨基酸取代可包括这些类别之一的成员与相同类别的另一个成员交换。保守氨基酸取代可包括非天然存在的氨基酸残基,其通常通过化学肽合成而非通过生物系统合成掺入。这些包括拟肽(peptidomimetic)和氨基酸残基的其它反转或反向形式。非保守取代可包括这些类别之一的成员交换为另一类别的成员。
采用众所周知的技术,技术人员将能够确定本发明的抗体样结合蛋白多肽链的合适变体。例如,通过靶向视认为对活性不重要的区域,本领域的技术人员可鉴定可被改变但又不破坏活性的多肽链的合适区域。或者,本领域的技术人员可鉴定在类似多肽中是保守的分子的残基和部分。另外,可对甚至对生物活性或对结构可能是重要的区域进行保守氨基酸取代而不破坏生物活性或不利地影响多肽结构。
本文所用术语“患者”包括人和动物受试者。
“病症”是可获益于使用本发明的抗体样结合蛋白治疗的任何病况。“病症”和“病况”在本文中可互换使用,包括慢性和急性病症或疾病,包括使患者易患所述病症的那些病理病况。
本文所用术语“治疗”或“医治”是指任何治疗性治疗和预防或预防性措施两者。需要治疗的受试者包括患有病症的受试者以及易患病症的受试者或其中病症待被预防的受试者。
本文所用术语“药物组合物”或“治疗组合物”是指当适当给予患者时能够引起所需治疗作用的任何化合物或组合物。
本文所用术语“药学上可接受的载体”或“生理学上可接受的载体”是指适于实现或促进抗体样结合蛋白递送的一种或多种制剂材料。
术语“有效量”和“治疗有效量”当用于提及包含一种或多种抗体样结合蛋白的药物组合物时,是指足以产生所需治疗结果的量或剂量。更具体地说,治疗有效量是足以抑制与待治疗病况相关的一个或多个临床上确定的病理过程达一定时间的抗体样结合蛋白的量。有效量可随所使用的具体抗体样结合蛋白而变化,也可取决于与受治疗患者相关的各种因素和状况和病症的严重性。例如,如果抗体样结合蛋白体内给予,则例如患者的年龄、体重和健康状况以及在临床前动物研究中获得的剂量反应曲线和毒性数据等因素将在所考虑的那些因素内。给定药物组合物的有效量或治疗有效量的确定完全在本领域技术人员的能力范围内。
本发明的一个实施方案提供包含药学上可接受的载体和治疗有效量的抗体样结合蛋白的药物组合物。
2.抗体样结合蛋白
在本发明的一个实施方案中,抗体样结合蛋白包含形成4个抗原结合位点的4条多肽链,其中2条多肽链具有由下式表示的结构:
VL1-L1-VL2-L2-CL [I]
和2条多肽链具有由下式表示的结构:
VH2-L3-VH1-L4-CH1-Fc [II]
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;
Fc为免疫球蛋白铰链区和CH2、CH3免疫球蛋白重链恒定结构域;
L1、L2、L3和L4为氨基酸接头;
且其中式I的多肽和式II的多肽形成交换轻链-重链对。
在本发明的另一个实施方案中,抗体样结合蛋白包含形成两个抗原结合位点的2条多肽链,其中第一多肽链具有由下式表示的结构:
VL1-L1-VL2-L2-CL [I]
和第二多肽链具有由下式表示的结构:
VH2-L3-VH1-L4-CH1 [II]
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;
L1、L2、L3和L4为氨基酸接头;
且其中第一和第二多肽形成交换轻链-重链对。
本发明的抗体样结合蛋白可自由任何人或非人的抗体(包括例如人、鼠或人源化抗体)获得或衍生的结构域或序列制备。
在本发明的一些抗体样结合蛋白中,L3的长度是L1的长度的至少两倍。本发明的其它抗体样结合蛋白中,L4的长度是L2的长度至少两倍。在本发明的一些抗体样结合蛋白中,L1的长度是L3的长度的至少两倍。本发明的其它抗体样结合蛋白中,L2的长度是L4的长度的至少两倍。
在本发明的一些抗体样结合蛋白中,L1的长度为3-12个氨基酸残基,L2的长度为3-14个氨基酸残基,L3的长度为1-8个氨基酸残基,L4的长度为1-3个氨基酸残基。在其它的抗体样结合蛋白中,L1的长度为5-10个氨基酸残基,L2的长度为5-8个氨基酸残基,L3的长度为1-5个氨基酸残基,L4的长度为1-2个氨基酸残基。在一优选的抗体样结合蛋白中,L1的长度为7个氨基酸残基,L2的长度为5个氨基酸残基,L3的长度为1个氨基酸残基,L4的长度为2个氨基酸残基。
在本发明的一些抗体样结合蛋白中,L1的长度为1-3个氨基酸残基,L2的长度为1-4个氨基酸残基,L3的长度为2-15个氨基酸残基,L4的长度为2-15个氨基酸残基。在其它的抗体样结合蛋白中,L1的长度为1-2个氨基酸残基,L2的长度为1-2个氨基酸残基,L3的长度为4-12个氨基酸残基,L4的长度为2-12个氨基酸残基。在一个优选的抗体样结合蛋白中,L1的长度为1个氨基酸残基,L2的长度为2个氨基酸残基,L3的长度为7个氨基酸残基,L4的长度为5个氨基酸残基。
在本发明的一些抗体样结合蛋白中,L1、L3或L4可等于零。然而,在其中L1、L3或L4等于零的抗体样结合蛋白中,可变区和恒定区之间或另一链上的双重可变结构域之间的相应的转换接头不能为零。在一些实施方案中,L1等于零且L3为2个或更多个氨基酸残基,L3等于零且L1等于一个或更多个氨基酸残基,或L4等于0且L2为3个或更多个氨基酸残基。
在本发明的一些抗体样结合蛋白中,选自L1、L2、L3和L4的至少一个接头含有至少一个半胱氨酸残基。
合适接头的实例包括单个甘氨酸(Gly)残基;二甘氨酸肽(Gly-Gly);三肽(Gly-Gly-Gly);具有4个甘氨酸残基的肽(Gly-Gly-Gly-Gly;SEQ ID NO:25);具有5个甘氨酸残基的肽(Gly-Gly-Gly-Gly-Gly;SEQ ID NO:26);具有6个甘氨酸残基的肽(Gly-Gly-Gly-Gly-Gly-Gly;SEQ ID NO:27);具有7个甘氨酸残基的肽(Gly-Gly-Gly-Gly-Gly-Gly-Gly;SEQ ID NO:28);具有8个甘氨酸残基的肽(Gly-Gly-Gly-Gly-Gly-Gly-Gly-Gly;SEQ ID NO:29)。可使用氨基酸残基的其它组合,例如肽Gly-Gly-Gly-Gly-Ser(SEQ ID NO:30)和肽Gly-Gly-Gly-Gly-Ser-Gly-Gly-Gly-Gly-Ser(SEQ ID NO:31)。其它合适的接头包括单个Ser和Val残基;二肽Arg-Thr、Gln-Pro、Ser-Ser、Thr-Lys和Ser-Leu;Thr-Lys-Gly-Pro-Ser(SEQ ID NO:52)、Thr-Val-Ala-Ala-Pro(SEQ ID NO:53)、Gln-Pro-Lys-Ala-Ala(SEQ ID NO:54)、Gln-Arg-Ile-Glu-Gly(SEQ ID NO:55)、Ala-Ser-Thr-Lys-Gly-Pro-Ser(SEQ ID NO:48)、Arg-Thr-Val-Ala-Ala-Pro-Ser(SEQ ID NO:49)、Gly-Gln-Pro-Lys-Ala-Ala-Pro(SEQ ID NO:50)和His-Ile-Asp-Ser-Pro-Asn-Lys(SEQ ID NO:51)。上列实例并无意指以任何方式限制本发明的范围,且已表明包含选自以下随机选择的氨基酸的接头适于本发明的抗体样结合蛋白:缬氨酸、亮氨酸、异亮氨酸、丝氨酸、苏氨酸、赖氨酸、精氨酸、组氨酸、天冬氨酸、谷氨酸、天冬酰胺、谷氨酰胺、甘氨酸和脯氨酸(参见实施例12)。
接头中氨基酸残基的特性和序列可随接头中必需实现的二级结构元件的类型而变化。例如,甘氨酸、丝氨酸和丙氨酸最适于具有最大柔性的接头。如果需要更刚性和延长的接头,则甘氨酸、脯氨酸、苏氨酸和丝氨酸的某些组合是有用的。需要时,任何氨基酸残基都可被考虑与其它氨基酸残基组合以构建较大肽接头的接头,这取决于所需性质。
在本发明的一些抗体样结合蛋白中,VL1包含SEQ ID NO:1的氨基酸序列;VL2包含SEQ ID NO:3的氨基酸序列;VH1包含SEQ ID NO:2的氨基酸序列;VH2包含SEQ ID NO:4的氨基酸序列。
在本发明的一些实施方案中,抗体样结合蛋白能够与一种或多种抗原靶特异性结合。在本发明的优选实施方案中,抗体样结合蛋白能够特异性结合至少一种选自以下的抗原靶:B7.1、B7.2、BAFF、BlyS、C3、C5、CCL11(嗜伊红粒细胞趋化因子)、CCL15(MIP-1d)、CCL17(TARC)、CCL19(MIP-3b)、CCL2(MCP-1)、CCL20(MIP-3a)、CCL21(MIP-2)、SLC、CCL24(MPIF-2/嗜伊红粒细胞趋化因子-2)、CCL25(TECK)、CCL26(嗜伊红粒细胞趋化因子-3)、CCL3(MIP-1a)、CCL4(MIP-1b)、CCL5(RANTES)、CCL7(MCP-3)、CCL8(mcp-2)、CD3、CD19、CD20、CD24、CD40、CD40L、CD80、CD86、CDH1(E-钙黏着蛋白)、几丁质酶、CSF1(M-CSF)、CSF2(GM-CSF)、CSF3(GCSF)、CTLA4、CX3CL1(SCYD1)、CXCL12(SDF1)、CXCL13、EGFR、FCER1A、FCER2、HER2、IGF1R、IL-1、IL-12、IL13、IL15、IL17、IL18、IL1A、IL1B、IL1F10、IL1β、IL2、IL4、IL6、IL7、IL8、IL9、IL12/23、IL22、IL23、IL25、IL27、IL35、ITGB4(b 4整联蛋白)、LEP(瘦蛋白)、MHC II类、TLR2、TLR4、TLR5、TNF、TNF-a、TNFSF4(OX40配体)、TNFSF5(CD40配体)、Toll样受体、TREM1、TSLP、TWEAK、XCR1(GPR5/CCXCR1)、DNGR-1(CLEC91)和HMGB1。在本发明的其它实施方案中,抗体样结合蛋白能够抑制一种或多种抗原靶的功能。
在本发明的一些实施方案中,抗体样结合蛋白是双特异性的并且能够结合两种不同的抗原靶或表位。在本发明的优选实施方案中,抗体样结合蛋白是双特异性的,并且各轻链-重链对能够结合两种不同的抗原靶或表位。在本发明更优选的实施方案中,抗体样结合蛋白能够结合选自以下的两种不同的抗原靶:IL4和IL13、IGF1R和HER2、IGF1R和EGFR、EGFR和HER2、BK和IL13、PDL-1和CTLA-4、CTLA4和MHC II类、IL-12和IL-18、IL-1α和IL-1β、TNFα和IL12/23、TNFα和IL-12p40、TNFα和IL-1β、TNFα和IL-23以及IL17和IL23。在甚至更优选的实施方案中,抗体样结合蛋白能够结合抗原靶IL4和IL13。
在本发明的一些实施方案中,抗体样结合蛋白以2.97E+07的结合速率和3.30E-04的解离速率特异性地结合IL4,且以1.39E+06的结合速率和1.63E-04的解离速率特异性地结合IL13。在本发明的其它实施方案中,抗体样结合蛋白以3.16E+07的结合速率和2.89E-04的解离速率特异性地结合IL4,且1.20E+06的结合速率和1.12E-04的解离速率特异性地结合IL13。
在本发明的一个实施方案中,包含形成4个抗原结合位点的4条多肽链的抗体样结合蛋白通过如下制备:鉴定结合第一靶抗原的第一抗体可变结构域和结合第二靶抗原的第二抗体可变结构域,所述可变结构域各含有VL和VH;指定轻链或重链作为模板链;指定第一抗体可变结构域或第二抗体可变结构域的VL作为VL1;按照下式[I]和式[II]指定VL2、VH1和VH2:
VL1-L1-VL2-L2-CL [I]
VH2-L3-VH1-L4-CH1-Fc [II]
确定L1、L2、L3和L4的最大和最小长度;产生式I和式II的多肽结构;选出当组合形成抗体样结合蛋白时,结合第一靶抗原和第二靶抗原的式I和式II的多肽结构;
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;
Fc为免疫球蛋白铰链区和CH2、CH3免疫球蛋白重链恒定结构域;和
L1、L2、L3和L4为氨基酸接头;
且其中式I的多肽和式II的多肽形成交换轻链-重链对。
在本发明的另一个实施方案中,包含形成4个抗原结合位点的4条多肽链的抗体样结合蛋白通过如下制备:鉴定结合第一靶抗原的第一抗体可变结构域和结合第二靶抗原的第二抗体可变结构域,所述可变结构域各含有VL和VH;指定轻链或重链作为模板链;指定第一抗体可变结构域或第二抗体可变结构域的VL作为VL1;按照下式[I]和式[II]指定VL2、VH1和VH2:
VL1-L1-VL2-L2-CL [I]
VH2-L3-VH1-L4-CH1 [II]
确定L1、L2、L3和L4的最大和最小长度;产生式I和式II的多肽结构;选出当组合形成抗体样结合蛋白时,结合第一靶抗原和第二靶抗原的式I和式II的多肽结构;
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;和
L1、L2、L3和L4为氨基酸接头;
且其中式I的多肽和式II的多肽形成交换轻链-重链对。
在本发明的其它实施方案中,制备其中第一抗体可变结构域和第二抗体可变结构域是相同的抗体样结合蛋白。
本发明的一个实施方案提供用于制备抗体样结合蛋白的方法,所述方法包括在细胞中表达编码多肽的一种或多种核酸分子,所述多肽具有由下式[I]和式[II]表示的结构:
VL1-L1-VL2-L2-CL [I]
VH2-L3-VH1-L4-CH1-Fc [II]
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;
Fc为免疫球蛋白铰链区和CH2、CH3免疫球蛋白重链恒定结构域;和
L1、L2、L3和L4为氨基酸接头;
且其中式I的多肽和式II的多肽形成交换轻链-重链对。
本发明的另一个实施方案提供用于制备抗体样结合蛋白的方法,所述方法包括在细胞中表达编码多肽的一种或多种核酸分子,所述多肽具有由下式[I]和式[II]表示的结构:
VL1-L1-VL2-L2-CL [I]
VH2-L3-VH1-L4-CH1 [II]
其中:
VL1为第一免疫球蛋白轻链可变结构域;
VL2为第二免疫球蛋白轻链可变结构域;
VH1为第一免疫球蛋白重链可变结构域;
VH2为第二免疫球蛋白重链可变结构域;
CL为免疫球蛋白轻链恒定结构域;
CH1为免疫球蛋白CH1重链恒定结构域;和
L1、L2、L3和L4为氨基酸接头;
且其中式I的多肽和式II的多肽形成交换轻链-重链对。
3.抗体样结合蛋白的用途
在任何已知的测定方法中,例如用于一种或多种靶抗原检测和定量的竞争结合测定法、直接和间接夹心测定法和免疫沉淀测定法,可使用本发明的抗体样结合蛋白。抗体样结合蛋白将以适合于所采用的测定方法的亲和力结合一种或多种靶抗原。
对于诊断应用,在某些实施方案中,抗体样结合蛋白可用可检测部分标记。可检测部分可为能够直接或间接产生可检测信号的任何部分。例如,可检测部分可以是放射性同位素,例如3H、14C、32P、35S、125I、99Tc、111In或67Ga;荧光或化学发光化合物,例如异硫氰酸荧光素、罗丹明或萤光素;或酶,例如碱性磷酸酶、β-半乳糖苷酶或辣根过氧化物酶。
本发明的抗体样结合蛋白还可用于体内成像。可将用可检测部分标记的抗体样结合蛋白给予动物,优选进入血流,并测定宿主中标记抗体的存在情况和位置。抗体样结合蛋白可用任何在动物中可检测的部分标记,不管是核磁共振、放射学还是本领域已知的其它检测方法。
本发明还涉及试剂盒,其包含抗体样结合蛋白和可用于检测生物样品中的靶抗原水平的其它试剂。所述试剂可包括可检测标记、封闭血清、阳性和阴性对照样品和检测试剂。
4.抗体样结合蛋白治疗组合物及其给予
包含抗体样结合蛋白的治疗或药物组合物属于本发明的范围。所述治疗或药物组合物可包含与药学上或生理上可接受的调制剂(formulation agent)相混合的治疗有效量的抗体样结合蛋白或抗体样结合蛋白-药物缀合物,所述调制剂选择以与给予方式相适应。
可接受的制剂材料优选在所用剂量和浓度下对接受者是无毒的。
药物组合物可含有用于改进、维持或保持例如组合物的pH、摩尔渗透压浓度、粘度、透明度、颜色、等渗性、气味、无菌度、稳定性、溶出或释放速率、吸附或穿透的制剂材料。合适的制剂材料包括但不限于氨基酸(例如甘氨酸、谷氨酰胺、天冬酰胺、精氨酸或赖氨酸)、抗微生物剂、抗氧化剂(例如抗坏血酸、亚硫酸钠或亚硫酸氢钠)、缓冲剂(例如硼酸盐、碳酸氢盐、Tris-HCl、柠檬酸盐、磷酸盐或其它有机酸)、填充剂(例如甘露糖醇或甘氨酸)、螯合剂(例如乙二胺四乙酸(EDTA))、络合剂(例如咖啡因、聚乙烯吡咯烷酮、β-环糊精或羟丙基-β-环糊精)、填料、单糖、双糖和其它碳水化合物(例如葡萄糖、甘露糖或糊精)、蛋白质(例如血清白蛋白、明胶或免疫球蛋白)、着色剂、矫味剂和稀释剂、乳化剂、亲水聚合物(例如聚乙烯吡咯烷酮)、低分子量多肽、成盐平衡离子(例如钠)、防腐剂(例如苯扎氯铵、苯甲酸、水杨酸、硫柳汞、苯乙醇、对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、氯己定、山梨酸或过氧化氢)、溶剂(例如甘油、丙二醇或聚乙二醇)、糖醇(例如甘露糖醇或山梨糖醇)、助悬剂、表面活性剂或润湿剂(例如pluronics、PEG、山梨坦酯、聚山梨醇酯例如聚山梨醇酯20或聚山梨醇酯80、triton、氨丁三醇、卵磷脂、胆固醇或四丁酚醛)、稳定增强剂(例如蔗糖或山梨糖醇)、张度增强剂(例如碱金属卤化物(优选氯化钠或氯化钾)或甘露糖醇、山梨糖醇)、递送载体、稀释剂、赋形剂和/或药用辅料(参见例如Remington's Pharmaceutical Sciences(第18版,A.R.Gennaro主编,Mack Publishing Company 1990)和所述文献的后续版本,通过引用与本文结合用于任何目的)。
根据例如预期的给药途径、递送形式和所需剂量,技术人员可确定最适药物组合物。所述组合物可影响抗体样结合蛋白的物理状态、稳定性、体内释放速率和体内清除速率。
药物组合物中主要的溶媒或载体在性质上可以是水性的或非水的。例如,合适的注射用溶媒或载体可以是水、生理盐水溶液或人工脑脊液,可能补充了用于胃肠外给药的组合物中常见的其它物质。中性缓冲的盐水或与血清白蛋白混合的盐水是其它示例性溶媒。其它示例性的药物组合物包含约pH 7.0-8.5的Tris缓冲液,或约pH 4.0-5.5的乙酸盐缓冲液,其还可包括山梨糖醇或合适的代替物。在本发明的一个实施方案中,可通过将所选的具有所需纯度的组合物与任选的调制剂混合,来制备呈冻干饼或水溶液形式的抗体样结合蛋白组合物。另外,可使用合适的赋形剂(例如蔗糖),将抗体样结合蛋白制成冻干物。
本发明的药物组合物可选择用于胃肠外递送。或者,组合物可选择用于吸入或用于通过消化道递送,例如口服。这类药学上可接受的组合物的制备属于本领域的技术范围内。
制剂组分以给药位点可接受的浓度存在。例如,使用缓冲剂使组合物保持在生理pH下或在略微较低的pH下,通常在约5-约8的pH范围内。
当考虑胃肠外给药时,用于本发明的治疗组合物可呈无热原、胃肠外可接受的水溶液形式,其包含在药学上可接受的溶媒中的所需抗体样结合蛋白。用于胃肠外注射的特别合适的溶媒是无菌蒸馏水,其中抗体样结合蛋白被配成为适当防腐的无菌等渗溶液。又一种制备物可包括所需分子与作用剂的制剂,所述作用剂例如可注射微球、生物可侵蚀粒子、聚合物(例如聚乳酸或聚乙醇酸)、珠粒或脂质体,其提供产品的控释或缓释,然后产品通过长效注射剂递送。还可使用透明质酸,这可具有延长在循环中的持续时间的作用。用于引入所需分子的其它合适方法包括可植入药物递送装置。
在一个实施方案中,药物组合物可配制成用于吸入。例如,抗体样结合蛋白可配制成干粉剂用于吸入。抗体样结合蛋白吸入溶液剂还可与抛射剂一起配制用于气雾剂递送。在又一个实施方案中,可使溶液剂成雾状。
还要考虑可口服给予的某些制剂。在本发明的一个实施方案中,以这种方式给予的抗体样结合蛋白可与或不与常用于固体剂型(例如片剂和胶囊剂)混配的那些载体一起配制。例如,胶囊剂可设计成在胃肠道某点上释放制剂的活性部分,此时生物利用度被最大化且内吸收前降解被最小化。可包括其它作用剂以促进抗体样结合蛋白的吸收。还可使用稀释剂、矫味剂、低熔点蜡、植物油、润滑剂、助悬剂、片剂崩解剂和粘合剂。
另一种药物组合物可包括与适于制造片剂的无毒赋形剂混合的有效量的抗体样结合蛋白。可通过将片剂溶于无菌水或另一种合适的溶媒来制备呈单位剂型的溶液剂。合适的赋形剂包括但不限于惰性稀释剂,例如碳酸钙、碳酸钠或碳酸氢钠、乳糖或磷酸钙;或结合剂,例如淀粉、明胶或阿拉伯胶;或润滑剂例如硬脂酸镁、硬脂酸或滑石粉。
本发明的其它药物组合物对本领域技术人员而言将是显然的,包括这样的制剂,其包括呈缓释或控释剂型的抗体样结合蛋白。用于配制各种其它缓释或控释方法的技术,例如脂质体载体、生物可蚀解微粒或多孔珠粒和长效注射剂,也为本领域技术人员所知。缓释制剂的其它实例包括呈成型制品形式的半渗透聚合物基质,例如膜剂或微囊剂。缓释基质可包括聚酯、水凝胶、聚交酯、L-谷氨酸和γ乙基-L-谷氨酸的共聚物、聚(2-羟乙基-甲基丙烯酸酯)、乙烯乙酸乙烯酯或聚-D(-)-3-羟基丁酸。缓释组合物还可包括脂质体,其可通过本领域已知的几种方法中的任一种制备。
用于体内给药的本发明的药物组合物通常必须无菌。这可通过经由无菌滤膜过滤实现。在组合物是冻干的时,采用该方法的灭菌可在冻干和复溶之前或之后进行。用于胃肠外给药的组合物可以冻干形式或在溶液中保存。另外,将胃肠外组合物一般装入具有无菌接口的容器中,例如静脉内溶液袋或小瓶,其具有可通过皮下注射针穿入的瓶塞。
一旦药物组合物制成,便可将其作为溶液剂、混悬剂、凝胶剂、乳剂、固体或作为脱水或冻干粉剂保存在无菌小瓶中。这类制剂可以即用形式或以在给药前需要复溶的形式(例如冻干)储存。
本发明还包括用于产生单剂量给药单位的试剂盒。试剂盒可各含有具有干的蛋白质的第一容器和具有含水制剂的第二容器。含有单室和多室预载药注射器(例如液体注射器和lyosyringes)的试剂盒亦包括在本发明的范围内。
待治疗性应用的抗体样结合蛋白药物组合物的有效量将取决于例如治疗背景和目的。本领域的技术人员应了解,用于治疗的合适剂量水平将因此部分随所递送的分子、使用抗体样结合蛋白所针对的适应症、给药途径和患者尺寸(体重、体表面或器官大小)和一般状况(年龄和一般健康状况)而变化。因此,临床医师可确定(titer)剂量和修改给药途径以获得最佳治疗效果。典型剂量的范围可为约0.1μg/kg至多达约100mg/kg或更高,这取决于上述因素。在其它实施方案中,剂量范围可为0.1μg/kg直到约100mg/kg;或1μg/kg直到100mg/kg;或5μg/kg、10μg/kg、15μg/kg、20μg/kg、25μg/kg、30μg/kg、35μg/kg、40μg/kg、45μg/kg、50μg/kg、55μg/kg、60μg/kg、65μg/kg、70μg/kg、75μg/kg直到约100mg/kg。
给药频率将取决于待使用制剂中的抗体样结合蛋白的药代动力学参数。通常,临床医师将给予组合物直到达到获得所需作用的剂量。组合物因此可如下给予:作为单次剂量、随时间推移作为两次或更多次剂量(其可含或不含相同量的所需分子)或作为通过植入装置或导管的连续输注。适当剂量的进一步改进按常规由本领域普通技术人员进行,并属于他们常规进行的任务的范围内。合适的剂量可通过利用合适的剂量反应数据来确定。
药物组合物的给药途径遵循已知方法,例如口服;通过经由静脉内、腹膜内、大脑内(实质内)、脑室内、肌内、眼内、动脉内、门静脉内或病灶内途径的注射;通过缓释系统或通过植入装置。需要时,组合物通过推注或通过连续输注或通过植入装置给予。
还可通过植入其中已吸附或包封所需分子的膜、海绵或其它合适的材料,局部给予组合物。在使用植入装置时,可将装置植入任何合适的组织或器官中,并且所需分子的递送可以是通过扩散、定时释放推注或连续给予。
5.实施例
接下来的实施例是说明性的本发明的具体实施方案及其各种用途。其仅为解释目的而提供,不应解释为以任何方式限制本发明的范围。
实施例1.双特异性交换双重可变区抗体样结合蛋白的设计和工程改造
Fv形式的交换双重可变区描述于美国专利号5,989,830,并称为交换双头(CODH)构型。分子建模预测,交换双头(CODH)设计导致具有以相对方向面对的两个结合位点的复合物,其没有双重Fv构型所提示的约束。检查CODH Fv形式以确定它是否可通过将CL结构域加入轻链中并将Fc区加入重链中而转化成完整抗体样分子。对于相应的双重可变结构域(DVD-Ig)和TBTI,类似的转化是成功的,如美国专利号7,612,181和国际公布号WO2009/052081中所描述。以下结构中显示了CODH形式中可变区的排列,其指示肽链的氨基至羧基取向:
(a)轻链:NH2-VL1-接头-VL2-COOH
(b)重链:NH2-VH2-接头-VH1-COOH
上述(a)和(b)中可变区的氨基至羧基端排列可与以下(c)和(d)所示双重Fv构型中的排列区别开来:
(c)轻链:NH2-VL1-接头-VL2-COOH
(d)重链:NH2-VH1-接头-VH2-COOH
要注意的主要差别是在两个双重可变区构型中相对于彼此的相应轻链和重链可变区的不同安置(VH1/VL1和VH2/VL2)。在双重可变区构型中,相应的VL1和VH1结构域两者均位于轻链和重链的N端。相比之下,在交换构型中,在交换构型的蛋白质链内,一对抗体可变区的一半在空间上被分隔。在交换构型中,VL1结构域可位于蛋白质轻链的N端,但配对的VH1结构域位于交换构型重链的C端。存在于双重可变区构型中的VL1和VH1之间的空间关系是存在于天然抗体中的排列。
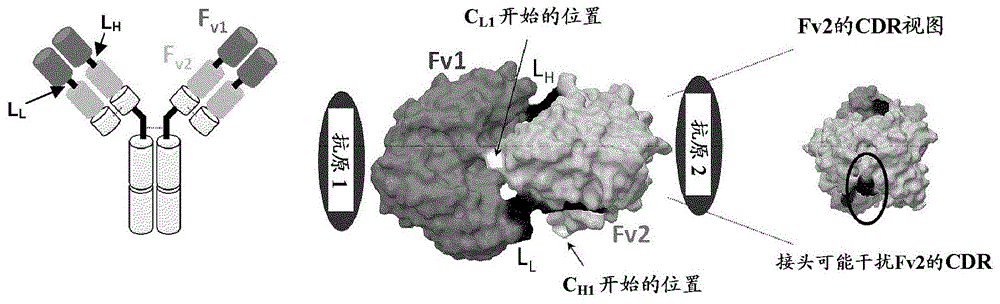
双重Fv构型的一个潜在缺点是分隔2个可变区的接头LL突出到Fv2结构域的抗原结合位点(参见图1)。这种突出可能干扰抗原结合,并导致抗原2对Fv2的可及性受扰。这种受扰的可及性或干扰可阻止抗原结合。另外,在抗原2尺寸较大时,这种干扰可能更显著。实际上,在美国专利号7,612,181中已证明,DVD-Ig分子的结合亲和力和中和能力取决于哪个抗原特异性存在于N端还是C端。参见美国专利号7,612,181,实施例2。
因此,为产生与亲代抗体相比更稳定的不遭受抗原亲和力损失的抗体样结合蛋白,设计和构建了轻链上具有CL结构域和重链上具有Fc区的交换双重可变区分子。形成这些抗体样蛋白的多肽具有以下所示结构,其中指示多肽链的氨基至羧基端取向:
(e)轻链:NH2-VL1-接头-VL2-CL-COOH
(f)重链:NH2-VH2-接头-VH1-CH1-Fc-COOH
为了评价这种双特异性抗体样蛋白设计是否可与两种不同的抗原结合,使用两种来自对IL4(亲代人源化抗IL4)和IL13(亲代人源化抗IL13)有特异性的抗体的之前产生的人源化可变区,来构建表1所示双特异性抗体样分子。小鼠抗体的测序和人源化方法描述于国际公布号WO 2009/052081(TBTI)。简单地说,鼠抗IL13克隆B-B13和鼠抗IL4克隆8D4-8的可变重链和轻链的氨基酸序列通过氨基酸测序测定。使鼠序列人源化,然后反向翻译成国际公布号WO 2009/052081的实施例5中描述的核苷酸序列,所述国际公布号通过引用以其整体结合到本文。如表1所示将亲代人源化抗IL4VH和VL及亲代人源化抗IL13VH和VL序列组合和排列。创建表1第一栏中的简写代码以简化这些抗体样结合蛋白的阐述。如表1所示,抗体样结合蛋白在插入2个可变区间的接头大小上不同。自反向翻译的亲代抗IL4和抗IL13抗体产生编码表1所示多肽的DNA分子。CH1、CL和Fc结构域获自IGHG1(GenBank登录号569F4)和IGKC(GenBank登录号Q502W4)。
表1.交换双头免疫球蛋白
表2所示蛋白质组合通过瞬时转染表达,并通过蛋白A色谱法纯化。在每种情况下,分子排阻色谱法显示小于12%聚集,大部分小于7%聚集;但未发现交换双头免疫球蛋白显示任何与IL4或IL13结合的能力。然而,未能检出功能性抗体样结合,并且无法确定这种缺乏活性的原因。之前预测,这种排列将显示优异的稳定性,其超过了描述于美国专利号7,612,181和国际公布号WO 2009/052081的双重可变区结构域抗体。
表2.CODH-Ig与IL4和IL13的结合
*ND意指未检出
实施例2.通过分子建模设计CODV-Ig蛋白
为了利用可改良以掺入Fc和CL1结构域的交换双头构型来获得完全功能性抗体样蛋白,开发出用于加入和评价重链和轻链两者上的恒定和可变结构域之间和双重可变结构域之间不同接头的分子建模方案。问题是在重链和轻链两者上的各恒定/可变结构域界面之间和2个可变/可变结构域界面之间加入独特接头是否可允许在交换双重可变区构型中发生合适的蛋白质折叠,并产生功能性抗体样分子(参见图2)。换句话说,对总共4个独立和独特的接头进行了评价(参见图2)。该分子建模方案分别基于FvIL4和FvIL13区的同源性模型和实验模型的蛋白质-蛋白质对接,其与在FvIL4和FvIL13区之间和在Fv和恒定区或Fc区之间的合适接头组合。
如下指定独立接头的独特名称:L1是指轻链上的N端VL和C端VL之间的接头;L2是指轻链上的C端VL和CL之间的接头;L3是指重链上的N端VH和C端VH之间的接头;L4是指重链上的C端VH和CH1(和Fc)之间的接头。应注意的是标识VH和VL仅是指最终形式的特定蛋白质链上的结构域的位置。例如,VH1和VH2可来源于亲本抗体的VL1和VL2结构域,并置于CODV-Ig中的VH1和VH2位置上。同样地,VL1和VL2可来源于亲本抗体的VH1和VH2结构域,并置于CODV-Ig中的VH1和VH2位置上。因此,VH和VL标识是指现在的位置,而非亲本抗体中的原始位置。
更详细地,FvIL4的同源性模型在PDB条目1YLD(轻链)和1IQW(重链)上构建。FvIL4二聚体在IL13/抗IL13FabIL13复合物的内部晶体结构上再次组成并优化。为了获得当与FvIL4结合时IL4所需要的体积的估算值,使IL4(1RCB.pdb)的晶体结构对接至FvIL4的同源性模型。接下来,产生值得进一步考虑的复合物的22个推定模型。
平行地,使FvIL4的同源性模型对接至由IL13/FabIL13复合物的内部晶体结构选取的FvIL13。发现一种良好的解答,其允许构建相对短的接头,同时不显示如双重可变区免疫球蛋白中的情况一样对抗原结合和安排恒定结构域的空间干扰(参见图3)。在这种排列中,FvIL4(VL1)被置于轻链的N端,接着是轻链C端上的FvIL13(VL2)和Fc(CL1)。在重链上,FvIL13(VH2)被置于N端,接着是FvIL4(VH1)和恒定区(CH1-CH2-CH3)。
如表3所示,轻链的模型提议VL1和VL2结构域之间的接头L1及VL2和CL1结构域之间的接头L2应分别为1-3个之间和0-2个之间的甘氨酸残基长。重链的模型提议VH2和VH1结构域之间的接头L3及VH1和CH1结构域之间的接头L4应分别为2-6个之间和2-7个之间的甘氨酸残基长(参见表3和图2)。在该实施例中,甘氨酸用作接头的原型氨基酸,但其它氨基酸残基也可用作接头。所提议的模型的结构稳定性通过接头构象、最小化和分子动力学计算的优化来验证。4个轻链和6个重链构建体的系统组合导致24个可能的交换双重可变区双特异性抗IL4和抗IL13抗体样结合蛋白(参见表4)。
表3.提议的接头长度
表4.用于表达的CODV-Ig
*设计简写代码以表示相关结构。以HC开始的代码表示相邻的重链,以LC开始的代码表示相邻的轻链。
表4中,前缀“抗”未包括在内,但旨在意指IL13是指抗IL13,IL4是指抗IL4。
实施例3.CODV-Ig表达质粒的产生
编码表4中描述的6个重链和4个轻链的可变重链和轻链的核酸分子通过Geneart(Regensburg,Germany)的基因合成而产生。可变轻链结构域通过以下与恒定轻链融合(IGKC,GenBank登录号Q502W4):用限制性内切核酸酶ApaLI和BsiWI消化,随后连接至附加型表达载体pFF(一种由Durocher等人(2002,Nucl.Acids Res.30(2):E9)描述的pTT载体的类似物(analogon))的ApaLI/BsiWI位点,产生用于轻链表达的哺乳动物表达质粒。
使可变重链结构域与人恒定重链(IGHG1,GenBank登录号569F4)的“Ted”变体融合,或者,与来自人恒定IGHG1的带6x His标签的CH1结构域融合,以产生双特异性Fab。接下来,VH结构域用限制性内切核酸酶ApaLI和ApaI消化,然后通过连接至附加型表达载体pFF的ApaLI/ApaI位点,分别与IGHG1或带His标签的CH1结构域融合,产生用于重链表达(分别为IgG1或Fab)的哺乳动物表达质粒。
实施例4.CODV-Ig的表达
使编码相应构建体的重链和轻链的表达质粒在大肠杆菌(E.coli)DH5a细胞中增殖。使用Qiagen EndoFree Plasmid Mega试剂盒,从大肠杆菌制备用于转染的质粒。
按照生产商所述使用293fectin(Invitrogen)转染试剂,将生长在Freestyle培养基(Invitrogen)中的HEK 293-FS细胞用所指示的编码表4中所示重链和轻链的LC和HC质粒转染。7天后,通过离心除去细胞,使上清液通过0.22μm过滤器以除去颗粒。
CODV-IgG1构建体通过蛋白A柱(HiTrap Protein A HP柱,GE Life Sciences)上的亲和色谱法纯化。在用100mM乙酸盐缓冲液和100mM NaCl(pH 3.5)从柱中洗脱后,使用HiPrep 26/10脱盐柱使CODV-IgG1构建体脱盐,以1mg/mL的浓度在PBS中配制,并使用0.22μm膜过滤。
双特异性CODV Fab构建体在HiTrap IMAC HP柱(GE Life Sciences)上通过IMAC纯化。用线性梯度(洗脱缓冲液:20mM磷酸钠,0.5M NaCl,50-500mM咪唑,pH 7.4)从柱中洗脱后,合并含蛋白质的流分,并使用HiPrep 26/10脱盐柱脱盐,以1mg/mL的浓度在PBS中配制,并使用0.22μm膜过滤。
通过测量280nm处的吸光度,来测定蛋白质浓度。在还原和非还原条件下,通过SDS-PAGE对每批进行分析,以测定各亚基和单体的纯度和分子量。
Nunc F96-MaxiSorp-Immuno板用山羊抗人IgG(Fc特异性)[NatuTec A80-104A]包被。在碳酸盐包被缓冲液(50mM碳酸钠,pH 9.6)中将抗体稀释至10μg/ml,并以50μL/孔分装。板用胶带密封,在4℃下保存过夜。板用洗涤缓冲液(PBS,pH 7.4和0.1%Tween20)洗涤3次。将150μL封闭溶液(1%BSA/PBS)分装在各孔中以覆盖板。在室温下1小时后,板用洗涤缓冲液洗涤3次。加入100μL样品或标准品(1500ng/ml-120ng/ml的范围),允许在室温下静置1小时。板用洗涤缓冲液洗涤3次。使用温育溶液(0.1%BSA,PBS,pH 7.4和0.05%Tween20),加入1:10.000稀释的100μL山羊抗人IgG-FC-HRP缀合物[NatuTec A80-104P-60]。在室温下温育1小时后,板用洗涤缓冲液洗涤3次。100μL ABTS底物(含10mg ABTS片(Pierce 34026)的0.1M Na2HPO4、0.05M柠檬酸溶液(pH 5.0)。使用前加入10μL30%H2O2/10ml的底物缓冲液,使其分装至各孔,使之显色。显色后(约10-15分钟),加入50μL 1%SDS溶液终止反应。在A405处读板。
实施例5.CODV-Ig变体的表征
为了确定CODV-Ig抗体样蛋白重链和轻链是否正确地配对并折叠,通过分析型分子排阻色谱(SEC)测量聚集水平。采用配备有TSKgel G3000SWXL柱(7.8mm x 30cm)和TSKgel SWXL保护柱(Tosoh Bioscience)的探测器10(GE Healthcare),对装配的各对进行分析型SEC。分析使用250mM NaCl、100mM磷酸钠(pH 6.7)以1ml/分钟运行,在280nm处检测。将30μL蛋白质样品(以0.5-1mg/ml)施加到柱中。为了估算分子大小,使用凝胶过滤标准混合物(MWGF-1000,SIGMA Aldrich)给柱定标。数据评价应用UNICORN软件v5.11进行。
表5显示使用表4所述抗IL4和抗IL13可变区组合得到的第一组24种不同的CODV-Ig分子的结果。表4中指定的代码表示表4所示的相邻结构。对于其中产生蛋白质的轻链和重链对,使用SEC测量聚集水平。结果见表5,其中在与全部6个重链的配对中LC4(L1=1;L2=2)最为成功。LC4对应于具有接头等于1的L1的结构IL4 VL-(Gly)-IL13 VL-(Gly2)-CL1,其中单个氨基酸残基将双重可变区轻链的两个VL结构域分隔开。另外,LC4具有等于2的L2,其含有在中心VL和C端CH1之间的Gly-Gly二肽接头。
表5.重链和轻链对中的聚集水平
*ND表明无蛋白质产生
其中产生了CODV-Ig分子,在中间IL13和IL4浓度下,进行了单一浓度BIACORE实验以验证与靶抗原的结合。选择相当于表4所述LC4:HC4和LC4:HC6组合的CODV-Ig抗体样分子以应用表面等离振子共振来评价完全动力学分析。
如表5所述,大部分的CODV-Ig分子根本不产生或仅作为聚集体(高达90%)产生。在一次色谱步骤后,产生可接受的聚集水平(5-10%)的重链/轻链组合是与轻链IL4VL-(Gly)-IL13VL-(Gly2)-CL1组合的情况。该轻链是这些CODV-Ig变体内最苛求的链,并被用作接受不同重链与不同接头组成的平台。
1.动力学分析
选择两个重链和轻链对用于完全动力学分析。重组人IL13和IL4购自Chemicon(USA)。纯化抗体的动力学表征采用表面等离振子共振技术在BIACORE 3000(GE Healthcare)上进行。采用俘获测定法,该方法使用物种特异性抗体(例如人-Fc特异性MAB 1302,Chemicon)用于所研究抗体的俘获和定位。采用标准方法,使俘获抗体通过伯胺基(11000RU)固定在研究级CM5芯片(GE Life Sciences)上。以可导致30RU的最大分析物结合的调节的RU值,按10μL/分钟的流速俘获所分析的抗体。在HBS EP(10mM HEPES(pH 7.4)、150mM NaCl、3mM EDTA和0.005%表面活性剂P20)中的0-25nM间的浓度范围内以30μl/分钟的流速,针对重组人IL4和IL13测量结合动力学。芯片表面用10mM甘氨酸(pH 2.5)再生。使用无俘获抗体的流动池作为参比,用BIA评价程序包v4.1分析并计算动力学参数。
下表6显示亲代BB13(抗IL13)和8D4(抗IL4)抗体(作为IgG表达)与CODV-Ig形式内相对应的结构域(表4,代码LC4:HC4和LC4:HC6)的动力学的比较。如表6所示,当与亲代抗IL13和抗IL4抗体比较时,CODV-Ig构建体不显示针对相应抗原的结合性质降低。使用相同Fv序列,用CODV-Ig构型不发生在DVD-Ig/TBTI形式中观察到的结合速率损失。相对的面对结合位点将允许用双特异性抗体样构型结合大的抗原或桥接不同的细胞,并且还适于更宽泛的亲代抗体选择。CODV-Ig的其它优势是无接头残基突出到抗原结合位点和降低抗原的可及性。
表6.LC4:HC4和LC4:HC6的动力学分析
2.共注入IL4和IL13以证实由CODV-Ig所致加性抗原结合
为了研究两种抗原的加性结合,应用向导驱动型共注入方法(wizard-driven co-inject method),其中注入一种抗原,紧接着在延迟时间后注入另一种抗原(IL4,然后IL13,反之亦然)。可将所得结合水平与用相同浓度下两种抗原的1:1混合物所实现的水平相比较。为了显示由CODV-Ig分子所致IL4和IL13抗原两者的加性结合,在3个单独的分析周期中,通过共注入两种抗原,用CODV-Ig组合[HC4:LC4]进行BIACORE实验(参见图4)。用3.125nM IL4/25nM IL13(和反之亦然)和用3.125nM IL4和25nM IL13的1:1混合物进行了共注入。进行HBS-EP缓冲液的共注入作为参比。在800秒钟的时间点,不论共注入顺序如何,在抗原混合物注入或抗原共注入后,达到63RU的相同结合水平。当CODV-Ig蛋白被第一抗原(IL4)饱和时,注入第二抗原(IL13),观察到第二结合信号。当抗原注入顺序颠倒时,这种观察结果得到重现。这就表明两种抗原由CODV-Ig所致结合是加性的,并非抑制。因此,CODV-Ig构建体能够同时与两种抗原结合(即显示双特异性),使全部结合位点饱和(即显示四价)。
实施例6.用于CODV-Ig的接头长度容限
通过构建对于轻链上的L1、L2及重链上的L3和L4具有不同组合的接头长度的CODV-Ig分子,来评价各种长度的接头容限。产生具有重链接头L3和L4的CODV-Ig构建体,对于L3在1-8个残基间变化,对于L4为0或1个残基。重链含有作为N端结合结构域的抗IL4和作为C端结合结构域的抗IL13,接着是CH1-Fc。轻链接头L1和L2对于L1自3到12个残基变化,对于L2自3到14个残基变化。轻链含有作为N端结合结构域的抗IL13和作为C端结合结构域的抗IL4,接着是CL1。
1.CODV-Ig变体的表征
聚集水平的测定通过分析型分子排阻色谱(SEC)进行。采用配备有TSKgel G3000SWXL柱(7.8mm x 30cm)和TSKgel SWXL保护柱(Tosoh Bioscience)的探测器10(GE Healthcare),进行分析型SEC。分析使用250mM NaCl、100mM磷酸钠(pH 6.7)以1ml/分钟运行,在280nm处检测。将30μL蛋白质样品(以0.5-1mg/ml)施加到柱中。为了估算分子大小,使用凝胶过滤标准混合物(MWGF-1000,SIGMA Aldrich)给柱定标。数据评价应用UNICORN软件v5.11进行。
重组人IL13和IL4购自Chemicon(USA)。重组人TNF-α购自Sigma Aldrich(H8916-10μg),重组人IL-1β(201-LB/CF)、重组人IL-23(1290-IL/CF)、重组人EGFR(344ER)和重组人HER2(1129-ER-50)购自R&D Systems。
如下通过Biacore进行动力学结合分析。采用Biacore 3000(GE Healthcare)上的表面等离振子共振技术用于纯化抗体的详细动力学表征。采用俘获测定法,该方法使用物种特异性抗体(例如人-Fc特异性MAB 1302,Chemicon)用于所研究抗体的俘获和定位。为了测定IL4和IL13结合动力学,使用抗人Fab俘获试剂盒(GE Healthcare),俘获如实施例10、表12中的相应CODV Fab。采用标准方法,使俘获抗体通过伯胺基(11000RU)固定在研究级CM5芯片(GE Life Sciences)上。以可导致30RU的最大分析物结合的调节的RU值,按10μL/分钟的流速俘获所分析的抗体。在HBS EP(10mM HEPES pH 7.4、150mM NaCl、3mM EDTA、0.005%表面活性剂P20)中的0-25nM间的浓度范围内以30μl/分钟的流速,针对重组人IL4和IL13测量结合动力学。芯片表面用10mM甘氨酸(pH 2.5)再生。使用无俘获抗体的流动池作为参比,用BIA评价程序包v4.1分析并计算动力学参数。
使用Proteon XPR36蛋白质相互作用阵列系统(Biorad),测量CODV-Ig、CODV-Fab和TBTI针对EGFR和HER2的结合亲和力。使抗原通过胺反应性偶联固定在GLC传感器芯片(Biorad)上。以具有双重参比的单触发动力学模式(one-shot kinetics mode),平行地对双特异性抗体变体在PBSET缓冲液(Biorad)中的稀释系列进行分析。应用具有带传质(mass transfer)的Langmuir 1:1模型或二价分析物模型的Proteon Manager软件v3.0(Biorad),对数据进行了分析。
表7概括了具有不同大小组合的接头的CODV-Ig的产量、聚集(通过分子排阻色谱法测量)和结合亲和力的结果。结果显示,一般无法产生其中L2为零的CODV-Ig分子,或如果蛋白质产生,则有高水平的聚集(参见表7中的批次标识号101、102、106-111和132-137)。因此,与实施例2的分子建模预测(其中L2等于零在可接受的范围内)不同,这些结果表明,VL2-CL转换(或L2)需要至少一个残基的接头(参见表7)。
表7.CODV-Ig的接头大小的优化
*重链上的排列必需为IL13VH-L3-IL4VH-L4-CH1-Fc
1n.p.意指构建体不可产生。
另外,发现上述CODV-Ig接头长度增加1个氨基酸残基比增加2个氨基酸残基更敏感。例如,虽然批次标识号103和104在L2中以1个氨基酸残基之差而不同,但批次标识号103显示6倍以上的聚集,批次标识号104显示较少聚集和两倍的产量。相比之下,批次标识号104和105,其在L2中以2个残基差而不同,就产量、聚集和结合而论,显示类似特征。
实施例7.用于CODV-Ig的作为模板链的重链
在实施例1-5中,轻链上的最适的短接头大小提示,该轻链通过保持线性排列而用作模板,在重链上需要较大的接头以使重链正确折叠成交换构型以便与模板轻链一致(参见图5,图A)。接下来对以下方面进行了评价:特别置于重链上以保持重链上的线性排列的短接头是否赋予重链“模板”链,以及该模式本身是否重复和是否需要较大接头以使非模板链正确折叠并适应现有的模板重链(参见图5,图B)。
图6说明基于以轻链或重链作为“模板”的这些CODV-Ig设计原理。为了评价该概念的一般性质,用重链接头L3和L4产生CODV-Ig构建体,对于L3在1-8个残基之间改变,对于L4为0或1个残基。重链含有作为N端结合结构域的抗IL4和作为C端结合结构域的抗IL13,接着是CH1-Fc。轻链接头L1和L2对于L1自3到12个残基变化,对于L2自3到14个残基变化。轻链含有作为N端结合结构域的抗IL13和作为C端结合结构域的抗IL4,接着是CL1。
表8概括了具有不同大小组合的接头的CODV-Ig的产量、聚集(通过分子排阻色谱法测量)和结合亲和力的结果,在所述CODV-Ig中重链保持为线性排列作为模板链并允许轻链以交换构型折叠。结果显示,一般不能产生其中L4为零的CODV-Ig分子,或如果蛋白质产生,则有高水平的聚集(类似于其中L2等于零的分子)(参见表8中的批次标识号207-209、211-212、219-224、231-236、243-252和263-266)。一个例外是批次标识号210,其中L1为7,L2为5,L3为2,L4为零。这种排列产生足量的蛋白质,并具有可接受水平的聚集和结合,这就表明,可以存在在某些情况下接头大小的一些组合补偿L4上的零长度接头。
表8.以重链作为模板的接头大小的优化
*轻链上的排列必需为IL13VL-L1-IL4VL-L2-CL1
表7和表8的结果明确表明,在可变和恒定结构域之间需要接头以供最佳折叠。仅在罕见排列中容许接头等于零(参见批次标识号103-105,其中L1(LC)为零,及批次标识号210,其中L4为零)。然而,在每种情况下,另一链上的可变区和恒定区之间相应的转换接头不能为零。
上述结果表明组合L1=7、L2=5、L3=1和L4=2是用于优化其中重链是模板的新的CODV-Ig的良好起点。表9中的范围表明是用于从2个亲本抗体成功改造新的CODV-Ig的合理范围。
表9.LC或HC任一个作为模板的接头大小的范围
实施例8.CODV-Ig形式的通用实用性
为了评价CODV-Ig形式对于工程改造新的抗体样结合蛋白的适合性,将来自对以下具有特异性的多个现有人和人源化抗体的可变区掺入CODV-Ig形式中:胰岛素样生长因子1受体(IGF1R(1))、胰岛素样生长因子1受体(IGF1R(2))的第二抗体、人表皮生长因子受体2(HER2)、表皮生长因子受体(EGFR)、肿瘤坏死因子-α(TNFα)、白介素12和23(IL-12/23)和白介素1β(IL-1β)(参见表10)。
表10.用于双特异性CODV-Ig的重链和轻链的描述性代码
*将简写代码设计成代表相关结构。以HC开始的代码表示相邻的重链,以LC开始的代码表示相邻的轻链。
在设计双特异性抗体样结合蛋白时,使用来自已知的人和人源化抗体的抗体可变区测试CODV-Ig形式的通用实用性。另外,调查了有关重链或轻链上N端或C端的某些抗体可变区的位置的位置效应的可能性。根据具有L1=7、L2=5、L3=1和L4=2的接头组成的CODV-Ig分子的设计,将不同的抗体序列引入CODV-Ig形式中。
通过使用市售HEK-Blue TNFα/IL1β报道细胞(InvivoGen),测定了双特异性抗体或衍生物针对IL1β和TNFα的活性。为了测定针对TNFα和IL1β的抗体活性,使细胞因子与不同浓度的抗体预温育1小时,并加入到50,000HEK Blue TNFα/IL1β细胞中。用QU抗Blue测定法(InvivoGen),在培养上清液中24小时后,测量细胞因子介导的SEAP诱导。
如表11所示,所有构建体显示良好到优秀的蛋白质产量和可接受的聚集水平(具体参见表11中的批次标识号301和302)。针对各抗体可变结构域测量的亲和力在已发表和预期的亲和力内。在评价亲和力的情况下,未检测到位置效应。总的来说,如下表所示,在所用的任何抗体可变结构域或在任一抗体链上使用这些结构域的情况下,均未发现位置效应。
表11.双特异性抗体样结合蛋白的CODV-Ig形式的普遍应用
实施例9.CODV-Ig形式中亲代抗体亲和力的保持
将抗IL4和抗IL13的相同抗体序列掺入TBTI/DVD-Ig或CODV-Ig形式中用于这些构型、接头位置和所得分子亲和力的直接比较。如图7所示,在CODV形式中保持每种抗体的亲代亲和力。如图7的上图所示,当可变区以TBTI/DVD-Ig形式放置时,位于内部Fv2位置上的IL4抗体的亲和力下降表现为抗体结合与抗原的结合速率降低。相比之下,CODV-Ig形式的亲和力与亲代抗体相比无损失(参见图7的下图)。
实施例10.CODV-Ig对Fab形式的适应性
接下来,对CODV-Ig形式提供片段(例如Fab片段)的能力进行评价。使两种不同的可变重链通过接头L3彼此融合并通过接头L4进行C端延长。然后使该VH复合物与IGHG1(GenBank登录号Q569F4)的CH1结构域融合,所述IGHG1带有来自铰链区的C端5个氨基酸序列DKTHT(SEQ ID NO:60)和接着的6个组氨酸残基。两种不同的可变轻链通过接头L1以相应重链的交换构型彼此融合,并通过接头L2进行C端延伸,随后与恒定κ链(IGKC,GenBank登录号Q502W4)融合。
Fab片段如前所述通过瞬时转染表达。转染后7天,通过离心除去细胞,加入10%vol/vol 1M Tris-HCl,pH 8.0,使上清液通过0.22μm过滤器除去颗粒。使用HisTrap High Performance柱(GE Healthcare)俘获Fab蛋白质,并通过咪唑梯度洗脱。合并含蛋白质的流分,并使用PD-10或Sephadex柱脱盐。调节浓缩和无菌过滤(0.22μm)的蛋白质溶液至1mg/ml,并保持在4℃下备用。
在CODV取向中的Fab样分子显示无聚集倾向并保持亲代抗体的亲和力的情况下观察到直接优势(参见表12)。来自批次标识号401-421的结合蛋白构建体直接与抗体样蛋白比较,在所述抗体样蛋白中抗体可变区按在以下中进行排列:以重链作为模板的CODV-Ig分子(401、402、406和407)、CODV Fab样片段(402、408、413、418和421)、TBTI/DVD-Ig形式的4种结构域抗体样分子(404、409、414和419)和无接头的CODV-Ig(405、410、415和420)。如表12所示,该比较的结果表明,当可变区掺入TBTI或DVD-Ig形式中时,与亲本抗体相比,亲和力更可能丧失。相比之下,CODV-Ig和CODV-Ig Fab样形式两者能够更好地保持亲代亲和力。结果还证实,CODV-Ig分子需要可变区之间及可变区和恒定结构域之间的接头(参见表12)。
表12.用于Fab样片段的CODV-Ig形式的应用
实施例11.CODV-Ig和CODV-Fab内可变结构域的取代
为了在T细胞接合方法(T-cell engaging approach)中表征CODV形式,产生具有TCR结合位点(CD3ε)和CD19结合位点的双特异性CODV Fab样结合蛋白(CODV-Fab),并与来源于TBTI/DVD-Ig形式的双特异性Fab(B-Fab)进行了比较。为了研究结合位点(TCR x CD19相对于CD19x TCR)的取向的重要性,针对各结合蛋白评价两种取向。
使用NALM-6(CD19表达)细胞作为靶细胞和原代人T细胞作为效应细胞,在细胞毒性测定法中对结合蛋白进行表征。CD3阳性细胞自新鲜制备的人PBMC中分离。效应细胞和靶细胞以10:1的比率混合,并与指定浓度的双特异性结合蛋白温育20小时(参见图8)。使用7-氨基放线菌素染色,在基于FACS的测定法中测定凋亡的靶细胞。
构型CD3-CD19的B-Fab形式(1060)显示出在诱导针对NALM-6细胞的T细胞介导的细胞毒性中有活性,其EC50为3.7ng/ml。对于CD19-CD3CODV-Fab(1109),观察到类似的高活性,其EC50为3.2ng/ml(参见图8)。
B-Fab分子(TBTI/DVD-Ig形式的Fab)的构型与CD19-CD3取向的交换导致活性显著丧失(参见图8)。交换的B-Fab分子显示,在对于CODV-Ig Fab的两种取向和B-Fab的其它取向是最大的浓度下无活性。对于CODV-Ig Fab和B-Fab的一种取向,观察到最大反应(范围介于1和100ng/ml之间)。对于B-Fab的CD19-CD3取向,甚至在最大浓度(30μg/ml)下,未达到最适毒性反应。形成鲜明对比的是,CODV-Fab中结构域取向朝向CD3-CD19的改变(1108),产生在该测定法中具有明显活性的分子(参见图8)。虽然CODV-Fab中的结构域交换还降低T细胞介导的细胞毒性的诱导(EC50增加达约100倍),但是这种作用远不如在B-Fab形式中所观察到的显著,且分子能够诱导细胞毒性直到最大水平。数据是代表性的,并获自3个独立实验。
实施例12.氨基酸序列特性对CODV-Ig接头的影响
选择对应于批次标识204的优化构建体(参见实施例7和表8)以研究接头组成对接头L1-L4的影响。分别设置L1、L2、L3和L4的接头长度为7、5、1和2个残基长(参见表13)。试验序列来源于天然抗体VH和CH1结构域之间或κ或λ轻链的抗体Fv和CL结构域之间转换处的天然存在的接头。候选序列为ASTKGPS(SEQ ID NO:48)(其来源于VH和CH1结构域转换)、RTVAAPS(SEQ ID NO:49)和GQPKAAP(SEQ ID NO:50)(其分别来源于κ和λ轻链的Fv和CL结构域转换)。而且,一个构建体用任意接头组成产生以显示任何序列均可用于接头L1-L4。该接头组成通过将以下氨基酸随机分布在4种接头的15个位置上而获得:缬氨酸、亮氨酸、异亮氨酸、丝氨酸、苏氨酸、赖氨酸、精氨酸、组氨酸、天冬氨酸、谷氨酸、天冬酰胺、谷氨酰胺、甘氨酸和脯氨酸。有意不包括芳香族氨基酸苯丙氨酸、酪氨酸和色氨酸以及氨基酸甲硫氨酸和半胱氨酸以避免聚集的潜在增加。
生成批次标识号204的构建体三维模型以确保适合性或完善接头组成的选择。因此,对于接头L3,选择丝氨酸作为带正电荷,并且在该三维模型附近观察到带负电荷的残基。选择接头L4中的残基与由模型提示的这些位置的溶剂暴露相容。类似地,对于L1和L2的接头组成,未预期或预测有问题。对于接头组成,构建了所选建议的三维模型。
如表12所示,接头组成可对产量有极大影响。来源于L1上的λ链的序列(将批次标识号505-507与批次标识号501-503比较)是更多产的蛋白质发生器(增加高达8倍)。实际上,基于随机产生的接头也产生良好产量,如表13批次标识号508所示。因此,接头组成应为在CODV-Ig优化期间所考虑的一个参数。
表13.接头组成对CODV-Ig的影响
在市售HEK-Blue IL-4/IL-13报道细胞(InvivoGen)中,测定了针对细胞因子IL4和IL13的双特异性抗体或衍生物的活性。HEK-Blue IL-4/IL-13细胞设计为监测由IL-4或IL13所致STAT6途径的活化。细胞用任一种细胞因子刺激导致报道基因分泌型胚期碱性磷酸酶(SEAP)的产生,其可在培养上清液中用QUANTI-Blue测定法测量。为了测试针对IL4或IL13的抗体活性,使细胞因子与不同浓度的抗体预温育1小时,并加入到50,000HEK-Blue IL-4/IL-13细胞中。用QUANTI-Blue测定法(InvivoGen),在细胞培养上清液中温育24小时后,测量细胞因子介导的SEAP诱导。
实施例13.将半胱氨酸引入CODV-Ig接头
已发表的数据表明,通过引入非天然二硫桥,可提高抗体和抗体来源的蛋白质的稳定性(参见Wozniak-Knopp等,2012,“Stabilisation of the Fc Fragment of Human IgG1by Engineered Intradomain Disulfide Bonds(通过工程改造的结构域内二硫键所致人IgG1的Fc片段的稳定),”PLoS ONE 7(1):e30083)。为了检查通过引入链间和链内二硫桥是否稳定来源于人IgG1抗体并经改造成CODV-Ig分子的等同Fc片段,使CODV-Ig构建体批次标识号204(来自实施例7)的等同Fc位置突变成半胱氨酸残基,使突变体蛋白质过量产生、纯化并进行表征(参见表14)。
如表14所示,含有额外的半胱氨酸残基的突变的CODV-Ig分子的每一个都具有与CODV-Ig构建体批次标识号204的解链温度相同的解链温度。
另外,按Brinkmann等人,1993,Proc.Natl.Acad.Sci.U.S.A.90:7538-42所述,在每个可变结构域的Kabat位置(轻链第100位和重链第44位)上引入两个同时存在的半胱氨酸。已表明这些位置在抗体折叠内是结构上保守的,因此可接受半胱氨酸取代而不干扰各结构域的完整性。
如表15所示,其中在各可变结构域的Kabat位置(轻链第100位和重链第44位)上引入半胱氨酸残基的CODV和CODV-Ig构建体具有比其中在这些位置上未引入半胱氨酸残基的CODV和CODV-Ig构建体高的解链温度(参见例如批次标识号704和706及批次标识号713和714)。
1.CODV和TBTI变体的热稳定性测量
使用示差扫描荧光测定法(differential scanning fluorimetry,DSF),测定CODV和TBTI变体的解链温度(Tm)。将样品在D-PBS缓冲液(Invitrogen)中稀释至0.2μg/μl的终浓度,并加入到白色semi-skirt 96孔板中的2μl含SYPRO-Orange染料(Invitrogen)的D-PBS的40x浓溶液中。所有测量采用MyiQ2实时PCR仪器(Biorad)一式两份进行。Tm值应用iQ5软件v2.1,得自解链曲线的负一阶导数。
接下来,检查了将半胱氨酸残基直接引入接头或可变区内的影响。在该实施例中,批次标识号204(来自实施例7和表8)用作模式CODV-Ig结合蛋白,使半胱氨酸取代三维模型基础上的可变区、L1或L3中的甘氨酸。如下表16所示,结果表明如何引入半胱氨酸对可影响产量和聚集。将预期的突变全部模型化以确定适当形成二硫键且对模型中的接头及其环境保持正确的几何结构。然而,批次标识号808显示良好产量和很少聚集,因此表明可能形成适当的半胱氨酸桥。
虽然通过不同的实施方案描述了本发明,但应理解的是,本领域技术人员会想到变化和修改。因此,意旨在于随附权利要求书涵盖在所要求保护的本发明范围内的所有这类等同变化。另外,本文所用段落标题仅出于组织目的,并不得解释为限制所述主题。
本文所述各实施方案可与任何一个或多个其它实施方案组合,除非明确具有相反的说明。具体地说,表明为优选的或有利的任何特征或实施方案可与表明为优选的或有利的任一个或多个其它特征或实施方案组合,除非明确具有相反的说明。
本申请所引用的所有参考文献均通过引用明确地结合到本文中。
表14.二硫桥稳定对CODV-Ig的影响
表15.二硫桥稳定对CODV-Ig的影响
表16A.二硫桥稳定对CODV-Ig的影响
表16B.二硫桥稳定对CODV-Ig的影响
序列表
<110> E. 劳(Rao, Ercole)
V. 米科尔(Mikol, Vincent)
C. 科维(Corvey, Carsten)
C. 贝尔(Beil, Christian)
C. 兰格(Lange, Christian)
A. 施泰因梅茨(Steinmetz, Anke)
N. 鲍林(Baurin, Nicolas)
D. 李(Li, Danxi)
<120> 具有交换结合区取向的双重可变区抗体样结合蛋白
<130> 11-414-WO-CN DIV.2
<140> PCT/US2012/030948
<141> 2012-03-28
<150> 61/468276
<151> 2011-03-28
<150> FR1160311
<151> 2011-11-14
<160> 60
<170> PatentIn 3.5版
<210> 1
<211> 108
<212> PRT
<213> 人工序列
<220>
<223> 来自抗IL4 的人源化抗体轻链(VL)
<400> 1
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Val Ser Val Gly
1 5 10 15
Asp Thr Ile Thr Leu Thr Cys His Ala Ser Gln Asn Ile Asp Val Trp
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gly Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Ala His Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 2
<211> 124
<212> PRT
<213> 人工序列
<220>
<223> 来自抗IL4 抗体的人源化重链V 区(VH)
<400> 2
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile His Trp Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Asp Pro Ser Asp Gly Glu Thr Arg Leu Asn Gln Arg Phe
50 55 60
Gln Gly Arg Ala Thr Leu Thr Val Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Arg Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Leu Lys Glu Tyr Gly Asn Tyr Asp Ser Phe Tyr Phe Asp Val
100 105 110
Trp Gly Ala Gly Thr Leu Val Thr Val Ser Ser Ala
115 120
<210> 3
<211> 111
<212> PRT
<213> 人工序列
<220>
<223> 来自抗IL13 抗体的人源化轻链V 区(VL)
<400> 3
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Ser Tyr
20 25 30
Gly Gln Ser Tyr Met His Trp Tyr Gln Gln Lys Ala Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Gln Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asn Ala
85 90 95
Glu Asp Ser Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 4
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> 来自抗IL-13 抗体的人源化重链V 区(VH)
<400> 4
Glu Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Gly Gly
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asp Ser
20 25 30
Ser Ile Asn Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Met Ile Trp Gly Asp Gly Arg Ile Asp Tyr Ala Asp Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Ser Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Glu Met Thr Ser Leu Arg Thr Asp Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Asp Gly Tyr Phe Pro Tyr Ala Met Asp Phe Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 5
<211> 575
<212> PRT
<213> 人工序列
<220>
<223> 交换双头构建体IL13(G4S)IL4CHFc 的重链
<400> 5
Glu Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Gly Gly
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asp Ser
20 25 30
Ser Ile Asn Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Met Ile Trp Gly Asp Gly Arg Ile Asp Tyr Ala Asp Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Ser Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Glu Met Thr Ser Leu Arg Thr Asp Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Asp Gly Tyr Phe Pro Tyr Ala Met Asp Phe Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Gln
115 120 125
Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala Ser Val Lys Ile Ser
130 135 140
Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr Trp Ile His Trp Ile
145 150 155 160
Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Met Ile Asp Pro
165 170 175
Ser Asp Gly Glu Thr Arg Leu Asn Gln Arg Phe Gln Gly Arg Ala Thr
180 185 190
Leu Thr Val Asp Glu Ser Thr Ser Thr Ala Tyr Met Gln Leu Arg Ser
195 200 205
Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Thr Arg Leu Lys Glu
210 215 220
Tyr Gly Asn Tyr Asp Ser Phe Tyr Phe Asp Val Trp Gly Ala Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
245 250 255
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
260 265 270
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
275 280 285
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
290 295 300
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
305 310 315 320
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
325 330 335
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
340 345 350
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
355 360 365
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
370 375 380
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
385 390 395 400
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
405 410 415
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
420 425 430
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
435 440 445
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
450 455 460
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
465 470 475 480
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
485 490 495
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
500 505 510
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
515 520 525
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
530 535 540
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
545 550 555 560
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
565 570 575
<210> 6
<211> 580
<212> PRT
<213> 人工序列
<220>
<223> 交换双头构建体IL13(G4S2)IL4CHFc 的重链
<400> 6
Glu Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Gly Gly
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asp Ser
20 25 30
Ser Ile Asn Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Met Ile Trp Gly Asp Gly Arg Ile Asp Tyr Ala Asp Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Ser Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Glu Met Thr Ser Leu Arg Thr Asp Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Asp Gly Tyr Phe Pro Tyr Ala Met Asp Phe Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
130 135 140
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr
145 150 155 160
Trp Ile His Trp Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
165 170 175
Gly Met Ile Asp Pro Ser Asp Gly Glu Thr Arg Leu Asn Gln Arg Phe
180 185 190
Gln Gly Arg Ala Thr Leu Thr Val Asp Glu Ser Thr Ser Thr Ala Tyr
195 200 205
Met Gln Leu Arg Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
210 215 220
Thr Arg Leu Lys Glu Tyr Gly Asn Tyr Asp Ser Phe Tyr Phe Asp Val
225 230 235 240
Trp Gly Ala Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly
245 250 255
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
260 265 270
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
275 280 285
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
290 295 300
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
305 310 315 320
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
325 330 335
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
340 345 350
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
355 360 365
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
370 375 380
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
385 390 395 400
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
405 410 415
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
420 425 430
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
435 440 445
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
450 455 460
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
465 470 475 480
Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln
485 490 495
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
500 505 510
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
515 520 525
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
530 535 540
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
545 550 555 560
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
565 570 575
Leu Ser Pro Gly
580
<210> 7
<211> 698
<212> PRT
<213> 人工序列
<220>
<223> 重链交换双头构建体IL4(G4S)IL13CHFc
<400> 7
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile His Trp Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Asp Pro Ser Asp Gly Glu Thr Arg Leu Asn Gln Arg Phe
50 55 60
Gln Gly Arg Ala Thr Leu Thr Val Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Arg Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Leu Lys Glu Tyr Gly Asn Tyr Asp Ser Phe Tyr Phe Asp Val
100 105 110
Trp Gly Ala Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser
115 120 125
Glu Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Gly Gly
130 135 140
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asp Ser
145 150 155 160
Ser Ile Asn Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
165 170 175
Gly Met Ile Trp Gly Asp Gly Arg Ile Asp Tyr Ala Asp Ala Leu Lys
180 185 190
Ser Arg Leu Ser Ile Ser Lys Asp Ser Ser Lys Ser Gln Val Phe Leu
195 200 205
Glu Met Thr Ser Leu Arg Thr Asp Asp Thr Ala Thr Tyr Tyr Cys Ala
210 215 220
Arg Asp Gly Tyr Phe Pro Tyr Ala Met Asp Phe Trp Gly Gln Gly Thr
225 230 235 240
Ser Val Thr Val Ser Ser Gln Val Gln Leu Gln Gln Ser Gly Pro Glu
245 250 255
Leu Val Lys Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Ala Ser Gly
260 265 270
Tyr Ser Phe Thr Ser Tyr Trp Ile His Trp Ile Lys Gln Arg Pro Gly
275 280 285
Gln Gly Leu Glu Trp Ile Gly Met Ile Asp Pro Ser Asp Gly Glu Thr
290 295 300
Arg Leu Asn Gln Arg Phe Gln Gly Arg Ala Thr Leu Thr Val Asp Glu
305 310 315 320
Ser Thr Ser Thr Ala Tyr Met Gln Leu Arg Ser Pro Thr Ser Glu Asp
325 330 335
Ser Ala Val Tyr Tyr Cys Thr Arg Leu Lys Glu Tyr Gly Asn Tyr Asp
340 345 350
Ser Phe Tyr Phe Asp Val Trp Gly Ala Gly Thr Leu Val Thr Val Ser
355 360 365
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser
370 375 380
Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
385 390 395 400
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
405 410 415
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
420 425 430
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln
435 440 445
Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp
450 455 460
Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro
465 470 475 480
Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro
485 490 495
Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr
500 505 510
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
515 520 525
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
530 535 540
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
545 550 555 560
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
565 570 575
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
580 585 590
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
595 600 605
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
610 615 620
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
625 630 635 640
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
645 650 655
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
660 665 670
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
675 680 685
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
690 695
<210> 8
<211> 703
<212> PRT
<213> 人工序列
<220>
<223> 重链交换双头构建体IL4(G4S2)IL13CHFc
<400> 8
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr
20 25 30
Trp Ile His Trp Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Asp Pro Ser Asp Gly Glu Thr Arg Leu Asn Gln Arg Phe
50 55 60
Gln Gly Arg Ala Thr Leu Thr Val Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Arg Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Leu Lys Glu Tyr Gly Asn Tyr Asp Ser Phe Tyr Phe Asp Val
100 105 110
Trp Gly Ala Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Glu Val Gln Leu Lys Glu Ser Gly Pro Gly Leu
130 135 140
Val Ala Pro Gly Gly Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe
145 150 155 160
Ser Leu Thr Asp Ser Ser Ile Asn Trp Val Arg Gln Pro Pro Gly Lys
165 170 175
Gly Leu Glu Trp Leu Gly Met Ile Trp Gly Asp Gly Arg Ile Asp Tyr
180 185 190
Ala Asp Ala Leu Lys Ser Arg Leu Ser Ile Ser Lys Asp Ser Ser Lys
195 200 205
Ser Gln Val Phe Leu Glu Met Thr Ser Leu Arg Thr Asp Asp Thr Ala
210 215 220
Thr Tyr Tyr Cys Ala Arg Asp Gly Tyr Phe Pro Tyr Ala Met Asp Phe
225 230 235 240
Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gln Val Gln Leu Gln
245 250 255
Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala Ser Val Lys Ile Ser
260 265 270
Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr Trp Ile His Trp Ile
275 280 285
Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Met Ile Asp Pro
290 295 300
Ser Asp Gly Glu Thr Arg Leu Asn Gln Arg Phe Gln Gly Arg Ala Thr
305 310 315 320
Leu Thr Val Asp Glu Ser Thr Ser Thr Ala Tyr Met Gln Leu Arg Ser
325 330 335
Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Thr Arg Leu Lys Glu
340 345 350
Tyr Gly Asn Tyr Asp Ser Phe Tyr Phe Asp Val Trp Gly Ala Gly Thr
355 360 365
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
370 375 380
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
385 390 395 400
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
405 410 415
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
420 425 430
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
435 440 445
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
450 455 460
Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr
465 470 475 480
His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser
485 490 495
Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg
500 505 510
Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro
515 520 525
Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala
530 535 540
Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val
545 550 555 560
Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr
565 570 575
Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr
580 585 590
Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu
595 600 605
Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys
610 615 620
Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser
625 630 635 640
Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp
645 650 655
Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser
660 665 670
Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala
675 680 685
Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
690 695 700
<210> 9
<211> 330
<212> PRT
<213> 人工序列
<220>
<223> 轻链交换双头构建体IL13(G4S)IL4CL
<400> 9
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Ser Tyr
20 25 30
Gly Gln Ser Tyr Met His Trp Tyr Gln Gln Lys Ala Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Gln Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asn Ala
85 90 95
Glu Asp Ser Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly
100 105 110
Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser
115 120 125
Val Ser Val Gly Asp Thr Ile Thr Leu Thr Cys His Ala Ser Gln Asn
130 135 140
Ile Asp Val Trp Leu Ser Trp Phe Gln Gln Lys Pro Gly Asn Ile Pro
145 150 155 160
Lys Leu Leu Ile Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser
165 170 175
Arg Phe Ser Gly Ser Gly Ser Gly Thr Gly Phe Thr Leu Thr Ile Ser
180 185 190
Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Ala His
195 200 205
Ser Tyr Pro Phe Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
210 215 220
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
225 230 235 240
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
245 250 255
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
260 265 270
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
275 280 285
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
290 295 300
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
305 310 315 320
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
325 330
<210> 10
<211> 335
<212> PRT
<213> 人工序列
<220>
<223> 轻链交换双头构建体IL13(G4S2)IL4CL
<400> 10
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Ser Tyr
20 25 30
Gly Gln Ser Tyr Met His Trp Tyr Gln Gln Lys Ala Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
65 70 75 80
Pro Val Gln Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asn Ala
85 90 95
Glu Asp Ser Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser
115 120 125
Pro Ala Ser Leu Ser Val Ser Val Gly Asp Thr Ile Thr Leu Thr Cys
130 135 140
His Ala Ser Gln Asn Ile Asp Val Trp Leu Ser Trp Phe Gln Gln Lys
145 150 155 160
Pro Gly Asn Ile Pro Lys Leu Leu Ile Tyr Lys Ala Ser Asn Leu His
165 170 175
Thr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Gly Phe
180 185 190
Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
195 200 205
Cys Gln Gln Ala His Ser Tyr Pro Phe Thr Phe Gly Gly Gly Thr Lys
210 215 220
Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu
245 250 255
Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp
260 265 270
Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp
275 280 285
Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys
290 295 300
Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln
305 310 315 320
Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
325 330 335
<210> 11
<211> 330
<212> PRT
<213> 人工序列
<220>
<223> 轻链交换双头构建体IL4(G4S)IL13CL
<400> 11
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Val Ser Val Gly
1 5 10 15
Asp Thr Ile Thr Leu Thr Cys His Ala Ser Gln Asn Ile Asp Val Trp
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gly Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Ala His Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
115 120 125
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Ser Tyr
130 135 140
Gly Gln Ser Tyr Met His Trp Tyr Gln Gln Lys Ala Gly Gln Pro Pro
145 150 155 160
Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
165 170 175
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp
180 185 190
Pro Val Gln Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asn Ala
195 200 205
Glu Asp Ser Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
210 215 220
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
225 230 235 240
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
245 250 255
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
260 265 270
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
275 280 285
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
290 295 300
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
305 310 315 320
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
325 330
<210> 12
<211> 335
<212> PRT
<213> 人工序列
<220>
<223> 轻链交换双头构建体IL4(G4S2)IL13CL
<400> 12
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Val Ser Val Gly
1 5 10 15
Asp Thr Ile Thr Leu Thr Cys His Ala Ser Gln Asn Ile Asp Val Trp
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gly Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Ala His Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu
115 120 125
Ala Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu
130 135 140
Ser Val Asp Ser Tyr Gly Gln Ser Tyr Met His Trp Tyr Gln Gln Lys
145 150 155 160
Ala Gly Gln Pro Pro Lys Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu
165 170 175
Ser Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe
180 185 190
Thr Leu Thr Ile Asp Pro Val Gln Ala Glu Asp Ala Ala Thr Tyr Tyr
195 200 205
Cys Gln Gln Asn Ala Glu Asp Ser Arg Thr Phe Gly Gly Gly Thr Lys
210 215 220
Leu Glu Ile Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro
225 230 235 240
Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu
245 250 255
Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp
260 265 270
Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp
275 280 285
Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys
290 295 300
Ala Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln
305 310 315 320
Gly Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
325 330 335
<210> 13
<211> 583
<212> PRT
<213> 人工序列
<220>
<223> 具有代码HC1 的交换双重V-Ig 的重链序列
<400> 13
Glu Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Gly Gly
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asp Ser
20 25 30
Ser Ile Asn Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Met Ile Trp Gly Asp Gly Arg Ile Asp Tyr Ala Asp Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Ser Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Glu Met Thr Ser Leu Arg Thr Asp Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Asp Gly Tyr Phe Pro Tyr Ala Met Asp Phe Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Gly Gly Gln Val Gln Leu
115 120 125
Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala Ser Val Lys Ile
130 135 140
Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr Trp Ile His Trp
145 150 155 160
Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Met Ile Asp
165 170 175
Pro Ser Asp Gly Glu Thr Arg Leu Asn Gln Arg Phe Gln Gly Arg Ala
180 185 190
Thr Leu Thr Val Asp Glu Ser Thr Ser Thr Ala Tyr Met Gln Leu Arg
195 200 205
Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Thr Arg Leu Lys
210 215 220
Glu Tyr Gly Asn Tyr Asp Ser Phe Tyr Phe Asp Val Trp Gly Ala Gly
225 230 235 240
Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Gly Gly Gly Ala Ser
245 250 255
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
260 265 270
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
275 280 285
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
290 295 300
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
305 310 315 320
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
325 330 335
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
340 345 350
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
355 360 365
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
370 375 380
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
385 390 395 400
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
405 410 415
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
420 425 430
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
435 440 445
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
450 455 460
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
465 470 475 480
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
485 490 495
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
500 505 510
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
515 520 525
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
530 535 540
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
545 550 555 560
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
565 570 575
Ser Leu Ser Leu Ser Pro Gly
580
<210> 14
<211> 580
<212> PRT
<213> 人工序列
<220>
<223> 具有代码HC2 的交换双重V-Ig 的重链序列
<400> 14
Glu Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Gly Gly
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asp Ser
20 25 30
Ser Ile Asn Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Met Ile Trp Gly Asp Gly Arg Ile Asp Tyr Ala Asp Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Ser Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Glu Met Thr Ser Leu Arg Thr Asp Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Asp Gly Tyr Phe Pro Tyr Ala Met Asp Phe Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Gly Gly Gln Val Gln Leu
115 120 125
Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala Ser Val Lys Ile
130 135 140
Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr Trp Ile His Trp
145 150 155 160
Ile Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Met Ile Asp
165 170 175
Pro Ser Asp Gly Glu Thr Arg Leu Asn Gln Arg Phe Gln Gly Arg Ala
180 185 190
Thr Leu Thr Val Asp Glu Ser Thr Ser Thr Ala Tyr Met Gln Leu Arg
195 200 205
Ser Pro Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Thr Arg Leu Lys
210 215 220
Glu Tyr Gly Asn Tyr Asp Ser Phe Tyr Phe Asp Val Trp Gly Ala Gly
225 230 235 240
Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ala Ser Thr Lys Gly
245 250 255
Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly
260 265 270
Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val
275 280 285
Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe
290 295 300
Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val
305 310 315 320
Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val
325 330 335
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
340 345 350
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
355 360 365
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
370 375 380
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
385 390 395 400
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
405 410 415
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
420 425 430
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
435 440 445
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
450 455 460
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
465 470 475 480
Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln
485 490 495
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
500 505 510
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
515 520 525
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
530 535 540
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
545 550 555 560
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
565 570 575
Leu Ser Pro Gly
580
<210> 15
<211> 579
<212> PRT
<213> 人工序列
<220>
<223> 具有代码HC3 的交换双重V-Ig 的重链序列
<400> 15
Glu Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Gly Gly
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asp Ser
20 25 30
Ser Ile Asn Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Met Ile Trp Gly Asp Gly Arg Ile Asp Tyr Ala Asp Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Ser Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Glu Met Thr Ser Leu Arg Thr Asp Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Asp Gly Tyr Phe Pro Tyr Ala Met Asp Phe Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gln Val Gln Leu Gln Gln Ser Gly
115 120 125
Pro Glu Leu Val Lys Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Ala
130 135 140
Ser Gly Tyr Ser Phe Thr Ser Tyr Trp Ile His Trp Ile Lys Gln Arg
145 150 155 160
Pro Gly Gln Gly Leu Glu Trp Ile Gly Met Ile Asp Pro Ser Asp Gly
165 170 175
Glu Thr Arg Leu Asn Gln Arg Phe Gln Gly Arg Ala Thr Leu Thr Val
180 185 190
Asp Glu Ser Thr Ser Thr Ala Tyr Met Gln Leu Arg Ser Pro Thr Ser
195 200 205
Glu Asp Ser Ala Val Tyr Tyr Cys Thr Arg Leu Lys Glu Tyr Gly Asn
210 215 220
Tyr Asp Ser Phe Tyr Phe Asp Val Trp Gly Ala Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ser Gly Gly Gly Gly Gly Gly Gly Ala Ser Thr Lys Gly Pro
245 250 255
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
260 265 270
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
275 280 285
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
290 295 300
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
305 310 315 320
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn
325 330 335
His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser
340 345 350
Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu
355 360 365
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
370 375 380
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
385 390 395 400
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
405 410 415
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
420 425 430
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
435 440 445
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
450 455 460
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
465 470 475 480
Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val
485 490 495
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
500 505 510
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
515 520 525
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
530 535 540
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
545 550 555 560
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
565 570 575
Ser Pro Gly
<210> 16
<211> 576
<212> PRT
<213> 人工序列
<220>
<223> 具有代码HC4 的交换双重V-Ig 的重链序列
<400> 16
Glu Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Gly Gly
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asp Ser
20 25 30
Ser Ile Asn Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Met Ile Trp Gly Asp Gly Arg Ile Asp Tyr Ala Asp Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Ser Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Glu Met Thr Ser Leu Arg Thr Asp Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Asp Gly Tyr Phe Pro Tyr Ala Met Asp Phe Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gln Val Gln Leu Gln Gln Ser Gly
115 120 125
Pro Glu Leu Val Lys Pro Gly Ala Ser Val Lys Ile Ser Cys Lys Ala
130 135 140
Ser Gly Tyr Ser Phe Thr Ser Tyr Trp Ile His Trp Ile Lys Gln Arg
145 150 155 160
Pro Gly Gln Gly Leu Glu Trp Ile Gly Met Ile Asp Pro Ser Asp Gly
165 170 175
Glu Thr Arg Leu Asn Gln Arg Phe Gln Gly Arg Ala Thr Leu Thr Val
180 185 190
Asp Glu Ser Thr Ser Thr Ala Tyr Met Gln Leu Arg Ser Pro Thr Ser
195 200 205
Glu Asp Ser Ala Val Tyr Tyr Cys Thr Arg Leu Lys Glu Tyr Gly Asn
210 215 220
Tyr Asp Ser Phe Tyr Phe Asp Val Trp Gly Ala Gly Thr Leu Val Thr
225 230 235 240
Val Ser Ser Gly Gly Gly Gly Ala Ser Thr Lys Gly Pro Ser Val Phe
245 250 255
Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu
260 265 270
Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp
275 280 285
Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu
290 295 300
Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser
305 310 315 320
Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro
325 330 335
Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys
340 345 350
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
355 360 365
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
370 375 380
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
385 390 395 400
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
405 410 415
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
420 425 430
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
435 440 445
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
450 455 460
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
465 470 475 480
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
485 490 495
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
500 505 510
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
515 520 525
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
530 535 540
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
545 550 555 560
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
565 570 575
<210> 17
<211> 581
<212> PRT
<213> 人工序列
<220>
<223> 具有代码HC5 的交换双重V-Ig 的重链序列
<400> 17
Glu Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Gly Gly
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asp Ser
20 25 30
Ser Ile Asn Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Met Ile Trp Gly Asp Gly Arg Ile Asp Tyr Ala Asp Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Ser Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Glu Met Thr Ser Leu Arg Thr Asp Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Asp Gly Tyr Phe Pro Tyr Ala Met Asp Phe Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Gln Val Gln Leu Gln Gln
115 120 125
Ser Gly Pro Glu Leu Val Lys Pro Gly Ala Ser Val Lys Ile Ser Cys
130 135 140
Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr Trp Ile His Trp Ile Lys
145 150 155 160
Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Met Ile Asp Pro Ser
165 170 175
Asp Gly Glu Thr Arg Leu Asn Gln Arg Phe Gln Gly Arg Ala Thr Leu
180 185 190
Thr Val Asp Glu Ser Thr Ser Thr Ala Tyr Met Gln Leu Arg Ser Pro
195 200 205
Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Thr Arg Leu Lys Glu Tyr
210 215 220
Gly Asn Tyr Asp Ser Phe Tyr Phe Asp Val Trp Gly Ala Gly Thr Leu
225 230 235 240
Val Thr Val Ser Ser Gly Gly Gly Gly Gly Gly Gly Ala Ser Thr Lys
245 250 255
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
260 265 270
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
275 280 285
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
290 295 300
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
305 310 315 320
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
325 330 335
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro
340 345 350
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
355 360 365
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
370 375 380
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
385 390 395 400
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
405 410 415
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
420 425 430
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
435 440 445
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
450 455 460
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
465 470 475 480
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn
485 490 495
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
500 505 510
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
515 520 525
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
530 535 540
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
545 550 555 560
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
565 570 575
Ser Leu Ser Pro Gly
580
<210> 18
<211> 578
<212> PRT
<213> 人工序列
<220>
<223> 具有代码HC6 的交换双重V-Ig 的重链
<400> 18
Glu Val Gln Leu Lys Glu Ser Gly Pro Gly Leu Val Ala Pro Gly Gly
1 5 10 15
Ser Leu Ser Ile Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asp Ser
20 25 30
Ser Ile Asn Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Met Ile Trp Gly Asp Gly Arg Ile Asp Tyr Ala Asp Ala Leu Lys
50 55 60
Ser Arg Leu Ser Ile Ser Lys Asp Ser Ser Lys Ser Gln Val Phe Leu
65 70 75 80
Glu Met Thr Ser Leu Arg Thr Asp Asp Thr Ala Thr Tyr Tyr Cys Ala
85 90 95
Arg Asp Gly Tyr Phe Pro Tyr Ala Met Asp Phe Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Gln Val Gln Leu Gln Gln
115 120 125
Ser Gly Pro Glu Leu Val Lys Pro Gly Ala Ser Val Lys Ile Ser Cys
130 135 140
Lys Ala Ser Gly Tyr Ser Phe Thr Ser Tyr Trp Ile His Trp Ile Lys
145 150 155 160
Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile Gly Met Ile Asp Pro Ser
165 170 175
Asp Gly Glu Thr Arg Leu Asn Gln Arg Phe Gln Gly Arg Ala Thr Leu
180 185 190
Thr Val Asp Glu Ser Thr Ser Thr Ala Tyr Met Gln Leu Arg Ser Pro
195 200 205
Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Thr Arg Leu Lys Glu Tyr
210 215 220
Gly Asn Tyr Asp Ser Phe Tyr Phe Asp Val Trp Gly Ala Gly Thr Leu
225 230 235 240
Val Thr Val Ser Ser Gly Gly Gly Gly Ala Ser Thr Lys Gly Pro Ser
245 250 255
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
260 265 270
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
275 280 285
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
290 295 300
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
305 310 315 320
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
325 330 335
Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
340 345 350
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
355 360 365
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
370 375 380
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
385 390 395 400
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
405 410 415
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
420 425 430
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
435 440 445
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
450 455 460
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
465 470 475 480
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
485 490 495
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
500 505 510
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
515 520 525
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
530 535 540
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
545 550 555 560
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
565 570 575
Pro Gly
<210> 19
<211> 328
<212> PRT
<213> 人工序列
<220>
<223> 具有代码LC1 的交换双重V-Ig 的轻链序列
<400> 19
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Val Ser Val Gly
1 5 10 15
Asp Thr Ile Thr Leu Thr Cys His Ala Ser Gln Asn Ile Asp Val Trp
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gly Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Ala His Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Asp Ile
100 105 110
Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly Gln Arg
115 120 125
Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Ser Tyr Gly Gln
130 135 140
Ser Tyr Met His Trp Tyr Gln Gln Lys Ala Gly Gln Pro Pro Lys Leu
145 150 155 160
Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala Arg Phe
165 170 175
Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp Pro Val
180 185 190
Gln Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asn Ala Glu Asp
195 200 205
Ser Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val
210 215 220
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
225 230 235 240
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
245 250 255
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
260 265 270
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
275 280 285
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
290 295 300
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
305 310 315 320
Lys Ser Phe Asn Arg Gly Glu Cys
325
<210> 20
<211> 326
<212> PRT
<213> 人工序列
<220>
<223> 具有代码LC2 的交换双重V-Ig 的轻链序列
<400> 20
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Val Ser Val Gly
1 5 10 15
Asp Thr Ile Thr Leu Thr Cys His Ala Ser Gln Asn Ile Asp Val Trp
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gly Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Ala His Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly Asp Ile Val Leu
100 105 110
Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly Gln Arg Ala Thr
115 120 125
Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Ser Tyr Gly Gln Ser Tyr
130 135 140
Met His Trp Tyr Gln Gln Lys Ala Gly Gln Pro Pro Lys Leu Leu Ile
145 150 155 160
Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala Arg Phe Ser Gly
165 170 175
Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp Pro Val Gln Ala
180 185 190
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asn Ala Glu Asp Ser Arg
195 200 205
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
210 215 220
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
225 230 235 240
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
245 250 255
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
260 265 270
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
275 280 285
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
290 295 300
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
305 310 315 320
Phe Asn Arg Gly Glu Cys
325
<210> 21
<211> 330
<212> PRT
<213> 人工序列
<220>
<223> 具有代码LC3 的交换双重V-Ig 的轻链序列
<400> 21
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Val Ser Val Gly
1 5 10 15
Asp Thr Ile Thr Leu Thr Cys His Ala Ser Gln Asn Ile Asp Val Trp
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gly Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Ala His Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Asp Ile
100 105 110
Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly Gln Arg
115 120 125
Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Ser Tyr Gly Gln
130 135 140
Ser Tyr Met His Trp Tyr Gln Gln Lys Ala Gly Gln Pro Pro Lys Leu
145 150 155 160
Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala Arg Phe
165 170 175
Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp Pro Val
180 185 190
Gln Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asn Ala Glu Asp
195 200 205
Ser Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly Gly Arg
210 215 220
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
225 230 235 240
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
245 250 255
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
260 265 270
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
275 280 285
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
290 295 300
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
305 310 315 320
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
325 330
<210> 22
<211> 328
<212> PRT
<213> 人工序列
<220>
<223> 具有代码LC4 的交换双重V-Ig 的轻链序列
<400> 22
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Val Ser Val Gly
1 5 10 15
Asp Thr Ile Thr Leu Thr Cys His Ala Ser Gln Asn Ile Asp Val Trp
20 25 30
Leu Ser Trp Phe Gln Gln Lys Pro Gly Asn Ile Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Asn Leu His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gly Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Ala His Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly Asp Ile Val Leu
100 105 110
Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly Gln Arg Ala Thr
115 120 125
Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Ser Tyr Gly Gln Ser Tyr
130 135 140
Met His Trp Tyr Gln Gln Lys Ala Gly Gln Pro Pro Lys Leu Leu Ile
145 150 155 160
Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala Arg Phe Ser Gly
165 170 175
Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asp Pro Val Gln Ala
180 185 190
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Asn Ala Glu Asp Ser Arg
195 200 205
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly Gly Arg Thr Val
210 215 220
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
225 230 235 240
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
245 250 255
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
260 265 270
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
275 280 285
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
290 295 300
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
305 310 315 320
Lys Ser Phe Asn Arg Gly Glu Cys
325
<210> 23
<211> 107
<212> PRT
<213> 人(Homo sapiens)
<400> 23
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 24
<211> 329
<212> PRT
<213> 人(Homo sapiens)
<400> 24
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly
325
<210> 25
<211> 4
<212> PRT
<213> 人工序列
<220>
<223> 具有4甘氨酸残基的肽接头
<400> 25
Gly Gly Gly Gly
1
<210> 26
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 具有5甘氨酸氨基酸残基的肽接头
<400> 26
Gly Gly Gly Gly Gly
1 5
<210> 27
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 具有6甘氨酸氨基酸残基的肽接头
<400> 27
Gly Gly Gly Gly Gly Gly
1 5
<210> 28
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 具有7甘氨酸氨基酸残基的肽接头
<400> 28
Gly Gly Gly Gly Gly Gly Gly
1 5
<210> 29
<211> 8
<212> PRT
<213> 人工序列
<220>
<223> 具有8甘氨酸氨基酸残基的肽接头
<400> 29
Gly Gly Gly Gly Gly Gly Gly Gly
1 5
<210> 30
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 人工肽接头
<400> 30
Gly Gly Gly Gly Ser
1 5
<210> 31
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> 人工肽接头
<400> 31
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 32
<211> 582
<212> PRT
<213> 人工序列
<220>
<223> 具有代码HC10 的交换双重V-Ig 的重链序列
<400> 32
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Pro Leu Arg Phe Leu Glu Trp Ser Thr Gln Asp His Tyr
100 105 110
Tyr Tyr Tyr Tyr Met Asp Val Trp Gly Lys Gly Thr Thr Val Thr Val
115 120 125
Ser Ser Gly Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile
145 150 155 160
Lys Asp Thr Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
165 170 175
Glu Trp Val Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala
180 185 190
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn
195 200 205
Thr Ala Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
210 215 220
Tyr Tyr Cys Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr
225 230 235 240
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Ala Ser Thr
245 250 255
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
260 265 270
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
275 280 285
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
290 295 300
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
305 310 315 320
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
325 330 335
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
340 345 350
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
355 360 365
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
370 375 380
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
385 390 395 400
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
405 410 415
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
420 425 430
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
435 440 445
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
450 455 460
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
465 470 475 480
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
485 490 495
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
500 505 510
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
515 520 525
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
530 535 540
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
545 550 555 560
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
565 570 575
Leu Ser Leu Ser Pro Gly
580
<210> 33
<211> 582
<212> PRT
<213> 人工序列
<220>
<223> 具有代码HC11 的交换双重V-Ig 的重链序列
<400> 33
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Asn Ile Lys Asp Thr
20 25 30
Tyr Ile His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Tyr Pro Thr Asn Gly Tyr Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Ala Asp Thr Ser Lys Asn Thr Ala Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ser Arg Trp Gly Gly Asp Gly Phe Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Gly Glu Val Gln Leu Val Gln Ser
115 120 125
Gly Ala Glu Val Lys Lys Pro Gly Ser Ser Val Lys Val Ser Cys Lys
130 135 140
Ala Ser Gly Gly Thr Phe Ser Ser Tyr Ala Ile Ser Trp Val Arg Gln
145 150 155 160
Ala Pro Gly Gln Gly Leu Glu Trp Met Gly Gly Ile Ile Pro Ile Phe
165 170 175
Gly Thr Ala Asn Tyr Ala Gln Lys Phe Gln Gly Arg Val Thr Ile Thr
180 185 190
Ala Asp Lys Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg
195 200 205
Ser Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Ala Pro Leu Arg Phe
210 215 220
Leu Glu Trp Ser Thr Gln Asp His Tyr Tyr Tyr Tyr Tyr Met Asp Val
225 230 235 240
Trp Gly Lys Gly Thr Thr Val Thr Val Ser Ser Gly Gly Ala Ser Thr
245 250 255
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
260 265 270
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
275 280 285
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
290 295 300
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
305 310 315 320
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
325 330 335
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
340 345 350
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
355 360 365
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
370 375 380
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
385 390 395 400
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
405 410 415
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
420 425 430
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
435 440 445
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
450 455 460
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
465 470 475 480
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
485 490 495
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
500 505 510
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
515 520 525
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
530 535 540
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
545 550 555 560
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
565 570 575
Leu Ser Leu Ser Pro Gly
580
<210> 34
<211> 571
<212> PRT
<213> 人工序列
<220>
<223> 具有代码HC12 的交换双重V-Ig 的重链序列
<400> 34
Glu Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Ser Val Ile Asp Thr Arg Gly Ala Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Leu Gly Asn Phe Tyr Tyr Gly Met Asp Val Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Gly Gln Val Gln Leu Gln Glu Ser Gly Pro
115 120 125
Gly Leu Val Lys Pro Ser Gln Thr Leu Ser Leu Thr Cys Thr Val Ser
130 135 140
Gly Gly Ser Ile Ser Ser Gly Asp Tyr Tyr Trp Ser Trp Ile Arg Gln
145 150 155 160
Pro Pro Gly Lys Gly Leu Glu Trp Ile Gly Tyr Ile Tyr Tyr Ser Gly
165 170 175
Ser Thr Asp Tyr Asn Pro Ser Leu Lys Ser Arg Val Thr Met Ser Val
180 185 190
Asp Thr Ser Lys Asn Gln Phe Ser Leu Lys Val Asn Ser Val Thr Ala
195 200 205
Ala Asp Thr Ala Val Tyr Tyr Cys Ala Arg Val Ser Ile Phe Gly Val
210 215 220
Gly Thr Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
225 230 235 240
Gly Gly Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
245 250 255
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
260 265 270
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
275 280 285
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
290 295 300
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
305 310 315 320
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
325 330 335
Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
340 345 350
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
355 360 365
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
370 375 380
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
385 390 395 400
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
405 410 415
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
420 425 430
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
435 440 445
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
450 455 460
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
465 470 475 480
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
485 490 495
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
500 505 510
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
515 520 525
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
530 535 540
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
545 550 555 560
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
565 570
<210> 35
<211> 571
<212> PRT
<213> 人工序列
<220>
<223> 具有代码HC13 的交换双重V-Ig 的重链序列
<400> 35
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Gly Ser Ile Ser Ser Gly
20 25 30
Asp Tyr Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu
35 40 45
Trp Ile Gly Tyr Ile Tyr Tyr Ser Gly Ser Thr Asp Tyr Asn Pro Ser
50 55 60
Leu Lys Ser Arg Val Thr Met Ser Val Asp Thr Ser Lys Asn Gln Phe
65 70 75 80
Ser Leu Lys Val Asn Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Val Ser Ile Phe Gly Val Gly Thr Phe Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Gly Glu Val Gln Leu Val Gln
115 120 125
Ser Gly Gly Gly Leu Val Lys Pro Gly Gly Ser Leu Arg Leu Ser Cys
130 135 140
Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe Ala Met His Trp Val Arg
145 150 155 160
Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Ser Val Ile Asp Thr Arg
165 170 175
Gly Ala Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser
180 185 190
Arg Asp Asn Ala Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg
195 200 205
Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Leu Gly Asn Phe Tyr
210 215 220
Tyr Gly Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
225 230 235 240
Gly Gly Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
245 250 255
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
260 265 270
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
275 280 285
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
290 295 300
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
305 310 315 320
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
325 330 335
Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
340 345 350
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
355 360 365
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
370 375 380
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
385 390 395 400
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
405 410 415
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
420 425 430
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
435 440 445
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
450 455 460
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
465 470 475 480
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
485 490 495
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
500 505 510
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
515 520 525
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
530 535 540
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
545 550 555 560
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
565 570
<210> 36
<211> 572
<212> PRT
<213> 人工序列
<220>
<223> 具有代码HC14 的交换双重V-Ig 的重链序列
<400> 36
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Gly Glu Val Gln Leu Val Gln
115 120 125
Ser Gly Ala Glu Val Lys Lys Pro Gly Glu Ser Leu Lys Ile Ser Cys
130 135 140
Lys Gly Ser Gly Tyr Ser Phe Thr Thr Tyr Trp Leu Gly Trp Val Arg
145 150 155 160
Gln Met Pro Gly Lys Gly Leu Asp Trp Ile Gly Ile Met Ser Pro Val
165 170 175
Asp Ser Asp Ile Arg Tyr Ser Pro Ser Phe Gln Gly Gln Val Thr Met
180 185 190
Ser Val Asp Lys Ser Ile Thr Thr Ala Tyr Leu Gln Trp Asn Ser Leu
195 200 205
Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys Ala Arg Arg Arg Pro Gly
210 215 220
Gln Gly Tyr Phe Asp Phe Trp Gly Gln Gly Thr Leu Val Thr Val Ser
225 230 235 240
Ser Gly Gly Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
245 250 255
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
260 265 270
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
275 280 285
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
290 295 300
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
305 310 315 320
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
325 330 335
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
340 345 350
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
355 360 365
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
370 375 380
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
385 390 395 400
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
405 410 415
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
420 425 430
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
435 440 445
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
450 455 460
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
465 470 475 480
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
485 490 495
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
500 505 510
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
515 520 525
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
530 535 540
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
545 550 555 560
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
565 570
<210> 37
<211> 572
<212> PRT
<213> 人工序列
<220>
<223> 具有代码HC15 的交换双重V-Ig 的重链序列
<400> 37
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Thr Thr Tyr
20 25 30
Trp Leu Gly Trp Val Arg Gln Met Pro Gly Lys Gly Leu Asp Trp Ile
35 40 45
Gly Ile Met Ser Pro Val Asp Ser Asp Ile Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Met Ser Val Asp Lys Ser Ile Thr Thr Ala Tyr
65 70 75 80
Leu Gln Trp Asn Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Arg Arg Pro Gly Gln Gly Tyr Phe Asp Phe Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Gly Glu Val Gln Leu Val Glu Ser Gly
115 120 125
Gly Gly Leu Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala
130 135 140
Ser Gly Phe Thr Phe Asp Asp Tyr Ala Met His Trp Val Arg Gln Ala
145 150 155 160
Pro Gly Lys Gly Leu Glu Trp Val Ser Ala Ile Thr Trp Asn Ser Gly
165 170 175
His Ile Asp Tyr Ala Asp Ser Val Glu Gly Arg Phe Thr Ile Ser Arg
180 185 190
Asp Asn Ala Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala
195 200 205
Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Val Ser Tyr Leu Ser Thr
210 215 220
Ala Ser Ser Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
225 230 235 240
Ser Gly Gly Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
245 250 255
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
260 265 270
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
275 280 285
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
290 295 300
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
305 310 315 320
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
325 330 335
Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
340 345 350
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
355 360 365
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
370 375 380
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
385 390 395 400
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
405 410 415
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
420 425 430
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
435 440 445
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
450 455 460
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
465 470 475 480
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
485 490 495
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
500 505 510
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
515 520 525
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
530 535 540
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
545 550 555 560
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
565 570
<210> 38
<211> 571
<212> PRT
<213> 人工序列
<220>
<223> 具有代码HC16 的交换双重V-Ig 的重链序列
<400> 38
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val
50 55 60
Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gln Val Gln Leu Val Glu
115 120 125
Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys
130 135 140
Ala Ala Ser Gly Phe Thr Phe Ser Val Tyr Gly Met Asn Trp Val Arg
145 150 155 160
Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ala Ile Ile Trp Tyr Asp
165 170 175
Gly Asp Asn Gln Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile
180 185 190
Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Gly Leu
195 200 205
Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg Asp Leu Arg Thr
210 215 220
Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
225 230 235 240
Gly Gly Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
245 250 255
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
260 265 270
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
275 280 285
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
290 295 300
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
305 310 315 320
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
325 330 335
Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
340 345 350
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
355 360 365
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
370 375 380
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
385 390 395 400
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
405 410 415
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
420 425 430
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
435 440 445
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
450 455 460
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
465 470 475 480
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
485 490 495
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
500 505 510
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
515 520 525
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
530 535 540
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
545 550 555 560
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
565 570
<210> 39
<211> 571
<212> PRT
<213> 人工序列
<220>
<223> 具有代码HC17 的交换双重V-Ig 的重链序列
<400> 39
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Val Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ile Ile Trp Tyr Asp Gly Asp Asn Gln Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Gly Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Arg Thr Gly Pro Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Gly Glu Val Gln Leu Val Glu Ser Gly Gly
115 120 125
Gly Leu Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser
130 135 140
Gly Phe Thr Phe Asp Asp Tyr Ala Met His Trp Val Arg Gln Ala Pro
145 150 155 160
Gly Lys Gly Leu Glu Trp Val Ser Ala Ile Thr Trp Asn Ser Gly His
165 170 175
Ile Asp Tyr Ala Asp Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp
180 185 190
Asn Ala Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu
195 200 205
Asp Thr Ala Val Tyr Tyr Cys Ala Lys Val Ser Tyr Leu Ser Thr Ala
210 215 220
Ser Ser Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
225 230 235 240
Gly Gly Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
245 250 255
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
260 265 270
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
275 280 285
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
290 295 300
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
305 310 315 320
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
325 330 335
Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
340 345 350
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
355 360 365
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
370 375 380
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
385 390 395 400
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
405 410 415
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
420 425 430
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
435 440 445
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
450 455 460
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
465 470 475 480
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
485 490 495
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
500 505 510
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
515 520 525
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
530 535 540
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
545 550 555 560
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
565 570
<210> 40
<211> 334
<212> PRT
<213> 人工序列
<220>
<223> 具有代码LC10 的交换双重V-Ig 的轻链序列
<400> 40
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val Asn Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr Thr Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Gly
100 105 110
Gly Gly Ser Ser Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu
115 120 125
Gly Gln Thr Val Arg Ile Thr Cys Gln Gly Asp Ser Leu Arg Ser Tyr
130 135 140
Tyr Ala Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Ile Leu Val
145 150 155 160
Ile Tyr Gly Glu Asn Lys Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser
165 170 175
Gly Ser Ser Ser Gly Asn Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln
180 185 190
Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Lys Ser Arg Asp Gly Ser Gly
195 200 205
Gln His Leu Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly
210 215 220
Gly Gly Gly Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
225 230 235 240
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
245 250 255
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
260 265 270
Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser
275 280 285
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala
290 295 300
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
305 310 315 320
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
325 330
<210> 41
<211> 334
<212> PRT
<213> 人工序列
<220>
<223> 具有代码LC11 的交换双重V-Ig 的轻链序列
<400> 41
Ser Ser Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln
1 5 10 15
Thr Val Arg Ile Thr Cys Gln Gly Asp Ser Leu Arg Ser Tyr Tyr Ala
20 25 30
Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Ile Leu Val Ile Tyr
35 40 45
Gly Glu Asn Lys Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Ser Ser Gly Asn Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Lys Ser Arg Asp Gly Ser Gly Gln His
85 90 95
Leu Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gly Gly Gly
100 105 110
Gly Gly Gly Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala
115 120 125
Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Val
130 135 140
Asn Thr Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys
145 150 155 160
Leu Leu Ile Tyr Ser Ala Ser Phe Leu Tyr Ser Gly Val Pro Ser Arg
165 170 175
Phe Ser Gly Ser Arg Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
180 185 190
Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Tyr Thr
195 200 205
Thr Pro Pro Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly
210 215 220
Gly Gly Gly Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro
225 230 235 240
Ser Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu
245 250 255
Asn Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn
260 265 270
Ala Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser
275 280 285
Lys Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala
290 295 300
Asp Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly
305 310 315 320
Leu Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
325 330
<210> 42
<211> 333
<212> PRT
<213> 人工序列
<220>
<223> 具有代码LC12 的交换双重V-Ig 的轻链序列
<400> 42
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys His Gln Tyr Gly Ser Thr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Ala Glu Ile Lys Gly Gly Gly Gly Gly
100 105 110
Gly Gly Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Val Ser
115 120 125
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Gly
130 135 140
Ser Ser Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu
145 150 155 160
Leu Ile Lys Tyr Ala Ser Gln Ser Leu Ser Gly Ile Pro Asp Arg Phe
165 170 175
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu
180 185 190
Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys His Gln Ser Ser Arg Leu
195 200 205
Pro His Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly Gly
210 215 220
Gly Gly Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
225 230 235 240
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
245 250 255
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
260 265 270
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
275 280 285
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
290 295 300
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
305 310 315 320
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
325 330
<210> 43
<211> 333
<212> PRT
<213> 人工序列
<220>
<223> 具有代码LC13 的交换双重V-Ig 的轻链序列
<400> 43
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Ile Gly Ser Ser
20 25 30
Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Gln Ser Leu Ser Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys His Gln Ser Ser Arg Leu Pro His
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Gly
100 105 110
Gly Gly Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser
115 120 125
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser
130 135 140
Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu
145 150 155 160
Leu Ile Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe
165 170 175
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
180 185 190
Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys His Gln Tyr Gly Ser Thr
195 200 205
Pro Leu Thr Phe Gly Gly Gly Thr Lys Ala Glu Ile Lys Gly Gly Gly
210 215 220
Gly Gly Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
225 230 235 240
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
245 250 255
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
260 265 270
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
275 280 285
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
290 295 300
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
305 310 315 320
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
325 330
<210> 44
<211> 333
<212> PRT
<213> 人工序列
<220>
<223> 具有代码LC14 的交换双重V-Ig 的轻链序列
<400> 44
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Glu Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ile Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly Gly Gly
100 105 110
Gly Gly Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser
115 120 125
Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg
130 135 140
Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu
145 150 155 160
Leu Ile Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe
165 170 175
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
180 185 190
Gln Pro Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg Tyr Asn Arg Ala
195 200 205
Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly Gly
210 215 220
Gly Gly Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
225 230 235 240
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
245 250 255
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
260 265 270
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
275 280 285
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
290 295 300
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
305 310 315 320
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
325 330
<210> 45
<211> 333
<212> PRT
<213> 人工序列
<220>
<223> 具有代码LC15 的交换双重V-Ig 的轻链序列
<400> 45
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg Tyr Asn Arg Ala Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Gly
100 105 110
Gly Gly Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser
115 120 125
Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser
130 135 140
Ser Trp Leu Ala Trp Tyr Gln Gln Lys Pro Glu Lys Ala Pro Lys Ser
145 150 155 160
Leu Ile Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe
165 170 175
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
180 185 190
Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ile Tyr
195 200 205
Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Gly Gly Gly
210 215 220
Gly Gly Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
225 230 235 240
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
245 250 255
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
260 265 270
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
275 280 285
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
290 295 300
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
305 310 315 320
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
325 330
<210> 46
<211> 333
<212> PRT
<213> 人工序列
<220>
<223> 具有代码LC16 的交换双重V-Ig 的轻链序列
<400> 46
Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly Ser Ser
20 25 30
Leu His Trp Tyr Gln Gln Lys Pro Asp Gln Ser Pro Lys Leu Leu Ile
35 40 45
Lys Tyr Ala Ser Gln Ser Phe Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Ala Tyr Tyr Cys His Gln Ser Ser Ser Leu Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys Gly Gly Gly Gly Gly
100 105 110
Gly Gly Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser
115 120 125
Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg
130 135 140
Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu
145 150 155 160
Leu Ile Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe
165 170 175
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
180 185 190
Gln Pro Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg Tyr Asn Arg Ala
195 200 205
Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly Gly
210 215 220
Gly Gly Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
225 230 235 240
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
245 250 255
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
260 265 270
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
275 280 285
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
290 295 300
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
305 310 315 320
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
325 330
<210> 47
<211> 333
<212> PRT
<213> 人工序列
<220>
<223> 具有代码LC17 的交换双重V-Ig 的轻链序列
<400> 47
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg Tyr Asn Arg Ala Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Gly Gly Gly Gly Gly
100 105 110
Gly Gly Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val Thr
115 120 125
Pro Lys Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Gly
130 135 140
Ser Ser Leu His Trp Tyr Gln Gln Lys Pro Asp Gln Ser Pro Lys Leu
145 150 155 160
Leu Ile Lys Tyr Ala Ser Gln Ser Phe Ser Gly Val Pro Ser Arg Phe
165 170 175
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser Leu
180 185 190
Glu Ala Glu Asp Ala Ala Ala Tyr Tyr Cys His Gln Ser Ser Ser Leu
195 200 205
Pro Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys Gly Gly Gly
210 215 220
Gly Gly Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser
225 230 235 240
Asp Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn
245 250 255
Asn Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala
260 265 270
Leu Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys
275 280 285
Asp Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp
290 295 300
Tyr Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu
305 310 315 320
Ser Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
325 330
<210> 48
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 肽接头
<400> 48
Ala Ser Thr Lys Gly Pro Ser
1 5
<210> 49
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 肽接头
<400> 49
Arg Thr Val Ala Ala Pro Ser
1 5
<210> 50
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 肽接头
<400> 50
Gly Gln Pro Lys Ala Ala Pro
1 5
<210> 51
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 肽接头
<400> 51
His Ile Asp Ser Pro Asn Lys
1 5
<210> 52
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 肽接头
<400> 52
Thr Lys Gly Pro Ser
1 5
<210> 53
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 肽接头
<400> 53
Thr Val Ala Ala Pro
1 5
<210> 54
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 肽接头
<400> 54
Gln Pro Lys Ala Ala
1 5
<210> 55
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 肽接头
<400> 55
Gln Arg Ile Glu Gly
1 5
<210> 56
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 人工肽接头
<400> 56
Gly Gly Cys Gly Gly Gly Gly
1 5
<210> 57
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 人工肽接头
<400> 57
Gly Gly Gly Cys Gly Gly Gly
1 5
<210> 58
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 人工肽接头
<400> 58
Gly Gly Gly Gly Cys Gly Gly
1 5
<210> 59
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 人工肽接头
<400> 59
Gly Gly Gly Gly Gly Cys Gly
1 5
<210> 60
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 来自IGHG1铰链区的氨基酸序列
<400> 60
Asp Lys Thr His Thr
1 5
- 还没有人留言评论。精彩留言会获得点赞!