一种快速检测食品中金黄色葡萄球菌的方法及其试剂盒与流程
本发明属于食品微生物检测技术领域,涉及一种快速检测食品中金黄色葡萄球菌的方法及其试剂盒。
背景技术:
金黄色葡萄球菌是一种常见的食源性致病菌,常存在于奶、肉、蛋、鱼、虾等食品中,其产生的肠毒素可引起食物中毒,导致皮肤和软组织感染、败血症、骨髓炎和肺炎等疾病。目前我国用于检测食品中食源性致病菌的传统方法多为选择性培养基、显微镜镜检和生化培养鉴定等,其优点是操作简便,所需设备简单,但耗时长、灵敏性差,无法快速检测,会对经济生产活动产生一定的影响。
随着免疫学和分子生物学在食品安全方面的应用,致病菌的检测效率正在逐步提升,目前常采用的方法有聚合酶链式反应(polymerasechainreaction,pcr)、基因芯片法、酶联免疫吸附测定技术(enzymelinkedimmunosorbentassay,elasa)、生物传感器等,但这些方法仍需要昂贵的试剂与实验设备,无法满足突发公共卫生事件时对食源性致病菌快速、准确、便携的现场检测需求。
免疫磁珠分离技术(immunomagneticseparation,ims)就是目前运用广泛的一种快速有效的前处理方法,能够缩短微生物检测的增菌时间,实现微生物致病菌的快速检测。1979年,ugelstad等人首次制成了分离细胞效果极佳的免疫磁珠,因其操作简便、特异性强、可有效保持目标物原有的特性,被广泛应用于分子生物学领域。该技术利用具有磁性的微颗粒结合特定抗体,在液相中能特异性地与相应的抗原结合,依靠磁场的作用力快速地与样品稀释液分离,从而达到富集、纯化样品的目的。
2000年,notomi等人提出了一种新型核酸扩增技术,环介导等温扩增(loop-mediatedisothermalamplification,lamp),该技术利用4~6条的特异性引物和一种具有链置换活性的dna聚合酶(bstdna聚合酶),在等温条件(60~65℃)下可高效、快速、特异性地扩增靶序列。该技术避免了核酸扩增对温度和昂贵仪器的要求,并且该技术特异性强、灵敏度高、实验步骤简单、不需要专业的技术人员,适合现场快速检测食源性致病菌。本发明建立了一种免疫磁珠-环介导等温扩增法(ims-lamp)对金黄色葡萄球菌进行快速、准确的检测,该方法避免使用价格高昂的仪器,降低了实验成本。
技术实现要素:
有鉴于此,本发明所解决的技术问题在于提供一种快速检测食品中金黄色葡萄球菌的方法及。
本发明所解决的技术问题还在于提供一种快速检测食品中金黄色葡萄球菌的试剂盒。
为了解决上述技术问题,本发明所采用的技术方案如下:
一方面,本发明公开了一种快速检测食品中金黄色葡萄球菌的方法,包括如下步骤:
1)利用免疫磁珠富集金黄色葡萄球菌:取1ml待测样品于1.5ml离心管中,投入免疫磁珠300μl混匀;垂直混匀仪上室温孵育30min后,将其置于磁力架上3min使磁珠充分吸附后,将上清液弃去,取下磁力架上的离心管,加入1ml的0.01mol/lpbs洗涤悬浮,充分混匀,然后置于磁力架上3min,使磁珠充分吸附后,弃去悬浮液,重复洗涤3次,加入1ml0.01mol/lpbs震荡重悬磁珠,将富集得到的磁珠-菌体复合物用于后续的dna提取及环介导等温扩增法(lamp)的检测;
2)对富集的金黄色葡萄球菌进行dna提取:采用市售的dna提取试剂盒提取磁珠-菌体复合物的dna,其原理是基于硅胶柱纯化方式,利用试剂盒中的溶菌酶(lysozyme)消化去除金黄色葡萄球菌的细胞壁,在裂解液和蛋白酶(proteinasek)作用下裂解消化,dna释放到裂解液中;加入乙醇后,转移至吸附柱(column)中过滤,dna被吸附至吸附柱的膜上,而蛋白质则被去除;吸附柱经洗涤后去除其他杂质,最后通过低盐缓冲液洗脱dna,洗脱的dna可直接用于后续的lamp的检测;
3)对提取的金黄色葡萄球菌的dna进行lamp检测:使用荧光定量pcr仪,荧光基团选择fam,淬灭基团选择none,将63℃15s,63℃45s作为一个循环,于63℃45s处收集荧光信号,30个循环;反应完成后,根据机器绘制的扩增曲线判断扩增结果,若出现“s”形曲线则为阳性扩增,而获得线性或稍微倾斜的扩增曲线则为阴性扩增。
优选地,步骤1)中所用免疫磁珠的制备方法为:
颠倒混匀pbs溶液中的500nm链霉亲和素磁珠,吸取50μl的链霉亲和素磁珠加入1.5ml灭菌离心管中;然后加1ml0.01mol/lpbst缓冲液,洗涤磁珠,磁场吸附,弃上清液;
将磁珠重悬于1ml0.01mol/lpbst缓冲液,加入20μl含生物素标记的金黄色葡萄球菌的多克隆抗体,垂直混匀仪上轻柔振荡,在室温下孵育45分钟;
在磁场吸附,弃去上清液;后加入0.01mol/lpbst缓冲液(每次1ml)洗涤磁珠3次,每次5min,磁场吸附,弃去上清液;
最后将磁珠重悬在含有0.02%na3n,0.1%牛血清白蛋白(bsa)的pbst缓冲液中,用于后续实验,免疫磁珠保存于4℃冰箱,尽量在一周之内使用。
优选地,步骤3)中的lamp反应体系设置为25μl,按照n+2个数量计算各组分用量,其中n个待检样品+1个阴性对照+1个阳性对照,将反应液置于1.5ml离心管中,漩涡混匀,离心30秒,分装于0.2mlpcr管中,并向每管加入约20μl矿物油,然后加入2μl提取的金黄色葡萄球菌基因组,涡旋混匀30s,离心1min,立即进行扩增反应。
优选地,lamp反应体系成分为:2×rm反应液12.5μl,ddh2o8μl,引物1μl,syto-9工作液0.5μl,bstdna聚合酶1μl,待检测dna2μl。
优选地,所述引物序列如下:
f3引物:ggatggctatcagtaatgtt;
b3引物:gctaagccacgtccatat;
fip引物:actgttggatcttcagaaccaccgctactagttgcttagtgtta;
bip引物:agcgattgatggtgatacggttcaggaccatatttctctacacc;
loopf引物:tgctgagctacttagacttgaa;
loopb引物:aggtcaaccaatgacattcaga。
另一方面,本发明还公开了一种基于智能恒温扩增技术检测金黄色葡萄球菌的试剂盒,该试剂盒包括:免疫磁珠,dna提取试剂,lamp反应液,阳性对照和阴性对照。
其中,所用免疫磁珠的制备方法为:
颠倒混匀pbs溶液中的500nm链霉亲和素磁珠,吸取50μl的链霉亲和素磁珠加入1.5ml灭菌离心管中;然后加1ml0.01mol/lpbst缓冲液,洗涤磁珠,磁场吸附,弃上清液;
将磁珠重悬于1ml0.01mol/lpbst缓冲液,加入20μl含生物素标记的金黄色葡萄球菌的多克隆抗体,垂直混匀仪上轻柔振荡,在室温下孵育45分钟;
在磁场吸附,弃去上清液;后加入0.01mol/lpbst缓冲液(每次1ml)洗涤磁珠3次,每次5min,磁场吸附,弃去上清液;
最后将磁珠重悬在含有0.02%na3n,0.1%牛血清白蛋白(bsa)的pbst缓冲液中,用于后续实验,免疫磁珠保存于4℃冰箱,尽量在一周之内使用。
优选地,lamp反应液成分为:2×rm反应液12.5μl,ddh2o8μl,引物1μl,syto-9工作液0.5μl,bstdna聚合酶1μl,待检测dna2μl。lamp反应体系如表1所示:
表1lamp反应体系
优选地,所述引物序列如下:
f3引物:ggatggctatcagtaatgtt;
b3引物:gctaagccacgtccatat;
fip引物:actgttggatcttcagaaccaccgctactagttgcttagtgtta;
bip引物:agcgattgatggtgatacggttcaggaccatatttctctacacc;
loopf引物:tgctgagctacttagacttgaa;
loopb引物:aggtcaaccaatgacattcaga。
优选地,2×rm反应液的配制方法为:将5mlbuffer缓冲液,3.5ml5.7mol·l-1甜菜碱和4mldntps混匀至白色透明塑料瓶中,保存于-20℃冰箱;其中buffer缓冲液:将5mlmgso4·7h20,5ml(nh4)2so4,5mlkcl,5mltris-hcl,5ml2.5%tween20;
syto-9工作液的配制方法为:向10ml棕色塑料瓶中加入10mldmso,取20μlsyto-9母液(5mmol·l-1)加入10ml棕色塑料瓶,涡旋,离心后保存于-20℃冰箱。
上述表1的引物工作液:详细记录所有引物的信息包括nmol数、编号等,并计算所需te量:内引物和环引物均为nmol数×5μl;外引物为nmol数×10μl。记录完所有信息后,将同一批引物在放入离心机内进行离心(10000rpm,3min),使引物集中在容器底部,离心后在离心管内加入计算好的的te量,即为引物母液,涡旋1min,充分溶解后,再次离心(10000rpm,1min)。下表2为配制1μl引物工作液体系。
表2引物配方(以配制10μl为例)
上述表2所用的引物序列如表3所示。
表3引物序列
与现有技术相比,本发明具有如下的优点及效果:
1)市面上的免疫磁珠制备时间较长,多数需要过夜活化磁珠。本发明所建立的ims法,使用链霉亲和素-生物素介导偶联的免疫磁珠,制备时间为1h,大大降低了制备免疫磁珠的时间。同时链霉亲和素与生物素间有极高的亲和力,故本发明的免疫磁珠能够与抗体和磁珠直接偶联制备的免疫磁珠相比,本发明的磁珠表面能够结合更多抗体,从而大大提高了捕获率。
2)本发明所建立的lamp体系,实现非主观经验的快速准确的食源性微生物检测,可将金黄色葡萄球菌的检测时间缩短在1h内。
3)本发明所建立的ims-lamp检测食品中的金黄色葡萄球菌,其操作步骤简单省时,可高特异性的富集金黄色葡萄球菌,避免复杂食品样品基质的干扰。
附图说明
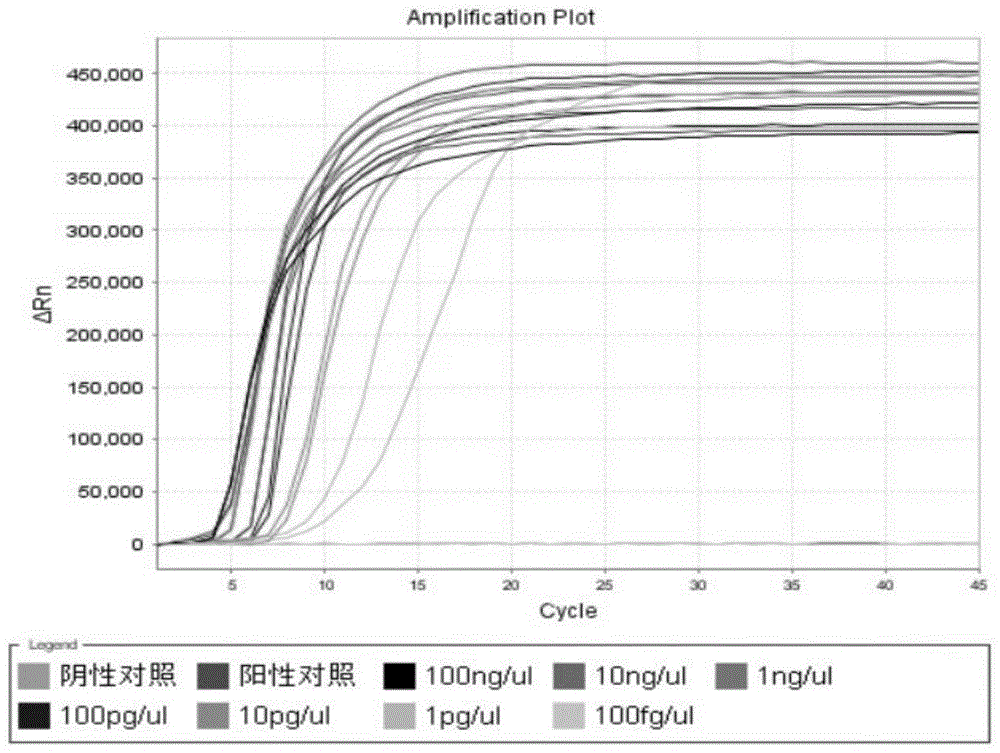
图1所示为免疫磁珠-恒温荧光(ims-lamp)检测方法的灵敏度实验结果图。
图2所示为免疫磁珠-恒温荧光(ims-lamp)检测方法的特异性实验结果图。
具体实施方式
为了更清楚的说明本发明的方法,下面结合实施例及附图对本发明作进一步详细的描述,,但所举实施例不作为对本发明的限定。
实施例1:制备免疫磁珠
颠倒混匀pbs溶液中的500nm链霉亲和素磁珠,吸取50μl的链霉亲和素磁珠(20mg/ml)加入1.5ml灭菌离心管中。然后加1ml0.01mol/lpbst缓冲液,洗涤磁珠,磁场吸附,弃上清液。将磁珠重悬于1ml0.01mol/lpbst缓冲液,加入20μl含生物素标记的金黄色葡萄球菌的多克隆抗体,垂直混匀仪上轻柔振荡,在室温下孵育45分钟。再磁场吸附,弃去上清液。后加入0.01mol/lpbst缓冲液(每次1ml)洗涤磁珠3次,每次5min,磁场吸附,弃去上清液。最后将磁珠重悬在含有0.02%na3n,0.1%牛血清白蛋白(bsa)的pbst缓冲液中,用于后续实验。免疫磁珠保存于4℃冰箱,尽量在一周之内使用。
表4免疫磁珠制备所用磁珠与抗体
实施例2:免疫磁珠-恒温荧光(ims-lamp)法的灵敏度实验
1)试验菌株培养:将-20℃甘油保存的金黄色葡萄球菌,在营养琼脂平板上划线,37℃恒温培养18h。用移液枪吸取单个典型单菌落,反复吹打于7.5%氯化钠肉汤中,37℃、150r/min的摇床中培养12h。
2)免疫磁珠富集:取1ml待测菌液于1.5ml离心管中,投入免疫磁珠300μl混匀。垂直混匀仪上室温孵育30min后,将其置于磁力架上3min使磁珠充分吸附后,将上清液弃去,取下磁力架上的离心管,加入1ml的0.01mol/lpbs洗涤悬浮,充分混匀,然后置于磁力架上3min,使磁珠充分吸附后,弃去悬浮液,重复洗涤3次,加入1ml0.01mol/lpbs震荡重悬磁珠,
3)金黄色葡萄球菌dna模板制备:将免疫磁珠富集的金黄色葡萄球菌菌液采用细菌基因组dna提取试剂盒进行核酸提取,采用微量分光光度计测量核酸浓度,经过计算,对提取的核酸模板利用te缓冲液进行10倍梯度稀释,使其浓度为100ng/μl,10ng/μl,1ng/μl,100pg/μl,10pg/μl,1pg/μl,100fg/μl,10fg/μl,-20℃保存,用于后续实验。
4)恒温引物的合成选取nuc基因为金黄色葡萄球菌特异基因,引物序列如表3所示,由上海生工生物工程有限公司合成。
5)lamp检测:lamp反应体系如表1,使用荧光定量pcr仪,荧光基团选择fam,淬灭基团选择none,将63℃15s,63℃45s作为一个循环,于63℃45s处收集荧光信号,30个循环。反应完成后,根据机器绘制的扩增曲线判断扩增结果,若出现“s”形曲线则为阳性扩增,而获得线性或稍微倾斜的扩增曲线则为阴性扩增。
灵敏度实验的实验结果如图1所示,ims-lamp法的最低检测限为1pg/μl。
实施例3:免疫磁珠-恒温荧光(ims-lamp)法的特异性实验
使用本发明的ims-lamp法检测8株金黄色葡萄球菌菌株,19株非金黄色葡萄球菌菌株,菌株信息如表5所示,结果如图2所示。从结果可知,本发明的方法对8株金黄色葡萄球菌均有扩增曲线,结果都为阳性,对非金黄色葡萄球菌的19种其它菌株均未扩增,结果均为阴性,该方法的特异性良好。
表5实验菌株
实施例4:免疫磁珠-恒温荧光(ims-lamp)法的实际样品检测对比实验
20份实际样品污染:将25g肉糜与225ml3%氯化钠碱性蛋白胨水在三角瓶中混匀。按照国标法(gb4789.10—2016)进行检测,以确保所购买实际中是否有金黄色葡萄球菌。当确定所购样品为金黄色葡萄球菌阴性样品后,在10份样品增菌液中接入金黄色葡萄球菌,接种浓度为104cfu/ml,将这些人工污染样品作为模拟阳性样品。另将大肠杆菌与阪崎肠杆菌菌液悬液均匀混合于其他样品中,作为模拟阴性样品。于37℃,160r/min摇床中增菌18h。分别利用本发明的ims-lamp法国标的方法对20份样品进行检测,进行对比平行实验。实验结果人表6所示。
表6ims-lamp法与国标方法的对比检测结果
表7ims-lamp法与国标方法的的检测结果对比
从表7中可知,20份实际样品中,本发明法检测方法的检测结果为10份阳性,与国标法对比,检测结果完全一致,同时与实际样品污染编号一致,阳性符合率和阴性符合率均为100%,验证了ims-lamp方法的准确性。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
sequencelisting
<110>暨南大学
<120>一种快速检测食品中金黄色葡萄球菌的方法及其试剂盒
<130>2019
<160>6
<170>patentinversion3.3
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
ggatggctatcagtaatgtt20
<210>2
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>2
gctaagccacgtccatat18
<210>3
<211>44
<212>dna
<213>人工序列(artificialsequence)
<400>3
actgttggatcttcagaaccaccgctactagttgcttagtgtta44
<210>4
<211>44
<212>dna
<213>人工序列(artificialsequence)
<400>4
agcgattgatggtgatacggttcaggaccatatttctctacacc44
<210>5
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>5
tgctgagctacttagacttgaa22
<210>6
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>6
aggtcaaccaatgacattcaga22
- 还没有人留言评论。精彩留言会获得点赞!