选择性腺苷A1受体拮抗剂的制作方法
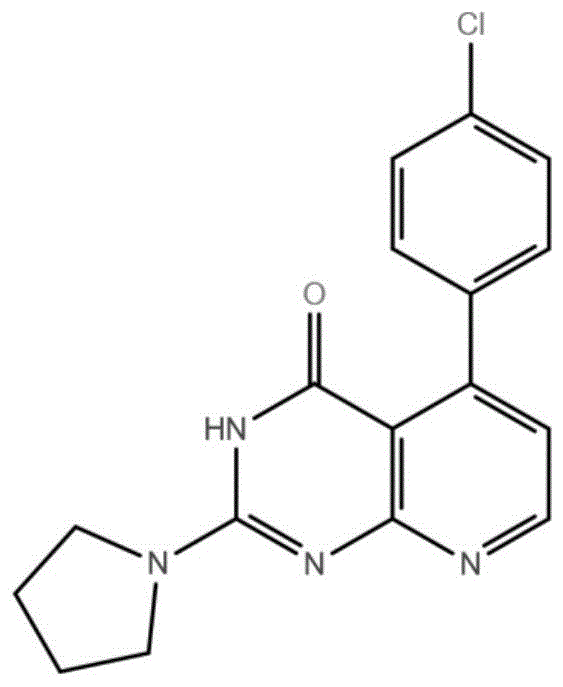
本发明涉及小分子药物领域,更具体而言,涉及一种选择性腺苷a1受体拮抗剂。
背景技术:
:腺苷是多种生理活动中普遍存在的调节剂,特别是在心血管和神经系统中,通过与特异性细胞表面受体的相互作用,调节多种生理功能。已知的腺苷受体有四种亚型,分别为a1、a2a、a2b、a3,属于g蛋白偶联受体家族。腺苷a1和a3受体通过与抑制腺苷酸环化酶的g蛋白偶联来下调细胞camp水平,而腺苷a2a和a2b受体通过与活化腺苷酸环化酶的g蛋白偶联上调细胞内的camp水平。通过这些受体,腺苷调控广泛的生理功能。腺苷a1受体是一个有吸引力的药理靶点,在整个大脑中都有表达,包括皮质、海马和纹状体。其拮抗剂可作为肾脏保护剂、认知促进剂、以及平喘剂和中枢神经系统药物。腺苷a1受体拮抗剂在炎性疾病中起到潜在的治疗作用,在哮喘和炎症的啮齿动物模型中已经显示出其功效。有报告显示腺苷a1拮抗剂能够降低梗塞面积,在高血压、充血性心力衰竭等疾病中具有治疗潜能。另外,腺苷a1受体参与调节肠道运动,腺苷a1受体的激活会导致肠梗阻推进运动活性的抑制,拮抗剂能够阻断a1受体从而恢复肠道正常的运动功能,并不导致腹泻,腺苷a1受体拮抗剂是治疗各种结肠功能运动性综合征(包括便秘和术后肠梗阻)的潜在治疗策略。因此选择性腺苷a1受体拮抗剂的发现对于因腺苷a1受体高表达或活性过高所导致的相关疾病的治疗具有重大意义。技术实现要素:本发明的目的是提供此选择性腺苷a1受体拮抗剂及其在药物合成方面的应用。所述具有选择性腺苷a1受体拮抗活性的化合物d718-0907,分子式:c17h15cln4o,分子量:326.790,结构式为i:上述化合物d718-0907对腺苷a1和a2a受体的ki比值小于0.0078,对腺苷a1受体具有选择性;ic50为1.480μm,具有较高的腺苷a1受体拮抗活性。本发明的又一个目的是提供所述化合物在制备用于治疗或预防腺苷a1受体介导的相关疾病或病症的药物方面的用途。其中所述疾病或病症包括(但不仅限于):哮喘、炎症、高血压、充血性心力衰竭、结肠功能运动性综合征。实现上述用途的药物组合物,包括所述的化合物或其药学上可接受的盐和至少一种药学上可接受的赋形剂。上述药学上可接受的赋形剂可以是药物制剂领域中任何常规的赋形剂,特定赋形剂的选择将用于治疗特定患者的给药方式或疾病类型和状态,用于特定给药模式的合适药物组合物的制备方法在药物领域技术人员的知识范围内。例如,可以作为药学上可接受的赋形剂包括药学领域常规的稀释剂、载体、填充剂、粘合剂、湿润剂、崩解剂等。附图说明附图1.化合物d718-0907的结构式(i);附图2.结合实验中化合物d718-0907对腺苷a1受体的抑制率曲线;附图3.结合实验中化合物d718-0907对腺苷a2a受体的抑制率曲线;附图4.功能实验中化合物d718-0907对腺苷a1受体的抑制率曲线;具体实施方式为了理解本发明,下面以实施例进一步说明本发明,但不意于限制本发明的保护范围。本研究利用多级虚拟筛选技术,利用已有的腺苷a1受体拮抗剂数据构建随机森林(randomforest),并利用该模型对chemdiv数据库进行第一级筛选;然后利用腺苷a1受体的晶体结构(pdbid:5n2s)构建基于能量的药效团模型(e-pharmacophore),并进行第二级筛选;最后利用腺苷a1受体的晶体结构进行基于分子对接的第三级筛选。将第三级筛选得到的化合物d718-0907分别进行结合活性测试(a1/a2abindingassay)和功能活性测试(a1antagonistcampassay)。化合物d718-0907结合活性测试实验过程:(1)a1bindingassay:试剂配制反应缓冲液500ml体积用hcl将ph调到7.4nameweightfinalconctris-base3.03g50mmmgcl20.476g10mmedta1ml1mmadenosinedeaminase500μg1μg/ml洗液体积是2l,配置成10x洗液用hcl将ph调到7.4nameweight(2l)finalconctris-base121.14g500mmnacl180g1.54m用ddh2o按1:10比例稀释成1x洗液后再使用。孵育unifilter-96gf/b缓冲液nameweightddh2ofinalconcpei0.5ml100ml0.5%化合物稀释a)化合物储存浓度为20mm溶于dmso中,在-20℃中储存。b)阳性化合物:dpcpx.c)化合物在384圆底板子中稀释,化合物的起始浓度为10μm,3倍稀释,10个点,0.5%dmso作为阴性对照,100umdpcpx作为阳性对照。阳性化合物稀释如下:利用echo550将250nl稀释的化合物转移到opti-plate中,两个复孔,最终0.5%dmso。实验过程a)总反应体系是50μl,用echo550加入250nl化合物(0.5%dmso)到opti-plate中,封口膜封口。b)配制膜、[3h]-dpcpx与反应缓冲液的混合液:每个孔中加入0.5μla1膜(1u/μl)和[3h]-dpcpx(终浓度2.5nm)和50μl反应缓冲液到96孔板中,600rpm震荡5min混匀。c)在25℃孵育50min。d)用0.5%pei处理unifilter-96gf/b板,每孔加入150ul的0.5%pei,在4℃预孵育1.5小时。e)用universalharvester洗unifilter-96gf/b板2次,每次50ml洗液。f)将孵育后的反应液转移到unifilter-96gf/b板上,每孔加入900μl洗液,用universalharvester冲洗4次,洗后的unifilter-96gf/b板55℃烘干10分钟。g)每孔加入40μlultimagold闪烁液,使用topcount读数。数据分析a)kd值通过graphpadprism6软件作图获得。b)ic50通过使用xlfit5.3.1分析数据获得,x轴是化合物浓度,y轴是cpm值。化合物ic50的拟合曲线:y=bottom+(top-bottom)/(1+10^((logic50-x)*hillslope))x:logofcpdconcentrationy:percentinhibition(%inh)topandbottom:plateausinsameunitsasylogic50:samelogunitsasxhillslope:slopefactororhillslopec)ki=ic50/(1+(c)/kd)(2)a2abindingassay试剂配制反应缓冲液500ml体积用hcl将ph调到7.4nameweightfinalconctris-base3.03g50mmmgcl20.476g10mmedta1ml1mmadenosinedeaminase500μg1μg/ml洗液体积是2l,配置成10x洗液用hcl将ph调到7.4nameweight(2l)finalconctris-base121.14g500mmnacl180g1.54m用ddh2o按1:10比例稀释成1x洗液后再使用。孵育unifilter-96gf/b缓冲液nameweightddh2ofinalconcpei0.5ml100ml0.5%化合物稀释d)化合物储存浓度为20mm溶于dmso中,在-20℃中储存。e)阳性化合物:zm-241385.f)化合物在384圆底板子中稀释,化合物的起始浓度为1μm,3倍稀释,10个点,1%dmso作为阴性对照,10umzm-241385作为阳性对照。阳性化合物稀释如下:[required]μm[stock](100x)mmdilution10.11μl20mmcpd+199μldmso0.3333330.033320μlof30mmcpd+40μldmso0.1111110.011120μlof10mmcpd+40μldmso0.0370370.003720μlof3.33mmcpd+40μldmso0.0123460.0012320μlof1.11mmcpd+40μldmso0.0041150.0004120μlof0.37mmcpd+40μldmso0.0013720.00013720μlof0.12mmcpd+40μldmso0.0004570.00004520μlof0.041mmcpd+40μldmso0.0001520.00001520μlof0.0137mmcpd+40μldmso0.000050.00000520μlof0.0046mmcpd+40μldmsonegativecontrol40μldmsopositivecontrol12μl20mmzm-241385+38μldmso转移5μl稀释后的化合物到96深孔板中,2个复孔,1%dmso。实验过程a)总反应体系为500μl,每个孔中加入100μl的反应缓冲液和5μl稀释后的化合物(1%dmso)到96深孔板中。b)配制膜与反应缓冲液的混合液:每个孔中加入1μla2a膜(1u/μl)和300μl反应缓冲液到96孔板中,600rpm震荡5min混匀。c)每个孔中加入100μl的反应缓冲液和[3h]-zm241385(终浓度为0.5nm)混合液到反应体系中,600rpm震荡5min混匀。d)在27℃孵育1.5h。e)用0.5%pei处理unifilter-96gf/b板,每孔加入150ul的0.5%pei,在4℃预孵育1.5小时。f)用universalharvester洗unifilter-96gf/b板2次,每次50ml洗液。g)将孵育后的反应液转移到unifilter-96gf/b板上,每孔加入900μl洗液,用universalharvester冲洗4次,洗后的unifilter-96gf/b板55℃烘干10分钟。h)每孔加入40μlultimagold闪烁液,使用topcount读数。数据分析d)kd值通过graphpadprism6软件作图获得。.e)ic50通过使用xlfit5.3.1分析数据获得,x轴是化合物浓度,y轴是cpm值。化合物ic50的拟合曲线:y=bottom+(top-bottom)/(1+10^((logic50-x)*hillslope))x:logofcpdconcentrationy:percentinhibition(%inh)topandbottom:plateausinsameunitsasylogic50:samelogunitsasxhillslope:slopefactororhillslopef)ki=ic50/(1+(c)/kd)化合物d718-0907功能活性测试(a1antagonistcampassay)实验过程:细胞培养和接种:1.cho-k1-adenosinea1稳定细胞株培养于37℃,5%co2的细胞完全培养基中。2.实验缓冲液:1xhbss,0.1%bsa,20mmhepes,100nmibmx。3.细胞接种:将细胞重悬于实验缓冲液中,每孔接种8000个细胞于384孔(6007680-50,pe)检测板中。化合物拮抗剂活性检测:1.用实验缓冲液制备8x待测化合物工作液(化合物编号:d718-0907)。2.添加2.5μl8x待测化合物工作液至上述384孔检测板中,于37℃孵育10分钟。3.用实验缓冲液制备forskolin(8μm)和neca(40nm)混合物。4.添加2.5μlforskolin和neca的混合物至检测板中,于37℃孵育30min。5.用裂解缓冲液制备20xcamp-d2和20xanti-camp-eu3+检测试剂。6.向检测板中加入10μlcamp-d2,随后加入10μlanti-camp-eu3+。7.将检测板于室温孵育1小时。8.利用envision2104酶标仪收集波长为665nm和615nm的htrf信号。数据分析:·z’factor=1-3*(sdmax+sdmin)/(meanmax-meanmin);·cvmax=(sdmax/meanmax)*100%;·cvmin=(sdmin/meanmin)*100%;·s/b=singal/background;·使用graphpad的非线性拟合公式计算化合物ec50/ic50:·y=bottom+(top-bottom)/(1+10^((logec50/ic50-x)*hillslope))x:logofcompoundconcentration;y:%activationorinhibition%.结果:化合物d718-0907具有腺苷a1受体拮抗活性并具有较好的a1/a2a选择性。如附图2,其腺苷a1受体结合实验(bindingassay)的ic50为1.70μm,ki为0.78μm;如附图3,其腺苷a2a受体结合实验的ic50大于100μm,ki大于100μm。化合物d718-0907对腺苷a1和a2a受体的ki比值小于0.0078,表明该化合物对腺苷a1受体具有选择性。如附图4,化合物d718-0907腺苷a1受体功能实验(a1antagonistcampassay)的ic50为1.480μm,证明该化合物具有较高的腺苷a1受体拮抗活性。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1