一种含高拷贝数蛋清溶菌酶基因的重组毕赤酵母工程菌及其应用的制作方法
(一)技术领域
本发明构建了一种含有高拷贝数蛋清溶菌酶基因的重组毕赤酵母及其生产溶菌酶的应用。
(二)技术背景
溶菌酶是一种特异性作用于细胞壁的有效抗菌剂,破坏细胞壁的n-乙酰氨基葡糖和n-乙酰胞壁酸之间的β-1,4-糖苷键,分解不溶性黏多糖为可溶性糖肽,具有溶菌作用。溶菌酶在自然界中来源广泛,可分为微生物、噬菌体、植物和动物四种类型的溶菌酶,其中动物溶菌酶活性高,应用广泛。1992年fao/wto的食品添加剂协会公布:溶菌酶应用于食品工业中是安全的,我国卫生部2010年第23号公告批准溶菌酶等物质为食品添加剂。溶菌酶的化学本质为蛋白质,在人及动物的胃肠内可以被消化、吸收。因此不会在体内残留,无毒性,安全性很高,在药品、饲料和食品等行业具有广泛的应用前景。在食品工业中可应用于水产品、乳制品、果蔬、肉类、酒及饮料的防腐保鲜。在畜牧业溶菌酶可用作饲料防腐剂和杀菌剂。在医学上溶菌酶可以代替抗生素作为抗菌消炎的药物。
溶菌酶是一种碱性球蛋白,等电点为10.7-11.3,相对分子量为14.3kda,最适ph6-7,最适温度50℃,分子中有4个二硫键。目前,溶菌酶主要从鸡蛋清和蛋壳膜中提取。但这种直接提取的生产方式,其规模小、成本高,不利于大规模化生产与应用。特别是,随着饲料用的抗生素的管理不断加强,溶菌酶的市场需求正快速扩大。利用基因工程技术构建溶菌酶大肠杆菌表达系统和酵母表达系统,可对溶菌酶进行异源表达和微生物发酵生产,已成为溶菌酶生产技术研究的热点。目前在溶菌酶工程菌构建方面申请的专利较多,包括蛋清溶菌酶(cn101050467b、cn104263709a、cn104694559a、cn105039189b、cn104946675a)、人源溶菌酶(cn1325958、cn1300852a、cn1289678c、cn1664096a、cn102229939b、cn104278017a、cn109295033a、cn109295088a)、猪源溶菌酶(cn107236681a、cn105861468a、cn106046173a)等。为了提高溶菌酶的表达能力,本发明将通过两种整合型质粒,携带人工组装的多拷贝溶菌酶基因表达读码框,整合到毕赤酵母基因组,挑选多拷贝整合工程菌株,构建蛋清溶菌酶的高拷贝数整合的毕赤酵母工程菌。
(三)
技术实现要素:
本发明目的是提供一种含高拷贝数蛋清溶菌酶基因的毕赤酵母工程菌,实现发酵法高效生产蛋清溶菌酶。
本发明采用的技术方案是:
第一方面,本发明提供一种含高拷贝数蛋清溶菌酶基因的毕赤酵母工程菌,所述毕赤酵母工程菌是将seqidno.1所示的来源于gallusgallus蛋清的经过密码子优化的溶菌酶基因以高拷贝数整合毕赤酵母基因组而获得。所述毕赤酵母优选毕赤酵母(pichiapastoris)gs115,所述的毕赤酵母工程菌记为重组毕赤酵母工程菌(pichiapastoris)ief-ewlyz13。所述蛋清溶菌酶基因编码蛋白的氨基酸序列为seqidno.2,ncbi数据库登入号genbankproteinid:aal69327。
进一步,所述高拷贝数是指蛋清溶菌酶基因的拷贝数为13。
本发明所述重组毕赤酵母工程菌(优选ief-ewlyz13)的构建方法,包括以下步骤:
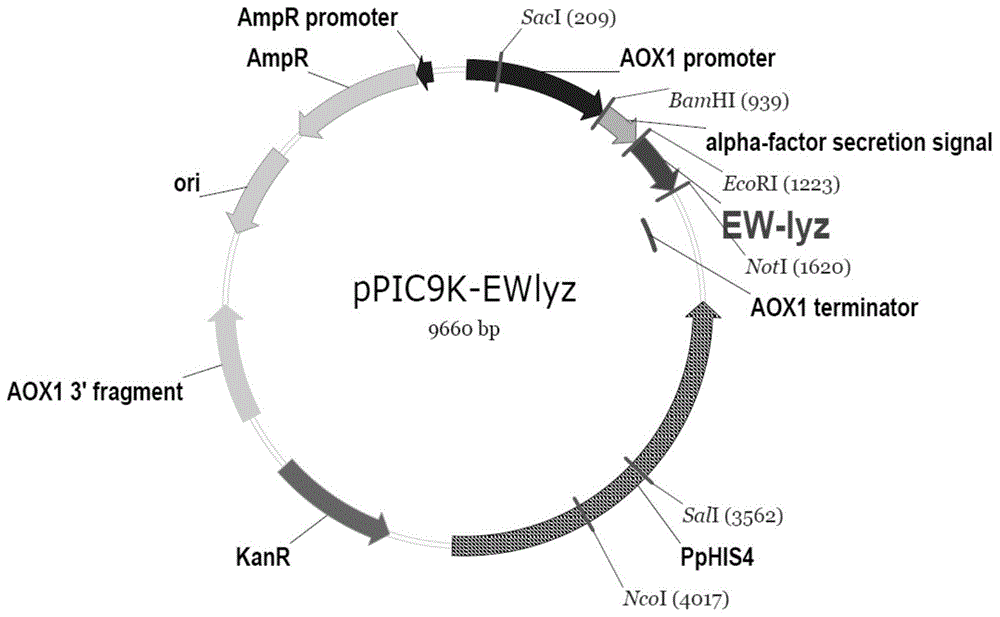
1)通过基因合成公司合成密码子优化的蛋清溶菌酶基因,其核苷酸序列seqidno.1,并将其克隆到分泌型表达质粒ppic9k上,获得重组质粒ppic9k-ewlyz,图1所示;
2)将ppic9k-ewlyz采用限制性内切酶saci线性化后,转化毕赤酵母gs115菌株中,通过高浓度g418抗性平板筛选、透明圈平板高通量筛选和三角瓶发酵实验,筛选得到高拷贝子和高活性的重组菌株ewc91,经定量pcr分析表明蛋清溶菌酶基因的拷贝数为5;所述高浓度g418抗性平板是指3.5g/l遗传霉素g418的ypd平板;
3)将ppic9k-ewlyz上的蛋清溶菌酶基因表达阅读框克隆到ppiczαa质粒上,并构建含有4个拷贝数的重组表达质粒ppiczαa-ewlyz4,如图2所示;
4)将ppiczαa-ewlyz4采用限制性内切酶sali线性化后,转化上述筛选得到的重组菌株ewc91,通过zeocin抗性平板筛选、透明圈平板高通量筛选和三角瓶发酵实验,筛选得到高拷贝子和高活性的重组菌株ief-ewlyz13,经定量pcr分析表明蛋清溶菌酶基因的拷贝数为13,该菌株记为重组毕赤酵母工程菌(pichiapastoris)ief-ewlyz13。
第二方面,本发明提供一种所述重组毕赤酵母工程菌(优选菌株pichiapastorisief-ewlyz13)发酵制备溶菌酶的应用。
本发明所述发酵方法如下:(1)将甘油管中保藏的重组毕赤酵母工程菌(优选pichiapastorisief-ewlyz13)菌液,划线到ypd平板上,25-30℃(优选30℃)培养40h;将单菌落接种到种子培养基中,25-30℃,100-250rpm(优选30℃、200rpm、20h)培养至对数生长中期,获得种子液;所述ypd平板组成如下:酵母粉10g/l、蛋白胨20g/l、葡萄糖10g/l、琼脂粉15g/l,溶剂为去离子水,ph自然;所述种子培养基终浓度组成:酵母粉10g/l、蛋白胨20g/l、葡萄糖10g/l,溶剂为去离子水,ph7.0;
2)发酵培养:将种子液以体积1-10%(优选4%)的接种量接种到发酵培养基中进行甘油批次发酵,在温度25-30℃、搅拌速率200-900rpm、通气量为2-4l/min/l起始发酵培养基条件下,发酵18-24h(优选温度为30℃,搅拌速率为300rpm,通气量为5m3/min),发酵过程控制搅拌速率与溶解氧do值偶联,使do值大于20%,甘油会被耗尽,溶解氧do值快速上升;开始进入甘油补料发酵阶段:其甘油补料培养基的补加速率为18-20ml/h/l起始发酵液体积,甘油补料培养基补加量为原始加入发酵培养基体积的15~20%,甘油会被耗尽,溶解氧快速上升,并继续饥饿培养1-2h;进入甲醇诱导发酵阶段,控制甲醇补料培养的补料速率为3.0-3.6ml/h/l起始发酵培养基,维持溶解氧do大于10%,发酵2-3h,提高甲醇补料速率为5.0-7.2ml/h/l起始发酵培养基,发酵3-5h后,继续增加甲醇补料速率为9.0-10.2ml/h/l起始发酵培养基,持续发酵60-70h,发酵结束,获得含溶菌酶的发酵液;所述甲醇补料培养基补加量为原始加入发酵培养基体积的50~80%;所述发酵培养基质量终浓度组成:26.7ml/l的85%磷酸,0.93g/l的硫酸钙,18.2g/l的硫酸钾,14.9g/l的mgso4·7h2o,4.13g/l的氢氧化钾,40g/l的甘油,4.35ml/lptm1缓冲液,溶剂为去离子水,ph5.0;所述的甘油补料培养基是向质量浓度25%甘油中添加12ml/lptm1缓冲液;所述甲醇补料培养基是向无水甲醇中添加12ml/lptm1缓冲液;所述ptm1缓冲液组成:6.0g/lcuso4·5h2o,0.08g/l的碘化钠,3.0g/lmnso4·h2o,0.2g/lna2moo4·2h2o,0.02g/l硼酸,0.5g/l氯化钴,20.0g/l氯化锌,65.0g/lfeso4·7h2o,0.2g/l生物素,5.0ml/l硫酸,溶剂为去离子水。
与现有技术相比,本发明有益效果体主要现在:①采用两种质粒介导的重组菌构建方法,得到高拷贝数的重组菌,其蛋清溶菌酶在基因组拷贝数为13;②重组菌产溶菌酶酶活高,120-140h内发酵酶活45-50ku/ml,高于现有专利cn201510350298.3报道的发酵水平(18-20ku/ml)。
本发明所述发酵生产蛋清溶菌酶的重组毕赤酵母工程菌的pichiapastorisief-ewlyz13,直接发酵生产蛋清溶菌酶,毕赤酵母具有食品安全性特点,发酵过程不添加抗生素,发酵制备的蛋清溶菌酶适合用于食品和饲料行业。
(四)附图说明
图1为重组质粒ppic9k-ewlyz谱图。
图2为重组质粒ppiczα-ewlyz的图谱。
图3为基于溶菌圈的平板筛选结果。
图4为拷贝数检测的标准质粒puc18-gapdh图谱。
图5为gapdh基因拷贝数的标准曲线。
图6为溶菌酶ewlyz基因拷贝数的标准曲线。
图7为菌株ief-ewlyz13高密度发酵参数变化图谱。
图8为菌株ief-ewlyz13高密度发酵的细胞密度od值和溶菌酶酶活的变化曲线。
(五)具体实施方法
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
本发明实施例中如无特殊说明所用方法均为常规方法,所用试剂均可从商业途径获得。
lb培养基:酵母粉5.0g/l,蛋白胨10g/l,nacl10g/l,溶剂为去离子水,ph7.0。
低盐lb培养基:酵母粉5.0g/l,蛋白胨10g/l,nacl5g/l,溶剂为去离子水,ph7.0。
ypd培养基:酵母粉10.0g/l,蛋白胨20g/l,葡萄糖20g/l,溶剂为去离子水,ph自然。
md培养基:1.34g/l酵母氮源碱(ynb),0.4mg/l生物素,10g/l葡萄糖,溶剂为去离子水,ph自然。
mm固体培养基组成:1.34g/l酵母氮源碱ynb,0.4mg/l生物素,5ml/l甲醇,100mmph6.0磷酸钾缓冲液,15g/l琼脂粉。
bmgy培养基:l0g/l酵母粉,20g/l蛋白胨,1.34g/lynb,0.4mg/l生物素,10g/l甘油,100mm磷酸钾缓冲液,ph6.0。
bmmy培养基:酵母粉l0g/l,蛋白胨20g/l,1.34g/lynb,0.4mg/l生物素,5ml/l甲醇,100mmph6.0磷酸钾缓冲液。
发酵培养基质量终浓度组成:26.7ml/l的85%磷酸,0.93g/l的硫酸钙,18.2g/l的硫酸钾,14.9g/l的mgso4·7h2o,4.13g/l的氢氧化钾,40g/l的甘油,4.35ml/lptm1缓冲液,溶剂为去离子水,ph5.0。
甘油补料培养基是向质量浓度25%甘油中添加12ml/lptm1缓冲液。
甲醇补料培养基是向无水甲醇中添加12ml/lptm1缓冲液。
ptm1缓冲液:6.0g/lcuso4·5h2o,0.08g/l的碘化钠,3.0g/lmnso4·h2o,0.2g/lna2moo4·2h2o,0.02g/l硼酸,0.5g/l氯化钴,20.0g/l氯化锌,65.0g/lfeso4·7h2o,0.2g/l生物素,5.0ml/l硫酸,溶剂为去离子水,过滤消毒。
本发明所述室温是指25℃。
实施例1gallusgallus来源的蛋清溶菌酶基因ewlyz合成及ppic9k-ewlyz质粒的构建
根据ncbi数据库genbankproteinid为aal69327的红原鸡(gallusgallus)来源的蛋清溶菌酶氨基酸序列(seqidno.2),根据毕赤酵母的密码子偏好性进行优化,得到其核苷酸序列(seqidno.1),由无锡华大青兰生物科技有限公司进行基因合成,并将基因克隆到ppic9k的ecori与noti之间,得到重组质粒ppic9k-ewlyz,如图1所示,将其转化到e.colidh5α菌株中,得到e.colidh5α(ppic9k-ewlyz)重组菌株。
实施例2构建分泌型表达蛋清溶菌酶的毕赤酵母重组菌
将线性化ppic9k-ewlyz质粒转化毕赤酵母(pichiapastoris)gs115后,通过高浓度g418平板筛选抗性菌株,随后采用溶菌圈平板筛选高产蛋清溶菌酶的菌株,最后通过三角瓶摇瓶实验得到分泌表达蛋清溶菌酶的毕赤酵母重组菌。
具体实施方案如下:
①线性化ppic9k-ewlyz质粒。将菌株e.colidh5α(ppic9k-ewlyz)接种到含有100μg/ml的氨苄青霉素的lb培养基,37℃过夜培养后,采用质粒提取试剂盒提取ppic9k-ewlyz质粒;采用限制性内切酶saci酶切质粒ppic9k-ewlyz,使其线性化,并对酶切产物进行胶回收,纯化线性化质粒溶解在超纯水中;
②制作毕赤酵母gs115的感受态细胞。接种毕赤酵母gs115的单菌落到含有25mlypd液体培养基的250ml三角瓶中,30℃过夜培养;按体积浓度1%转接含有50mlypd液体培养基的500三角瓶,30℃培养过夜,直到od600=1.5;1500×g,4℃条件下离心培养液5min,再用50ml冰浴的超纯水重悬细胞;重复离心操作,然后用25ml冰浴的超纯水重悬细胞;重复离心操作,用2ml的1m山梨醇的水溶液(溶剂为超纯水)重悬细胞;重复离心操作,用100μl冰浴的1m的山梨醇水溶液重悬细胞,使菌悬液体积大约为150μl,得到毕赤酵母gs115的感受态细胞。
③转化毕赤酵母gs115,挑选阳性转化子。将80μl步骤②制备的感受态细胞和10μg步骤①线性化的质粒ppic9k-ewlyz,加入到一个1.5ml预冷离心管中,混匀,即为转化混合液;然后把转化混合液转移入预先冰浴的转化杯中(0.2cm型),冰浴5min;采用bio-rad电击仪进行电转化:电压1.5kv、电场强度7.5kv/cm、电容25μf、电阻400ω;脉冲后立即往电转杯中加入1ml冰浴的1m的山梨醇水溶液,然后把转化液转入一个新的1.5ml离心管中;30℃静置培养2h;取转化液200μl涂布md平板;30℃培养,直到转化子出现。
④筛选耐受高浓度g418的菌落。刮取步骤③md平板上的菌落,采用无菌水进行10倍梯度稀释;将100μl不同稀释梯度的菌悬液,涂布到含有3.5g/l遗传霉素g418的ypd平板上,30℃培养48h,直至菌落出现。
⑤采用溶菌圈平板法筛选高产蛋清溶菌酶的重组菌株。将溶壁微球菌(micrococcuslysodeikticus)atcc4698接种在50mllb液体培养基中,37℃培养20h后,3000×g离心10min,弃去上清,收集细胞;采用5ml无菌水重新悬浮细胞后,加入到100ml已加热煮沸融化的bmmy固体培养基中,将微球菌细胞与刚融化的热培养基混匀,制成带菌平板。将步骤④含g418的ypd平板上生长的菌落,点到带菌平板上,如图3所示,30℃培养3-5天,持续观察溶菌圈大小的变化。挑选溶菌圈较大的菌株,用于下一轮的筛选工作。
⑥三角瓶摇瓶发酵筛选高产蛋清溶菌酶的菌株。摇瓶发酵实验分为两个阶段,即在bmgy培养基中的细胞生长阶段和在bmmy中的诱导产酶阶段。挑取步骤⑤单菌落,接种到装有5mlbmgy培养基的50ml离心管中,30℃摇床培养20h;发酵液od600在2.0时,将离心管取出并2000×g离心10min,倒掉上清;用5ml的bmmy培养基重悬菌体,加入装有20mlbmmy培养基的250ml三角瓶中,总计25ml的bmmy培养基,在30℃、200rpm摇床中进行诱导培养。每24h后从中取出200μl发酵液,同时补加200μl的无水甲醇,连续诱导发酵3d。取出的发酵液样品用于溶菌酶酶活测定。
溶菌酶酶活的测定方法,参考国家食品安全标准gb1886.257-2016的检测方法。
酶活单位定义:将一个酶活单位(u)定义为25℃,ph6.2条件下,使溶壁微球菌菌悬液在450nm处每分钟引起吸光度变化为0.001所需溶菌酶的量。
溶壁微球菌菌悬液的制备:取0.5g步骤⑤溶壁微球菌atcc4698细胞用含0.372g/ledtana2的ph6.2、0.1mol/l磷酸钠缓冲液制备50ml溶壁微球菌菌悬液,在使用前,将此菌悬液置于28℃恒温摇床中培养30min。此菌悬液在室温下可稳定2h,以含0.372g/ledtana2的ph6.2磷酸钠缓冲液调节分光光度计零点,测定溶壁微球菌菌悬液吸光值,450nm处的读数应为0.70±0.1。
25℃下,将1cm比色皿放入分光光度计,用含0.372g/ledtana2的ph6.2磷酸盐缓冲液调整吸光度零点。吸2.9ml溶壁微球菌菌悬液于比色皿,最初450nm处吸光度应为0.70±0.10,3min之内初始吸光度值变化应小于或等于0.003时,方可开始测定。吸取0.1ml待检测发酵液样品作为试样,加入2.9ml溶壁微球菌菌悬液,充分混合制成试样溶液。记录3min吸光度值的变化,每15s记录一次吸光度值。每分钟吸光度值变化应在0.03-0.08,若不在要求范围需调整试样溶液的浓度。重复操作测定试样溶液。反应1min后稳定,计算时忽略最初1min的读数。
上述酶活力x结果的计算使用以下公式(1)进行计算:
x=((a1-a2))/(2×v×0.001)(1)
式中:
a1——试样溶液在450nm处反应1min时的吸光度;
a2——试样溶液在450nm处反应3min时的吸光度;
v——用于分析的试样溶液中的试样体积,单位为毫升(ml)
2——获得1min和3min吸光度读数所用时间,单位为分钟(min)
0.001——由单位溶菌酶每分钟所引起吸光度降低的值。
通过上述的三角瓶发酵实验,筛选得到高产蛋清溶菌酶的菌株,记为重组菌株ewc91。
采用荧光定量pcr的双标准曲线法检测重组菌株ewc91中蛋清溶菌酶基因拷贝数:
①构建内参基因gapdh(甘油醛-3-磷酸-脱氢酶基因)的标准质粒puc18-gapdh,如图4所示。提取毕赤酵母gs115菌株的基因组dna,采用以下引物gap-puc18-f:
cgaattcgagctcggtacccggggatccttttttgtagaaatgtc和gap-puc18-r:
cgacggccagtgccaagctttttagataaggacggagagatg,扩增gapdh,获得扩增后纯化的gapdh。提取puc18质粒,并采用bamhi/hindiii进行双酶切,胶回收纯化,获得线性化质粒puc18。采用一步克隆试剂盒,将扩增后纯化的gapdh与纯化的线性化质粒puc18进行连接反应,并转化e.colidh5α菌株中;通过氨苄青霉素抗性平板筛选得到阳性克隆;通过测序验证,得到标准质粒puc18-gapdh,如图4所示。
②rt-pcr双标准曲线的制作:
用微量核酸定量仪检测puc18-gapdh质粒和ppic9k-ewlyz质粒的质量浓度;根据以下公式换算拷贝数:拷贝数=6.023×1014×质粒质量浓度/(660×m),其中m代指所测基因长度(bp)。将质粒溶液用双蒸馏水稀释成104、105、106、107以及108个拷贝/μl的质粒梯度稀释液,分别用1μl各质粒梯度稀释液作为模板,以
rt-gap-f(ttgtcggtgtcaacgaggag)/rt-gap-r(ggtcttttgagtggcggtc)、
rt-ewlyz-f(gttgtgaattggctgctgct)/rt-ewlyz-r(ccatcgttacaccaccaacg)为引物,进行荧光定量pcr分析。每个样品重复检测3次,每次检测做3个平行样品。以荧光定量pcr给出的ct值为纵坐标,质粒拷贝数为横坐标,建立双标准曲线,如图5和图6所示。
③重组菌株ewc91中蛋清溶菌酶基因拷贝数的确定
以重组菌株ewc91基因组dna1μl为模板,分别以rt-gap-f/rt-gap-r和rt-ewlyz-f/rt-ewlyz-r为引物,进行荧光定量pcr,将得到的ct值分别代入双标准曲线中,求出基因组dna样品中gapdh基因和ewlyz基因的起始模板拷贝数。gapdh基因在毕赤酵母基因组中以单拷贝的形式存在,故溶菌酶基因拷贝数=蛋清溶菌酶基因的起始模板拷贝数/gdpdh基因起始模板拷贝数。
分析结果表明,重组菌株ewc91基因组中含有5个蛋清溶菌酶的基因。
实施例3构建蛋清溶菌酶多拷贝的重组质粒ppiczα-ewlyz4
以ppiczαa质粒为基础,经过四步组装,构建含有四个拷贝数的蛋清溶菌酶基因读码框的重组质粒ppiczα-ewlyz4,如图2所示。具体操作方法如下所示:
①将ewlyz-tt克隆到ppiczαa的ecori和bsmbi之间,得到重组质粒ppiczα-ewlyztt,具体操作如下:首先提取ppiczαa质粒,采用ecori和bsmbi进行双酶切,并胶回收纯化;采用引物ewlyztt-1-f:gagaggctgaagctgaattcaaggtctttggtcgttgtgaattg和ewlyztt-1-r:ctcgaggtaccgatccgagacgacttctcacttaatcttctg,以质粒ppic9k-ewlyz为dna模板,采用南京诺唯赞生物科技有限公司(vazymebiotechco.,ltd)的高效保真酶phantamaxsuper-fidelitydnapolymerase进行pcr扩增,得到ewlyz-tt片段,胶回收纯化pcr产物;采用一步克隆试剂盒,将纯化的ppiczαa酶切产物和ewlyz-tt的pcr产物进行连接反应,并转化到e.colidh5α感受态细胞中,通过含25μg/ml的zeocin抗性的低盐lb培养基筛选,并测序验证,得到重组质粒ppiczα-ewlyztt。
②将ewlyz-orf克隆至ppiczα-ewlyztt的bsmbi和kpni之间,得到ewlyz读码框2个拷贝的重组质粒ppiczα-ewlyztt-ewlyz-orfii,具体为:将步骤①所得的ppiczα-ewlyztt质粒,采用bsmbi和kpni进行双酶切,并采用胶回收试剂盒进行纯化回收;采用引物ewlyzorf-2-f:gaagattaagtgagaagtcgtctcagatctaacatccaaagac和ewlyzorf-2-r:gccgccgcggctcgaggtacctctcacttaatcttctgtac,以ppic9k-ewlyz为dna模板,采用高保真酶进行pcr扩增,得到ewlyz-orfii片段,胶回收纯化pcr产物;采用南京诺唯赞生物科技有限公司的一步克隆试剂盒onestepcloningkit,将纯化的ppiczα-ewlyztt酶切产物和ewlyz-orfii的pcr产物进行连接反应,并转化到e.colidh5α感受态细胞中,通过含25μg/ml的zeocin抗性的低盐lb培养基筛选,并测序验证,得到重组质粒ppiczα-ewlyztt-ewlyz-orfii。
③将ewlyz-orfiii克隆至ppiczα-ewlyztt--ewlyz-orfii的kpni和sacii之间,得到ewlyz读码框3个拷贝的重组质粒ppiczα-ewlyztt-ewlyz-orfii-ewlyz-orfiii,具体为:将步骤②所得的ppiczα-ewlyztt-ewlyz-orfii质粒,采用kpni和sacii双酶切,并采用胶回收试剂盒进行纯化回收;采用引物ewlyzorf-3-f:cagaagattaagtgagaggtaccagatctaacatccaaagacgaaag和ewlyzorf-3-r:gaaagctggcggccgccgcggtctcacttaatcttctgtac,以ppic9k-ewlyz为dna模板,采用高保真酶进行pcr扩增,得到ewlyz-orfiii片段,胶回收纯化pcr产物;采用一步克隆试剂盒,将纯化的ppiczα-ewlyztt--ewlyz-orfii酶切产物和ewlyz-orfiii的pcr产物进行连接反应,并转化到e.colidh5α感受态细胞中,通过含25μg/ml的zeocin抗性的低盐lb培养基筛选,并测序验证,得到重组质粒ppiczα-ewlyztt--ewlyz-orfii-ewlyz-orfiii。
④将组氨酸脱氢酶基因his4的片段与ewlyz-orfiv融合,并克隆至步骤③中的重组质粒ppiczα-ewlyztt-ewlyz-orfii-ewlyz-orfiii的sacii和ncoi之间,得到ewlyz读码框4个拷贝的重组质粒ppiczα-ewlyz4,具体为:将步骤③所得的ppiczα-ewlyztt-ewlyz-orfii-ewlyz-orfiii质粒,采用sacii和ncoi双酶切,并采用胶回收试剂盒进行纯化回收;采用引物his-f:cagaagattaagtgagaccgcggtggagatgcaaaaacaatttc和his-r:agaagctaaatccaaggaagata,以ppic9k-ewlyz为dna模板,采用高保真酶进行pcr扩增,得到his4片段,胶回收纯化pcr产物;采用引物ewlyz-4-f:tatcttccttggatttagcttctagatctaacatccaaagacgaaag和ewlyz-4-r:caatgatgatgatgatgatggttacaaacgacaacctctaatccag,以ppic9k-ewlyz为dna模板,采用高保真酶进行pcr扩增,得到ewlyz-orf4片段,胶回收纯化pcr产物;采用引物tt-noci-f:ccatcatcatcatcatcattgag和tt-ncoi-r:cggcactggtcaacttggccatggtttagttcctcaccttgtc,以ppiczαa为dna模板,采用高保真酶进行pcr扩增,得到tt-ncoi片段,胶回收纯化pcr产物;采用引物his-f:cagaagattaagtgagaccgcggtggagatgcaaaaacaatttc和tt-ncoi-r:cggcactggtcaacttggccatggtttagttcctcaccttgtc,以上述纯化的pcr产物(his4片段、ewlyz-orf4片段和tt-ncoi片段)为模板,采用高保真酶进行pcr扩增,得到融合his4片段的ewlyz-orfiv片段,胶回收纯化pcr产物;采用一步克隆试剂盒,将纯化的ppiczα-ewlyztt--ewlyz-orfii-ewlyz-orfiii酶切产物和融合his4片段的ewlyz-orfiv片段,进行连接反应,所得片段记为ppiczα-ewlyz4,并转化到e.colidh5α感受态细胞中,通过含25μg/ml的zeocin抗性的低盐lb培养基筛选,并测序验证,得到含重组质粒ppiczα-ewlyz4的e.colidh5α(ppiczα-ewlyz4)。
实施例4构建含多拷贝蛋清溶菌酶基因的重组毕赤酵母菌株ief-ewlyz13
将实施例3构建的线性化ppiczα-ewlyz4质粒转化实施例2获得的重组菌株ewc91后,通过zeocin抗性平板筛选抗性菌株,随后采用溶菌圈平板筛选高产蛋清溶菌酶的菌株,最后通过三角瓶摇瓶实验得到分泌表达蛋清溶菌酶的毕赤酵母重组菌。
具体操作如下:
①线性化ppiczα-ewlyz4质粒。将实施例3菌株e.colidh5α(ppiczα-ewlyz4)接种到含有100μg/ml的氨苄青霉素的lb培养基,37℃过夜培养后,采用质粒提取试剂盒提取ppiczα-ewlyz4质粒;采用限制性内切酶sali酶切质粒ppiczα-ewlyz4,使其线性化,并对酶切产物进行胶回收,纯化线性化质粒溶解在超纯水中;
②根据实施案例2中的方法,制作重组菌株ewc91的感受态细胞。
③将线性化的ppiczα-ewlyz4转化重组菌株ewc91,挑选阳性转化子。将80μl步骤②重组菌株ewc91感受态细胞和10μg步骤①线性化质粒ppiczα-ewlyz4,加入到一个1.5ml预冷离心管中,混匀;然后把混合液转移入预先冰浴的转化杯中(0.2cm型);冰浴装有转化混合液的转化杯5min;采用bio-rad电击仪进行电转化:电压1.5kv、电场强度7.5kv/cm、电容25μf、电阻400ω;脉冲后立即往电转杯中加入1ml冰浴的1m的山梨醇水溶液,然后把转化液转入一个新的1.5ml离心管中;30℃静置培养2h;取200μl细胞悬浊液涂布含有100μg/ml的zeocin抗性ypd平板,30℃培养,直到菌落出现。
④采用溶菌圈平板法筛选高产蛋清溶菌酶的重组菌株。将溶壁微球菌(micrococcusmuralolyticus)atcc4698接种在50mllb液体培养基中,37℃培养20h后,3000×g离心10min,弃去上清,收集细胞;采用5ml无菌水重新悬浮细胞后,加入到100ml已加热煮沸的bmmy固体培养基中,将微球菌细胞与培养基混匀,制成带菌平板。将步骤③zeocin抗性平板上生长的菌落,点到带菌平板上,30℃培养3天,持续观察溶菌圈大小的变化。挑选溶菌圈较大的菌株,用于下一轮的筛选工作。
⑤根据实施案例2中的方法,进行三角瓶摇瓶发酵筛选高产蛋清溶菌酶的菌株。
⑥根据实施案例2中的方法,进行高活性重组菌株的蛋清溶菌酶基因的拷贝数检测。
通过以上研究,得到一株高活性高拷贝数的重组毕赤酵母菌株ief-ewlyz13,其蛋清溶菌酶基因的拷贝数为13。
实施例5、菌株ief-ewlyz13发酵制备溶菌酶
一、发酵种子液的培养
将实施例4重组毕赤酵母菌株ief-ewlyz13从保藏的甘油管中,划线到ypd平板,30℃培养40h;挑取单菌落,接种到ypd培养基中,30℃,200rpm培养20h,作为发酵种子液。
二、5l罐的高密度发酵生产溶菌酶
5l发酵罐的发酵过程分成两个阶段:菌体生长阶段以及诱导表达溶菌酶阶段。在菌体生长阶段,种子液接种发酵培养基,利用初始碳源进行生长繁殖,当碳源消耗殆尽时,再流加一定量的新鲜碳源(甘油),使毕赤酵母进一步提高细胞密度。在甘油补加完毕且发酵罐内并无残留甘油时,不添加任何物质,饥饿培养1-1.5个小时,然后进行流加甲醇,进入甲醇诱导培养阶段,甲醇流加速率随着诱导阶段以及罐中溶氧进行调整。在整个实验流程中不同时间点进行取样,测定od600值以及检测溶菌酶酶活。
发酵罐实验具体流程如下所示:
(1)甘油分批发酵阶段:起始发酵培养基的体积为2.5l,发酵罐容积为5l。在灭菌结束后,将罐体与控制装置正确连接,设定合适的温度参数、搅拌速率和通气量(温度为30℃,搅拌速率为300rpm,通气量为5m3/min)。使用氨水调节发酵液ph值至5.0,并向培养基内加入10.875mlptm1缓冲液。待所有参数回归稳定后,将新鲜摇瓶培养20h的100ml的种子液,接入发酵培养基中,体积接种量为4%。在发酵阶段开始之前将溶氧电极参数调节为100%,随着发酵阶段的进行,酵母菌耗氧的速度将会加快,导致溶氧的持续下降,偶联搅拌转速和溶氧(do),使do值>20%。分批发酵阶段会持续约20h,接着甘油就会耗尽,其主要特征就是溶氧快速上升。
(2)甘油补料发酵阶段:上一阶段中起始发酵培养基中的甘油被消耗完毕后,进入甘油补料发酵阶段,发酵条件同步骤(1)。甘油补料遵循先慢后快的原则,补加速率为20ml/h/l起始发酵液体积,在4个小时内将450ml甘油补料培养基补加完毕,甘油补料阶段的结束标志即溶氧重新上升,甘油补加完毕后继续培养1h。关键在于,控制溶氧大于20%。
(3)甲醇补料发酵阶段:完成甘油补料发酵阶段后,进入甲醇诱导发酵阶段。此阶段中的甲醇补加过程需要小心谨慎,甲醇的补加速率需要和菌体生长相互联系。若甲醇补加较快,过高的甲醇会导致酵母细胞无法正常生长甚至杀死细胞。一旦细胞开始适应甲醇后,氧气需求量大,溶氧控制就成为了至关重要的一环。用于流加的甲醇培养基是添加12ml/lptm1缓冲液的纯化甲醇。初始甲醇培养基补加速率保持在3.6ml/hr/l起始发酵培养基,维持溶解氧do大于10%,发酵2h,提高甲醇培养基补料速率为6.0ml/h/l起始发酵培养基,发酵3h后,继续增加甲醇培养基补料速率为9.0ml/h/l起始发酵培养基,持续发酵114h。
在甲醇补料阶段完毕后,高密度发酵过程结束,获得含溶菌酶的发酵液,整个发酵过程持续140h左右,发酵过程参数变化和酶活产生情况,如图7和图8所示所示,最终发酵od值为370,酶活为45ku/ml。
序列表
<110>浙江新银象生物工程有限公司、浙江工业大学
<120>一种含高拷贝数蛋清溶菌酶基因的重组毕赤酵母工程菌及其应用
<160>2
<170>siposequencelisting1.0
<210>1
<211>390
<212>dna
<213>未知(unknown)
<400>1
aaggtctttggtcgttgtgaattggctgctgctatgaagagacatggtttggataactac60
agaggttactctttgggtaactgggtttgtgctgctaagtttgagtctaacttcaacacc120
caagctactaacagaaacactgacggttctactgattacggtatcttgcagattaactct180
cgttggtggtgtaacgatggtagaactccaggttctagaaacttgtgcaacattccatgt240
tctgccttgttgtcttctgatataactgcctctgttaactgtgctaagaagattgtctct300
gatggtaacggtatgaacgcttgggttgcttggagaaacagatgtaagggtactgatgtt360
caagcctggattagaggttgtcgtttgtaa390
<210>2
<211>129
<212>prt
<213>未知(unknown)
<400>2
lysvalpheglyargcysgluleualaalaalametlysarghisgly
151015
leuaspasntyrargglytyrserleuglyasntrpvalcysalaala
202530
lysphegluserasnpheasnthrglnalathrasnargasnthrasp
354045
glyserthrasptyrglyileleuglnileasnserargtrptrpcys
505560
asnaspglyargthrproglyserargasnleucysasnileprocys
65707580
seralaleuleuserseraspilethralaservalasncysalalys
859095
lysilevalseraspglyasnglymetasnalatrpvalalatrparg
100105110
asnargcyslysglythraspvalglnalatrpileargglycysarg
115120125
leu
- 还没有人留言评论。精彩留言会获得点赞!