一种防治大豆菌核病的生防细菌BA20及其应用的制作方法
本发明涉及蔬菜病害防治技术领域,更具体的说是涉及一种生防细菌ba20及其在防治大豆菌核病中的应用。
背景技术:
大豆菌核病属于世界性真菌病害,在世界各地广泛存在。该病害在国外主要分布于美国、阿根廷、加拿大、匈牙利、日本、印度等国,在国内主要于华北、华东、西南、东北等大豆产区爆发,以东北发病最为频繁严重。
大豆菌核病病原菌为核盘菌(sclerotiniasclerotiorum),能侵染苗期和成熟期大豆植株,主要以子囊孢子附着在大豆茎秆或叶片表面,再侵入到寄主体内,出现苗枯、茎腐、叶腐等症状,在田间湿度较大的情况下,被侵染的茎叶在发病处形成白色菌丝体,后变黑色菌核,菌核在土壤中、病残体内或混杂在种子内越冬,成为翌年初侵染来源。
化学药剂防治是一种快速有效的防治方法,特别是在土传病害和种子带菌传播的病害上,有着不可代替的作用;但长时间的使用不仅造成病原菌抗药性的增加,使药效降低,也会造成农药残留等环境污染及人体健康问题。特别是针对大豆菌核病,其主要发生在大豆生长中后期,而化学防治(生产上主要是种子包衣)一般只能控制苗期和中期,无法控制后期大豆菌核病的发生,导致后期大豆菌核病发病严重。
随着人们对环境保护意识的加深,生物防治在综合防治中所占的比例越来越重。国内外近年来有许多对于生物制剂的研究。张淑梅等应用枯草芽孢杆菌zh-2菌株的发酵菌剂进行了生防菌剂防治大豆菌核病的田间防效试验,结果表明生防菌剂100倍稀释液浸种和喷洒处理对大豆菌核病的田间防效达67.9%。
因此,提供一株对大豆菌核病防治效果好的生防细菌是本领域技术人员亟需解决的问题。
技术实现要素:
有鉴于此,本发明提供了一种能够用于防治大豆菌核病的解淀粉芽孢杆菌。
为了实现上述目的,本发明采用如下技术方案:
一种防治大豆菌核病的生防细菌ba20,其特征在于,属于解淀粉芽孢杆菌bacillusamyloliquefaciens,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址北京市朝阳区北辰西路1号院3号,保藏时间为2019年11月28日,保藏编号为cgmccno.19052。
生防细菌ba20或生防细菌ba20的发酵产物在防治大豆菌核病中的应用。
生防细菌ba20或生防细菌ba20的发酵产物在制备防治大豆菌核病的生防制剂中的应用。
进一步地,生防细菌ba20或生防细菌ba20的发酵产物抑制大豆菌核病病原菌核盘菌菌丝生长或造成大豆菌核病病原菌核盘菌菌丝畸形。
一种生防制剂,包括生防细菌ba20或生防细菌ba20的发酵产物。
由上述技术方案可知,本发明公开的解淀粉芽孢杆菌bacillusamyloliquefaciensba20能够有效抑制大豆菌核病病原菌的菌丝生长,并且能够造成大豆菌核病病原菌畸变,对于大豆菌核病具有良好的防治效果。
附图说明
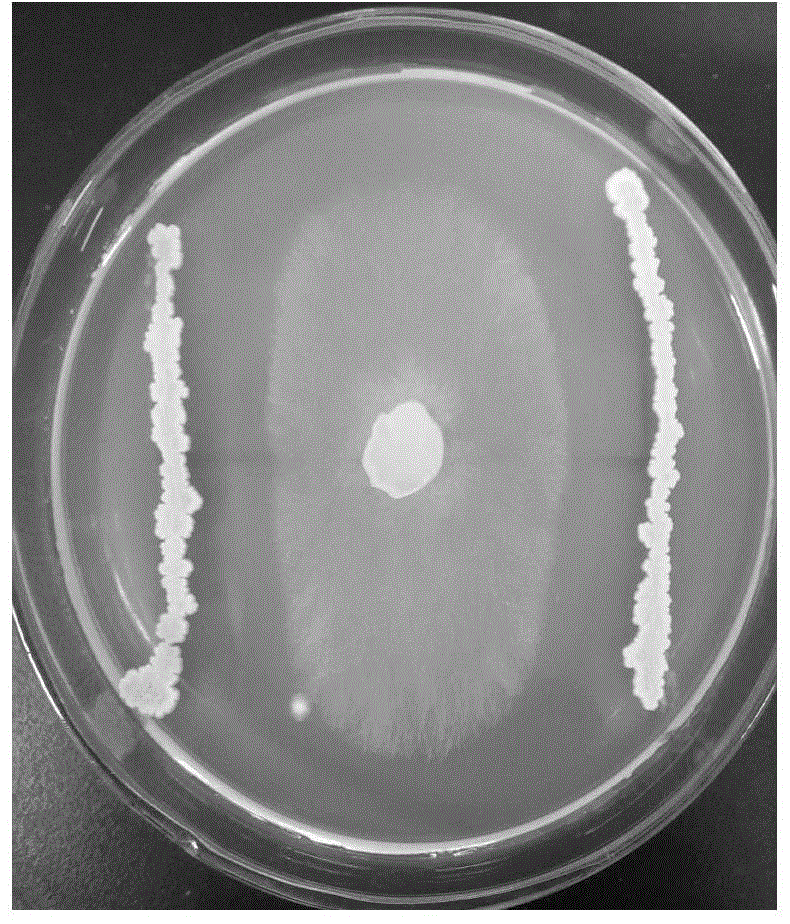
图1所示为ba20对大豆菌核病病原菌核盘菌的拮抗平板。
图2所示为ba20系统分育树分析。
图3所示为离体防效测定实验结果。
图4所示为ba20的次生代谢产物对大豆菌核病病原菌核盘菌菌丝形态学影响。
图5所示为ba20的次生代谢产物对大豆菌核病病原菌核盘菌超微结构的影响。
具体实施方式
下面对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1生防菌筛选
供试样品:土壤样品来自中国哈尔滨大豆种植区收集的大豆根际土。
供试方法:使用标准稀释平板法分离土壤样品中的细菌,通过单菌落分离纯化培养细菌分离株以测定其拮抗作用。
供试病原菌:大豆菌核病病原菌核盘菌(sclerotiniasclerotiorum)。
供试培养基:
马铃薯葡萄糖琼脂培养基(pda):土豆200g,葡萄糖20g,琼脂17-20g,水1000ml;ph7.0-7.2。
luria-bertani(lb)液体培养基:牛肉膏3.0g,蛋白胨10.0g,nacl10.0g;水1000ml,用于培养细菌。
测试细菌分离株对核盘菌的拮抗活性:
将大豆菌核病病原菌核盘菌在25℃下于马铃薯葡萄糖琼脂培养基(pda)上生长4天;用打孔器打取以菌落中点为圆心等距离(同龄)的菌丝体块,即为病原菌菌碟(d=0.7cm);将病原菌菌碟置于新的pda平板的中央。
细菌分离株分别在30℃的lb培养基中培养24h,然后用移菌钩蘸取细菌悬液在病原菌菌蝶两侧距离中心3cm处划线接种细菌(2条平行线/每个平板)。每个细菌分离株划2个平板,在无菌操作台晾干培养基表面的水分后,将pda平板放在26℃培养5d。
利用游标卡尺测量大豆菌核病病原菌核盘菌菌落的最长和最短半径,并且通过最长半径/最短半径量化细菌的拮抗活性。
共测试了获得的所有细菌分离株,其中5株对大豆菌核病病原菌核盘菌的体外研究显示出强烈的拮抗活性。分离株20号(命名为ba20)(图1)具有最强的拮抗活性,最长半径/最短半径比为2.53,部分筛选结果如表1和表2所示。
表1大豆菌核病病原菌核盘菌部分生防菌筛选结果
注:标有※的菌株为筛选出的对核盘菌具有较强拮抗作用(表2中的++++)的菌株。
表2生防菌初步筛选结果
注:++++:m≥2.0且min{rmax/rmin(1),rmax/rmin(2},rmax/rmin(3),rmax/rmin(4)}≥2.0的菌株;+++:m≥2.0且存在1次重复最长半径与最短半径比值小于2.0的菌株;++:m≥2.0且存在2次重复最长半径与最短半径比值小于2.0的菌株;+:m≥2.0且存在3次重复最长半径与最短半径比值小于2.0的菌株;_:m<2.0的菌株。
实施例2ba20的鉴定
ⅰ、传统形态学及生理生化反应鉴定
参照dongandcai的《常见细菌系统鉴定手册》,通过形态学,生理学和生物化学特征来鉴定拮抗菌株。
观察到的细菌形态包括:菌株在牛肉膏蛋白胨(nb)培养基菌落乳白色,圆形、中心稍隆起、表面透明、湿润;菌体呈杆状,具鞭毛,g+,有芽孢。
生理生化分析在相同的条件下重复两次试验,结果见表3。
表3细菌ba20生理生化分析
注:“+”表现阳性反应;“-”表现阴性反应。
ⅱ、分子鉴定
16srdna序列分析:使用细菌的基因组提取试剂盒(康维生物科技,北京,中国)提取ba20的基因组dna。通过使用细菌特异性引物27f(5’-agagtttgatcctggctcag-3’)和1492r(5’-taccttgttacgactt-3’)进行16srrna基因扩增。
扩增体系包括:0.1ngdna,2mmmgcl2,200μmdntp,200nm每种引物和0.25utaqdna聚合酶(invitrogencarlsbad,ca,usa),共25μl。
扩增程序为:94℃4min;94℃1min,54℃30秒,72℃2min,35个循环;最后延伸72℃10min。
使用qiaquickpcr纯化试剂盒(qiagen,germantown,md,usa)按照产品说明纯化pcr产物。pcr产物用dna级水稀释(fisherscientific,pittsburgh,pa,usa)并由上海生物工程有限公司测序。将序列与genbank数据库中可用的dna序列进行比较,一致性达99%,通过系统分育树分析(见图2),初步判定该ba20菌株为解淀粉芽孢杆菌(bacillusamyloliquefaciens)。
综上所述,从形态学、生理生化反应及分子生物学鉴定结果表明,ba20为解淀粉芽孢杆菌(bacillusamyloliquefaciens)。
实施例3防效的测定
(1)真菌扩繁
将大豆菌核病病原菌核盘菌菌丝块接种于pda平板中间,于26℃培养箱内培养5d后,备用。
(2)生防细菌扩繁
将菌株ba20接种于lb培养基中,30℃振荡培养12h,取1ml转移至含有100mllb的三角瓶中,30℃振荡培养120h。将液体培养基离心(5000rpm),并将细菌沉淀物重新悬浮于无菌蒸馏水(sdw)中,使用分光光度计(od600=0.1=108cfu/ml)通过测量od600将其调整至107cfu/ml,即为ba20菌悬液。
ba35为解淀粉芽孢杆菌,本课题组保存和备用,作为对照生防菌,扩繁方法同上,得到ba35菌悬液。
(3)离体防效测定
在2018年进行了离体防效试验,以评价ba20对由核盘菌引起的大豆菌核病的防治效果。
摘取生长30天大豆叶片,用70%的酒精消毒后,用无菌水冲洗干净;将步骤(2)ba20菌悬液使用无菌蒸馏水稀释成5%、10%和20%的体积分数,ba35菌悬液稀释成10%的体积分数,喷洒在大豆叶片表面;对照化学药剂使用45%菌核净水分散粒剂1000倍液;每处理3个叶片,3次重复,空白对照喷无菌水。待叶片表面水稍干燥(约15min),于叶片中心接种核盘菌菌蝶(直径0.7cm),将叶片均匀摆放在放有双层滤纸加水到饱和的培养皿中,然后置于光照培养箱中光/暗交替16h/8h、25℃培养,定期加水,保持培养皿内的湿度,待空白对照出现明显发病后,测定各处理叶片的面积。
(4)病害调查
当空白对照发病面积约80%以上,采用剪纸称重法,测定不同处理发病情况调查,计算防治效果如下,结果如表3所示。
病害防治效果(%)=(空白对照的发病面积重量-处理的发病面积重量)/(空白对照的发病面积重量)×100%。
表3ba20对大豆菌核病菌离体防效的测定
注:ba35为解淀粉芽孢杆菌作为对照生防菌株;化学杀菌剂为45%菌核净水分散粒剂;不同处理包括不同的剂量。se=标准差;根据duncan的多重范围检验,列后有不同字母的值有显著性差异(p<0.01和0.05)。
从表3和图3可以看出,与未处理的对照相比,各处理均存在显著差异,1×106cfu/ml和2×106cfu/ml的ba20的防效明显优于常用化学药剂,且2×106cfu/ml防效最好,可达100%。同时,与对照解淀粉芽孢杆菌ba35相比,ba20防治效果明显较好,能有效控制大豆菌核病病原菌核盘菌对叶片的侵染。
实施例4ba20次生代谢产物对大豆菌核病病原菌菌菌丝形态和超微结构的影响
(1)ba20无菌滤液的获得
细菌分离株ba20在lb培养基中30℃振荡培养过夜,取1ml转移到含有100mllb的三角瓶中,并在30℃下振荡(170rpm)温育120h。使用细菌过滤器(膜孔径为0.2μm直径)过滤ba20的发酵液以获得无菌滤液。然后,使用无菌滤液测定ba20次生代谢产物的抗菌机理。
(2)抗菌试验
取ba20无菌滤液分别使用lb无菌培养基稀释至5%、20%的体积分数。将培养5d的大豆菌核病病原菌核盘菌菌碟(d=0.7cm)接种在pda平板的中心,24h后刮取新鲜菌丝,将其浸泡在浓度5%和20%ba20无菌滤液中24h后,通过光学显微镜观察抑菌活性物质对菌丝形态的影响,对照用lb无菌培养基浸泡同等时间。
将在5%和20%ba20无菌滤液中浸泡24h的菌丝置于含2.5%的戊二醛的磷酸缓冲液(ph7.2)中固定2.5h,用0.1m磷酸缓冲液漂洗三次,每次15min,然后用1%锇酸固定液固定2.5h后,再次漂洗。样品经系列乙醇液逐级脱水后用树脂包埋。使用钻石刀切成的超薄切片,经醋酸铀和枸橼酸铅双染色后,于透射电镜下进行灰霉菌丝超微结构的观察,以判断抑菌活性物质对大豆菌核病病原菌核盘菌菌丝超微结构的影响。
从图4可以看出,通过光学显微镜观察,未经ba20无菌滤液处理的对照组菌丝表面平滑,隔膜间隔较大,原生质疏散,菌丝生长点大小均匀;经ba20无菌滤液处理后,菌丝膨胀部位失水畸形,原生质聚集,菌丝间隔膜变短,菌丝生长点膨大,且ba20无菌滤液浓度与菌丝变化程度成正比。
如图5所示,透射电镜观察发现,对照组菌丝内部有各种细胞器,这些细胞器结构完整,均匀分布在细胞质中,其细胞壁厚度均匀一致且无破损;经5%体积分数的ba20无菌滤液处理后,细胞器有缺损,胞质不均匀;20%体积分数的ba20无菌滤液处理后,细胞质坏死,细胞器崩解。
本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。
- 还没有人留言评论。精彩留言会获得点赞!