热稳定性提高的酮糖3-差向异构酶的制作方法
本发明涉及热稳定性提高的新型酮糖3-差向异构酶及其制备方法。
背景技术:
:d-阿洛酮糖(d-プシコース,d-psicose)作为自然界中仅微量存在的稀有糖的一种而已知,其甜度为砂糖的约70%,因此被用作甜味剂。还已知d-阿洛酮糖的热量值几乎接近于零,具有抑制血糖值升高等各种生理功能,作为具有功能性的食品原材料而受到关注。由于这样的情况,在食品工业中,对d-阿洛酮糖的有效且安全的生产方法的需求日益增加。另一方面,由于d-阿洛酮糖是d-果糖的差向异构体,因此建立了使d-阿洛酮糖3-差向异构酶与d-果糖发生作用的生产方法。例如,公开了源自球形节杆菌(arthrobacterglobiformis)m30的酮糖3-差向异构酶(专利文献1)或源自根癌农杆菌(agrobacteriumtumefaciens)的d-阿洛酮糖3-差向异构酶(专利文献2)。另外,为了维持生产效率而抑制由温度引起的酶变性,使得热稳定性提高的源自根癌农杆菌的阿洛酮糖(サイコース/プシコース)差向异构体化酶突变体(专利文献3)或源自伯克霍尔德菌(burkholderia)的d-阿洛酮糖3-差向异构酶突变体(专利文献4)被用于d-阿洛酮糖的生产。现有技术文献专利文献专利文献1:国际公开2014/109254号公报;专利文献2:日本特表2008-541753号公报;专利文献3:日本特表2016-518135号公报;专利文献4:cna106350498号公报。技术实现要素:发明所要解决的课题如上所述,关于通过使d-阿洛酮糖3-差向异构酶等酶发生作用而进行的d-阿洛酮糖的生产方法提出了各种各样的办法,但作为源自像球形节杆菌这样的食品安全性已被认可的菌种的d-阿洛酮糖的生产酶、且热稳定性提高的酶的制造方法尚未确立。另外,虽然源自球形节杆菌的酮糖3-差向异构酶的最佳温度在镁(mg2+)存在的条件下为60~80℃,但若在反应温度超过50℃的状态下长时间进行反应,则酶活性慢慢降低,存在着d-阿洛酮糖的生产减少的课题。用于解决课题的手段本发明人在对使酶发生作用来生产d-阿洛酮糖的方法进行各种研究时发现了:在源自球形节杆菌的酮糖3-差向异构酶的氨基酸序列中,通过取代特定的氨基酸,可得到热稳定性提高的突变酶,且发现了可有效地生产d-阿洛酮糖。更具体而言,发现了可得到酮糖3-差向异构酶突变体,该突变体在seqidno:1所表示的源自球形节杆菌的野生型酮糖3-差向异构酶的氨基酸序列内具有至少1个氨基酸突变,且(1)70℃下的酶活性(t70)与50℃下的酶活性(t50)之比t70/t50显示出较野生型酮糖3-差向异构酶的t70/t50高的值;或者(2)在以未处理的酶在50℃下的活性为100的情况下,在50mm磷酸缓冲液(ph8.0、包含2mm的硫酸镁)悬浮液中,60℃下进行了1小时处理的相同的酶在50℃下的残留酶活性a显示出较野生型酮糖3-差向异构酶的a高的值。即,本发明是根据上述见解而完成的,由以下的(1)~(9)构成。<1>酮糖3-差向异构酶突变体,该突变体在seqidno:1所表示的源自球形节杆菌的野生型酮糖3-差向异构酶的氨基酸序列内具有至少1个氨基酸突变,且(1)70℃下的酶活性(t70)与50℃下的酶活性(t50)之比t70/t50显示出较野生型酮糖3-差向异构酶的t70/t50高的值;或者(2)在以未处理的酶在50℃下的活性为100的情况下,在50mm磷酸缓冲液(ph8.0、包含2mm的硫酸镁)悬浮液中,60℃下进行了1小时处理的相同的酶在50℃下的残留酶活性a显示出较野生型酮糖3-差向异构酶的a高的值。<2>上述<1>所述的酮糖3-差向异构酶突变体,其中,t70/t50为1.0以上。<3>上述<1>或<2>所述的酮糖3-差向异构酶突变体,其中,残留酶活性a为40以上。<4>上述<1>~<3>中任一项所述的酮糖3-差向异构酶突变体,其中,野生型酮糖3-差向异构酶的氨基酸序列内的至少1个氨基酸突变为1~10个位置的氨基酸取代。<5>上述<1>所述的酮糖3-差向异构酶突变体,其中,野生型酮糖3-差向异构酶的氨基酸序列内的至少1个氨基酸突变存在于从seqidno:1的氨基酸序列的氨基末端数起的下述的任意一个位置:6、14、22、26、34、67、68、69、70、75、91、95、100、101、110、122、137、144、160、173、177、181、200、203、214、222、226、237、261、270、271、275、278、281和289。<6>酮糖3-差向异构酶突变体,其中,酮糖3-差向异构酶突变体选自从seqidno:1的氨基酸序列的氨基末端数起在下述的位置具有突变的突变体:酮糖3-差向异构酶突变体从seqidno:1的氨基酸序列的氨基末端数起的突变位置11442137和173326421451461227271和278867、68、69和7092210160和28911160、271、278和2891222、67、68、69、70、160和2891322、67、68、69、70、160、177和28914222152781620017177、181和20318160、226和2891923720270和28121275和27822177、200、237、275和278237524100和101252612675、177和237276和17728110和1772967、69和703022和34319132953313734270<7>上述<6>所述的酮糖3-差向异构酶突变体,其中,酮糖3-差向异构酶突变体进一步选自下述突变体:酮糖3-差向异构酶突变体seqidno:1的氨基酸序列内的突变pm3s144cpm4s137c和n173cpm5t26cpm9l214ppm12f14wpm14l122ypm15l122wpm17h271c和d278cpm18s67p、d68a、a69d和t70gpm19s22tpm23r160a和h289vsarhkppm26r160a、h271c、d278c和h289vsarhkppm28s22t、s67p、d68a、a69d、t70g、r160a和h289vsarhkppm29s22t、s67p、d68a、a69d、t70g、r160a、h177m和h289vsarhkppm31d222hpm32d278fpm33a200lpm36h177m、y181f和y203qpm37r160a、h289vsarhkp和k226dpm38v237ipm39a200kpm40a270c和t281cpm41f275c和d278cpm43h177m、a200k、v237i、f275c和d278cpm44e75ppm45t100p和d101vpm46l261mpm48r160a和h289vsarpm51e75p、h177m和v237ipm55r160a和h289vsarhkpm56h6y和h177mpm57m110w和h177mpm58s67p、a69d和t70gpm59s22t和v34ipm60d278lpm61v237lpm62v91ipm63a95rpm64s137kpm65a270k<8>上述<6>所述的酮糖3-差向异构酶突变体,其中,酮糖3-差向异构酶突变体进一步选自下述突变体:酮糖3-差向异构酶突变体seqidno:1的氨基酸序列内的突变pm4s137c和n173cpm17h271c和d278cpm18s67p、d68a、a69d和t70gpm23r160a和h289vsarhkppm26r160a、h271c、d278c和h289vsarhkppm29s22t、s67p、d68a、a69d、t70g、r160a、h177m和h289vsarhkppm32d278fpm33a200lpm38v237ipm39a200kpm41f275c和d278cpm43h177m、a200k、v237i、f275c和d278cpm44e75ppm45t100p和d101vpm48r160a和h289vsarpm51e75p、h177m和v237ipm55r160a和h289vsarhkpm57m110w和h177mpm58s67p、a69d和t70gpm60d278lpm61v237lpm63a95rpm65a270k<9>上述<1>~<8>中任一项所述的酮糖3-差向异构酶突变体,该突变体固定在固定化载体上。<10>d-酮糖的制备方法,其特征在于:使上述<1>~<8>中任一项所述的酮糖3-差向异构酶突变体或<9>所述的固定化的酮糖3-差向异构酶突变体与d-果糖发生作用。发明效果本发明可提供:与野生型相比热稳定性提高的、作为源自食品安全性已被认可的球形节杆菌的d-阿洛酮糖的生产酶的酮糖3-差向异构酶突变体。由于本发明的热稳定性提高的源自球形节杆菌的酮糖3-差向异构酶突变体可在高于50℃的温度下较长时间维持酶活性,因此通过使其与底物d-果糖发生作用,与现有的源自球形节杆菌的酮糖3-差向异构酶(野生型)相比,可有效地生产d-阿洛酮糖。附图说明[图1]显示从反应塔的运转开始起第42天的各固定化酶的残留活性。具体实施方式(球形节杆菌)本发明中利用的酮糖3-差向异构酶的野生型酶源自球形节杆菌。在食品工业中,该细菌的安全性已被确认。在美国,该细菌作为“源自固定化球形节杆菌的葡萄糖异构酶(glucoseisomerasefromimmobilizedarthrobacterglobiformis)”被收录于fda的eafus(everythingaddedtofoodintheunitedstates,美国食品添加剂):食品添加剂数据库(afoodadditivedatabase)中。由于该使用方法是将菌体直接固定化,因此证明了菌体本身的安全性非常高。另外,在欧州,由effca(theeuropeanfood&feedculturesassociation,欧洲食品与饲料菌种协会)和ifd(internationalfederationfortheroofingtrade,国际屋面联合会)在“有文献记载的用于食品的微生物名单(inventoryofmicroorganismswithadocumentedhistoryofuseinfood)”中记载了被用作“柑橘发酵以除去柠檬苦素并减少苦味(citrusfermentationtoremovelimoninandreducebitterness)”的要点。这显示了该菌种与酵母等同样地用于发酵,并显示了该菌种的安全性非常高。在日本,节杆菌(arthrobacter)属作为“α-淀粉酶、异麦芽糖葡聚糖酶(isomaltodextrase)”等的酶基原微生物被收录于食品添加剂清单中。如此,在日本、欧美有长期使用的实际成绩,节杆菌属可谓是安全性高的菌种。(酮糖3-差向异构酶)(1)本发明中使用的野生型酮糖3-差向异构酶源自球形节杆菌。优选源自球形节杆菌m30(保藏编号nitebp-1111),且具有下述氨基酸序列(seqidno:1)。另外,本发明的野生型酮糖3-差向异构酶优选为具有下述(a)、(b)的底物特异性、并且具有下述(a)~(f)的理化性质的酮糖3-差向异构酶。(seqidno:1)1 mkigchglvwtghfdaegirysvqktreagfdlvefplmdpfsfdvqtak;51 salaehglaasaslglsdatdvssedpavvkageellnravdvlaelgat;101 dfcgviysamkkymepataaglanskaavgrvadrasdlginvslevvnr;151 yetnvlntgrqalayleelnrpnlgihldtyhmnieesdmfspildtaea;201 lryvhigeshrgylgtgsvdfdtffkalgrigydgpvvfesfsssvvapd;251lsrmlgiwrnlwadneelgahanafirdkltaiktielh。野生型酮糖3-差向异构酶的底物特异性:(a)将d-或l-酮糖的3位进行差向异构化,生成对应的d-或l-酮糖。(b)在d-或l-酮糖中,对d-果糖和d-阿洛酮糖的底物特异性最高。野生型酮糖3-差向异构酶的理化性质:(a)分子量通过sds‐page测定的亚单位的分子量为约32kda,通过凝胶过滤法测定的分子量为120kda、亚单位的分子量为32kda的同源四聚体(homotetramer)结构。(b)最佳ph在30℃、反应30分钟、20mm的镁(mg2+)存在的条件下为6~11。(c)最佳温度在ph7.5、反应30分钟、20mm的镁(mg2+)存在的条件下为60~80℃。(d)ph稳定性在4℃、保持24小时的条件下至少在ph5~11的范围内稳定。(e)热稳定性在ph7.5、保持1小时、4mm的镁离子(mg2+)存在的条件下在约50℃以下稳定。在镁离子(mg2+)不存在的条件下在约40℃以下稳定。(f)通过金属离子的活化通过二价锰离子(mn2+)、二价钴离子(co2+)、钙(ca2+)和镁离子(mg2+)进行活化。(酮糖3-差向异构酶突变体)本发明的酮糖3-差向异构酶突变体在seqidno:1所表示的源自球形节杆菌的野生型酮糖3-差向异构酶的氨基酸序列内具有至少1个氨基酸突变,且(1)70℃下的酶活性(t70)与50℃下的酶活性(t50)之比t70/t50显示出较野生型酮糖3-差向异构酶的t70/t50高的值;或者(2)在以未处理的酶在50℃下的活性为100的情况下,在50mm磷酸缓冲液(ph8.0、包含2mm的硫酸镁)悬浮液中,60℃下进行了1小时处理的相同的酶在50℃下的残留酶活性a显示出较野生型酮糖3-差向异构酶的a高的值。本发明的突变型酮糖3-差向异构酶是以野生型的酮糖3-差向异构酶的氨基酸序列为基础,通过将一部分氨基酸序列取代成特定的氨基酸序列而得到的。通过取代表1所示的各位置的氨基酸得到酶突变体,对各突变体试验其热稳定性实际上是否提高。其结果,可得到突变体,该突变体在seqidno:1所表示的源自球形节杆菌的野生型酮糖3-差向异构酶的氨基酸序列内具有至少1个氨基酸突变,且(1)70℃下的酶活性(t70)与50℃下的酶活性(t50)之比t70/t50显示出较野生型酮糖3-差向异构酶的t70/t50高的值;或者(2)在以未处理的酶在50℃下的活性为100的情况下,在50mm磷酸缓冲液(ph8.0、包含2mm的硫酸镁)悬浮液中,60℃下进行了1小时处理的相同的酶在50℃下的残留酶活性a显示出较野生型酮糖3-差向异构酶的a高的值。(1)70℃下的酶活性(t70)与50℃下的酶活性(t50)之比t70/t50可如下求得:例如以d-阿洛酮糖(含有2mm的mg2so4的50mm磷酸缓冲液(ph8.0)溶液)为底物,使酮糖3-差向异构酶在50℃或70℃下反应10分钟,测定作为反应产物的d-果糖,从而可求出差向异构酶活性。更具体而言,反应停止后,将反应液供给hplc,由50℃和70℃的作为底物的d-阿洛酮糖与作为反应产物的d-果糖的峰面积比即可算出酶活性。如此操作而算出的上述突变型酮糖3-差向异构酶的t70/t50优选为0.70以上,更优选为0.80以上,进一步优选为1.0以上,更进一步优选为1.5以上。(2)在以未处理的酶在50℃下的活性为100的情况下,在50mm的磷酸缓冲液(ph8.0、包含2mm硫酸镁)悬浮液中,60℃下进行了1小时处理的相同的酶在50℃下的残留酶活性a可如下求得:例如,将酶制成50mm的磷酸缓冲液(ph8.0、包含2mm硫酸镁)悬浮液,在60℃下处理1小时,之后以d-阿洛酮糖为底物,在50℃下反应10分钟,测定其差向异构酶活性,即可求得残留酶活性a。更具体而言,反应停止后,将反应液供给hplc,由作为底物的d-阿洛酮糖与作为反应产物的d-果糖的峰面积比即可算出未处理的酶和60℃下进行了1小时处理的酶的酶活性。在以seqidno:1的野生型酮糖3-差向异构酶的酶活性为100的情况下,上述突变型酮糖3-差向异构酶的残留酶活性a优选为40以上,更优选为50以上,进一步优选为60以上,更进一步优选为70以上。seqidno:1所表示的源自球形节杆菌的野生型酮糖3-差向异构酶的氨基酸序列内的至少1个氨基酸突变只要显示出上述活性即可,可以是至少1个突变,而且,优选为1~10个位置的氨基酸的取代,更优选为1~8个位置的氨基酸的取代。而且,野生型酮糖3-差向异构酶的氨基酸序列内的至少1个氨基酸突变优选存在于从seqidno:1的氨基酸序列的氨基末端数起的下述的任意一个位置。位置:6、14、22、26、34、67、68、69、70、75、91、95、100、101、110、122、137、144、160、173、177、181、200、203、214、222、226、237、261、270、271、275、278、281和289。而且,野生型酮糖3-差向异构酶的氨基酸序列内的至少1个氨基酸突变更优选存在于从seqidno:1的氨基酸序列的氨基末端数起的下述的任意一个位置。位置:6、14、22、26、34、67、68、69、70、75、91、95、100、101、110、122、137、144、160、173、177、200、214、222、237、261、270、271、275、278、281和289。在各位置通过取代而插入的氨基酸的种类只要满足上述的t70/t50或残留酶活性a即可,可以是任何氨基酸。通常,优选将1个氨基酸用另一个氨基酸取代,但在羧基末端可将1个氨基酸用1~10个连续的氨基酸取代。酮糖3-差向异构酶突变体更优选选自在下述的位置具有氨基酸取代的突变体。酮糖3-差向异构酶突变体从seqidno:1的氨基酸序列的氨基末端数起的突变位置11442137和173326421451461227271和278867、68、69和7092210160和28911160、271、278和2891222、67、68、69、70、160和2891322、67、68、69、70、160、177和28914222152781620017177、181和20318160、226和2891923720270和28121275和27822177、200、237、275和278237524100和101252612675、177和237276和17728110和1772967、69和703022和34319132953313734270酮糖3-差向异构酶突变体更进一步优选选自在下述的位置具有氨基酸取代的突变体。酮糖3-差向异构酶突变体从seqidno:1的氨基酸序列的氨基末端数起的突变位置11442137和1735147271和278867、68、69和7010160和28911160、271、278和2891222、67、68、69、70、160和2891322、67、68、69、70、160、177和28915278162001923721275和27822177、200、237、275和278237524100和1012675、177和237276和17728110和1772967、69和703022和34319132953313734270更进一步优选显示出较野生型提高的热稳定性的突变体具有下述所示的氨基酸取代。在本说明书中,例如r160a表示从seqidno:1的氨基末端起第160位的精氨酸(r)被丙氨酸(a)取代。h289vsarhkp表示从seqidno:1的氨基末端起第289位的组氨酸(h)被vsarhkp的序列取代。酮糖3-差向异构酶突变体seqidno:1的氨基酸序列内的突变pm3s144cpm4s137c和n173cpm5t26cpm9l214ppm12f14wpm14l122ypm15l122wpm17h271c和d278cpm18s67p、d68a、a69d和t70gpm19s22tpm23r160a和h289vsarhkppm26r160a、h271c、d278c和h289vsarhkppm28s22t、s67p、d68a、a69d、t70g、r160a和h289vsarhkppm29s22t、s67p、d68a、a69d、t70g、r160a、h177m和h289vsarhkppm31d222hpm32d278fpm33a200lpm36h177m、y181f和y203qpm37r160a、h289vsarhkp和k226dpm38v237ipm39a200kpm40a270c和t281cpm41f275c和d278cpm43h177m、a200k、v237i、f275c和d278cpm44e75ppm45t100p和d101vpm46l261mpm48r160a和h289vsarpm51e75p、h177m和v237ipm55r160a和h289vsarhkpm56h6y和h177mpm57m110w和h177mpm58s67p、a69d和t70gpm59s22t和v34ipm60d278lpm61v237lpm62v91ipm63a95rpm64s137kpm65a270k上述突变体中,作为进一步优选的酮糖3-差向异构酶突变体,可列举:pm3、pm4、pm5、pm9、pm12、pm14、pm17、pm18、pm19、pm23、pm26、pm28、pm29、pm31、pm32、pm33、pm38、pm39、pm41、pm43、pm44、pm45、pm46、pm48、pm51、pm55、pm56、pm57、pm58、pm59、pm60、pm61、pm62、pm63、pm64和pm65。上述突变体中,作为更进一步优选的酮糖3-差向异构酶突变体,可列举:pm4、pm17、pm18、pm23、pm26、pm29、pm32、pm33、pm38、pm39、pm41、pm43、pm44、pm45、pm48、pm51、pm55、pm57、pm58、pm60、pm61、pm63和pm65。上述突变体中,特别优选:pm17、pm23、pm26、pm29、pm32、pm38、pm39、pm41、pm43、pm51、pm57、pm60、pm61和pm65。本发明的酮糖3-差向异构酶突变体在野生型酮糖3-差向异构酶的氨基酸序列内的至少1个氨基酸(更具体而言,是指seqidno:1的氨基酸序列内的至少1个氨基酸)的任意一个位置,可通过适当使用已知的方法进行取代。例如,可得到通过已知的基因工程学方法进行了目标位置的氨基酸取代的突变体。另外,本发明的酮糖3-差向异构酶突变体可如下制备:例如使用编码各突变体的氨基酸序列的核酸配列或者将插入有导入了酮糖3-差向异构酶突变的dna片段的质粒载体导入到大肠杆菌(宿主)等中,得到目标转化体来进行制备。对使用的重组载体的种类没有特别限定,可以是该
技术领域:
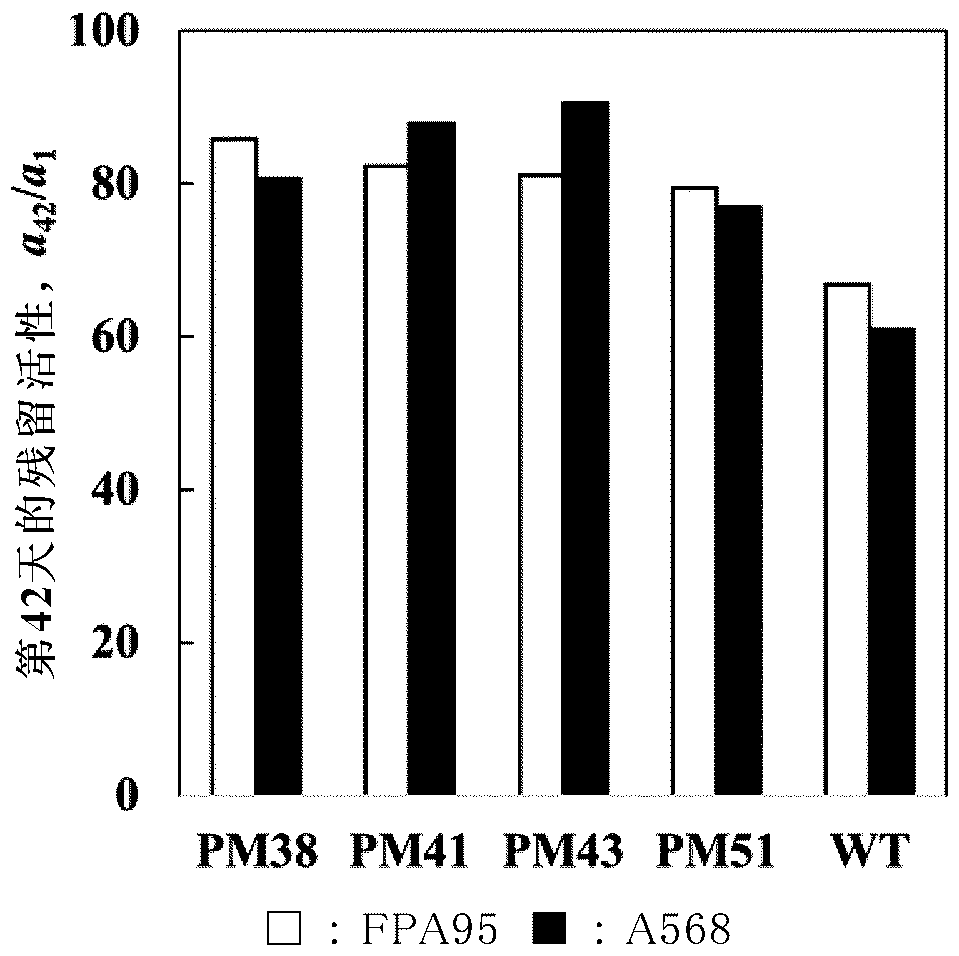
通常使用的载体。另外,生产酮糖3-差向异构酶的重组体可使用大肠杆菌、芽孢杆菌(bacillus,杆菌)、酵母或农杆菌。本发明的酮糖3-差向异构酶突变体可将粗酶或纯化酶以液态酶的形式使用,也可利用已知的固定化手段、例如载体结合法、交联法、凝胶包埋法等以固定化酶的形式使用。在利用载体结合法的情况下,可使用已知的固定化载体、例如离子交换树脂、合成吸附剂、活性炭、多孔性玻璃或硅胶。在固定化载体中使用离子交换树脂的情况下,例如可使用酚醛系凝胶型弱碱性离子交换树脂或苯乙烯系大孔型弱碱性离子交换树脂。在本发明中,可使用这些离子交换树脂的市售品,作为酚醛系凝胶型弱碱性离子交换树脂的市售品,可列举:duolitea561、duolitea568、duolitepwa7(以上,由dowdupont公司制造)等。另外,作为苯乙烯系大孔型弱碱性离子交换树脂的市售品,可列举amberlitefpa95、amberliteira904、amberlitexe583(以上,由dowdupont公司制造)、purolitea111s、purolitea103s(以上,由purolite公司制造)、diaionwa20、diaionwa30(以上,由三菱化学公司制造)等。可使用本发明的酮糖3-差向异构酶突变体或固定化的本发明的酮糖3-差向异构酶突变体,有效地生产d-阿洛酮糖。更具体而言,例如在使用固定化的本发明的酮糖3-差向异构酶突变体的情况下,可使d-果糖水溶液连续地通过填充有该突变体的反应塔,从而得到一部分d-果糖被转换成了d-阿洛酮糖的d-果糖和d-阿洛酮糖的混合水溶液,之后利用已知的方法施行脱色/脱盐/色谱分离(chromatographicfractionation),从而生产高纯度的d-阿洛酮糖水溶液。之后,还可进一步利用已知的方法生产结晶d-阿洛酮糖。在使d-果糖水溶液通过反应塔时,d-果糖水溶液期望加热至50~80℃,其浓度期望为30~70wt%,期望用氢氧化钠等ph调节剂调整至ph6~9。另外,使d-果糖水溶液通过反应塔时的流速,期望调节成由d-果糖向d-阿洛酮糖的转换率达到接近于酶的反应平衡的20%以上。另外,可包含各种离子、例如10~100ppm的镁离子或50~500ppm的亚硫酸离子作为酶的活化剂和稳定剂。以下,通过实施例来更详细地说明本发明,但本发明的内容并不限于这些实施例。(实施例)<酮糖3-差向异构酶的氨基酸序列内的取代部位的选定>首先,为了选定与酮糖3-差向异构酶的活性和热稳定性有关的氨基酸序列,通过blast检索了与源自该菌株的酮糖3-差向异构酶的同源性高的一次结构(氨基酸序列)。其结果,得到了与酮糖3-差向异构酶的同源性高的12种酶的一次结构信息。由于源自该菌株的酶的立体结构尚未确定,所以无法利用其信息。于是,从上述12种中选定了立体结构(三维结构)已明确的酶种,使用swiss-model和能量最小化计算来构建目标酶的推断立体结构的模型。通过比较该模型结构和类似酶的结构,检索/抽取该酶中的有助于结构稳定性的部位,进行了认为在物理化学上能热稳定酶的立体结构的氨基酸的改变。选定表1所示的各位置作为预期会使热稳定性提高的特定的氨基酸序列位置,将其取代成特定的氨基酸序列。转换成特定的氨基酸序列是指,例如取代成预测在提高疏水性相互作用、肽主链的环结构的稳定化、基于二硫键的氨基酸间的共价键导入、提高空间密度、基于伸长蛋白c末端的缔合体稳定化等方面具有效果的氨基酸序列(表1)。<表1>酮糖3-差向异构酶突变体seqidno:1的氨基酸序列内的突变pm3s144cpm4s137c和n173cpm5t26cpm9l214ppm12f14wpm14l122ypm15l122wpm17h271c和d278cpm18s67p、d68a、a69d和t70gpm19s22tpm23r160a和h289vsarhkppm26r160a、h271c、d278c和h289vsarhkppm28s22t、s67p、d68a、a69d、t70g、r160a和h289vsarhkppm29s22t、s67p、d68a、a69d、t70g、r160a、h177m和h289vsarhkppm31d222hpm32d278fpm33a200lpm36h177m、y181f和y203qpm37r160a、h289vsarhkp和k226dpm38v237ipm39a200kpm40a270c和t281cpm41f275c和d278cpm43h177m、a200k、v237i、f275c和d278cpm44e75ppm45t100p和d101vpm46l261mpm48r160a和h289vsarpm51e75p、h177m和v237ipm55r160a和h289vsarhkpm56h6y和h177mpm57m110w和h177mpm58s67p、a69d、t70gpm59s22t和v34ipm60d278lpm61v237lpm62v91ipm63a95rpm64s137kpm65a270k<表达载体的制作和大肠杆菌的转化>首先,根据包含进行了表1中记载的1个或2个以上的取代的氨基酸序列的酮糖3-差向异构酶的dna,通过pcr法或基因合成服务(thermofisherscientific公司)进行突变导入。将已导入突变的dna片段插入到大肠杆菌表达用的pqe60(qiagen公司)载体中,转化大肠杆菌(宿主)。突变导入部位通过序列分析来确认。<粗酶溶液的调制>首先,将表达酮糖3-差向异构酶突变酶的转化体(大肠杆菌)接种(植菌)于包含100μg/ml的氨苄青霉素和50μg/ml的卡那霉素的lb培养基(培养液)中,在37℃下预培养16小时。将该预培养液添加到包含0.1mmiptg的10~100倍量的正式培养液中,在20℃下培养24小时,诱导目标的酶表达。接下来,利用离心分离机将正式培养液在4℃、5,500×g下离心20分钟。离心后,除去上清,回收菌体。将所回收的菌体悬浮于适当量的50mm磷酸缓冲液(ph8.0、包含2mm的硫酸镁)中,以45秒的间隔进行6个循环的15秒的超声波粉碎。之后,在4℃、5,500×g下离心20分钟,取出上清,得到粗酶溶液。通过上述方法得到表1的各突变酶的粗酶溶液,将其用于酶活性的评价。<粗酶溶液的活性评价>(i)70℃下的酶活性(t70)与50℃下的酶活性(t50)之比t70/t50的比较酮糖3-差向异构酶的酶反应是平衡反应,在平衡状态下大致为d-阿洛酮糖:d-果糖=30:70,所以在以d-阿洛酮糖为底物的情况下,d-果糖的生成量容易测定。因此,酮糖3-差向异构酶活性的评价通过测定在以d-阿洛酮糖为底物进行酶反应的情况下所产生的d-果糖的生成量来进行。具体而言,使用通过上述方法得到的各粗酶溶液,在表2所示的反应条件下进行酶反应。反应停止后,通过基于离子交换树脂的脱盐来纯化反应液,进行过滤处理,供试给hplc(hplc系统(tosoh公司制造)、mcigelck08ec(三菱化学公司制造))。算出通过hplc测定的d-果糖的峰面积,由50℃和70℃的峰面积比算出各酶活性。1单位的酶活性定义为:在各条件下,将d-阿洛酮糖进行差向异构化,1分钟生成1μmol的d-果糖的酶量。所得结果见表4。<表2>测定的结果,由表4可见t70/t50比野生型的活性值(0.7±0.1)高的突变酶。这些突变酶暗示了热稳定性的提高。如上所述,选定表1所示的各位置作为预期会使热稳定性提高的特定的氨基酸序列位置,进行了氨基酸序列的取代,但在所制作的突变体中,热稳定性没有太大变化、甚至有时还下降,得到了与预期相反的结果。(ii)在以未处理的酶在50℃下的活性为100的情况下,在50mm磷酸缓冲液(ph8.0、包含2mm的硫酸镁)悬浮液中,60℃下进行了1小时处理的相同的酶在50℃下的残留酶活性a的比较接下来,测定在60℃下静置1小时的热处理后的酶的残留活性。使用通过上述得到的粗酶溶液,在以下的表3所示的条件下,以d-阿洛酮糖为底物,使热处理后的酶发生反应。酶反应停止后,将在冰水中冷却了10分钟的反应液通过基于离子交换树脂的脱盐进行纯化,供试给hplc。算出通过hplc测定的d-阿洛酮糖的峰面积,并算出热处理后和未处理的酶在50℃下的酶活性。热处理后的残留酶活性作为以未处理的酶活性为100的情况下的相对活性来算出。所得结果见表4。<表3>其结果,由表4可见残留酶活性a超过了野生型酶的残留酶活性值的突变酶。暗示了这些酶的热稳定性高。<表4>t70/t50残留酶活性野生型0.7±0.135.1pm30.7737.6pm40.8249.8pm50.7733.5pm90.7129.6pm120.7737.5pm140.7331.2pm150.5729.6pm171.2592.9pm180.9148.4pm190.7822.9pm231.5269.9pm261.5993.0pm280.9322.1pm291.5050.0pm310.7330.9pm321.60100.0pm330.9260.0pm360.4719.1pm370.4125.4pm381.6690.9pm391.0163.2pm400.3822.8pm411.0883.9pm431.4186.0pm440.8452.9pm450.7753.0pm460.7627.6pm480.5246.1pm511.3283.6pm551.2462.9pm560.8133.5pm572.5460.9pm580.9043.7pm590.9920.8pm602.53100.0pm611.6790.8pm620.8530.9pm630.8440.0pm640.9238.4pm651.4686.4与野生型相比,上述突变体中,特别是pm3、pm4、pm5、pm9、pm12、pm14、pm17、pm18、pm19、pm23、pm26、pm28、pm29、pm31、pm32、pm33、pm38、pm39、pm41、pm43、pm44、pm45、pm46、pm48、pm51、pm55、pm56、pm57、pm58、pm59、pm60、pm61、pm62、pm63、pm64和pm65的t70/t50或残留酶活性a优异。另外,这些之中,与野生型相比,特别是pm4、pm17、pm18、pm23、pm26、pm29、pm32、pm33、pm38、pm39、pm41、pm43、pm44、pm45、pm48、pm51、pm55、pm57、pm58、pm60、pm61、pm63和pm65的t70/t50为1.0以上或者残留酶活性a为40以上而优异。而且,相对于野生型的t70/t50或残留酶活性a的数值,pm17、pm23、pm26、pm29、pm32、pm38、pm39、pm41、pm43、pm51、pm57、pm60、pm61和pm65显示出2倍以上的活性,特别优异。<固定化酶的制作>1.利用与上述的<粗酶溶液的调制>中记载的方法相同的方法,得到了pm38/41/43/51/野生型(以下,记作wt)的粗酶溶液。按照上述的<粗酶溶液的活性评价>和<表2>中记载的方法和条件测定了各粗酶溶液的酶活性。2.将用包含2mm硫酸镁的50mm的磷酸缓冲液(ph8.0)进行洗涤并平衡化的固定化载体(离子交换树脂amberlitefpa95或duolitea568(均由dowdupont公司制造))和粗酶溶液以相对于1ml的固定化载体粗酶溶液的酶活性为630u的比例在小瓶中混合,并颠倒混合24小时以上。3.通过以上的方法制作的固定化酶用包含2mm硫酸镁的50mm的磷酸缓冲液(ph8.0)洗涤后,在4℃的冰箱中保存直至使用。<连续反应>以下的实验操作依据jisk7002:1988(工业用葡萄糖异构酶)来实施。1.在加热至55℃的反应塔(φ18mm×l400mm)中填充29ml的固定化酶,向反应塔中供应反应原料(包含50wt%的果糖、240ppm的mgso4和150ppm的na2so3)。2.来自反应塔的流出液每1天存储起来,并实施hplc分析(与<粗酶溶液的活性评价>同样的方法),算出hplc色谱图中的阿洛酮糖和果糖的面积apsi和afru。3.适当调节反应原料的流速,使式(1)所表示的异构化率x达到20%以上。x=apsi/(apsi+afru) (1)4.固定化酶的酶活性a通过式(2)算出。a=f/vcsxeln(xe/(xe﹣x)) (2)式中,f为底物的流速,cs为底物浓度,xe为表观平衡反应率(0.29),v为固定化酶的床体积。从反应塔运转开始起第42天的酶活性a42与运转开始第1天的酶活性a1之比(以下,记作第42天的残留活性)见图1。wt的第42天的残留活性为60%左右,而pm38/41/43/51的第42天的残留活性为80%左右,通过42天的运转引起的酶活性的下降幅度小。这表示活性下降缓慢。在阿洛酮糖的实际生产中,反应塔往往是在50℃以上的温度下长时间(数月~数年左右)运转。这种情况下,酶活性慢慢下降,阿洛酮糖的产量下降。由于本实施例中采用的突变体的活性下降缓慢,所以阿洛酮糖产量也不易下降,在工业上有用。由以上结果可知:与现有的野生型酶相比,本发明的突变酶通过提高热稳定性,可维持最佳温度下的酶活性,可有效地生产d-阿洛酮糖。<110>松谷化学工业株式会社<120>热稳定性提高的酮糖3-差向异构酶<130>op18170<160>1<170>patentinversion3.1<210>1<211>289<212>prt<213>源自球形节杆菌的野生型阿洛酮糖差向异构酶<400>1metlysileglycyshisglyleuvaltrpthrglyhispheaspala151015gluglyileargtyrservalglnlysthrargglualaglypheasp202530leuvalglupheproleumetasppropheserpheaspvalglnthr354045alalysseralaleualagluhisglyleualaalaseralaserleu505560glyleuseraspalathraspvalsersergluaspproalavalval65707580lysalaglyglugluleuleuasnargalavalaspvalleualaglu859095leuglyalathraspphecysglyvaliletyrseralametlyslys100105110tyrmetgluproalathralaalaglyleualaasnserlysalaala115120125valglyargvalalaaspargalaseraspleuglyileasnvalser130135140leugluvalvalasnargtyrgluthrasnvalleuasnthrglyarg145150155160glnalaleualatyrleuglugluleuasnargproasnleuglyile165170175hisleuaspthrtyrhismetasnileglugluseraspmetpheser180185190proileleuaspthralaglualaleuargtyrvalhisileglyglu195200205serhisargglytyrleuglythrglyservalasppheaspthrphe210215220phelysalaleuglyargileglytyraspglyprovalvalpheglu225230235240serpheserserservalvalalaproaspleuserargmetleugly245250255iletrpargasnleutrpalaaspasnglugluleuglyalahisala260265270asnalapheileargasplysleuthralailelysthrilegluleu275280285his当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1