芽孢杆菌属细菌、白介素-22产生诱导剂、皮肤屏障功能增强剂的制作方法
本发明涉及芽孢杆菌属细菌、白介素-22产生诱导剂、皮肤屏障功能增强剂。进一步详细而言,涉及诱导白介素-22的产生的芽孢杆菌属细菌、白介素-22产生诱导剂、皮肤屏障功能增强剂。
背景技术:
当前,作为细胞因子的一组即白介素,已知白介素-10、白介素-12等多种,也报告了白介素-22(il-22)为其中一种。
该白介素-22是属于白介素-10家族的细胞因子,被报告有提高皮肤、肠道等的屏障功能等功能,在提高免疫系统等中也是重要的细胞因子之一。
在此,为了提高例如白介素-12的产生量而实现免疫功能的提高,报告了含有芽孢杆菌属细菌的一种即纳豆菌(枯草芽孢杆菌)作为有效成分的功能性食品(参照专利文献1)。
现有技术文献
专利文献
专利文献1:日本专利第5090754号
技术实现要素:
(发明要解决的课题)
该专利文献1中记载的功能性食品利用纳豆菌(枯草芽孢杆菌)而提高白介素-12的产生量,但关于提高(诱发)白介素-22的产生的效果,目前为止没有报告。
据此,要求发现可诱发白介素-22的产生的细菌,特别是还存在上述细菌为容易摄取的细菌的需求。
本发明提供诱导白介素-22的产生的芽孢杆菌属细菌。
(用于解决课题的技术方案)
根据本发明,可提供以下所示的芽孢杆菌属细菌。
[1]一种芽孢杆菌属细菌,其诱导白介素-22的产生。
[2]根据上述[1]记载的芽孢杆菌属细菌,其具有提高b细胞的存活能力的能力和b细胞的活化能力。
[3]根据上述[1]或[2]记载的芽孢杆菌属细菌,其以食品为来源。
[4]根据上述[1]~[3]中任一项记载的芽孢杆菌属细菌,其以味噌或纳豆为来源。
[5]根据上述[1]~[4]中任一项记载的芽孢杆菌属细菌,其属于选自枯草芽孢杆菌(bacillussubtilis)和凝结芽孢杆菌(bacilluscoagulans)中的至少1种。
[6]根据上述[1]~[5]中任一项记载的芽孢杆菌属细菌,其为保藏编号nitebp-02583的芽孢杆菌属细菌、保藏编号nitebp-02584的芽孢杆菌属细菌或保藏编号nitebp-02590的芽孢杆菌属细菌。
[7]一种白介素-22产生诱导剂,其含有上述[1]~[6]中任一项记载的芽孢杆菌属细菌。
[8]一种皮肤屏障功能增强剂,其含有上述[1]~[6]中任一项记载的芽孢杆菌属细菌。
(发明效果)
本发明的芽孢杆菌属细菌诱发白介素-22的产生,可成为白介素-22产生诱导剂的有效成分,上述白介素-22产生诱导剂可在因白介素-22的产生不足而引起的疾病的预防等中使用。
本发明的白介素-22产生诱导剂诱发白介素-22的产生,可成为白介素-22产生诱导剂的有效成分,上述白介素-22产生诱导剂可在因白介素-22的产生不足而引起的疾病的预防等中使用。
附图说明
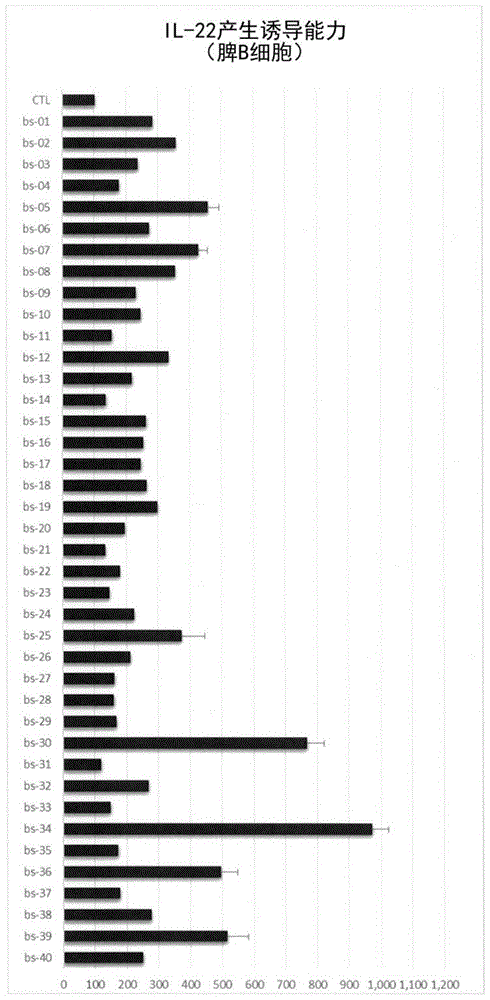
图1是表示具有b细胞中的白介素-22的产生诱导能力的菌株的筛选结果的图表。
图2是表示具有b细胞中的白介素-22的产生诱导能力的菌株的筛选结果的图表。
图3是表示具有全脾细胞中的白介素-22的产生诱导能力的菌株的筛选结果的图表。
图4是表示具有全脾细胞中的白介素-22的产生诱导能力的菌株的筛选结果的图表。
图5是表示b细胞的活化能力的图表。
图6是表示b细胞的活化能力的图表。
图7是表示对il-22的产生诱导能力进行利用流式细胞术的测定时的结果的图。
图8是表示实施例5中的经表皮失水量(tewl)的测定结果的图表。
图9是表示实施例6中的经表皮失水量(tewl)的测定结果的图表。
具体实施方式
以下,对用于实施本发明的方式进行说明,但本发明不限于以下的实施方式。即,应当理解为:在不脱离本发明的主旨的范围内,基于本领域技术人员的通常的知识,对以下的实施方式可进行适当变更、改良等而得到的也属于本发明的范围。
[1]芽孢杆菌属细菌:
本发明的芽孢杆菌属细菌诱导白介素-22(il-22)的产生。在此,例如芽孢杆菌属细菌的一种即枯草芽孢杆菌是自古以来与日本的饮食生活相关联的微生物,例如,在日本的传统发酵食品即纳豆的制造(发酵)中,涉及了枯草芽孢杆菌的一种即纳豆菌。此外,味噌或酱油的原浆中也大多包含枯草芽孢杆菌,以往,通过食用这些发酵食品,也摄取了枯草芽孢杆菌。因此,例如枯草芽孢杆菌在摄取时的安全性高(即,食品适合性高),此外还具有因培养简单而容易制造的优点。应予说明,芽孢杆菌(bacillus)属是需氧性的产孢子性菌,代表物种为枯草芽孢杆菌(bacillussubtilis)。纳豆菌被分类为枯草芽孢杆菌的一种。
“白介素-22”可使角质形成细胞增殖,促进皮肤的更新(turnover),因此能够期待适合地用于美肤原材料、抗菌原材料等用途。此外,白介素-22涉及组织修复、细胞生存·增殖、粘膜屏障防御,可期待特应性皮炎等皮肤疾病、脂肪肝疾病、由艰难梭菌(clostridiumdifficile)等而导致的感染症的预防·治疗等用途。
此外,本发明的芽孢杆菌属细菌优选具有提高b细胞的存活能力的能力和b细胞的活化能力。
在此,b细胞在体液免疫发挥核心作用,是针对病原体等异物(抗原)产生抗体的唯一的细胞,但关于枯草芽孢杆菌等芽孢杆菌属细菌引起的作用尚未知晓。此外,已知b细胞是向t细胞提呈抗原的细胞,是为了维持活化t细胞而不可缺少的细胞。因此,增强b细胞的作用也补强了t细胞的作用,还在免疫系统的细胞整体中增强免疫刺激效果。本发明中“b细胞的活化能力”是指抗体产生的能力和抗原提呈的能力两者活化。
并且,如果能够进行人为地强化可以产生抗体而攻击异物的b细胞的活动等直接控制,则可期待与以下情形产生联系,即,基于抗体的作用影响的过敏疾病、感染症、自身免疫疾病等免疫系统疾病的预防或缓解、治疗。
本说明书中“具有提高b细胞的存活能力的能力”是指具有提高b细胞所具有的“生存的能力”的性质。更具体而言,是指使用实验用小鼠脾细胞,以在未添加芽孢杆菌属细菌的试样中的生存的b细胞的数量相对于总细胞的数量的比例为基准(基准值100)时,在添加有芽孢杆菌属细菌的试样中的生存的b细胞的数量相对于总细胞的数量的比例的值(测定值)超过100。“总细胞的数量”通过流式细胞术定量而求出,“生存的b细胞(活细胞)的数量”通过以与抗b220抗体反应的细胞为b细胞,对未被碘化丙啶(pi)核染色液染色,且与抗b220抗体反应的细胞进行定量而求出。
应予说明,“具有b细胞的存活能力”是指如上述所示,具体而言,是指通过实施例2所示的方法得到的值(测定值)超过100。
本说明书中“具有b细胞的活化能力”是指具有使b细胞活化的能力(性质)。更具体而言,是指使用实验用小鼠脾细胞,以在未添加芽孢杆菌属细菌的试样中的活化的b细胞的数量与未活化的b细胞的数量之比为基准(基准值100)时,在添加有芽孢杆菌属细菌的试样中的活化的b细胞的数量与未活化的b细胞的数量之比的值(测定值)超过100。应予说明,“活化的b细胞的数量”通过流式细胞术测定与抗b220抗体和抗cd86抗体两者反应的细胞的数量而求出。“未活化的b细胞的数量”通过流式细胞术测定未与抗cd86抗体反应,且与抗b220抗体反应的细胞的数量而求出。
应予说明,“具有b细胞的活化能力”是指如上述所示,具体而言,是指通过实施例1所示的方法而得到的测定值超过100。
本发明的芽孢杆菌属细菌可以以食品为来源,具体而言,可以为味噌来源的、纳豆来源的。像这样,通过为自古以来具有食用经验的食品(特别是发酵食品)来源的微生物,摄取时的安全性更优异。
在此,味噌来源的芽孢杆菌属细菌还可以指在味噌的酿造工序中被分离的枯草芽孢杆菌等芽孢杆菌属细菌。“在味噌的酿造工序中被分离”的芽孢杆菌属细菌是指在味噌酿造工序中的“仓库”、“窖(ムロ)”、“桶”等中附着的芽孢杆菌属细菌。进一步,是指在从味噌的投料至熟化工序中可以生长(生存)的芽孢杆菌属细菌。应予说明,本发明中,来自味噌的芽孢杆菌属细菌不限于在味噌的酿造工序中直接单离的细菌,还包括从味噌分离,其后进行培养(传代培养)而得到的细菌。此外,来自纳豆的芽孢杆菌属细菌(枯草芽孢杆菌)可以指在纳豆的制造工序中分离的芽孢杆菌属细菌,还包括从市售(制品)的纳豆中分离的枯草芽孢杆菌(芽孢杆菌属细菌)。
本发明的芽孢杆菌属细菌可以属于选自枯草芽孢杆菌(bacillussubtilis)和凝结芽孢杆菌(bacilluscoagulans)中的至少1种。其理由在于,枯草芽孢杆菌(枯草芽孢杆菌)、凝结芽孢杆菌(凝结杆菌,也是产孢子性乳酸菌的一种)是与日本的饮食生活自古以来相关联的微生物,摄取时的安全性高(即,食品适合性高)。此外,它们培养简单,因此具有容易制造的优点。
[1-1]优选的芽孢杆菌属细菌:
本发明的芽孢杆菌属细菌优选为保藏编号nitebp-02583的芽孢杆菌属细菌(菌株)(菌株名“sc-09”)(以下有时将该菌株记为“凝结杆菌sc-09”)、保藏编号nitebp-02584的芽孢杆菌属细菌(菌株)(菌株名“bs-30”)(以下有时将该菌株记为“枯草芽孢杆菌bs-30”)或保藏编号nitebp-02590的芽孢杆菌属细菌(菌株)(菌株名“bs-34”)(以下有时将该菌株记为“枯草芽孢杆菌bs-34”)。
这些芽孢杆菌属细菌以味噌为来源,因此摄取时的安全性高,与b细胞直接作用而发挥b细胞中的存活能力和活化能力,能够激活免疫系统(即,具有良好的免疫刺激作用)。进一步,这些芽孢杆菌属细菌的il-22的产生诱导能力非常优异。应予说明,可认为上述的芽孢杆菌属细菌也可作用于t细胞,进一步还作用于树突状细胞等。
在此,保藏编号nitebp-02583的芽孢杆菌属细菌、保藏编号nitebp-02584的芽孢杆菌属细菌和保藏编号nitebp-02590的芽孢杆菌属细菌均在国家技术评估学会专利微生物保藏中心(npmd)保藏。
本发明的芽孢杆菌属细菌如上述所示,优选为保藏编号nitebp-02583的芽孢杆菌属细菌、保藏编号nitebp-02584的芽孢杆菌属细菌或保藏编号nitebp-02590的芽孢杆菌属细菌,il-22的产生诱导能力更优异的是保藏编号nitebp-02583的芽孢杆菌属细菌。
而且,“优选的芽孢杆菌属细菌”中,保藏编号nitebp-02583的芽孢杆菌属细菌(菌株名“sc-09”)是来自味噌的凝结芽孢杆菌(凝结杆菌),il-22产生诱导能力非常高而优异。即,在欲提高il-22的产生时,最适合采用。此外,该凝结杆菌sc-09即使在厌氧条件下也能够培养,在高温区域(45~60℃)也能够增殖,因此通过在一般的细菌难以生长的高温区域(45~60℃)培养,可选择性培养,进而,可在简易的培养设施中制造。此外,由于具有孢子形成能力,因此通过孢子化,从而保管等种菌(促酵物)的处理也容易。
“优选的芽孢杆菌属细菌”中,保藏编号nitebp-02584的芽孢杆菌属细菌(菌株名“bs-30”)和保藏编号nitebp-02590的芽孢杆菌属细菌(菌株名“bs-34”)均为来自味噌的枯草芽孢杆菌(bacillussubtilis),在透气性良好,室温25℃~45℃左右的环境下可旺盛地增殖。此外,在7w/v%左右的盐分浓度下也能够生长,通过在包含盐分的培养基中培养,可抑制一般细菌的生长,因此制造是容易的。即,可以说能够在简易的培养设备中制造。此外,由于具有孢子形成能力,因此通过孢子化,从而保管等种菌(促酵物)的处理也容易。
由此,本发明的芽孢杆菌属细菌还优选为可在高温(45℃以上,进一步为50℃以上)下生长的细菌。通过可在高温下培养,如上述所示,其它杂菌难以混入(难以发生因其它杂菌导致的污染),因此培养变得容易。
[2]芽孢杆菌属细菌的制备方法:
本发明的芽孢杆菌属细菌可通过在培养后进行杀菌等处理而制备。具体而言,在培养结束后,通过离心分离等手段去除培养基成分,清洗·精制。并且,进行加热杀菌,其后,通过冻结干燥·减压干燥·热风干燥等手段干燥·浓缩。如此操作,可制备本发明的芽孢杆菌属细菌。
应予说明,加热杀菌没有特别限制,具体而言,优选为压热釜杀菌(121℃,20分钟)或相同程度的杀菌。
[3]白介素-22(il-22)产生诱导剂:
本发明的il-22产生诱导剂含有本发明的芽孢杆菌属细菌。该il-22产生诱导剂可诱导il-22的产生。应予说明,芽孢杆菌属细菌中,存在如枯草芽孢杆菌等那样以往与发酵食品一起被食用的物质,且安全性高的物质,因此在使用枯草芽孢杆菌等的情况下,本发明的il-22产生诱导剂可提高安全性。
本发明的il-22产生诱导剂只要含有本发明的芽孢杆菌属细菌作为有效成分,则其含有比例没有特别限制。应予说明,本发明的il-22产生诱导剂除了本发明的芽孢杆菌属细菌之外,作为其它成分,可含有难消化性糊精、寡糖、糊精、二氧化硅等。
应予说明,本发明的il-22产生诱导剂可以含有培养本发明的芽孢杆菌属细菌时得到的培养物、菌体(可以为营养细胞和孢子中的任一者)或菌体成分。
应予说明,本发明的il-22产生诱导剂可以将其本身制成饮食品、补剂、医药品等,也可以添加至饮食品、补剂、医药品等中而使用。作为饮食品,没有特别限制,例如可举出味噌、即食味噌汁、烹饪味噌(味噌加工品)、金山寺味噌等副食酱、酱油、汤汁、调味酱(“调味酱”的日语原文是“調味ソース”)、调味汁(“调味汁”的日语原文是“調味たれ”)、佐饭料(“佐饭料”的日语原文是“ご飯の素”)、副食、甜酒(曲饮料(“曲饮料”的日语原文是“糀飲料”))等。
[4]皮肤屏障功能增强剂:
本发明的皮肤屏障功能增强剂含有本发明的芽孢杆菌属细菌。该皮肤屏障功能增强剂诱导il-22的产生,可抑制经表皮的水分蒸发。即,皮肤上皮的紧密连接(tightjunction)变得牢固,可增强(即提高)皮肤的屏障功能。因此,若提高皮肤的屏障功能,则可保持皮肤的湿润,不易引起干燥皮肤或敏感皮肤。此外,可保护皮肤免受病原体的入侵等外来刺激(除了病原体的入侵之外,例如还有因吸收紫外线而导致的刺激、因与过敏原、化学物质、尘埃等接触而导致的刺激、因暴露于干燥环境下而导致的刺激等)。
在此,皮肤的表皮层承担防御生物体受到紫外线、过敏原、化学物质、病原体等上述等外来刺激的屏障功能,但若皮肤上皮的紧密连接松弛、皮层的屏障功能无法充分发挥功能,则无法保护皮肤免受外来刺激。其结果是,成为皮肤粗糙、色斑、皱纹、紧致感的降低、皮肤的松弛等问题的原因。由此,将皮肤的屏障功能保持正常,在该屏障功能降低的情况下提高该功能是重要的。本发明的皮肤屏障功能增强剂通过含有本发明的芽孢杆菌属细菌,该芽孢杆菌属细菌诱导il-22的产生,其结果,可发挥皮肤的屏障功能(发挥防止经表皮失水的效果)。
应予说明,若经表皮的水分蒸发量大(即,经表皮失水量(transepidermalwaterloss(tewl)大),则除了皮肤(特别是表皮层)成为干燥状态之外,也无法发挥基于皮肤的充分保护功能,紫外线、过敏原、化学物质、病原体等外来刺激对皮肤的内部产生不良影响(色斑的发生、瘙痒等)。
实施例
以下,基于实施例具体说明本发明,但本发明不限于这些实施例。
(实施例1)
<il-22的测定试验>
从味噌和纳豆中分别收集芽孢杆菌属细菌,培养得到的各芽孢杆菌属细菌,进行杀菌处理,添加至实验用小鼠(c57bl/6)的脾细胞进行培养,测定培养后的il-22的产生量。应予说明,试验中使用的菌株记载于表1,表2。以下,针对il-22的测定试验进行具体说明。
(1)芽孢杆菌属细菌的分离和鉴定:
由味噌和味噌的酿造工序,进行芽孢杆菌属细菌的收集,此外,从市售的纳豆中也分离芽孢杆菌属细菌。分离培养基使用标准琼脂培养基(日水制药公司制),在30℃和45℃下静置培养1~2天,从得到的菌落中提纯分离,收集菌。此外,为了选择性得到凝结杆菌(bacilluscoagulans),使用添加有碳酸钙的乳酸菌mrs琼脂培养基(和光纯药公司制),在50℃下厌氧培养1~3天,收集周围的碳酸钙溶解的菌落。
分离的芽孢杆菌属细菌进行革兰氏染色,利用显微镜进行观察,进行确认是否为革兰氏染色阳性的杆菌、以及是否形成孢子。
此外,从分离的菌体中提取dna,使用引物10f(5'-gtttgatcctggctca-3')和引物1500r(5'-taccttgttacgactt-3')利用pcr将16srdna扩增后,通过得到的pcr产物的序列分析进行菌种的鉴定。应予说明,分析方法的详情按照第十七修订日本药典参考信息“利用基因分析的微生物的迅速鉴定法”。
收集的芽孢杆菌属细菌为72株,其中,包括枯草芽孢杆菌(包括纳豆菌)40株、凝结杆菌20株。
(2)菌体悬浮液(芽孢杆菌属细菌悬浮液)的制备:
分离·鉴定的芽孢杆菌属细菌使用营养肉汤培养基(和光纯药公司制),在30℃下振荡培养1~3天。其中,凝结杆菌中,使用乳酸菌mrs肉汤(lactobacillimrsbroth)(和光纯药公司制),在50℃下静置培养1~3天。
培养后,在121℃下进行20分钟压热釜灭菌处理,得到各菌株的培养液。
接着,将得到的各培养液以5000rpm进行离心分离10分钟。其后,分别收集菌,利用蒸馏水清洗3次后,利用蒸馏水悬浮,冻结干燥,得到菌体。其后,针对各个得到的菌体,利用ph6.8的磷酸缓冲液(pbs)以达到1mg/ml的方式悬浮,制备各菌株的菌体悬浮液。
(3)细胞悬浮液的制备:
将从实验用小鼠(c57bl/6)的脾采集的细胞收集至50ml离心管(conicaltube)(falcon公司制),添加5ml的红细胞裂解缓冲液(0.155mnh4cl,0.01mtris-hcl,ph7.5),使细胞悬浮。其后,在其中添加ph6.8的磷酸缓冲液(pbs)5ml,以1200rpm离心分离5分钟。其后,利用ph6.8的磷酸缓冲液(pbs)清洗2次,制备细胞悬浮液。
(4)细胞培养:
利用基本培养基以达到2×106细胞/ml的方式调整细胞悬浮液,将调整后的细胞悬浮液以各1ml接种到24孔微孔板(falcon公司制),制成2×106细胞/1ml/孔。应予说明,基本培养基使用以下培养基,即,在规定的添加l-谷氨酸(0.3g/l)的rpmi1640(nacalaitesque公司制)中以在培养基中达到9(w/v)%的方式添加在55℃下加热30分钟而失活的胎牛血清(safcbiosciences公司制)而得到的培养基,上述“规定的添加l-谷氨酸(0.3g/l)的rpmi1640”为添加有青霉素-链霉素混合溶液(培养基中100u/ml-100μg/ml,nacalaitesque公司制)和2-巯基乙醇(培养基中50μm,nacalaitesque公司制)的添加l-谷氨酸(0.3g/l)的rpmi1640。
其后,在其中以各10μl添加各菌体悬浮液(1mg/ml),在37℃,5%co2的条件下培养2天。应予说明,也准备对照。该对照设为在调整后的细胞悬浮液中不添加菌体悬浮液,在与添加菌体的情况相同的条件(37℃,5%co2的条件)下培养2天。
(5)il-22的测定:
从2天(48小时)的培养中的的培养42小时后开始,在培养液中各添加0.67μl的bdgolgistoptm(bd公司制)并混合。其后,进一步,在37℃,5%co2的条件下培养6小时。
其后,将利用24孔微孔板(falcon公司制)培养的细胞培养液转移至1.5ml反应管(greinerbio-one公司制),以1200rpm离心分离5分钟,回收细胞。其后,对回收的细胞使用bdcytofix/cytopermtmfixation/permeabilizationkit(bd公司制)进行固定和透性化。该操作按照fixation/permeabilizationkit的随附的说明书。
b细胞的染色中,使用violetfluor450标记的抗b220抗体(tonbobiosciences公司制),进一步,il-22的染色中,使用pe标记的抗il-22抗体(affymetrixebioscience公司制)。此外,为了测定b细胞的活化状态,使用apc标记的抗cd86抗体(tonbobiosciences公司制)。
染色反应在冷藏(5℃)下静置60分钟而进行。其后,以1200rpm离心分离5分钟,回收细胞,悬浮在0.5ml的pbs中,得到测定用试样。
应予说明,测定使用流式细胞术(miltenyibiotech公司制macsquantanalyzer)。
并且,分析使用fcs数据分析软件flowjo(flowjo,llc公司制)。
<结果>(1)脾b细胞中的il-22产生细胞量的测定:
将b220阳性细胞作为b细胞,用各测定用试样,求出脾b细胞中的il-22阳性细胞的比例(il-22+,b220+/b220+)。
将对照(未添加菌体悬浮液)中的b细胞中的il-22阳性细胞的比例作为基准(100),算出各测定用试样的相对值,作为b细胞的il-22产生细胞量的值(表1,表2中,记作“il-22产生诱导能力(脾b细胞)”)。
应予说明,在对各测定用试样进行1次测定的基础上,对于测定值高的测定用试样,进一步反复进行2~6次测定,求出平均值(x-)和标准误差(s.e.)。将结果示于表1、表2。
(2)全脾细胞中的il-22产生细胞量的测定:
利用各测定用试样求出全脾细胞中的il-22阳性细胞的比例(“il-22阳性细胞/全脾细胞”)。
将对照(未添加菌体悬浮液)中的脾细胞中的il-22阳性细胞的比例作为基准(100),算出各测定用试样的相对值,作为全脾细胞的il-22产生细胞量的值(表1,表2中,记作“il-22产生诱导能力(全脾细胞)”)。
与上述“(1)b细胞中的il-22产生细胞量的测定”相同,在对各测定用试样进行1次测定的基础上,对于测定值高的测定用试样,进一步与上述(1)的情况相同,反复进行测定,求出平均值(x-)和标准误差(s.e.)。将结果示于表1、表2。
(3)b细胞的活化能力的测定:
求出b细胞中的cd86阳性细胞的比例(cd86+,b220+/cd86-,b220+)。并且,将对照(未添加菌体悬浮液)中的b细胞中的cd86阳性细胞的比例作为基准(100),算出b细胞的活化能力的值(表1,表2中,表示为“b细胞的活化能力”)。
应予说明,对于反复进行上述“(1)b细胞中的il-22产生细胞量的测定”和“(2)全脾细胞中的il-22产生细胞量的测定”的测定用试样,b细胞的活化能力的测定也同样反复进行,求出平均值(x-)和标准误差(s.e.)。将结果示于表1、表2。
(4)生长温度的确认:
此外,进行分离的各菌株的生长温度的确认。具体而言,准备以下培养基,即,将营养肉汤培养基(和光纯药公司制)各10ml添加至试验管(直径18mm×180mm),盖上培养塞(silicosen,信越聚合物公司制),利用压热釜(121℃、20分钟)进行灭菌处理得到的培养基。以每个接种环3个培养基的方式接种菌落,各自在30℃、45℃、55℃下静置培养。作为对照,准备未接种菌的培养基。培养2天后,进行目视确认(确认培养基的浑浊和沉淀的有无),进行是否充分增殖的判定。判定基准是,将增殖的情况记作“○”,将未增殖的情况记作“×”。
将生长温度的确认的结果示于表1,表2(表1,表2中,示于“培养温度”的栏)。任一菌株均在30℃的培养中增殖。
[表1]
[表2]
(5)il-22的产生诱导菌的筛选结果:
各菌种的筛选结果如下所示(参照表1,表2、图1~图6)。
所有菌株(72个菌株)中,il-22的产生上升(1.1倍以上)。其中,来自味噌的芽孢杆菌属细菌(例如,表1中,以菌株名“bs-30”、“bs-34”、“sc-09”表示)的b细胞中的il-22产生细胞的量与对照相比为7~10倍,此外,在脾细胞整体的结果中,与对照相比il-22产生细胞的量也达到约6倍。将il-22的生产活细胞的量特别高的菌株示于表3。
[表3]
<总结>
可知il-22被芽孢杆菌属细菌的菌体(杀菌菌体)引起的刺激诱导,该诱导的程度根据菌株而存在差异。可认为芽孢杆菌属细菌据信具有il-22产生诱导能力。
已知cd4+t细胞、nk细胞等产生il-22,但目前为止未报告il-22在b细胞中产生。应予说明,根据上述结果,在使用本发明的芽孢杆菌属细菌的情况下,通过这些菌体的刺激,在脾细胞中特别是来自b细胞的il-22产生增加。
应予说明,图7是实施例1中的流式细胞术的测定的一例,纵横表示b220的表达,横轴表示白介素-22的表达,从左侧起依次表示对照(control)、添加“bs-34”的菌株(枯草芽孢杆菌bs-34)的情况(记作“+bs-34”)、添加“sc-09”的菌株(凝结杆菌sc-09)的情况(记作“+sc-09”)。
此外,il-22的产生诱导能力高的芽孢杆菌属细菌(菌株)存在b细胞的活化能力也高的趋势。另一方面,b细胞的活化能力高的菌未必对il-22具有高的产生诱导能力。
由此,可知通过菌体的刺激而使b细胞活化的芽孢杆菌属细菌的一部分也具有il-22的产生诱导能力。应予说明,若b细胞为被活化的状态,则还可期待激活免疫的效果。
应予说明,本实施例中,着眼于b220阳性细胞而对b细胞进行分析,但对于il-22的产生诱导能力高的乳酸菌,在代替b220阳性细胞利用cd19阳性细胞(使用violetfluor450标记的抗b220抗体(tonbobiosciences公司制))进行分析的情况中也可得到相同的结果。由此,也可确认通过规定的菌株从而提高来自b细胞的il-22产生诱导能力,进一步可提高b细胞的活化能力。
(实施例2)
<细胞的存活能力和细胞的活化能力的测定试验>
对于实施例1中il-22的产生诱导能力高的枯草芽孢杆菌bs-30、枯草芽孢杆菌bs-34和凝结杆菌sc-09,将杀菌处理后的菌体与实验用小鼠(c57bl/6)的“脾细胞共培养”,研究脾细胞整体的存活能力、脾b细胞和脾t细胞的存活能力、以及脾b细胞和脾t细胞的活化能力。以下,针对试验内容进行具体说明。
(1)菌体悬浮液的制备:
使用与实施例1中制备的芽孢杆菌属细菌悬浮液相同的物质。
(2)细胞悬浮液的制备:
与实施例1同样地制备。
(3)细胞培养:
利用基本培养基以达到2×106细胞/ml的方式调整细胞悬浮液,将调整后的细胞悬浮液以各0.5ml接种至48孔微孔板(falcon公司制),制成1×106细胞/0.5ml/孔。
其后,在其中以各5μl添加各菌体悬浮液(1mg/ml),在37℃,5%co2的条件下培养2天。应予说明,对照为在调整后的细胞悬浮液中不添加菌体悬浮液,在与添加了菌体的情况相同的条件(37℃,5%co2的条件)下培养2天。
(4)细胞的存活能力和细胞的活化能力的测定:
将利用48孔微孔板培养的细胞培养液转移至1.5ml反应管(greinerbio-one公司制),以1200rpm离心分离5分钟,回收细胞。其后,将回收的细胞悬浮在ph6.8的磷酸缓冲液(pbs)0.2ml中,以各1μl添加以下4种抗体,在冷藏(5℃)下静置60分钟。
添加的4种抗体为violetfluor450标记的抗b220抗体(tonbobiosciences公司制)、apc标记的抗cd86抗体(tonbobiosciences公司制)、brilliantviolet510标记的抗cd4抗体(biolegend公司制)和pe标记的抗cd69抗体(biolegend公司制)。
静置后,以1200rpm离心分离5分钟,回收细胞,悬浮在ph6.8的磷酸缓冲液(pbs)0.5ml中。其后,添加碘化丙啶(pi)核染色液(cosmobio公司制)0.5μl,得到测定用试样。对该测定用试样,使用流式细胞术(miltenyibiotech公司制macsquantanalyzer)进行测定。应予说明,分析使用fcs数据分析软件flowjo(flowjo,llc公司制)。
(细胞存活能力)
测定用试样中,将pi检测到的细胞(被pi核染色液染色的细胞)视为死细胞,将与计数的细胞数(总细胞数)的差值作为活细胞的数量。并且,算出总细胞中的活细胞的比例(活细胞的数量/总细胞的数量×100)。同样地,算出对照(未添加菌体悬浮液)的总细胞中的活细胞的比例。其后,比较这些值,算出将对照作为基准(100)时的比的值,作为细胞的存活能力(细胞存活能力)的值。应予说明,反复进行试验,求出平均值(x-)和标准误差(s.e.)。将结果示于表4。本实施例中“平均值(x-)”是基于6次试验(n=6)的平均值。
(b细胞的存活能力)
通过b细胞的细胞表面标记即violetfluor450标记的抗b220抗体(tonbobiosciences公司制)检测b细胞。算出活细胞中的b细胞的数量(pi未检测到的细胞中的b220阳性细胞)与总细胞的数量的商(生存的b细胞的数量相对于总细胞的数量的比例)。同样地,算出对照(未添加菌体悬浮液)的生存的b细胞的数量相对于总细胞的数量的比例。其后,比较这些值,算出将对照作为基准(100)时的比的值,作为b细胞的存活能力的值。应予说明,反复进行试验,求出平均值(x-)和标准误差(s.e.)。将结果示于表4。
(t细胞的存活能力)
通过t细胞的细胞表面标记即brilliantviolet510标记的抗cd4抗体(biolegend公司制)检测t细胞。算出活细胞中的t细胞的数量(pi未检测到的细胞中的cd4阳性细胞)与总细胞的数量的商(生存的t细胞的数量相对于总细胞的数量的比例)。同样地,算出对照(未添加菌体悬浮液)的生存的t细胞的数量相对于总细胞的数量的比例。其后,比较这些值,算出将对照作为基准(100)时的比的值,作为t细胞的存活能力的值。应予说明,反复进行试验,求出平均值(x-)和标准误差(s.e.)。将结果示于表4。
(b细胞的活化能力)
通过b细胞的细胞表面标记即violetfluor450标记的抗b220抗体和b细胞的活化标记即apc标记的抗cd86抗体检测表达b220和cd86的b细胞,进行计数。并且,算出b细胞(b220阳性细胞)之中,活化的b细胞(cd86+,b220+)与未活化的b细胞(cd86-,b220+)的商(活化的b细胞/未活化的b细胞的比的值)。同样地,算出对照(未添加菌体悬浮液)的活化的b细胞(cd86+,b220+)与未活化的b细胞(cd86-,b220+)的商。其后,比较这些值,算出将对照作为基准(100)时的比的值,作为b细胞的活化能力的值。应予说明,反复进行试验,求出平均值(x-)和标准误差(s.e.)。将结果示于表4。
(t细胞的活化能力)
通过t细胞的细胞表面标记即brilliantviolet510标记的抗cd4抗体(biolegend公司制)和t细胞的活化标记即pe标记的抗cd69抗体(biolegend公司制),检测表达cd4和cd69的细胞,计数其数量。并且,算出t细胞(cd4阳性细胞)中,活化的t细胞(cd69+,cd4+)与未活化的t细胞(cd69-,cd4+)的商(活化的t细胞/未活化的t细胞的比的值)。同样地,算出对照(未添加菌体悬浮液)的活化的t细胞(cd69+,cd4+)与未活化的t细胞(cd69-,cd4+)的商。其后,比较这些值,算出将对照作为基准(100)时的比的值,作为t细胞的活化能力的值。应予说明,反复进行试验,求出平均值(x-)和标准误差(s.e.)。将结果示于表4。
[表4]
<结果>
根据本实施例的结果可知:实施例1中选择的il-22的产生诱导能力高的芽孢杆菌属细菌的菌株不仅b细胞的活化能力高,而且提高b细胞的存活能力的能力也高。此外,可知:提高t细胞的存活能力的能力和t细胞的活化能力也高。
应予说明,本实施例中,着眼于b220阳性细胞而针对b细胞进行分析,但在代替b220阳性细胞利用cd19阳性细胞(violetfluor450标记的抗b220抗体(tonbobiosciences公司制)进行分析的情况中,也可得到相同的结果。由此也可确认通过上述规定的菌株能够提高b细胞的存活能力,还可活化b细胞。
(实施例3)
<b细胞的存活能力和b细胞的活化能力的测定试验>
对实施例1中il-22的产生诱导能力高的枯草芽孢杆菌bs-30、枯草芽孢杆菌bs-34和凝结杆菌sc-09,将杀菌处理后的菌体与实验用小鼠(c57bl/6)的“来自脾脏的b细胞(b220阳性细胞)共培养”,研究提高脾b细胞的存活能力的能力和脾b细胞的活化能力(活化b细胞的能力)。以下,对测定试验进行具体说明。
(1)菌体悬浮液的制备:
使用与实施例1中制备的芽孢杆菌属细菌悬浮液相同的物质。
(2)b细胞悬浮液的制备:
将从实验用小鼠(c57bl/6)的脾脏采集的细胞收集至50ml离心管(falcon公司制),添加5ml的红细胞裂解缓冲液(0.155mnh4cl,0.01mtris-hcl,ph7.5),使细胞悬浮。其后,在其中添加ph6.8的磷酸缓冲液(pbs)5ml,以1200rpm离心分离5分钟。其后,利用ph6.8的磷酸缓冲液(pbs)清洗2次,制备细胞悬浮液。
利用基本培养基悬浮后,添加生物素-抗b220抗体(tonbobiosciences公司制),冷藏(5℃)并静置30分钟。
静置后,以1200rpm离心分离5分钟,利用ph6.8的磷酸缓冲液(pbs)清洗2次后,利用ph6.8的磷酸缓冲液(pbs)使其悬浮。其后,添加磁珠即streptavidinparticlesplus·dm(日本bd公司制),冷藏(5℃)并静置30分钟。
其后,以1200rpm离心分离5分钟,利用ph6.8的磷酸缓冲液(pbs)清洗1次后,再次悬浮于ph6.8的磷酸缓冲液(pbs),转移至圆管(roundtube)。
其后,利用bdimagcellseparationsystem(日本bd公司制)进行细胞分离,将靠近磁铁的细胞作为“b细胞(b220阳性细胞)”而回收(阳性细胞级分)。将回收的细胞悬浮于基本培养基,制备b细胞悬浮液。应予说明,得到的b细胞悬浮液使用血细胞计算板,测量细胞数。
(3)细胞培养:
利用基本培养基以达到2×106细胞/ml的方式调整细胞悬浮液,将调整后的细胞悬浮液以各1ml接种到24孔微孔板(falcon公司制),制成2×106细胞/1ml/孔。其后,以各10μl添加各菌体悬浮液,在37℃,5%co2的条件下培养2天。应予说明,将在调整后的b细胞悬浮液中不添加菌体(菌体悬浮液),在与添加有菌体的水平相同的条件(37℃,5%co2的条件)下培养2天而得到的作为对照。
(4)b细胞的存活能力和b细胞的活化能力的测定:
培养后,使用流式细胞术(miltenyibiotech公司制macsquantanalyzer),对各试样(细胞培养液)进行b细胞的存活能力的测定(生存的b细胞的量的测定)和b细胞的活化能力的测定(活化的b细胞的量的测定)。
首先,将利用24孔微孔板培养的细胞培养液转移至1.5ml反应管(greinerbio-one公司制),以1200rpm离心分离5分钟,回收细胞。其后,将回收的细胞悬浮于ph6.8的磷酸缓冲液(pbs)0.1ml,以各0.5μl添加violetfluor450标记的抗b220抗体(tonbobiosciences公司制)和apc标记的抗cd86抗体(tonbobiosciences公司制),冷藏(5℃)并静置60分钟。
静置后,以1200rpm离心分离5分钟,回收细胞,悬浮于ph6.8的磷酸缓冲液(pbs)0.5ml中。其后,添加碘化丙啶(pi)核染色液(cosmobio公司制)0.5μl,得到测定用试样。对该测定用试样,使用流式细胞术进行测定。应予说明,分析使用fcs数据分析软件flowjo(flowjo,llc公司制)。
(b细胞的存活能力)
测定用试样中,将pi检测到的细胞(被pi核染色液染色的细胞)视为死细胞,将与计数的细胞数(总细胞数)的差值作为b细胞的活细胞数。并且,算出总细胞中的活细胞的比例(活细胞的数量/总细胞的数量×100)。同样地,算出对照(未添加芽孢杆菌属细菌悬浮液)的总细胞中的活细胞的比例。其后,比较这些值,算出将对照作为基准(100)时的比的值,作为b细胞的存活能力(细胞存活能力)的值。应予说明,反复进行试验,求出平均值(x-)和标准误差(s.e.)。将结果示于表5的“b细胞的存活能力”。本实施例中“平均值(x-)”是基于4次试验(n=4)而得到的平均值。
(b细胞的活化能力)
通过b细胞的细胞表面标记即violetfluor450标记的抗b220抗体和b细胞的活化标记即apc标记的抗cd86抗体,检测表达b220和cd86的b细胞,计数其数量。并且,算出b细胞(b220阳性细胞)中,活化的b细胞(cd86+,b220+)与未活化的b细胞(cd86-,b220+)的商(活化的b细胞的数量与未活化的b细胞的数量的比)。同样地,算出对照(未添加菌体悬浮液)中的活化的b细胞(cd86+,b220+)与未活化的b细胞(cd86-,b220+)的商。其后,比较这些值,算出将对照作为基准(100)时的比的值,作为b细胞的活化能力的值。应予说明,反复进行试验,求出平均值(x-)和标准误差(s.e.)。将结果示于表5的“b细胞的活化能力”。
[表5]
<结果>
根据本实施例的结果,进一步可确认通过实施例1选择的“il-22的产生诱导能力高的菌株”直接作用于b细胞,可提高b细胞的存活能力,且可活化b细胞。
(实施例4)
<b细胞的il-22产生诱导能力的测定试验>
对实施例1中il-22的产生诱导能力高的枯草芽孢杆菌bs-30、枯草芽孢杆菌bs-34和凝结杆菌sc-09,将杀菌处理后的菌体与实验用小鼠(c57bl/6)的“来自脾脏的b细胞(b220阳性细胞)共培养”,研究il-22产生诱导能力。以下,对测定试验进行具体说明。
(1)菌体悬浮液的制备:
使用与实施例1中制备的芽孢杆菌属细菌悬浮液相同的物质。
(2)b细胞悬浮液的制备:与实施例3同样地制备。
(3)细胞培养:与实施例3同样地制备。
(4)il-22的测定:
培养42小时后,在培养液中以各0.67μl添加bdgolgistoptm(bd公司制)并混合。其后,进一步,在37℃,5%co2的条件下培养6小时。
其后,将利用24孔微孔板(falcon公司制)培养的细胞培养液转移至1.5ml反应管(greinerbio-one公司制),以1200rpm离心分离5分钟,回收细胞。其后,对回收的细胞使用bdcytofix/cytopermtmfixation/permeabilizationkit(bd公司制)进行固定和透性化处理。该操作按照fixation/permeabilizationkit的随附的说明书。
b细胞的染色中,使用violetfluor450标记的抗b220抗体(tonbobiosciences公司制)。此外,il-22的染色中,使用pe标记的抗il-22抗体(affymetrixebioscience公司制)。
染色反应在冷藏(5℃)并静置60分钟而进行。其后,以1200rpm离心分离5分钟,回收细胞,悬浮于0.5ml的ph6.8的磷酸缓冲液(pbs)而得到测定用试样。对该测定用试样使用流式细胞术进行测定。应予说明,分析使用fcs数据分析软件flowjo(flowjo,llc公司制)。
利用各测定用试样求出b细胞中的il-22阳性细胞的比例(il-22+,b220+/b220+),将对照(未添加菌体悬浮液)的b细胞中的il-22阳性细胞的比例作为基准(100),算出各测定用试样的相对值,作为b细胞的il-22产生细胞量的值。应予说明,反复进行试验,求出平均值(x-)和标准误差(s.e.)。将结果示于表5的“il-22产生诱导能力”。本实施例中“平均值(x-)”是基于4次试验(n=4)的平均值。
<结果>
根据本实施例的结果可知通过实施例1选择的“il-22的产生诱导能力高的菌株”直接作用于b细胞,使产生il-22的b细胞增加。
(实施例5)
<喂食试验(正常小鼠)>
使实验用小鼠摄取il-22的产生诱导能力高的“凝结杆菌sc-09”的杀菌处理后的菌体,其后,测定皮肤的状态(经表皮失水量(transepidermalwaterloss(tewl))。此外,也相应地准备给予il-22的组(表11中,“il-22给予组”)和给予il-22的中和抗体的组(表11中,“菌体摄取/抗il-22抗体给予组”),也确认il-22的接种引起的皮肤的变化。
(1)芽孢杆菌属细菌配合饲料的制备:
制备在通常的小鼠用饲料中以1w/w%的比例配合凝结杆菌sc-09的菌体而得到的饲料(芽孢杆菌属细菌配合饲料),其中,上述凝结杆菌sc-09的菌体为杀菌处理然后冻结干燥而得到的。应予说明,作为通常的小鼠用饲料,使用小鼠饲养繁殖用饲料ce-2(日本clea公司制)。
(2)喂食饲养:
将通常的实验用小鼠(c57bl/6)(8周龄·雌)12只分为4组(各组各3只),对其中的2组给予配合芽孢杆菌属细菌的饲料,对剩余的2组给予不包含芽孢杆菌属细菌的菌体的通常的小鼠用饲料,进行21天饲养。
对给予不包含芽孢杆菌属细菌的菌体的通常的小鼠用饲料的2组中的一组,在喂食开始第14天和第17天,分别尾静脉注射(各自2μg/只)il-22的重组蛋白即“重组il-22(tonbo公司制重组小鼠il-22(recombinantmouseil-22))”。上述2组中,将尾静脉注射“重组il-22”的组称为“il-22给予组”,将未进行尾静脉注射(给予)“重组il-22”的组称为“对照组”。
此外,对给予芽孢杆菌属细菌配合饲料的2组中的一组,在喂食开始第14天和第17天,分别尾静脉注射作为il-22中和抗体的“抗il-22抗体(thermofisher公司制il-22单克隆抗体)”(各自20μg/只)。上述2组中,将尾静脉注射“抗il-22抗体”的组称为“菌体摄取/抗il-22抗体给予组”,将未进行尾静脉注射(给予)“抗il-22抗体”的组称为“菌体摄取组”。
(3)经表皮失水量(tewl)的测定:
从喂食开始第21天,测定各组小鼠的背部的皮肤的经表皮失水量(tewl)。进行该测定时,在前一日(第20天)对小鼠的背部进行剃毛处理。tewl的测定通过cortextechnology公司制的皮肤测定装置“dermalab(注册商标)”进行。各小鼠中tewl的测定各进行3次,求出平均值,进一步求出各组的平均值和标准偏差。表6、图8中,示出经表皮失水量(tewl)的结果。对对照组和其它各组的数量值,进行f检验,进行方差是否存在显著差异的确认。其后,进行student'st检验(其为利用假定为等方差的2个样本的检验)。
[表6]
由表6、图8的结果可知菌体摄取组(摄取“bacilluscoagulanssc-09”,未给予“抗il-22抗体”的组)与对照组相比,tewl低,student'st检验的结果是p<0.01(p=0.0004),在显著水平1%下确认到显著差异。
应予说明,由表6可知il-22给予组(未给予乳酸菌配合饲料,给予il-22的组)与对照组相比,tewl低,student'st检验的结果是p<0.01(p=0.003),在显著水平1%下确认到显著差异。此外,“菌体摄取/抗il-22抗体给予组”与菌体摄取组相比,tewl高(即,经由皮肤的水分的蒸散量多),与对照组相比tewl也高,student'st检验的结果是p<0.01(p=0.003),在显著水平1%下确认到显著差异。应予说明,各组的小鼠在目视上在皮肤的性状方面没有确认到变化。
因此,根据本实施例可知在菌体摄取组中tewl变低,可知:通过摄取本发明的芽孢杆菌属细菌,皮肤的屏障功能提高。
应予说明,虽然通过给予il-22tewl也降低,但是,通过给予(尾静脉注射)il-22的中和抗体而使tewl上升(参照表6,图8),因此可确认il-22提高皮肤的屏障功能。而且,菌体摄取引起的皮肤的屏障功能的提高是基于摄取菌体引起的刺激而发生的,可认为有可能是菌体引起的il-22的产生诱导而引起的。
(实施例6)
<喂食试验(无菌小鼠)>
使无菌小鼠摄取il-22的产生诱导能力高的“枯草芽孢杆菌bs-34”的杀菌处理后的菌体,其后,测定皮肤的状态(经表皮失水量(transepidermalwaterloss(tewl))。
(1)菌体配合饲料的制备:
制备在通常的小鼠用饲料中以1w/w%的比例配合枯草芽孢杆菌bs-34的菌体而得到的饲料(芽孢杆菌属细菌配合饲料),其中,上述枯草芽孢杆菌bs-34的菌体为杀菌处理然后冻结干燥而得到的。应予说明,作为通常的小鼠用饲料,使用小鼠饲养繁殖用饲料ce-2(日本clea公司制)。
(2)喂食饲养:
将无菌小鼠(c57bl/6njcl[gf])(8周龄·雌)10只分为给予配合芽孢杆菌属细菌的饲料的组(菌体摄取组)和给予不包含菌体的通常的小鼠用饲料的组(对照组)各5只,在无菌环境下饲养1个月。
(3)经表皮失水量(tewl)的测定:
从喂食开始1个月后,测定背部的皮肤的tewl。应予说明,在即将测定前,利用小动物用理发器剃掉小鼠的背部的毛后进行测定。tewl的测定通过cortextechnology公司制的皮肤测定装置“dermalab(注册商标)”进行。tewl的测定对各小鼠进行3次,求出平均值和标准偏差。将结果示于表7,图9。针对对照组和菌体摄取组的数量值,进行f检验,进行方差是否存在显著差异的确认。其后,进行student'st检验。
[表7]
菌体摄取组与对照组(未摄取配合芽孢杆菌属细菌的饲料的组)相比,tewl显著低,student'st检验的结果是p<0.01(p=0.001),在显著水平1%下确认到显著差异。因此根据该实施例也可知菌体摄取组中tewl变低,可知通过摄取本发明的芽孢杆菌属细菌,皮肤的屏障功能提高。
综上,可知本发明的芽孢杆菌属细菌的il-22的产生诱导能力高。进一步,可知本发明的芽孢杆菌属细菌具有通过直接作用于b细胞而提高b细胞的存活能力的能力,具有b细胞的活化能力(活化b细胞的能力)。并且,根据该结果可知本发明的芽孢杆菌属细菌具有免疫刺激作用。此外,可知本发明的芽孢杆菌属细菌增强(提高)皮肤的屏障功能。
工业实用性
可将本发明的芽孢杆菌属细菌添加到饮食品、补剂、医药品等而作为产生il-22的il-22产生诱导剂的有效成分(进一步为皮肤屏障功能增强剂的有效成分)而使用,或者可将其本身作为饮食品、补剂、医药品等。作为饮食品,例如可举出味噌、即食味噌汁、烹饪味噌(味噌加工品)、金山寺味噌等副食酱、酱油、汤汁、调味酱(“调味酱”的日语原文是“調味ソース”)、调味汁(“调味汁”的日语原文是“調味たれ”)、佐饭料(“佐饭料”的日语原文是“ご飯の素”)、副食、甜酒(曲饮料(“曲饮料”的日语原文是“糀飲料”))等
保藏编号
保藏编号nitebp-02583
保藏日:2017年12月5日
保藏机构名:国家技术评估学会专利微生物保藏中心
保藏机构地址:〒292-0818日本千叶县木更津市kazusa镰足2-5-8122号室
保藏编号nitebp-02584
保藏日:2017年12月5日
保藏机构名:国家技术评估学会专利微生物保藏中心
保藏机构地址:〒292-0818日本千叶县木更津市kazusa镰足2-5-8122号室
保藏编号nitebp-02590
保藏日:2017年12月5日
保藏机构名:国家技术评估学会专利微生物保藏中心
保藏机构地址:〒292-0818日本千叶县木更津市kazusa镰足2-5-8122号室
pct/ro/134表
- 还没有人留言评论。精彩留言会获得点赞!