调节目的植物叶片衰老进程的基因及方法及其在棉花作物上的应用与流程
本发明涉及基因工程技术领域,尤其是一种调节目的植物叶片衰老进程的基因及其相关应用。
背景技术:
叶子是获取光能、固定二氧化碳产生碳水化合物的基本器官,也是植物生长发育的主要器官(woo等人,2016年)。叶子衰老是植物发育最后一步的一个组成部分,被提出通过进化来选择,以提高营养经济和植物的存活率(leopold,1961)。衰老期间,叶细胞在生理、生物化学和新陈代谢、基因表达和结构方面发生巨大变化(buchanan-wollaston等人,2005年;基里诺等人,2000年)。最明显的表型变化是叶片发黄,这是由叶绿体退化过程中叶绿素的分解引起的,接着是大分子如蛋白质、脂类和核酸的水解,这反过来又导致细胞死亡(kim等人,2006年;woo等人,2001年)。这一过程促进了营养物质从源头到吸收组织(如快速生长的营养组织和生殖器官)的水解和再循环,这对植物发育尤其是作物产量非常重要(杨等人,2011年)。
叶子衰老是一个发育程序,伴随着许多基因表达的变化(breeze等人,2011年)。发育年龄是引发叶片衰老的主要因素,但衰老过程也受到环境因素的影响,如极端温度、干旱或盐胁迫、光照强度、黑暗、病原体侵袭、营养缺乏,以及各种内源性因素,如生殖、活性氧物种(ros)和植物激素(balazadeh等人,2014年;balazadeh等人,2010年;barth等人,2004年;brouwer等人,2012年;lee等人,2012年;oh等人,1996年;richard-molard等人,2008年;zhou等人)。在植物激素中,脱落酸(aba)、水杨酸(sa)、乙烯(et)和茉莉酮酸(ja)已被证实可促进叶片衰老,而细胞分裂素和生长素通过复杂的信号途径延缓叶片衰老(jibran等人,2013年;lim等人,2007年)。
硫辛酸(6,8-硫辛酸或1,2-二硫杂环戊烷-3-戊酸)是一种含硫辅酶,它是参与α-酮酸氧化脱羧的酶复合物活性所必需的(mattevi等人,1992;perham,1991年;里德和哈克特,1990年)和甘氨酸切割系统(藤原等人,1990年;金和奥利弗,1990年;macherel等人,1990年)。众所周知,丙酮酸脱氢酶(pdh)、2-氧代戊二酸脱氢酶(ogdh)和支链2-氧代酸脱氢酶复合物以及甘氨酸切割系统是需要硫辛酸的酶复合物(藤原等人,1990;金和奥利弗,1990年;macherel等人,1990年;mattevi等人,1992年;perham,1991年;里德和哈克特,1990)。这些酶复合物在中枢代谢中发挥重要作用。硫辛酸是通过在硫辛酸合酶催化的酰基载体蛋白(acp)上的辛酰基基团中加入两个硫原子而由辛酸合成的(miller等人,2000)。尽管已经克隆和鉴定了一些硫辛酸合酶,例如大肠杆菌中的lipa(reedandcronan,1993),酿酒酵母中的lip5(suloandmartin,1993),拟南芥中的lip1和lip1p(yasunoandwada,1998;yasuno和wada,2002),它们的硫辛酸合成酶的功能,特别是在植物发育中的功能几乎不清楚。
棉花是最重要的经济作物之一,因其纤维价值而被广泛种植。在棉花中,叶片衰老可能因某些内部因素或不均匀的环境变化而过早或过晚发生(guinn,1985)。后期衰老会影响营养物质向下沉器官的再动员,如发育中的铃。过早衰老导致皮棉产量降低和纤维性能差(wright,1998;zhao等人,2012年)。最近,虽然棉花中大量衰老相关基因已被利用核糖核酸序列鉴定出来(林等人,2015),但棉花叶片衰老的调控机制仍需进一步研究。
本发明的背景技术参考文献包括:
babiychuk,e.,vandepoele,k.,wissing,j.,garcia-diaz,m.,derycke,r.,akbari,h.,joubes,j.,beeckman,t.,jansch,l.,frentzen,m.,etal.(2011).plastidgeneexpressionandplantdevelopmentrequireaplastidicproteinofthemitochondrialtranscriptionterminationfactorfamily.procnatlacadsciusa.108,6674-6679.
balazadeh,s.,schildhauer,j.,araújo,w.l.,munné-bosch,s.,fernie,a.r.,proost,s.,humbeck,k.,mueller-roeber,b.(2014).reversalofsenescencebynresupplyton-starvedarabidopsisthaliana:transcriptomicandmetabolomicconsequences.jexpbot65,3975-3992.
balazadeh,s.,siddiqui,h.,ad,a.,lp,m.r.,caldana,c.,mehrnia,m.,mi,z.,khler,b.,muellerroeber,b.(2010).ageneregulatorynetworkcontrolledbythenactranscriptionfactoranac092/atnac2/ore1duringsalt-promotedsenescence.plantj62,250-264.
barth,c.,moeder,w.,klessig,d.f.,conklin,p.l.(2004).thetimingofsenescenceandresponsetopathogensisalteredintheascorbate-deficientarabidopsismutantvitaminc-1.plantphysiol134,1784-1792.
breeze,e.,harrison,e.,mchattie,s.,hughes,l.,hickman,r.,hill,c.,kiddle,s.,kim,y.s.,penfold,c.a.,jenkins,d.,etal.(2011).high-resolutiontemporalprofilingoftranscriptsduringarabidopsisleafsenescencerevealsadistinctchronologyofprocessesandregulation.plantcell23,873-894.
brouwer,b.,ziolkowska,a.,bagard,m.,keech,o.,gardestrom,p.(2012).theimpactoflightintensityonshade-inducedleafsenescence.plantcellenviron35,1084-1098.
buchanan-wollaston,v.,page,t.,harrison,e.,breeze,e.,lim,p.o.,nam,h.g.,lin,j.f.,wu,s.h.,swidzinski,j.,ishizaki,k.,etal.(2005).comparativetranscriptomeanalysisrevealssignificantdifferencesingeneexpressionandsignallingpathwaysbetweendevelopmentalanddark/starvation-inducedsenescenceinarabidopsis.plantj42,567-585.
chen,e.r.,wang,x.q.,gong,q.,butt,h.i.,chen,y.l.,zhang,c.j.,yang,z.r.,wu,z.x.,ge,x.y.,zhang,x.l.,etal.(2017).anovelghbee1-likegeneofcottoncausesantherindehiscenceintransgenicarabidopsisunderuncontrolledtranscriptionlevel.gene627,49-56.
clough,s.j.,bent,a.f.(1998).floraldip:asimplifiedmethodforagrobacterium-mediatedtransformationofarabidopsisthaliana.plantj16,735-743.
fujiwara,k.,okamura-ikeda,k.,motokawa,y.(1990).cdnasequence,invitrosynthesis,andintramitochondriallipoylationofh-proteinoftheglycinecleavagesystem.jbiochem265,17463-17467.
技术实现要素:
本发明要解决的技术问题是提供一种调节目的植物叶片衰老进程的基因及方法及其在棉花作物上的应用。
为解决上述技术问题,本发明所采取的技术方案如下。
调节目的植物叶片衰老进程的基因,其核苷酸序列如序列表中的seqidno:1所示。
本发明同时包含所述基因的同源基因。
本发明同时包含与所述基因具有相同功能的核苷酸序列。
本发明同时包含所述基因表达得到蛋白质。
调节目的植物叶片衰老进程的方法,通过提高或下调所述基因的表达量来调节目的植物叶片衰老进程。
通过提高所述基因的表达量来延缓植物叶片的衰老进程;通过下调所述基因的表达量来加速植物叶片的衰老进程。
包含seqidno:1所示基因的过表达载体,扩增全长基因编码序列,并克隆到pmd19-t骨架载体,pmd19-t-ghlip1载体用bami和saci酶切,基因全长orf克隆到p6myc载体的bami和saci位点;其中,用于克隆基因的引物如seqidno:2和seqidno:3所示。
seqidno:1所示基因的病毒诱导基因沉默载体,使用特异性引物克隆基因片段,并将其与pmd19-t骨架载体相连,然后用来自pmd19-t骨架载体的xbai和saci酶切基因片段,并克隆到trv2载体的相同位点;其中,所用特异性引物如seqidno:4和seqidno:5所示。
一种棉花脱叶可控方法,通过所述基因对棉花进行基因工程修饰,实现棉花作物的提前后延后脱叶。
一种脱叶可控的棉花机械采摘作业方法,基于所述的基因对棉花进行基因工程修饰,实现棉花作物的提前脱叶,创造便利条件进行机械采摘。
采用上述技术方案所产生的有益效果在于:在本发明的研究中,克隆并鉴定了棉花中的一种硫辛酸合酶,命名为ghlip1。定量反转录聚合酶链反应结果表明,ghlip1在纤维中高度表达,尤其是在纤维伸长的后期。此外,生长素诱导了ghlip1的表达。当ghlip1转化为拟南芥时,与野生型col-0相比,转基因系表现出晚叶衰老的表型。此外,利用病毒诱导基因沉默(vigs)技术敲除棉花中的ghlip1基因,导致叶片早衰甚至死亡。叶片衰老相关基因ghwrky53和ghnap在棉花中的表达显著上调。我们的研究结果揭示了ghlip1是如何调节植物叶片衰老的,并可能为今后棉花基因工程修饰的应用奠定基础,如机械采摘脱叶可控的棉花。
附图说明
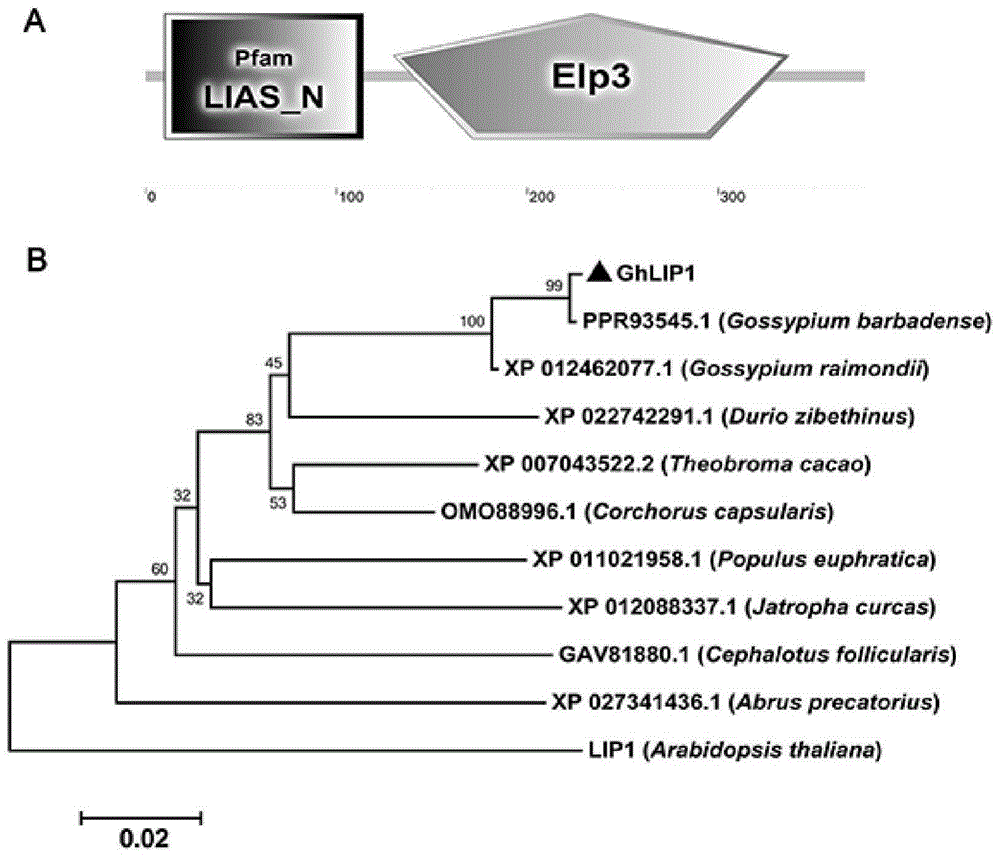
图1ghlip1的结构域分析,以及ghlip1及其同源物在其他物种中的系统发育关系。ghlip1蛋白的结构域分析。ghlip1及其同源物在莱蒙棉属、半枝莲属、可可豆属、榴莲属、胡杨属、荚膜黄麻属、毛头菇属、鸡骨草属、麻疯树属和拟南芥属中的系统发育关系。系统进化树是在mega6程序中构建的。引导数据库值是基于1,000次复制获得的。
图2ghlip1的表达谱。不同组织中ghlip1的相对表达水平。-1,胚珠在-1dpa(花后天数);0,胚珠在0dpa1、3、6、9、12、15、18、21、24、27和30,1dpa、3dpa、6dpa、9dpa、12dpa、15dpa、18dpa、21dpa、24dpa、27dpa和30dpa光纤。生长素1对吲哚乙酸的表达模式。进行了三次独立的生物复制。与0小时(studentt测验)相比有显著性差异:*,p<0.05。
图3拟南芥中col-0和ghlip1转基因系的表型分析。将植物移植到土壤混合物中三周后,col-0和转基因ghlip1系的表型。转基因拟南芥的半定量聚合酶链反应验证。ghlip1在转基因系中的表达水平高于col-0植物。atubq10被用作内部控制。拟南芥中col-0和ghlip1转基因系叶片衰老表型的比较。转基因品系叶片衰老比col-0植株晚。
图4利用vigs技术敲除ghlip1基因的棉花、仅转化trv2空载体的trv2棉花品系和仅转化根癌农杆菌gv3101的wt棉花品系的表型分析。上述三种棉花类型的表型。trv2::ghlip1棉株系的真叶全部枯萎死亡,但trv2棉株系和wt棉株系均正常生长。上述三种棉花的成活率分析。进行了三次独立的生物复制。数值是平均值标准差(n=60,studentt检验,***,p<0.01)。上述三种棉花类型的快速定量聚合酶链反应验证。分析了三个独立的生物复制。与trv2棉系相比有显著差异。studentt测试,*p<0.05。
图5利用vigs技术敲除ghlip1基因的棉花衰老相关基因的表达分析,只转化trv2空载体的trv2棉花系和只转化gv3101(根癌农杆菌)的wt棉花系。敲除ghlip1基因的棉花中ghwrky53和ghnap两个衰老相关基因的表达水平高于仅转化trv2空载体的对照棉花。误差线代表三个独立工厂的标准差。studentt测试,*p<0.05;***,p<0.001。
图6iaa和ghlip1调控棉花叶片衰老的假设模型。吲哚乙酸促进生长素1的表达,生长素1抑制促进棉花叶片衰老的衰老相关基因ghwrky53和ghnap的表达。
具体实施方式
以下实施例详细说明了本发明。本发明所使用的各种原料及各项设备均为常规市售产品,均能够通过市场购买直接获得。
在以下实施例的描述中,为了说明而不是为了限定,提出了诸如特定系统结构、技术之类的具体细节,以便透彻理解本申请实施例。然而,本领域的技术人员应当清楚,在没有这些具体细节的其它实施例中也可以实现本申请。在其它情况中,省略对众所周知的系统、装置、电路以及方法的详细说明,以免不必要的细节妨碍本申请的描述。
应当理解,当在本申请说明书和所附权利要求书中使用时,术语“包括”指示所描述特征、整体、步骤、操作、元素和/或组件的存在,但并不排除一个或多个其它特征、整体、步骤、操作、元素、组件和/或其集合的存在或添加。
还应当理解,在本申请说明书和所附权利要求书中使用的术语“和/或”是指相关联列出的项中的一个或多个的任何组合以及所有可能组合,并且包括这些组合。
如在本申请说明书和所附权利要求书中所使用的那样,术语“如果”可以依据上下文被解释为“当...时”或“一旦”或“响应于确定”或“响应于检测到”。类似地,短语“如果确定”或“如果检测到[所描述条件或事件]”可以依据上下文被解释为意指“一旦确定”或“响应于确定”或“一旦检测到[所描述条件或事件]”或“响应于检测到[所描述条件或事件]”。
另外,在本申请说明书和所附权利要求书的描述中,术语“第一”、“第二”、“第三”等仅用于区分描述,而不能理解为指示或暗示相对重要性。
在本申请说明书中描述的参考“一个实施例”或“一些实施例”等意味着在本申请的一个或多个实施例中包括结合该实施例描述的特定特征、结构或特点。由此,在本说明书中的不同之处出现的语句“在一个实施例中”、“在一些实施例中”、“在其他一些实施例中”、“在另外一些实施例中”等不是必然都参考相同的实施例,而是意味着“一个或多个但不是所有的实施例”,除非是以其他方式另外特别强调。术语“包括”、“包含”、“具有”及它们的变形都意味着“包括但不限于”,除非是以其他方式另外特别强调。
叶子是产生光合产物的主要器官。叶片衰老促进了养分从源到库的再流动,这极大地影响了作物的品质和产量。尽管通过抑制消减杂交和核糖核酸序列鉴定出棉花中许多衰老相关基因,但关于棉花中硫辛酸合酶在叶片衰老中的作用知之甚少。
在本发明的研究当中,我们从棉花中分离出一个硫辛酸合成酶基因,命名为ghlip1。蛋白质结构域分析显示ghlip1含有lias-n结构域和elp3结构域。表达模式分析表明ghlip1在纤维器官中高表达,其表达受植物激素iaa诱导。当ghlip1转化为拟南芥时,与野生型拟南芥col-0相比,过量表达的拟南芥植株的叶片表现出较晚的叶片衰老。此外,利用病毒诱导的基因沉默(vigs)技术下调ghlip1的表达导致棉花早期叶片衰老。快速定量聚合酶链反应(qrt-pcr)分析表明,在敲除ghlip1基因的棉花植株中,两个衰老相关基因ghwrky53和ghnap上调。这些结果表明ghlip1在棉花叶片衰老中起着重要作用。
本发明的相关研究所涉及的材料和方法分述如下。
①植物材料和生长条件
在这项研究中,拟南芥生态型哥伦比亚-0(col-0)被用于我们的研究。拟南芥的种植和栽培方法根据之前的研究(chen等人,2017年)。
t1代转基因种子播种在含有潮霉素(25μg·l-1)的固体质谱培养基上。十二天后,从非抗性幼苗中选择具有两个真叶和一个较长初生根的潮霉素抗性幼苗(t2代),并移植到含有营养土和蛭石(v/v=2)的土壤混合物中生长。三周后和四十五天后,拍摄转基因品系和col-0的表型(佳能,eos80d)。拟南芥幼苗生长在恒温20℃和16小时光照/8小时黑暗光周期的室内。
棉花品种陆地棉ccri24播种在含有营养土的盆中,在生长室中生长。棉花幼苗在一周大时使用vigs(病毒诱导的基因沉默)技术进行渗透(庞等人,2013年)。对于该实验,生长室具有25℃的恒定温度和16小时的光照/8小时的黑暗光周期。此外,为了分离核糖核酸,快速收集三叶期幼苗的棉花叶,在液氮中冷冻并进一步储存在-80℃下。生长室具有28℃的恒定温度和16小时的光照/8小时的黑暗光周期。
②核糖核酸提取和cdna合成
为了从各种组织样品中分离总核糖核酸,根据制造商的说明使用核糖核酸制备纯植物试剂盒(中国天根)。然后,按照制造商的方案,用引物逆转录试剂盒(primescriptrt试剂盒)和gdna橡皮擦(takara,中国大连)合成第一链cdna,并将这些cdna用作随后的逆转录聚合酶链反应和快速逆转录聚合酶链反应中的模板。
③载体的构造
为了产生ghlip1基因的过表达载体,使用特异性ghlip1引物和引物星形hs脱氧核糖核酸聚合酶(takara,中国大连)从ccri24扩增全长ghlip1编码序列,并克隆到pmd19-t骨架载体(takara,中国大连)中。pmd19-t-ghlip1载体用bami和saci酶切,ghlip1全长orf克隆到p6myc载体的bami和saci位点。本研究用于克隆ghlip1的引物如下:正向(f)(5′-ggatctattatcgatcgctcgctttacc-3′seqidno:2)和反向(r)(5′-gactctctctatgaagcagaac-3′seqidno:3)。
为了获得ghlip1基因的vigs(病毒诱导基因沉默)载体,使用特异性引物克隆ghlip1基因片段,并将其与pmd19-t骨架载体相连。然后,用来自pmd19-t骨架载体的xbai和saci酶切ghlip1片段,并克隆到trv2载体的相同位点。本研究中使用的特异性引物如下:f(5′-tctagatcggacgtctttgctcatatata-3′seqidno:4)和r(5′-gactctctatgaagagcagaac-3′seqidno:5)。
④拟南芥的转化
为了获得过度表达的转基因植物,拟南芥被转化为使用五口蘸方法(克劳夫和本特,1998)。根据之前的研究选择转基因植物(王等人,2018年),同时筛选抗生素将卡那霉素改为潮霉素。
⑤病毒诱导的基因沉默(vigs)
为了获得基因敲除的棉花品系,根据以前的研究应用了vigs技术(庞等人,2013年)。
⑥半定量逆转录聚合酶链反应分析
为了检测ghlip1在拟南芥中是否过表达,使用从转基因系和col-0植物的叶子中提取的总核糖核酸制备了cdna。然后使用2×taq聚合酶链反应主混合物(中国cwbio)用下列特异性引物进行聚合酶链反应扩增:f(5′-tggacgtcttctctctcatata-3′seqidno:6)和r(5′-ctatgaagcagacagaac-3′seqidno:7)。在加热盖热循环仪(美国应用生物系统公司)中,在以下条件下进行多氯联苯回收:在94℃预变性4分钟,随后在94℃30秒、56℃30秒和72℃30秒循环27次,然后在72℃10分钟和12℃储存。以atubq10(at4g05320)为内标,使用以下引物:f(5′-gactttgccggaaacaatgg-3′seqidno:8)和r(5′-tagaaagaagatagaacagg-3′seqidno:9)。
⑦定量逆转录聚合酶链反应
为了确定vigs棉株ghlip1基因是否下调以及衰老相关基因的表达是否发生变化,采用qrt-pcr方法分析了vigs棉株和对照植株ghlip1和衰老相关基因的转录水平。使用从上述样品中提取的总核糖核酸合成用于检测基因表达的cdnas。根据制造商的说明,反应在应用生物系统quantstudio6flex系统上进行,使用sybr预混料extaq(tlirnaseplus)(中国大连takara)。每个聚合酶链反应进行三次,并定量三次生物复制。ghhis3基因被用作内部对照,以标准化ghlip1基因的相对表达水平,并使用2-δδct方法计算结果。用于定量逆转录聚合酶链反应的引物见下表。
表s1用于分析ghlip1和衰老相关基因表达模式的特异性qrt-pcr引物
实施例1、ghlip1基因克隆及系统发育分析
为了从异源四倍体棉花ccri24克隆ghlip1基因,lip1蛋白序列被用作blast陆地棉棉花转录本数据库的查询。克隆并测序了与lip1相似性最高的棉花ortholog,lip1的ortholog基因命名为ghlip1。使用smart进行的结构域分析表明,ghlip1序列包含一个lias结构域和一个elp3结构域(图1a)。结果表明,ghlip1属于硫辛酸合酶家族蛋白。为了研究ghlip1及其同源物之间的进化关系,我们进行了系统发育分析,发现ghlip1及其来自其他两个棉花物种的同源物表现出较高的相似性并聚集在一起。此外,ghlip1与二倍体棉种ppr93545.1和杜里奥紫贝丁种棉种棉株xp_022742291.1更相似(图1b)。这些结果表明,异源四倍体陆地棉中的ghlip1可能来源于二倍体海岛棉,棉花中的ghlip1蛋白可能与杜里欧紫叶棉中的xp_022742291.1有共同的祖先。
实施例2、ghlip1表达的定量pcr分析
为了更好地理解ghlip1的潜在功能,应用实时聚合酶链反应分析其在不同组织中的表达谱,包括根、芽、叶、萼片、花瓣、花药、在-1和0dpa(花后天数)的胚珠以及1dpa至30dpa的纤维。表达模式分析结果表明,ghlip1在-1和0dpa的胚珠中表达水平很低,但在21-30dpa的纤维样品中相对较高,特别是在30dpa。此外,除上述样品外,其他样品中ghlip1的表达水平中等(图2a)。此外,qrt-pcr结果还显示,生长素上调了ghlip1的表达水平,并且在生长素处理3h和6h后基因表达显著升高(图2b)。这表明ghlip1可能在纤维成熟中起重要作用,并受植物激素iaa的调节。
实施例3、转基因拟南芥植物的表型分析
快速分析ghlip1在棉花中的作用。ghlip1基因被转化为拟南芥。将阳性品系和野生型col-0移植到同一盆中,三周后阳性品系和col-0之间没有表型差异(图3a)。半定量逆转录聚合酶链反应分析显示,三个阳性系均为转基因拟南芥(图3b)。四十五天后,过表达ghlip1的转基因品系的叶片显示出比col-0晚的叶片衰老(图3c)。这些结果提示ghlip1可能是棉花叶片衰老的负调节因子。
实施例4、利用vigs技术敲除ghlip1基因导致棉花早期叶片衰老
为了保证ghlip1在棉花叶片衰老中的作用,利用vigs技术产生了敲除ghlip1基因的棉花品系。转化后三周,含有trv2::glip1的转化gv3101的棉花枯萎,子叶上部死亡(图4a)。而分别转化含有trv2空载体的gv3101和gv3101的对照品系表现出正常的生长发育(图4a)。此外,统计结果与观察结果一致(图4a和图2)。qrt-pcr分析证实,与上述两个棉花对照品系相比,trv2::ghlip1系中ghlip1基因的敲除(图4c)。这些结果表明,基因敲除促进了棉花叶片衰老,进一步保证了基因敲除对叶片衰老的作用。
实施例5、基因敲除的棉花衰老相关基因的表达分析
许多基因与叶子衰老有关(babiychuk等人,2011年;lin等人,2015年;ren等人,2012年)。为了获得叶片衰老的遗传控制,利用vigs技术,通过快速定量聚合酶链反应(qrt-pcr)检测了转化gv3101、含有trv2的gv3101和含有trv2::ghlip1的gv3101的棉花植株中与叶片衰老相关的基因的表达水平。本研究分析了控制棉花叶片衰老的两个基因——ghwrky53和ghnap。结果表明,与转化含有trv2的gv3101的对照棉花植株相比,上述两个基因在trv2::ghlip1棉花植株中均具有较高的表达水平,而转化含有trv2的gv3101的棉花植株和作为另一对照的gv3101之间没有显著差异(图5)。表明ghlip1影响衰老相关基因来调节叶片衰老。
实施例6、结果分析
硫辛酸(6,8-硫辛酸或1,2-二硫杂环戊烷-3-戊酸)是一种含硫辅酶,是参与中枢代谢的酶复合物活性所必需的。丙酮酸脱氢酶、甘氨酸切割系统、2-氧代戊二酸脱氢酶和支链2-氧代酸脱氢酶复合物被称为需要硫辛酸的酶复合物(藤原等人,1990;金和奥利弗,1990年;macherel等人,1990年;mattevi等人,1992年;perham,1991年;里德和哈克特,1990)。然而,硫辛酸是由辛酸合成的,并由硫辛酸合酶催化(miller等人,2000)。这些结果表明硫辛酸合酶在植物代谢、生长发育中具有重要作用。
这里,我们首先用同源克隆方法从棉花中分离出硫辛酸合酶基因ghlip1。序列分析表明,ghlip1的氨基酸序列含有高度保守的lias-n结构域和elp3结构域(图1a),这表明它是棉花中硫辛酸合酶的蛋白质。系统发育分析显示,ghlip1与其来自两个棉花物种——海岛棉和雷蒙棉(图1b)的同源基因有更密切的进化关系,但与其来自拟南芥的同源基因有更远的进化关系。这些结果表明硫辛酸合酶在棉花和拟南芥中具有不同的功能。
拟南芥中的lip1和lip1p已被克隆,它们具有硫辛酸合酶的活性(yasuno和wada,1998;yasuno和wada,2002),但硫辛酸合酶的功能,特别是在植物生长发育中的功能几乎不清楚。辛格的研究发现,α硫辛酸可以通过维持细胞膜稳定性和影响许多其他生理参数来延长唐菖蒲花的花瓶插寿命(辛格和杰加德森,2003年)。结果表明硫辛酸合酶对瓶插寿命有重要作用。一项对拟南芥叶片自然衰老过程中表达上调的基因的全球研究发现,硫辛酸合酶的两个基因(at5g08410和at2g20860)参与了这一过程(gepstein等人,2004年)。陆地棉子叶衰老相关基因的鉴定也发现硫辛酸合酶基因是一个差异表达的基因。这些结果提示硫辛酸合酶可能在叶片衰老中起重要作用。在我们的研究中,我们发现转基因拟南芥比col-0表现出更晚的叶片衰老(图3c)。此外,利用vigs技术敲除棉花中的ghlip1基因导致早期叶片衰老甚至死亡表型(图4a和图4b)。然而,用作对照的棉花系是正常生长和发育的(图4a)。这些结果表明ghlip1确实参与了叶片衰老,并对叶片衰老起到负调节作用。
植物激素已被广泛报道调节植物叶片衰老,脱落酸、内皮素、茉莉酸、溴化阻燃剂和水杨酸起诱导剂的作用,生长素、细胞分裂素和赤霉酸起抑制剂的作用(gan和amasino,1997;jibran等人,2013年;jing等人,2005年;kusaba等人,2013年;vandergraaff等人,2006年)。生长素,因其在调节植物的根结构、分枝和叶片发育、病原体相互作用和叶片衰老中的作用而众所周知(江等人,2014;lim等人,2007年;ouellet等人,2001年;rouse等人,1998年;shi等人,2014年;shoji等人,1951年)。内源生长素水平随着叶龄而下降,并且生长素水平的变化和茎随着衰老的发生在菜豆叶片中大致相等(shoji等人,1951年)。在这项研究中,生长素治疗上调了ghlip1的表达谱(图2b)。同时,转基因拟南芥具有晚期叶片衰老表型(图3),棉花中敲除的ghlip1基因导致早期叶片衰老和死亡表型(图4)。此外,在敲除ghlip1基因的棉花中,两个衰老相关基因ghwrky53和ghnap的表达水平高于对照棉花(图5)。因此,基于以上所有结果,我们提出了一个假说,即生长素1受吲哚乙酸调节,生长素1也调节其他衰老相关基因来调节棉花叶片衰老(图6)。
以上所述实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围,均应包含在本发明的保护范围之内。
序列表
<110>河南科技学院
<120>调节目的植物叶片衰老进程的基因及方法及其在棉花作物上的应用
<160>17
<170>siposequencelisting1.0
<210>1
<211>1134
<212>dna
<213>棉属棉花(gossypiumhirsutum)
<400>1
atgatgcaatctcgctttacctctgttgttcgtgccatatcatccgccgcaaaggcaagg60
cccttctcatccaccatcgattcacctacccccaccaaacccgatttccctcccaccctt120
gctggcctccgggcccgccttgccgccgaatctcccaccctctccgattttttcggtctc180
caaaccaataacctctattcggtcgaagtcggcaccaagaaaaaaccgctccctaagccc240
aaatggatgagagaatccattcccggcggcgaaaaatacgttcagattaaagccaaatta300
agggaattaaaactccacactgtctgcgaagaagctcgatgccccaatcttggcgagtgc360
tggtccggtggcgagactgggaccgcaactgccaccataatgatcctgggtgatacttgt420
actcgcggttgcaggttttgcaacgtgaagacgtcgcgaacgccgcctccaccagatccc480
gatgaaccgaggaatgttgcggaggcaattgcatcgtggggtttggattacgtggtgatt540
acgagcgtggaccgggatgatttggctgatcaaggaagtgggcattttgcggaaaccgtt600
gagaagttgaaaactttgaagccaaatatgcttatagaagccttggttcctgatttccgg660
gcagatgctgcctgtgtagagaaagttgcaaaatctggattggacgtctttgctcataat720
atcgagactgttgaagaacttcaaagggttgtacgtgatcaccgtgctaattttaagcaa780
tctttggatgttctaatgatggccaaagagtatgttcctgctggaacacttaccaagact840
tcgattatgttaggatgtggagaaacgcctgatcaagttgtgaaaacaatggagaaggtc900
agagcagcaggtgttgatgtaatgacattcggtcagtacatgagaccatcaaagcgtcac960
atgcccgtatcagaatatattacacctgaagcttttggaaaatatcgagcccttggcatg1020
gaaatgggatttcgatatgtggcatctggtcccatggtcagatcatcctacaaggcagga1080
gaattctacatcaaatctatgatagaatctgatcgttctgctgctgcttcatag1134
<210>2
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>2
ggatctattatcgatcgctcgctttacc28
<210>3
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>3
gactctctctatgaagcagaac22
<210>4
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>4
tctagatcggacgtctttgctcatatata29
<210>5
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>5
gactctctatgaagagcagaac22
<210>6
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>6
tggacgtcttctctctcatata22
<210>7
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>7
ctatgaagcagacagaac18
<210>8
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>8
gactttgccggaaacaatgg20
<210>9
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>9
tagaaagaagatagaacagg20
<210>10
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>10
tcgctttacctctgttgttcg21
<210>11
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>11
gaccgaaaaaatcggagagg20
<210>12
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>12
ccccagaaaaacaacataaatc22
<210>13
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>13
cgctctttatacacccaaatg21
<210>14
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>14
caggctcatattctcgtttgt21
<210>15
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>15
cctgactcagtactgtaattg21
<210>16
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>16
gccaagcgtgtcacaattatg21
<210>17
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>17
acatcacattgaacctaccactacc25
- 还没有人留言评论。精彩留言会获得点赞!