一种DNA催化网络调控的纳米粒子结晶的方法与流程
本发明涉及dna纳米技术领域,具体涉及一种dna催化网络调控的纳米粒子结晶的方法。
背景技术:
watson-crick碱基互补配对的特异性和可预测性使dna成为一种功能强大的纳米材料。通过程序化设计dna链之间的反应,这种dna纳米材料可用于构建各种具有复杂结构和不同功能的dna纳米结构和纳米器件。其中,在动态dna纳米技术领域,dna链替换作为一类特殊的dna反应受到人们的广泛关注。dna链替换反应是两条部分或完全互补的dna链相互杂交的同时替换掉一条或多条预先杂交的dna链的过程,通常由一个短的单链悬挂端区域(称为toehold)引发。反应过程中释放的单链dna可以进一步引发下游反应,从而构成复杂的反应体系。因此,dna链替换反应被广泛应用于构建各种dna纳米器件,如dna反应线路、催化放大器、自动的分子行走及可重构的dna纳米结构等。
在材料科学领域,纳米粒子可作为结构单元通过自下而上的方式组装形成各种纳米材料。通过精确调控粒子间的相互作用,这些纳米粒子能够被诱导形成新的物质形态。例如,将dna分子接枝到纳米粒子表面可以在粒子之间形成特异性的相互作用。这种dna修饰的纳米粒子也被称为“可编程的原子等价物”(paes)。和原子一样,paes可以通过组装形成三维超晶格结构;而区别于原子的是,paes本身携带的信息(粒子表面的dna序列)可以用来调控粒子间的相互作用,从而程序设计平衡态的晶体结构。目前,mirkin等人利用dna功能化的金纳米粒子作为结构单元进行组装,能够制备得到各种不同晶型的超晶格结构,如面心立方、体心立方、alb2型、cs6c60型等。
通常情况下,这种dna诱导的纳米粒子组装在常温下易于形成无序结构,需要经过退火处理得到长程有序排列的超晶格结构。然而,相比于游离状态下的双链dna,dna修饰的纳米粒子组装体具有更窄的熔融转变区间(约2-8℃)。因此,为制备高质量的纳米粒子超晶格,通常需要严苛的退火条件。此外,对于高温下结构和性能不稳定的纳米粒子,利用退火的方法制备超晶格结构难以实现。
技术实现要素:
(一)要解决的技术问题
解决退火方法在制备纳米粒子超晶格材料上的不足;建立dna催化网络调控的纳米粒子结晶的方法,并利用该方法在常温下制备纳米粒子超晶格材料。
(二)技术方案
本发明提供了一种dna催化网络调控的纳米粒子结晶的方法,所述方法的实施原理参阅图4,图4示意性示出了dna催化网络调控的纳米粒子结晶原理图。具体地,反应体系由三链底物链、单链燃料链和双链dna修饰的纳米粒子(双链dna-纳米粒子)构成。初始状态下,双链dna-纳米粒子表面的黏性末端(区域f)被完全或部分保护,双链dna-纳米粒子无法通过黏性末端的杂交进行组装,因此反应体系保持稳定。当向反应体系中加入催化链后,催化链中的区域a*与底物链中的toehold区域a结合,引发dna链替换反应。反应完成后,中间产物中产生新的toehold区域c,继续引发新一轮和燃料链之间的dna链替换反应。最终释放出两条单链dna:其中催化链继续驱动dna催化网络的运行;引发链随后替换掉双链dna-纳米粒子上的保护链,同时释放出黏性末端(区域f)。通过不断释放的黏性末端之间的杂交,纳米粒子之间的相互作用随时间逐步增强,表现出一种时间依赖的相互作用机制。在这种机制下,纳米粒子逐步完成组装并进一步通过调控粒子间的相互作用组装得到超晶格结构。
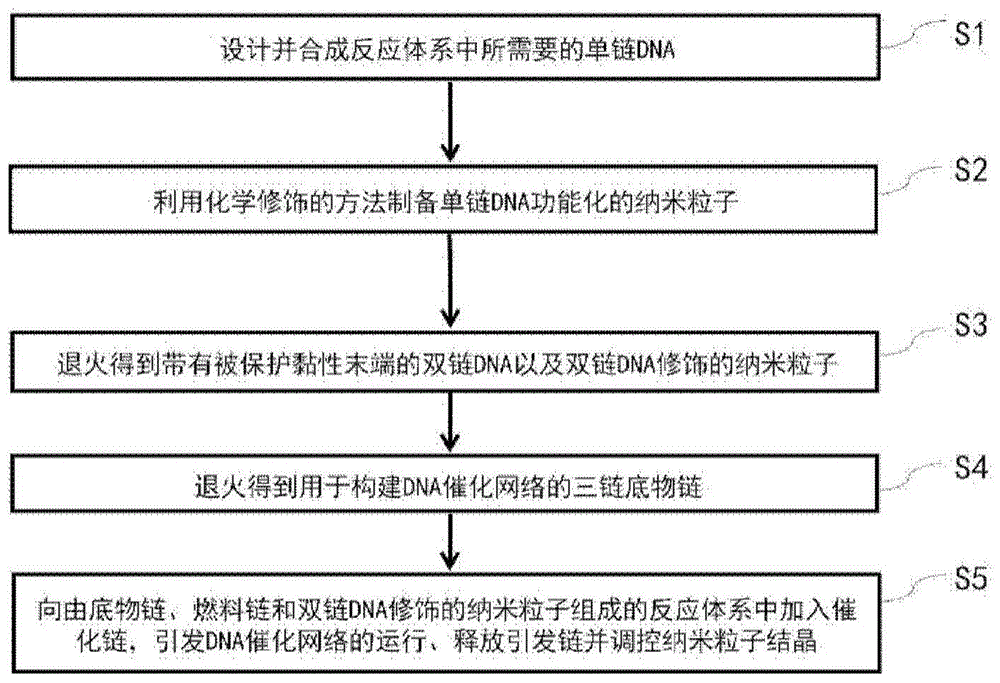
具体地,本发明提供的方法包括如下步骤:s1,设计并合成反应体系中所需要的单链dna;s2,利用化学修饰的方法制备单链dna功能化的纳米粒子;s3,退火得到带有被保护黏性末端的双链dna以及双链dna-纳米粒子;s4,退火得到用于构建dna催化网络的三链底物链;s5,向由底物链、燃料链和双链dna-纳米粒子组成的反应体系中加入催化链,引发dna催化网络的运行、释放引发链并调控纳米粒子结晶。
可选地,步骤s5中,在一预设范围内降低催化链的加入量可以减慢引发链的释放,从而提高由双链dna-纳米粒子组装得到的结构中纳米粒子排列的有序度。
可选地,步骤s5中,在dna催化网络调控下,组装过程中纳米粒子之间的相互作用随时间逐步增强,表现出一种时间依赖的相互作用机制。
可选地,步骤s4中,底物链由三条单链dna按一预设比例范围退火杂交形成,得到的底物链直接用于构建dna催化网络,不需要额外的纯化处理。
可选地,步骤s3中,双链dna由连接链和保护链退火杂交形成,通过连接链与保护链的杂交,双链dna-纳米粒子表面的黏性末端被完全或部分保护,从而使所述黏性末端的杂交性能被抑制。
可选地,步骤s3中,双链dna-纳米粒子结构中包含由4-10个碱基组成的toehold区域,用于引发和引发链之间的dna链替换反应并进一步释放出所述被完全或部分保护的黏性末端。
可选地,步骤s3中,双链dna与接枝在纳米粒子表面的单链dna的摩尔比在0.3∶1到1∶1之间。
可选地,步骤s5中,底物链与修饰在纳米粒子表面的双链dna的摩尔比在1.5∶1到4∶1之间。
可选地,该方法的反应条件为室温。
(三)有益效果
1.通过本发明提供的方法可以制备得到面心立方、体心立方以及alb2等结构的纳米粒子超晶格材料。
2.本发明提供的方法操作简单,不需要精密的仪器设备,而且反应体系中所有反应物一次性加入,不需要额外的实验操作。
3.通过本发明提供的方法可以选择性激活两组分纳米粒子的组装,实现不同的组装动力学路径,从而由同一组装体系得到两种不同的超晶格结构。
4.通过本发明提供的方法可以制备得到以蛋白作为结构单元的超晶格材料或以蛋白和无机纳米粒子共同作为结构单元的复合超晶格材料。
5.本发明提供的方法可以在常温或更低的温度下进行,有利于维持结晶过程中纳米粒子(如蛋白)结构和性能的稳定。
附图说明
图1示意性示出了本发明提供的dna催化网络调控的纳米粒子结晶方法的实施流程图;
图2示意性示出了带有被保护黏性末端的双链dna-纳米粒子的构建示意图;
图3示意性示出了三链底物链的具体结构图;
图4示意性示出了dna催化网络调控的纳米粒子结晶原理图;
图5a示意性示出了本发明实施例中引发链释放速率的荧光动力学表征原理图;
图5b示意性示出了本发明实施例中引发链释放速率的荧光动力学表征结果图;
图6示意性示出了本发明实施例中dna催化网络调控下金纳米粒子聚集速率的动力学表征结果图;
图7示意性示出了本发明实施例中组装体结构的小角x射线散射表征结果图。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚明白,以下结合具体实施例,并参照附图,对本发明作进一步的详细说明。
本实例在以本发明技术方案为前提下进行实施,给出了比较详细的实施方式和过程。应理解,这些实施例是用于说明本发明而不限于本发明保护的范围。实施例中采用的实施条件可以根据具体厂家的条件做进一步的调整,未注明的实验条件通常按照常规实验中的条件。
本发明实施例通过构建带有自互补黏性末端的单组分金纳米粒子组装体系,使金纳米粒子在dna催化网络调控下组装形成面心立方超晶格结构,参阅图4,图4示意性示出了dna催化网络调控的纳米粒子结晶原理图。本发明实施例中用到的金纳米粒子从nanocomposix公司购买。所有用到的试剂都是分析纯级别,购买以后直接使用。其中三(2-羧乙基)膦盐酸盐(tcep)从alfaaesar公司购买,其他化学试剂从国药集团购买。参阅图1,图1示意性示出了本发明提供的dna催化网络调控的纳米粒子结晶方法的实施流程图,具体的实施步骤如下:
第一步,设计反应体系中所需要的单链dna,并交由上海生工生物工程公司合成。
第二步,通过形成au-s共价键制备单链dna功能化的金纳米粒子:
1.巯基修饰的单链dna(巯基链)用过量的tcep活化一小时,之后用体积排除色谱柱nap5(gehealthcare)分离纯化。
2.活化后的巯基链与直径为10nm的金纳米粒子以300∶1摩尔比混合,4℃静置过夜。
3.然后,依次加入2%十二烷基硫酸钠(sds)溶液和200mm磷酸钠缓冲溶液(pb,ph=7.4),分别调节溶液浓度至0.01%sds和10mmpb,4℃静置12小时。
4.接着,向溶液中分5次逐步加入5mnacl溶液,每次间隔12小时,直至溶液的nacl浓度为0.5m。最后一次加完后25℃静置过夜。
5.没有接枝到金纳米粒子表面的巯基链通过3次离心处理(13500转/小时,1小时)去除。最终沉淀重新分散于0.5mpbs(10mmpb,0.5mnacl)。
6.利用cary300紫外可见分光光度计测定巯基链-金纳米粒子浓度。
第三步,制备带有被保护自互补黏性末端的双链dna-金纳米粒子,参阅图2,图2示意性示出了带有被保护黏性末端的双链dna-纳米粒子的构建示意图:
1.双链dna由连接链和保护链退火杂交形成,本发明实施例中保护链与连接链等摩尔比混合,95℃加热10分钟,接着退火至室温。
2.双链dna与巯基链-金纳米粒子按30:1摩尔比混合,45℃加热30分钟,接着退火至室温,以确保所有的双链dna都能够修饰到金纳米粒子表面,且每个粒子表面接枝约相等数量的双链dna,其中,双链dna与接枝在金纳米粒子表面的巯基链的摩尔比约为0.375∶1。
3.在形成的双链dna-金纳米粒子结构中,黏性末端(区域f)为包含4个碱基的自互补序列(5’-gcgc3’);保护链上的区域f1*包含3个碱基,这里,黏性末端被部分保护是为了在抑制黏性末端杂交性能的同时提高dna链替换反应的效率;区域e含有6个碱基,作为toehold引发dna链替换反应并进一步释放出被部分保护的黏性末端。
第四步,制备用于构建dna催化网络的三链底物链,参阅图3,图3示意性示出了三链底物链的具体结构图:三链底物链由三条单链dna杂交而成。具体地,下-底物链、引发链和副产物链按1.1∶1∶1摩尔比混合,95℃加热10分钟,接着退火至室温,其中,得到的底物链直接用于构建dna催化网络,不需要额外的纯化处理。
第五步,向由上述底物链、燃料链和双链dna-金纳米粒子组成的反应体系中加入催化链,引发dna催化网络的运行和双链dna-金纳米粒子的组装并进一步对引发链释放速率、金纳米粒子聚集速率以及反应得到的组装体结构进行表征:
1.引发链释放速率的荧光动力学表征:
首先,cy5荧光基团修饰的荧光-报告链de与bhq2淬灭基团修饰的淬灭-报告链d*按1∶1.1摩尔比混合,退火形成双链报告链。报告链中的区域e作为toehold引发报告链与dna催化网络中释放的引发链之间的链替换反应,具体参阅图5a,图5a示意性示出了本发明实施例中引发链释放速率的荧光动力学表征原理图。反应后,淬灭-报告链与荧光-报告链分离,释放出荧光。
然后,向由底物链(1.5μm)、燃料链(3μm)和报告链(0.75μm)组成的反应体系中加入不同浓度的催化链(0-10nm),室温反应并用f-7000荧光光谱仪监测反应体系中荧光强度随时间的变化。
实验结果参阅图5b,图5b示意性示出了本发明实施例中引发链释放速率的荧光动力学表征结果图,当催化链浓度为10nm时,荧光强度迅速增加并在1小时内达到平衡;随着催化链浓度的降低,荧光强度的变化呈衰减的趋势。这表明通过改变催化链的加入量可以调控dna催化网络的运行,进而调控引发链的释放速率。
2.dna催化网络调控下金纳米粒子聚集速率的动力学表征:
向由底物链(1.5μm)、燃料链(3μm)和双链dna-金纳米粒子(25nm)组成的反应体系中加入不同浓度的催化链(0-5nm),室温反应得到金纳米粒子组装体,其中,反应体系中底物链与修饰在金纳米粒子表面的双链dna的摩尔比为2∶1。在此过程中,利用cary300紫外可见分光光度计监测反应体系中吸光度值随时间的变化(金纳米粒子的聚集及聚集体的沉降会引起反应体系的吸光度值降低)。
实验结果参阅图6,图6示意性示出了本发明实施例中dna催化网络调控下金纳米粒子聚集速率的动力学表征结果图,当催化链浓度为5nm时,反应体系的吸光度值迅速降低并在6小时内达到平衡;随着催化链浓度的降低,吸光度值降低的速率减慢。这表明在dna催化网络调控的金纳米粒子组装体系中,金纳米粒子的聚集速率可以通过改变催化链的加入量来调控。
3.金纳米粒子组装体的小角x射线散射表征:
首先,向由底物链(1.5μm)、燃料链(3μm)和双链dna-金纳米粒子(25nm)组成的反应体系中加入不同浓度的催化链(0.5-50nm),室温反应几小时至数天,直至金纳米粒子聚集完全。作为对照,引发链(1.5μm)不通过dna催化网络释放,直接与双链dna-金纳米粒子(25nm)反应,引发金纳米粒子组装。
然后,聚集完全的金纳米粒子组装体转移至直径1.0毫米的石英毛细管中,进行小角x射线散射表征,x射线波长
实验结果参阅图7,图7示意性示出了本发明实施例中组装体结构的小角x射线散射表征结果图,随着催化链浓度从50nm降至0.5nm,面心立方结构的特征散射峰逐渐出现并清晰,表明在dna催化网络调控的金纳米粒子组装体系中,通过在一预设范围内降低催化链的加入量可以减慢引发链的释放,从而提高组装体中金纳米粒子排列的有序度,最终得到面心立方超晶格结构。这进一步证明了dna催化网络调控的纳米粒子结晶方法的可靠性。
上述实施例中涉及的序列如下:
巯基链(5'到3'):
hs-aaaaaaaaaaaagacgaatatttaacaa(seqidno.1)
连接链(5′到3′):
cgcgacggtaagttagttgaggatctgattgttaaatattcgtctt(seqidno.2)
保护链(5′到3′):
ctcaactaacttaccgtcgc(seqidno.3)
下-底物链(5′到3′):
tgaagggcgagtatgatatggcagggcggtaagttagttgaggatctg(seqidno.4)
副产物链(5'到3′):
tttttttttttttttccctgccatatcatactcgc(seqidno.5)
引发链(5′到3′):
cagatcctcaactaacttaccg(seqidno.6)
燃料链(5′到3′):
ctcaactaacttaccgccctgccatatcatactcgc(seqidno.7)
催化链(5′到3′):
gccatatcatactcgcccttca(seqidno.8)
荧光-报告链(5′到3′):
cy5-cggtaagttagttgaggatctg(seqidno.9)
淬灭-报告链(5'到3′):
ctcaactaacttaccg-bhq2(seqidno.10)
以上所述的具体实施例,对本发明要解决的技术问题、技术方案和有益效果进行了进一步详细说明,所应理解的是,以上所述仅为本发明的具体实施例而已,并不用于限制本发明,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!