一种裂解多糖单加氧酶及制备方法与流程
本发明属于酶基因工程
技术领域:
,尤其涉及一种裂解多糖单加氧酶及制备方法。
背景技术:
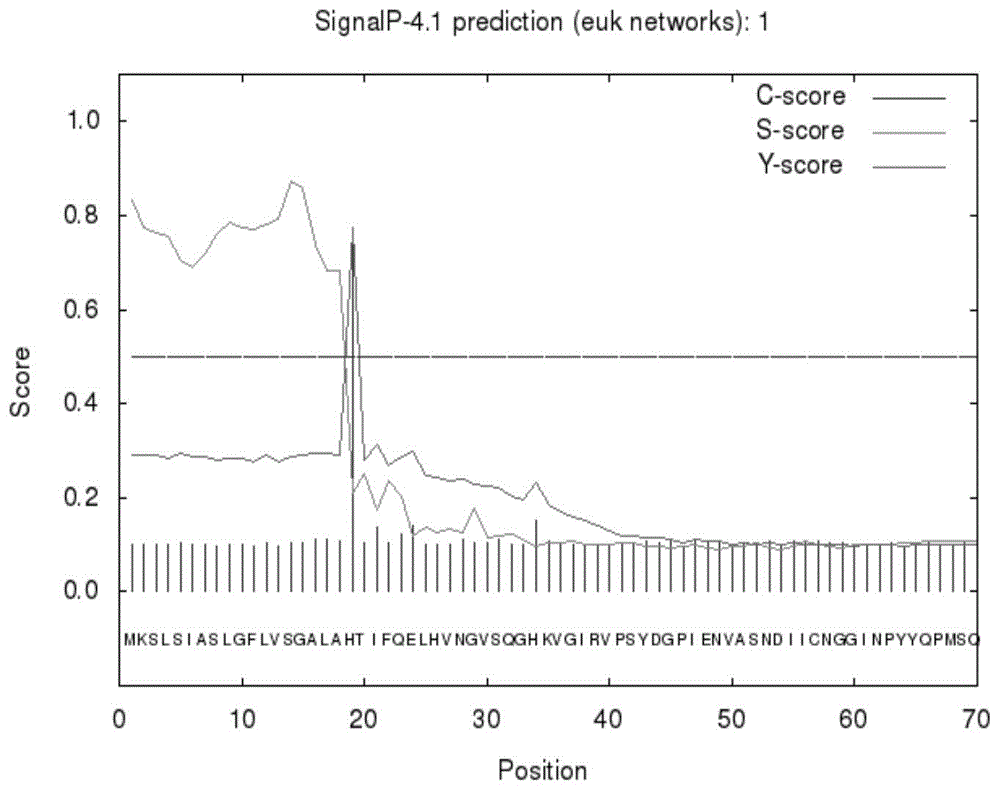
:我国秸秆产量居世界首位,但与发达国家相比,利用率依然不高。众所周知,秸秆含有极其丰富的生物质,这对于解决能源危机和可持续发展具有极其重要的意义。但是,其转化为高附加值生物燃料或绿色化工产品的前提是将秸秆中难降解的纤维素转化为可利用的葡萄糖单体。目前,研究最多的纤维素降解酶包括外切纤维素酶、内切纤维素酶和β-葡萄糖苷酶,它们都属于糖苷水解酶。尽管纤维素酶的研究已经取得较好进展,但依然存在着成本高,水解效率低等瓶颈问题。近年来,裂解多糖单加氧酶(lpmo)的发现革新了人们对纤维素降解的认知。lpmo是一种含铜的氧化酶,最初因其含有弱的纤维素酶活性,被碳水化合物活性酶(cazy)数据库(http://www.cazy.org/)划分至糖苷水解酶gh61家族。后来发现其主要通过氧化裂解作用而非水解作用降解纤维素,从而将其归为辅助活性酶aa家族。自然界中存在多种可降解木质纤维素的微生物,其中,担子菌降解能力最佳。它们分泌的木质纤维素酶可以使木质纤维素聚合物完全解聚。因此,发掘有潜力的降解木质纤维素的担子菌对于生物质开发利用势在必行。红侧耳(pleurotusdjamor)是一种可食用担子菌,研究发现它可在多种农林废弃物中生长,具有广泛的底物适应性。目前ncbi核苷酸数据库中(https://www.ncbi.nlm.nih.gov/nuccore#)有关真菌的lpmo序列可检索到599条,其绝大多数来源于子囊菌,担子菌研究的很少。而在常见的食用担子菌中,仅能检索到armillaria属、hypsizygusmarmoreus和volvariellavolvacea的少部分序列。技术实现要素:本发明的第一个目的在于提供一种高活性的裂解多糖单加氧酶。本发明的第二个目的在于提供一种裂解多糖单加氧酶的制备方法。本发明目的按如下技术方案实现:一种裂解多糖单加氧酶,其特征在于,所述裂解多糖单加氧酶的氨基酸序列具有如下特征:序列表中seqidno:2从氨基酸开始的第1-321或第19-321位氨基酸残基序列。本发明还提供了裂解多糖单加氧酶的编码基因(命名为pdlpmo9a),所述裂解多糖单加氧酶编码基因pdlpmo9a的编码序列如seqidno:1所示。所述裂解多糖单加氧酶的制备方法,包括如下步骤:(1)目的基因的克隆通过pcr技术扩增获得裂解多糖单加氧酶编码基因pdlpmo9a的编码序列,如seqidno:1所示;(2)重组表达载体ppiczαa-pdlpmo9a的构建首先预测裂解多糖单加氧酶信号肽,然后采用pcr扩增引物,去除裂解多糖单加氧酶信号肽,并扩增得到裂解多糖单加氧酶成熟肽编码序列,通过同源重组的方法,将裂解多糖单加氧酶成熟肽编码序列正确插入到ppiczαa载体xhoi位点,获得重组表达载体ppiczαa-pdlpmo9a,其中裂解多糖单加氧酶成熟肽编码序列终止密码子之前不加his标签;其中所述扩增引物如下:上游引物:5’gaaggggtatctctcgagaaaagacacaccattttccagga3’下游引物:5’agatgagtttttgttctagattattggcattgatggtagtaggggt3’所述扩增引物是经过特别设计的独特引物,该引物能够使外源蛋白在毕赤酵母gs115中成功表达,且效果最佳;(3)转基因菌株的获得采用电转化法将重组表达载体ppiczαa-pdlpmo9a导入宿主细胞毕赤酵母pichiapastorisgs115菌株中;(4)裂解多糖单加氧酶的获得采用甲醇诱导裂解多糖单加氧酶表达。本发明方法制得的裂解多糖单加氧酶为粗酶液,还未经过提纯。经过甲醇诱导表达6d后,收集粗酶液。采用bca法检测粗酶液的蛋白含量为0.53mg/ml。采用sds-page对粗酶液进行鉴定检测,表明裂解多糖单加氧酶在甲醇诱导下有明显的表达。以羧甲基纤维素钠(cmc)为底物,采用3,5-二硝基水杨酸(dns)法检测粗酶液降解cmc的酶活力为2046u.l-1;采用2,6-二甲氧基苯酚(dmp)法检测粗酶液的lpmo酶活力为13u.l-1。本发明获得的有益效果:1、本发明方法制得的裂解多糖单加氧酶,在没有提纯的情况下,裂解多糖单加氧酶粗酶液的lpmo酶活力高达13u.l-1,表明裂解多糖单加氧酶具有显著的氧化裂解作用。同时,裂解多糖单加氧酶粗酶液降解cmc的酶活力高达2046u.l-1,表明裂解多糖单加氧酶具有很强的纤维素降解酶的活力。另外,裂解多糖单加氧酶可以产生协同增效的作用,在反应过程中通过释放糖链末端,增加了纤维素酶等糖苷水解酶与底物的作用机会,从而加速纤维素的降解。因此,裂解多糖单加氧酶还可用作农作物秸秆饲料的制备、利用秸秆生产如乙醇等化工产品的制备。2、现有的获得酶的方法主要是采用原始红侧耳菌株(购自福建三明真菌研究所)发酵法,具有周期长,产量低的弊端。本发明采用基因工程技术手段有效获得裂解多糖单加氧酶,使发酵周期由原始菌株发酵法的12d缩短至6d,降解cmc的酶活力由原始菌株发酵法的220u.l-1提高到2046u.l-1,提升了9.3倍。因此,本发明制备方法缩短了生产周期,提高了产量,具有较好的经济效益。3、常见的构建表达载体的方法有如下几种:(1)将基因完整编码序列构建到载体中其弊端为酵母细胞不能较好识别外源信号肽,所以无法将外源蛋白很好地分泌至胞外,或者利用酵母信号系统将外源蛋白分泌到胞外后,也无法切割外源蛋白信号肽,导致外源蛋白活性较低。(2)将成熟肽构建到载体中,但是在终止密码前插入his标签其弊端为成熟肽非原始蛋白,额外增加了his标签,虽然his标签给纯化带来便利,但其导致外源蛋白的结构被增加了不属于原有蛋白的his标签结构,人为改造的蛋白可能会带来活性的下降。(3)将外源蛋白序列构建到ppiczαa载体的酶切位点非xhoi处其弊端为使外源蛋白n端序列多了几个氨基酸残基,相当于人为改造了蛋白序列,会带来活性的下降。而本发明重组表达载体ppiczαa-pdlpmo9a构建的方法克服了上述方法的缺点,首先预测信号肽,然后将其去除变为成熟肽。成熟肽序列终止密码子之前不加his标签,将其正确插入到载体xhoi位点,借助载体α-factor信号肽,引导裂解多糖单加氧酶成熟肽分泌到胞外。附图说明图1裂解多糖单加氧酶信号肽预测;图2裂解多糖单加氧酶三维结构预测;图3pdlpmo9a基因pcr扩增电泳检测;1为marker;2为pdlpmo9a基因pcr产物;图4pdlpmo9a基因菌液pcr扩增电泳检测;图5pdlpmo9a基因序列比对结果;图6ppiczαaa-pdlpmo9a表达载体构建示意图;图7pdlpmo9a基因成熟肽编码序列pcr扩增电泳检测;图8pdlpmo9a基因的菌液pcr扩增电泳检测;图9ppiczαa-pdlpmo9a酶切线性化结果;m为dnadl5000marker;1为重组质粒ppiczαa-pdlpmo9a;2为线性化重组质粒;图10重组ppiczαa-pdlpmo9a酵母的pcr鉴定;m为dnadl5000marker;1-4为ppiczαa转化的酵母;5-6为ppiczαa-pdlpmo9a转化的酵母;图11裂解多糖单加氧酶粗酶液的蛋白含量;图12裂解多糖单加氧酶粗酶液的sds-page检测;m:标准蛋白marker;1-3分别为ppiczαa转化的酵母96h、120h、144h甲醇诱导;4-6分别为ppiczαa-pdlpmo9a转化的酵母96h、120h、144h甲醇诱导;图13裂解多糖单加氧酶粗酶液降解cmc的酶活力测定。具体实施方式为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚地描述,所描述的实施例是本发明一部分实施例,而不是全部的实施例。实施例1裂解多糖单加氧酶基因序列的生物信息学分析1、基因的cds及编码氨基酸预测利用expasy在线软件预测了裂解多糖单加氧酶的氨基酸序列,为321个氨基酸,其氨基酸序列如seqidno.2所示。根据其编码氨基酸序列,预测了其编码的裂解多糖单加氧酶基因(命名为pdlpmo9a)的cds序列:长度为966bp,其核苷酸序列如seqidno.1所示。2、基因编码蛋白的信号肽预测利用signalp4.1在线软件预测基因编码蛋白的信号肽,结果如图1:裂解多糖单加氧酶n端有信号肽序列,长度18个氨基酸(1-18),19-321为成熟肽氨基酸序列,符合酶为分泌型蛋白的特点。3、基因编码蛋白分子量与等电点预测采用expasy在线软件预测了裂解多糖单加氧酶成熟肽蛋白分子量为31.50kda,pi为4.93。4、基因编码蛋白保守结构域预测利用pfam在线软件预测基因编码蛋白的保守结构域,结果表明:裂解多糖单加氧酶含有糖苷水解酶gh61结构域和cbm纤维素结合结构域,符合lpmo酶的特点。5、基因编码蛋白三维结构建模利用swiss-model在线软件预测基因编码蛋白的三维结构,结果如图2所示:裂解多糖单加氧酶含cu2+,符合lpmo酶的特点。实施例2目的基因的克隆1、pcr扩增目的基因提取红侧耳(pleurotusdjamor)菌株(购自福建三明真菌研究所)rna,反转录合成cdna。以cdna为模板,采用特异cds引物(cdsf5’atgaagtctctttcaatcgcttcc3’,cdsr5’ttattggcattgatggtagtaggg3’),进行pcr扩增。pcr体系如表1所示:表1pcr反应体系成分样品加样量premixextaq10μl引物cdsf1μl引物cdsr1μl模板cdna2μl双蒸水6μl总体积20μl反应程序为:94℃预变性2min,94℃变性30s,55℃退火30s,72℃延伸90s,共30个循环,72℃补齐5min。反应产物经1%琼脂糖凝胶电泳检测,在966bp处有一条特异性条带,与预期片段大小相符,产物如图3所示。对pcr扩增后大小正确的目的条带使用生工试剂盒(sanprep柱式dna胶回收试剂盒)进行切胶回收,按说明书中进行,并进行1%琼脂糖凝胶电泳检测。2、回收产物与pmd-18t载体的连接将胶回收产物与pmd-18t载体进行连接。连接体系如表2所示:表2连接体系成分成分加入量μl终浓度pmolt载体10.03目的片段-0.1-0.3solutioni5-ddh2o补足至10μl-将上述样品混匀,置于16℃恒温箱中,连接1h。3、转化感受态细胞(1)将连接反应体系10μl全部转入100μl大肠杆菌dh5α感受态细胞中,轻轻吹打,混合后冰浴放置30分钟。(2)将1.5mlep管放入42℃水浴,90秒。迅速冰浴,冷却2分钟。(3)向1.5mlep管中加入890μllb液体培养基,在37℃摇床上,110rpm震荡培养培养1-1.5h,进行菌体复苏。用空白lb液体培养基做对照。(4)取出100μl,涂布于lb-氨苄抗性含有x-gal和iptg的平板上。37℃倒置培养12-16h。同时用感受态做空白对照。4、菌液pcr鉴定无菌牙签挑取白色菌落,加入lb氨苄抗性的液体培养基中。37℃,200rpm,培养4h,取1μl菌液,采用通用引物m13f/m13r(m13f5’cgccagggttttcccagtcacgac3’,m13r5’agcggataacaatttcacacagga3’)进行菌液pcr。菌液pcr结果如图4所示:初步确定为阳性克隆。5、质粒dna的提取及测序取菌液pcr条带正确的菌液,用生工sanprep试剂盒提取质粒,按说明书中方法进行。产物进行1%琼脂糖凝胶电泳检测。采用试剂盒进行重组质粒提取,送往吉林省库美生物技术有限公司进行序列测定。使用blast比对基因序列,结果如图5所示:与原始的序列进行比较,发现两者的相似性是100%。由此说明了测序结果与目标序列的一致性。获得了基因的阳性克隆。实施例3pdlpmo9a基因在毕赤酵母gs115中的重组表达1、表达载体构建根据红侧耳pdlpmo9a基因序列的特点,成功预测裂解多糖单加氧酶信号肽,然后采用pcr扩增引物,去除信号肽,并扩增得到裂解多糖单加氧酶成熟肽编码序列,通过同源重组的方法而非传统的t4连接酶方法,将裂解多糖单加氧酶成熟肽编码序列插入到ppiczαa载体xhoi位点,其中裂解多糖单加氧酶成熟肽编码序列终止密码子之前不加his标签。借助载体α-factor因子分泌的信号肽,引导裂解多糖单加氧酶成熟肽分泌到胞外。表达载体构建图谱如图6所示。(1)目的基因的获取以重组质粒为模板,采用wsf/wsr为引物(wsf5’gaaggggtatctctcgagaaaagacacaccattttccagga3’,wsr5’agatgagtttttgttctagattattggcattgatggtagtaggggt3’),对pdlpmo9a基因成熟肽编码序列进行pcr扩增。条件见表3:表3高保真酶pcr反应体系成分样品加样量2×superpfxmastermix10μl引物wsf1μl引物wsr1μl重组pmd-18t质粒1μl双蒸水至20μl7μl反应程序为:98℃预变性1min,98℃变性10s,55℃退火20s,72℃延伸30s,共30个循环,72℃延伸7min,4℃保存。结果如图7所示:在912bp对应位置处扩增得到目的条带。(2)ppiczαa质粒的提取及双酶切采用试剂盒进行质粒提取,采用限制性内切酶进行酶切(表4)。反应条件为37℃,反应3h。1%琼脂糖凝胶电泳检测结果。表4ppiczαa的双酶切试剂体积10×quickbuffer4ulppiczαa质粒≤2ug限制酶xhoi2ul限制酶xbai2ul总体系40ulh2o补足至40ul(3)目的基因与载体的连接采用同源重组即无缝克隆方法进行目的基因的克隆。10ul反应体系如表5所示:将反应体系置于50℃,反应30min。之后迅速置于冰水浴中2-5min。表5无缝克隆的条件2、重组质粒的转化、阳性克隆的筛选将上述连接体系进行感受态dh5α的转化。条件如下:(1)将连接反应体系10ul全部转入100μl大肠杆菌dh5α感受态细胞中,轻轻吹打,混合后冰浴放置30分钟。(2)将1.5mlep管放入42℃水浴中,热激45-60s。迅速冰浴,冷却5分钟。(3)向1.5mlep管中加入500ul低盐lb液体培养基,在37℃摇床上,110rpm震荡培养培养1-2小时,进行菌体复苏。(4)取出100ul,涂布于低盐lb-zeocin固体筛选平板上。3、重组质粒的菌液pcr鉴定取适量菌液,采用通用引物5’aox1/3’aox1(5’aox15’gactggttccaattgacaagc3’,3’aox15’gcaaatggcattctgacatcc3’)对pdlpmo9a基因进行菌液pcr扩增。体系如表6:表6菌液pcr鉴定成分样品加样量2×extaqmix10μl5’aox11μl3’aox11μl菌液1μl双蒸水7μl总体积20μl反应程序为:95℃预变性2min,94℃变性30s,55℃退火30s,72℃延伸1min,共30个循环,72℃补齐5min,4℃保存。结果如图8所示:在1433bp处扩增得到目的条带,与预期相符,初步确定为阳性克隆。4、重组质粒的提取及测序方法同上。使用blast比对基因序列,结果显示:与原始的序列进行比较,发现两者有一个碱基发生突变,为简并密码子,不影响基因表达。获得了基因的阳性克隆。5、ppiczαa-pdlpmo9a重组质粒的酶切线性化及回收使用pmei限制性内切酶进行ppiczαa-pdlpmo9a重组质粒的酶切线性化。反应体系见表7:置于37℃,酶切3h。表7重组质粒的线性化体系反应成分添加量ulddh2o补足至170ul10×cutsmart25ul重组质粒10ugpmei5ultotal250ul酶切后,进行电泳检测,结果如图9所示表明:酶切完全。酶切完全后,65℃,10min使酶失活。向溶液中加入1/10v的3m无菌naac,混匀后,加入2.5v的无水乙醇,混匀。冰上放置5min。12000g离心5min。弃上清。用80%乙醇清洗沉淀,12000g,离心5min。自然风干,直至无任何残余乙醇。向离心管中加入10ul无菌去离子水裂解沉淀,-20℃保存,备用。6、重组质粒转化毕赤酵母(1)毕赤酵母gs115感受态细胞的制备:①将毕赤酵母gs115菌株进行划线培养于ypd培养基上,30℃培养2-3d。②挑单菌落转接到ypd培养基的摇菌管,30℃,200rpm-250rpm培养过夜。③取上述培养物转接至含200mlypd液体培养基中。30℃,200-250rpm,振荡培养过夜。直至od600nm=1.3-1.5后停止培养。④收集菌液,4℃,1500×g,离心5min,弃上清。用200ml冰冷的无菌水重悬菌体。4℃,1500×g,离心5min,弃上清。用100ml冰冷的无菌水重悬菌体。4℃,1500×g,离心5min,弃上清。⑤取8ml冰冷的1m无菌山梨醇重悬菌体。4℃,1500×g,离心5min,弃上清。用1m无菌山梨醇重悬菌体,即为感受态细胞。(2)线性化质粒电转毕赤酵母gs115电转仪设置为:c=25uf,pc=200ω/ohm,v=1500v,cuvette=0.2cm,cellvol=40ul。将7.5ul冰上放置的重组线性化质粒加入到80ul感受态细胞中,轻轻吹打混匀。立即全部转移至0℃的0.2cm电击杯中,立即冰浴5min。按设置的程序电击。同时用线性化的ppiczαa载体做阴性对照。电击之后立即向电击杯中加入1ml冰冷的无菌1m山梨醇溶液,吸出后将它们分别转移至无菌管中,30℃,静置培养1-2h。取一定量涂平板ypds-zeocin平板,30℃,静置避光培养2-3d,直至长出菌落。(3)阳性菌株的鉴定采用试剂盒法提取酵母基因组,采用通用引物进行pcr鉴定。体系和程序详见:实施例3中3、重组质粒的菌液pcr鉴定。将其中菌液更换为基因组dna。重组ppiczαa-pdlpmo9a酵母的pcr鉴定结果如图10所示:1-4为空载体ppiczαa转化的菌,5-6为重组ppiczαa-pdlpmo9a质粒转化的菌。在2200bp处和1500bp处均出现条带,表明已整合到基因组中,转化成功。7、裂解多糖单加氧酶在毕赤酵母的诱导表达采用甲醇诱导重组裂解多糖单加氧酶表达。实施例4裂解多糖单加氧酶粗酶液的蛋白含量经过甲醇诱导表达后,收集粗酶液,采用bca法对重组ppiczαa-pdlpmo9a在毕赤酵母中诱导表达的裂解多糖单加氧酶粗酶液的蛋白含量进行测定,结果如图11所示:随着诱导时间的延长,蛋白含量随之增加,在144h(6d)达到最高,为0.53mg/ml。实施例5裂解多糖单加氧酶的表达情况采用12%sds-page凝胶电泳检测裂解多糖单加氧酶的表达情况,结果如图12所示,在43kda附近,出现目标条带,而空载体没有发生明显的诱导,表明裂解多糖单加氧酶在甲醇诱导下有明显的表达。经软件预测,裂解多糖单加氧酶蛋白分子量在31.5kda左右,而诱导表达后的蛋白分子量为43kda左右,这是因为裂解多糖单加氧酶发生了糖苷化所导致的,因为预测其有1个n糖苷化位点和22个o糖苷化位点。实施例6裂解多糖单加氧酶降解cmc的酶活力测定取200μl1%羧甲基纤维素钠(cmc),加入浓缩20倍的粗酶液200μl。50℃水浴,10min,冷却后加入400μldns试剂。沸水浴5min。冷却,测540nm处光吸光值。酶活力单位定义为:每1min产生1μmol葡萄糖所需的酶量。空白用煮沸的酶液替代。实验三次重复,取平均值用于分析。结果如图13所示:甲醇诱导表达144h(6d)时,裂解多糖单加氧酶粗酶液降解cmc的酶活力达到最高值,为2046u.l-1。实施例6裂解多糖单加氧酶的lpmo酶活力的测定30℃,100mm2,6-dmp20μl,100mm柠檬酸/磷酸盐缓冲液(ph6.0)136μl,5mmh2o24μl。加入浓缩20倍的粗酶液40μl,立即启动反应。300s后测469nm出光吸收值。酶活力单位定义为每分钟形成1μmolcoerulignone(摩尔吸光系数ε469=53,200m-1cm-1)所需要的酶量。空白用煮沸的酶液替代。实验三次重复,取平均值用于分析。结果表明:在甲醇诱导表达6d时,裂解多糖单加氧酶粗酶液的lpmo酶活力为13u.l-1。序列表<110>吉林农业大学<120>一种裂解多糖单加氧酶及制备方法<160>2<170>siposequencelisting1.0<210>1<211>966<212>dna<213>红侧耳菌株(pleurotusdjamor)<400>1atgaagtctctttcaatcgcttccttgggcttccttgttagtggtgctctcgcccacacc60attttccaggaacttcacgtaaatggtgtttctcaaggccacaaagttggaattcgggtt120ccttcttacgatggtcccatcgaaaatgttgcctcaaacgacatcatctgcaacggtggc180atcaatccttactaccaacccatgtctcaagtgatcatcgacgtccccgctggtggtgat240gtcaccgcagagttccatcatacactttcaggcgcgaacccttccgattcctctgacccc300attgaccccactcacaagggtcccatcctcgcatatcttgccaaagttgactcagccctt360caatctgacgtcacgggtcttgactggttcaaaatctacgaagatgggtacggtcctggc420acagagtgggccgtagaccgcctcatcgccaacgatgggttggtcactttcaaaatcccc480gattgcattccttctggcgaatatcttctccgcgttgagttgattgctctccacggtgct540ggatcttaccctggtgctcaattctacatgtcatgtgctcaaatcagagtcactggtggt600ggcagcgccgtaccaggacccattgcccacttccctggtgcctactctggaactgaccct660ggcatcaaattgagcatctactggccccctgtcaccagctacactattccaggccctgct720gtcttcacgtgcaacggatcacctcccacttcttctgttcgaccatcttctagctccgtt780gctcccacttcttcgagctctgccgtcccttcgccgcaacctacctcttccactcctcca840gttaccccaacaggtggcaccgccccccaatggggtcaatgtggaggtgaaggctggacc900ggtcccactgtttgcgctgcgggtacctgtgtcgctctcaacccctactaccatcaatgc960caataa966<210>2<211>321<212>prt<213>人工合成()<400>2metlysserleuserilealaserleuglypheleuvalserglyala151015leualahisthrilepheglngluleuhisvalasnglyvalsergln202530glyhislysvalglyileargvalprosertyraspglyproileglu354045asnvalalaserasnaspileilecysasnglyglyileasnprotyr505560tyrglnprometserglnvalileileaspvalproalaglyglyasp65707580valthralagluphehishisthrleuserglyalaasnproserasp859095serseraspproileaspprothrhislysglyproileleualatyr100105110leualalysvalaspseralaleuglnseraspvalthrglyleuasp115120125trpphelysiletyrgluaspglytyrglyproglythrglutrpala130135140valaspargleuilealaasnaspglyleuvalthrphelysilepro145150155160aspcysileproserglyglutyrleuleuargvalgluleuileala165170175leuhisglyalaglysertyrproglyalaglnphetyrmetsercys180185190alaglnileargvalthrglyglyglyseralavalproglyproile195200205alahispheproglyalatyrserglythraspproglyilelysleu210215220seriletyrtrpproprovalthrsertyrthrileproglyproala225230235240valphethrcysasnglyserproprothrserservalargproser245250255serserservalalaprothrserserserseralavalproserpro260265270glnprothrserserthrproprovalthrprothrglyglythrala275280285proglntrpglyglncysglyglygluglytrpthrglyprothrval290295300cysalaalaglythrcysvalalaleuasnprotyrtyrhisglncys305310315320gln当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1